-
Medical journals
- Career
Prognostický význam morfologického hodnocení u mnohočetného myelomu
Authors: M. Al-Sahmani 1,2; I. Trnavská 1; M. Antošová 1; L. Antošová 1; J. Kissová 1; B. Kaisarová 2; Z. Adam 1,3; A. Buliková 1; M. Penka 1; R. Hájek 1,2,3,4
Authors‘ workplace: Oddělení klinické hematologie, FN Brno 1; Babákova myelomová skupina, Ústav patologické fyziologie, LF MU Brno 2; Interní hematoonkologická klinika, FN Brno 3; Laboratoř experimentální hematologie a buněčné imunoterapie, Oddělení klinické hematologie, FN Brno 4
Published in: Klin Onkol 2012; 25(2): 103-109
Category: Original Articles
Overview
Východiska:
Mnohočetný myelom je druhé nejčastější krevní nádorové onemocnění způsobené klonální proliferací B buněk. Morfologické vyšetření se stanovením počtu plazmocytů v kostní dřeni patří mezi základní diagnostická kritéria i dnes.
Cílem práce bylo ověřit, zda tato hodnocení mají prognostický význam i v éře nových léků.Materiál a metody:
Do analýzy byly zařazeny dvě skupiny nemocných s MM. První skupinu tvořilo 45 nově diagnostikovaných nemocných s MM, kteří podstoupili primoléčbu thalidomidem (skupina T). Druhá skupina nemocných zahrnovala 86 pacientů v prvním relapsu MM bez autologní transplantace kostní dřeně, kteří byli léčeni protokoly s thalidomidem a bortezomibem v různých kombinacích (skupina B). Bylo hodnoceno procentuální zastoupení podtypů plazmocytů v kostní dřeni na základě progresivní analýzy nukleolu, chromatinu a nukleocelulárního poměru (N/C). Kombinace těchto tří prvků vytváří osm podtypů a čtyři subklasifikace plazmatických buněk.Výsledky:
Zralé plazmatické buňky byly nalezeny u 53,3 % (skupina T) a 53,5 % (skupina B) nemocných, proplazmocyty I u 22,2 % (skupina T) a 24,4 % (skupina B) nemocných, proplazmocyty II u 22,2 % (skupina T) a 22,1 % (skupina B) nemocných a plazmablasty u 1,0 % (skupina T) a 0 % (skupina B). Nemocní, kteří po primoléčbě dosáhli léčebné odpovědi, měli statisticky významně vyšší počet proplazmocytů II proti skupině bez léčebné odpovědi (medián 37,0 % vs 11,0 %; p = 0,033). Nemocní skupiny B se zastoupením zralých plazmocytů pod 10 % měli i významně kratší dobu přežití než ostatní skupiny nemocných při rozdělení pomocí kvartilů. Nemocní skupiny B s infiltrací proplazmocytů I vyšší než medián 15 % měli kratší přežití (medián OS 50,3 měsíce vs 74,9 měsíce; p = 0,024) a totéž platilo pro hodnocení proplazmocytů II (medián OS 41,3 měsíce vs 74,9 měsíce; p = 0,011).Závěr:
Počet plazmatických buněk v kostní dřeni zůstává základním diagnostickým kritériem MM i v době nových genomických analýz. Přesnější morfologické hodnocení 8 subtypů plazmatických buněk přináší dílčí prognostické informace, které spolu s jinými prognostickými faktory mohou dále upřesnit prognózu nemocných s mnohočetným myelomem.Klíčová slova:
mnohočetný myelom – plazmocyty – morfologie – přežití – stagingÚvod
Mnohočetný myelom (MM) je druhé nejčastější krevní nádorové onemocnění způsobené neoplastickou proliferací plazmocytů stojících na konci vývojové fáze B lymfocytární linie. Morfologické hodnocení a stanovení počtu plazmatických buněk v kostní dřeni patří mezi základní diagnostická kritéria i v době moderních genomických analýz [1–4]. Z některých prací vyplývá, že podrobnější morfologická analýza může být důležitá pro stanovení prognózy. Prognostický význam přítomnosti tří dílčích kritérií (přítomnosti jadérka, charakteru jaderného chromatinu a poměru jádra k objemu cytoplazmy) byl původně prokázán v éře konvenční chemoterapie. Je založen na zhodnocení přítomnosti nezralých plazmablastických buněk [5,6] nebo naopak na dominanci zralých plazmocytů [7]. Goasguen et al prokázali vliv přítomnosti plazmablastů na celkové přežívání u nemocných s MM léčených konvenční terapií. Celkové přežití (OS) bylo 54 měsíců pro nemocné s počtem plazmablastů < 2 % oproti 20 měsícům pro nemocné s plazmablasty ≥ 2 % [6]. V největší morfologické studii provedené v Japonsku na 1 119 nemocných naopak přítomnost více zralých plazmocytů znamenala lepší prognózu [7].
Cílem naší práce bylo ověřit, zda tato hodnocení mají prognostickou informaci i v éře účinných léků současnosti. V retrospektivní studii jsme analyzovali prognostický význam uvedených podtypů nádorových buněk ve vztahu k celkové léčebné odpovědi, dlouhodobému přežití a definovali jsme vztah k jiným konvenčním prognostickým parametrům. Jde o první analýzu in extenso podobného typu u homogenního souboru nově diagnostikovaných nemocných léčených režimem na bázi thalidomidu a nemocných s MM v prvním relapsu onemocnění léčených režimem na bázi bortezomibu nebo thalidomidu.
Materiál a metody
Charakteristika souboru
Do analýzy byly zařazeny dvě skupiny nemocných s MM. První skupinu tvořilo 45 nově diagnostikovaných nemocných s MM (18 žen a 27 mužů s průměrným věkem 67,4 [40–83 let]), kteří podstoupili primoléčbu thalidomidem (Myrin; skupina T). Druhá skupina nemocných (skupina B) zahrnovala 86 pacientů v prvním relapsu MM bez autologní transplantace kostní dřeně (42 žen a 44 mužů s průměrným věkem 61,1 [33–82 let]). Nemocní byli léčeni protokoly s bortezomibem (Velcade) v různých kombinacích (36,0 %; 31/86) a protokoly s thalidomidem v různých kombinacích (64,0 %; 55/86). Demografická data nemocných jsou uvedena v tab. 1. Všichni nemocní byli léčeni na Interní hematoonkologické klinice Fakultní nemocnice Brno v období od roku 2005 do roku 2009 v rámci standardních léčebných postupů. Ve skupině T se u všech nemocných jednalo o kombinovaný režim CTD (cyklofosfamid, thalidomid a dexametazon). Mezi nejčastěji použité režimy na bázi thalidomidu ve skupině B patřil režim CTD (cyklofosfamid, thalidomid, dexametazon; 55 %, 47/86) a režim TD (thalidomid, dexametazon; 9 %, 8/86). Mezi nejčastěji použité režimy na bázi bortezomibu ve skupině B patřil režim CVD (cyklofosfamid, bortezomib, dexametazon; 14 %, 12/86), režim Vel/Dox (Velcade, Doxil; 13 %, 11/86) v rámci klinické studie a režim V (bortezomib v monoterapii; 9 %, 8/86). Všechny vzorky kostní dřeně byly odebrány v rámci rutinního diagnostického zákroku po podepsání informovaného souhlasu schváleného etickou komisí FN Brno.
Metodika morfologického hodnocení
Kategorizace zralosti buněk proběhla podle již publikované metodiky [6]. Výstupem analýzy 8 podtypů P000–P111 jsou čtyři typy plazmocytů různé zralosti: zralé plazmocyty (podtypy P000 a P001), proplazmocyty I (podtypy P010, P011 a P100), proplazmocyty II (podtypy P101 a P110) a plazmablasty (podtyp P111), viz obr. 1–3.
Image 1. Konstrukce algoritmu pro automatickou subklasifikaci plazmatických buněk u MM. Jsou položeny tři po sobě následující otázky a jejich odpovědi jsou ano (1) nebo ne (0). 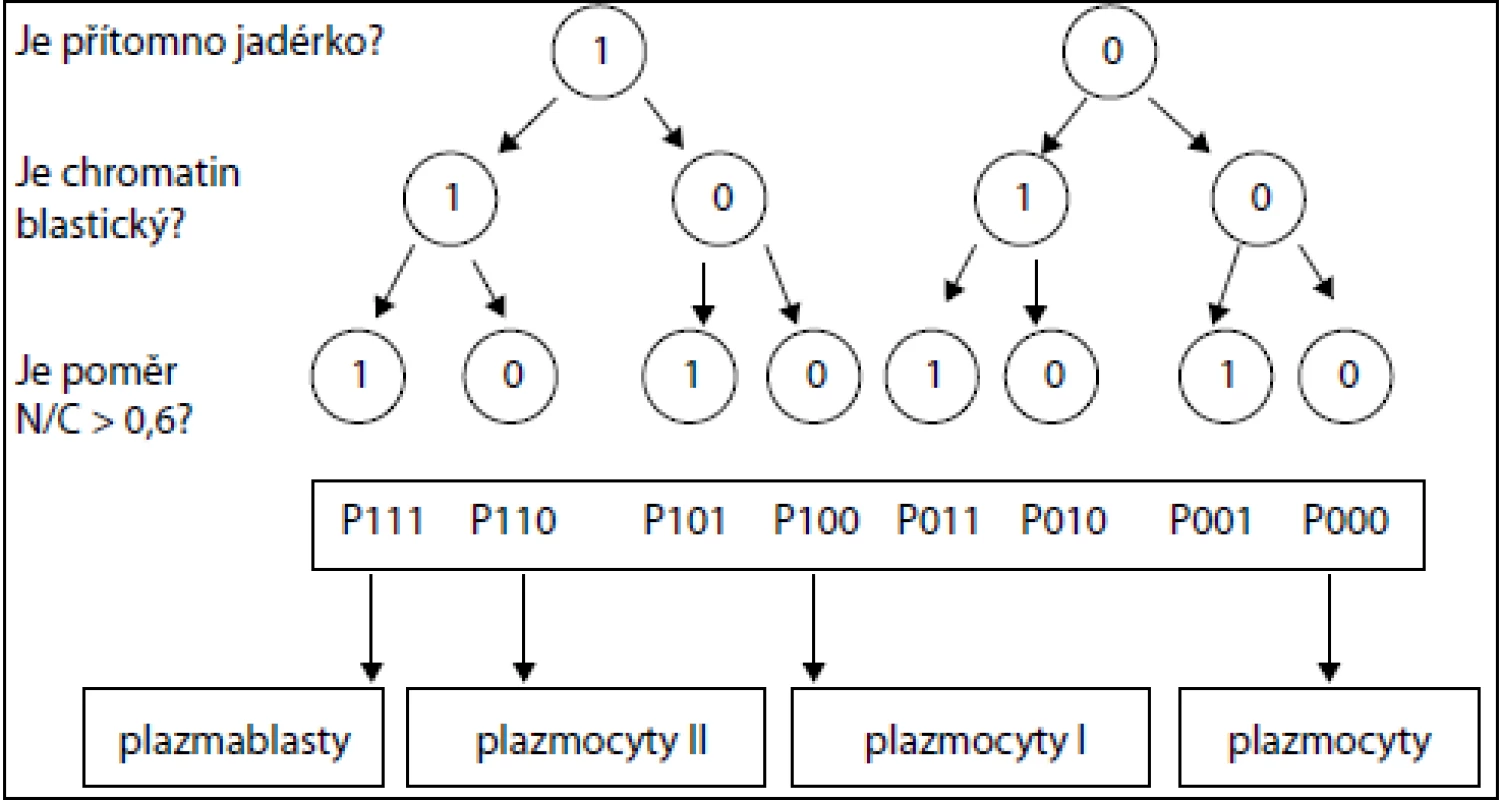
Image 2. Přehledná zastoupení plazmatických buněk podtypů podle definice algoritmu systému plazmatická buňka, první číslo představuje přítomnost (1) nebo absenci (0) jadérka, druhé číslo představuje přítomnost (1) nebo nepřítomnost (0) blastického chromatinu, poslední číslo představuje přítomnost (1) nebo nepřítomnost (0) N: C poměru < 0,6. 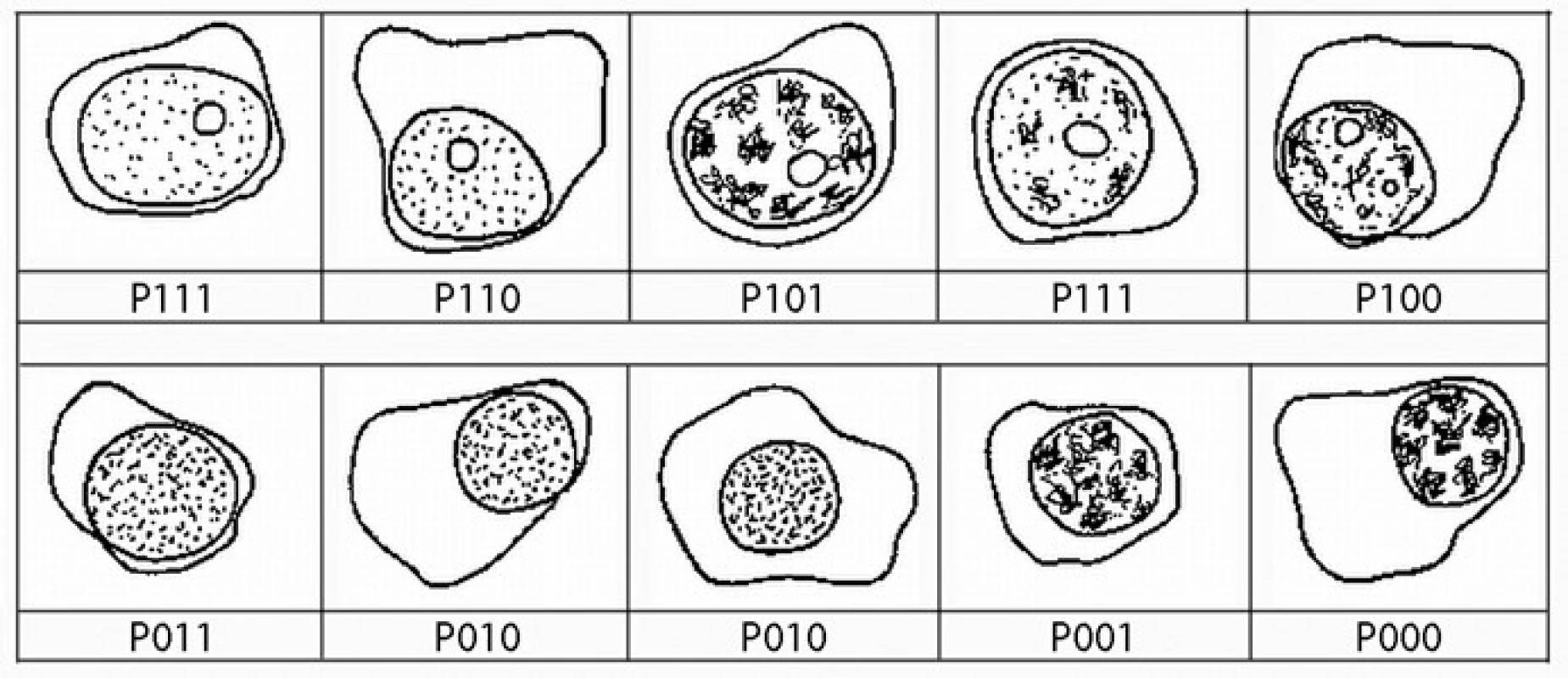
Image 3. Přehledná zastoupení plazmocytů dle používaného algoritmu. Buňky s jadérkem jsou definováné jako P111, P110, P101, P100. Buňky s blastickým chromatinem jsou definovány jako P111, P110, P011, P010 a buňky s velmi vysokým N: C poměrem (< 0,6) jsou P111, P101, P011, P001. 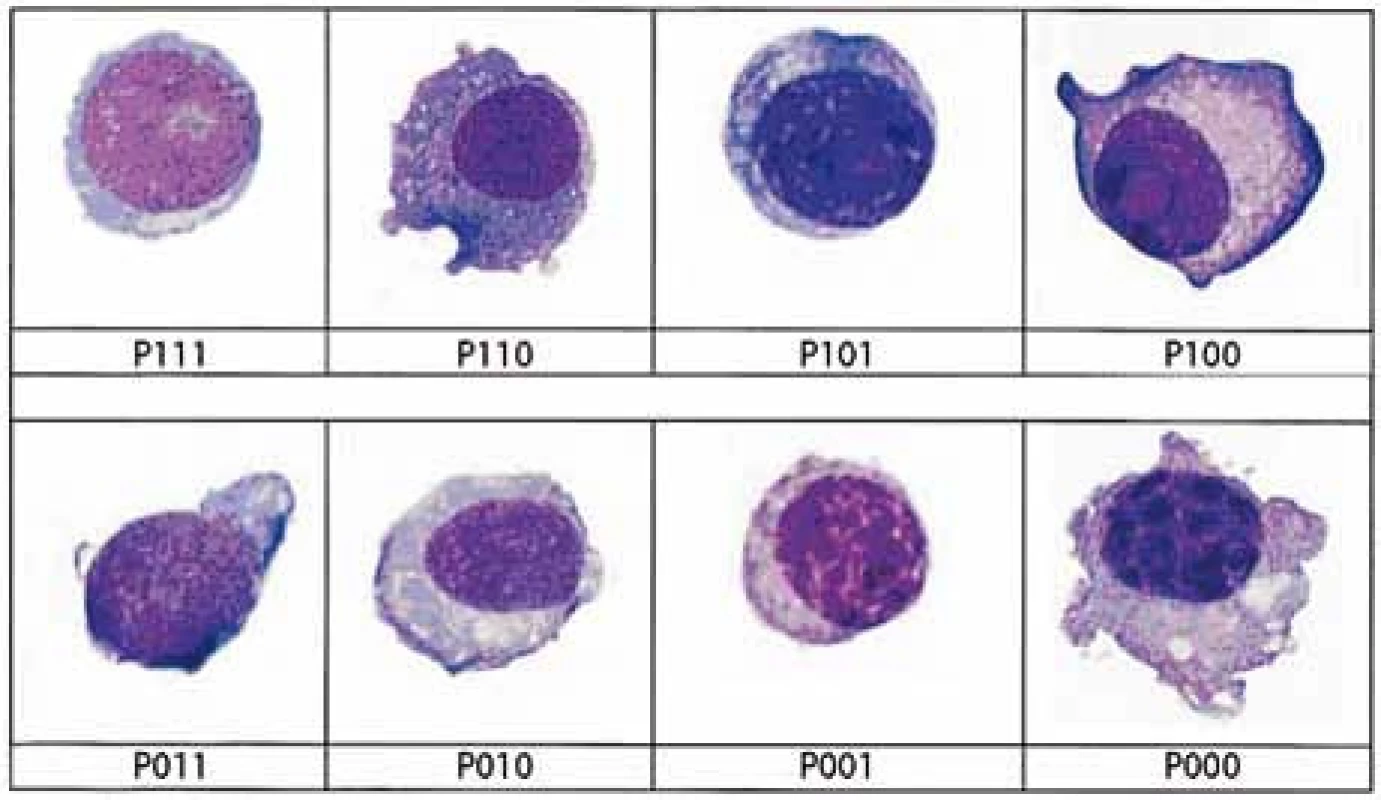
Každý aspirát kostní dřeně byl hodnocen a následně skórován po fixaci roztokem May-Grünwald a obarven dle Giemsy-Romanovského (Pappenheimova panoptická barvicí metoda) [8,9]. Při potvrzení diagnózy MM jsme vycházeli z kritéria ≥ 10% přítomnosti plazmatických buněk na celkový počet všech jaderných krevních buněk na nátěru. K hodnocení nátěrů kostní dřeně byl použit mikroskop Olympus BH-2, objektiv 100×, 20×, 10× a hematologické počítadlo typ SH-96/24D. U každého pacienta bylo hodnoceno 100 plazmatických buněk dle třech stanovených kritérií v následujícím pořadí:
- Jadérko – přítomnost jadérka byla označena číslem 1, nepřítomnost jadérka číslem 0.
- Chromatin – přítomnost jemného chromatinu byla označena číslem 1, přítomnost kondenzovaného chromatinu byla označena číslem 0.
- N/C poměr – k posouzení tohoto parametru byla hodnocena velikost jádra vzhledem k objemu cytoplazmy. Poměr N/C > 0,6 byl označen číslem 1, poměr N/C < 0,6 byl označen číslem 0.
U nemocných byl dále proveden odběr žilní krve ke sledování následujících laboratorních hodnot: albumin, beta-2-mikroglobulin, CRP (C reaktivní protein), LDH (laktátdehydrogenáza), kalcium, hemoglobin, trombocyty. Vzorky kostní dřeně pro hodnocení buněk byly získány sternální punkcí nebo aspirací z kosti kyčelní. Před tímto rutinním diagnostickým zákrokem nemocní podepsali informovaný souhlas.
Statistická analýza
Statistická analýza prognostických významů morfologického hodnocení nádorových buněk u MM byla provedena pomocí programu StatSoft, Inc. (2009) STATISTICA version 9.0 (www.statsoft.com). U parametrů P000–P111 nebyla prokázána normalita, proto pro srovnání těchto parametrů s ostatními parametry byly použity neparametrické testy. Vztah s laboratorními parametry (albumin, beta-2-mikroglobulin, CRP, LDH, kalcium, hemoglobin, trombocyty, M-Ig v séru a moči) byl hodnocen využitím Spearmannova korelačního koeficientu (RS). Vztah parametrů P000–P111 s kategoriálními parametry (léčebné odpovědi, typ paraproteinu, klinické stadium dle Durie-Salmona) byl hodnocen Mann-Whitney testem a při ověřování statistické významnosti parametrů P000–P111 s kategoriálními parametry ISS byl použit Kruskal-Wallis Anova test. U analýzy přežití byly mediány přežití stanoveny Kaplan-Meierovým odhadem a rozdíl mezi skupinami nemocných v časech přežití byl testován log-rank testem. Všechny testy byly provedeny na 5% hladině významnosti.
Výsledky analýzy prognostického významu morfologie plazmatických buněk u mnohočetného myelomu
U 45 nově diagnostikovaných nemocných s MM bylo morfologické hodnocení následující: v 53,3 % (24/45) se jednalo o zralé plazmocyty (podtypy P000 a P001), v 22,2 % (10/45) o proplazmocyty I (podtypy P010, P011, P100), ve 22,2 % (10/45) o proplazmocyty II (podtypy P101 a P110) a o plazmablasty (podtyp P111) v 2,2 % (1/45).
U skupiny 86 nemocných s relapsem MM bylo morfologické hodnocení následující: v 53,5 % (46/86) se jednalo o zralé plazmocyty (podtypy P000, P001), v 24,4 % (21/86) o proplazmocyty I (podtypy P010, P011, P100), v 22,1 % (19/86) o proplazmocyty II (podtypy P101, P110) a o plazmablasty (podtyp P111) v 0 %.
Korelace podtypů plazmatických buněk s celkovou léčebnou odpovědí
Ve skupině T s primoléčbou jsme prokázali statisticky významný vztah mezi podtypem proplazmocytů II (P110) a celkovou léčebnou odpovědí (Overall Response Rate, ORR). Skupina nemocných s ORR měla vyšší počet proplazmocytů II (podtyp P110) než skupina nemocných bez léčebné odpovědi (medián 37,0 % vs 11,0 %; p = 0,033). Výsledky jsou znázorněny v grafu 1A. Ve skupině B léčené pro první relaps MM nebyl prokázán statisticky signifikantní vztah mezi podtypy plazmatických buněk a ORR.
Graf 1 A. Grafické znázornění statistické významnosti vztahu mezi proplazmocyty II podtypu P110 a léčebné odpovědi ORR. 
Korelace morfologických podtypů P000–P111 s dobou celkového přežití (OS) od diagnózy, dobou do progrese (TTP) a přežitím bez progrese (PFS)
Vzhledem k dobré účinnosti vstupní léčby thalidomidem byla četnost progresí onemocnění nízká a u nově diagnostikovaných nemocných nebylo doposud proveditelné úplné zhodnocení významu morfologického hodnocení. Ve skupině T s primoléčbou zemřelo doposud 15,6 % (7/45) nemocných a jen u 26,7 % (12/45) nemocných bylo možné stanovit dobu do progrese onemocnění při době sledování 8,6 měsíce. Z tohoto důvodu nešlo určit medián přežití u OS, neboť podíl zemřelých nemocných byl velmi malý.
U skupiny B byly pro podtypy plazmatický buněk P000–P111 hledány vhodné cut-off. Při srovnávání podle kvartilů bylo zjištěno, že nemocní s nižším počtem zralých plazmocytů podtypu P000 < 10 % měli statisticky významně kratší dobu přežití – medián přežití 37,7 vs 62,9 měsíce, resp. 89,8 měsíce a resp. 88,8 měsíce (p = 0,044) oproti nemocným s počtem zralých plazmocytů podtypu P000 ≥ 10 %, resp. ≥ 28 % a resp. ≥ 53 %. Podobně byl zjištěn statisticky významný rozdíl při analýze zralých plazmocytů podtypu P001 při rozdělení na tři stejně početné skupiny (medián 39,2 měsíce, 69,5 měsíce a 89,3 měsíce; p = 0,032) – graf 2A a 2B.
Graf 2 A a B. Grafické znázornění statistické významnosti vztahu mezi zralými plazmocyty podtypů P000, P001 a dobou přežití OS (od diagnózy) dle kvartilů a tercilů. 
Při srovnávání skupiny B podle mediánu byl zjištěn statisticky významný vztah s celkovým přežitím OS u proplazmocytů I podtypu P010 a proplazmocytů II podtypu P110. Skupina nemocných s vyšší infiltrací proplazmocytů I podtypu P010 (≥ 15 %) měla kratší dobu přežití (74,9 vs 50,3 měsíce; p = 0,024). Rovněž nemocní s počtem proplazmocytů II (podtyp P110) ≥ 14,5 % měli kratší dobu celkového přežití (74,9 vs 41,3 měsíce; p = 0,011) – graf 1B. Při hodnocení doby do progrese (TTP) byl pozorován trend k prodloužení TTP (medián 18,8 měsíce vs 13,9 měsíce; p = 0,083) u nemocných s počtem plazmablastů P111 nižším než 2,8 %. Podobný trend byl pozorován i pro interval PFS.
Graf 1 B. Grafické znázornění statistické významnosti vztahu mezi proplazmocyty II podtypu P110 a dobou přežití OS (od diagnózy) dle mediánů. 
Korelace morfologických podtypů plazmatických buněk P000–P111 s konvenčními prognostickými laboratorními parametry
Ve skupině T s primoléčbou byla nalezena statisticky významná negativní korelace mezi zralými plazmocyty a M-Ig v moči. Pozitivní korelace byla nalezena pro proplazmocyty I podtypu P011 a proplazmocyty II podtypu P110 (RS = –0,383; p = 0,011, Rs = 0,384; p = 0,011 a Rs = 0,345; p = 0,024).
U skupiny nemocných s proplazmocyty II podtypu P101 byla prokázána pozitivní korelace s hemoglobinem a albuminem (RS = 0,420; p = 0,005 a RS = 0,295; p = 0,049). Nebyl prokázán statisticky významný vztah podtypů plazmatických buněk P000–P111 k typům paraproteinů. Neprokázali jsme statisticky významný vztah podtypů plazmatických buněk P000–P111 ke klinickým stadiím dle Durie-Salmona.
Ve skupině nemocných ve 3. stadiu dle ISS ve srovnání s 1. a 2. stadiem dle ISS byly nalezeny vyšší hodnoty proplazmocytů II P110 (medián 22,0 vs 13,0; p = 0,055).
Graph 1. Grafické znázornění statistické významnosti vztahu mezi proplazmocyty I podtypu P010 a dobou přežití OS (od diagnózy) dle mediánů. 
Ve skupině B s relapsem byla nalezena pozitivní korelace mezi zralými plazmocyty podtypu P000 a albuminem (RS = 0,273; p = 0,016). U proplazmocytů I podtypu P010 byla nalezena pozitivní korelace s CRP a negativní korelace s albuminem (RS = 0,264, RS = –0,252; p = 0,021, p = 0,027). Podobně skupina proplazmocytů I podtypu P011 korelovala s Ca a negativně korelovala s hemoglobinem (RS = 0,268, RS = –0,263; p = 0,017, p = 0,020). Negativní korelace u CRP byla nalezena u proplazmocytů I podtypu P100 a proplazmocytů II podtypu P101 (RS = –0,356, RS = –0,241; p = 0,002, p = 0,036). Proplazmocyty II P110 negativně korelovaly s albuminem a pozitivně korelovaly s M-Ig v séru (RS = –0,348, RS = 0,220; p = 0,002, p = 0,049).
Nebyl prokázán statisticky významný vztah podtypů plazmatických buněk P000–P111 k typům paraproteinů. Dále nebyl prokázán statisticky významný vztah podtypů plazmatických buněk P000–P111 ke klinickým stadiím dle Durie-Salmona. U podstadia A–B dle Durie-Salmona byl statisticky prokázán vztah u nemocných, kteří měli v podstadiu B vyšší počet proplazmocytů I podtypu P011, než u nemocných v podstadiu A (medián 4,0 vs 1,0; p = 0,016).
Diskuze
Od roku 1984 je známo, že přítomnost nezralých plazmatických buněk (plazmablasty) koreluje s horší prognózou u mnohočetného myelomu a naopak. V nejrozsáhlejší klinické studii zahrnující 1 119 nemocných léčených konvenční léčbou přežívalo déle než 10 let více nemocných ze skupiny s vyšším zastoupením zralých plazmocytů v biopsii kostní dřeně (54 % vs 31 %; p = 0,01) [7]. Goasguen et al rozpracovali tyto základní morfologické prognostické údaje podrobněji do osmi podtypů P000–P111 plazmocytů dle zralosti a potvrdili jejich prognostický přínos v éře konvenční léčby [6]. Prognostickou platnost tohoto dělení se nám dříve podařilo prokázat i při použití autologní transplantace [10]. V této publikaci jsme potvrdili přínos morfologického hodnocení i při použití účinných léků současnosti thalidomidu a bortezomibu v relapsu onemocnění. U nemocných s MM léčených v primoléčbě thalidomidem jsme pozorovali vyšší četnost parciálních remisí v případě vyššího vstupního počtu proplazmocytů II podtypu P110 ve srovnání s nemocnými bez léčebné odpovědi (medián 37,0 % vs 11,0 %; p = 0,033). Obecně platí, že nezralé formy představují buňky s intenzivní látkovou výměnou, které jsou více citlivé na vnější vlivy. Nicméně pokud chemoterapie tyto buňky zcela nezničí, dynamika jejich obnovy je následně rychlejší. Takové vysvětlení odpovídá i pozorovaným výsledkům přežití ve vztahu ke zralosti plazmocytů v našem druhém souboru (skupina B), kde počet zralých plazmocytů podtypu P000 koreloval s mediánem celkového přežití (< 10 % – 37,7 měsíce; < 28 % – 62,9 měsíce; < 53 % – 89,8 měsíce; ≥ 53 % – 88,8 měsíce; p = 0,044). Opačná korelace byla zjištěna u nemocných s proplazmocyty I a II podtypů P010, 110, které nesou rovněž prognostickou informaci (medián OS 74,9 měsíce vs 50,3 měsíce; p = 0,024, resp. 74,9 měsíce vs 41,3 měsíce; p = 0,011). Je zřejmé, že podrobnější morfologické hodnocení stále přináší velmi levné, rychlé a významné prognostické informace.
Ve skupině T s primoléčbou bylo nalezeno několik statisticky významných vztahů k ostatním laboratorním parametrům, resp. konvenčním prognostickým faktorům. Pozorovali jsme negativní korelaci mezi zralými plazmocyty (P000) a M-Ig v moči (RS = –0,383; p = 0,011), pozitivní korelaci mezi proplazmocyty II (P101), hemoglobinem (RS = 0,420; p = 0,005) a rovněž albuminem (RS = 0,295; p = 0,049). S ohledem na četnost souboru a krátkodobost sledování budeme analýzu ověřovat na rozšířeném souboru.
Ve skupině B byly vedle několika popisných vztahů zajímavé korelace mezi různými typy plazmocytů a hodnotou albuminu. Byla nalezena pozitivní korelace mezi zralými plazmocyty (P000) a albuminem (RS = 0,273; p = 0,016), ale negativní korelace pro proplazmocyty I P010 (RS = –0,252; p = 0,027) a proplazmocyty II P110 (RS = –0,348; p = 0,002). Hodnota albuminu je přitom součástí ISS (International Staging System) prognostického systému. Vysvětlením pro vztahy různých podtypů plazmocytů a albuminu může být skutečnost, že méně zralé nádorové buňky mají vyšší metabolizmus a nároky na výživu, nádor je obecně agresivnější a dochází k malnutrici a mimo jiné i vyšší spotřebě albuminu [11]. Nálezy jsou v souladu i se zjištěním trendu k vyšším hodnotám proplazmocytů II u nemocných ve skupině T ve 3. stadiu dle ISS. Při hodnocení vztahu podtypu plazmatických buněk P000–P111 s D-S stadiem u skupin T a B nebyl prokázán statisticky významný vztah podtypů plazmatických buněk P000–P111 ke klinickým stadiím dle Durie-Salmona. I zde budeme platnost vztahů ověřovat na rozšířeném souboru. Nejvýznamnějším prognostickým zjištěním tak zůstává souvislost mezi procentuální četností zralých plazmocytů a celkovým přežitím, který byl potvrzen i na limitovaném souboru nemocných, u kterých bylo potvrzeno rozdělení na 3 skupiny s významně rozdílnou prognózou (37,7 vs 62,9 vs 89,8 měsíce).
Závěr
Morfologické hodnocení plazmatických buněk v kostní dřeni stále zůstává základním diagnostickým kritériem MM i v době genomických, proteomických a cytomických analýz. Přesnější a také ekonomicky i časově méně náročné morfologické hodnocení 8 subtypů plazmatických buněk v kostní dřeni přináší dílčí prognostické informace, které spolu s jinými prognostickými faktory mohou dále upřesnit prognózu nemocných s mnohočetným myelomem.
Tato práce byla podpořena výzkumnými projekty MŠMT LC06027, MSM0021622434, granty IGA MZ ČR NS10387, NS10406, NS10408, NT12130 a grantem GAČR GAP304/10/1395.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Roman Hájek, CSc.
Ústav patologické fyziologie
Lékařská fakulta MU
Kamenice 5
Brno
625 00 Brno
e-mail: r.hajek@fnbrno.cz
Obdrženo: 2. 6. 2011
Přijato: 29. 8. 2011
Sources
1. Ščudla V, Adam Z. Diagnostický význam a úskalí hodnocení roztěrového preparátu kostní dřeně u mnohočetného myelomu. Vnitř Lék 2006; 52 (Suppl 2): 55–65.
2. Adam Z, Hájek R, Mayer J et al. Mnohočetný myelom a další mnoklonální gamapatie. 1. vyd. Brno: Masarykova univerzita 1999.
3. Adam Z, Bačovský J, Flochová E et al. Diagnostika a léčba mnohočetného myelomu – Doporučení vypracované Českou myelomovou skupinou a experty SR. Transfuze Hematol Dnes 2005; 11(1): 3–11.
4. Fonseca R, Bergsagel PL, Drach J et al. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23(12): 2210–2221.
5. Greipp PR, Raymond NM, Kyle RA et al. Multiple myeloma: significance of plasmablastic subtype in morphological classification. Blood 1985; 65(2): 305–310.
6. Goasguen JE, Zandecki M, Mathiot C et al. Mature plasma cells as indicator of better prognosis in multiple myeloma. New methodology for the assessment of plasma cell morphology. Leuk Res 1999; 23(12): 1133–1140.
7. Tsuchiya J, Murakami H, Kanoh T. Ten-year survival and prognostic factors in multiple myeloma. Japan Myeloma Study Group. Br J Haematol 1994; 87(4): 832–834.
8. Mayer J, Starý J et al. Leukemie. 1. vyd. Praha: Grada Publishing 2002.
9. Lexová S, Buliková A et al. Hematologie pro zdravotní laboranty 1. díl. 1. vyd. Brno: IDVPZ 2000.
10. Al-Sahmani M, Trnavská I, Antošová M. Prognostický význam morfologického hodnocení nádorových buněk u mnohočetného myelomu. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 4889.
11. Adam Z, Hájek R, Mayer J et al. Mnohočetný myelom a další Monoklonální gamapatie. 1. vyd. Brno: Masarykova univerzita 1999.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 2-
All articles in this issue
- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Změny imunologické reaktivity u onkologických pacientů
- Prognostický význam morfologického hodnocení u mnohočetného myelomu
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
- Klinický registr GIST
- MikroRNA vstupují do klinického testování
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Ionizujúcim žiarením indukované dlhodobé zmeny v hipokampe za experimentálnych podmienok
- Gastrointestinální stromální tumor duodena projevující se akutním krvácením do horního zažívacího traktu a léčený klínovitou resekcí
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



