-
Medical journals
- Career
Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně
Authors: S. Vokurka; V. Koza; A. Jungová; J. Navrátilová; T. Svoboda; P. Jindra; K. Steinerová; M. Hrabětová; R. Výrutová; L. Novák
Authors‘ workplace: Hematologicko-onkologické oddělení, FN Plzeň
Published in: Klin Onkol 2012; 25(1): 42-46
Category: Original Articles
Overview
Východiska:
Růstový faktor granulopoézy filgrastim je využíván jako mobilizační prostředek před odběry periferních krvetvorných buněk a vedou se polemiky o riziku rozvoje hematologických malignit. Analyzovali jsme výskyt malignit a systém dispenzarizace dárců po odběrech krvetvorných buněk.Soubor pacientů a metody:
Prospektivní sledování příbuzenských dárců Hematologicko-onkologického oddělení FN Plzeň a nepříbuzenských dárců Českého národního registru dárců dřeně (ČNRDD) v období 2001–2010.Výsledky:
U 344 dárců ČNRDD při sledování 753 osobo-let byl zastižen pouze rozvoj chronické lymfatické leukemie u jednoho dárce kostní dřeně 6 let po odběru s tím, že retrospektivně byl klon leukemie prokázán analýzou DNA ve vzorku krve dárce již v době před odběrem dřeně. U 84 příbuzenských dárců periferních krvetvorných buněk při sledování 337 osobo-let byly zastiženy akutní myeloidní leukemie, non-hodgkinský lymfom, karcinom ledviny a kolorekta. Korespondující incidence hematologických malignit zde byla 593 případů, přičemž očekávaná incidence byla 143/100 000. Věk příbuzenských dárců byl signifikantně vyšší: 48 (16–75) vs 31 (20–42) let, (p < 0,0001). Významně více nedispenzarizovaných dárců bylo příbuzenských i při aktivním systému poodběrového sledování: 32 % vs 3 % (p < 0,0001).Závěr:
Výskyt malignit u dárců krvetvorných buněk lze přirozeně předpokládat s tím, že u příbuzenských dárců je riziko vyšší s ohledem na jejich obecně vyšší věk. U příbuzenských dárců je nutné počítat také s obecně vyšším rizikem hematologických malignit při rodinném výskytu. Vliv filgrastimu na vývoj hematologických malignit vyžaduje další analýzy a není zatím evidentní. Spolupráce s příbuzenskými dárci v rámci dispenzarizace je omezená.Klíčová slova:
filgrastim – incidence – dárci tkání – leukemie myeloidní akutní – lymfomÚvod
Alogenní transplantace krvetvorných buněk jsou významnou součástí léčby hematologických malignit a akutních leukemií především. U dospělých pacientů jsou jako hlavní štěpy krvetvorných buněk využívány kostní dřeň (KD), která se odebírá dárcům v celkové anestezii z lopaty kosti kyčelní, a dále periferní krvetvorné buňky (PKB), které se odebírají dárcům prostřednictvím leukaferézy z periferní krve po předchozí stimulaci filgrastimem – růstovým faktorem granulopoézy (G-CSF, granulocyte colony-stimulating factor, Neupogen®). V souvislosti s používáním filgrastimu se objevují polemiky o možném zvýšeném riziku rozvoje hematologických malignit. Bylo zjištěno, že krátkodobá aplikace G-CSF dárcům indukovala chromozomální tetraploidii v malé části zralých myeloidních buněk v krvi [1], genetické alterace v lymfocytech [2] a aneuploidii [3]. V roce 2006 publikoval Bennett et al [4] dva případy rozvoje akutní myeloidní leukemie (AML) u příbuzenských dárců PKB, jejichž sourozenci trpěli rovněž AML, ze souboru 200 dárců stimulovaných filgrastimem. V rozsáhlé retrospektivní analýze EBMT – the European Group for Blood and Marrow Transplantation – bylo u dárců zastiženo 20 hematologických malignit (392/100 000), z nichž 8 bylo po dárcovství KD a 12 po dárcovství PKB, přičemž zjištěná incidence nepřekročila incidenci v běžné populaci v odpovídající věkové skupině, a z nepříbuzenských dárců došlo k rozvoji AML pouze u jednoho dárce KD [5]. Mezi 4 015 dárci PKB amerického registru NMDP – National Marrow Donor Program – bylo zaznamenáno 20 případů malignit bez případu leukemie nebo lymfomu [6] a bez incidencí převyšujících běžný výskyt v populaci.
Rozhodli jsme se analyzovat výsledky dispenzarizace a výskyt malignit po odběrech krvetvorných buněk u příbuzenských dárců Hematologicko-onkologického oddělení (HOO) FN Plzeň a porovnat je s nepříbuzenskými dárci Českého národního registru dárců dřeně (ČNRDD).
Metodika a soubor
Analýza dat získaných prospektivně v období 1/2001–12/2010 v rámci dispenzarizace příbuzenských (sourozeneckých) dárců krvetvorných buněk HOO a nepříbuzenských dárců registru ČNRDD.
Odběr krvetvorných buněk všech dárců probíhal v odběrovém centru HOO FN Plzeň vždy po předchozím informovaném souhlasu a lékařském vyšetření dárce a po stanovení jeho způsobilosti a únosnosti k dárcovství a odběru podle platných právních norem ČR [7] a doporučení a standard WMDA – World Marrow Donors Association [8] a JACIE//EBMT – Joint Accreditation Committee-ISCT and European Group for Blood and Marrow Transplantation [9]. Péče o dárce v rámci HOO a ČNRDD a bezpečnost medicínské a laboratorní praxe rovněž odrážely nároky legislativy ČR a požadavky WMDA a JACIE/EBMT.
Kostní dřeň (KD) byla odebírána dárcům v celkové anestezii na chirurgickém operačním sále z lopaty kosti kyčelní v množství nepřekračujícím objem 20 ml kostní dřeně a krve na 1 kg hmotnosti dárce, maximálně však 1 500 ml (předem byl dárcům zajištěn odběr autotransfuze). Periferní krvetvorné buňky (PKB) byly odebírány dárcům leukaferézou z periferní krve cestou dialyzační kanyly zavedené do femorální žíly nebo cestou periferních žil po předchozí stimulaci filgrastimem (Neupogen inj., fa Amgen) v dávce 10 µg/kg/den s.c. po dobu pěti dní před odběrem.
Po odběru byli všichni dárci poučeni o systému poodběrové dispenzarizace ve spolupráci s jednotlivými dárcovskými centry ČNRDD, HOO FN Plzeň nebo se svými praktickými lékaři podle místa bydliště a byli poučeni o vhodnosti dodržení pravidelných kontrol zdravotního stavu v základních intervalech 1 týden, 1 měsíc, 6 měsíců a 1 rok po odběru (dárci KD alespoň v intervalu 6 měsíců a 1 rok). V rámci ČNRDD bylo od roku 2005 doplněno další sledování dárců v intervalu jednoho roku po celkovou dobu 5 let. Původní systém pasivního sledování byl od roku 2003 v ČNRDD a od roku 2008 na HOO nahrazen systémem aktivním, kdy regionální dárcovská centra ČNRDD, respektive transplantační koordinátor HOO, aktivně sledují plánované termíny návštěv a dárcům je v případě potřeby připomínají. Příbuzenským dárcům HOO byl v roce 2009 navíc odeslán specifický dotazník pro doplnění informací o aktuálním zdravotním stavu.
Porovnání charakteristik souborů bylo provedeno s využitím programu GraphPad InStat a byly použity základní statistické testy Fisher’s exact two-tailed test pro kategoriální data a unpaired t-test pro data kontinuální. Rozdíly mezi skupinami byly testovány na hladině významnosti 95 % a hodnoty p < 0,05 byly považovány za statisticky významné.
Výsledky
V období 2001–2010 bylo do dispenzarizace zařazeno 137 příbuzenských dárců (45 % žen) HOO FN Plzeň, přičemž dárců KD bylo 12 s mediánem věku 33 (16–59) let a dárců PKB bylo 125 s mediánem věku 50 (16–75) let. Průběh plánované dispenzarizace nebyl dodržen z důvodu nezájmu nebo odmítnutí u 7/12 (58 %) dárců KD a 41/125 (33 %) dárců PKB. Po doplňujícím přičtení dalších dárců, kteří ještě navíc odpověděli na retrospektivní dotazník o zdravotním stavu z roku 2009, byly údaje o poodběrovém zdravotním stavu dostupné u 23 dárců KD a 84 dárců PKB, s celkovým mediánem doby sledování 6 (1–13) let, což souhrnně odpovídalo hodnotě 199 osobo-let sledování ve skupině dárců KD a 337 osobo-let u PKB příbuzenských dárců.
V období 2001–2010 bylo do krátkodobé jednoleté dispenzarizace zařazeno 360 dárců ČNRDD (29 % žen), přičemž dárců KD bylo 172 s mediánem věku 29 (19–54) let a dárců PKB 188 s mediánem věku 31 (19–55) let. Do dlouhodobé 5leté dispenzarizace bylo zařazeno celkem 127 KD a 121 PKB dárců. Dispenzarizace nebyla realizována u 6/172 (3,5 %) dárců KD a 10/188 (5 %) PKB. Celkem byly údaje o poodběrovém sledování zdravotního stavu dostupné u 166 KD a 178 PKB dárců, s celkovým mediánem doby sledování 3 (1–5) let, což souhrnně odpovídalo hodnotě sledování 309 osobo-let ve skupině dárců KD a 444 osobo--let u PKB nepříbuzenských dárců.
Statisticky signifikantně více nedispenzarizovaných dárců bylo při původním pasivním systému poodběrového sledování dárců ve srovnání s aktuálním systémem aktivním, a to jak v rámci ČNRDD, tak i HOO. Současně bylo také statisticky signifikantně více nedispenzarizovaných dárců ve skupině příbuzenských i při zajištěném aktivním systému poodběrového sledování. Přesné údaje jsou pro přehlednost uvedeny v tab. 1.
Table 1. Statistické analýzy efektivity dispenzarizace dárců a věku. 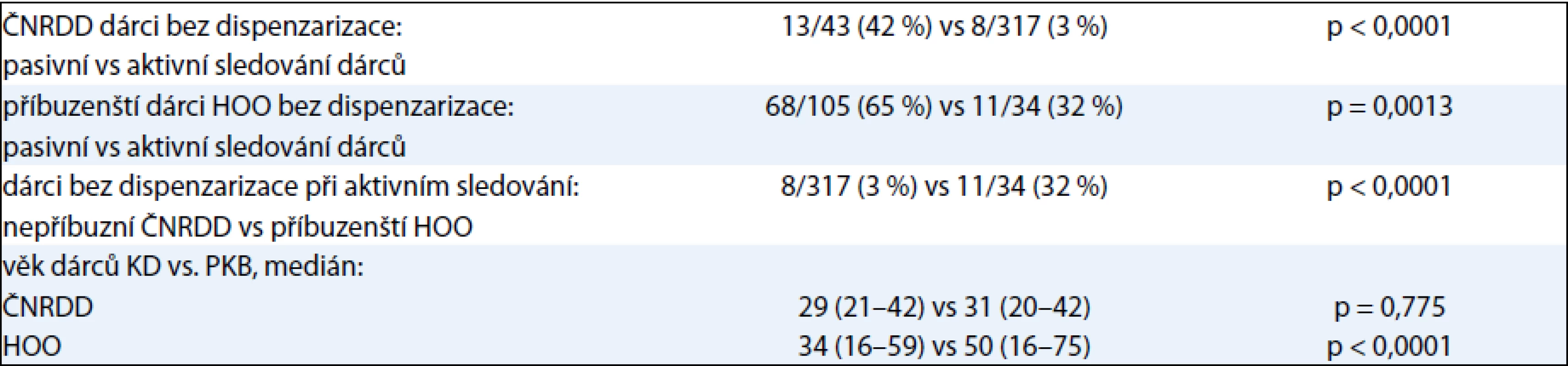
Při srovnání příbuzenských vs nepříbuzenských dárců registru byl statisticky významný rozdíl v mediánu věku [48 (16–75) vs 31 (20–42) let, p < 0,0001] a také v zastoupení žen dárkyň (45 % vs 29 %, p < 0,0001).
Ve skupině nepříbuzenských dárců ČNRDD nebyl během sledování zastižen žádný rozvoj malignity kromě případu dárce KD, u kterého došlo za šest let po odběru k manifestaci chronické lymfocytární leukemie (CLL), přičemž retrospektivní analýzou DNA byla prokázána přítomnost populace klonu CLL ve vzorcích krve dárce již v období před odběrem kostní dřeně (P. Jindra – osobní sdělení), a tento případ nelze tedy dávat do souvislosti s dárcovstvím. Žádná malignita nebyla pozorována ani v malé skupině 23 příbuzenských dárců KD.
Ve skupině 84 příbuzenských PKB dárců, respektive 337 osobo-let sledování s mediánem věku 50 (16–75) let byl zastižen případ AML, non-hodgkinského lymfomu (periferní T-lymfom), karcinomu ledviny a kolorekta. Korespondující incidence dvou hematologických malignit v této skupině dárců vztažená na 100 000 osobo-let byla 593 případů, přičemž očekávaná incidence (současně onemocnění AML a non-hodgkinského lymfomu) je 143/100 000 v bělošské populaci věku 20–75 let podle údajů National Cancer Institute registru SEER [10]. Bližší údaje o hematologických malignitách, příbuzenském dárci a příjemci jsou uvedeny v tab. 2, přesnější klinicko-patologické údaje o dvou výše uvedených nehematologických malignitách nejsou k dispozici s ohledem na retrospektivní a dotazníkový charakter informace o jejich výskytu.
Table 2. Hematologické malignity, dárci a příjemci. 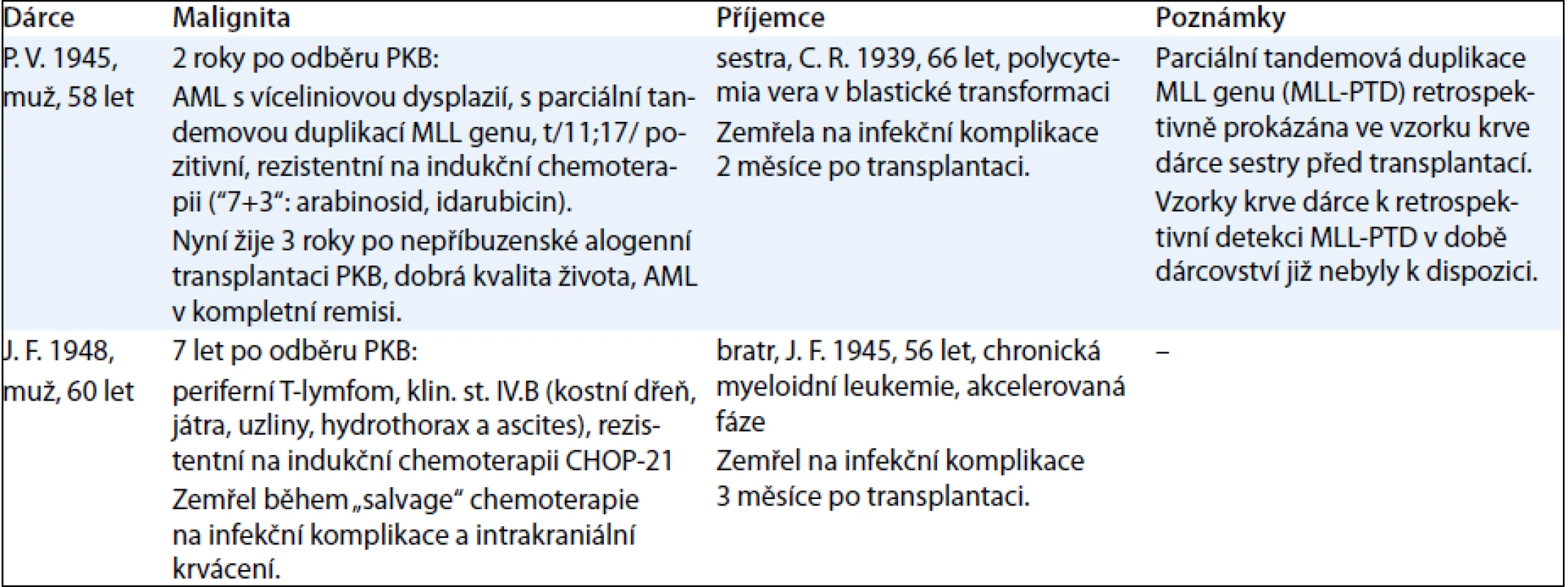
Diskuze
V souvislosti s používáním filgrastimu – růstového faktoru granulopoézy (G-CSF, granulocyte colony-stimulating factor, Neupogen®) – se objevují polemiky o potenciálním riziku rozvoje hematologických malignit. Dosavadní pozorování dokládají výskyt hematologických i nehematologických nádorových onemocnění jak u dárců PKB, tak i KD, přičemž zřetelně více u dárců příbuzenských, nicméně bez prokazatelné souvislosti s vlastním aktem dárcovství, respektive s aplikací filgrastimu v rámci přípravy k odběru PKB [4–6]. Za bezpečné je považováno také podávání filgrastimu při mobilizaci krvetvorných buněk periferní krve přímo u pacientů s akutní myeloidní leukemií [11].
Provedli jsme analýzu nepříbuzenských dárců z registru ČNRDD a dárců příbuzenských (sourozeneckých) z našeho pracoviště HOO FN Plzeň. Výsledky sledování je však nutné interpretovat s přihlédnutím k několika zásadním okolnostem. Soubory dárců jsou především poměrně malé a v případě dárců příbuzenských byla významná nedostupnost v poodběrovém sledování. Ve srovnání s výsledky ČNRDD je patrné, že i přes zavedení aktivního systému sledování na HOO je účast příbuzenských dárců na poodběrovém sledování značně problematická a zatížená jejich nechutí spolupracovat, převážně z psycho-sociálních důvodů, které bude vhodné samostatně sledovat a vyhodnotit.
Dalším významným faktorem, který přispívá ke zvýšenému výskytu malignit ve skupině příbuzenských dárců, je jistě také jejich vyšší věk, který souvisí s vyšším věkem jejich transplantovaných sourozenců a preferencí štěpů PKB v léčbě těchto starších pacientů, kde jsou intenzivní předtransplantační přípravné režimy nahrazeny režimy s redukovanou toxicitou (např. protokol Flu/Mel s fludarabinem a melfalanem). Přirozeně lze očekávat, že ve starší věkové skupině dárců bude i vyšší záchyt případných malignit, jak dokládají analýzy dat onkologických registrů [10,16] a českého registru akutních leukemií ALERT [12], kde je incidence akutních leukemií ve starší populaci několikanásobná ve srovnání s mladými jedinci. Při hodnocení výsledků našeho pozorování je nutné přihlédnout také k faktu, že sourozenci pacientů s hematologickými malignitami mají rovněž 2–5násobně vyšší riziko rozvoje stejného onemocnění než běžná populace [13–15], což by nejspíše odpovídalo i poměru námi zjištěné incidence s údaji očekávané incidence v populaci (593 vs 143/100 000).
Závěr
Výskyt hematologických a nehematologických malignit u dárců krvetvorných buněk lze přirozeně předpokládat s tím, že u příbuzenských dárců je riziko onemocnění vyšší s ohledem na jejich obecně vyšší věk a současně i fakt určité genetické rodinné zátěže. Vliv filgrastimu na vývoj hematologických malignit vyžaduje další analýzy, pro které bude nutné zajistit aktivní sledování na velmi početných skupinách dárců KD a PKB, příbuzenských i nepříbuzenských. K naplnění tohoto cíle bude potřebná mezinárodní spolupráce, prospektivní definované sledování a dlouhodobá dispenzarizace dárců, která je však zřetelně zatížena omezenou spoluprací ze strany příbuzenských dárců.
Poděkování
Dárcovská centra Českého národního registru dárců dřeně: Transfuzní oddělení a krevní banka FN Brno, Transfuzní oddělení nemocnice České Budějovice, Transfuzní oddělení FN Hradec Králové, Transfuzní oddělení nemocnice Liberec, Transfuzní oddělení nemocnice Most, Imunologický ústav FN a LF UP Olomouc, Transfuzní oddělení Ostrava, Hematologicko-onkologické oddělení Plzeň, Oddělení hematologie, biochemie a krevní transfuze ÚVN Střešovice Praha, Transfuzní oddělení Masarykovy nemocnice Ústí nad Labem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Samuel Vokurka, Ph.D.
Hematologicko-onkologické oddělení
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Obdrženo: 30. 6. 2011
Přijato: 23. 8. 2011
Sources
1. Kaplinsky C, Trakhtenbrot L, Hardan I et al. Tetraploid myeloid cells in donors of peripheral blood stem cells treated with rhG-CSF. Bone Marrow Transplant 2003; 32(1): 31–34.
2. Nagler A, Korenstein-Ilan A, Amiel A et al. Granulocyte colony-stimulating factor generates epigenetic and genetic alterations in lymphocytes of normal volunteer donors of stem cells. Exp Hematol 2004; 32(1): 122–130.
3. Marmier-Savet C, Larosa F, Legrand F et al. G-CSF-induced aneuploidy does not affect CD34+ cells and does not require cell division. Blood 2010; 115(4): 910–911.
4. Bennett CL, Evens AM, Andritsos LA et al. Haematological malignancies developing in previously healthy individuals who received haematopoietic growth factors: report from the Research on Adverse Drug Events and Reports (RADAR) project. Br J Haematol 2006; 135(5): 642–650.
5. Halter J, Kodera Y, Ispizua AU et al. Severe events in donors after allogeneic hematopoietic stem cell donation. Haematologica 2009; 94(1): 94–101.
6. Confer DL, Miller JP. Long-term safety of filgrastim (rhG-CSF) administration. Br J Haematol 2007; 137(1): 77–78.
7. Nařízení vlády, kterým se provádí zákon č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (transplantační zákon), č. 436/2002 Sb. a Vyhláška Ministerstva zdravotnictví, kterou se stanoví bližší podmínky posuzování zdravotní způsobilosti a rozsah vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací), č. 437/2002 Sb.
8. The World Marrow Donor Association (WMDA). Worldmarrow.org. Last update: 2011 June 06, cited 2011 June 23. Available from: http://www.worldmarrow.org/.
9. The Joint Accreditation Committee-ISCT (Europe) & EBMT (JACIE-EBMT). Jacie.org. Last update: 2011 June 22, cited 2011 June 25. Available from: http://www.jacie.org/.
10. The Surveillance, Epidemiology, and End Results (SEER) Program of the National Cancer Institute, Cancer statistics, Database: Incidence – SEER 17 (2000–2008). Last update 2011 May 5, cited 2011 June 16. Available from: http://www.seer.cancer.gov/.
11. Doubek M, Mayer J. Filgrastim a akutní myeloidní leukemie. Klin Onkol 2003; 16(4): 161–167.
12. Indrák K, Papajík T, Faber E et al. Kritická analýza dat o akutních a chronických leukémiích v Národním onkologickém registru České republiky. Klin Onkol 2007; 20 (Suppl 1): 132–141.
13. Pottern LM, Linet M, Blair A et al. Familial cancers associated with subtypes of leukemia and non-Hodgkin’s lymphoma. Leuk Res 1991; 15(5): 305–314.
14. Segel GB, Lichtman MA. Familial (inherited) leukemia, lymphoma, and myeloma: an overview. Blood Cells Mol Dis 2004; 32(1): 246–261.
15. Wang SS, Slager SL, Brennan P et al. Family history of hematopoietic malignancies and risk of non-Hodgkin lymphoma (NHL): a pooled analysis of 10 211 cases and 11 905 controls from the International Lymphoma Epidemiology Consortium (InterLymph). Blood 2007; 109(8): 3479–3488.
16. Dušek L, Mužík J, Gelnarová E et al. Incidence a mortalita nádorových onemocnění v České republice. Klin Onkol 2010; 23(5): 311–324.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 1-
All articles in this issue
- Žilní vstupy v onkologii
- Srovnávací proteomická analýza krevní plazmy pacientů s mnohočetným myelomem léčených režimy s bortezomibem
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Žilní vstupy v onkologii
- Využitie elektroimpedančnej tomografie v diagnostike karcinómu prsníka
- Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML)
- Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

