-
Medical journals
- Career
Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
Authors: M. Oliverius 1; M. Šafanda 2; L. Petruželka 3
Authors‘ workplace: Klinika transplantační chirurgie IKEM, Praha 1; Onkologické oddělení Nemocnice na Homolce, Praha 2; Onkologická klinika VFN UK, Praha 3
Published in: Klin Onkol 2010; 23(2): 73-77
Category: Reviews
Overview
Východiska:
Česká republika je zemí s nejvyšším výskytem kolorektálního karcinomu. Každoročně zemře na toto onemocnění více než 4 500 lidí. Je známou skutečností, že až u 50 % nemocných vzniknou v průběhu onemocnění vzdálené metastázy.Metody:
Ačkoliv onkologická léčba díky novým preparátům a zavedení biologické léčby zaznamenala velký úspěch v prodloužení přežívání nemocných, samotná není schopna zajistit úplné vyléčení. Chirurgická léčba tak nadále zůstává jedinou potenciálně kurabilní metodou. Pokroky v operační léčbě, především snížení morbidity a mortality po jaterních resekcích, umožnily nabídnout chirurgický zákrok většímu množství pacientů. Přesto stále zůstává velké množství nemocných primárně inoperabilních pro rozsah onemocnění. Kombinace léčby chirurgické a onkologické individuálně naplánované v rámci multimodálního léčebného týmu podstatně zvyšuje množství pacientů vhodných k radikální resekci. Tím umožňuje nejen zlepšení celkového pětiletého přežívání, ale i významné prodloužení bezpříznakového období.Cíl:
Cílem práce je sumarizovat nový pohled na strategii léčby jaterních metastáz kolorektálního karcinomu a předložit doporučení nových vhodných algoritmů.Klíčová slova:
jaterní metastázy – perioperační chemoterapie – adjuvantní chemoterapie – jaterní resekce – embolizace porty – radiofrekvenční ablaceÚvod
Česká republika je zemí s vysokým výskytem kolorektálního karcinomu. Průměrná incidence je 42,6/100 tis. obyvatel u mužů a 24,9/100 tis. obyvatel u žen. Mortalita v roce 2005 činila 21,0/100 tis. mužů, resp. 13,1/100 tis. žen. Téměř u poloviny pacientů dochází v průběhu onemocnění k vzniku vzdálených ložisek, nejčastěji lokalizovaných do jater, případně do plic. V současné době pouze chirurgická léčba dává nemocným naději na potenciální vyléčení, event. signifikantní prodloužení života. Z celkového množství pacientů je k chirurgické léčbě primárně indikována necelá čtvrtina nemocných. U zbylých 75% je onemocnění shledáno jako primárně neresekabilní. Kombinací léčby onkologické a chirurgické lze ale dosáhnout zvýšení resekability u dalších 15–30% nemocných, a tím zlepšit jejich naději na dlouhodobé přežívání. Klíčovou roli zde sehrává spolupráce všech zainteresovaných stran naplánováním léčebné strategie hned v úvodu onemocnění a její přizpůsobení měnícím se podmínkám. Tento tzv. „tailoring“ aneb ušití léčby na míru přináší nutnost změny v myšlení jak chirurgů, tak onkologů. Vznikají tak nové léčebné postupy, které směřují k společnému cíli, jímž je dlouhodobé přežívání, případně vyléčení pacientů, při zachování dobré kvality života. Tam, kde tato spolupráce dobře funguje, lze dosáhnout pětiletého přežívání pacientů s jaterními metastázami kolorektálního karcinomu přes 50 %.
V klinické praxi musí interdisciplinární týmy řešit tři základní modelové situace: a) pacient s primárně resekabilními jaterními metastázami, b) pacient s primárně neresekabilními metastázami, u kterých lze předpokládat možnost dosažení sekundární resekability a c) pacient s metastázami, u kterého nelze předpokládat, že bude dosaženo resekability [1].
Resekabilita jaterních metastáz a prognostické faktory
Názor na resekabilitu jaterních metastáz, její rozsah a nutnost zachování minimálního okraje zdravé jaterní tkáně se postupně vyvíjel. První práce dokumentující nepochybný význam jaterní chirurgie pro přežívání pacientů se objevují koncem 70. let minulého století [2–3]. Z počátku byli k resekci indikováni pacienti s jedním ložiskem, později se hovořilo o maximálně třech ložiscích. V současné době většina center nemá stanoven žádný limit v počtu či velikosti metastatických ložisek, které by kontraindikovaly jaterní resekci. Podobně se vyvíjel i názor na nezbytnost dodržení tzv. „save margin“ – bezpečného lemu zdravé jaterní tkáně, který je nezbytný zajistit, abychom mohli hovořit o radikální (R0) resekci. Tento okraj se z původních 3cm pomalu zmenšoval až na 1 cm. Některé současné práce referují o nepochybném benefitu resekce při zachování zcela minimálního okraje (5 i méně mm). Podmínkou je, aby ložisko bylo odstraněno celé. Tyto poznatky podporuje zjištění, že se mikrometastázy, na rozdíl od hepatocelulárního karcinomu, vyskytují v okolí ložiska jen u 2% pacientů a všechny jsou uvnitř lemu 4mm. V souboru 58 pacientů s 62 jaterními resekcemi byla rekurence u pacientů s okrajem větším 4mm nulová, s okrajem 2–4mm 2,8% a tam, kde byl okraj menší než 2mm, došlo k rekurenci pouze v 13,3% [4]. Ačkoli každá chirurgická intervence musí být směřována k primárně radikální R0 resekci, má z prognostického hlediska dokonce i mikroskopicky pozitivní resekční okraj (R1 resekce) benefit z hlediska přežívání, díky vysoce potentní chemoterapii, která může po operaci následovat. V nedávno publikované studii provedené u 436 pacientů bylo ve skupině R0 resekovaných (n = 234) dosaženo pětiletého celkového přežití (overall survival – OS) 61% a ve skupině R1 resekcí (n = 202) 57% (p = 0,27). Výskyt lokálních recidiv byl pochopitelně větší v druhé skupině (28% vs 17%; p = 0,004) [5]. Současný konsenzus je ten, že R0 resekce je zlatým standardem a chirurgická strategie musí být plánována s cílem dosažení zdravého resekčního okraje. Pokud se ale R0 resekce nepodaří provést vzhledem k lokalizaci ložiska, je R1 resekce přijatelnou léčebnou strategií s lepšími výsledky než ponechání ložisek bez operace.
Stále jsou diskutovány prognostické faktory s cílem vybrat pro radikální léčbu nejvhodnější kandidáty. Z hlediska dlou-hodobé prognózy bereme jako nepříznivé prognostické faktory velikost jaterního postižení nad 5cm, přítomnost synchronních metastáz nebo vznik metachronních ložisek do jednoho roku od resekce nádoru kolorekta. Dalšími negativními faktory z hlediska onemocnění je N1 pozitivita primárního onemocnění a vysoké hodnoty onkomarkerů s hodnotami CEA > 200 ng/ml [6–8]. Nicméně dosud neexistují doporučení, která by tyto nemocné z chirurgické léčby vylučovala, pokud jsou schopni ji absolvovat.
Resekabilní pacient
V klinické praxi se setkáváme se základními dvěma situacemi: synchronní jaterní metastázy a metachronní jaterní metastázy. Jak tedy postupovat v případě synchronních jaterních metastáz, které jsou primárně resekabilní? Nejčastěji používanou strategií je primární resekce nádoru střeva, následně chemoterapie a poté resekce jater. Tento dnes spíše konvenční postup vychází z předpokladu lepší stratifikace pacientů, kteří progredují v průběhu léčby [9]. Nicméně výsledky dlouhodobého přežívání a DFS nepotvrzují jednoznačnou správnost této teorie. Jednou z možností je synchronní resekce jater a střeva. Tato strategie se zdá optimální jak z hlediska pacienta, tak ekonomiky celého systému. Podobně i výsledky přežívání jsou z retrospektivních údajů příznivé, avšak možnost provedení tohoto zákroku je limitována dalšími faktory. Rozhodující je symptomatologie nádoru, která si v mnoha případech vynutí urgentní řešení (obstrukce, krvácení apod.), a nutný rozsah jaterní resekce, jenž může být pro primární pracoviště limitující [10]. Nicméně synchronní chirurgické řešení onemocnění se z dnešního pohledu zdá optimální. Léčebná strategie zejména u asymptomatických onemocnění směřuje k tomuto cíli. Rozhodnutí o synchronní operaci je v kompetenci multimodálního týmu. Obecným doporučením je primární operace u nádorů pravé poloviny s hepatektomií nepřesahující limity velké jaterní resekce [11]. V případě symptomatického nádoru je na místě využití všech dostupných prostředků k jejich odstranění, jako je např. zavedení kolonických stentů k překlenutí poruch pasáže a následné zahájení vysoce potentní onkologické léčby, kterou následuje definitivní zákrok. Pro tento postup hovoří zejména to, že účinnost soudobé onkologické léčby potencované biologickou léčbou (bevacuzimab, cetuximab) má primární odpověď až u 80% pacientů [12].
V případě, že rozsah jaterního postižení vyžaduje větší chirurgickou intervenci nebo pokud by byl plánován vícedobý zákrok, je optimálním řešením zahájení předoperační chemoterapie podobně jako u primárně neresekabilních ložisek [13].
Pro doplnění je třeba uvést, že původní strategie resekce střeva, následně resekce jater a poté chemoterapie má v současnosti menší oprávnění. Jsou práce hovořící i o možnosti primárně resekovat játra a následně kolon [14]. Aby byla situace ještě komplikovanější, je třeba vzít v úvahu i individuální zkušenosti chirurgických center s komplikovanějšími jaterními resekcemi. Jde o faktor významný, který lze však obtížně specifikovat.
V případě metachronních metastáz rozhoduje o indikaci k chirurgickému zákroku kromě únosnosti pacienta k operaci technická proveditelnost resekce. Je li ložisko (ložiska) lokalizováno tak, že chirurgický zákrok je primárně proveditelný bez nutnosti extenzivního výkonu (více než lobektomie), je dosavadní léčebnou strategií primární výkon. U pacientů vyžadujících extenzivní chirurgický zákrok je na místě zvažovat strategii podobnou jako u primárně neoperabilních metastáz. Tedy zahájení onkologické léčby a po „downsizingu“ (zmenšení ložiska) provedení resekce [15–18]. Nový pohled na léčebnou strategii přinášejí výsledky multicentrické prospektivní randomizované studie III. fáze EPOC 40983 s předoperačně podávanou chemoterapií v režimu FOLFOX 4 v šesti cyklech před jaterní resekcí a po ní oproti skupině léčené pouze chirurgicky [19]. Primárním endopointem byl progression free survival (PFS). V průběhu tří let se podíl PFS zvýšil o 8,1% (hazard ratio (HR) = 0,77; p = 0,041) ve prospěch skupiny léčené. Podobné výsledky podporují další dvě monocentrické studie fáze II s režimy XELOX/FOLFOX [20] a XELOX a bevacuzimab [21]. Na základě těchto studií vyvstává otázka, zda předoperační chemoterapii nezahájit ani u primárně resekabilních ložisek. Pro tuto strategii hovoří menší potřeba rozsáhlejších resekcí ve prospěch limitovaných parenchym šetřících resekcí, vyšší radikalita a prodloužení doby do relapsu onemocnění – relaps free survival (RFS).
Vzhledem k odlišnému pohledu na resekabilitu mezi jednotlivými chirurgickými centry a chybění „guidelines“ pro typ zvoleného režimu je obtížné definovat obecná doporučení. Strategií našeho centra je primárně resekovat pacienty, kteří mají příznivé prognostické faktory a nevyžadují excesivní resekci. V ostatních případech začínáme léčbu předoperačně podanou chemoterapií s častými kontrolami a indikací pacienta k zákroku, jakmile je to situace dovolí.
Primárně neresekabilní pacient
Ačkoli v současné době na mnoha pracovištích probíhá pravidelné sledování pacientů po resekci KRCa, stále se setkáváme s určitým podílem nemocných, kteří přicházejí s primárně chirurgicky neřešitelným nálezem. Z této skupiny nemocných je nezbytné vyloučit ty, kteří velmi pravděpodobně nikdy k resekci nedospějí. Prvním kritériem je performance status posuzovaný podle obecně platných kritérií ECOG [22]. Druhým kritériem je mimojaterní chirurgicky neovlivnitelná generalizace. To jsou pacienti indikovaní k paliativní nebo symptomatické léčbě. Všichni ostatní představují soubor potenciálně resekabilních nemocných. Tato skupina nemocných s izolovaným postižením jater (případně s chirurgicky radikálně ovlivnitelným mimojaterním postižením) je indikována k předoperační systémové léčbě. Optimální léčebný režim dosud není stanoven. Na základě klinických studií jsou možností volby režimy s oxaliplatinou (FOLFOX, XELOX). Zařazení biologických léků bevacizumab či cetuximab do těchto režimů se zdá přínosem, ale pro nedostatek prediktivních faktorů to nelze považovat za standard. Mutace genu k ras je zatím jediným prediktorem odpovědi pro cetuximab (resp. panitumumab) využitelným v praxi. Prediktivní faktor pro bevacizumab není znám. Další „individualizace“ léčby půjde směrem genetického definování nádorů. V současné době neexistují data spolehlivě preferující některý z biologických léků (bevactizumab, cetuximab). Odpověď možná přinese výsledek probíhající randomizované studie fáze III CALGB 80405 s FOLFIRI/ FOLFOX plus bevacizumab nebo cetuximab [23]. Z praktického hlediska tyto pacienty rozdělujeme na tři skupiny vyžadující odlišnou strategii léčby (obr. 1). První skupinu představují pacienti s unilaterálním postižením jater, kde je primární resekce možná, ale zbylý jaterní parenchym je svým objemem nedostatečný pro bezproblémovou funkci (méně než 30% u zdravých jater, méně než 40% u jater nemocných nebo po předchozí chemoterapii). Léčebnou strategií je embolizace portální žíly s cílem dosáhnout kompenzatorní hypertrofie zbylého parenchymu, který umožní rozsáhlejší chirurgický zákrok, event. s předoperační chemoterapií. Druhou skupinu představují pacienti s bilobárním postižením jater, u kterých lze snadno dosáhnout odstranění všech ložisek, a přitom objem zbylého ponechaného parenchymu je funkčně dostačující. Po provedené perioperační léčbě indikujeme jednodobou resekci. Poslední skupinu představují pacienti s multilobárním postižením, kde ponechaná část parenchymu není po odstranění přítomných ložisek funkčně pro svoji velikost dostatečná. V takovém případě po provedené předoperační chemoterapii plánujeme výkon dvoudobý. V první fázi sanujeme budoucí část ponechaného parenchymu a pomocí radiofrekvenční ablace ošetříme přechodovou zónu. Krátce poté provedeme embolizaci porty. V druhé fázi, pokud dojde k dostatečné hypertrofii parenchymu, naplánujeme druhou, definitivní resekci zaměřenou na odstranění zbylých ložisek.
Image 1. Strategie léčby primárně neresekabilního metastatického postižení jater. 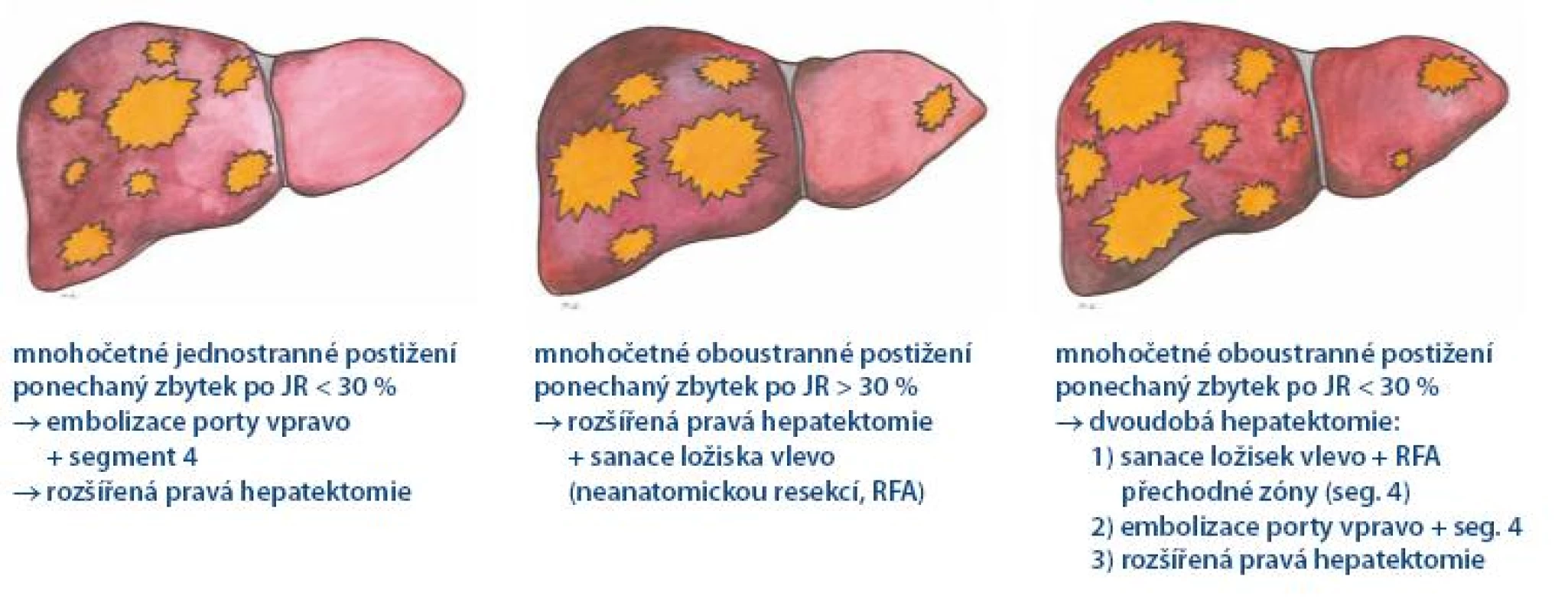
Načasování a délka chemoterapie
Dosavadní zkušenosti jednoznačně ukazují, že předoperačně podávaná chemoterapie následovaná radikální resekcí je výhodná pro pacienty jak z hlediska OS, tak PFS. Otázkou zůstává délka podávání této léčby. Hlavní rizika podávané předoperační chemoterapie jsou tři: 1) hepatotoxický efekt, 2) kompletní radiologická remise a 3) progrese po iniciální odpovědi.
Hepatotoxický efekt léčby
Každá chemoterapie vede k poškození jaterního parenchymu, který má histopatologický korelát. Z pohledu následné chirurgické léčby je důležitý jeho vliv na morbiditu a mortalitu. Rozeznáváme základní dva typy poškození. Léčebné režimy založené na oxaliplatině se projevují především hemoragickými nekrózami a vznikem regenerativní nodulární hyperplazie. Makroskopicky se tyto změny označují jako „blue liver“. Tyto změny zásadně neovlivňují mortalitu, ale mohou vést k většímu krvácení s nutností podávání krevních derivátů, což je spojeno s horším onkologickým výsledkem [24–26]. Chemoterapie založená na podávání irinotecanu vede k steatóze jater až k steatohepatitidě, která má již bezprostřední vliv na mortalitu nemocných [27]. Přidáním biologické léčby cílené na vaskulární endoteliální růstový faktor (vascular endotelial growth factor – VEGF) má za následek sníženou schopnost regenerace jater a potenciální možnost jaterního selhání zejména při extenzivnějších resekcích. Z tohoto důvodu by resekční léčba měla být naplánována s odstupem pěti týdnů po skončení chemoterapie.
Kompletní radiologická remise
To, co je ideálem pro onkologa, tj. dosažení kompletní remise na zobrazovacích vyšetřeních, je noční můrou pro chirurga. Jak ukazují uveřejněné práce a zkušenosti s našimi pacienty, kompletní rentgenologická remise nepředstavuje vyléčení v 83% lézí u 92% pacientů [28–30].
Progrese po iniciální odpovědi
Posledním důvodem, který hovoří proti protrahované onkologické léčbě, je nebezpečí promeškání vhodného terapeutického okna. Po iniciální dobré odpovědi na léčbu dochází vlivem selekce některých nádorových linií k progresi, která na další chemoterapii nereaguje. Znovu progredující tumor se tak může stát sekundárně pro svůj rozsah nebo lokalizaci neresekabilním.
Diskuze a závěr
Základem pro maximální využití všech dostupných metod v léčbě kolorektálního karcinomu je spolupráce mezi chirurgem, onkologem, popř. radioterapeutem, radiologem a patologem. Multimodální tým vede nemocného hned od počátku onemocnění a rozhoduje o správném načasování jednotlivých metod léčby. Tam, kde tyto principy nefungují a léčba je zaměřena pouze jednooborovým směrem, tj. když onkolog léčí pacienta s metastázami, které jsou nebo mohou být operabilní a na druhou stranu chirurg neoperuje pacienty, u kterých lze díky novým léčebným strategiím dosáhnout operability, nelze dospět k lepším výsledkům. Soudobé možnosti nabízejí využití vysoce efektivních chemoterapeutických režimů případně s použitím biologické léčby, jedno či vícedobé jaterní resekce, event. s využitím embolizace porty. Dále kombinované postupy zaměřené k dosažení sekundární resekability. V mnoha případech je předoperačně podaná onkologická léčba výhodná, bohužel zbývá mnoho neznámých. Jaká kombinace cytostatik, zda s biologickou léčbou, jakou biologickou látkou a kolik cyklů. Za nejdůležitější faktor onkoterapie obecně považujeme její zaměření. Musí být dostatečně agresivní a zároveň časově limitovaná, tak aby chirurgická intervence byla správně načasována. Je tedy na nás, do jaké míry se promítne výhoda ze znalosti a využití těchto metod do léčby metastazujícího kolorektálního karcinomu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Martin Oliverius
Klinika transplantační chirurgie IKEM, Praha
Vídeňská 1958/9
140 00 Praha 4
e-mail: maol@ikem.cz
Sources
1. Nordlinger B, Van Cutsem E, Rougier P et al. Does chemotherapy prior to liver resection increase the potential for cure in patients with metastatic colorectal cancer? A report from the European Colorectal Metastases Treatment Group. Eur J Cancer 2007; 43(14): 2037 – 2045.
2. Adson MA. Resection of liver metastases – when is it worthwhile? World J Surg 1987; 11(4): 511 – 520.
3. Scheele J, Stangl R, Altendorf ‑ Hofmann A. Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 1990; 77(11): 1241 – 1246.
4. Kokudo N, Miki Y, Sugai S et al. Genetic and histological assessment of surgical margins in resected liver metastases from colorectal carcinoma: minimum surgical margins for successful resection. Arch Surg 2002; 137(7): 833 – 840.
5. de Haas RJ, Wicherts DA, Flores E et al. R1 resection by necessity for colorectal liver metastases: is it still a contraindication to surgery? Ann Surg 2008; 248(4): 626 – 637.
6. Fong Y, Fortner J, Sun RL et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1 001 consecutive cases. Ann Surg 1999; 230(3): 309 – 321.
7. Nordlinger B, Guiguet M, Vaillant JC et al. Surgical resection of colorectal carcinoma metastases to the liver. A prognostic scoring system to improve case selection, based on 1 568 patients. Association Française de Chirurgie. Cancer 1996; 77(7): 1254 – 1262.
8. Treska V, Topolcan O, Stanislav K et al. Preoperative tumor markers as prognostic factors of colorectal liver metastases. Hepatogastroenterology 2009; 56(90): 317 – 320.
9. Lambert LA, Colacchio TA, Barth RJ Jr. Interval hepatic resection of colorectal liver metastases improves patient selection. Arch Surg 2000; 135(4): 473 – 480.
10. Adam R. Colorectal carcinoma with synchronous liver metastases. Br J Surg 2007; 94(2): 129 – 131.
11. Weber JC, Bachellier P, Oussoultzoglou E et al. Simultaneous resection of colorectal primary tumour and synchronous liver metastases. Br J Surg 2003; 90(8): 956 – 962.
12. Benoist S, Pautrat K, Mitry E et al. Treatment strategy for patients with colorectal cancer and synchronous irresectable liver metastases. Br J Surg 2005; 92(9): 1155 – 1160.
13. Ablorsu E, Kothaj P. Súčasné postavenie chirurgie v liečbe pečeňových metastáz kolorektálneho karcinómu. Klin Onkol 2006; 19(2): 121 – 123.
14. Mentha G, Majno PE, Andres A et al. Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases before treatment of colorectal primary. Br J Surg 2006; 93(7): 872 – 878.
15. Leonard GD, Brenner B, Kemeny NE. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 2005; 23(9): 2038 – 2048.
16. Leonard GD, Brenner B, Kemeny NE. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 2005; 23(9): 2038 – 2048.
17. Treska V, Skalický T, Sutnar A et al. Surgical management of the colorectal carcinoma liver metastases. Rozhl Chir 2009; 88(2): 69 – 74.
18. Alberts SR. Updated options for liver‑limited metastatic colorectal cancer. Clin Colorectal Cancer 2008; 7 (Suppl 2): S58 – S62.
19. Nordlinger B, Sorbye H, Collette L et al. Final results of the EORTC Intergroup randomized phase III study 40983 [EPOC] evaluating the benefit of peri ‑ operative FOLFOX4 chemotherapy for patients with potentially resectable colorectal cancer liver metastases. Proc Am Soc Clin Oncol 2007; 25 : 962s.
20. Gruenberger B, Scheithauer W, Punzengruber R et al. Importance of response to neoadjuvant chemotherapy in potentially curable colorectal liver metastases. BMC Cancer 2008; 8 : 120.
21. Gruenberger B, Tamandl D, Schueller J et al. Bevacizumab, capecitabine, and oxaliplatin as neoadjuvant therapy for patients with potentially curable metastatic colorectal cancer. J Clin Oncol 2008; 26(11): 1830 – 1835.
22. Oken MM, Creech RH, Tormey DC et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5(6): 649 – 655.
23. Adam R, Aloia T, Lévi F et al. Hepatic resection after rescue cetuximab treatment for colorectal liver metastases previously refractory to conventional systemic therapy. J Clin Oncol 2007; 25(29): 4593 – 4602.
24. Rubbia ‑ Brandt L, Audard V, Sartoretti P et al. Severe hepatic sinusoidal obstruction associated with oxaliplatin‑based chemotherapy in patients with metastatic colorectal cancer. Ann Oncol 2004; 15(3): 460 – 466.
25. Aloia T, Sebagh M, Plasse M et al. Liver histology and surgical outcomes after preoperative chemotherapy with fluorouracil plus oxaliplatin in colorectal cancer liver metastases. J Clin Oncol 2006; 24(31): 4983 – 4990.
26. Younes RN, Rogatko A, Brennan MF. The influence of intraoperative hypotension and perioperative blood transfusion on disease‑free survival in patients with complete resection of colorectal liver metastases. Ann Surg 1991; 214(2): 107 – 113.
27. Vauthey JN, Pawlik TM, Ribero D et al. Chemotherapy regiment predicts steatohepatitis and an increase in 90 - day mortality after surgery for hepatic colorectal metastases. J Clin Oncol 2006; 24(13): 2065 – 2072.
28. Nordlinger B, Benoist S. Benefits and risks of neoadjuvant therapy for liver metastases. J Clin Oncol 2006; 24(31): 4954 – 4955.
29. Benoist S, Brouquet A, Penna C et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol 2006; 24(24): 3939 – 3945.
30. Adam R, Delvart V, Pascal G et al. Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long‑term survival. Ann Surg 2004; 240(4): 644 – 658.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2010 Issue 2-
All articles in this issue
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Vakcinace proti lidskému papillomaviru v ČR
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

