-
Medical journals
- Career
Radikální operační výkon a intenzivní chemoterapie jsou podmínkou úspěšné léčby osteosarkomu
: J. Kruseová 1; H. Mottl 1; R. Kodet 2; J. Mraček 3; Z. Matějovský ml. 4; J. Schovanec 3; J. Šnajdauf 5; M. Rygl 5; I. Lišková 6; E. Kabíčková 1; J. Mališ 1; D. Sumerauer 1; E. Drahokoupilová 1; M. Ganevová 1; V. Šmelhaus 1; J. Starý 1
: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 2Ústav patologie 2. LF UK a FN Motol, Praha 3Ortopedická klinika 2. LF UK a FN Motol, Praha 4Ortopedická klinika 1. LF UK a IPVZ FN Bulovka, Praha 5Klinika dětské chirurgie 2. LF UK a FN Mo 1
: Klin Onkol 2009; 22(4): 168-175
: Original Articles
Východiska:
V práci hodnotíme léčebné výsledky u pacientů s osteosarkomem.Soubor pacientů a metody:
V období let 1997–2006 jsme s touto diagnózou přijali 44 pacientů (27 chlapců a 17 dívek). Průměrný věk byl 12,8 let (2,5–20,2 let). Lokalizované onemocnění mělo 41 pacientů a generalizované onemocnění 3 pacienti. Použili jsme léčebný protokol severoamerické kooperativní skupiny dětské onkologie CCG 7921 POG 9351 INT 0133. Medián sledování byl 5,5 let (2–11 let).Výsledky:
U 40 pacientů jsme dosáhli kompletní remise. Relaps onemocnění jsme prokázali u 18 pacientů. Zemřelo 17 pacientů (15krát progrese onemocnění, 1krát toxické úmrtí, 1krát sekundární leukemie). Celkové pětileté přežití (Overall Survival – OS) bylo 58,4% a pětileté přežití do selhání (Event Free Survival – EFS) 46,7%. Pacienti s postižením končetin (n = 40) měli pětiletý EFS 51%. Pacienti s příznivou histologickou odpovědí (n = 22) měli pětiletý EFS 63,6%, naproti tomu nemocní s nepříznivou odpovědí (n = 18) měli pětiletý EFS 30,5% (p = 0,009).Závěr:
Výsledky léčby pacientů s osteosarkomy postihujícími končetiny a s příznivou histologickou odpovědí na předoperační léčbu jsou velmi dobré. Osud pacientů s primárně generalizovaným onemocněním a osteosarkomem v axiálních lokalizacích byl nepříznivý.Klíčová slova:
osteosarkom – děti – mladiství – diagnostické postupy – terapieVýchodiska
Osteosarkom je primární maligní nádor kosti, který predilekčně postihuje metafýzy dlouhých kostí [1–3]. Nejvyšší výskyt onemocnění je mezi 15. a 19. rokem [4–5]. V tomto období se setkáváme převážně s centrálním osteosarkomem vysokého stupně malignity, který tvoří 80–90% všech osteosarkomů [2,6]. Přibližně 15–20% nemocných má již v okamžiku stanovení diagnózy zjistitelné metastázy, a to zejména v plicích (mikrometastázy v plicích jsou udávány ve více než 80%) [7–10]. Zavedení intenzivní chemoterapie začátkem sedmdesátých let zlepšilo přežití do selhání (Event Free Survival – EFS) u lokalizovaného onemocnění z 10–15% na 50–70% [11–13]. Spektrum účinných cytostatik používaných v léčbě osteosarkomu je poměrně úzké. Jednoznačně prokázaná účinnost je u metotrexátu, cisplatiny a doxorubicinu [2,14–15]. Různé kombinace těchto tří základních cytostatik tvoří základ standardní léčby pacientů s osteosarkomem [16]. Zařazení nových cytostatik nebo úprava dávkové intenzity nepřinesly zlepšení léčebných výsledků [4,7–8,17]. Prospektivní randomizované studie neprokázaly rozdíl v přežití, pokud byli pacienti operováni ihned nebo až po předoperační chemoterapii [1–3,19]. Účinná předoperační chemoterapie je však základním předpokladem pro možnost zachování končetiny, a proto většina současných protokolů preferuje druhou variantu, při které lze využít i prediktivního hodnocení histologické odpovědi [6,14,19]. Ve studii sledujeme výsledky naší léčby u pacientů léčených protokolem americké pracovní skupiny „Childrens Oncology Group“ CCG 7921 POG 9351 INT 0133.
Soubor pacientů a metody
V období let 1997–2006 jsme přijali na kliniku dětské hematologie a onkologie 44 pacientů (27 chlapců a 17 dívek) s diagnózou centrálního osteosarkomu. Průměrný věk pacientů byl 12,8 roku (2,5–20,2 roku). Průměrný věk chlapců byl 14 let (2,5–20,2 roku) a dívek 11,6 let (5,1–16,4 let). Interval vzniku symptomů ke stanovení histologické diagnózy byl 40 dní (10 dní až 10,8 měsíce). Nejčastějším symptomem byla bolest (93%), dále otok (39%), rezistence (18%) a patologická zlomenina (9%). Vstupně lokalizované onemocnění jsme prokázali u 37 pacientů (84%) a metastatické plicní postižení u 3 pacientů (7%) (2krát mnohočetné, 1krát solitární). Čtyřicet pacientů (91%) mělo postižení končetin a čtyři pacienti (9%) postižení páteře. Čtyři pacienti (9%) měli tzv. skip metastázy, lézi, která je anatomicky oddělena od primárního postižení nereaktivní normální tkání za zónou perineoplastické reakce. Lokalizace primárního postižení ukazuje graf1. Vstupní rentgenový snímek pacienta s osteosarkomem proximálního humeru je na obr.1. Pacienti nebyli před diagnózou osteosarkomu léčeni pro jiné nádorové onemocnění. U sledovaných pacientů jsme neprokázali Li-Fraumeni syndrom.
1. Lokalizace primárního postižení. 
1. Rentgenový snímek pacienta s osteosarkomem proximálního humeru. 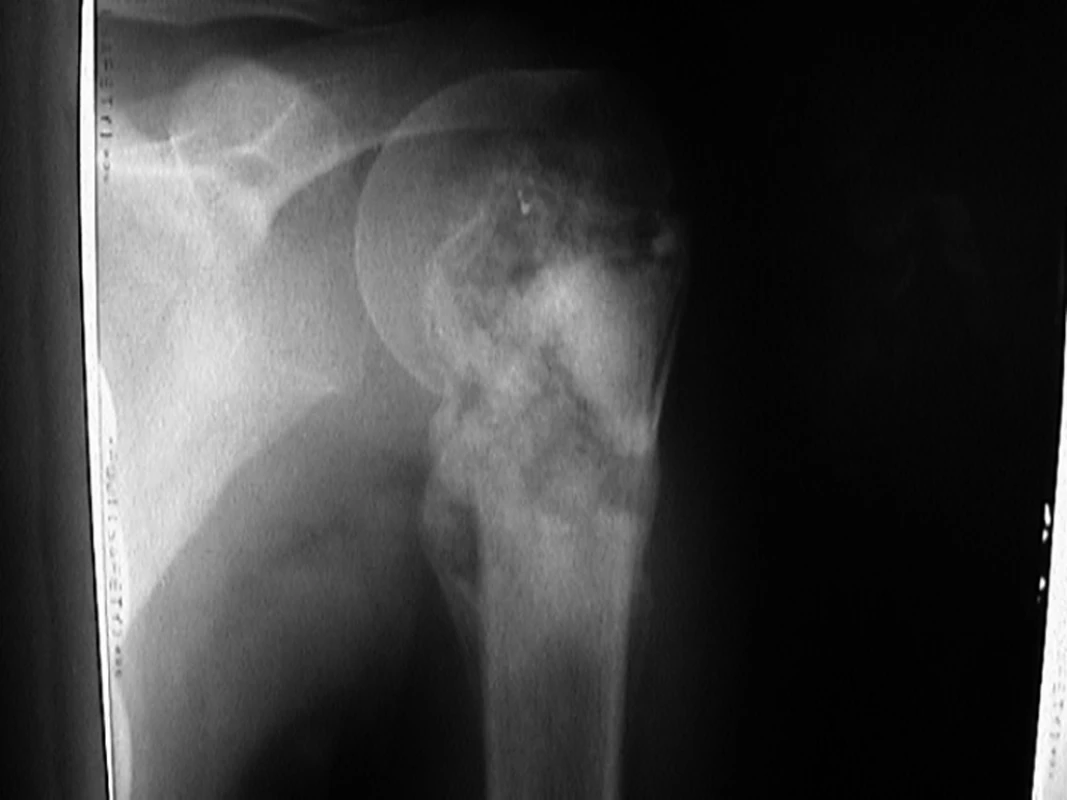
Pacienti byli operováni ve dvou ortopedických centrech: 29 pacientů na ortopedické klinice ve FN Motol a 2. LF UK v Praze a 14 pacientů na ortopedické klinice ve FN UK Bulovka, 1. LF UK Praha. Jednoho pacienta s postižením osového skeletu vstupně bioptovali na neurochirurgickém oddělení ve FN Plzeň.
Histologickým vyšetřením jsme prokázali následující varianty osteosarkomů: 18krát osteoblastický, 15krát chondroplastický, 5krát smíšený, 3krát nediferencovaný, 1krát osteoblastom like varianta, 2krát osteosarkom blíže nezařazený.
V uvedeném souboru sledujeme léčebné výsledky dosažené protokolem severoamerické kooperativní skupiny dětské onkologie CCG 7921 POG 9351 INT 0133. Používali jsme standardní režim, rameno A. Plánovaná délka léčby byla 31 týdnů. Dávkové schéma: vysokodávkovaný metotrexát (HD MTX) 12 gr/m2 1. den (týden 3, 4, 8, 9, 15, 16, 20, 21, 25, 26, 30, 31), doxorubicin (Doxo) 37,5mg/m2/d 1. a 2. den (týden 0, 5, 12, 17, 22, 27) a cisplatina (CDDP) 120mg/m2 den 1 (týden 0,5,12,17). Kumulativní dávka cytostatik byla MTX 144g/m2, Doxo 450mg/m2 a CDDP 480mg/m2. Definitivní chirurgický výkon byl plánován v 10. týdnu. Všichni pacienti podepsali informovaný souhlas s výše uvedeným léčebným postupem.
Histologickou odpověď na předoperační chemoterapii jsme hodnotili podle běžně zavedené stupnice Salzer-Kuntschik [20]:
- grade 1 – žádné vitální buňky
- grade 2 – ojedinělé vitální buňky na ploše menší než 0,5cm
- grade 3 – méně než 10% vitálních buněk(grade 1–3 – příznivá histologická odpověď)
- grade 4 – 10–50% vitálních buněk
- grade 5 – více než 50% vitálních buněk
- grade 6 – plně vitální nádor(grade 4–6 – nepříznivá histologická odpověď).
Křivky přežití jsme konstruovali podle metody Kaplana-Meiera a rozdíly jsme počítali pomocí testu log rank [21–22]. Pro stanovení přežití do selhání (EFS) jsme jako selhání hodnotili relaps, progresi na léčbě, smrt v remisi. Medián sledování pacientů byl 5,5 let (2–11 let).
Výsledky
Chemoterapii jsme zahájili s mediánem intervalu 9 dní (2–92 dní) od diagnostické biopsie. Celý léčebný protokol dokončilo 29 (66%) pacientů. U 12 pacientů jsme změnili léčbu – u 5 pacientů pro progresi onemocnění, u 6 pacientů pro relaps na léčbě a u 1 pacientky pro nefrotoxicitu. U 2 pacientů jsme léčbu předčasně ukončili (1krát pro protrahovanou pancytopenii grade 4, 1krát pro plicní aspergilózu). Jeden pacient zemřel na toxicitu léčby (kardiomyopatie po 2. cyklu chemoterapie).
Chirurgie
Lokální kontrola primárního nádoru: operaci v primární léčbě jsme indikovali u 41 pacientů. Resekční výkon byl proveden u 30 pacientů (73%). U 4 pacientů nebyly hranice resekce dostatečné (3krát marginální, 1krát intralezionální): 2krát pánevní lokalizace (další výkon nebyl možný) a 2krát končetinové lokalizace (v druhé době jsme indikovali amputaci). V této skupině žije 21 pacientů (70%) v kompletní remisi a 9 pacientů zemřelo. Čtyři pacienti (13%) měli lokální relaps. Ablativní výkon (amputace/exartikulace) byl primárně indikován u 11 pacientů (27%). V této skupině 6 pacientů (54%) žije v kompletní remisi a 5 pacientů zemřelo. Jeden pacient měl lokální relaps. Srovnání EFS obou skupin ukazuje tab.1. Rentgenový snímek pacienta po chirurgickém výkonu – artrodéza kolenního kloubu se štěpem je na obr. 2.
2. Pacient s osteosarkomem po chirurgickém výkonu: artrodéza kolene se štěpem. 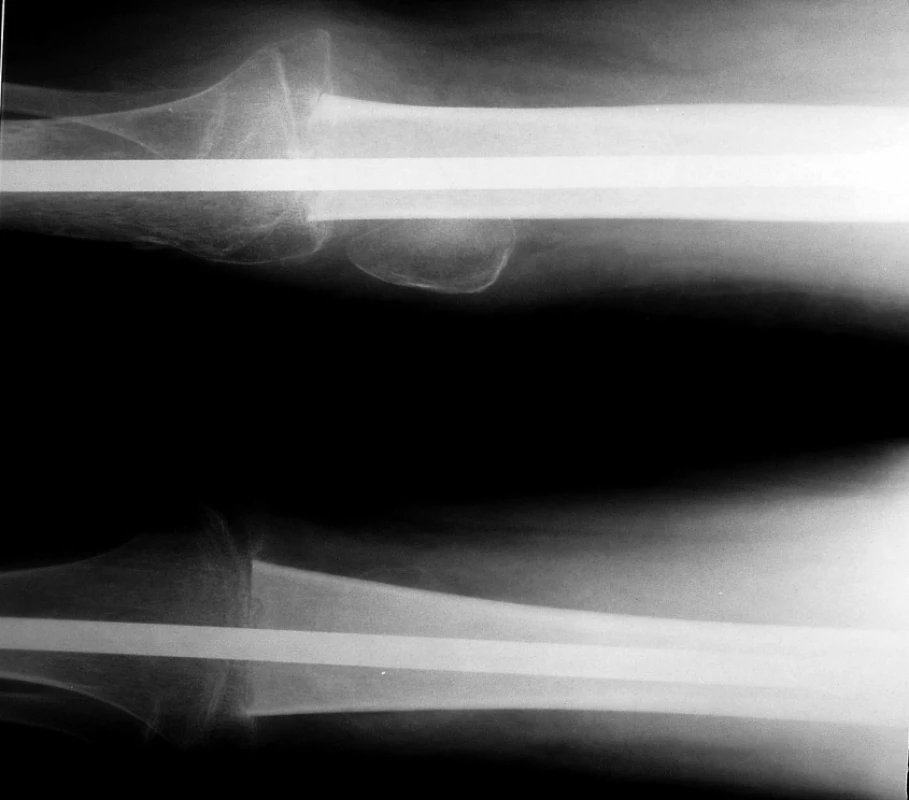
Pro lokální kontrolu primárních plicních metastáz jsme operaci indikovali pouze u jedné pacientky s mnohočetným bilaterálním postižením. Pacientka relabovala v plicích a zemřela na progresi základního onemocnění.
Histologická odpověď na předoperační chemoterapii
Léčebným protokolem jsme dosáhli u 22 pacientů s příznivou histologickou odpovědí pětiletý EFS 63,6% (grade 1 – 6 pacientů, grade 2–3 – 16 pacientů). Nepříznivou histologickou odpověď mělo 18 pacientů, kteří dosáhli pětiletý EFS 30,5% (grade 4 – 9 pacientů, grade 5 – 7 pacientů, grade 6 – 2 pacienti). Rozdíl v EFS je signifikantní (p = 0,009). Srovnání závislosti EFS na histologické odpovědi zobrazuje graf 2. Histologickou odpověď osteosarkomu po předoperační chemoterapii ukazuje obr. 3.
2. Srovnání závislosti EFS na histologické odpovědi. 
3. Osteosarkom, biopsie před zahájením (A) chemoterapie a po 6 cyklech léčby (B). Barvení hematoxylin a eosin, zvětšeno 400krát. (A) Nádor je silně buněčný, osteoblasty jsou velké, v tomto případě relativně uniformní, ale je patrná mitotická aktivita. v malém rozsahu je přítomna tvorba nádorového osteoidu, který je patrný jako homogenní nepravidelné pentlice mezi nádorovými buňkami v pravé části snímku. Zastiženy jsou také roztroušené nenádorové osteoklasty. (B) v nádoru převládá tvorba nádorového osteoidu, buněčnost je malá, nádorové buňky jsou však v tomto zorném poli vitální. V levé části obrázku je lamela spongiózy nenádorového původu. 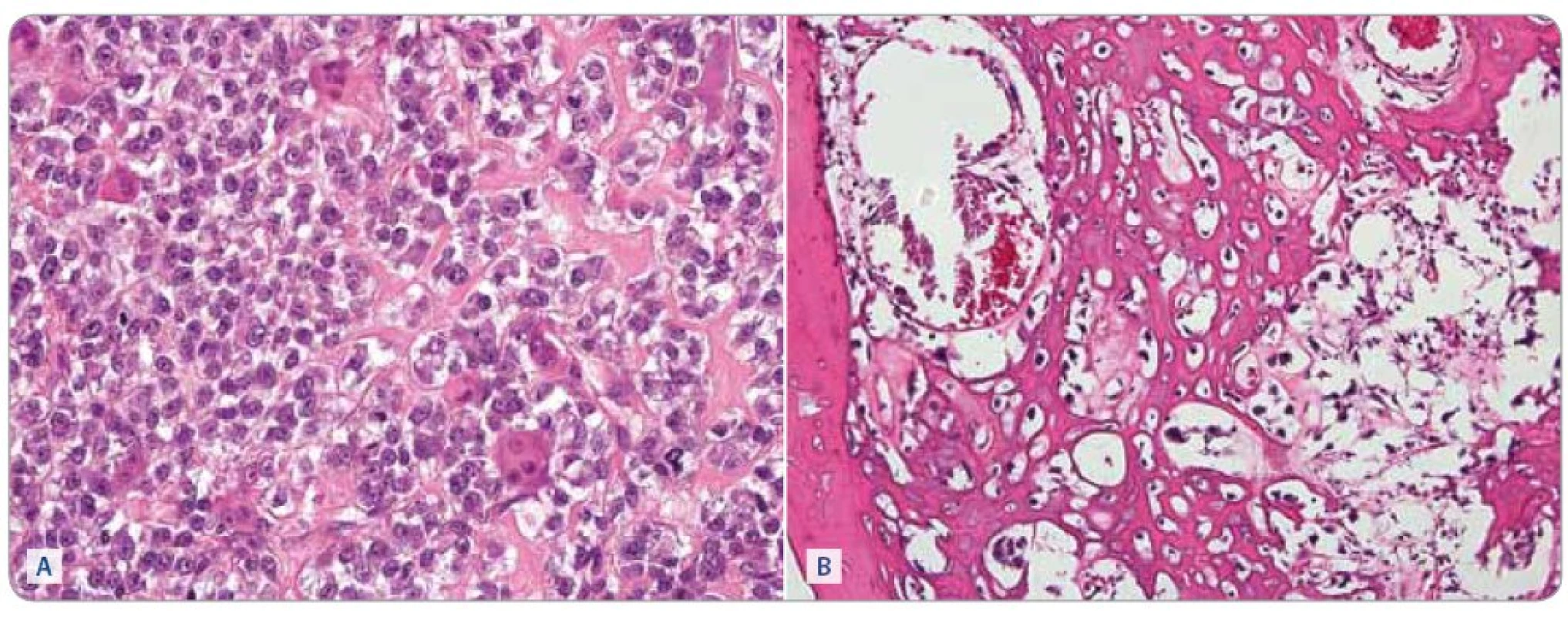
Léčebným protokolem CCG 7921 POG 9351 INT 0133 jsme dosáhli celkové pětileté přežití (Overall Survival – OS) 58,4% a celkové pětileté EFS 46,7% (graf 3). V našem souboru jsme prokázali statisticky signifikantní rozdíl v léčebných výsledcích pouze u histologické odpovědi na předoperační léčbu. U chlapců jsme měli horší celkové přežití než u dívek, avšak bez statistické významnosti. U končetinových lokalizací jsme nezaznamenali rozdíl mezi distálním a proximálním postižením. Nejlepší výsledky měli pacienti s postižením humeru a nejhorší s postižením tibie. Pro srovnání lokalizovaného onemocnění s primárně generalizovaným onemocněním a s axiálním postižením jsme neměli dostatečný počet pacientů. Analýzu těchto prognostických faktorů uvádí tab. 1.
3. Srovnání celkového EFS a OS pacientů s osteosarkomem. 
1. Léčebné výsledky CCG 7921 POG 9351 INT 0133 (analýza prognostických faktorů). 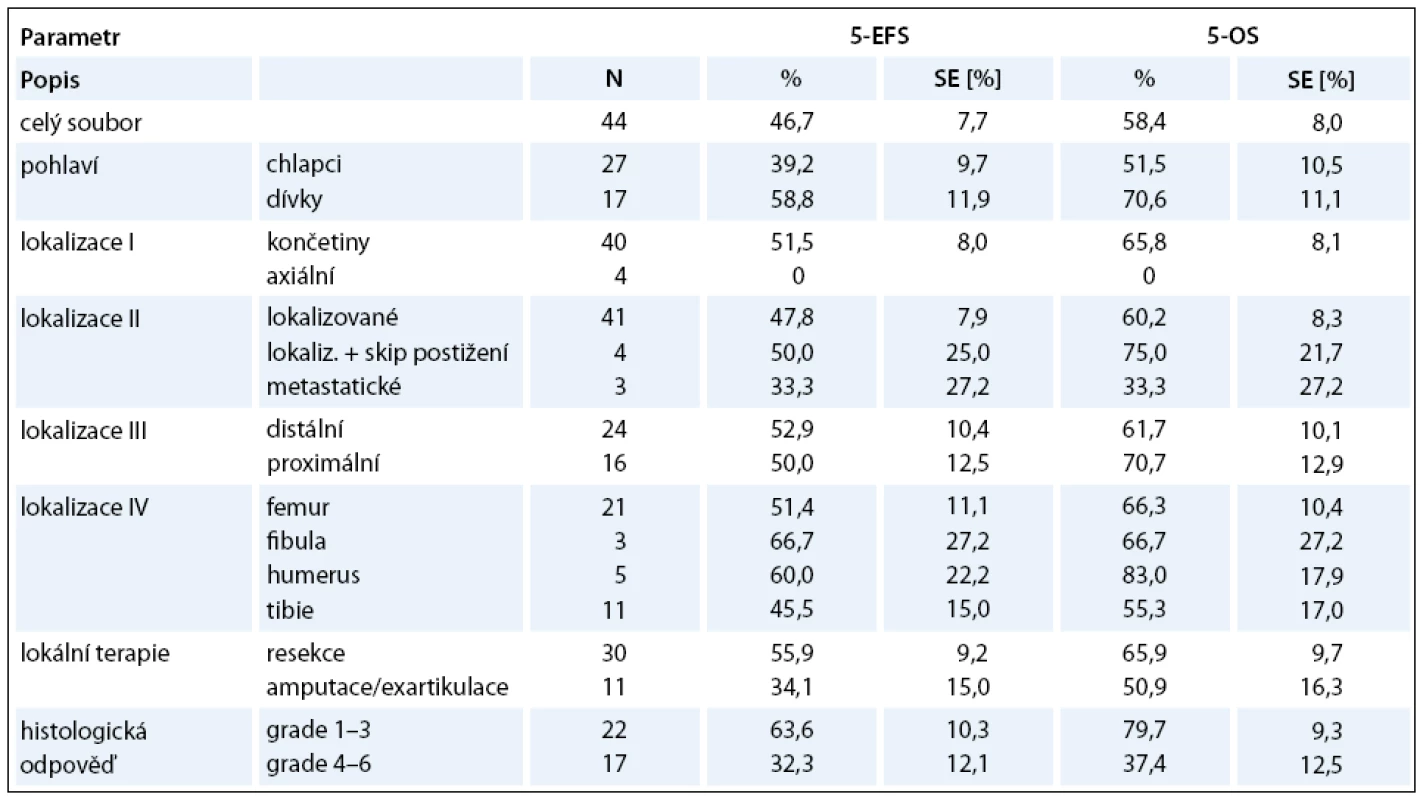
Relapsy onemocnění
Relaps onemocnění postihl 18 pacientů. Medián vzniku relapsu od dosažení 1. kompletní remise (Complete Remision – CR) byl 14,7 měsíce (2,5 měsíce–2,7 roku). Relaps na léčbě mělo 6 pacientů, relaps po ukončené léčbě první volby 12 pacientů. Tři pacienti měli lokální relaps a 15 dětí systémový relaps (10krát v plicích, 3krát v plicích a ve skeletu, 1krát ve skeletu a lokálně a 1krát v plicích a lokálně).
Léčbu druhé volby jsme indikovali u 16 pacientů. Základem byla snaha o adekvátní odstranění všech nádorových ložisek. 12krát jsme makroskopicky radikálně odstranili plicní metastázy. Pacienty jsme nejčastěji zajistili kombinací ifosfamidu a etoposidu. Dva pacienti podstoupili submyeloablitní režim cyklofosfamid + melfalan s převodem periferních kmenových buněk a jedna pacientka autologní transplantaci kostní dřeně. Dva pacienti měli pro rozsáhlou generalizaci procesu pouze symptomatickou léčbu. Po druhém relapsu žije v 3. CR jen jedna pacientka s opakovaným mnohočetným plicním postižením. U pacientů s relapsem jsme dosáhli pětiletý EFS 20,8% a pětiletý OS 27,8%.
Diskuze
Vrchol výskytu osteosarkomu nastává v nižším věku u dívek (10–14 let) než u chlapců (14–18 let) [23], což odpovídá i našemu souboru, v němž byl průměrný věk dívek 11,4 let a chlapců 14 let. Také vyšší incidence onemocnění u chlapců našeho souboru 1,6 : 1 je shodná s ostatními pracovišti [4,6]. Výskyt osteosarkomu u dětí pod 5 let je vzácný 0,8%–2% [3,23]. V sledovaném období jsme měli pouze jednoho pacienta mladšího pěti let a čtyři pacienty mladší osmi let. Průběh onemocnění je u malých dětí stejný jako u adolescentů [23–24]. Meyers et al [1], kteří publikovali léčebné výsledky protokolu CCG 7921 POG 9351 INT 0133 u 677 pacientů léčených v rámci COG, také neprokázali vliv věku na prognózu pacientů. Proto jsme i u této věkové kategorie v souladu s protokolem volili stejný léčebný postup.
Cílem řady studií je identifikovat prognostické faktory, které by v budoucnu mohly lépe stratifikovat léčbu pacientů. Bielack et al [3] hodnotili dosud největší počet 1 765 pacientů s osteosarkomem léčených protokoly německé pracovní skupiny COSS (Cooperative Osteosarcoma Study Group). Mezi nepříznivé prognostické faktory patřila axiální lokalizace, metastatické postižení, nepříznivá histologická odpověď na předoperační léčbu a neradikální chirurgický výkon. Stejný prognostický vliv jsme zaznamenali i u našich pacientů. Na rozdíl od práce Bielacka et al [3], kde u končetinových lokalizací mělo postižení tibie nejlepší prognózu a postižení humeru nejhorší, byly v našem souboru výsledky opačné. Také jsme neprokázali rozdíl mezi výsledky proximálního a distálního postižení, zatímco ve studii Bielacka et al [3] byla proximální lokalizace nepříznivým prognostickým faktorem. V naší sestavě jsme však byli limitováni malým počtem pacientů. V hodnoceném souboru měly dívky lepší přežití než chlapci. Stejné výsledky publikovali i Smeland et al [25] u pacientů léčených protokoly SSG (Scandinavian Sarcoma Group), naproti tomu Bielack et al [3] a Meyers [1] rozdíl v přežití mezi chlapci a dívkami neprokázali.
Nejdůležitějším faktorem v léčbě osteosarkomu je lokální kontrola primárního nádoru [2,13,23]. Díky stále se zlepšujícím chirurgickým technikám je v dnešní době u 80–90% pacientů možný konzervativní postup [6,16,23,26,27]. Resekční výkon je indikován jen při dobré odpovědi na předoperační chemoterapii, a pokud je možné dosáhnout bezpečného odstranění nádoru s adekvátními okraji (široké nebo radikální resekční okraje podle Ennekinga) [2,24]. V opačném případě je vždy doporučena amputace [13,26]. Rozdíl v přežití pacientů, kteří podstoupili ablativní vs resekční výkon, není prokázán [3]. Ablativní výkony jsou indikovány obecně u pacientů s horší prognózou anebo u periferních lokalizací s obtížnou rekonstrukcí zejména ve velmi mladém věku. V našem souboru uvedené vyšší procento amputací (27%) vyplývá z těchto důvodů. Počet lokálních recidiv byl srovnatelný u záchovných i ablativních výkonů, zvláště s ohledem na pánevní lokalizace, kdy nádor nebylo možno vzhledem k jeho šíření do křížové kosti odstranit jinak než intralezionálně.
Histologické hodnocení protinádorové odpovědi na indukční léčbu je jedním z klíčových prognostických faktorů u pacientů s osteosarkomy [28]. Většina protokolů COG, včetně protokolu CCG 7921 POG 9351 INT 0133, používá hodnocení nekróz podle klasifikace Huvos [1]. Za příznivou odpověď považují 98% nekróz v nádorové tkáni. Naproti tomu evropská centra mají hranici příznivé odpovědi ≥ 90% nekróz. Naše pacienty jsme hodnotili podle evropských kritérií. V rámci COSS protokolů mají pacienti s příznivou histologickou odpovědí pětileté EFS 68% a s nepříznivou odpovědí 39% [2]. Stejné výsledky jsme měli i v našem souboru. Pooperační léčbu jsme na základě výsledků histologického nálezu neměnili. Bielack et al [3] ve své multivariantní analýze prokázali, že dívky mají vyšší procento příznivých odpovědí na předoperační chemoterapii než chlapci, ale tento trend jsme u sledovaných pacientů nezaznamenali. Při posuzování odpovědi je nutné brát v úvahu i typ osteosarkomu, neboť nádory s velkým podílem chondroblastické složky mají méně příznivou odpověď na chemoterapii [8,17,29]. Tuto zkušenost jsme měli i při hodnocení našich pacientů.
Prognóza pacientů s primárně metastatickým onemocněním je velmi špatná [6,30]. Přežití těchto nemocných závisí na počtu a lokalizaci metastáz a možnosti adekvátního odstranění všech ložisek [4]. Nejlepší naději mají pacienti s plicními metastázami, u kterých se pětiletý EFS pohybuje kolem 30% [7,9]. Pro prognózu těchto pacientů je důležité, zda se jedná o unilaterální nebo bilaterální postižení, statisticky významný je i počet plicních metastáz [3,7,31]. Některá pracoviště revidují plicní metastázy, přestože vymizely po předoperační chemoterapii [6], jiná ne [7–8]. V našem souboru podstoupila bilaterální torakotomii pouze jedna pacientka, která měla v důsledku mnohočetného plicního postižení i opakované oboustranné pneumotoraxy. U dalších dvou jsme revizi neindikovali – u pacienta se solitárním postižením zmizelo ložisko po předoperační chemoterapii a pacientka s mnohočetným plicním postižením měla inoperabilní progresi primárního nádoru. Pokud je u pacientů v době diagnózy prokázáno jiné metastatické postižení – skelet, játra, slezina, lymfatické uzliny – je prognóza velmi špatná [31]. Tito pacienti by mohli být kandidáty pro studie fáze I–II [30,32]. V našem souboru jsme pacienty s tímto postižením neměli, ale v předchozích letech jsme měli s jejich léčbou obdobnou zkušenost.
Zvláštní skupinou zůstávají tzv. skip léze. Některá pracoviště je zahrnují mezi metastatická postižení [4,33]. Bielack et al [3] řadí pacienty s izolovaným skip postižením mezi lokalizované onemocnění. Stejné hodnocení jsme použili i u našich pacientů. Ve studii Sajadi et al [33] měli pacienti se skip postižením extrémně špatnou prognózu, naproti tomu v práci Kagera et al [31] měli tito pacienti pětileté EFS 47%. Pro předoperační identifikace skip metastáz je suverénní metodou MRI vyšetření [33], které však musí zobrazit v dostatečném rozlišení celý kompartment – celou postiženou kost a nejen vlastní nádor. V našem souboru jsme u dvou pacientů nalezli skip ložiska až během operace – jeden pacient měl relaps onemocnění a žije ve 2. CR, druhý zemřel na progresi onemocnění. Další dva pacienti se skip postižením, kteří žijí, měli tato ložiska prokázána na scintigrafii skeletu a na CT, během operace nalezena nebyla. Nemůžeme tedy s jistotou říci, zda se u těchto dvou pacientů jednalo o skip léze.
I přes nejlepší standardní terapii má přibližně jedna třetina pacientů, která dosáhla kompletní remise, relaps onemocnění [4,13,34]. Některé studie považují za příznivé vznik relapsu za ≥ 12 měsíců od diagnózy [8,35], jiné ≥ 24 měsíců od diagnózy CR [6,16,36–38]. Naproti tomu Crompton et al [34] rozdíl v přežití pacientů s relapsem před 12. měsícem a později nebo před 24. měsícem a později neprokázal. Medián vzniku relapsu v zahraničních centrech se pohybuje mezi 14 a 23 měsíci [3,16,34,38]. Medián vzniku relapsu u našich pacientů byl stejný – 15 měsíců. Nejčastějším projevem recidivujícího onemocnění jsou plicní metastázy [8,38,39]. Kempf-Bielack et al [38] v multivariantní analýze 576 pacientů s relapsy prokázala, že počet plicních metastáz je statisticky signifikantní pro přežití pacientů, zatímco Harting et al [8], kteří hodnotili 137 pacientů s plicními metastázami, žádnou souvislost mezi EFS a počtem resekovaných plicních metastáz neprokázali. Obtížné je stanovení počtu malých metastáz (rozměry pod 5mm nelze na CT detekovat) [9]. Kvůli tomu se předpokládá, že řada pacientů s prokázaným unilaterálním postižením plic má již v době operace nedekovatelné postižení bilaterální [9,40]. Není jasné, zda tito pacienti mají podstoupit unilaterální torakotomii nebo bilaterální exploraci [9]. Su et al [40] na základě analýzy 84 pacientů se synchronními i metachronními plicními metastázami doporučují, že pokud se jedná o unilaterální plicní postižení na CT v rozmezí dvou let od diagnózy, je nutná bilaterální torakotomie. U našich pacientů jsme revidovali obě plíce, jen pokud zde bylo ze zobrazovacích metod podezření na metastatický proces. Řada retrospektivních studií prokázala potenciální kurativní efekt opakovaných resekcí plicních metastáz [8,37]. Ve shodě s těmito zkušenostmi jsme pacientku, která žije v 3. CR indikovali ke třem torakotomiím. Lokální relaps se vyskytuje u 4–10% pacientů [13,16]. Tito pacienti mají velké riziko vzniku metastatického postižení a úmrtí na progresi onemocnění [41]. U většiny studií prognózu lokálního relapsu ovlivňují u primární operace chirurgické okraje a histologická odpověď [6,8,13]. Nathan et al [35] vliv histologické odpovědi na přežití pacientů s lokálním relapsem neprokázali. V našem souboru měli tři pacienti (7%) izolovaný lokální relaps. Dva z nich měli nepříznivou histologickou odpověď a mikroskopicky neradikální výkon. Žije pouze jeden pacient, který měl mikroskopicky radikální odstranění primárního nádoru a příznivou histotologickou odpověď.
Dosud neexistuje jednotná standardní léčba druhé volby pro relapsy [2,4,19]. Pro přežití pacientů je nezbytné dosažení druhé chirurgické remise [38]. Efekt chemoterapie je diskutabilní [38], v některých pracích nebyl přínos chemoterapie potvrzen vůbec [34,41]. Hawkins et al [37] v terapii recidivujících osteosarkomů nejvíce používali ifosfamid a etoposid (IE) nebo v kombinaci s karboplatinou (Ifosfamid + Carboplatin + Etopozid – ICE). U našich pacientů jsme nejčastěji volili stejná cytostatika. Celkové pětileté přežití pacientů s relapsy klesá pod 30% [36–38,42]. V našem souboru jsme dosáhli pětileté OS 27,8%. Většina pacientů má relaps onemocnění během prvních dvou let od diagnózy [36]. Během pěti let od biopsie vznikne 94% relapsů, 5% do 10 let a jen 0,7% později [39]. Medián sledování našich pacientů je 5,5 let a předpokládáme, že počet pacientů s pozdními relapsy nebude vysoký.
Vzhledem ke krátké době sledování pacientů se nemůžeme vyjádřit k riziku vzniku sekundárních nádorů. Bacci et al [12] sledovali 1 205 pacientů po léčbě osteosarkomu. Medián vzniku sekundární malignity solidní nádor vs hematologická malignita byl 9,4 vs 2,6 let. V našem souboru zemřel jeden pacient na sekundární akutní myeloidní leukemii čtyři měsíce po ukončené léčbě osteosarkomu. Meyers et al [1] měli ve svém souboru 1,6% sekundárních malignit s mediánem sledování 4,8 let.
Jak jsme již uvedli v úvodu sdělení, jsou v léčbě osteosarkomu účinná tři cytostatika: doxorubicin, cisplatina, metotrexát [2,4]. Přínos čtvrtého cytostatika, ifosfamidu, který je užíván od roku 1980, je stále zvažován [1–3,6,14]. U řady vysoce rizikových solidních nádorů bylo dosaženo pokroku v léčbě eskalací dávek cytostatik [16,43]. Ve studii EOI (European Osteosarcoma Intergroup) intenzifikovali podání cisplatiny a doxorubicinu v předoperační chemoterapii osteosarkomu, které sice statisticky významně zvýšilo procento příznivých histologických odpovědí, ale nemělo vliv na celkové přežití pacientů [17]. Studie COSS sledovaly zvýšení dávkové intenzity Dose Intensity (DI) do dvoustého dne léčby. Také neprokázaly žádnou korelaci mezi DI 200 metotrexátu, cisplatiny a ifosfamidu a léčebnými výsledky [14]. Na základě těchto výsledků můžeme zatím říci, že zvýšení dávkové intenzity prognózu pacientů s osteosarkomem nezlepší.
Výsledky nejen naší, ale i jiných zahraničních prací jsou pro nízkou incidenci onemocnění limitovány počtem hodnocených pacientů. Je to jeden z důvodů, proč jsou závěry těchto studií nejednotné. Od roku 2005 pracuje skupina EURAMOS (European and American Osteosarcoma Group), která vznikla spojením COG (centra v USA), COSS (Německo, Švýcarsko, Maďarsko, Rakousko), SSG (Dánsko, Finsko, Norsko, Švédsko, Island) a EOI (Velká Británie, Francie, Itálie, Belgie, Nizozemsko, Španělsko, Portugalsko, Řecko, Slovinsko). Jejím cílem je na velkém počtu sledovaných pacientů nalézt pro pacienty s osteosarkomem optimální léčebnou strategii. EURAMOS vytvořila jednotnou multicentrickou randomizovanou studii, která má mimo jiné zjistit, zda imunoterapie spolu s CDDP, Doxo a MTX může zlepšit prognózu pacientů s příznivou histologickou odpovědí a zda přidání ifosfamidu a etoposidu zlepší prognózu pacientů s nepříznivou histologickou odpovědí. Od roku 2006 jsou pacienti na klinice dětské hematologie a onkologie léčeni stejným protokolem.
Závěr
Léčebným protokolem CCG 7921 POG 9351 INT 0133 jsme dosáhli celkový pětiletý OS 58,4% a pětiletý EFS 46,7%. Pacienti s příznivou histologickou odpovědí měli pětiletý EFS 63,6%, pacienti s nepříznivou odpovědí měli pětiletý EFS 30,5%. Pacienti s postižením končetin měli pětiletý EFS 51%. Pro hodnocení metastatického postižení a axiálních lokalizací jsme neměli dostatečný počet pacientů. Osud této malé skupiny byl špatný. Pacienti s lokalizovaným onemocněním léčení stejným protokolem v rámci COG mají předpokládaný pětiletý EFS 64%. Naše výsledky se pohybují na dolní hranici publikovaných výsledků zahraničních center, ale jak jsme se již zmínili, hodnocení bylo limitováno menším počtem sledovaných pacientů. Zařazení nově přijatých pacientů s osteosarkomem do léčebného protokolu EURAMOS může přinést další zlepšení léčebných výsledků, je však nutná delší doba sledování.
Práce byla podpořena VZ MZO 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Jarmila Kruseová
Klinika dětské hematologie a onkologie 2. LF UK a FN Motol
V Úvalu 84
156 00 Praha 5 – Motol
e-mail: jarmila.kruseova@fnmotol.cz
Sources
1. Meyers PA, Schwartz CL, Krailo M et al. Osteosarcoma: A Randomized, prospective trial of the addition of ifosfamide and/or murami tripeptide to cisplatin, doxorubicin, and high dose methotrexate. J Clin Oncol 2005; 23 : 2004–2011.
2. Carrle D, Bielack SS. Current strategies of chemotherapy in osteosarcoma. Int Orthop 2006; 30(6): 445–451.
3. Bielack SS, Bielack KB, Delling G et al. Prognostic factors in high grade osteosarcoma of the extremities or trunk: An analysis of 1702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. J Clin Oncol 2002; 20 : 776–790.
4. Longhi A, Errani C, De Paolis M et al. Primary bone osteosarcoma in the pediatric age: state of the art. Cancer Treat Rev 2006; 32(6): 423–436.
5. Picci P. Osteosarcoma (osteogenic sarcoma). Orphanet J Rare Diseases 2007; 2 : 6.
6. Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma. Curr Opin Oncol 2007; 19(4): 341–346.
7. Harting MT, Blakely ML, Jaffel N et al. Long term survival after aggressive resection of pulmonary metastases among children and adolescents with osteosarcoma. J Pediatr Surg 2006; 41(1): 194–199.
8. Harting MT, Blakely ML. Management of osteosarcoma pulmonary metastases. Semin Pediatr Surg 2006; 15(1): 25–29.
9. Bacci G, Longhi A, Versari M et al. Prognostic factors for osteosarcoma of the extremity treated with neoadjuvant chemotherapy: 15 year experience in 789 patients treated at a single institution. Cancer 2006; 106(5): 1154–1161.
10. Jaffe N, Paerson P, Yasko AW et al. Single and multiple metachronous osteosarcoma tumors after therapy. Cancer 2003; 98(11): 2457–2466.
11. Longi A, Ferrari S, Bacci G et al. Long term follow up of patiens with doxorubicin induced cardiac toxicity after chemotherapy for osteosarcoma. Anticancer Drugs 2007; 18(6): 737–744.
12. Bacci G, Ferrari C, Longhi A et al. Second malignit neoplasm in patiens with osteosarcoma of the extremities treated with adjutant and neoadjuvant chemotherapy. J Pediatr Hematol Oncol 2006; 28(12): 774–780.
13. Bacci G, Longhi A, Versari M et al. Prognostic factors for osteosarcoma of the extremity treated with neoadjuvant chemotherapy: 15 year experience in 789 patients treated at a single institution. Cancer 2006; 106(5): 1154–1161.
14. Eselgrim M, Grunert H, Kuhne T et al. Dose intensity of chemotherapy for osteosarcoma and outcome in the Cooperative Osteosarcoma Study Group (COSS) trials. Pediatr Blood Cancer 2006; 47(1): 42–50.
15. Bacci G, Loro L, Longhi A et al. No correlation between methotrexate serum level and histologic response in the pre operative treatment of extremity osteosarcoma. Anti Cancer Drugs 2006; 17 : 411–415.
16. Rodriguez GC, Shah N, McCarville MB et al. Outcome after local recurrence of osteosarcoma: the St. Jude Children’s Research Hospital experience (1970–2000). Cancer 2004; 100(9): 1928–1935.
17. Lewis IJ, Nooij MA, Whelan J et al. Improvement in histologic response but not survival in osteosarcoma patiens treated with intensified chemotherapy: a randomized phase III trial of the European Osteosarcoma Intergroup. J Natl Cancer Inst 2007; 99(2): 112–128.
18. Goorin AM, Swartzentruber DJ, Devidas M et al. Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for nonmetastatic osteosarcoma: Pediatric oncology group study POG - 865l. J Clin Oncol 2003; 8 : 1574–1580.
19. Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma. Curr Opin Oncol 2007; 19(4): 341–346.
20. Salzer-Kuntschik M, Brand G, Delling G. Bestimmung des morphologischen Regressionsgrades nach Chemotherapie bei malignen konchentumoren. Pathologie 1983; 4 : 135–141.
21. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
22. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163–170.
23. Harford CM, Wodowski KS, Rao BN et al. Osteosarcoma among children aged 5 years or younger. The St. Jude Children’s Research Hospital experience. J Pediatr Hematol Oncol 2006; 28(1): 43–47.
24. Bacci G, Longhi A, Beroni F et al. Primary high grade osteosarcoma: comparison between preadolescent and older patiens. J Pediatr Hematol Oncol 2005; 27(3): 129–134.
25. Smeland S, Muller C, Alvegard TA et al. Scandinavian Sarcoma Group Osteosarcoma Study SSG VIII: prognostic factors for outcome and the role of replacement salvage chemotherapy for poor histological responders. Eur J Cancer 2003; 39 : 488–494.
26. Bacci G, Forni C, Longhi A et al. Local recurrence and local control of non metastatic osteosarcoma of the extremities: a 27year experience in a single institution. J Surg Oncol 2007; 96(2): 118–123.
27. Grimer RJ. Surgical options for children with osteosarcoma. Lancet Oncol 2005; 6(2): 85–92.
28. Swartz CL, Gorlick R, Teot L et al. Multiple drug resistence in osteogenic sarcoma: INT0133 from the Children’s oncology group. J Clin Oncol 2007; 25 : 2057–2062.
29. Bacci G, Bertoni F, Longhi A et al. Neoadjuvant chemotherapy for high grade central osteosarcoma of the extremity. Cancer 2003; 97 : 3068–3075.
30. Mialou V, Philip T, Kalifa Ch et al. Metastatic Osteosarcoma at Diagnosis-Prognostic factors and long term outcome-The French Pediatric Experience. Cancer 2005; 104 : 1100–1109.
31. Kager L, Zoubek A, Potschger U et al. Primary metastatic osteosarcoma: presentation and outcome of patients treated on neoadjuvant cooperative osteosarcoma study group protocols. J Clin Oncol 2003; 21 : 2011–2018.
32. Tiernan A, Mezer T, Michelagnoli M et al. A phase I/II study of doxorubicin, ifosfamide, etoposide and interval methotrexate in patients with poor prognosis osteosarcoma. Cancer 2006; 46 : 345–350.
33. Sajadi KR, Heck RK, Neel MD et al. The incidence and prognosis of osteosarcoma skip metastases. Clin Orthop Relat Res 2004; 426 : 92–96.
34. Crompton BD, Goldsby RE, Weinberg VK et al. Survival after recurrence of osteosarcoma: a 20 year experience at a single institution. Pediatric Blood Cancer 2006; 47(3): 255–259.
35. Nathan SS, Gorlick R, Bukata S et al. Treatment algorithm for locally recurrent osteosarcoma based on local disease free interval and the presence of lung metastasis. Cancer 2006; 107 : 1607–1616.
36. Chou AJ, Merola PR, Wexler LH et al. Treatment of osteosarcoma at first recurrence after contemporary therapy: the memorial Sloan-Kettering Cancer Center experience. Cancer 2005; 104(10): 2214–2221.
37. Hawkins DS, Arndt CA. Pattern of disease recurrence and prognostic factors in patiens with osteosarcoma treated with contemporary chemotherapy. Cancer 2003; 98(11): 2447–2456.
38. Bielack BK, Bielack SS, Jurgens H et al. Osteosarcoma relace after combined modality therapy: An analysis of unselected patiens in the kooperative osteosarcoma study group (COSS). J Clin Oncol 2005; 23 : 559–568.
39. Ferrari S, Briccoli A, Mercuri M et al. Postrelapse survival in osteosarcoma of the Extremities: Prognostic factors for long term survival. J Clin Oncol 2003; 21 : 710–715.
40. Su WT, Chewning J, Abramson S et al. Surgical management and outcome of osteosarcoma patiens with unilateral pulmonary metastases. J Pediatr Surg 2004; 39(3): 418–423.
41. Bacci G, Longhi A, Cesari M et al. Influence of local recurrence on survival in patiens with extremity osteosarcoma treated with neoadjuvant chemotherapy: the experience of a single institution with 44 patients. Cancer 2006; 106(12): 2701–2716.
42. Berrak GS, Pearson M, Berberoglu S et al. High dose ifosfamide in relapsed pediaic osteosarcoma: therapeutic effects and renal toxicity. Pediatric Blood Cancer 2005; 44 : 215–219.
43. Kruseová J, Sumerauer D, Stejskalová E et al. Diagnostické a léčebné postupy u nádorů ze skupiny Ewingův sarkom/periferní neuroepitheliální tumor (ES/PNET) u dětí a mladistvých. Klin Onkol 2006; 19(6): 293–299.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue 4-
All articles in this issue
- Primary Pulmonary Sarcomas
- IKARUS Project – Incidence of Bone Events in Breast Cancer: Retrospective Analysis of Patients in Oncological Centres in the Czech Republic and Slovakia
- Experience in Data Management of the Clinical Retrospective Project in Czech and Slovak Oncology Centres (IKARUS Project)
- Radical Surgery and Intensive Chemotherapy Are Necessaryfor Successful Treatment of Osteosarcoma
- Treatment with Sunitinib and Hypothyroidism – a Case Report and Overview of Literature
- Iris Metastasis as the First Sign of Small Cell Lung Carcinoma with Metastatic Involvement of the Mediastinum
- Palliative and Hospic Care in the Czech Republic and in Europe
- Targeted Therapies in the Treatment of Advanced Non Small Cell Lung Cancer: Update
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primary Pulmonary Sarcomas
- Palliative and Hospic Care in the Czech Republic and in Europe
- Radical Surgery and Intensive Chemotherapy Are Necessaryfor Successful Treatment of Osteosarcoma
- Treatment with Sunitinib and Hypothyroidism – a Case Report and Overview of Literature
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

