-
Medical journals
- Career
Pleurální výpotky – cytologicko-energetická analýza versus tradiční Lightova kritéria
Authors: I. Matuchová 1,2,3; P. Kelbich 1,2,3; J. Kubalík 2,4; I. Staněk 4; J. Špička 5; V. Malý 4; O. Karpjuk 4; E. Hanuljaková 1,3; J. Krejsek 2
Authors‘ workplace: Biomedicínské centrum, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 1; Ústav klinické imunologie a alergologie, LF UK v Hradci Králové a FN v Hradci Králové 2; Laboratoř pro likvorologii, neuroimunologii, patologii a speciální diagnostiku Topelex, s. r. o. 3; Oddělení hrudní chirurgie, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 4; Oddělení klinické biochemie, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 5
Published in: Klin. Biochem. Metab., 29, 2021, No. 4, p. 190-198
Overview
Cíl studie: Porovnání diagnostické efektivity vyšetření pleurálních výpotků dle Lightových pravidel s jejich cytologicko-energetickou analýzou.
Typ studie: Retrospektivní.
Název a sídlo pracoviště: Biomedicínské centrum, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z.; Ústav klinické imunologie a alergologie, LF UK v Hradci Králové a FN v Hradci Králové; Laboratoř pro likvorologii, neuroimunologii, patologii a speciální diagnostiku Topelex, s. r. o.; Oddělení hrudní chirurgie, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z.; Oddělení klinické biochemie, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z.
Materiál a metody: Náš soubor pro tuto studii zahrnuje 96 případů nezánětlivých pleurálních výpotků od pacientů s kardiálním postižením či systémovou sepsí, 211 případů pleurálních výpotků od pacientů s purulentní pneumonií a 283 případů pleurálních výpotků od pacientů s hrudním empyémem. Ve všech případech jsme provedli vyšetření vybraných parametrů dle Lightových pravidel (počet jaderných elementů na 1 μl, koncentrace celkové bílkoviny, glukózy a laktátu a katalytická aktivita laktátdehydrogenázy (LDH)) a kompletní cytologicko-energetickou analýzu (četnost neutrofilních granulocytů, výpočet koeficientu energetické bilance (KEB) a katalytická aktivita aspartátaminotrasferázy (AST)). Pro statistické zhodnocení souboru jsme použili Kruskal-Wallisův test s vícenásobným porovnáním p-hodnot a ROC analýzu.
Výsledky: Na úrovni všech zmíněných parametrů dle Lightových kritérií i cytologicko-energetické analýzy nacházíme při porovnání nezánětlivých a zánětlivých výpotků statisticky významné rozdíly (p < 0,01). Při porovnání výpotků pacientů s purulentními pneumoniemi a hrudními empyémy nacházíme statisticky významné diference (p < 0,01) v případě „Lightových“ počtů jaderných elementů, koncentrací celkové bílkoviny a laktátu a katalytických aktivit LDH a „cytologicko-energetických“ hodnot KEB a katalytických aktivit AST.
Pro rozlišení nezánětlivých a parapneumonických výpotků dosáhly vysokou diagnostickou efektivitu „Lightovy“ koncentrace glukózy (AUC = 0,981), laktátu (AUC = 0,970) a katalytické aktivity LDH (AUC = 0,962) a „cytologicko - energetické“ četnosti neutrofilních granulocytů (AUC = 0,982), hodnoty KEB (AUC = 0,999) a katalytické aktivity AST (AUC = 0,954).Pro rozlišení nezánětlivých výpotků a výpotků pacientů s hrudními empyémy dosáhly vysokou diagnostickou efektivitu „Lightovy“ počty jaderných elementů (AUC = 0,939), koncentrace glukózy (AUC = 0,967), laktátu (AUC = 0,987) a katalytické aktivity LDH (AUC = 0,984) a „cytologicko-energetické“ četnosti neutrofilních granulocytů (AUC = 0,985), hodnoty KEB (AUC = 0,991) a katalytické aktivity AST (AUC = 0,979).
Podstatně nižších diagnostických efektivit všech sledovaných parametrů bylo dosaženo při diferenciaci parapneumonických výpotků a výpotků pacientů s hrudními empyémy: „Lightovy“ počty jaderných elementů (AUC = 0,714), koncentrace glukózy (AUC = 0,631), laktátu (AUC = 0,721), celkové bílkoviny (AUC = 0,537) a katalytických aktivit LDH (AUC = 0,710) a „cytologicko-energetické“ četnosti neutrofilních granulocytů (AUC = 0,553), hodnot KEB (AUC = 0,671) a katalytických aktivit AST (AUC = 0,718).
Závěr: Předností cytologicko-energetické analýzy oproti analýze pleurálních výpotků dle Lightových kritérií je charakteristika lokální imunitní odpovědi s ohledem na její energetické nároky. Obě metodiky se vhodně doplňují. V žádném případě si ale neodporují.
Klíčová slova:
pleurální výpotek – pneumonie – empyém – Lightova kritéria – cytologicko-energetická analýza – koeficient energetické bilance
Úvod
Za fyziologického stavu existuje rovnováha mezi sekrecí pleurální tekutiny a její resorpcí v subpleurálním lymfatickém systému. V případě narušení této rovnováhy dochází k produkci pleurálního výpotku. Ta je vždy projevem patologických změn [1-3]. Tradičně se pro určení charakteru postižení provádí vyšetření pleurálního výpotku dle tzv. Lightových kritérií [3, 4]. Princip této metodiky spočívá v analýze vybraných laboratorních parametrů ve výpotku, příp. též v krvi a v diferenciaci na výpotek nezánětlivý, tzv. transudát, či zánětlivý exudát [5-7]. Transudát je definován jako nezánětlivá tekutina hromadící se v pleurální dutině pouze v důsledku změn tlakových poměrů na úrovni kapilár. Tyto změny mohou být indukovány v důsledku kardiálního postižení, renálního selhání či jiného systémového onemocnění [1,8,9]. Exudát je tekutina produkovaná při zánětu v důsledku zvýšené permeability cévní stěny [1, 3, 4, 7, 9-12].
Limitujícím faktorem při interpretaci výsledků analýzy pleurálních výpotků dle Lightových pravidel je skutečnost, že tento způsob neposkytuje informaci o mechanismech, které vedly k výsledným hodnotám příslušných parametrů. Řešení spatřujeme v aplikaci cytologicko-energetického principu, sledujícího společné imunitní a biochemické procesy v oblasti produkce příslušné extravaskulární tělní tekutiny. Na jeho základě lze zánětlivou odpověď nejen detekovat, ale také určit její charakter, který je pro odhalení příčiny postižení podstatný [13-18].
Prvním krokem je cytologické vyšetření pleurálního výpotku s důrazem na přítomnost imunokompetentních buněk. Právě ty jsou nositeli imunitní reakce. Dalším krokem je vyšetření vhodných funkčních parametrů. Těmi jsou, obecně pro většinu extravaskulárních tělních tekutin, parametry energetického metabolismu glukózy [13, 15, 19-21]. Klíčovým parametrem je koeficient energetické bilance (KEB), definovaný jako teoretický průměrný počet molekul adenosintrifosfátu (ATP) vyprodukovaných za aktuálních energetických poměrů v oblasti rezervoáru příslušné extravaskulární tělní tekutiny z jedné molekuly glukózy. Podstata hodnocení pak spočívá ve společném nárůstu intenzity lokální imunitní odpovědi a jejích energetických nároků [15, 18, 22, 23].
[glukóza] = látková koncentrace glukózy v pleurálním výpotku
[laktát] = látková koncentrace laktátu v pleurálním výpotku
Dva energetické modely pleurální dutiny
Při bazální imunitní reakci v oblasti rezervoáru pleurálního výpotku registrujeme majoritně aerobní metabolismus s hojnou produkcí energie v podobě vysokého počtu ATP vyjádřenou vysokými hodnotami KEB (obr. 1) [14, 15, 18].
Fig. 1: The 1st model of energy relationships in the pleural cavity – Basic immunity response. O2 = oxygen, ATP = adenosine triphosphate, KEB = the coefficient of energy balance 
Obvyklou příčinou, podstatou či následkem patologického procesu v pleurální dutině je imunitní, resp. zánětlivá, odpověď (obr. 2). S nárůstem její intenzity se zvyšují lokální energetické nároky aktivovaných imunokompetentních buněk. Dochází tak ke zvýšené spotřebě glukózy a kyslíku, tím pádem k rozvoji anaerobního metabolismu a snížení produkce ATP, což pozorujeme na snižující se hodnotě KEB.
Fig. 2: The 2nd model of energy relationships in the pleural cavity – Local inflammatory response. O2 = oxygen, ATP = adenosine triphosphate, KEB = the coefficient of energy balance 
Ze závěrů dřívějších studií vyplývají následné charakteristiky cytologicko-energetické analýzy pleurálních výpotků [15, 18, 22].
Hodnoty KEB ≥ 28,0: Jedná se o normální energetické poměry v oblasti rezervoáru pleurálního výpotku a obvykle představují reaktivní až mírné serózní zánětlivé změny v pleurální dutině.
Hodnoty KEB = 20,0 až 28,0: Jedná se o mírně zvýšený rozsah anaerobního metabolismu v oblasti rezervoáru pleurálního výpotku obvykle odpovídající zvýšeným energetickým nárokům aktivovaného imunitního systému při serózních zánětlivých změnách v pleurální dutině.
Hodnoty KEB = 10,0 až 20,0: Jedná se o středně zvýšený rozsah anaerobního metabolismu v oblasti rezervoáru pleurálního výpotku obvykle odpovídající výrazněji zvýšeným energetickým nárokům aktivovaného imunitního systému při intenzivním serózním zánětlivém procesu či přítomnosti razantních zánětlivých změn s oxidačním vzplanutím profesionálních fagocytů v pleurální dutině.
Hodnoty KEB < 10,0: Jedná se o vysoký rozsah anaerobního metabolismu v oblasti rezervoáru pleurálního výpotku zpravidla odpovídající přítomnosti razantního zánětu s oxidačním vzplanutím profesionálních fagocytů v pleurální dutině. Při významné přítomnosti neutrofilních granulocytů jde zpravidla o purulentní zánět s obvyklou účastí extracelulárních bakterií v patogenezi. Dominující přítomnost mononukleárních imunokompetentních buněk, tzn. lymfocytů či monocytárně-makrofagických elementů, pak vede k úvaze o razantním zánětu s oxidačním vzplanutím makrofágů s obvyklou účastí intracelulárních agens či nádorové proliferace v patogenezi.
Ukazateli lokálního strukturálního poškození tkáně standardně doplňující cytologicko-energetickou analýzu extravaskulárních tělních tekutin jsou dále koncentrace katalytických aktivit aspartátaminotransferázy (AST) a laktátdehydrogenázy (LDH) [14, 15, 18, 22-24].
Cílem této studie je porovnání diagnostické efektivity vyšetření pleurálních výpotků dle Lightových pravidel s jejich cytologicko-energetickou analýzou.
Materiál a metody
Vyšetřili jsme 590 vzorků pleurálních výpotků. V 96 případech se jednalo o nezánětlivé výpotky vzniklé v důsledku kardiálního postižení nebo systémové sepse, v 211 případech se jednalo o parapneumonické výpotky pacientů s bakteriální pneumonií a v 283 případech se jednalo o purulentní zánětlivé výpotky pacientů s hrudními empyémy (Tabulka 1). Pleurální výpotky byly odebrány hrudní drenáží do čisté zkumavky bez aditiv a neprodleně transportovány k laboratornímu vyšetření. To bylo provedeno dle tradičních Lightových pravidel (počet jaderných elementů, koncentrace celkové bílkoviny, glukózy a laktátu a katalytické aktivity LDH) a dle cytologicko-energetického principu (cytologický obraz s důrazem na četnost neutrofilních granulocytů, hodnoty KEB a katalytická aktivita AST).
Table 1. Demographic data of patients with non-inflammatory effusions, parapneumonic effusions and patients with chest empyemas 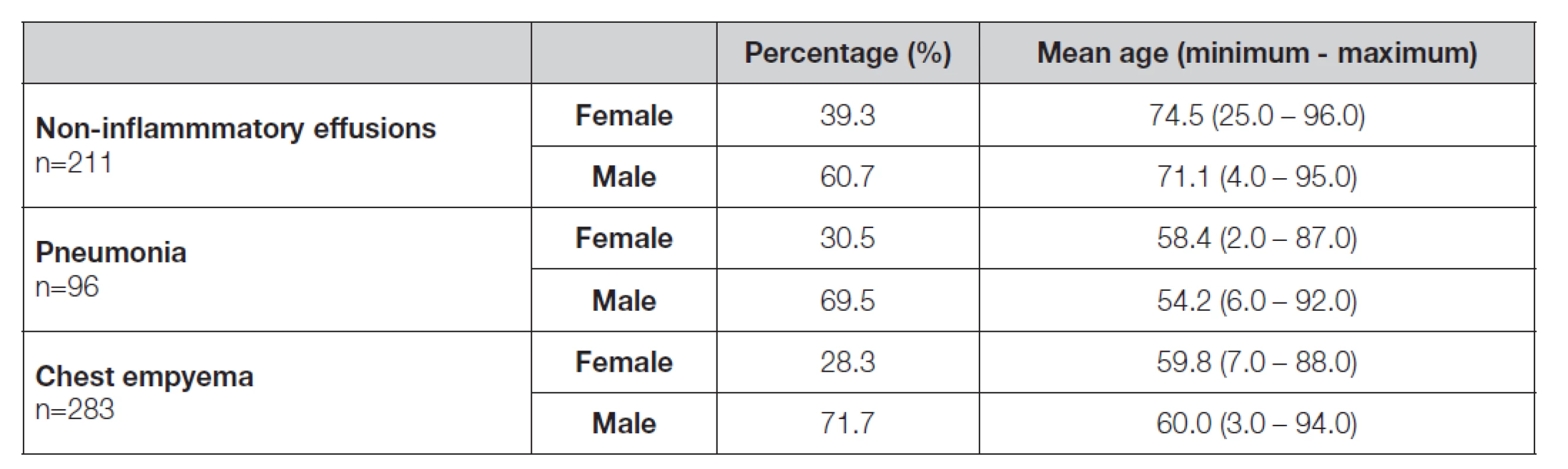
n = number of patients V každém vzorku výpotku byl stanoven počet jaderných elementů a erytrocytů na 1 μL ve Fuchsově-Rosenthalově komůrce. Za použití cytocentrifugy StatSpin Cytofuge 2 byl zhotoven trvalý cytologický preparát obarvený cytologickým barvením Hemacolor® (Merck, Německo) a zamontovaný do Entellanu® (Merck, Německo). Odborně způsobilý pracovník provedl mikroskopický odečet (světelný mikroskop BX40, Olympus, Japonsko) trvalého cytologického preparátu. Koncentrace celkové bílkoviny, glukózy, laktátu a katalytické aktivity LDH a AST v pleurálních výpotcích byly stanoveny na analytickém systému Cobas 600® c501 (Roche diagnostics, Švýcarsko). Koncentrace celkové bílkoviny byly stanoveny biuretovou metodou, koncentrace glukózy hexokinázovou metodou, koncentrace laktátu laktátoxidázovou a peroxidázovou metodou a koncentrace katalytických aktivit AST a LDH metodou dle IFCC.
Soubor vyšetřených pleurálních výpotků byl rozdělen na nezánětlivé výpotky od pacientů se srdečním postižením a systémovou sepsí, na parapneumonické výpotky pacientů s purulentními pneumoniemi a na purulentní zánětlivé výpotky pacientů s hrudními empyémy. Pomocí statistického programu Statistica 14.0 (StatSoft Inc., USA) jsme Kruskal-Wallisovým testem s vícenásobným porovnáním p-hodnot na 1% hladině významnosti testovali významnost rozdílů počtů jaderných elementů, četností neutrofilních granulocytů, koncentrací celkové bílkoviny, glukózy, laktátu, hodnot KEB a katalytických aktivit AST a LDH ve výše zmíněných skupinách pleurálních výpotků (Tabulka 2).
Table 2. Analysis of pleural effusions – comparison of Light’s criteria and cytological-energy methods 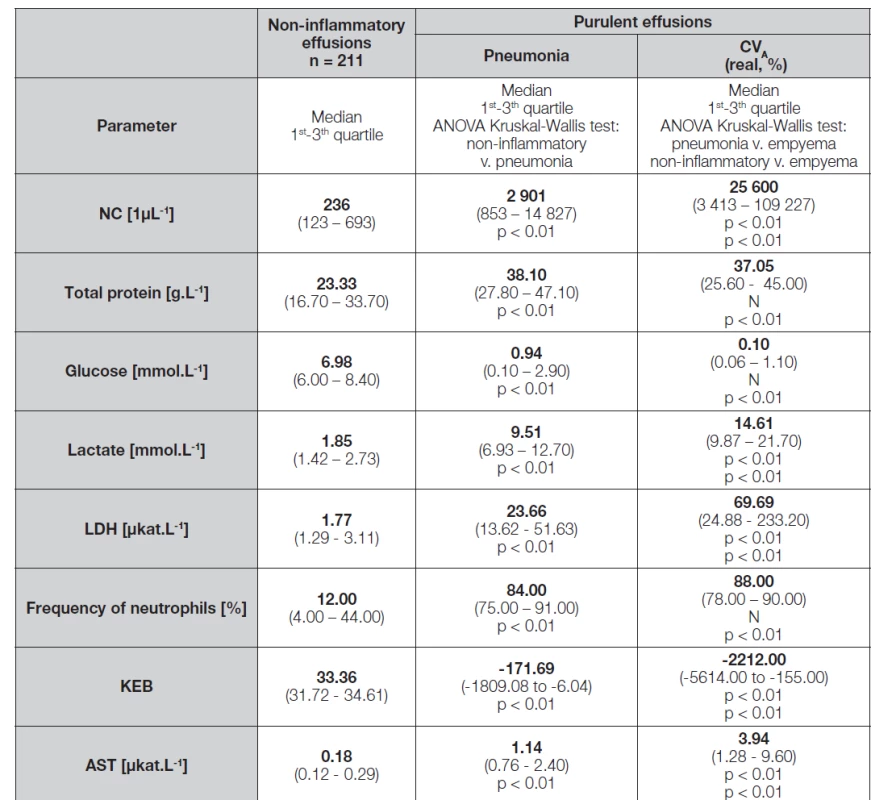
Legend: NC – number of nucleated cells in pleural effusion; TP – mass concentration of total protein in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion; N – statistically insignificant Pomocí statistického softwaru MedCalc (MedCalc Software Ltd., Belgie) jsme pro vzájemné odlišení nezánětlivých výpotků, parapneumonických výpotků a výpotků od pacientů s hrudními empyémy provedli ROC analýzu. Na 1% hladině významnosti jsme metodou dle De Long et al. (1988) porovnali ROC křivky [25].
Výsledky
Na úrovni všech parametrů vyšetřených v pleurálních výpotcích dle Lightových kritérií i cytologicko-energetické analýzy jsou patrné statisticky významné rozdíly mezi skupinou pacientů s nezánětlivými výpotky a oběma skupinami pacientů s purulentními záněty v dutině hrudní (Tabulka 2).
Statisticky významné rozdíly mezi pleurálními výpotky pacientů s purulentními pneumoniemi a hrudními empyémy jsou patrné na úrovni počtu jaderných elementů, koncentrací laktátu, hodnotách KEB a katalytických aktivitách LDH a AST. Naproti tomu na úrovni koncentrací celkové bílkoviny a glukózy a četnosti neutrofilních granulocytů statisticky významné rozdíly nepozorujeme (Tabulka 2).
Pro porovnání diagnostické efektivity cytologických (počet jaderných elementů a četnost neutrofilních granulocytů), energetických (koncentrace glukózy a laktátu a hodnoty KEB) a destrukčních (katalytické aktivity LDH a AST) parametrů v pleurálních výpotcích vyšetřených dle Lightových kritérií a cytologicko-energetickou analýzou jsme použili ROC analýzu. Významně vyšší diagnostické efektivity pro odlišení nezánětlivých výpotků a parapneumonických výpotků bylo dosaženo v případě četností neutrofilních granulocytů oproti počtům jaderných elementů a hodnot KEB oproti koncentracím laktátu. Naproti tomu statisticky významné rozdíly mezi hodnotami KEB a koncentracemi glukózy a katalytickými aktivitami LDH a AST zjištěny nebyly (Tabulka 3 a 4).
Table 3. ROC analysis of non-inflammatory pleural effusions and pleural effusions of patients with purulent pneumonia analysed using the Light’s criteria and the cytological-energy methods 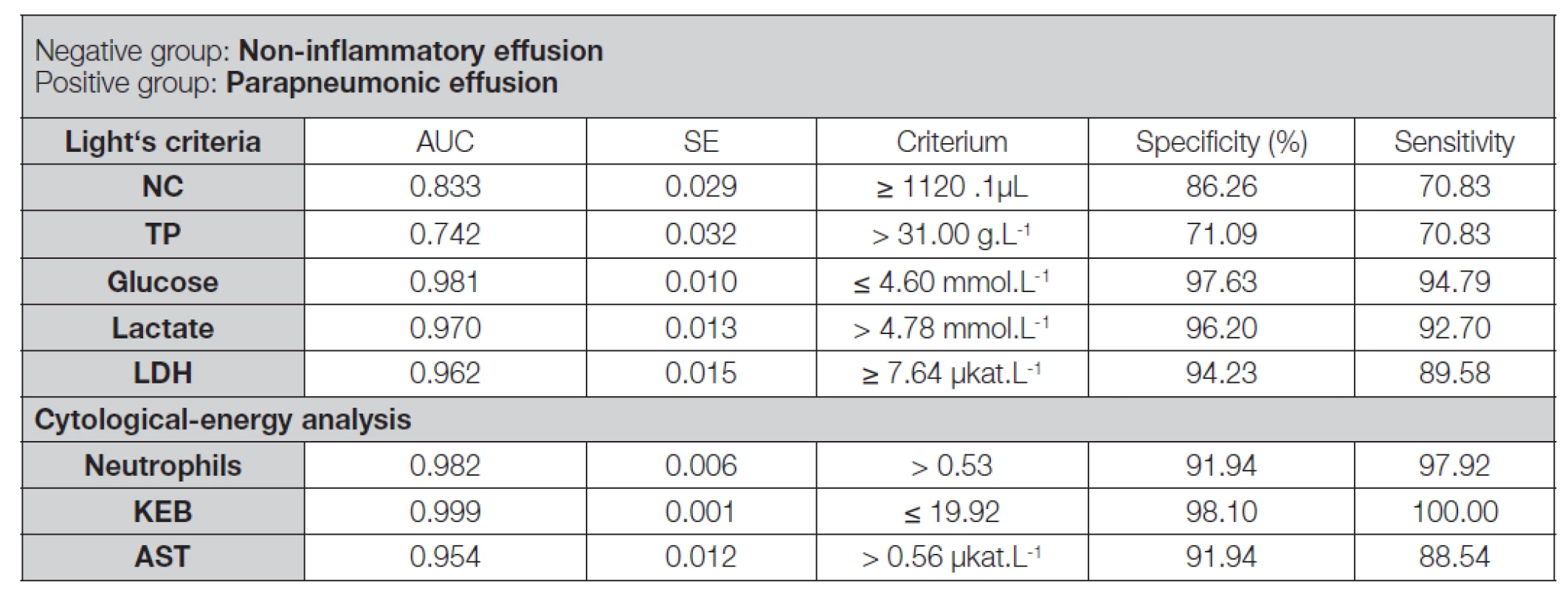
Legend: ROC – receiver operator characteristic; AUC – area under ROC curve; SE – Standard error of AUC (method of De Long et al. 1988 [25]); NC – nucleated cell count in pleural effusion; NC – number of nucleated cells in pleural effusion; TP – mass concentration of total protein in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Table 4. Comparison of “Light’s” and “cytological-energy” parameters in non-inflammatory and parapneumonic pleural effusions using ROC analysis 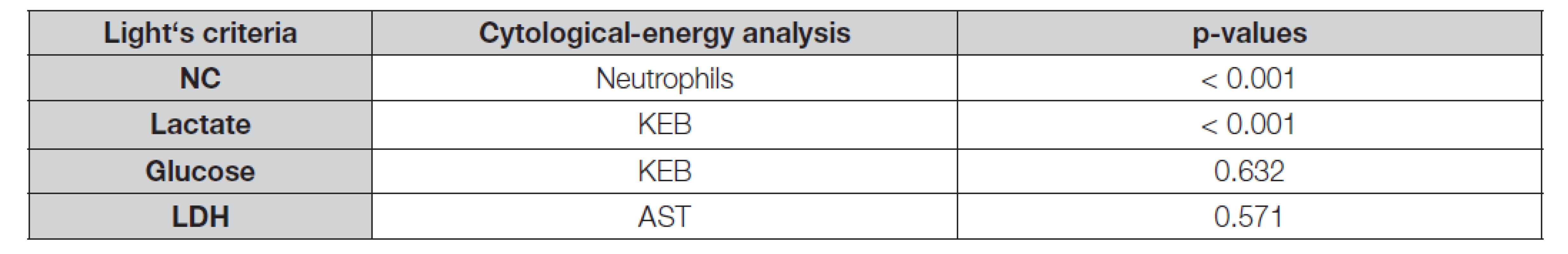
Legend: ROC – receiver operator characteristic; NC – number of nucleated cells in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Při porovnání diagnostické efektivity vybraných parametrů v nezánětlivých výpotcích a výpotcích pacientů s hrudními empyémy jsme opět dosáhli významně lepších výsledků u četností neutrofilních granulocytů oproti počtu jaderných elementů. Diagnostická efektivita hodnot KEB pak byla statisticky významně příznivější v porovnání s koncentracemi glukózy. Mezi hodnotami KEB a koncentracemi laktátu a katalytickými aktivitami LDH a AST jsme zásadní rozdíl nezjistili (Tabulka 5 a 6).
Table 5. ROC analysis of non-inflammatory pleural effusions and pleural effusions of patients with chest empyema analysed using the Light’s criteria and the cytological-energy methods 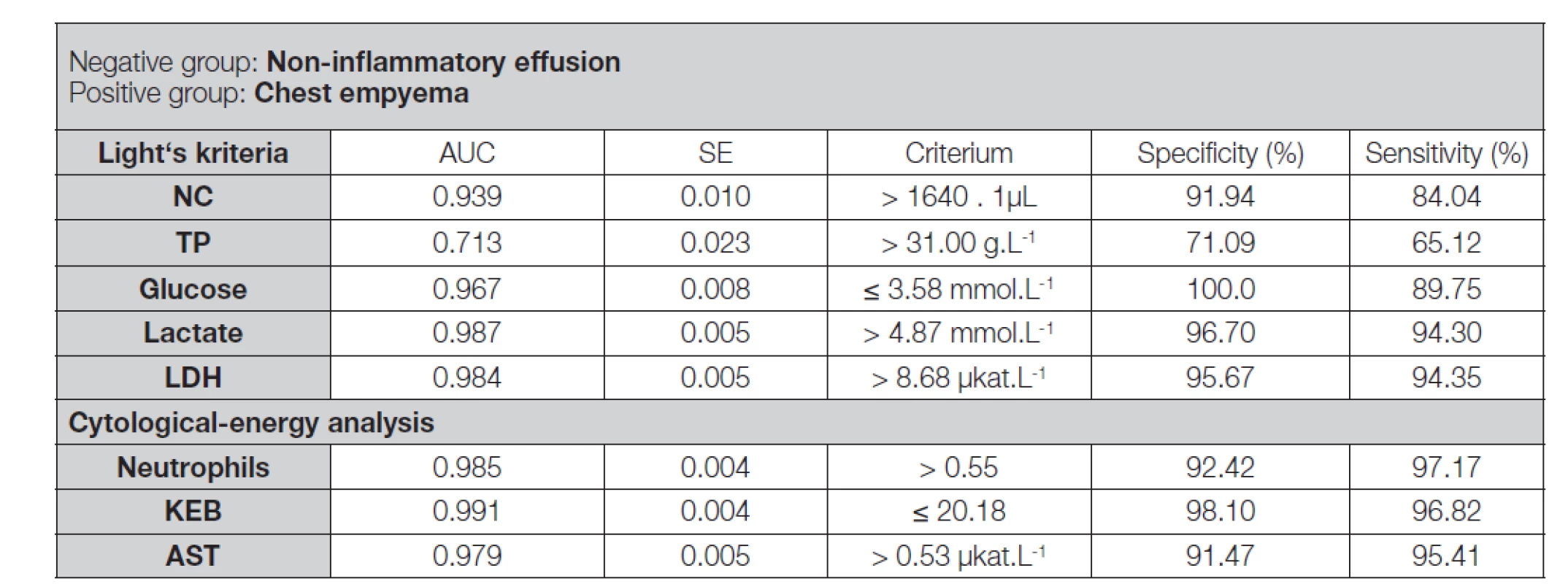
Legend: ROC – receiver operator characteristic; AUC – area under ROC curve; SE – Standard error of AUC (method of De Long et al. 1988 [25]); NC – number of nucleated cells in pleural effusion; TP – mass concentration of total protein in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Table 6. Comparison of “Light’s” and “cytological-energy” parameters in non-inflammatory pleural effusions and chest empyemas using ROC analysis 
Legend: ROC – receiver operator characteristic; NC – number of nucleated cells in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Diagnostická efektivita vybraných cytologických, energetických a destrukčních parametrů v parapneumonických výpotcích a purulentních výpotcích pacientů s hrudními empyémy zdaleka nedosahuje úrovně patrné z výše uvedených porovnání nezánětlivých výpotků s oběma skupinami purulentních zánětlivých výpotků. V tomto případě jsme zjistili statisticky významně vyšší diagnostickou efektivitu počtu jaderných elementů oproti četnostem neutrofilních granulocytů a koncentrace laktátu předčily hodnoty KEB. Významný rozdíl mezi katalytickými aktivitami LDH a AST opět nebyl prokázán (Tabulka 7 a 8).
Table 7. ROC analysis of pleural effusions of patients with parapneumonic effusions and patients with chest empyema analysed using the Light’s criteria and the cytological-energy methods 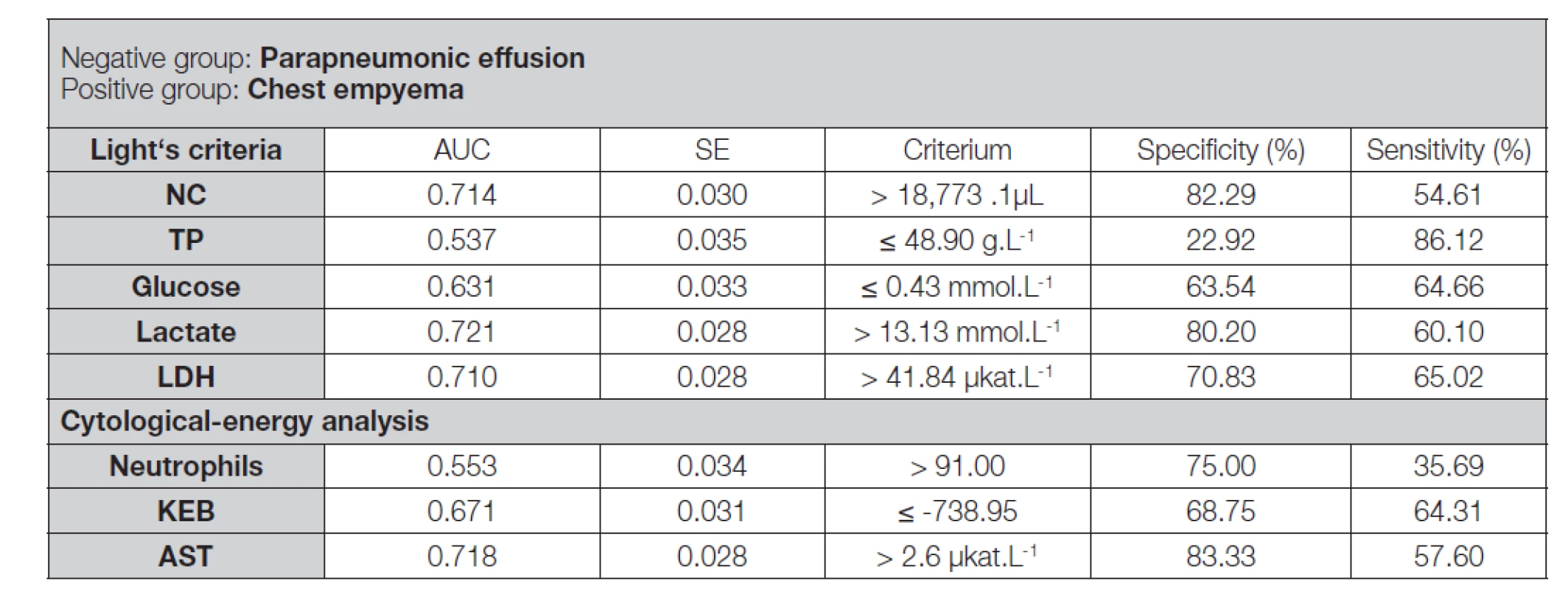
Legend: ROC – receiver operator characteristic; AUC - area under ROC curve; SE – Standard error of AUC (method of De Long et al. 1988 [25]); NC – number of nucleated cells in pleural effusion; TP – mass concentration of total protein in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Table 8. Comparison of “Light’s” and “cytological-energy” parameters in parapneumonic pleural effusions and chest empyemas using ROC analysis 
ROC – receiver operator characteristic; NC – number of nucleated cells in pleural effusion; Glucose – molar concentration of glucose in pleural effusion; Lactate – molar concentration of lactate in pleural effusion; Neutrophils – frequency of neutrophils in pleural effusion; KEB – coefficient of energy balance; LDH – catalytic activity of lactate dehydrogenase in pleural effusion; AST – catalytic activity of aspartate aminotransferase in pleural effusion Nejnižších diagnostických efektivit jsme při všech uvedených ROC analýzách dosáhli u koncentrací celkové bílkoviny (Tabulka 3, 5, 7).
Diskuse
Přibližně posledních 50 let se extravaskulární tělní tekutiny, včetně pleurálních výpotků, vyšetřují dle Lightových kritérií. Postup spočívá v analýze několika laboratorních parametrů, podle jejichž úrovně se výpotky diferencují na zánětlivé exudáty a nezánětlivé transudáty [3,4]. Tento způsob ale neposkytuje informaci o mechanismech, které vedly k příslušným úrovním vyšetřených laboratorních parametrů.
Na našich pracovištích dlouhodobě provádíme tzv. cytologicko-energetickou analýzu pleurálních výpotků. Ta na rozdíl od zmíněných Lightových pravidel vychází z imunitních a biochemických procesů a sleduje lokální metabolické změny ve vztahu k různé intenzitě a charakteru imunitní odpovědi v oblasti rezervoáru pleurálního výpotku [14, 15, 18].
V Tabulce 2 jsou na první pohled patrné výrazné kvalitativní rozdíly mezi nezánětlivými výpotky pacientů s kardiálním postižením či systémovou sepsí a parapneumonickými výpotky a purulentními výpotky pacientů s hrudními empyémy. Podstatou purulentního zánětu je přísun neutrofilních granulocytů do místa zánětu a jejich oxidační vzplanutí [10, 14, 20, 26, 27]. Proto pozorujeme vysoké počty jaderných elementů s naprostou převahou neutrofilů u obou skupin pacientů s purulentními výpotky (Tabulka 2). Oba tyto parametry disponují značnou diagnostickou efektivitou (Tabulka 3, 5 a 7). Neutrofilní granulocyty jsou nositeli purulentní zánětlivé odpovědi. To je důvod příznivějších výsledků při hodnocení jejich četnosti v porovnání s prostým počtem jaderných elementů při rozlišení nezánětlivého a purulentního výpotku (Tabulka 3 a 5). Naopak, pro pneumonii a hrudní empyém je typický stejný purulentní charakter zánětu s identickou buněčnou skladbou výpotku. Rozdíl je ve vyšší intenzitě zánětlivé odpovědi v případě empyému [10, 14, 28]. Tím si vysvětlujeme podstatně nižší diagnostickou efektivitu četnosti neutrofilních granulocytů v porovnání s počty jaderných elementů při odlišení parapneumonického výpotku a hrudního empyému (Tabulka 7 a 8).
Oxidační vzplanutí neutrofilů má za následek vysokou spotřebu kyslíku, což vede k intenzivnímu rozvoji anaerobního metabolismu v rezervoáru výpotku. Výsledkem je snaha o saturaci energetického deficitu zvýšeným metabolickým obratem, a tím pádem větší spotřeba glukózy a výrazná nadprodukce laktátu v purulentních výpotcích (Tabulka 2) [27, 29].
Interpretační potenciál koncentrací glukózy a laktátu ve výpotcích je limitován. Koncentrace glukózy ve výpotku je ovlivněna systémovou glykémií. Výsledná koncentrace laktátu ve výpotku pak podléhá dvěma faktorům – množství energetického substrátu vstupujícího do metabolických procesů, tedy systémové glykémii a rozsahu anaerobního metabolismu v rezervoáru výpotku [14, 15, 17, 22, 29]. Eliminaci těchto rušivých vlivů řeší přepočet na teoretickou produkci ATP, čili KEB. Při rozlišení nezánětlivých a purulentních výpotků dosahuje nejvyšší diagnostické efektivity ze všech hodnocených parametrů (Tabulka 3 a 4). Pro rozlišení parapneumonických výpotků a empyémů se spolu s dalšími parametry diagnostická efektivita hodnot KEB snižuje (Tabulka 7). Zároveň ale pokles hodnot KEB odpovídající zvýšení intenzity lokálního zánětu zvyšuje pravděpodobnost hrudního empyému (Tabulka 2). Hodnoty KEB navíc umožňují bez ohledu na momentální glykemické výkyvy spolehlivé spojité monitorování vlivu léčby na vývoj intenzity lokální zánětlivé odpovědi v pleurální dutině [14, 15, 18, 22, 23].
Při porovnání všech tří skupin pleurálních výpotků pozorujeme skokový nárůst katalytických aktivit LDH a AST v pořadí transudativní výpotky – parapneumonické výpotky – empyémy (Tabulka 2). Chavallitamrong et al. (1979) zmínili souvislost nárůstu katalytických aktivit LDH s nárůstem anaerobní glykolýzy v pleurálních výpotcích pacientů s hrudními empyémy [30]. Téměř identický projev LDH a AST v pleurálních výpotcích všech tří zmíněných skupin pacientů (Tabulka 2) nás ale utvrzuje v přesvědčení, že skutečnou příčinou významně zvýšených katalytických aktivit obou enzymů v pleurálních výpotcích pacientů s purulentním zánětlivým postižením orgánů dutiny hrudní je jejich uvolnění z poškozených či rozpadlých buněk. Souvislost elevace LDH s nárůstem anaerobního metabolismu v pleurálních výpotcích však nepopíráme. Není ale přímá. Společným jmenovatelem je purulentní zánět. Jeho vyšší intenzita je příčinou většího rozsahu anaerobního metabolismu a zároveň rozsáhlejšího tkáňového poškození [14, 20, 26].
Závěr
Za zásadní slabinu vyšetřování pleurálních výpotků dle Lightových pravidel považujeme skutečnost, že nepopisují mechanismy, kterými je příslušných úrovní sledovaných parametrů dosahováno. Přínosnější je v tomto ohledu cytologicko-energetická analýza popisující vzájemnou závislost intenzity a charakteru imunitní odpovědi a metabolických poměrů v oblasti rezervoáru pleurálního výpotku. Porovnáním obou metodik konstatujeme vyšší diagnostickou efektivitu „cytologicko-energetické“ četnosti neutrofilních granulocytů pro rozlišení nezánětlivých a purulentních výpotků, zároveň ale poněkud příznivější efekt „Lightových“ počtů jaderných elementů pro rozlišení parapneumonických výpotků a empyémů. Na úrovni energetických parametrů je vysoká diagnostická efektivita „Lightových“ koncentrací glukózy a laktátu dále zpřesňována aplikací „cytologicko-energetického“ KEB. V případě parametrů destrukce tkáně dosahují „Lightovy“ katalytické aktivity LDH i „cytologicko-energetické“ katalytické aktivity AST shodně vysokou diagnostickou efektivitu a vhodně se doplňují. „Lightova“ koncentrace celkové bílkoviny nemá „cytologicko-energetickou“ alternativu a provedená ROC analýza potvrdila její mizivý přínos pro diagnostiku postižení orgánů dutiny hrudní.
Souhrnně lze konstatovat, že se v některých ohledech obě metodiky prolínají, v jiných vhodně doplňují, ale v žádném případě nepopírají.
Poděkování: Děkujeme paní Květoslavě Sýkorové za přípravu databází vyšetřených vzorků pleurálních výpotků.
Zdroj podpory: Studie byla podpořena interním grantem Krajské zdravotní, a.s v Ústí nad Labem ‘IGA-KZ-2021-1-1’ a výzkumných projektem lékařské fakulty Univerzity Karlovy v Hradci Králové ‘PROGRES Q40/10’.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 14. 7. 2021
Adresa pro korespondenci:
Ing. Inka Matuchová
Biomedicínské centrum-Masarykova nemocnice v Ústí nad Labem
Sociální péče 3316/12A, 401 13, Ústí and Labem
e-mail: inka.matuchova@gmail.com
Sources
1. Teřl, M., Pešek, A., Tauchman, A. Pleurální výpotek v interní praxi. Vnitř. Lék., 2015, 51 (4), s. 430-437.
2. Šimánek, V., Třeška, V., Klečka, J., Špidlen, V., Vodička, J. Empyém hrudníku. Interní Med., 2005, 7(7), 358-359.
3. Light, R. W, Macgregor, M. I., Luchsinger, P. C., Ball, W. C. Pleural effusions: the diagnostic separation of transudates and exudates. Ann. Intern., 1972, 77, s. 507–513.
4. Light, R. W. Light Criteria: The Beginning and Why they are Useful 40 Years Later. Clinics in Chest Medicine, 2013, 34 (1), s. 21-26.
5. Na, M. J. Diagnostic tools of pleural effusion. Tuberc. Respir. Dis., 2014; 76, s. 199–210.
6. Karkhanis, V. S., Joshi, J. M. Pleural effusion: diagnosis, treatment, and management. Open Access Emerg. Med., 2012, 4, s. 31–52.
7. Salajka, F. Pleurální výpotky – etiologie a diagnostika. Kardiol. Rev. Int. Med., 2009, 11(4): s. 181-186.
8. Uzan, G., İkitimur, H. Pleural Effusion in End Stage Renal Failure Patients. Sisli Etfal Hastan Tip. Bul., 2019, 1953(1), s. 54-57.
9. Wiener-Kronish, J. P, Matthay, M. A., Callen, P. W. et al. Relationship of pleural effusions to pulmonary hemodynamics in patients with congestive heart failure. Am. Rev. Respir. Dis., 1985, 132, s. 1253-1256.
10. Ahmed, O., Zangan S. Emergent management of empyema. Semin. Intervent. Radiol., 2012, 29, s. 226–230.
11. Šimánek, V., Třeška, V., Klečka, J., Špidlen, V., Vodička, J. Empyém hrudníku. Interní Med., 2005, 7(7), s. 358-359.
12. Peterman, T. A., Speicher, C. E. Evaluating Pleural EffusionsA Two-Stage Laboratory Approach. JAMA, 1984, 252(8), s. 1051–1053.
13. Bystroňová, I., Kušnierová, P., Walder, P., Hlubek, R., Rolová, J., Stejskal, D. Přehled biomarkerů synoviální tekutiny u kloubních onemocnění. Klin. Biochem. Metab. 2021, 29(50), s. 11 - 18.
14. Matuchova, I., Kelbich, P., Kubalik, J. et al. Cytological-energy analysis of pleural effusions with predominance of neutrophils. Ther. Adv. Respir. Dis., 2020,14 : 1753466620935772.
15. Kelbich, P., Malý, V., Matuchová, I. et al. Cytological-energy analysis of pleural effusions. Ann. Clin. Biochem., 2019, 56, s. 630–637.
16. Sobek, O; Dušková, J. Laboratorní vyšetření likvoru. Štětkářová, I a kol. (eds.) Spinální neurologie. Praha: Maxdorf, 2019, ISBN 978-80-7345-626-9.
17. Zeman, D. Praktický průvodce laboratorním vyšetřením likvoru. Olomouc: Univerzita Palackého v Olomouci, 2018, 136 s. ISBN: 978-80-244-5262-3.
18. Kelbich, P., Hejčl, A., Staněk, I. et al. Principles of the cytological-energy analysis of the extravascular body fluids. Biochem. Mol. Biol. J., 2017, 3, s. 1-3.
19. Chubb, S. P., Williams, R. A. Biochemical Analysis of Pleural Fluid and Ascites. Clin. Biochem. Rev., 2018, 9(2), s. 39-50.
20. Krejsek, J. Imunologie člověka. Hradec Králové: Garamon, 2016, 495 s. ISBN: 978-80-86472-74-4 .
21. Santotoribio, J. D., Alnayef-Hamwie, H., Batalha-Caetano, P., Perez-Ramos, S., Pino, M. J. Evaluation of Pleural Fluid Lactate for Diagnosis and Management of Parapneumonic Pleural Effusion. Clin. Lab., 2016, 62(9), s. 1683-1687.
22. Kelbich, P., Hejčl, A., Selke Krulichová, I. et al. Coefficient of energy balance, a new parameter for basic investigation of the cerebrospinal fluid. Clin Chem. Lab. Med., 2014, 52, s. 1009–1017.
23. Kelbich, P., Slavík, S., Jasanská, J. et al. Evaluations of the energy relations in the CSF compartment by investigation of selected parameters of the glucose metabolism in the CSF. Klin. Biochem. Metab., 1998, 6, s. 213–225.
24. Kelbich, P., Radovnický, T., Selke-Krulichová, I. et al. Can Aspartate Aminotransferase in the Cerebrospinal Fluid Be a Reliable Predictive Parameter? Brain Sci., 2020, 10, s. 698.
25. De Long, E. R., De Long, D. M., Clarke-Pearson, D. L. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach, Biometrics, 1988; 44, s. 837–845.
26. Babior, B. M. The respiratory burst of phagocytes. The Journal of clinical investigation, 1984, 73(3), s. 599–601.
27. Borregaard, N., Herlin, T. Energy metabolism of human neutrophils during phagocytosis. The Journal of clinical investigation, 1982, 70(3), s. 550–557.
28. McCauley, L., Dean, N. Pneumonia and empyema: causal, casual or unknown. Journal of thoracic disease, 2015, 7(6), s. 992–998.
29. Karlson, P. Základy Biochemie. 3. přeprac. vyd. Praha: Academia, 1981, 504 s. ISBN 104-21-852.
30. Chavalittamrong, B., Angsusingha, K., Tuchinda, M. et al. Diagnostic Significance of pH, Lactic Acid Dehydrogenase, Lactate and Glucose in Pleural Fluid. Respiration, 1979, 38, s. 112-120.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2021 Issue 4-
All articles in this issue
- Monoklonální gamapatie – stále aktuální téma
- Pleural effusion – cytological-energy analysis versus traditional Light’s criteria
- Analysis of the more frequent occurrence of multiple myeloma in Eastern Bohemia
- Use of serum calprotectin as rutine biomarker of bacterial infection
- Urea cycle disorders, Arginine Chloride in the treatment of hyperammonemia
- Measurement and interpretation of cardiac troponins in Europe. Commentary on the studies CAMARGUE and SEKK 2019. Communication for practice.
- How to increase the effectiveness of EHK programs for hormones
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Use of serum calprotectin as rutine biomarker of bacterial infection
- Urea cycle disorders, Arginine Chloride in the treatment of hyperammonemia
- Monoklonální gamapatie – stále aktuální téma
- Pleural effusion – cytological-energy analysis versus traditional Light’s criteria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


