-
Medical journals
- Career
Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
Authors: A. Jabor 1,2; S. Fraňková 3; R. Šenkeříková 3; J. Komrsková 1; M. Labanczová 1; D. Viczénová 1; P. Sečník Jr. 3; T. Vacková 1; J. Franeková 1,2
Authors‘ workplace: Institut klinické a experimentální medicíny, Pracoviště laboratorních metod, Praha, Česká republika 1; Univerzita Karlova, 3. lékařská fakulta, Praha, Česká republika 2; Institut klinické a experimentální medicíny, Klinika hepatogastroenterologie, Praha, Česká republika 3; SK Lab, Lučenec, Slovensko 4
Published in: Klin. Biochem. Metab., 26, 2018, No. 4, p. 166-172
Overview
Cíl studie:
Zhodnotit roli volných lehkých řetězců imunoglobulinů (FLC) a párů lehkých a těžkých řetězců imunoglobulinů (HLC) u pacientů před transplantací jater (LTx) a po transplantaci. Porovnat asociaci imunoglobulinů a jejich komponent s komorbiditami pacientů vyjádřených objektivními laboratorními testy a posoudit vývoj laboratorních nálezů v průběhu dvou let sledování.
Typ studie:
Observační prospektivní studie.
Název a sídlo pracoviště:
Institut klinické a experimentální medicíny, Vídeňská 1958/9, 140 21 Praha 4
Materiál a metody:
Sledovali jsme soubor 174 pacientů před LTx a v průběhu 2letého follow-up. Jako ukazatele orgánových dysfunkcí byly použity ELF skóre, MELD skóre, laboratorní parametry charakterizující červenou krevní řadu, trombocyty, jaterní funkce, renální funkce, stav nutrice a glukózového metabolismu. Pro stanovení FLC a HLC byly použity soupravy The Binding Site a analyzátor SPA Plus (HLC) a Optilite (FLC, imunoglobuliny). Pro biochemické parametry byl použit analyzátor Architect ci16200 Abbott, pro krevní parametry analyzátor Sysmex XN, koagulační analyzátor STA R Max (Stago), bylo vypočteno MELD skóre, ELF skóre bylo vypočteno z parametrů měřených na analyzátoru Centaur CP, Siemens, vždy s originálními reagenciemi příslušných firem. Statistické postupy zahrnovaly Spearmanův korelační koeficient pořadové korelace, Mannův a Whitneyho neparametrický test a Friedmanův neparametrický test pro opakovaná vyšetření.
Výsledky:
Zvýšené koncentrace IgA, FLC-κ a FLC-λ před LTx byly asociovány s častějším výskytem patologicky zvýšených hodnot ELF a MELD skóre, kyseliny močové a kreatininu a se sníženými hodnotami hemoglobinu, trombocytů, albuminu, prealbuminu, lipidových ukazatelů a cholinesterázy. Během 2letého follow-up se u pacientů se zvýšenými výchozími hodnotami IgA a FLC-κ koncentrace udržovaly zvýšené a zhoršovaly se renální funkce a lipidové ukazatele.
Závěr:
U pacientů s pokročilým jaterním onemocněním vyžadujícím transplantaci jater byla potvrzena prognostická role zvýšených koncentrací IgA, podobnou výpovědní hodnotu mělo stanovení FLC-κ a FLC-λ. Stanovení HLC nevykazovalo asociace s orgánovými dysfunkcemi a komorbiditami těchto pacientů.
Klíčová slova:
transplantace jater, imunoglobuliny, volné lehké řetězce imunoglobulinů, páry volných a těžkých řetězců imunoglobulinů, ELF skóre.
Úvod
Institut klinické a experimentální medicíny v Praze provádí ročně kolem 150 transplantací jater. Ve většině případů jde o pacienty s chronickým selháním jater (alkoholická choroba jater, virová hepatitida C, cholestatické jaterní choroby) či primárními tumory jater (hepatocelulární karcinom). V rámci širšího projektu sledování pacientů po transplantaci solidních orgánů, zaměřeného na rozvoj potransplantační lymfoproliferativní choroby (PTLD), prezentujeme část výsledků popisujících vztah mezi koncentracemi imunoglobulinů, HLC a FLC a závažností stavu pacientů před LTx a v průběhu follow-up.
Pro pacienty s jaterní cirhózou je obvyklé zmnožení imunoglobulinů především ve třídě IgA a IgG, provázené elektroforetickým nálezem polyklonálního zmnožení. Imunitní protilátková odpověď je v potransplantačním období modifikována indukční (související bezprostředně s LTx) a udržovací imunosupresivní terapií. U pacientů po transplantacích všeobecně dochází k různým změnám imunitní odpovědi, které mohou vyústit v rejekci, infekční komplikace nebo dokonce k rozvoji potransplantační lymfoproliferativní choroby (PTLD) [1,2]. Klíčovým imunoglobulinem, který se uplatňuje v patofyziologii cirhózy, je IgA [3].
Sekreční IgA (SIgA, dimer) je důležitý pro udržení homeostázy ve střevě. Reguluje složení mikrobiomu, chrání sliznici střeva před patogeny, ovlivňuje imunitní funkci. Je tvořen plasmatickými buňkami v lamina propria, do lumen střeva se dostává transcytózou přes epitel střevního lumen a játra jsou přímo přes vena portae ovlivněna produkty tvořenými ve střevě a jsou tedy podstatně ovlivněna porušenou homeostázou ve střevě. Kupfferovy buňky prostřednictvím receptorů rozpoznávajících molekulové vzory (pattern-recognition receptors, PRR) reagují na přítomnost bakteriálních zbytků (lipopolysacharidy) a spouštějí lokální zánětlivou reakci. Naopak játra ovlivňují mikrobiom přes IgA tvořený v játrech, který je společně se žlučovými kyselinami secernován do střeva.
Ukazuje se, že imunologická funkce sérového IgA (monomer) je rozsáhlejší, než se předpokládalo dříve, a má přidanou diagnostickou hodnotu. Sérový IgA (nikoli sekreční) po opsonizaci bakterií vytváří imunokomplex, zprostředkuje vazbu mezi FcαRI (CD89) a toll-like receptory (TLR), což vede k vyplavení prozánětlivých cytokinů, především TNFα, IL1 a IL6. Vazba na FcαRI však může indukovat nejen aktivační, ale naopak i inhibiční odpověď. Vazba volného IgA na FcαRI spouští inhibiční signál a blokuje aktivační odpověď. Exprese CD89 byla pozorována na různých typech buněk včetně neutrofilů, makrofágů, monocytů a Kupfferových buněk. Sérové, nesekreční IgA indukuje protektivní proinflamační odpověď různých myeoloidních imunitních buněk a reguluje cytokinovou odpověď v nemukózních tkáních [4,5].
Protože se zvýšené sérové koncentrace IgA považují za známku zhoršené prognózy pacientů, bylo cílem naší práce zjistit, zda existuje vztah mezi změnami protilátkové odpovědi a morbiditou pacientů. Stav pacientů byl objektivizován vyšetřením laboratorních parametrů charakterizujících hlavní orgánové dysfunkce. Kromě základních vyšetření protilátkové odpovědi (celkové IgA, IgG a IgM) jsme se zaměřili na význam stanovení volných lehkých řetězců imunoglobulinů třídy kappa a lambda (FLC-κ a FLC-λ) a párů lehkých a těžkých řetězců imunoglobulinů HLC IgA-κ, HLC IgA-λ, HLC IgG-κ, HLC IgG-λ, HLC IgM-κ a HLC IgM-λ v posouzení stavu nemocných s transplantací jater.
Metodika
Vyšetřili jsme celkem 174 pacientů před LTx, jeden a dva roky po LTx. Společně s vyšetřením FLC a HLC bylo vypočteno ELF skóre (matematické zpracování tří sérových parametrů: kyselina hyaluronová, HA; N-terminální propeptid prokolagenu typu III, PIIINP; tkáňový inhibitor metaloproteáz typu 1, TIMP-1) a MELD skóre (posuzující prognózu pacientů na základě matematického zpracování parametrů charakterizujících koagulaci – INR, renální funkce – sérový kreatinin, a jaterní funkce – sérový bilirubin). Z běžných laboratorních parametrů jsme sledovali parametry červené krevní řady (hemoglobin, hematokrit, počet erytrocytů), parametry koagulace (INR jako součást MELD skóre, trombocyty), ukazatele funkce ledvin nebo s funkcí ledvin souvisejícími (kreatinin, urea, kyselina močová v séru), sérové markery jaterní fibrózy (kromě již zmíněného ELF skóre koncentrace galectinu-3), ukazatele jaterních funkcí a aktivity jaterních enzymů (kromě již uvedeného MELD skóre ALT, AST, GGT, cholinesterázu), ukazatele nutrice (albumin, prealbumin, celkový cholesterol, HDL - a LDL-cholesterol, triacylglyceroly) a ukazatele glukózového metabolismu (koncentrace glukózy, HbA1c).
Sérové koncentrace HLC byly měřeny na analyzátoru SPA Plus (The Binding Site, UK), FLC a celkové imunoglobuliny na analyzátoru Optilite (The Binding Site, UK), biochemické markery na analyzátoru Architect ci16200 (Abbott), ELF skóre na analyzátoru Advia Centaur CP (Siemens) a krevní obraz na analyzátoru Sysmex XN. Všechny metody mají efektivní systém vnitřní kontroly kvality (IKK, UnityRealTime, BioRad) a externího hodnocení kvality (EHK, SEKK). Výjimkou je stanovení složek ELF skóre, pro které systém EHK sice není dostupný, ale sami organizujeme mezilaboratorní porovnávání [6], a galectin-3 (existuje pouze firemní zajištění kvality vyšetření).
Statistické zpracování
Použili jsme neparametrický Mann-Whitneyův test pro nezávislé soubory, Friedmanův test pro hodnocení po sobě jdoucích vyšetření a neparametrický Spearmanův korelační koeficient.
Výsledky
Tabulka 1 popisuje kohortu celého souboru pacientů před LTx.
Table 1. Basic characteristics of patients before LTx (N=174). There were 2, 2, and 4 patients with decreased IgA, IgG, and IgM, respectively, and 1 patient with decreased FLC-λ. Reference values for immunoglobulins were sex-specific, reference values for FLC κ/λ ratio were chosen with respect to the eGFR (CKD-EPI equation). 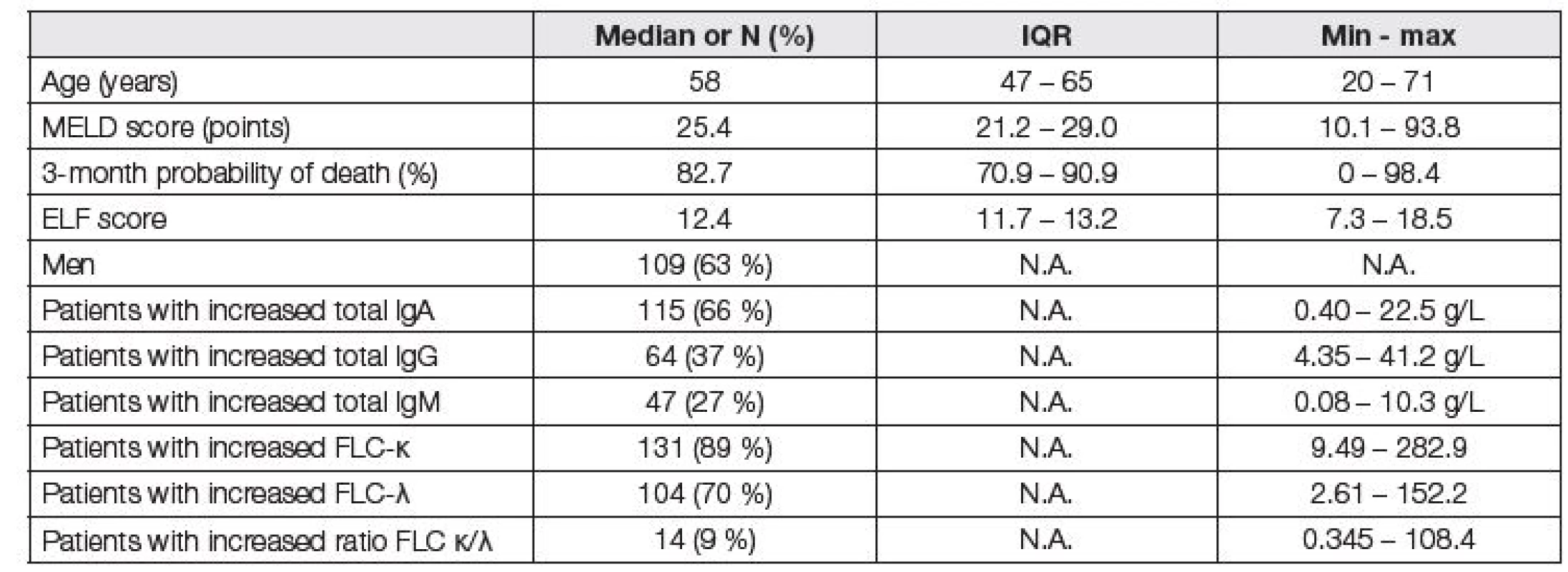
N.A. = not applicable Při vyhodnocení vztahů mezi ELF skóre a MELD skóre byla zjištěna vyšší těsnost vztahu pro FLC-κ než FLC-λ (r=0,305 vs. 0,268 pro ELF skóre, resp. r=0,429 vs. r=0,382 pro MELD skóre, p < 0,001 pro všechny vztahy). Pro celkové IgA, HLC IgA-κ a HLC IgA-λ byly vztahy s ELF skóre a MELD skóre rovněž významné, ale méně těsné. Prakticky zanedbatelné korelace vykazovaly s ELF a MELD skóre hodnoty IgG a IgM včetně HLC IgG a HLC IgM κ i λ. Poměr FLC κ/λ s oběma skóre nekoreloval vůbec.
Z uvedených důvodů jsme použili pro další sledování klasifikaci pacientů podle dvou různých kritérií: prvním kritériem byla hodnota celkového IgA v séru (s rozdělením kohorty pacientů na skupinu do mediánu 6,14 g/l a nad mediánem 6,14 g/l, v obou skupinách byl stejný počet pacientů N=87; dělení podle tohoto kritéria je na skupiny A a B); druhým kritériem byla hodnota FLC-κ (opět s rozdělením na skupinu do mediánu 48,3 mg/l a nad mediánem 48,3 mg/l, v obou skupinách bylo opět 87 pacientů, vznikly tak skupiny C a D).
V Tabulce 2 jsou hodnoty FLC a HLC zjištěné před LTx při rozdělení souboru pacientů podle dvou kritérií (celkové IgA nebo FLC kappa). Je vyznačen statistický rozdíl při vyhodnocení skupiny A a B, resp. C a D.
Table 2. Medians of immunoglobulin compounds before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). Symbol (a) means that the variable was used for classification to the respective group. 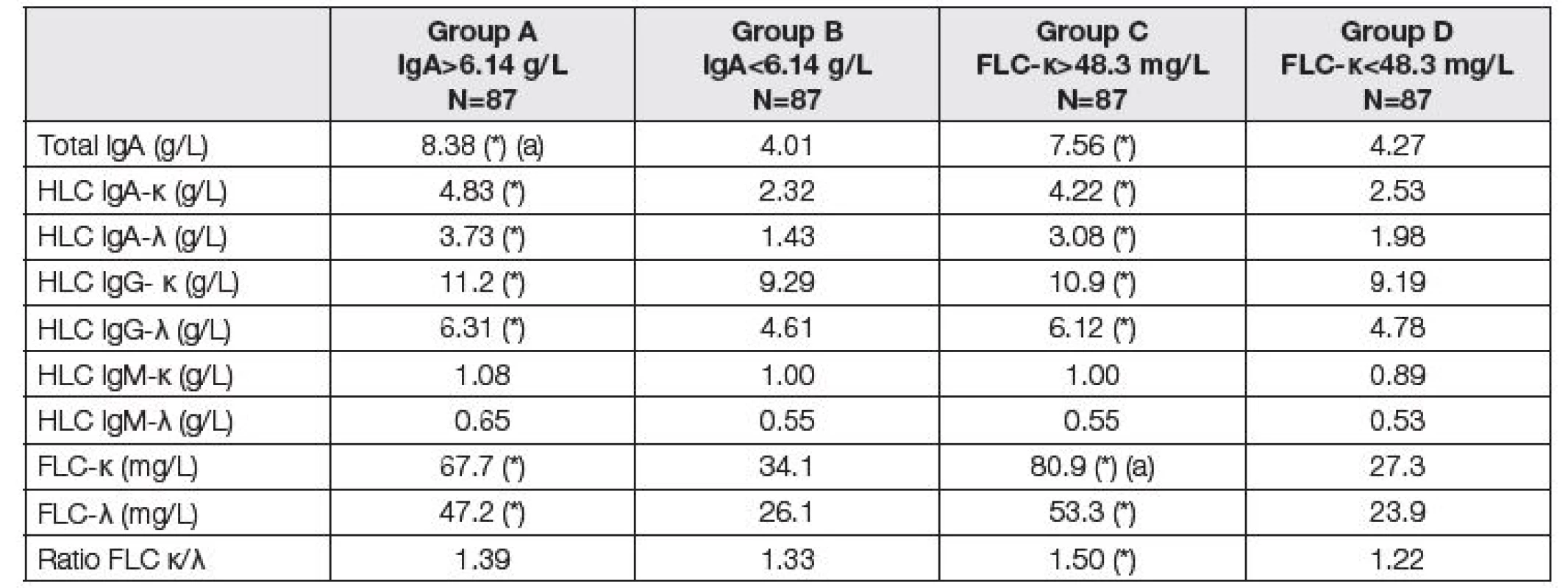
Analogicky jsou v Tabulkách 3 až 5 uvedeny parametry fibrózy před LTx (Tabulka 3), renálních funkcí a krevní obraz (Tabulka 4) a parametry jaterních funkcí a nutriční ukazatele (Tabulka 5).
Table 3. Medians of biomarkers of liver fibrosis before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 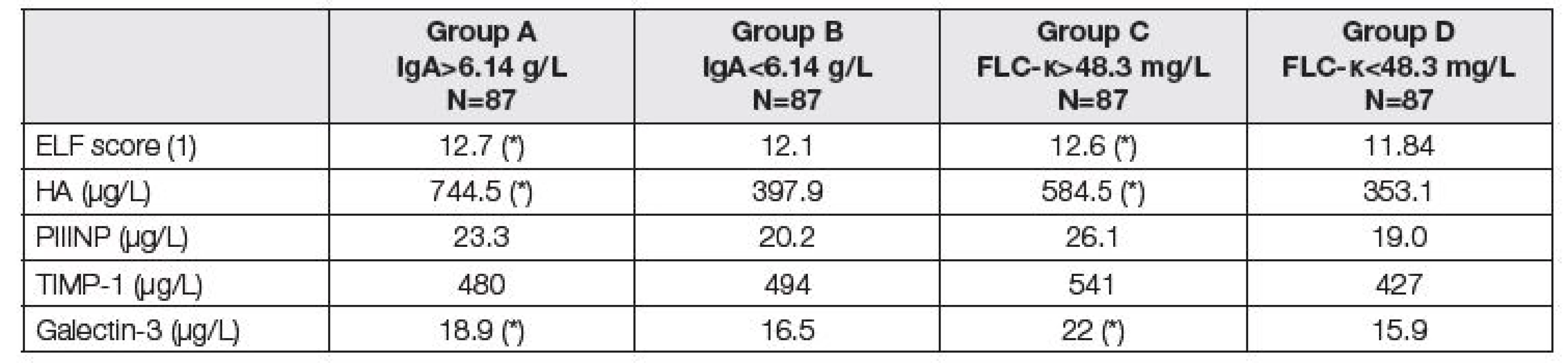
Table 4. Medians of parameters of renal function and liver fibrosis before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 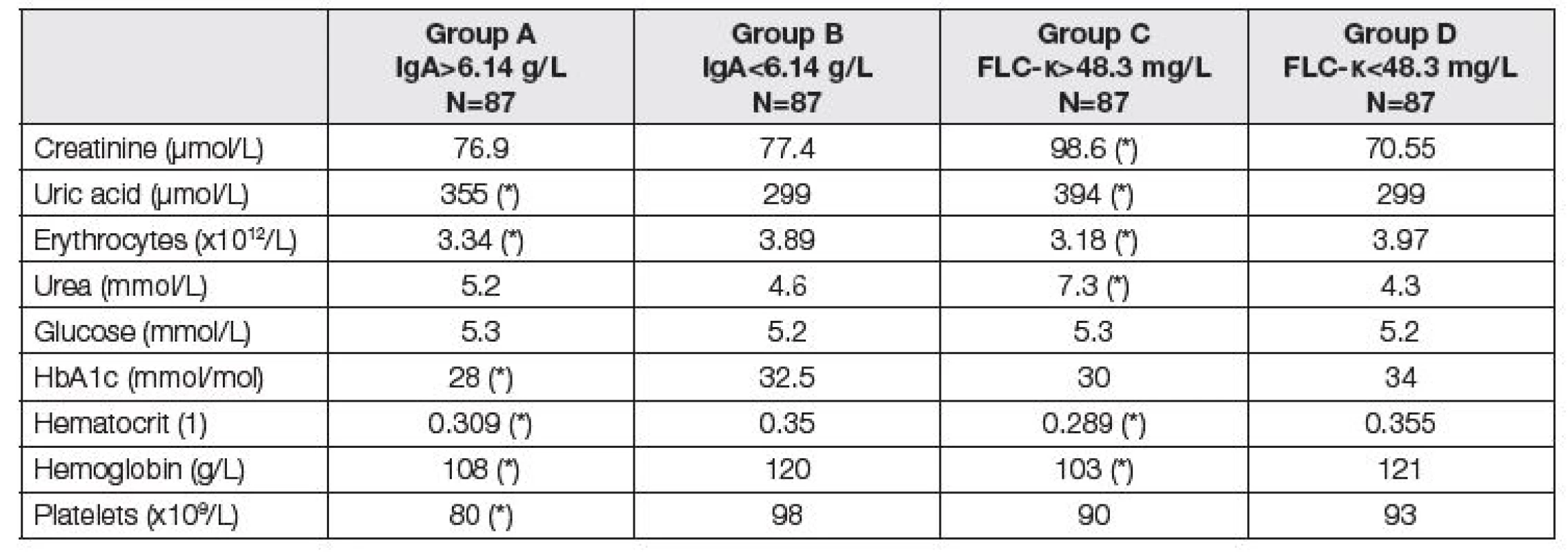
Table 5. Medians of parameters of liver function and nutritional parameters before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L. Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 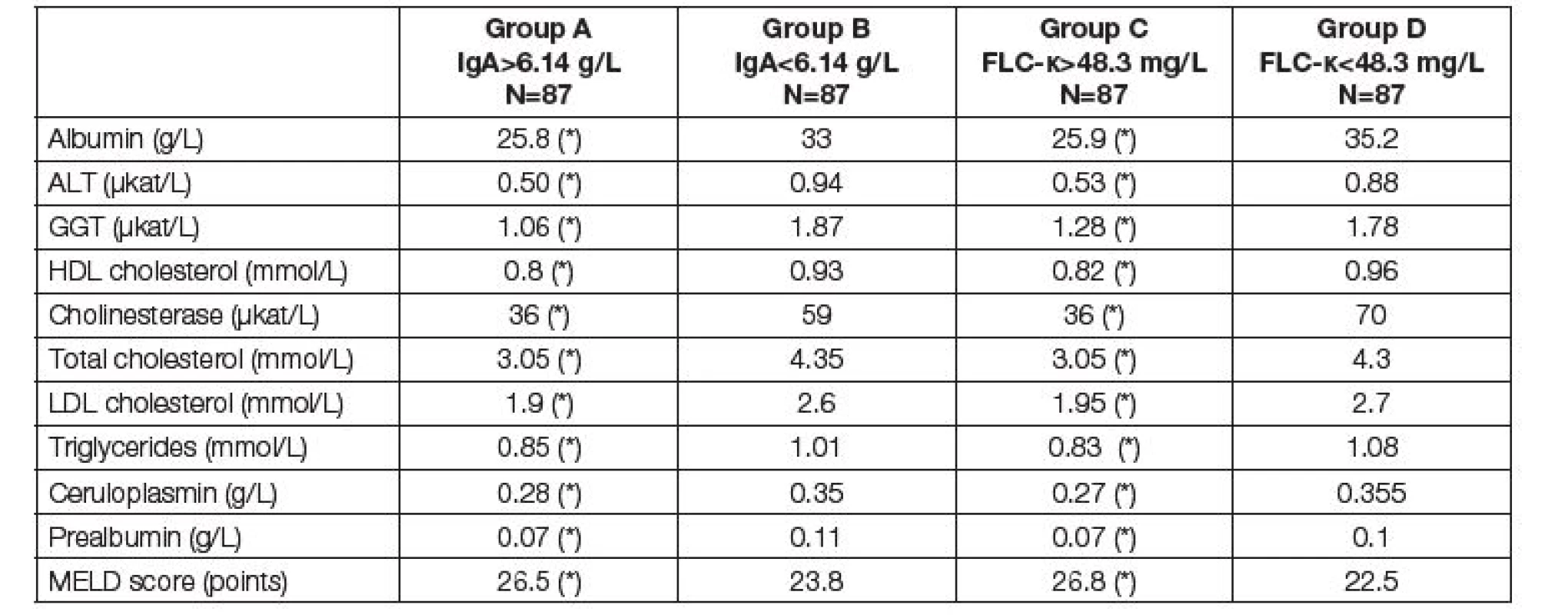
Po LTx dochází k poklesu koncentrace imunoglobulinů i jejich komponent (FLC a HLC). Vyhodnocení významnosti změn v koncentracích imunoglobulinů a jejich komponent pomocí Friedmanova testu ukázalo, že významný pokles je pro FLC-κ (p<0.001), FLC-λ (p<0.001), HLC IgA-κ (p<0.001), HLC IgA-λ (p<0.001), HLC IgG-κ (p<0.001), HLC IgG-λ (p<0.001), HLC IgM-κ (p<0.001) a HLC IgM-λ (p<0.001). Pokles HLC IgA-κ je znázorněn na obr. 1, pokles HLC IgA-λ je na obr 2.
Image 1. The significant decrease in HLC IgA-κ (y-axis, g/L) concentrations during the 2-year follow-up after LTx (Friedman test, p<0.001). The median of the rate of HLC IgA-κ decrease was 2.2 g/L (IQR 1.13-3.87) during the first year. 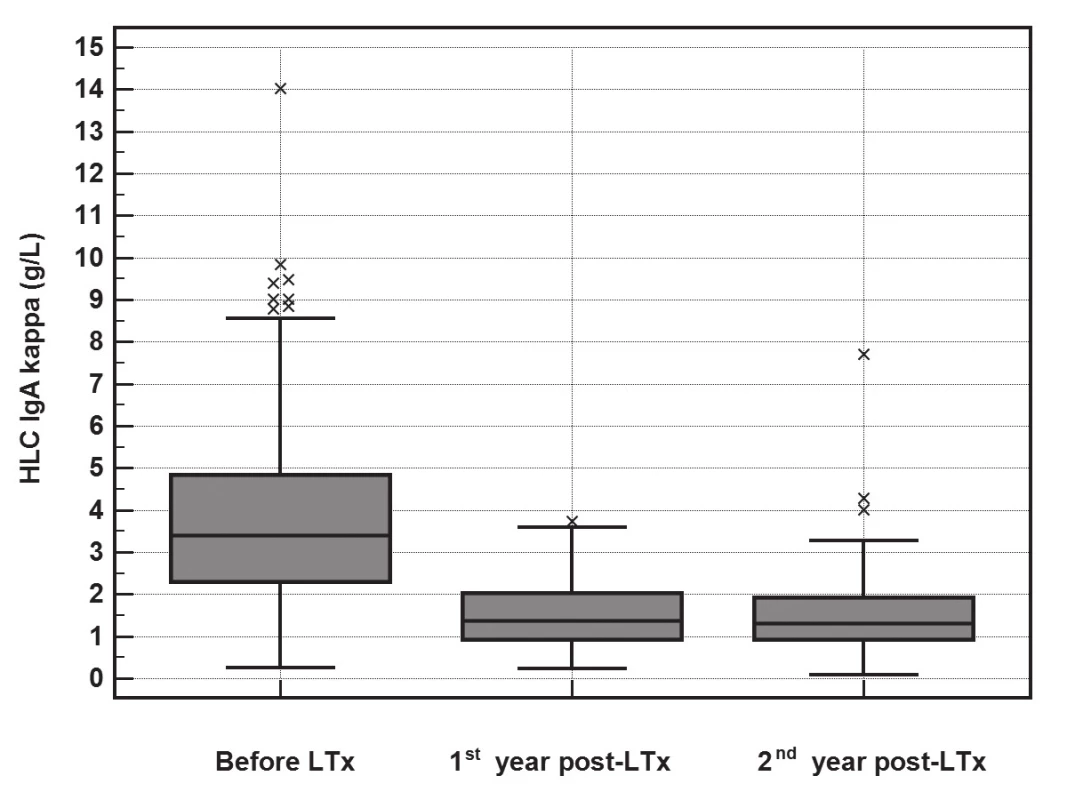
Image 2. The significant decrease in HLC IgA-λ (y-axis, g/L) concentrations during the 2-year follow-up after LTx (Friedman test, p<0.001). The median of the rate of HLC IgA-λ decrease was 2.0 g/L (IQR 0.82-2.97) during the first year. 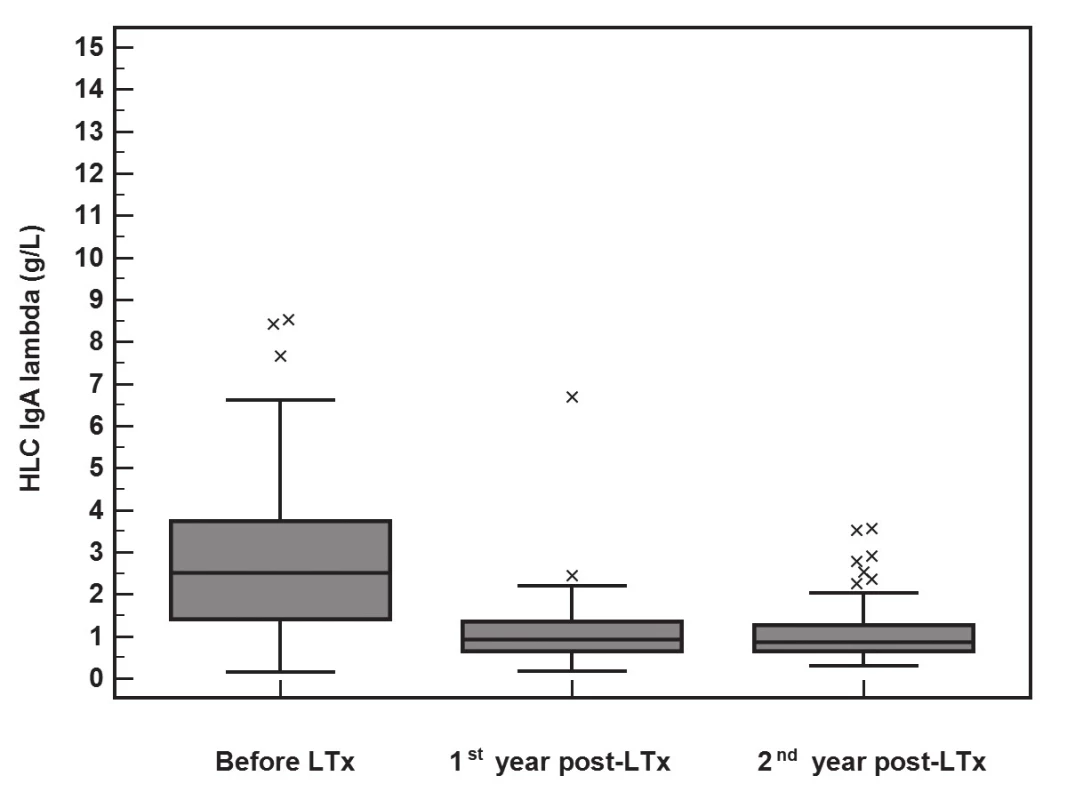
Tabulka 6 ukazuje změny ve sledovaných parametrech za 1, resp. 2 roky po LTx. Výchozí dělení na podskupiny bylo zachováno; to znamená, že pacient klasifikovaný do podskupiny A – D před LTx zůstal v této skupině i v prvním a druhém roce po LTx.
Table 6. Medians of selected parameters tested 1 and 2 years after LTx. Comparison of two subgroups with respect to the same criteria as used in the analysis of data before LTx. Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 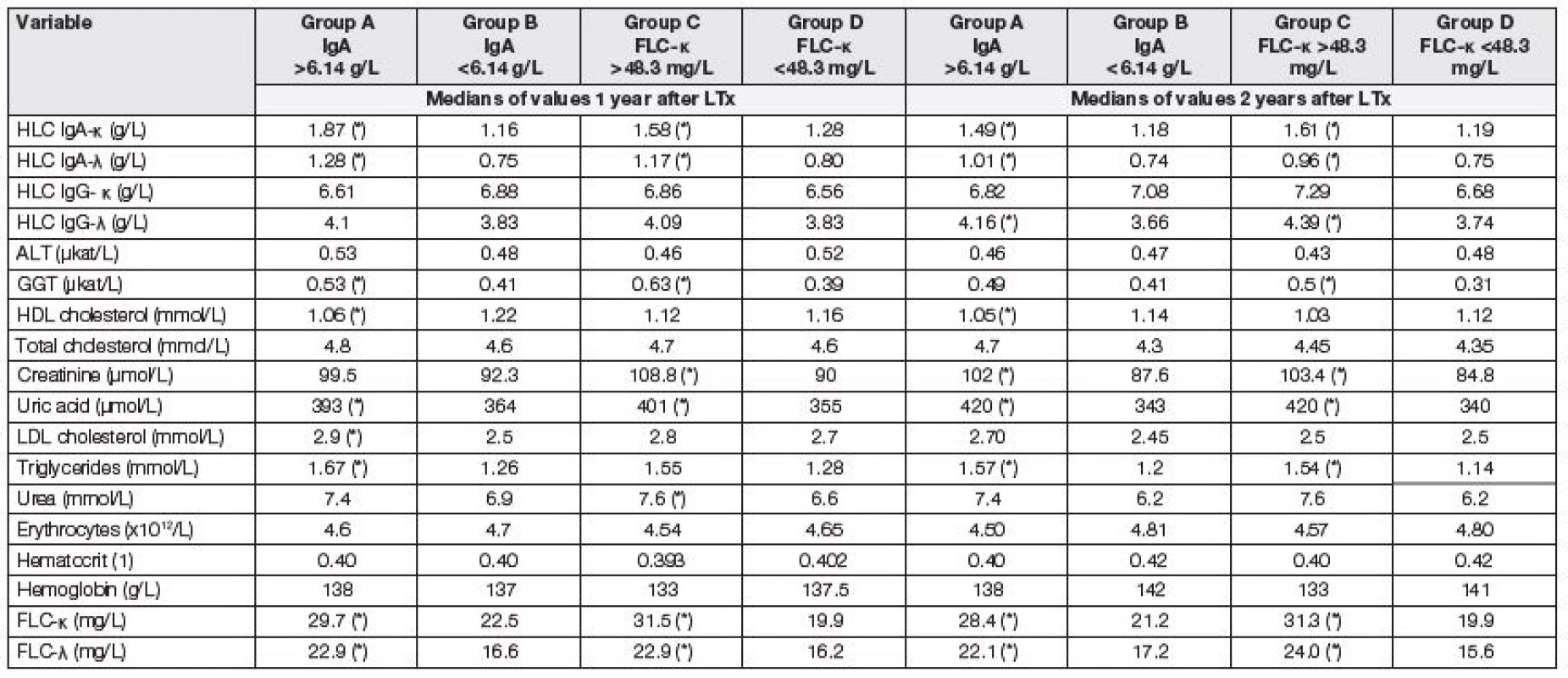
Klasifikace v Tabulkách 2 – 6 byla založena na použití mediánu FLC-κ. Pokud jsme pro hodnocení asociací s parametry orgánových dysfunkcí a komorbidit použili FLC-λ, byly vztahy podobné. Veškeré analýzy jsme rovněž provedli pro pacienty s hodnotami eGFR (CKD-EPI) 1,0 ml/s na 1,73 m2 a vyššími. Asociace zůstaly zachovány i po této úpravě, takže vliv renálních funkcí na výpovědní hodnotu FLC-κ i FLC-λ není podstatný.
Diskuse
V této práci jsme se pokusili objasnit vztah mezi protilátkovou odpovědí a prognózou u pacientů se závažným jaterním onemocněním, které vyžadovalo transplantaci jater. Vztah mezi sérovou koncentrací IgA a prognózou pacientů s chronickým jaterním onemocněním je známý [3-5], méně jasné jsou ale vztahy mezi volnými lehkými řetězci imunoglobulinů (FLC) nebo páry lehkých a těžkých řetězců imunoglobulinů (HLC) a klinickým stavem pacientů. Předtransplantační období je u jaterních onemocnění spojeno s řadou patofyziologických změn, zvýšenou produkcí imunoglobulinů ve třídě IgA a IgG, případně IgM u biliárních cirhóz. Potransplantační období znamená zásah do buňkami zprostředkované i humorální imunity; některé orgánové a systémové dysfunkce se mohou upravovat, jiné se mohou komplikovat například imunosupresivní terapií.
Vyšetřený soubor pacientů vykazoval před transplantací závažnou poruchu syntetické funkce jater (významně zvýšené MELD skóre s nízkou pravděpodobností přežití) i změny ve stupni fibrózy, charakterizované pomocí skóre ELF (Tabulka 1) [6]. Prokázali jsme také časté patologie v koncentracích imunoglobulinů a jejich komponent (Tabulky 1 a 2). Korelační analýza ukázala podobné vztahy mezi MELD nebo ELF skóre a hodnotami IgA a FLC-κ, podstatně slabší byly vztahy mezi oběma skóre a ostatními imunoglobulinovými komponentami, včetně HLC IgA, IgG a IgM. Zvýšená produkce IgA je logicky (patofyziologicky) propojena se zvýšením FLC-κ a FLC-λ. Protože vztah ke komorbiditám byl silnější pro FLC-κ, vybrali jsme tento parametr pro posouzení vazeb na biomarkery orgánových dysfunkcí v porovnání s IgA.
Jak ukazují Tabulky 3 – 5, vztah ke komorbiditám byl v podstatě rovnocenný při klasifikaci pacientů do skupin podle mediánů hodnot IgA nebo FLC-κ. Jak zvýšené IgA, tak zvýšení FLC-κ nad medián souboru je spojeno s poruchou jaterních a renálních funkcí, poruchou nutrice a anémií. Z parametrů jaterní fibrózy je vidět těsný vztah IgA a FLC-κ především k hodnotám kyseliny hyalorunové s výsledným zvýšením ELF skóre u pacientů se zvýšenými hodnotami IgA a FLC-κ (Tabulka 3). Tabulka 4 ukazuje závažnou asociaci mezi IgA nebo FLC-κ a červenou krevní řadou – přibližně každý čtvrtý pacient se zvýšením těchto parametrů má hemoglobin pod 108 g/l a trombocyty pod 80.109/l (pro vyšší IgA), resp. 90.109/l (pro vyšší FLC-κ). Nejvýraznější odchylky před LTx byly zjištěny u cholinesterázy (čtvrtina pacientů se zvýšením IgA nebo FLC-κ má CHS pod 36 µkat/l), současně jsou u těchto pacientů snížené hodnoty albuminu, krevních lipidů, ceruloplasminu a prealbuminu (Tabulka 5). Hodnocení FLC-λ ukázalo podobné asociace s komorbiditami jako FLC-κ.
V našem sledování jsme se vzhledem k celkovému zaměření studie i vzhledem k možnému riziku rozvoje PTLD zaměřili i na hodnocení významu stanovení párů lehkých a těžkých řetězců imunoglobulinů. V případě HLC IgA κ i λ změny koncentrací byly analogické jako změny celkového IgA, významnější asociace mezi HLC IgG nebo HLC IgM a komorbiditami jsme nepozorovali. Doménou stanovení HLC tedy zůstává monitorování pacientů s monoklonálními gamapatiemi, jak je popsáno v literatuře více autory. Katzmann popsal potenciál stanovení HLC IgA u pacientů s monoklonálním proteinem migrujícím v beta-frakci elektroforézy a navrhl možnost nahradit tímto vyšetřením sérovou elektroforézu proteinů, imunofixaci a stanovení koncentrace celkového IgA [7]. Podobně Ludwig popsal zhoršenou prognózu pacientů s IgG myelomem se suprimovaným párem HLC a možnost sledování odpovědi na terapii [8]. Podobně také Chae [9] a Michallet [10] popsali výhody monitorování párů lehkých a těžkých řetězců u pacientů s mnohočetným myelomem typu IgA a IgG. U pacientů s monoklonálním proteinem IgM bylo stanovení HLC IgM κ a λ hodnoceno jako užitečný způsob vyšetřování [11]. Potenciál využití HLC byl dále popsán u různých typů monoklonálních gamapatií, včetně monoklonálních gamapatií IgA a IgG, Waldenströmovy makroglobulinémie, chorob z lehkých řetězců a MGUS [12]. Nízká intraindividuální variabilita imunoglobulinů a jejich komponent (FLC, HLC) monitorování pacientů rozhodně umožňuje [13].
Největší pokles HLC IgA a FLC byl patrný během prvního roku po LTx (obr. 1 a 2). V prvním a druhém roce přetrvávají zvýšené koncentrace HLC IgA-κ, HLC IgA-λ, FLC-κ a FLC-λ u pacientů, kteří měli před LTx vysoké hodnoty těchto parametrů (tabulka 6). Došlo sice k normalizaci ukazatelů červené krevní řady a upravily se nutriční ukazatele, ale změnil se lipidový profil ve smyslu zhoršení u původně rizikových pacientů (se zvýšením IgA nebo FLC-κ před LTx) a přetrvávají horší renální funkce u původně rizikových pacientů. Není tedy zásadně jiná výpověď o orgánových dysfunkcích při rozdělení pacientů podle výchozí koncentrace IgA nebo FLC-κ, ale FLC-κ (i FLC-λ) může být biomarkerem rozvoje PTLD.
Závěry
Před LTx byly častější asociace mezi ukazateli morbidity a zvýšenými hodnotami IgA a FLC-κ: zjistili jsme častější anémie (signifikantně snížený počet erytrocytů, snížený hemoglobin a hematokrit, vše p < 0,0001), vyšší ukazatele fibrotizace jater (vyšší ELF skóre, kyselina hyaluronová, galectin-3, vše p < 0,05), zhoršenou funkci jater (snížené CHS, albumin, ceruloplasmin, vše p < 0,005), zhoršené renální funkce (vyšší kreatinin, urea, kyselina močová, vše p < 0,001) a zhoršené nutriční ukazatele (nižší prealbumin, nižší lipidy, vše p < 0,05). Pokud byly hodnoty FLC-κ zvýšeny před LTx, zůstaly signifikantně vyšší i v 1. a 2. roce po LTx. Zvýšené hodnoty IgA a FLC kappa jsou asociovány s nepříznivým stavem pacienta před transplantací. Zvýšená produkce IgA a FLC-κ, která přetrvává i v dalších letech po LTx, může predikovat zhoršení prognózy pacientů. Potvrdili jsme tedy význam stanovení celkové koncentrace IgA pro posouzení prognózy u pacientů s chronickým jaterním onemocněním, ale podobné výsledky přineslo stanovení FLC-κ a FLC-λ. Výhodou monitorování FLC-κ a λ je možnost detekce případného rozvoje PTLD. V první linii testů u pacientů s LTx je vhodné dále doplnění elektroforézy a případně imunofixace. Stanovení HLC zůstává zatím vyhrazeno pro situace s již prokázanou monoklonální gamapatií s nutností sledovat kvantity jednotlivých klonů.
Práce byla podpořena z grantu MZ ČR číslo AZV MZ 15-27579A.
Autoři děkují za technickou pomoc ing. Štěpánce Strnadové, Mgr. Jiřímu Vymětalíkovi a ing. Vandě Filové, Ph.D.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 20. 9. 2018
Adresa pro korespondenci:
MUDr. Janka Franeková, Ph.D.
OKB PLM, Institut klinické a experimentální medicíny
Vídeňská 1958/9, 140 21 Praha
e-mail: jafa@ikem.cz
Sources
1. Sečník, P. Jr., Lavríková, P., Hošková, L., Malíková, P., Jabor, A., Franeková, J. Free light chain and intact immunoglobulin abnormalities in heart transplant recipients: Two year follow-up timelines and clinical correlations. Transpl Immunol, 2017,41, p. 22-26.
2. Lavríková, P., Sečník, P. Jr., Kubíček, Z., Jabor, A., Hošková, L., Franeková, J. Tacrolimus has immunosuppressive effects on heavy/light chain pairs and freelight chains in patients after heart transplantation: A relationship with infection. Transpl Immunol, 2018, 50, p. 43-47.
3. Inamine, T., Schnabl, B. Immunoglobulin A and liver diseases. J Gastroenterol, 2018, 53, p. 691-700.
4. Hansen, I.S., Hoepel, W., Zaat, S. A. J., Baeten, D. L. P., den Dunnen, J. Serum IgA Immune Complexes Promote Proinflammatory Cytokine Production by Human Macrophages, Monocytes, and Kupffer Cells through FcαRI-TLR Cross-Talk. J Immunol, 2017, 199, p. 4124-4131.
5. Lin, S., Sun, Q., Mao, W., Chen, Y. Serum Immunoglobulin A (IgA) Level Is a Potential Biomarker Indicating Cirrhosis during Chronic Hepatitis B Infection. Gastroenterol Res Pract, 2016, 2016 : 2495073. doi: 10.1155/2016/2495073.
6. Jabor, A., Kubíček, Z., Fraňková, S., Šenkeříková, R., Franeková, J. Enhanced liver fibrosis (ELF) score: Reference ranges, biological variation in healthy subjects, and analytical considerations. Clin Chim Acta, 2018, 483, p. 291-295.
7. Katzmann, J. A., Willrich, M. A., Kohlhagen, M. C., et al. Monitoring IgA multiple myeloma: immunoglobulin heavy/light chain assays. Clin Chem, 2015, 61, p. 360-367.
8. Ludwig, H., Milosavljevic, D., Berlanga, O. et al. Suppression of the noninvolved pair of the myeloma isotype correlates with poor survival in newly diagnosed and relapsed/refractory patients with myeloma. Am J Hematol, 2016, 91, p. 295-301.
9. Chae, H., Han, E., Yoo, J. et al. Heavy/light chain assay as a biomarker for diagnosis and follow-up of multiple myeloma, Clin Chim Acta, 2018, 479, p. 7-13.
10. Michallet, M., Chapuis-Cellier, C., Dejoie, T. et al. Heavy+light chain monitoring correlates with clinical outcome in multiple myeloma patients. Leukemia, 2018;32 : 376-382.
11. Sarto, C., Cappellini, F., Giagnacovo, M., Brambilla P. IgMκ-IgMλ pair quantitation in the clinical laboratory practice. Clin Biochem, 2018, 51, p. 56-60.
12. Greil, C., Ihorst, G., Gaiser, F. et al. The serum heavy/light chain immunoassay: A valuable tool for sensitive paraprotein assessment, risk, and disease monitoring in monoclonal gammopathies. Eur J Haematol, 2017, 99, p. 449-458.
13. Jabor, A., Kubíček, Z., Komrsková, J. et al. Within-subject biological variation of pairs of heavy/light immunoglobulin IgM chains (HLC IgM κ and λ) is low and requires monitoring: A comparison with HLC IgA, HLC IgG, and free light immunoglobulin chains (FLC) in healthy subjects. Clin Chim Acta, 2018, 486, p. 311-312.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2018 Issue 4-
All articles in this issue
- Biologické účinky oxidu uhelnatého
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Ověření referenčního rozmezí volného trijodtyroninu v séru na analyzátoru Architect ci 16200
- Urolitiáza - efekt terapie indapamidem – kazuistika
- Realimentační syndrom po paleodietě
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Realimentační syndrom po paleodietě
- Urolitiáza - efekt terapie indapamidem – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

