-
Medical journals
- Career
Vplyv indukovanej hyperhomocysteinémie na kardiomyocyty v experimentálnom modeli
Authors: M. Kovalská 1*; L. Kovalská 2; P. Kaplán 3; M. Kmeťová 3; M. Furjelová 1,3; K. Jurková 1,3; M. Adamkov 1; I. Malachovský 2; Z. Tatakrová 3
Authors‘ workplace: Ústav histológie a embryológie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Slovensko 1; Klinika stomatológie a maxilofaciálnej chirurgie, Univerzitná nemocnica Martin, Martin, Slovensko 2; Ústav lekárskej biochémie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Slovensko 3
Published in: Klin. Biochem. Metab., 22 (43), 2014, No. 2, p. 81-86
Overview
Ciel štúdie:
Mnohé klinické ale aj experimentálne štúdie dokázali koreláciu medzi výskytom vaskulárnych ochorení a plazmatickou hladinou homocysteínu (Hcy). Jeho zvýšená koncentrácia v plazme je považovaná za nezávislý rizikový faktor vaskulárnej patológie. Prekročenie jeho nerizikovej hodnoty zvyšuje riziko infarktu myokardu až trojnásobne. Sledovali sme efekt chemicky indukovanej hyperhomocysteinémie (hHcy) na asociované zmeny proteínov MAPK/ERK (Mitogen Activated Protein Kinase/extracellular signal-regulated kinases) dráhy v kardiomyocytoch.Typ štúdie:
Experimentálna.Materiál a metódy:
Pre naše experimenty sme použili dospelé laboratórne potkany (samce) kmeňa Wistar. V sterilných podmienkach im bolo vyoperované srdce. Tkanivo bolo použité na prípravu homogenátov alebo pre imunohistologickú analýzu. Druhej skupine zvierat bol počas 14 dní pred experimentom subkutánne podávaný Hcy v množstve 0,45 µmol/g zvieraťa dvakrát denne, pričom im po uplynutí 14 dní bolo vyoperované srdce za rovnakých podmienok ako predchádzajúcej skupine. Srdcia boli následne napojené na Langendorffov perfúzny systém.Výsledky:
V našich experimentoch sme zaznamenali signifikantné zmeny kontraktility kardiomyocytov v Hcy skupine a teda pokles hodnôt indexov rýchlosti kontrakcie (+LV dP/dt) a relaxácie (-LV dP/dt) srdca o 30,94 %, respektíve 17,42 %. Taktiež sme zaznamenali štatisticky signifikantné zmeny medzi kontrolou a Hcy skupinou, a to nárast hladiny p-ERK proteínu až o 143 % (p<0,05) v Hcy skupine, čo korelovalo aj s imunohistochemickou analýzou.Záver:
Chemicky indukovaná 14dňová hHcy dokáže kardiomyocyty nepriaznivo ovplyvniť, a tým zvýšiť riziko vzniku poškodenia srdca.Kľúčové slová:
homocysteín, hyperhomocysteinémia, infarkt myokardu, MAPK.Úvod
Homocysteín (Hcy) zohráva dôležitú úlohu v patogenéze mnohých civilizačných chorôb ako sú nádorové ochorenia, predčasné starnutie, zápalové reumatické ochorenie kĺbov, predčasné pôrody a potraty, niektoré vrodené vývinové poruchy nervového systému, depresie, demencie vrátane Alzheimerovej choroby [1-2]. Dáva sa do súvisu i so vznikom chronického únavového syndrómu a niektorých ekzémov, s kožnými alergiami a s prieduškovou astmou. V ostatných rokoch je Hcy intenzívne študovaným rizikovým faktorom kardiovaskulárnych chorôb. Viaceré štúdie dokázali vzťah medzi miernou hyperhomocysteinémiou (hHcy), dysfunkciou endotelu a s predčasnou aterosklerózou. Hlavnou príčinou vzniku hHcy je deficit kyseliny listovej, vitamínu B12 a B6, homozygotná forma mutácie metyléntetrahydrofolát reduktázy (MTHFR) a porucha renálnych funkcií [1-4]. Toxický účinok Hcy sa vysvetľuje jeho priamym a/alebo nepriamym vplyvom na cievnu stenu, oxidačným stresom a poruchou koagulačnej rovnováhy [4-5]. Práce z posledných desiatich rokov poukázali na skutočnosť, že aj mierne zvýšená hladina Hcy (15-30 µmol/l) zvyšuje riziko vzniku aterosklerózy [2]. Je známe, že zvýšenú hladinu Hcy majú hlavne fajčiari, ktorí majú zároveň aj nízke hodnoty vitamínov skupiny B. Kyselina listová je schopná hladinu Hcy pomerne rýchlo a ľahko upraviť, a tak odstrániť zvýšené riziko infarktu. Dôvodom nedostatku kyseliny listovej je jej nedostatočný príjem potravou, alebo jej odbúravanie alkoholom, antikoncepčnými tabletami, niektorými liekmi ako sú spasmolytiká, sulfonamidy, antiepileptiká, antituberkulotiká, ale aj veľkými dávkami vitamínu C*. Asociácia zvýšenej hladiny Hcy s konvenčnými rizikovými faktormi aterosklerózy významne zvyšuje kardiovaskulárnu morbiditu a mortalitu [1, 5-6]. Prospektívne štúdie zaoberajúce sa rekurentnými kardiovaskulárnymi príhodami zaznamenali signifikantné zvýšenie sérovej koncentrácie Hcy o 5 µmol/l, ktorý následne viedol k nárastu rizika vzniku rekurentnej kardiovaskulárnej príhody o 16 % [7]. Experimentálne modely a menšie štúdie na pacientoch zahŕňajúce meranie endotelovej funkcie, markerov oxidačného stresu, zápalu a ich odpoveď na podávanie kyseliny listovej a vitamínu B12 priniesli pozitívne výsledky [8]. Doterajšie výsledky však poukazujú na skutočnosť, že podávanie kyseliny listovej a vitamínu B12 (s alebo bez pridania vitamínu B6) neprináša klinický benefit pacientom s kardiovaskulárnymi ochoreniami [2, 8]. Podľa najnovších údajov je bezriziková hodnota koncentrácie Hcy v plazme do 10 µmol/l. Mierna hHcy je najčastejšie spôsobená dedičným defektom aktivity 5,10-MTHFR. V dôsledku spomalenej remetylácie dochádza k zvýšeniu Hcy v plazme, pričom je cievny endotel vystavený jeho toxickým účinkom. Analýzy skupinových štúdií preukázali jednoznačnú pozitívnu asociáciu medzi koncentráciou Hcy v sére a ischemickou chorobou srdca (fatálny aj mierny srdcový infarkt) a mozgovou príhodou, kde sa riziko vzniku ochorenia zvyšovalo v prvom prípade o 15 % a v druhom o 24 % [3, 6]. Humphrey a kol. [1] dokázali, že rizikový faktor pre vznik koronárnej srdcovej choroby sa s každými 5 µmol/l Hcy zvýši o 20 %. Rowan a kol. [9] uvádzajú, že 51 % pacientov pokročilého veku, ktorí netrpeli demenciou boli postihnutí hHcy rôzneho typu ešte tri mesiace po mozgovej príhode. Podľa Kénina a kol., [6] až 50 % pacientov po mozgovej príhode trpí hHcy. V experimentálnych štúdiách in vivo bol rovnako dokázaný priamy vplyv Hcy na systolickú dysfunkciu srdca a na progres reaktívnej srdcovej fibrózy [2-3], na funkciu a morfológiu mozgu starnúcich potkanov [10] a potkanov s ischemicko-reperfúznym poškodením [11]. Výrazné poškodenie endotelových buniek sa doteraz dokázalo na mozgových, periférnych, srdcových a placentárnych cievach [1,3]. Dokáže však indukovaná hHcy ovplyvniť aj kardiomyocyty u laboratórnych zvierat? Doteraz nie je presne známe ako signálna transdukčná MAPK dráha a p-ERK proteíny, ktoré sú súčasťou tejto signalizačnej dráhy, môžu viesť k prežívaniu buniek po inzulte. Klinické, ale aj experimentálne štúdie potvrdili, že aktivovaná ERK zohráva dôležitú úlohu pri prežívaní buniek po rôznych inzultoch [12]. Pochopenie podstaty molekulovo-biologických mechanizmov prebiehajúcich v kardiomyocytoch laboratórnych zvierat, ktoré boli vystavené nadmernému účinku Hcy, by mohlo prispieť k pochopeniu zmien, ktoré nastávajú pri hHcy v kardiomyocytoch človeka. Detailné objasnenie patogenézy poškodenia týchto buniek by mohlo v budúcnosti prispieť k zefektívneniu vhodnej terapie pacientov s kardiovaskulárnymi ochoreniami.
Materiál a metódy
Pre naše experimenty sme použili dospelé laboratórne potkany (samce) kmeňa Wistar (Ústav experimentálnej farmakológie Slovenskej akadémie vied, Dobrá Voda) vo veku šesť až osem mesiacov s váhou 300-400 g v celkovom počte 16 kusov. Experimentálne zvieratá boli chované v štandardných podmienkach vo zverinci s klimatizáciou pri teplote 22±2 °C, s pravidelným striedaním svetla a tmy v 12 hodinových intervaloch a so začiatkom svetelnej fázy o 6 hodine ráno. Zvieratám bolo podávané krmivo so štandardným zložením obsahujúce všetky vitamíny. Prístup k potrave a vode boli zvieratám poskytnuté ad libitum. Experimentálne zvieratá boli rozdelené do dvoch skupín po osem kusov.
Zvieratá: Príprava izolovaných potkaních sŕdc a perfúzia
Fyziologický roztok: 0,15 mol/l NaCl
Krebs-Henseleitov roztok: 135 mmol/l NaCl, 5,4 mmol/l KCl, 0,9 mmol/l MgCl2, 24 mmol/l NaHCO3, 1,2 mmol/l NaH2PO4, 1,8 mmol/l, CaCl2, 10 mmol/l glukóza (pH 7,4)
A. Kontrolná skupina zvierat (K; 8 ks) bola anestezovaná so zmesou obsahujúcou 2,5 % halotanu, 30 % O2 a 70 % N2O, následne boli zvieratá usmrtené v súlade s etickými zásadami práce so zvieratami a následne bolo vyoperované srdce. Srdce bolo vložené do fyziologického roztoku s heparínom a ihneď nasadené na kanylu cez aortu srdca. Po kanylácii aorty bolo srdce pripojené na perfúzny systém (AD Instruments) a kontinuálne premývané Krebs-Henseleitovým roztokom, nasycovaným pneumoxidom (95 % O2 a 5 % CO2). Medzi odobratím srdca a začiatkom perfúzie zvyčajne uplynulo 30 sekúnd. V experimentoch sme použili Langendorffov model perfúzie srdca, pričom celý perfúzny systém bol prepojený s počítačom a všetky parametre sme zaznamenávali a spracovávali s využitím programu LabChart Pro Data Acquisition (Nemecko) po dobu 20 minút.
B. Zvieratá s podávaním homocysteínu (Hcy; 8 ks). Zvieratám v tejto skupine bol počas 14 dní pred experimentom subkutánne podávaný Hcy v množstve 0,45 µmol/g zvieraťa dvakrát denne podľa Matté a kol. [10]. Po 14 dňoch boli zvieratá anestezované so zmesou obsahujúcou 2,5 % halotanu, 30 % O2 a 70 % N2O, pričom celý postup, všetky podmienky pokusu ako aj podmienky odobratia tkanív boli totožné s predchádzajúcou skupinou zvierat. Uvedené experimenty so zvieratami boli schválené Etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského v Martine ako aj Štátnou veterinárnou a potravinovou správou v Bratislave.
Stanovenie Hcy v plazme zvierat
Zvieratá boli usmrtené v rozmedzí 18-20 h od poslednej dávky Hcy. Bola im odobratá krv do skúmaviek, ktoré obsahovali EDTA (kyselina etyléndiamintetraoctová). Krv bola následne scentrifugovaná a plazma bola uchovaná pri –80 °C. Celková hladina Hcy (tHcy) v plazme zvierat bola stanovená dvojreagenčnou enzymatickou metódou (Homocysteine liquidstable reagent kit, Erba Lachema, 50003526) pomocou chemického analyzátora (Siemens ADVIA 1650) na oddelení klinickej biochémie UNM v Martine.
Western blotting (WB) analýza
Na separáciu proteínov (40 µg), ktoré boli izolované z tkanív sŕdc, bola použitá polyakrylamidová gélová elektroforéza v prítomnosti dodecylsulfátu sodného (SDS-PAGE). Po ukončení separácie na SDS-PAGE boli gély inkubované v transferovom pufri (TGM) po dobu 5 minút a následne prenesené na nitrocelulózovú membránu metódou polosuchého (semi-dry) prenosu [13]. Na overenie transferu proteínov na membrány a vylúčenie artefaktov sa membrány farbili po dobu štyroch minút v Ponceau S. Membrány sa premyli v TBS-T a počas noci boli inkubované v blokovacom roztoku pozostávajúceho z Bloto non-fat dry milk (2,5 % w/v, Santa Cruz Biotechnology) a TBS-T. Po blokovaní sa premyté membrány na druhý deň inkubovali tri hodiny s primárnymi protilátkami p-ERK (riedenie 1 : 300, Santa Cruz, sc-7383) a β-aktínom (riedenie 1 : 500, Santa Cruz Biotechnology, sc-69879). Po premývaní boli membrány premyté 3 x 10 minút v roztoku TBS-T a za stáleho miešania na shakeri (Polymax 1040) sa membrány inkubovali jednu hodinu so sekundárnou protilátkou (riedenie 1 : 1000 anti-mouse IgG-HRP, Santa Cruz). Membrány sa po následnom dôkladnom premytí roztokom TBS-T (3x10 minút) inkubovali päť minút s roztokom ECL (Thermo Fisher Scientific) a chemiluminiscenčný signál príslušných bandov bol detegovaný na prístroji Molecular Imager Gel Doc XR System (Bio-Rad). Na vyhodnotenie intenzity signálov bola použitá bodová analýza použitím programu Gene Tools (SynGene).
Histologická analýza
Príprava tkaniva
Po odpojení z Langendorffovho perfúzneho systému boli tkanivá na 24 h ponorené do 4% paraformaldehydu v 0,1 mol/l fosfátovom tlmivom roztoku, pH 7,4 pri 4 °C. Následne boli tkanivá kvôli kryoprotekcii uložené 24 hodín v 30% sacharóze pri 4°C. Po postfixácii bolo srdcové tkanivo narezané na kryocut-e (Thermo Fisher Scientific) na hrúbku 30 µm, rezy boli natiahnuté na silanizované sklá a uskladnené pri -20°C.
Fluorescenčné imunohistologické farbenie kryorezov
Sklíčka s rezmi boli vybraté z -20°C a spracované podľa metódy Kovalska a kol. [14], pričom primárnu protilátku p-ERK (Santa Cruz, sc-7383) po riedení 1 : 100 sme nechali pôsobiť 24 hodín pri 4°C. Sekundárna protilátka goat-anti mouse s riedením 1 : 100 (Life Science, Alexa Fluor 488, A-11029) sme nechali pôsobiť dve hodiny v tme a pri laboratórnej teplote. Sklíčka boli montované do montovacieho média obohateného o DAPI (4’,6-diamidino-2-fenylindol), ktorý zvýrazňuje jadrá všetkých buniek (Fluoroshield, Sigma Aldrich, F6057). Pri hodnotení imunohistochemických farbení sme sledovali intenzitu imunoreakcie a počet pozitívnych kardiomyocytov s jadrovou a cytoplazmatickou lokalizáciou reakcie.
Matematické a štatistické vyhodnotenie
K štatistickému vyhodnocovaniu sme použili počítačový program GraphPad InStat V2.04a (GraphPad Software, Inc.). Výsledky sme udávali ako priemerné hodnoty, rozptyl hodnôt nameraných údajov ± štandardnú chybu priemeru (SEM). Štatisticky významné odchýlky v skúmaných parametroch boli vykonané analýzou premenných (ANOVA), vyhodnotené pomocou Student-Newman-Keulsovho testu. Rozdiely boli považované za štatisticky významné pri hodnote p<0,05.
Výsledky
V štúdiu účinku hHcy na funkciu srdca sme kontinuálne zaznamenávali jednotlivé parametre charakterizujúce činnosť srdca. Počas celého experimentu bola hodnota perfúzneho tlaku u kontrolnej skupiny stabilná a menila sa vo fyziologickom rozhraní 73,05 ± 2,15 mm Hg, avšak u skupiny vystavenej hHcy sme zaznamenali nárast na 79,16 ± 2,48 mm Hg. Štatisticky vyhodnotené základné parametre činnosti srdca sú uvedené v Tabuľke 1.
Table 1. Effect of hHcy on cardiac contractile function 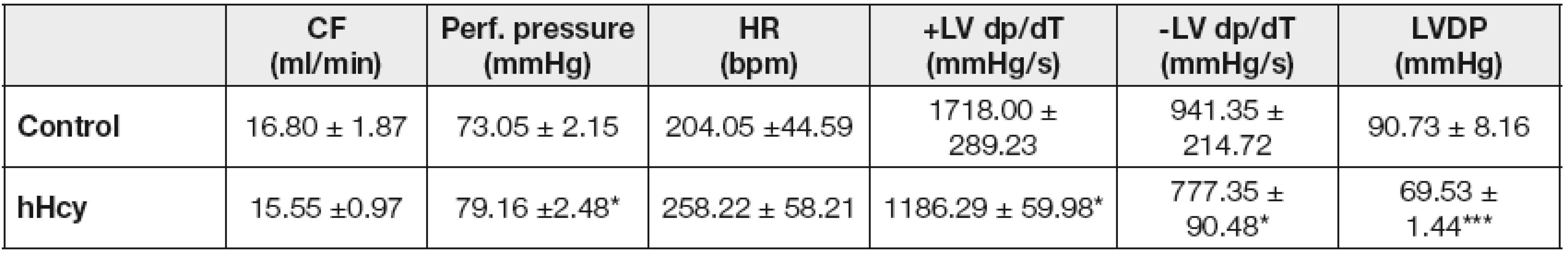
HR, heart rate; bmp, beats per minute, CF, coronary flow; LVDP, left ventricular end diastolic pressure; +LV dP/dt, maximum rate of pressure development; -LV dP, maximum rate of relaxation. Values are expressed as means ± SEM of 4 hearts. * p<0.05 and *** p<0.001; significantly different as compared to controls. Prietok koronárnou tepnou ako aj tepnová frekvencia myokardu po indukovanej hHcy sa významne neodlišovali od hodnôt nameraných u kontrolných sŕdc. Koncový ľavokomorový tlak (LVDP), ktorý je rozdielom ľavokomorového systolického a diastolického tlaku, signifikantne klesol o 23,36 % (p<0,001) u hHcy skupiny oproti kontrolnej skupine sŕdc. Podobne sme zaznamenali pokles hodnôt indexov rýchlosti kontrakcie (+LV dP/dt) a relaxácie (-LV dP/dt) srdca o 30,94 %, respektíve 17,42 %.
Vyšetrenia tHcy v plazme zvierat ukázali, že v kontrole so 14dňovou Hcy premedikáciou je hladina Hcy zvýšená oproti fyziologickým hodnotám Hcy v plazme potkanov kmeňa Wistar [15]. Nami stanovaná hladina Hcy v skupine s indukovanou hHcy bola 16,64 ± 1,38 µmol/l, pričom Martins a kol. [15] uvádzajú fyziologickú hodnotu hladiny Hcy v plazme 6 mesačných samcov potkanov kmeňa Wistar 6,42 ± 1,65 µmol/l.
V našich experimentoch sme ďalej sledovali zmeny v MAPK dráhe kardiomyocytov v asociácii s indukovanou hHcy u potkanov. Zaznamenali sme signifikantné zmeny medzi kontrolnou a Hcy skupinou a to nárast hladiny p-ERK proteínu až o 143 % (p<0,05; Obrázok 1) v Hcy skupine. Rovnako sme sledovali štatisticky významný nárast tak v cytoplazmatickej ako aj v jadrovej lokalizácii p-ERK proteínu v srdcových bunkách Hcy skupiny v porovnaní s kontrolou (obr 1). Zistili sme nárast počtu p-ERK+ buniek s cytoplazmatickou lokalizáciou o 266 % (p<0,001; obr. 2) a s jadrovou lokalizáciou o 600 % (p<0,001; obr. 2) v Hcy skupine v porovnaní s kontrolou. Naše výsledky naznačujú, že dochádza k aktivácií MAPK/ERK dráhy v kardiomyocytoch [16-17].
Fig. 1. A. Protein levels of p-ERK1/2 in the heart homogenates in control (K) and hyperhomocysteinemic group (Hcy). *P<0.05 represents statistically significant difference as compared to the controls. B. Western blot of β-Actin. C. Western blot of p-ERK (left). Fluorescent immunohistochemistry of p-ERK (green) in the heart of rat in control group (A) and in group with induced hHcy (B). The arrows (→) indicate cytoplasmic positivity and empty arrows (>) present nuclear positivity in the rat myocardium. Nuclei are co-stained with DAPI (4’,6-diamidino-2-phenylindole). Bar = 50 μm (right). 
Fig. 2. Comparison of numbers of p-ERK positive cells with cytoplasmic (c; left) and nuclear (n; right) co-localisation in control (K) and hyperhomocysteinemic group (Hcy). ***P<0,001 means statistically significant difference as compared to the controls. 
Diskusia
U pacientov s hHcy, ktorí prekonali infarkt myokardu [1] je zvýšený výskyt kardiovaskulárnych ochorení. V súčasnosti však mechanizmus poškodenia srdcového svalu pri hHcy nie je dostatočne objasnený [3]. Nás zaujímalo, či dokážeme u laboratórnych zvierat 14-dňovým podávaním Hcy vyvolať hHcy a či tá následne dokáže kardiomyocyty v určitom smere ovplyvniť. Chemicky vyvolaná hHcy u zvierat zodpovedala koncentrácii Hcy hladine, ktorá bola nameraná pacientom s hyperhomocysteinúriou [18] a dosahovala hodnoty miernej hHcy [15, 19]. Experimentálne štúdie dokázali pri mladých jedincoch potkana, že indukovanou 21dňovou hHcy dochádza k signifikantným zmenám v hepatocytoch redukciou antioxidačnej ochrany na jednom konci a fibrózou pečene na konci druhom [10]. Ďalší autori [18] uvádzajú, že pri hHcy potkanov dochádza k zvýšeniu aktivity matrixových metaloproteináz, ktoré zároveň podporovali remodeláciu svaloviny ľavej komory srdca [2]. Moshal a kol. [20] dokázali priamy vazodilatačný efekt Hcy na koronárne cievy. Naše výsledky taktiež poukazujú na to, že indukovaná hHcy u dospelých potkanov vedie k narušeniu normálnej funkcie srdca ako možno vidieť z niektorých vybraných parametrov v Tabuľke 1. Z našich výsledkov vyplýva, že indukovaná hHcy výrazne ovplyvňuje funkciu srdca na úrovni ľavokomorového tlaku, a to najmä vo fáze kontrakcie myokardu.
Z literatúry je známe, že zmeny v intracelulárnych signalizačných dráhach zohrávajú dôležitú úlohu v mechanizmoch poškodenia/protekcie po inzulte [14], preto sme ďalej v našej práci študovali jednu z MAPK dráh v srdcovom svale potkanov. V našich experimentoch sme sledovali zvýšenú hladinu p-ERK proteínov v skupine s umelo indukovanou hHcy, čím sme potvrdili aktiváciu MAPK/ERK dráhy. Následne je aktivovaný p-ERK translokovaný do jadra (obr. 1), kde aktivuje transkripčné faktory, ktoré zabránia nástupu bunkovej smrti [16-17]. Z našich výsledkov vyplýva, že umelo indukovaná hHcy aktivuje adaptačný mechanizmus kardiomyocytov, kedy paradoxne dochádza k prežívaniu buniek. Na druhej strane, štúdie Balakumara a kol. [21-22] a Singha a kol. [23], ktoré sledovali vplyv ischemickej tolerancie na umelo indukovanú hHcy potkanov, sú v súlade s nami získanými výsledkami. Po indukovaní hHcy u potkanov a následným vyvolaním ischemickej tolerancie zaznamenali títo autori paradoxne horšie výsledky u zvierat ako po samotnom ischemickom inzulte. Poddar a Paul [5], zistili na bunkových líniách nervového tkaniva za podmienok in vitro, že po chemickej indukcii hHcy dochádza k aktivácii MAPK/ERK dráhy. Detegovali vyššiu hladinu p-ERK2 proteínov, u ktorých bol dokázaný priamy pro-apoptotický účinok, čo je v zhode s našimi výsledkami. Títo autori ďalej uvádzajú, že v závislosti od typu a dĺžky pôsobenia inzultu je aktivita MAPK/ERK dráhy spočiatku vysoká, ale postupne klesá a je nahradená aktivovaním iných MAPK dráh, ktoré súvisia s navodením bunkovej smrti, alebo nástupom zápalovej reakcie [5]. Predpokladáme, že podobná situácia nastáva aj v srdcovom tkanive. V neposlednom rade musíme uvažovať aj o možnom protektívnom vplyve kyseliny listovej, ktorá je zložkou potravy laboratórnych zvierat. Vzhľadom k tomu, že bol zvieratám podávaný Hcy v rovnakom množstve, predpokladáme, že hladina vitamínov v potrave nebude závisieť od endogénnych rozdielov v hladinách kyseliny listovej a nemala by teda ovplyvňovať indukovanú hHcy u zvierat. Na druhej strane, zatiaľ sa nepodarilo dokázať pozitívnu koreláciu medzi hHcy a dlhodobím užívaním kyseliny listovej ako prevencie vzniku, či rekurencie napr. žilovej trombózy a embolických prejavov, aterosklerózy, a pod. [2, 7, 24-25]. Z pohľadu patogenézy je nutné v budúcnosti detailne objasniť úlohu hHcy pri kardiovaskulárnych ochoreniach, možné terapeutické využitie a tiež vplyv znižovania hladiny Hcy pri pacientoch s vaskulárnym ochorením.
Záver
Naše výsledky dokazujú, že hHcy vplýva na zmeny p-ERK proteínov v srdci laboratórnych zvierat. Preto práve experimentálne štúdie na potkanoch môžu mať veľký význam a prínos aj pre humánnu medicínu. Ďalej naše výsledky poukazujú na široký záber pôsobenia adaptačného mechanizmu MAPK signálnej transdukčnej dráhy v tkanive myokardu a rozširujú poznatky o mechanizmoch regulácie post-translačných zmien v intracelulárnych dráhach MAPK/ERK v odpovedi na hHcy. Indukovanou hHcy sme u potkanov paradoxne miesto aterosklerózy vyvolali určitú formu, pravdepodobne dočasnej, adaptácie srdcového tkaniva. V ďalších experimentoch sa zameriame na poškodenie, ktoré vznikne v kombinácii ischemického inzultu a hHcy. Uvedené výsledky v konečnom dôsledku môžu ovplyvniť terapeutický prístup k pacientom s kardiovaskulárnymi ochoreniami.
Táto práca bola podporená projektmi VEGA 213/12, 1/0050/11, 1/0129/14 a GUK/141/2013.
Do redakce došlo 23. 12. 2013
Adresa pro korespondenci
RNDr. Mária Kovalská, Ph.D.
Univerzita Komenského v Bratislave
Jesseniova lekárska fakulta v Martine
Ústav histológie a embryológie
Malá Hora 4, 036 01 Martin
e-mail: kovalska@jfmed.uniba.sk
telefón: +421432633445
Sources
1. Humphrey, L. L., Fu, R., Rogers, K., Freeman, M., Helfand, M. Homocysteine level and coronary heart disease incidence: a systematic review and meta-analysis. Mayo. Clin. Proc., 2008, 83(11), p. 1203-12.
2. Vizzardi, E., Bonadei, I., Zanini, G., et al. Homocysteine and heart failure: an overview. Recent Pat. Cardiovasc. Drug Discov., 2009, 4(1), p. 15-21.
3. Kolling, J., Scherer, E. B., da Cunha, A. A., da Cunha, M. J., Wyse, A. T. Homocysteine induces oxidative-nitrative stress in heart of rats: prevention by folic acid. Cardiovasc. Toxicol., 2011, 11(1), p. 67-73.
4. Šamudovská, K., Podracká Ľ. Homocysteín ako vaskulárny toxín. Interná med., 2009, 9(11), p. 522-526.
5. Poddar, R., Paul, S. Novel crosstalk between ERK MAPK and p38 MAPK leads to homocysteine-NMDA receptor-mediated neuronal cell death. J Neurochem., 2013, 124(4), p. 558-70.
6. Kénina, V., Auce, P., Priede, Z., Millers, A., Smeltere, E. Homocysteine, Atherothrombosis, and Stroke. Neurologijos seminarai. 2009, 13(41), p. 139–142.
7. Čaprda, M., Rašlová, K. Súčasný pohľad na homocysteín vo svete poznatkov z klinických štúdii. Interná med., 2006, 6, p. 344-347.
8. Devlin, A. M, Arning, E., Bottiglieri, T., Faraci, F. M., Rozen, R., Lentz, S. R. Effect of Mthfr genotype on diet-induced hyperhomocysteinemia and vascular function in mice. Blood, 2004, 103, p. 2624-2629.
9. Rowan, E. N., Dckinson, H. O., Stephens, S., Ballard, C., Kalaria, R., Kenny, R. A. Homocysteine and post-stroke cognitive decline. Age and Ageing, 2007, 36(3), p. 339-343.
10. Matté, C., Mussulini, B. H. M., Santos, T. M., et al. Hyperhomocysteinemia reduces glutamate uptake in parietal cortex of rats. Int. J Dev. Neurosci., 2010, 28(2), p. 183-187.
11. Kovalská, M., Kovalská, L., Furjelová, M., Adamkov, M., Lehotský, J. Indukovaná hyperhomocysteinémia a ischemické poškodenie mozgu. Slovenský lekár, 2012, 22(36), p. 46-51.
12. Lee, C. H., Yoo, K. Y., Park, O. K. et al. Phosphorylated Extracellular Signal-Regulated Kinase 1/2 Immunoreactivity and Its Protein Levels in the Gerbil Hippocampus during Normal Aging. Mol. Cells., 2010, 29, p. 373-378.
13. Tatarkova, Z., Engler, I., Calkovska, A. et al. Effect of long-term normobaric hypoxia on oxidative stress in mitochondria of the guinea pig brain. Neurochem. Res., 36, p. 1475–1481.
14. Kovalska, M., Kovalska, L., Pavlikova, M. et al. Intracellular Signaling MAPK Pathway After Cerebral Ischemia–Reperfusion Injury. Neurochem. Res., 2012, 37, p. 1568–1577.
15. Martins, P. J. F, Galdieri, L. C., Souza, F. G. et al. Physiological variation in plasma total homocysteineconcentrations in rats. Life Sci., 2005, 76, p. 2621–2629.
16. Zhang, J., Bian, H. J., Li, X. X. et al. P. ERK-MAPK Signaling Opposes Rho-Kinase to Reduce Cardiomyocyte Apoptosis in Heart Ischemic Preconditioning. Mol. Med., 2010, 16(7-8), p. 307-315.
17. Yue, T. L., Wang, C., Gu, J. L. et al. Inhibition of extracellular signal-regulated kinase enhances ischemia/reoxygenation-induced apoptosis in cultured cardiac myocytes and exaggerates reperfusion injury in isolated perfused heart. Circ. Res., 2000, 86, p. 692–699.
18. Mudd, S. H., Levy, H.L., Skovby, F. Disorders of transsulfuration. In C. R. Scriver, A. L. Beaudet, W. S. The metabolic and molecular basis of inherited disease. New York: McGraw-Hill, 2001, 2, p. 1279 - 1327.
19. Miller, A., Mujumdar, V., Palmer, L., Bower, J. D., Tyagi, S. C. Reversal of endocardial endothelial dysfunction by folic acid in homocysteinemic hypertensive rats. Am. J Hypertens., 2002, 15, p. 157 - 163.
20. Moshal, K. S., Metreveli, N., Frank, I., Tyagi, S. C. Mitochondrial MMP activation, dysfunction and arrhythmogenesis in hyperhomocysteinemia. Curr. Vasc. Pharmacol., 2008, 6(2), p. 84-92.
21. Balakumar, P., Harsimran, S., Snigh, M., Anad-Srivastava, M. B. The impairment of preconditioning-mediated cardioprotection in pathological conditions. Pharmacol. Res., 2009, 60, p. 18-23.
22. Balakumar, P., Rohilla, A., Snigh, G., Snigh, K., Snigh, M. Modulation of cardioprotective effect of ischemic pre - and postconditioning in the hyperhomocysteinemic rat heart. Methods Find Exp. Clin. Pharmacol., 2009, 31(2), p. 71-79.
23. Snigh, G., Rohilla, A., Snigh, M., Balakumar, P. The possible Role of JAK-2 in Attenuated Cardioprotective Effect of Ischemic Preconditioning in Hyperhomocysteinemic Rat Hearts. Yakugaku Zasshi, 2009, 129(5), p. 523 - 535.
24. Herrmann, M., Muller, S., Kindermann, I. et al. Plasma B vitamins and their relation to the severity of chronic heart failure. Am. J. Clin. Nutr., 2007, 85, p. 117-123.
25. Witte KK, Nikitin NP, Parker AC, et al. The effect of micronutrient supplementation on quality-of-life and left ventricular function in elderly patients with chronic heart failure. Eur. Heart J., 2005, 26, p. 2238-2244.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2014 Issue 2-
All articles in this issue
- Diagnostika a stratifikace systémové AL amyloidózy ve světle „Doporučení České myelomové skupiny 2013“
- Klinická problematika IgM monoklonálních gamapatií
- Detekce hereditárních amyloidóz
- Rizikové faktory asymptomatického mnohočetného myelomu
- Úroveň analytické kvality glukometrů
- Vplyv indukovanej hyperhomocysteinémie na kardiomyocyty v experimentálnom modeli
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinická problematika IgM monoklonálních gamapatií
- Rizikové faktory asymptomatického mnohočetného myelomu
- Úroveň analytické kvality glukometrů
- Diagnostika a stratifikace systémové AL amyloidózy ve světle „Doporučení České myelomové skupiny 2013“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

