-
Medical journals
- Career
Detekce hereditárních amyloidóz
Authors: Z. Kufová 1,2,3; S. Ševčíková 1,4; R. Hájek 1,2,3,4
Authors‘ workplace: Babákova myelomová skupina, Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Brno 1; Klinika hematoonkologie, Fakultní nemocnice Ostrava 2; Lékařská fakulta, Ostravská univerzita v Ostravě 3; Oddělení klinické hematologie, Fakultní nemocnice Brno, Brno 4
Published in: Klin. Biochem. Metab., 22 (43), 2014, No. 2, p. 65-69
Overview
Amyloidóza je označení pro skupinu heterogenních onemocnění, která vedou k extracelulární depozici amorfních hmot proteinové povahy. Tyto hmoty mohou způsobit změny v orgánech a tkáních vedoucí k jejich nevratnému poškození nebo dokonce k smrti jedince. Celosvětově udávaná incidence amyloidózy je 10/100 000, přesné údaje z České republiky však nejsou známy. Specifickým typem amyloidózy, jež se vyskytuje asi u jednoho pacienta ze 100 000, je hereditární amyloidóza, jejíž příčinou je vrozená patologická mutace v některém z genů kódujícím prekurzory amyloidních vláken, nejčastěji v genu pro transthyretin (TTR). V České republice však záchyt nemocných s hereditární amyloidózou zatím nedosahuje hodnot celosvětové udávané incidence. V současné době roste zájem o zdokonalení diagnostiky amyloidózy směrem, který by komplexně pokryl screening všech genů spojených s hereditární amyloidózou v jednom diagnostickém setu. Důvodem je možná dědičnost této mutace v rámci rodiny a fakt, že dřívější záchyt může pozitivně ovlivnit průběh léčby. Tato práce shrnuje současné poznatky o hereditární transthyretinové amyloidóze, její diagnostice a aktuálních trendech ve výzkumu.
Klíčová slova:
amyloidóza, genomika, sekvenování.Úvod
Amyloidózy jsou onemocnění, pro které je typické extracelulární, homogenní ukládání amorfních hmot proteinové povahy, jež vykazují strukturu β-skládaného listu [1]. Jsou obtížně diagnostikovatelné, mají řadu shodných vlastností, ale rozdílný klinický průběh. Incidence onemocnění je celosvětově udávána 10/100 000 [2]. Amyloidóza je ale obtížně diagnostikovatelné onemocnění i pro zkušené hematology a patology. Nedostatečně zvládnuté diagnostické metodiky jsou často důvodem falešně negativních vyšetření. Četnost amyloidózy v České republice zatím bohužel není přesně známá [3], zcela jistě však není pozorováno 100 nových nemocných s amyloidózou ročně. Je tedy potřeba zejména zpřesnit diagnostiku a především na toto onemocnění myslet a indikovat při typických příznacích vyšetření vedoucích k diagnostice amyloidózy.
Dle příčiny zvýšené produkce prekurzoru dělíme amyloidózy na získané a hereditární. Mezi získané amyloidózy řadíme AL (amyloid light chain) amyloidózu, která se vyskytuje samostatně nebo u nemocných s monoklonálními gamapatiemie, především trpících mnohočetným myelomem, lymfomy nebo Waldenströmovou makroglobulinémií. Jedná se o nejčastější typ amyloidózy a amyloidním prekurzorem jsou lambda nebo kappa volné lehké řetězce imunoglobulinů [4]. Druhým nejčastějším typem získané amyloidózy je tzv. AA amyloidóza (amyloid A amyloidosis). AA amyloidóza může být způsobena dlouho trvajícím zánětlivým onemocněním (např. revmatoidní artritida) nebo dědičným zánětlivým onemocněním (např. familiární středozemní horečka) [5]. Třetím typem je amyloidóza charakterizovaná zvýšenou hladinou β2-mikroglobulinu, který se podílí na tvorbě amyloidu. Je také známá pod pojmem dialyzační amyloidóza a řadí se mezi amyloidózy získané, byla u ní však prokázaná i hereditární forma [6]. Hereditární formy amyloidózy jsou způsobeny mutací v genu, který kóduje prekurzorový protein potřebný pro vznik amyloidu [7].
Amyloidózy lze dělit podle ložiska vzniku na lokalizované amyloidózy, kde k depozici amyloidu dochází pouze v jednom orgánu, tkáni nebo orgánové soustavě, nebo systémové amyloidózy, charakterizované depozicí ve více orgánech nebo tkáních. Dále lze tato onemocnění dělit podle typu amyloidogenního proteinu, přičemž každý typ amyloidózy má svůj specifický fibrilární prekurzor. Do dnešní doby je známo 30 těchto prekurzorů [7].
Amyloidový fibrilární protein je definován jako protein, který je součástí amyloidových depozit v tkáních. Barví se pozitivně Kongo červení a v polarizovaném světle vykazuje zelený dichroismus [8]. Ke vzniku depozita amyloidu dochází agregací původně solubilní formy proteinu, což je následek různých poruch životního cyklu proteinu odrážející jeho abnormální konformaci. Při vzniku onemocnění je důležitá kinetika tvorby a zároveň narušená schopnost degradace amyloidových prekurzorů [9,10]. Zvýšená koncentrace amyloidových prekurzorů v séru může být způsobena nadměrnou produkcí či nedostatečným vylučováním proteinu. Roli hraje také abnormální finální proteolýza v tkáních, modifikace proteinů a u hereditární amyloidózy mutace v genu. Úloha patogeneze v depozici amyloidu je však stále nejasná [11]. Princip poškození je u všech typů amyloidóz podobný, depozita amyloidových fibril se ukládají v tkáních a orgánech, které závažně poškozují. Podle typu amyloidózy dochází k poškození určitého orgánu, tkáně nebo orgánové soustavy, které vede zpravidla k jeho selhání a následné smrti [8].
Tato práce se zaměřuje na popis diagnostických genetických metod pro zlepšení situace v oblasti diagnostiky hereditární TTR amyloidózy a stručně zmiňuje i léčebné možnosti. Přesto, že se jedná o onemocnění raritní, jistě by nemělo být opomíjené.
Hereditární TTR amyloidóza a genetická diagnostika
Hereditární amyloidóza je typem amyloidózy, který je způsoben patologickou mutací v genu kódujícího prekurzorový protein důležitý pro tvorbu amyloidu. V porovnání se získanými amyloidózami se jedná o vzácnější diagnózu. Celkový počet genů spojovaných se vznikem amyloidózy se k dnešnímu dni pohybuje kolem 22 (Tabulka 1) [7].
Table 1. List of genes, which are associated with hereditary amyloidosis 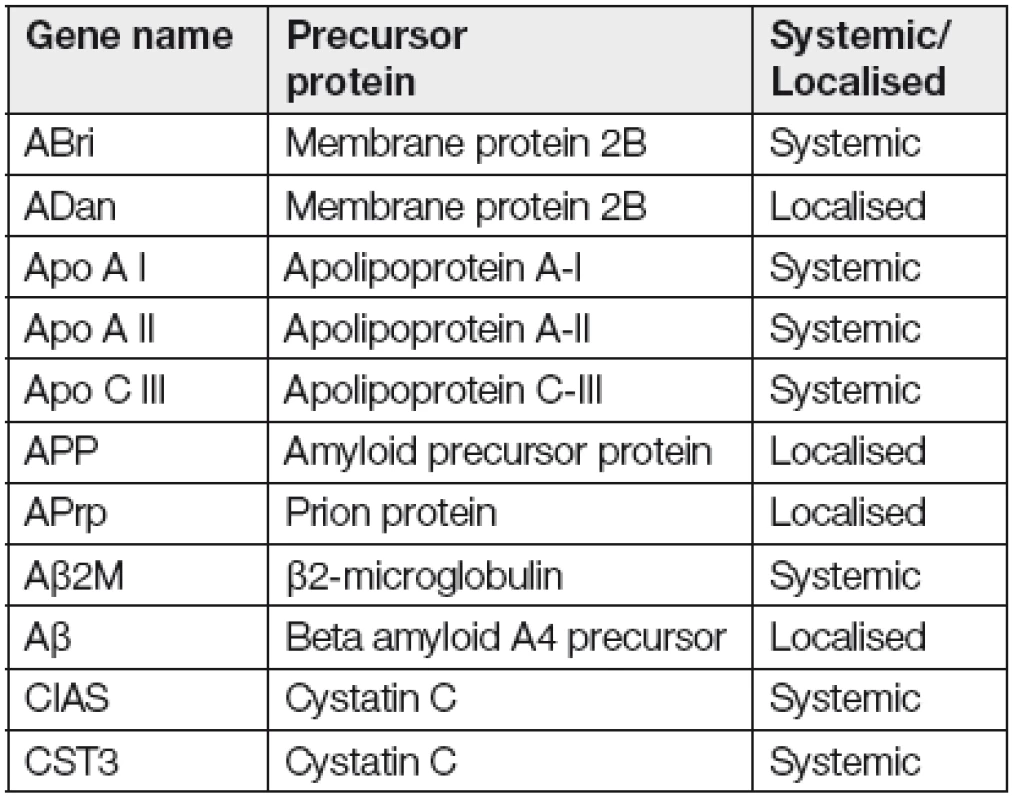
Nejčastěji mutovaným genem bývá TTR (transthyretin), dále pak gen kódující apolipoprotein A-I, lysozym, gelsolin, fibrinogen aj., ve kterých se mutace nevyskytují tak často [12-14]. Gen TTR kódující protein transthyretin je lokalizován na chromozomu 18 a skládá se ze čtyř exonů a pěti intronů. Mutace v genu vedou k destabilizaci proteinu, který následně snadněji vytváří amyloidovou strukturu [15]. K dnešnímu dni bylo popsáno v TTR genu 120 mutací, všechny autozomálně dědičné s rozdílnou penetrancí. Jedná se o bodové mutace zahrnující jedno - nebo dvounukleotidové substituce, v raritních případech delece celého kodónu nebo mutace v genové oblasti UTR („untranslated region“). Nejčastěji vyskytující se mutací je jednonukleotidová substituce způsobující záměnu valinu na pozici 30 za methionin. Transthyretin je plazmatický protein skládající se ze 127 aminokyselin kolující jako homomerní tetramer, je syntetizován v játrech, v plexus choroideus v mozku a v retině a zastává roli transportního proteinu pro thyroxin a retinol. Mutovaný protein však koluje ve formě monomerů s extendovanou strukturou β-skládaného listu, která je jedním z předpokladů ke vzniku amyloidových fibril [16,17]. Obr. 1 ukazuje pět možných variant tetramerů u mutací TTR genu [18].
Fig. 1. Scheme shows five possible variants of tetramer, which can be present by heterozygotes with mutation of TTR gene. M (mutation in monomer); N (normal monomer) (adapted from the Benson, 2013). 
Mutovaný protein, ačkoliv je přítomný od narození, vyvolává příznaky onemocnění se zpožděním dvou až pěti dekád a jednotlivé mutantní varianty se projevují klinicky heterogenně, dle druhu přítomné mutace v genu. Komplikovanost onemocnění dále zvyšuje vysoká fenotypová heterogenita, která je ovlivňována řadou faktorů, např. přítomnost polymorfismů, geografický původ, pohlaví, věk, aj [7].
Prozatím jediným schváleným lékem určeným k léčbě transthyretinové amyloidózy v Evropě od roku 2011 je Tafamidis meglumine (Pfizer Inc, NY, USA). Jedná se o nesteroidní protizánětlivý lék, který se váže v oblasti HBS („hormone binding site) transthyretinu, a tím tetramer stabilizuje. HBS je oblastí, na kterou se váže hormon (v případě transthyretinu hormon thyroxin), většina kolujících molekul transthyretinu jí však má neobsazenou, tudíž je využívána jako cíl pro navázání stabilizujícího léku [19, 20]. Jeho pozitivní účinky byly prokázány u nemocných s FAP (Familiální amyloidní polyneuropatie), kde až u 60 % z nich nedošlo během šesti let k žádnému zhoršení stavu [21]. Studie účinků Tafamidisu pro léčbu nemocných s FAC (familiární amyloidní kardiomyopatie) nebo SSA (senilní systémová amyloidóza) zatím nebyla provedena, je však plánované jejich spuštění.
Zatím jediným dostupným a účinným postupem, díky kterému lze dosáhnout vyléčení hereditární TTR amyloidózy, je transplantace. Transplantace závisí na druhu postiženého orgánu (srdce nebo játra), jsou však známy i případy, u kterých byly transplantovány jak játra, tak srdce. Nejvhodnějšími kandidáty pro transplantaci jater jsou jedinci s mutací Val30Met, ani to však nemusí být vždy zárukou úspěchu léčby, z důvodu komplikací, které mohou po transplantaci nastat [18]. Jedná se o velmi invazivní způsob léčby nevhodný pro vzácné mutantní varianty transthyretinu. V některých případech se používá tzv. domino transplantace, při které jsou játra osoby postižené amyloidózou dále transplantována dárci s jiným postižením jater (např. hepatocelulární karcinom, cirhóza). Takto transplantovaná játra od jedince trpícího hereditární TTR amyloidózou mohou totiž nemocného poškodit depozicí amyloidu nejdříve za 20-50 let a svoji funkci v organismu mohou plnit zpravidla řadu let [22].
Amyloidóza spojená s mutací v TTR zahrnuje dvě formy klinické manifestace, a to familiární amyloidní polyneuropatii (FAP) a familiární amyloidní kardiomyopatii (FAC). Při FAC se amyloid hromadí primárně v srdci a vede k srdečnímu selhání, u FAP dochází k primárnímu poškození a hromadění amyloidu především v periferních nervech, trávicím traktu nebo v očním sklivci. Světová incidence FAP je udávána 1/ 100 000, incidence FAC je dosud neznámá, incidence pro Českou republiku jsou neznámé v obou případech. Nejčastěji se vyskytujícím příznakem FAP v raném stádiu amyloidózy bývá syndrom karpálního tunelu, který zároveň u některých případů může zůstat projevem jediným [22, 23]. Zajímavým objektem ve studiu amyloidóz je jejich penetrance. Ve švédské populaci se mutace Val30Met (záměna valinu na pozici 30 za methionin) vyskytovala s nízkou penetrancí a s pozdním nástupem nemoci (věkový průměr 55-60 let) [24], zatímco v Portugalsku se ta samá mutace projevovala s vysokou penetrancí a nástup nemoci byl mezi věkem 30-35 let [25]. Někteří výzkumníci se zaměřili na studium monozygotních dvojčat trpících hereditární amyloidózou se snahou vysvětlit rozdíly v penetranci, dosud však nebyly přesně vysvětleny. Velký význam v rozdílech v penetranci má geografický původ a s ním související rozdílné životní podmínky.
S transthyretinem je spojená také nedědičná formy amyloidózy nazývaná senilní systémová amyloidóza (SSA). Vyskytuje se především u mužů starších 60 let, se zvyšujícím se věkem její výskyt rapidně narůstá (v 90 letech až u 50 % jedinců mužského pohlaví). U SSA dochází k agregaci „wild-type“ alely transthyretinu, zřejmě způsobená poruchou mechanismu proteolýzy, přesné vysvětlení mechanismu však dosud není známé. Depozicí amyloidu dochází u malé kohorty jedinců k srdeční dysfunkci. Nález SSA bývá často až nálezem pitevním [26]. Jako možná alternativa v léčbě FAC a SSA se nabízí lék Diflunisal (Merck & CO.), jedná se stejně jako v případě Tafamidisu o nesteroidní protizánětlivý lék, který může stabilizovat tetramer TTR in vitro, a tím předchází tvorbě amyloidních fibril a jejich depozici v srdci [27]. Zatím je tento lék v Evropě i USA ve fázi testování a schvalování pro použití v léčbě FAC a SSA [28].
Diagnostika amyloidóz spočívá ve stanovení mutace, která způsobí záměnu aminokyseliny. Dříve se jako diagnostický standard používala metoda stanovení polymorfismu délky restrikčních ramének (RFLP), která však neumožňuje zjištění konkrétního druhu záměny, pouze prokazuje přítomnost či nepřítomnost mutace. Dnešním standardem je však stanovení pomocí Sangerova sekvenování, na některých pracovištích již pomocí sekvenování nové generace („next generation sequencing“), které umožňuje vyšetřit kompletní diagnostický set všech genů hereditární amyloidózy najednou. Samotnému sekvenování často předchází barvení vzorků abdominálního tuku popř. biopsií tkání pomocí Kongo červeně, které je jednoduchou metodou stanovení depozit amyloidu. Barvení konžskou červení je jednoduchá a levná „prediagnostická“ metoda a její senzitivita se pohybuje kolem 80 % [29]. Po pozitivním výsledku u konžského barvení, a pokud nebyla zcela jasně stanovena diagnóza AL nebo AA amyloidózy, by měl být každý podezřelý nemocný vyšetřený na přítomnost některé z mutací. Výhodou sekvenování nové generace je úspora času, kterého by bylo vynaloženo pro sekvenování genů jednotlivě, a získání kompletního genetického profilu všech vybraných genů. Pro úplnost vyšetření by jedincům měla být poskytována konzultace zjištěných výsledků s klinickým genetikem. Jedinci, u nichž byla diagnóza potvrzena, by měli být dostatečně informováni o rizicích, která s sebou onemocnění přináší, o způsobu léčby, objasnění podstaty onemocnění a případném výskytu této nemoci u plánovaných potomků.
Závěr
U hereditární amyloidózy v dnešní době existuje již velké množství poznatků, které umožňují a usnadňují velice dobrý záchyt této nemoci v populaci. Důležitým aspektem je včasný záchyt onemocnění, neboť závažné poškození orgánů je limitujícím faktorem pro kvalitu života. Pozdní diagnostika bývá rovněž příčinou zvýšených ekonomických nákladů, což je dáno závažným poškozením orgánů a souvisejícími komplikacemi. Především však včasný záchyt zabraňující dalšímu rozvoji nemoci a poškozování orgánů může nemocným prodloužit život v 50 % případů až o 10 let [30]. Stav diagnostiky hereditární amyloidózy v České republice má zlepšující se tendenci, ne vždy však byly podmínky pro diagnostiku tak dobré. I přes předpokládaný nízký výskyt nově zjištěných diagnóz ročně v České republice (přibližně deset), by nemělo být toto onemocnění stavěno na samý okraj zájmu, zvláště proto, že genetická diagnostika je velice efektivním, jednoduchým a přesným nástrojem pro stanovení onemocnění. Dalším z faktorů, proč se vlastně zabývat diagnostikou tak vzácné nemoci, je možné riziko přenosu v rodině, kde je pravděpodobnost pro potomky 50%, což určitě není zanedbatelné. Takovýmto rodinám je poskytnuto následné genetické poradenství pro jednotlivé členy, při němž se zkoumá rodinná historie tohoto onemocnění. Rozdíly v průběhu onemocnění mohou nastat nejen mezi jednotlivými etnickými skupinami, ale také mezi rodinami, které jsou nositeli stejné mutace nebo v rámci jedné rodiny se stejnou mutací. Stále však zůstává mnoho molekulárně-genetických faktorů a vlivů prostředí, ovlivňujících průběh amyloidózy, které zatím jsou nevysvětlené. Oblast diagnostiky a výzkumu má však tendenci rychle se vyvíjet, můžeme tedy očekávat pokroky v objasnění mechanismů patogeneze tohoto heterogenního onemocnění.
Tato práce byla podpořena grantem Ministerstva zdravotnictví OZS/7a/4142/2013: Amyloidóza-národní kooperační a mezinárodní integrační akční plán pro Českou republiku. Podpořeno MZ ČR - RVO - FNOs/ 2012. Projekt byl rovněž financován v rámci Institucionálního rozvojového plánu OU v Ostravě v roce 2012. Finanční prostředky přiděluje MŠMT.
Do redakce došlo 27. 2. 2014
Adresa pro korespondenci:
prof. MUDr. Roman Hájek, CSc.
Lékařská fakulta, MU
Kamenice 5 / pavilon A3
625 00 Brno
roman.hajek@fno.cz
Sources
1. Sipe, J. D., Benson. M. D., Buxbaum. J. N. et al. Amyloid fibril protein nomenclature: recommendations from the Nomenclature Committee of the International Society of Amyloidosis. Amyloid, 2012, 19, p. 167–70.
2. Kyle, R. A., Linos, A., Beard, C. M. et al. Incidence and natural history of primary systemic amyloidosis in Olmsted County, Minnesota, 1950 through 1989. Blood, 1992, 79(7), p. 1817-22.
3. Adam, Z., Krejčí, M., Simonides, J. Choroby způsobené ukládáním monoklonálních imunoglobulinů. Postgraduální medicína, 2011, 9, p. 1009.
4. Kyle, R. A., Gertz, M. A. Primary systemic amyloidosis, clinical and laboratory features in 474 cases. Semin. Hematol., 1995, 32, p. 45–59.
5. Lachmann, H. J., Goodman, H. J., Gilbertson, J. A. et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med., 2007, 356, p. 2361–71.
6. Valleix, S., Gillmore, J. D., Bridoux, F. et al. Hereditary systemic amyloidosis due to Asp76Asn variant b2-microglobulin. N Engl J Med., 2012, 366, p. 2276–83.
7. Hazenberg, B. P. C. Amyloidosis: A clinical overview. Rheum. Dis. Clin. N. Am. 2013, 39, p. 323–345.
8. Merlini, G., Belloti V. Molecular mechanism of amyloidosis. The New England Journal of Medicine. 2003, 349, p. 583-96.
9. Buxbaum, J. N., Linke, R. P. A molecular history of the amyloidosis. J. Mol. Biol. 2012, 421, p.142-159.
10. Gillam, J. E., Macphee, C. E. Modelling amyloid fibril formation kinetics: mechanisms of nucleation and growth. J Phys Condens Matter. 2013, 25(37), p. 373101.
11. Miyata, T., Iida, Y., Ueda, Y. et al. Monocyte/macrophage response to beta 2-microglobulin modified with advanced glycation end products. Kidney Int. 1996, 49(2), p. 538-50.
12. Benson, M. D. Inherited amyloidosis. J. Med. Genet. 1991, 28, p. 73-78.
13. Ghiso, J., Haltia, M., Prelli, F., Novello, J., Frangione, B. Gelsolin variant (Asn-187) in familial amyloidosis, Fin-nish type. Biochem. J. 1990, 272, p. 827-830.
14. Uemichi, T., Liepnieks, J., Benson, M. D. Hereditary renal amyloidosis with a novel variant fibrinogen. Journ. of Clin. Investig. 1994, p. 731-736.
15. Lastovičková, J. Hereditární amyloidóza s defektem transthyretinu a její neurologické projevy. Neurol. Praxi. 2011, 12(2), p. 142-144.
16. Jing-Yao, L., Ying-Jie, G., Chun-Kui, Z. et al. Clinical and histopatological features of familial amyloidotic polyneuropathy with transthyretin Val30Ala in a Chinese family. Journ. Neurol. Sci. 2011, 304, p. 83-86.
17. Benson, M. D., Kincaid, J. C. The molecular bio-logy and clinical features of amyloid neuropathy. Muscle Nerve. 2007, 36, p. 411-423.
18. Benson, M. D. Liver transplantation and transthyretin amyloidosis. Muscle Nerve. 2013, 47(2), p. 157-162.
19. Sant’Anna, R. O., Braga, C. A., Polikarpov, I. et al. Inhibition of human transthyretin aggregation by non-steroidal anti-inflammatory compounds: A structural and thermodynamic analysis. Int. J. Mol. Sci. 2013, 14, p. 5284-5311.
20. Merlini, G., Planté-Bordeneuve, V., Judge, D. P. et al. Effects of tafamidis on transthyretin stabilization and clinical outcomes in patients with non-Val30Met transthyretin amyloidosis. J. of Cardiovasc. Res. 2013, 6, p. 1011-1020.
21. Coelho, T., Maia, L. F., Martins da Silva, A., Cruz, M. W., Planté-Bordeneuve, V., Lozeron, P. Tafamidis for transthyretin familial amyloid polyneuropathy: a rando-mized, controlled trial. Neurology 2012, 79, p. 785-792.
22. Pinheiro, R. S., Lai, Q., Dahrenmoller, C., Lerut, J. Complex hepatic outflow reconstruction in domino liver transplantation. Hepat. Pan. Dis. Int. 2014, 13(1), p. 98 -100.
23. Jacobson, D. R. A specific test for transthyretin 122 (Val→Ile), based on PCR-Primer-introduced restriction analysis ((PCR-PIRA): Confirmation of the gene frequency in blacks. Am. J. Hum. Genet. 1992, 50, p. 195-198.
24. Sandgren, O., Drugge, U., Holmgren, G., Sousa, A. Vitreous involvement in familial amyloidotic neuropathy: a genealogical and genetic study. Clin. Genet. 1991, 40, p. 452 – 460.
25. Coelho, T., Sousa, A., Lourenco, E., Ramalheira, J. A study of 159 Portuguese patients with familial amyloidotic polyneuropathy (FAP) whose parents were both unaffected. J. Med. Genet. 1994, 31, p. 293–299.
26. Ruberg, F. L., Berk, J. L. Transthyretin TTR cardiac amyloidosis. Circulation. 2012, 126(10), p. 1286-3000.
27. Julius, R. L., Farha, O. K., Chiang, J., Perry, L. J., Hawthome, M. F. Synthesis and evaluation fo transthyretin amyloidosis inhibitors containing carborane pharmacophores. Proc. Natl. Acad. Sci. USA. 2007, 104(12), p. 4808-4813
28. Castaño, A., Helmke, S. , Alvarez, J., Delisle, S., Maurer, M. S. Diflunisal for ATTR cardiac amyloidosis. Congest Heart Fail. 2012, 18(6), p. 315–319.
29. Ryšavá, R. Systémové amyloidózy a jejich léčba. Edice: Farmakoterapie pro praxi, Sv. 61. Vyd. Maxdorf, Praha. 2013, p. 12.
30. Selvanayagam, J. B., Hawkins, P. N., Paul, B. et al. Evaluation and management of the cardiac amyloidosis. Journal of American College of Cardiology. 2007, 50, p. 2101-10.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2014 Issue 2-
All articles in this issue
- Diagnostika a stratifikace systémové AL amyloidózy ve světle „Doporučení České myelomové skupiny 2013“
- Klinická problematika IgM monoklonálních gamapatií
- Detekce hereditárních amyloidóz
- Rizikové faktory asymptomatického mnohočetného myelomu
- Úroveň analytické kvality glukometrů
- Vplyv indukovanej hyperhomocysteinémie na kardiomyocyty v experimentálnom modeli
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinická problematika IgM monoklonálních gamapatií
- Rizikové faktory asymptomatického mnohočetného myelomu
- Úroveň analytické kvality glukometrů
- Diagnostika a stratifikace systémové AL amyloidózy ve světle „Doporučení České myelomové skupiny 2013“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


