-
Medical journals
- Career
Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
Authors: T. Andreasová; F. Málek
Authors‘ workplace: Kardiocentrum, Nemocnice Na Homolce, Praha
Published in: Kardiol Rev Int Med 2017, 19(2): 128-130
Overview
Srdeční selhání se zachovalou ejekční frakcí je časté a léčba je obtížná. Léky modifikující průběh onemocnění u nemocných se srdečním selháním a sníženou ejekční frakcí se ukázaly být u pacientů se zachovalou ejekční frakcí neefektivní. Doporučena je léčba ischemické choroby srdeční, arteriální hypertenze a kontrola rytmu nebo frekvence u fibrilace síní jako hlavní principy terapie této populace nemocných. Výzkum farmakoterapie se zaměřil i na nové patofyziologické cesty.
Klíčová slova:
srdeční selhání – zachovalá ejekční frakce – farmakoterapieÚvod
Srdeční selhání (SS) se zachovalou ejekční frakcí (heart failure with preserved ejection fraction – HFpEF) je klinický syndrom charakterizovaný normální nebo téměř normální systolickou funkcí levé komory (LK). Tato jednotka představuje zásadní a narůstající medicínský problém především kvůli vzestupu prevalence. Významná část nemocných s klinickým syndromem SS má normální nebo zachovalou ejekční frakci LK (EF LK). Prevalence SS s normální nebo se zachovalou EF LK se v populaci pacientů se syndromem chronického SS (CHSS) odhaduje až na 50 %. Prognóza nemocných s HFpEF je po hospitalizaci pro akutní SS stejná jako u pacientů se sníženou ejekční frakcí (heart failure with reduced ejection fraction – HFrEF). Riziko úmrtí je 65 % během 5 let [1 – 4]. HFpEF je odpovědné za 50 % hospitalizací pro SS, incidence HFpEF ve světě stoupá [2,5]. Léčebné strategie, které byly u pacientů s HFrEF spojeny se snížením nemocnosti a se zlepšením prognózy, se ukazaly být u nemocných s HFpEF neúspěšné. V dosud provedených studiích u pacientů s HFpEF se ukázalo, že léky modifikující průběh onemocnění u HFrEF mají u pacientů s HFpEF neutrální dopad na snížení mortality a morbidity ve srovnání s placebem [6]. Například terapie pomocí léků, které inhibují renin-angiotenzin-aldosteronový systém (RAAS), nebyla u pacientů s HFpEF spojená s očekávaným snížením rizika úmrtí a hospitalizace [7 – 10]. Na základě těchto výsledků se doporučení odborných společností zaměřují na léčbu komorbidit: arteriální hypertenze, ischemické choroby srdeční a fibrilace síní, které jsou nejčastějšími komorbiditami HFpEF [11,12]. Selhání principů neurohumorální blokády, zejména inhibice RAAS u HFpEF, by moho být vysvětleno odlišnou patofyziologií HFrEF a HFpEF.
Patofyziologie HFpEF
Ukazuje se, že HFpEF je heterogenní porucha zahrnující více patofyziologických mechanizmů. Typickým znakem HFpEF je zhoršená poddajnost myokardu způsobená hypertrofií a fibrózou. Zhoršená poddajnost komor vede ke zvýšení plnicích tlaků. Je zhoršená i poddajnost cév a jsou uvažovány i další mechanizmy, které přispívají k rozvoji symptomů: porucha renální homeostázy sodíku a vody, chronotropní inkompetence, chybění vazodilatační rezervy, prekapilární plicní hypertenze, anémie, poruchy dýchání ve spánku. Není také zcela jasné, zda se u HFpEF uplatňují podobné neurohumorální mechanizmy jako u HFrEF. Těmto pochybám odpovídají i práce, které se zabývaly významem stanovení biomarkerů SS u HFpEF. Nejvíce zkoumanou skupinou biomarkerů u HFrEF jsou ukazatele myokardiálního přetížení – natriuretické peptidy (NP) BNP, resp. NT-pro-BNP. Podle současných doporučení odborných společností se hranice normálních hodnot pro HFrEF a HFpEF neliší. Zajímavé jsou však rozdíly v epidemiologii populací pacientů s HFrEF a HFpEF:
- Vzestup koncentrace NT-proBNP je u pacientů s HFpEF méně výrazný než u HFrEF a koncentrace NT-proBNP jsou nižší u HFpEF při stejné funkční třídě podle NYHA.
- Nižší koncentrace NT-proBNP u HFpEF by mohly znamenat menší diastolické myokardiální přetížení ve srovnání s HFrEF. Kvůli tomu se při použití NP v diagnostice SS zachytí pouze nemocní v nejvyšším riziku a léčebné strategie, které se koncentrací NP u HFrEF řídí, mohou být u HFpEF neefektivní.
Z výše uvedeného vyplývá, že natriuretické peptidy mohou být v diagnostice a prognostické stratifikaci HFpEF méně použitelné [13,14].
Terapie HFpEF
Současná doporučení pro diagnostiku a léčbu SS se v případě terapie HFpEF již několik let nemění. Hlavními principy léčby jsou nadále: agresivní kontrola krevního tlaku u pacientů s arteriální hypertenzí v prevenci nebo k zábraně progrese srdeční hypertrofie, koronární revaskularizace u pacientů s prokázanou ischemií myokardu s cílem zlepšit relaxaci komor, kontrola tepové frekvence u pacientů s chronickými formami fibrilace síní s cílem zpomalit komorovou odpověď a zlepšit diastolické plnění komor a koronární perfuzi a těsná kontrola retence tekutin pomocí diuretik k odstranění kongesce s plným vědomím toho, že výrazné snížení preloadu při nadměrné diuretické terapii je spojeno s rizikem symptomatické hypotenze. Žádná farmakologická léčba dosud jednoznačně neprokázala schopnost snížit morbiditu a mortalitu pacientů s HFpEF. Vzhledem k tomu, že typicky se jedná o starší nemocné s řadou komorbidit a pokročilými symptomy, je důležitým léčebným cílem i zlepšení kvality života.
Farmakoterapie HFpEF spojená se zlepšením symptomů a snížením hospitalizace pro SS
Diuretika zlepšují symptomy SS s plicní nebo systémovou kongescí jak u nemocných s HFrEF, tak i u pacientů s HFpEF. Vliv na zlepšení symptomů je nezávislý na EF LK. Je nutné mít na mysli, že u pacientů s HFpEF může být příliš agresivní diuretická terapie spojená s významným poklesem žilního návratu a rozvojem symptomatické hypotenze. Chybí důkazy o zlepšení příznaků při léčbě betablokátory (BB) a antagonisty mineralokortikoidních receptorů (MRA). Existují důkazy pro zlepšení symptomatologie u pacientů s HFpEF léčených antagonistou AT1 receptoru angiotenzinu II (ARB) kandesartanem a inhibitorem enzymu konvertující angiotenzin (ACEI) perindoprilem [8,15].
Snížení rizika hospitalizace pro SS je důležitým klinickým cílem, jedná se o hlavní parametr morbidity. V případě pacientů s HFpEF existují důkazy o snížení rizika hospitalizace pro nebivolol, digoxin, spironolakton a kandesartan [9,15 – 17]. Tyto závěry ovšem platí pouze pro pacienty se sinusovým rytmem. U pacientů s fibrilací síní důkazy pro BB, digoxin, ACEI a ARB chybí.
Farmakoterapie HFpEF s účinkem na snížení mortality
Studie s ACEI, ARB, BB a MRA neprokázaly jednoznačné snížení mortality. Pouze ve studii SENIORS snížil nebivolol u starších pacientů riziko úmrtí a hospitalizace z kardiovaskulárních příčin bez ohledu na EF LK [16]. Subanalýza studie SENIORS si dala za úkol zjistit, zda je efekt nebivololu na snížení rizika úmrtí a kardiovaskulární hospitalizace nezávislý na EF LK. Do subanalýzy bylo zahrnuto 2 111 pacientů, z nichž 1 359 (64 %) mělo sníženou EF LK ≤ 35 % a 752 (36 %) mělo mírně sníženou nebo zachovalou EF LK > 35 %. Průměrná EF LK u první skupiny byla 28,7 % a u druhé skupiny 49,2 %. Pacienti s HFpEF byli častěji ženy, měli méně pokročilé symptomy, častěji hypertenzi a méně často byli po infarktu myokardu. Primární kombinovaný sledovaný ukazatel úmrtí a hospitalizace z kardiovaskulárních příčin se vyskytl u 34,2 % pacientů s HFrEF a u 31,2 % pacientů s HFpEF. Efekt nebivololu na snížení rizika primárního sledovaného ukazatele ve srovnání s placebem nebyl mezi oběma skupinami rozdílný, snížení rizika (HR – hazard ratio) bylo u HFrEF 0,86 a u HFpEF 0,81. Stejně tak nebyl rozdíl ve snížení rizika sekundárního ukazatele: úmrtí z jakékoli příčiny mezi oběma skupinami. Efekt betablokády pomocí nebivololu u starších nemocných se SS byl pozitivní jak u nemocných se sníženou, tak u pacientů se zachovalou EF LK [18]. Doplňující post-hoc analýza této studie ukázala, že efekt nebivololu na snížení rizika byl patrný i u pacientů s EF LK ≥ 40 % (n = 643) a nelišil se od pacientů s EF LK ≥ 35 %. Přehled farmakoterapie HFpEF ukazuje tab. 1.
Table 1. Efekt farmakoterapie HFpEF na defi nované klinické cíle. 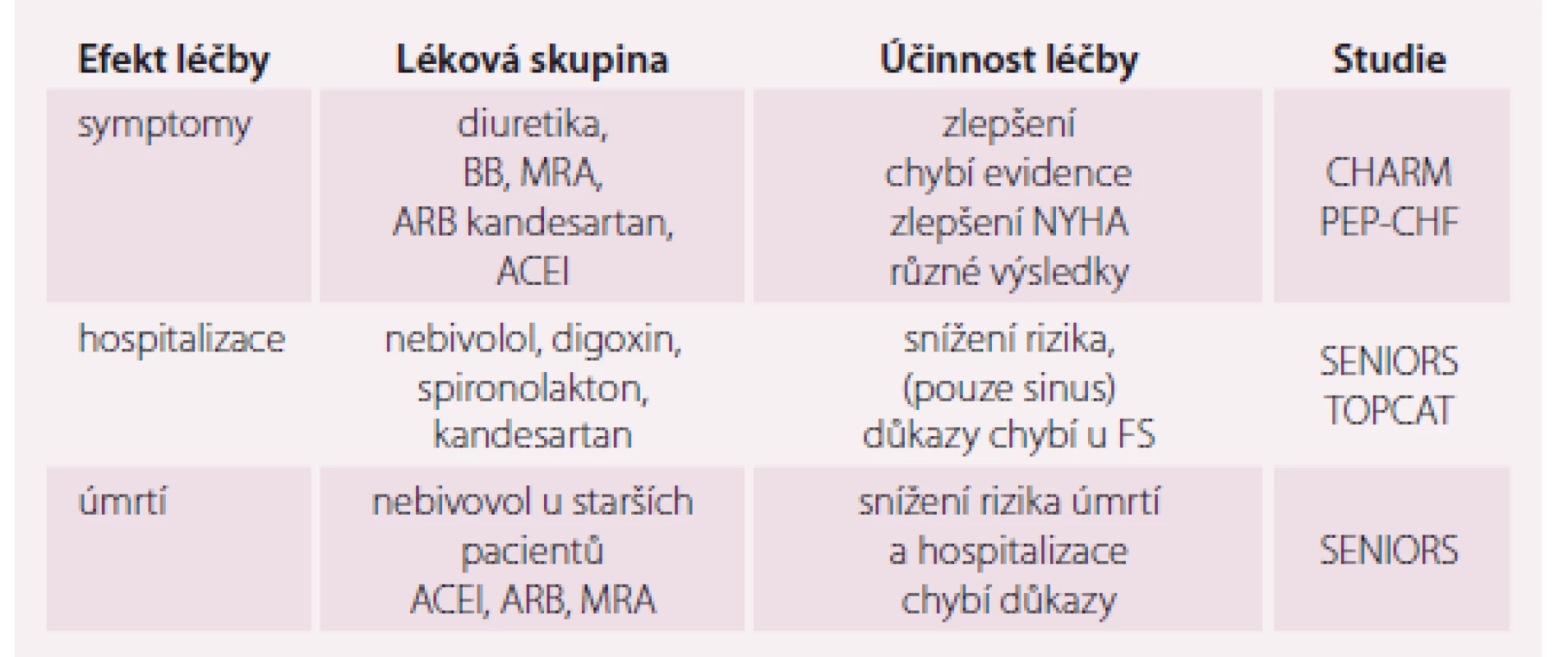
HFpEF – SS se zachovalou ejekční frakcí, BB – betablokátory, MRA – antagonisté mineralokortikoidních recepto, ARB – antagonisté AT1 receptoru angiotenzinu II, ACEI – inhibitor enzymu konvertující angiotenzin, FS – fibrilace síní Probíhající výzkum v oblasti farmakoterapie HFpEF
Zajímavým směrem výzkumu je ovlivnění oxidu dusnatého (NO), solubilní guanylátcyklázy (sGC) a cyklického guanozin-monofostátu (cGMP). Tento směr byl již dříve testován u pacientů s HFrEF a pokračuje i u nemocných s HFpEF. Předmětem výzkumu jsou donátory NO (např. nitroprusid), nitráty a hydralazin [19]. Očekává se zlepšení endoteliální funkce, zlepšení energetiky myokardu, zlepšení periferní cirkulace. Mimo jiné probíhá studie fáze II (Effect of organic nitrates and hydralazine on wave reflections and left ventricular structure and function in heart failure with preserved ejection fraction, clinical-trials.gov NCT01516346). Aktivátory a stimulátory sGC mají silný vazodilatační a antihypertenzní potenciál při zachování kardioprotektivních i nefroprotektivních účinků. Riociguat je prvním orálním stimulátorem sGC, byl testován u pacientů s HFpEF s plicní hypertenzí. Zlepšil srdeční výdej a snížil dotížení komor, ale neměl vliv na tlak v plicnici ani na plicní vaskulární rezistenci [20]. Další probíhající studií fáze II v rámci programu SOCRATES (Soluble guanylate cyclase stimulator heart failure studies, clinical-trials.gov NCT101951638) je studie SOCRATES-PRESERVED. Jedná se o randomizovanou dvojitě slepou studii hodnotící účinnost a bezpečnost vericiguatu (BAY1021189), stimulátoru sGC u hospitalizovaných pacient s HFpEF (EF LK ≥ 45 %) [21]. Aktivita cGMP může být ovlivněna inhibitory fosfodiesterázy-5 (PDE-5). Testovaným lékem byl v několika studiích u pacientů s HFpEF sildenafil, který má selektivní vazodilatační efekt na plicní cirkulaci. V menší studii pacientů s HFpEF a plicní hypertenzí vedl sildenafil ke snížení tlaku v plicnici, tlaku v plicnici v zaklínění a došlo ke zlepšení funkce LK i PK. Tyto příznivé výsledky však nebyly ve studii fáze III RELAX (Phosphodiesterase-5 inhibition to improve clinical status and exercise capacity in heart failure with preserved ejection fraction) potvrzeny [22].
Dalším směrem je také možnost ovlivnění degradace NP, a tím využití jejich fyziologické vlastnosti. Sakubitril-valsartan je zatím jediným představitelem lékové skupiny inhibitorů receptoru angiotenzinu a neprilysinu (angiotensin receptor and neprilysinu inhibitors – ARNI). U pacientů s HFrEF bylo prokázáno, že duální inhibice neprilysinu a receptoru angiotenzinu II je mnohem efektivnější na snížení rizika úmrtí a hospitalizace pro SS než konvenční léčba inhibitorem ACE enalaprilem. Tím se liší od duální inhibice neprilysinu a angiotenzin-konverujícího enzymu (představované omapatrilátem). Sakubitril-valsartan má potenciál v léčbě HFpEF. Randomizovaná srovnávací studie PARAMOUNT II. fáze klinického výzkumu ukázala, že sakubitril-valsartan 97/ 103 mg 2× denně ve srovnání s valsartanem 160 mg 2× denně významně snížil průměrnou koncentraci NT-proBNP o 23 % (p = 0,005) u 283 pacientů s CHSS NYHA II a III a EF LK ≥ 45 % [23]. V současnosti probíhá randomizovaná studie PARAGON-HF u HFpEF, jejímž cílem je zjistit dopad sakubitrilu-valsartanu na riziko úmrtí z kardiovaskulárních příčin a hospitalizace pro SS ve srovnání s valsartanem.
Závěr
Farmakoterapie HFpEF se nemůže opřít o tak průkazné výsledky mortalitních a morbiditních studií, které známe z léčby HFrEF. Nicméně výzkum v oblasti neurohumorální blokády a ovlivnění dalších patofyziologických procesů v této populaci pacientů pokračuje i s hledáním nových cest. Důvod pokračujícího zájmu o tuto populaci nemocných je nasnadě: prevalence a incidence tohoto syndromu stoupá a dlouhodobá prognóza se příliš od osudu nemocných s HFrEF neliší.
Podpořeno MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884), IG160502.
Doručeno do redakce: 7. 2. 2017
Přijato po recenzi: 10. 5. 2017
doc. MU Dr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Sources
1. Yancy CW, Lopatin M, Stevenson LW et al. Clinical presentation, management, and in-hospital outcomes of patients admitted with acute decompensated heart failure with preserved systolic function: a report from the Acute Decompensated Heart Failure National Registry (AD-HERE) Database. J Am Coll Cardiol 2006; 47(1): 76 – 84.
2. Lam CS, Donal E, Kraigher-Krainer E et al. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur J Heart Fail 2011; 13(1): 18 – 28. doi: 10.1093/ eurjhf/ hfq121.
3. Bhatia RS, Tu JV, Lee DS et al. Outcome of heart failure with preserved ejection fraction in a population-based study. N Engl J Med 2006; 355(3): 260 – 269.
4. Steinberg BA, Zhao X, Heidenreich PA et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation 2012; 126(1): 65 – 75. doi: 10.1161/ CIRCULATIONAHA.111.080770.
5. Solomon SD, Dobson J, Pocock S et al. Influence of nonfatal hospitalization for heart failure on subsequent mortality in patients with chronic heart failure. Circulation 2007; 116(13): 1482 – 1487.
6. Paulus WJ, van Ballegoij JJ. Treatment of heart failure with normal ejection fraction: an inconvenient truth! J Am Coll Cardiol 2010; 55(6): 526 – 537. doi: 10.1016/ j.jacc.2009.06.067.
7. Massie BM, Carson PE, McMurray JJ et al. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359(23): 2456 – 2467. doi: 10.1056/ NEJMoa0805450.
8. Cleland JG, Tendera M, Adamus J et al. The Perindopril in Elderly People with Chronic Heart Failure (PEP-CHF) study. Eur Heart J 2006; 27(19): 2338 – 2345.
9. Campbell RT, Jhund PS, Castagno D et al. What have we learned about patients with heart failure and preserved ejection fraction from DIG-PEF, CHARM-Preserved, and I-PRESERVE? J Am Coll Cardiol 2012; 60(23): 2349 – 2356. doi: 10.1016/ j.jacc.2012.04.064.
10. Pitt B, Pffefer MA, Assman SF et al. The TOPCAT Investigators. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 370(15): 1383 – 1392. doi: 10.1056/ NEJMoa1313731.
11. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Europ Heart J 2016; 37(27): 2129 – 2200. doi: 10.1093/ eurheartj/ ehw128.
12. Špinar J, Hradec J, Špinarová L et al. Souhrn doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Cor Vasa 2016; 58(5): e530 – e568.
13. McKelvie RS, Komajda M, McMurray J et al. I-Preserve Investigators. Baseline plasma NT-proBNP and clinical characteristics: results from the irbesartan in heart failure with preserved ejection fraction trial. J Card Fail 2010; 16(2): 128 – 134. doi: 10.1016/ j.cardfail.2009.09.007.
14. van Veldhuisen DJ, Linssen GC, Jaarsma T et al. B-type natriuretic peptide and prognosis in heart failure patients with preserved and reduced ejection fraction. J Am Coll Cardiol 2013; 61(14): 1498 – 1506. doi: 10.1016/ j.jacc.2012.12.044.
15. Yusuf S, Pfeffer MA, Swedberg K et al. The CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362(9386): 777 – 781.
16. Flather MD, Shibata MC, Coats AJ et al. The SENIORS Investigators. Randomised trial to determine the effect of nebivolol on mortality and hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26(3): 215 – 225.
17. Ahmed A, Rich MW, Fleg JL et al. Effect of digoxin on morbidity and mortality in diastolic heart failure trial: the ancillary digitalis investigation group. Circulation 2006; 114(5): 397 – 403.
18. van Veldhuisen DJ, Cohen-Solal A, Bohm M et al. The SENIORS Investigators. Beta-blockade with nebivolol in elderly heart failure patients with impaired and preserved left ventricular ejection fraction. J Am Coll Cardiol 2009; 53(23): 2150 – 2158. doi: 10.1016/ j.jacc.2009.02.046.
19. Zamani P, Rawat D, Shiva-Kumar P et al. Effect of inorganic nitrate on exercise capacity in heart failure with preserved ejection fraction. Circulation 2015; 131(4): 371 – 380. doi: 10.1161/ CIRCULATIONAHA.114.012957.
20. Bonderman D, Pretsch I, Steringer-Mascherbauer R et al. Acute hemodynamic effects of riociguat in patients with pulmonary hypertension associated with diastolic heart failure (DILATE-1): a randomized, double-blind, placebo-controlled, single-dose study. Chest 2014; 146(5): 1274 – 1285. doi: 10.1378/ chest.14-0106.
21. Pieske B, Butler J, Filippatos G et al. Rationale and design of the SOluble guanylate Cyclase stimulatoR in heArT failurE Studies (SOCRATES). Eur J Heart Fail 2014; 16(9): 1026 – 1038. doi: 10.1002/ ejhf.135.
22. Redfield MM, Chen HH, Borlaug BA et al. Effect of phosphodiesterase-5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA 2013; 309(2): 1268 – 1277. doi: 10.1001/ jama.2013.2024.
23. Solomon SD, Ziele M, Pieske B et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet 2012; 380(9851): 1387 – 1395. doi: 10.1016/ S0140-6736(12)61227-6.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 2-
All articles in this issue
- Léčba hypertenze ve stáří
- Kontrola krevního tlaku v primární a sekundární prevenci cévní mozkové příhody
- Endokrinní hypertenze
- Vztah mezi krevním tlakem a bolestí – co už víme?
- Vybrané poznámky ke studii FOURIER
- Implementace Doporučení pro diagnostiku a léčbu srdečního selhání 2016 do klinické praxe – úloha ivabradinu
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
- Elektrokardiogram a kardiostimulace
- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Hypertenze a srdeční selhání
- Hypertenze a ischemická choroba srdeční – dva nebezpeční sourozenci
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Elektrokardiogram a kardiostimulace
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

