-
Medical journals
- Career
Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
Authors: K. Urbánek
Authors‘ workplace: Ústav farmakologie, LF UP a FN Olomouc
Published in: Kardiol Rev Int Med 2015, 17(1): 76-81
Category: Internal Medicine
Overview
Přímá perorální antikoagulancia (DOACs) jsou látky, které byly nedávno zavedeny do klinické praxe s cílem nahradit warfarin. Kromě vyšší účinnosti a bezpečnosti byla jednou z jejich předpokládaných výhod absence nutnosti pravidelného monitorování koagulačních parametrů a nutnosti adjustování dávek na základě takto získaných výsledků. Stále více se však ve specifických případech ukazuje potřeba kvantitativního stanovení těchto látek v plazmě. Zlatým standardem pro stanovení plazmatických koncentrací DOACs je metoda LC ‑ MS. V praxi se používá nepřímých metod, jako je dTT pro inhibitory trombinu a chromogenní stanovení anti‑Xa pro inhibitory faktoru Xa. Prozatím není u žádného DOAC doporučováno opakované měření plazmatických koncentrací s cílem adjustace dávkování. Stanovení plazmatických koncentrací se zatím používá pouze jednorázově v případech, jakými jsou podezření na noncomplianci, krvácivé komplikace během léčby, potřeba akutních operačních výkonů nebo trombolýzy.
Klíčová slova:
přímá perorální antikoagulancia – terapeutické monitorování léčiv – dabigatran – rivaroxaban – apixaban
Přímá perorální antikoagulancia (DOACs – direct oral anticoagulants), donedávna se spíše používal název nová perorální antikoagulancia (NOACs), jsou látky, které byly nedávno zavedeny do klinické praxe s cílem nahradit warfarin (a částečně i parenterální antikoagulancia). Kromě vyšší účinnosti a bezpečnosti byla jednou z jejich předpokládaných výhod absence nutnosti pravidelného monitorování koagulačních parametrů a nutnosti adjustování dávek na základě takto získaných výsledků [1,2].
Někdy se do jisté míry zapomíná, že skupina DOACs není homogenní ani z hlediska farmakologických charakteristik ani z hlediska klinických indikací. Tvoří ji dvě skupiny antikoagulačně působících látek:
- přímé inhibitory trombinu, kde je jediným používaným zástupcem dabigatran,
- přímé inhibitory faktoru Xa, kde je u nás k dispozici rivaroxaban a apixaban, existují však i další látky, které jsou nebo budou zaváděny do klinické praxe.
Jednotlivé látky obou skupin byly nebo jsou postupně zaváděny do klinické praxe v následujících indikacích:
- prevence žilní trombembolické nemoci u elektivních ortopedických výkonů,
- prevence embolizační cévní mozkové příhody (CMP) u nevalvulární fibrilace síní,
- léčba hluboké žilní trombózy a plicní embolie,
- akutní koronární syndromy.
Spektrum indikací se bude v budoucnu nepochybně dále rozšiřovat. Je všeobecně známo, že některé látky jsou registrovány pro použití pouze v některých indikacích. Naopak se poněkud zapomíná, že jednotlivé indikace se významně liší jak dávkováním, tak délkou léčby, tudíž i potřeba terapeutického monitorování se může podstatně lišit.
To, že jsou nová antikoagulancia podávána v jednoduchých dávkovacích schématech a pacient nemusí docházet na pravidelné kontroly koagulačních parametrů, je samozřejmě jedním z hlavních přínosů této nové skupiny léčiv. Nicméně s tím, jak se rozšířilo používání těchto léků do širokých skupin populace, se postupně ukázalo, že v určitých případech by bylo velmi vhodné mít možnost ověřit si, zda je léčivo vůbec v pacientově organizmu přítomné (např. při úrazech s bezvědomím), zda představuje antikoagulační účinek léčiva nějaké riziko (např. při potřebě akutního chirurgického výkonu) nebo zda pacient není předávkován (například při krvácení). To spolu s neobvyklým ovlivněním běžně používaných koagulačních testů (především INR) vedlo k vývoji laboratorních metod, které by specificky hodnotily ovlivnění koagulačních funkcí pacientů léčených DOACs a vyvolalo diskuze nejen o tom, která z metod je optimální, ale i o tom, zda by v určitých případech nebylo přeci jen vhodné provádět jejich terapeutické monitorování.
Jak lze monitorovat účinek DOACs?
Stejně jako u jiných léčiv připadá v úvahu farmakokinetické nebo farmakodynamické monitorování. Při farmakokinetickém monitorování je stanovována koncentrace léčiva v plazmě a na základě změřených koncentrací je modelována farmakokinetika léčiva u konkrétního pacienta při daném dávkování. Tato metoda je dnes u DOACs používána v podstatě jen ve farmakokinetických studiích a prozatím nemá jednoznačné místo v běžné klinické praxi. Nicméně možnost jejího použití existuje a předpokládáme, že v budoucnu bude v určitých situacích využívána.
U antikoagulačních léčiv je však tradičně preferováno farmakodynamické monitorování pomocí vlivu léčiva na koagulační parametry pacientovy plazmy. Tato metoda se dobře osvědčuje u warfarinu (měřením INR), u parenterálních antikoagulancií je její význam omezen na jednorázové ověření účinku v rizikových situacích (traumata, předávkování, krvácení). U heparinu je využíváno měření aPTT, u nízkomolekulárních heparinů a fondaparinuxu stanovení anti‑Xa kalibrované na příslušnou účinnou látku. Je třeba zdůraznit, že tyto metody nejsou použitelné u pacientů léčených DOACs a jejich vypovídací hodnota je v nejlepším případě orientační (i zde záleží na typu podávaného DOAC). Proto musely být vyvinuty specifické metody pro měření koagulačních parametrů pacientů léčených těmito novými léky.
Laboratorní metody pro monitorování DOACs
Přímé stanovení koncentrace léčiv v plazmě
Nejspolehlivější metodou laboratorního stanovení koncentrací léčiv v plazmě (případně jiném biologickém materiálu) je kapalinová chromatografie s hmotnostní spektrometrií (LC ‑ MS) a její novější varianty. Je používána jako referenční metoda při ověřování použitelnosti nepřímých metod, které jsou zmíněny níže. Například v nedávno publikované studii je popsán nejen vývoj a validace UPLC ‑ MS/ MS metody pro stanovení dabigatranu, rivaroxabanu a apixabanu, ale i přesnost a spolehlivost nepřímých metod zmíněných níže [3].
V recentní práci Gouse et al je zdůrazněna jedna indikace, ve které je přímé stanovení koncentrace léčiva v plazmě pomocí LC ‑ MS metodou volby – jedná se o situaci, kdy není známo, které z přímých antikoagulancií pacient užíval [4].
Nepřímé stanovení – ovlivnění plazmatických koagulačních parametrů
Přímá perorální antikoagulancia mohou ovlivňovat širokou škálu rutinně používaných koagulačních testů. Jejich ovlivnění však obvykle nemá výpovědní hodnotu a nemůže být použito k interpretaci aktuálního účinku těchto léčiv na koagulaci pacienta, pouze některé testy mohou být orientačně využity ke kvalitativnímu zhodnocení rizika aktuálního krvácení a podobně. Protože však existuje potřeba přesnějšího, kvantitativního hodnocení, bylo vyvinuto několik specifických testů, které mohou sloužit k tomuto účelu. Přehled nejvýznamnějších laboratorních metod použitelných k farmakodynamickému monitorování DOACs je uveden v tab. 1.
Table 1. Použitelnost koagulačních testů pro farmakodynamické monitorování DOACs. 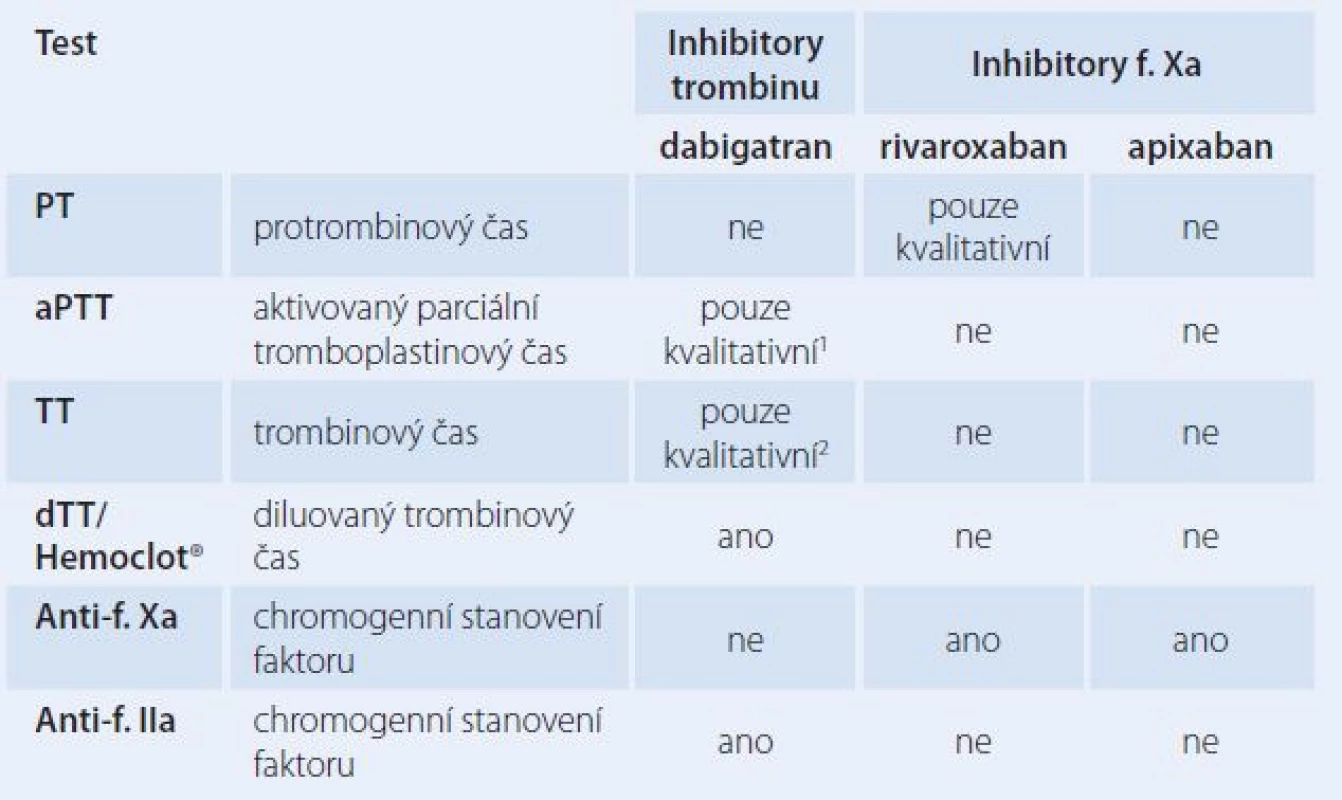
1 normální hodnoty byly zaznamenány i při terapeutických koncentracích dabigatranu 2 může být abnormální i při klinicky nevýznamných koncentracích dabigatranu Pro inhibitor trombinu dabigatran je k dispozici stanovení dTT, tedy diluovaného trombinového času (Hemoclot®). Ve studii Douxfilse et al byla prokázána dobrá korelace výpočtu plazmatických koncentrací dabigatranu tímto testem s přímým stanovením LC ‑ MS/ MS při koncentracích dabigatranu nad 50 ng/ ml [5].
Ke kvantifikaci inhibitorů faktoru Xa v plazmě jsou dobře použitelné především kalibrované metody chromogenního stanovení anti‑Xa. Další práce belgických autorů prokázala srovnáním s LC ‑ MS/ MS, že chromogenní stanovení anti‑Xa (Biophen DiXaI®) je dostatečně přesné pro nepřímé stanovení plazmatických koncentrací rivaroxabanu při hodnotách nad 30 ng/ ml [6]. Na stejném principu jsou založeny i metody určené ke stanovení plazmatických koncentrací apixabanu [7,8].
Jistou roli v tom, že jsou ke zjišťování účinku DOACs v klinické praxi používány převážně koagulační testy, hraje i to, že diagnostika a interpretace účinků tradičních antikoagulancií (warfarinu, heparinu nebo LMWH) je tradičně ve spektru činnosti hematologických laboratoří. Zmíněné metody farmakodynamického monitorování DOACs jsou ve většině situací dostatečně rychlé, spolehlivé i citlivé a reprodukovatelné. Výjimkou jsou velmi nízké plazmatické koncentrace, ve kterých je LC ‑ MS nenahraditelné, nicméně potřeba jejich přesného rutinního stanovování zatím není nikterak vysoká. Proto jsou a budou v budoucnosti používány i ke kvantifikaci plazmatických koncentrací DOACs.
Jaká je potřeba terapeutického monitorování DOACs?
Terapeutické monitorování léčiv (TDM – therapeutic drug monitoring) je metoda individualizace dávkování léčiv, která se využívá u léčiv s úzkým terapeutickým rozmezím, u kterých účinek koreluje lépe s plazmatickou koncentrací než s podanou dávkou. Skládá se ze tří fází:
- Nejdříve je změřena koncentrace léčiva ve vzorku pacientova biologického materiálu (obvykle plazmy).
- Poté je na základě změřených plazmatických koncentrací léčiva, charakteristik konkrétního pacienta (věk, pohlaví, hmotnost, sérový kreatinin) a dávkovacího režimu modelována farmakokinetika léčiva v jeho organizmu pomocí speciálních počítačových programů.
- Dále je na základě vypočtených údajů o farmakokinetice doporučováno optimální dávkování pro individuálního pacienta. Po případné úpravě dávkování může být provedena kontrola plazmatických koncentrací k potvrzení správnosti predikce a doporučeného dávkovacího režimu.
Už v úvodu bylo zmíněno, že přímá perorální antikoagulancia byla od počátku designována tak, aby u nich TDM nebylo třeba. Předpokládalo se především maximálně jednoduché dávkování, tedy jednotná dávka pro všechny pacienty, maximálně s redukcí na nižší, ale opět jednotnou dávku pro pacienty se sníženými eliminačními funkcemi. Dále měla být úplně vyloučena nutnost pravidelných kontrol koagulačních parametrů, které vyžaduje warfarin. To se sice zčásti podařilo, nicméně s tím, jak se rozšířilo indikační spektrum a rozmezí používaných dávek, se ukázalo, že i DOACs vykazují určitou interindividuální variabilitu farmakokinetiky. Kromě běžných faktorů ovlivňujících farmakokinetiku, které jsou uvedeny v tab. 2, mohou hrát roli i lékové interakce, především s látkami ovlivňujícími funkci P ‑ glykoproteinu a cytochromu P450 3A4.
Table 2. Známé faktory zvyšující variabilitu farmakokinetiky DOACs. 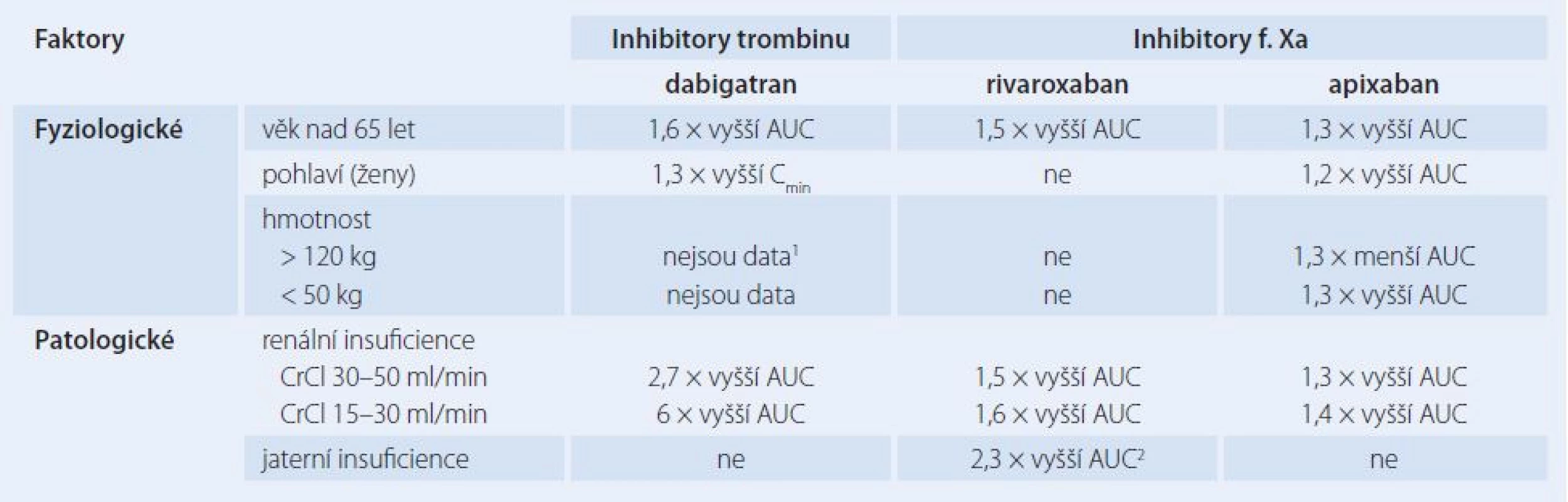
1 nad 100 kg o 20 % menší Cmin 2 pro cirrhosis hepatis Child-Pugh B Je třeba zdůraznit, že případná potřeba terapeutického monitorování DOACs se různí nejen mezi jednotlivými látkami, ale také z hlediska indikací a používaných dávek. Zatímco v ortopedických indikacích je potřeba monitorování velmi nízká, v indikaci prevence embolizačních CMP u nevalvulární fibrilace síní jsou používány vysoké dávky DOACs po velmi dlouhou dobu, navíc obvykle u starších pacientů s fragilní farmakokinetikou a větším množstvím konkomitantně podávaných léčiv, tudíž i potřeba TDM je podstatně vyšší.
Debata o potřebě TDM u DOACs je na svém počátku a existují silné argumenty jak pro [9], tak proti [10], přičemž prozatím rozhodně převažují názory, že skutečné TDM potřeba není. Je nepochybné, že rutinní provádění TDM by připravilo nová antikoagulancia o jednu z podstatných výhod, které přinášejí oproti warfarinu. Jako přijatelný kompromis se většinou jeví názor, že rutinní TDM sice třeba není, ale ověření plazmatických koncentrací může být výhodné za určitých přesně definovaných situací [11]. Těmi může být například rizikovost pacienta z hlediska eliminačních funkcí nebo užívání léku se známým rizikem interakcí s DOACs [12]. Míněno je tedy spíš jednorázové měření plazmatických koncentrací, které je popsáno níže.
Kritéria pro potřebu provádění TDM
Obvykle se uvádí pět kritérií, která předurčují léčivo k tomu, aby bylo při jeho podávání prováděno terapeutické monitorování:
- interindividuální variabilita,
- intraindividuální variabilita/ nestabilita farmakokinetiky,
- dostupnost spolehlivé a přesné metody stanovení,
- korelace mezi plazmatickou koncentrací a klinickým účinkem,
- průkaz efektivity TDM – úprava dávkování na jeho základě vede ke zlepšení klinické účinnosti.
Hlavní komparátor DOACs, warfarin, splňuje nepochybně všechna kritéria (s tím, že místo plazmatické koncentrace je používán farmakodynamický marker – INR). Naopak přímá perorální antikoagulancia alespoň prozatím jednoznačně splňují pouze třetí kritérium. První, druhé a čtvrté kritérium jsou u DOACs splněny pouze částečně a ne u všech látek ve stejném rozsahu. V současné době však zejména chybí jednoznačné důkazy o splnění pátého kritéria. To by hovořilo spíše pro odmítnutí nutnosti provádění TDM. Na podrobnější rozbor zde není dostatek prostoru, zájemce lze odkázat na publikace uvedené v seznamu literatury [9 – 12].
Již zmíněným nedostatkem debat o potřebě monitorovat přímá perorální antikoagulancia je jejich shrnutí do jedné skupiny. Rozlišíme‑li však inhibitory trombinu a inhibitory faktoru Xa a probereme se jejich farmakodynamickými a farmakokinetickými charakteristikami, zjistíme, že první skupina je podstatně významnějším kandidátem na provádění TDM než druhá.
Reálný kandidát – dabigatran
Pokud lze v současné době některé z DOACs považovat za kandidáta na provádění TDM, je to jediný zástupce skupiny inhibitorů trombinu – dabigatran. Důvodem je především jeho větší citlivost na faktory ovlivňující farmakokinetiku a zčásti zřejmě i užší terapeutický index při inhibici trombinu ve srovnání s inhibicí faktoru Xa. Zatímco farmakodynamický důvod – užší terapeutický index – je zatím prokázán pouze experimentálně [13] a jeho význam v klinických situacích není zcela jasný, značná interindividuální i intraindividuální variabilita farmakokinetiky především ve vyšších dávkách je prokazována opakovaně v klinických studiích i v praxi. Vzhledem k tomu, že dabigatran není vůbec metabolizován, jeho farmakokinetika je velmi citlivá na změny renálních funkcí (tab. 1), k čemuž přispívá i závislost na funkci P ‑ glykoproteinu v renálních tubulech. Dalším potenciálním zdrojem variability je jeho velmi nízká biologická dostupnost.
V roce 2013 byla v online verzi časopisu Journal of the American College of Cardiology publikována analýza dat získaných ve studii RE ‑ LY, ve které dabigatran prokázal účinnost a bezpečnost v prevenci CMP u pacientů s nevalvulární fibrilací síní. Tato analýza hodnotila závislost frekvence vzniku ischemické CMP a velkého krvácení na plazmatických koncentracích dabigatranu [14]. Kromě toho, že se prokázala závislost plazmatických koncentrací na renálních funkcích, hmotnosti, věku a pohlaví, bylo též prokázáno, že riziko ischemické CMP bylo nepřímo úměrné údolním plazmatickým koncentracím dabigatranu, zatímco riziko velkých krvácení jim bylo přímo úměrné (graf 1). Autoři došli k závěru, že u pacientů, kteří mají hraničně nízké nebo vysoké údolní koncentrace dabigatranu v ustáleném stavu a současně mají jeden nebo více ze tří hlavních faktorů ovlivňujících jeho farmakokinetiku (renální insuficienci, vysoký věk nebo nízkou tělesnou hmotnost), může být vhodná adjustace dávky na základě naměřených plazmatických koncentrací.
Graph 1. Regresní analýza závislosti rizika ischemické CMP a velkých krvácení na plazmatických koncentracích dabigatranu ve studii RE-LY. Upraveno podle [14]. ![Regresní analýza závislosti rizika ischemické CMP a velkých krvácení na plazmatických koncentracích dabigatranu ve studii RE-LY. Upraveno podle [14].](https://pl-master.mdcdn.cz/media/image/a330c80e9908f84efb37e732a55845ce.jpg?version=1537795687)
Zjištění pětinásobné variability plazmatických koncentrací ve zmíněné studii ovlivnilo také zajímavou debatu, která byla v loňském roce vedena na stránkách časopisu British Medical Journal [15 – 17]. V článku Debory Cohen je uvedeno několik výsledků analýz a názorů, které tvrdí, že adjustování dávky dabigatranu na základě měření plazmatických koncentrací by v prevenci ischemických CMP u fibrilace síní vedlo k vyšší bezpečnosti než současné používání dvou fixních dávek [18]. Podle autorů tyto poznatky nebyly vzaty v potaz při registraci léčiva proto, aby nebyla ohrožena jednoduchost podávání tohoto DOAC bez nutnosti laboratorních kontrol.
Tyto názory potvrzuje i nedávno publikovaná švédská studie, která hodnotila údolní plazmatické koncentrace dabigatranu u kohorty 90 pacientů s fibrilací síní [19]. Autoři zjistili pomocí LC ‑ MS/ MS 20násobnou variabilitu údolních plazmatických koncentrací (12 – 237 ng/ ml při dávce 150 mg 2× denně). Většina pacientů měla nízké údolní koncentrace, které podle výsledků výše zmíněné analýzy studie RE ‑ LY znamenají nízké riziko krvácení, avšak omezenou protekci vůči embolizační CMP [14]. Nízké koncentrace byly nalezeny především u pacientů s normální funkcí ledvin a vysokou tělesnou hmotností.
V současné době ovšem neexistuje jednoznačný názor na terapeutické rozmezí plazmatických koncentrací dabigatranu. Skeppholm et al se na základě výše uvedených výsledků domnívají, že optimální údolní koncentrace dabigatranu v indikaci nevalvulární fibrilace síní by se měly pohybovat mezi 50 a 120 ng/ ml [19], avšak stanovení terapeutického rozmezí bude vyžadovat další klinické studie.
Zdá se tedy, že inhibitor trombinu dabigatran vykazuje více vlastností, které ho předurčují k provádění TDM v rutinní praxi, než ostatní DOACs. Tuto skutečnost by však bylo ještě třeba prokázat v dostatečně validních klinických studiích. Na druhou stranu je možné, že pokud se potvrdí významný přínos monitorování plazmatických koncentrací dabigatranu, povede to k rychlejšímu ústupu jeho používání a jeho nahrazení látkami ze skupiny inhibitorů faktoru Xa.
Inhibitory faktoru Xa
U rivaroxabanu a apixabanu jsou sice také splněny některé podmínky pro provádění TDM, nicméně interindividuální rozdíly farmakokinetiky jsou relativně malé, vliv lékových a potravinových interakcí se nezdá být zásadní a především chybí důkazy o lepší korelaci mezi plazmatickými koncentracemi a klinickými účinky než mezi dávkou a těmito účinky. Inhibitory faktoru Xa mají více alespoň zčásti zastupitelných eliminačních cest a jejich biologická dostupnost je velmi vysoká, tudíž se jen velmi obtížně může excesivně zvýšit.
Za zmínku nicméně určitě stojí práce autorů z Heidelbergu, kteří se zabývali vlivem konkomitantního podávání cyklosporinu A a takrolimu na plazmatické koncentrace rivaroxabanu u devíti pacientů po transplantaci jater [20]. Zatímco takrolimus prakticky neovlivňoval plazmatické koncentrace rivaroxabanu, u tří z pěti pacientů léčených cyklosporinem A přesahovaly údolní plazmatické koncentrace rivaroxabanu hodnotu 75 ng/ ml, kterou autoři použili jako horní limit normy. U tří z nich se navíc objevily nezávažné krvácivé projevy, což vedlo k redukci dávkování. Takováto specifická skupina pacientů může být příkladem, kdy by TDM mohlo být vhodné i u inhibitorů faktoru Xa. Autoři vyjádřili názor, že terapeutické rozmezí údolních koncentrací rivaroxabanu by mělo být 7 – 75 ng/ ml [20], s čímž lze souhlasit na základě dostupných dat, nicméně vyžaduje to další ověření cílenými klinickými studiemi.
I když jsou známy průměrné naměřené vrcholové a údolní koncentrace inhibitorů faktoru Xa v klinických studiích (pochopitelně se významně liší podle použitých dávek a podle populačních charakteristik pacientů léčených pro různé indikace), nelze z nich prozatím učinit závěry o vhodném terapeutickém rozmezí plazmatických koncentrací. V tab. 3 jsou uvedeny hodnoty vrcholových a údolních koncentrací DOACs zjištěné u pacientů s nevalvulární fibrilací síní. V této populaci jsou jednak používány nejvyšší dávky, jednak je u ní nejvyšší riziko poruchy eliminace nebo lékových interakcí [14,21].
Table 3. Průměrné vrcholové (C<sub>peak</sub>) a údolní (C<sub>trough</sub>) plazmatické koncentrace DOACs naměřené u studovaných populací pacientů s fi brilací síní ve studiích RE-LY (dabigatran), ROCKET- AF (rivaroxaban) a ARISTOTLE (apixaban). 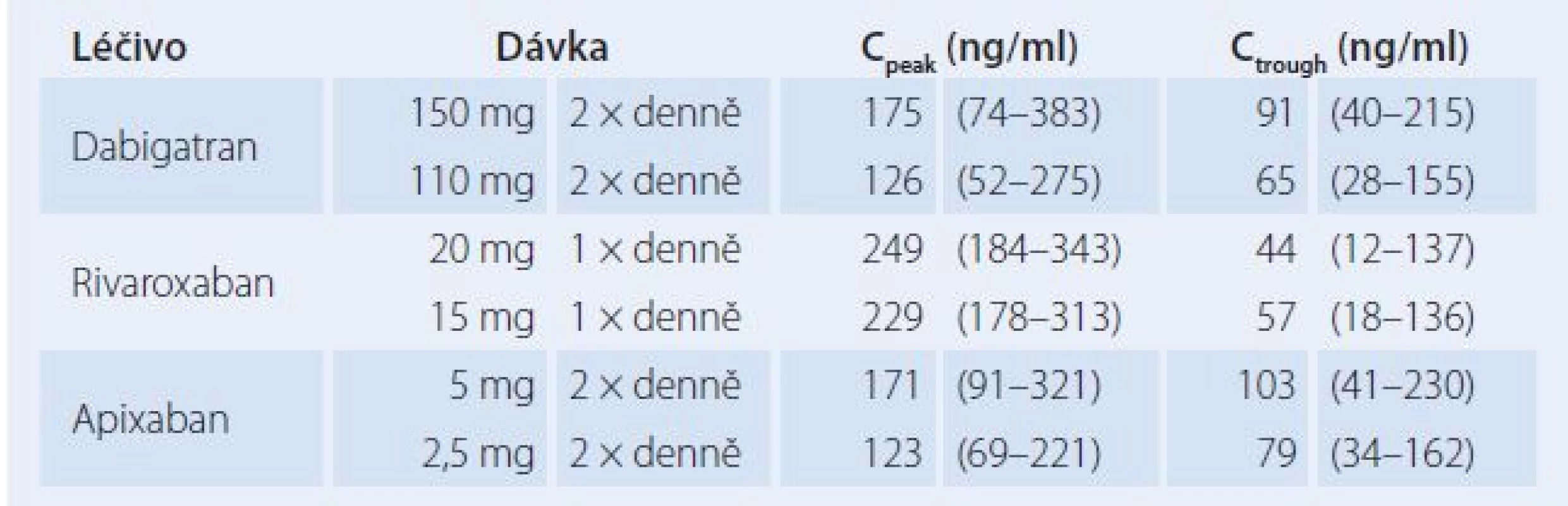
Současný stav lze tedy shrnout tak, že u žádného z DOACs není prozatím provádění TDM považováno za nezbytné. Nicméně v budoucnu může dojít k určité změně především u vyšších dávek a rizikových skupin pacientů. Velmi zajímavá odborná debata se vede především o dabigatranu.
Současný stav: drug concentration measurement
V současné době tedy nelze hovořit o tom, že by se u DOAC používalo skutečné terapeutické monitorování léčiv. Současný stav je na úrovni tzv. DCM (drug concentration measurement), tedy prosté měření koncentrace léčiva bez farmakokinetické interpretace a adjustace dávkovacího režimu. Jedná se o víceméně jednorázové ověření koncentrace léčiva v plazmě pacienta, které slouží k rozhodnutí o dalším postupu v určitých vybraných situacích. Pouze velmi omezeně se používá k adjustaci dávky, víceméně pouze v rozsahu přímo uvedeném v SPC jednotlivých DOACs. V rutinní praxi se používá téměř výhradně nepřímých, farmakodynamických metod výpočtu koncentrace léčiva z příslušných koagulačních testů, tedy dTT u dabigatranu a kalibrovaných chromogenních stanovení anti‑Xa u rivaroxabanu a apixabanu.
Podle současných názorů je vhodné laboratorně ověřit přítomnost DOAC v plazmě pacienta a případně kvantifikovat koncentrace léčiva pomocí farmakodynamických testů uvedených v tab. 1 v následujících situacích:
- Urgentní stavy – nutnost akutní operace, závažné krvácení, předávkování DOAC, ischemická CMP vyžadující trombolýzu.
- Potřeba identifikace pacientů se zvýšeným rizikem krvácení způsobeným nadměrnou expozicí vůči NOAC.
- Nutnost současného podávání léčiv se známou klinicky významnou interakcí DOAC.
- Pokles renálních eliminačních funkcí.
- Ověření compliance pacienta.
Závěr
Monitorování plazmatických koncentrací přímých perorálních antikoagulancií se bude používat nejspíše pouze pro účely výzkumu v klinických studiích. Standardní metodou je v tomto případě LC ‑ MS. V běžné praxi zůstává nenahraditelné při neznalosti konkrétní účinné látky a při potřebě detekovat velmi nízké koncentrace léčiva. Vyhovující je farmakodynamické monitorování pomocí odpovídajících koagulačních parametrů měřených ex vivo. Pro inhibitory trombinu je dTT, pro inhibitory faktoru Xa je to chromogenní stanovení anti‑Xa kalibrované pro příslušnou účinnou látku. Naměřené hodnoty se přepočítávají na plazmatické koncentrace příslušné látky, což je metoda, která již prokázala dostatečnou přesnost s výjimkou minimálních koncentrací. V současné době však není konsenzus v tom, jaké hodnoty představují terapeutické rozmezí. Prozatím není u žádného DOAC v žádné situaci doporučováno opakované měření s cílem adjustace dávkování. Stanovení plazmatických koncentrací pomocí aktivity koagulačních faktorů se zatím používá pouze jednorázově v případech, jakými jsou podezření na noncomplianci, krvácivé komplikace během léčby, potřeba akutních operačních výkonů, trombolýzy a podobně. Názory na tuto problematiku se však vyvíjejí velmi dynamicky a lze předpokládat, že požadavky na ověření vlivu na koagulaci, terapeutické monitorování nebo měření plazmatických koncentrací budou spíše přibývat.
Doručeno do redakce: 11. 1. 2015
Přijato po recenzi: 27. 1. 2015
doc. MUDr. Karel Urbánek, Ph.D.
www.fnol.cz
urbanek@fnol.cz
Sources
1. Levy JH, Spyropoulos AC, Samama CM et al. Direct oral anticoagulants: new drugs and new concepts. JACC Cardiovasc Interv 2014; 7 : 1333 – 1351. doi: 10.1016/ j.jcin.2014.06.014.
2. Harder S, Graff J. Novel oral anticoagulants: clinical pharmacology, indications and practical considerations. Eur J Clin Pharmacol 2013; 69 : 1617 – 1633. doi: 10.1007/ s00228 ‑ 013 ‑ 1510 ‑ z.
3. Schmitz EM, Boonen K, van den Heuvel DJ et al. Determination of dabigatran, rivaroxaban and apixaban by ultra ‑ performance liquid chromatography – tandem mass spectrometry (UPLC ‑ MS/ MS) and coagulation assays for therapy monitoring of novel direct oral anticoagulants. J Thromb Haemost 2014; 12 : 1636 – 1646. doi: 10.1111/ jth.12702.
4. Gous T, Couchman L, Patel JP et al. Measurement of the direct oral anticoagulants apixaban, dabigatran, edoxaban, and rivaroxaban in human plasma using turbulent flow liquid chromatography with high‑resolution mass spectrometry. Ther Drug Monit 2014; 36 : 597 – 605. doi: 10.1097/ FTD.0000000000000059.
5. Douxfils J, Dogné JM, Mullier F et al. Comparison of calibrated dilute thrombin time and aPTT tests with LC ‑ MS/ MS for the therapeutic monitoring of patients treated with dabigatran etexilate. Thromb Haemost 2013; 110 : 543 – 549. doi: 10.1160/ TH13 ‑ 03 ‑ 0202.
6. Douxfils J, Tamigniau A, Chatelain B et al. Comparison of calibrated chromogenic anti‑Xa assay and PT tests with LC ‑ MS/ MS for the therapeutic monitoring of patients treated with rivaroxaban. Thromb Haemost 2013; 110 : 723 – 731. doi: 10.1160/ TH13 ‑ 04 ‑ 0274.
7. Douxfils J, Chatelain C, Chatelain B et al. Impact of apixaban on routine and specific coagulation assays: a practical laboratory guide. Thromb Haemost 2013; 110 : 283 – 294. doi: 10.1160/ TH12 ‑ 12 ‑ 0898.
8. Gouin‑Thibault I, Flaujac C, Delavenne X et al. Assessment of apixaban plasma levels by laboratory tests: suitability of three anti‑Xa assays. A multicentre French GEHT study. Thromb Haemost 2014; 111 : 240 – 248. doi: 10.1160/ TH13 ‑ 06 ‑ 0470.
9. Mismetti P, Laporte S. New oral antithrombotics: a need for laboratory monitoring. For J Thromb Haemost 2010; 8 : 621 – 626. doi: 10.1111/ j.1538 ‑ 7836.2010.03764.x
10. Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against. J Thromb Haemost 2010; 8 : 627 – 630. doi: 10.1111/ j.1538 ‑ 7836.2010.03759.x.
11. Samama MM, Guinet C, Le Flem L. Do new oral anticoagulants require laboratory monitoring? The clinician point of view. Thromb Res 2012; 130 (Suppl 1): S88 – S89. doi: 10.1016/ j.thromres.2012.08.286.
12. Lippi G, Favaloro EJ, Mattiuzzi C. Combined administration of antibiotics and direct oral anticoagulants: a renewed indication for laboratory monitoring? Semin Thromb Hemost 2014; 40 : 756 – 765. doi: 10.1055/ s ‑ 0034 ‑ 1381233.
13. Wong PC, Crain EJ, Watson CA et al. Favorable therapeutic index of the direct factor Xa inhibitors, apixaban and rivaroxaban, compared with the thrombin inhibitor dabigatran in rabbits. J Thromb Haemost 2009; 7 : 1313 – 1320. doi: 10.1111/ j.1538 ‑ 7836.2009.03503.x.
14. Reilly PA, Lehr T, Haertter S et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE ‑ LY Trial (Randomized Evaluation of Long‑Term Anticoagulation Therapy). J Am Coll Cardiol 2014; 63 : 321 – 328. doi: 10.1016/ j.jacc.2013.07.104.
15. Charlton B, Redberg R. The trouble with dabigatran. BMJ 2014; 349: g4681. doi: 10.1136/ bmj.4681.
16. Moore TJ, Cohen MR, Mattison DR. Dabigatran, bleeding, and the regulators. BMJ 2014; 349: g4517. doi: 10.1136/ bmj.4517.
17. Cohen D. Concerns over data in key dabigatran trial. BMJ 2014; 349: g4747. doi: 10.1136/ bmj.g4747.
18. Cohen D. Dabigatran: how the drug company withheld important analyses. BMJ 2014; 349: g4670. doi: 10.1136/ bmj.670.
19. Skeppholm M, Hjemdahl P, Antovic JP et al. On the monitoring of dabigatran treatment in "real life" patients with atrial fibrillation. Thromb Res 2014; 134 : 783 – 789. doi: 10.1016/ j.thromres.2014.06.016.
20. Wannhoff A, Weiss KH, Schemmer P. Increased levels of rivaroxaban in patients after liver transplantation treated with cyclosporine A. Transplantation 2014; 98: e12 – e13. doi: 10.1097/ TP.0000000000000223.
21. Mueck W, Stampfuss J, Kubitza D et al. Clinical pharmacokinetic and pharmacodynamic profile of rivaroxaban. Clin Pharmacokinet 2014; 53 : 1 – 16. doi: 10.1007/ s40262 ‑ 013 ‑ 0100 ‑ 7.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2015 Issue 1-
All articles in this issue
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- TDM antibiotik v klinické praxi
- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

