-
Medical journals
- Career
Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
Authors: L. Riedlbauchová
Authors‘ workplace: Antiarytmické oddělení, Kardiologická klinika 2. LF UK a FN v Motole, Praha
Published in: Kardiol Rev Int Med 2015, 17(1): 32-36
Category: Cardiology Review
Overview
Srdeční resynchronizační léčba má dnes své nezastupitelné místo v léčbě části pacientů se symptomatickým srdečním selháním. Její přínos ke zlepšení symptomů, hemodynamiky nebo kvality života byl potvrzen řadou randomizovaných studií, které současně demonstrovaly, že je tato léčba schopna navodit i reverzní remodelaci srdce projevující se zlepšením systolické funkce a zmenšením dilatace srdečních oddílů. Důsledkem těchto změn je nejen pokles hospitalizací pro kardiální dekompenzace, ale také příznivé ovlivnění jak celkové, tak kardiální mortality. Účinnost srdeční resynchronizační léčby je však interindividuálně variabilní, což klade důraz především na selekci vhodných kandidátů k této terapii, které je věnován následující text vycházející z aktuálních doporučení Evropské kardiologické společnosti.
Klíčová slova:
srdeční resynchronizační léčba – biventrikulární stimulace – kardiostimulace – srdeční selhání – dyssynchronieÚvod
Rostoucí prevalence chronického srdečního selhání je závažným problémem současnosti. V rozvinutých zemích postihuje toto onemocnění přibližně 2 % populace a je důvodem asi 1 % všech akutních vyšetření v nemocnicích [1]. Předpokládá se přitom, že výskyt srdečního selhání bude v následujících desetiletích trvale růst. I přes významné zlepšení prognózy (medián přežití se z 3,5 let v 80. letech 20. století posunul na současných cca 8 let) [2,3] související se zavedením léků zasahujících jednotlivé úrovně neurohumorální kaskády zůstává mortalita srdečního selhání vysoká, a proto je věnována studiu patofyziologie a zejména léčbě srdečního selhání nadále vysoká pozornost.
Srdeční dyssynchronie – cíl srdeční resynchronizační terapie
Různá kardiální onemocnění jsou sice kompenzována specifickými adaptačními mechanizmy, nicméně po jejich vyčerpání dochází k aktivaci patofyziologické kaskády srdečního selhání, která má do značné míry obdobné rysy bez ohledu na typ vyvolávajícího onemocnění. Jednou z konsekvencí těchto funkčních a strukturálních změn je také rozvoj srdeční dyssynchronie, tedy poruchy koordinované činnosti jednotlivých srdečních oddílů vůči sobě navzájem. Dyssynchronie se nejčastěji týká tří úrovní:
AV dyssynchronie – prodloužení AV převodu vede k posunu systoly komor vůči systole síní, což ovlivňuje způsob a délku plnění komor (a tím i velikost tepového výdeje) a vede také k rozvoji mitrální insuficience. Poruchy nitrokomorového vedení mohou podmínit asynchronní kontrakci levé komory vůči komoře pravé (interventrikulární dyssynchronie), ale také abnormální souhru jednotlivých stěn levé komory vůči sobě navzájem (intraventrikulární dyssynchronie). Obě tyto patologie indukují další pokles tepového výdeje, progresi mitrální insuficience a srdeční remodelaci manifestující se mimo jiné i progredující dilatací srdečních oddílů a zhoršováním systolické funkce komor.
Předpokládá se, že příznivý efekt srdeční resynchronizační terapie (CRT) je podmíněn právě zásahem do dyssynchronní aktivace srdce. Biventrikulární stimulací (dnes hlavní formou resynchronizační léčby) je totiž možné dosáhnout úpravu atrio ‑ , inter ‑ i intraventrikulární dyssynchronie, a tím zlepšit systolickou funkci levé komory, zmírnit funkční mitrální insuficienci, upravit průběh plnění komor a v dlouhodobém horizontu přispět i ke zpomalení srdeční remodelace nebo indukovat proces opačný, tzv. reverzní remodelaci srdce. Všechny tyto změny se projeví ústupem dušnosti, zlepšením kvality života a v optimálním případě i zvýšením ejekční frakce, zmenšením objemů levé komory, poklesem hospitalizací pro kardiální dekompenzaci a zlepšením mortality.
Efekt CRT je však značně interindividuálně odlišný, za což je zřejmě zodpovědný různý poměr a tíže jednotlivých složek srdeční dyssynchronie a naše schopnost je cíleně ovlivnit. Současné možnosti, jak posoudit přítomnost, typ a rozsah dyssynchronie, jsou však omezené a vychází stále především z hodnocení EKG (šíře a morfologie QRS komplexu).
Pacienti se sinusovým rytmem
Řada velkých studií prokázala, že CRT snižuje mortalitu a počet hospitalizací pro kardiální dekompenzaci, zlepšuje funkci levé komory a indukuje reverzní remodelaci u pacientů se srdečním selháním, pokud mají významně sníženou ejekční frakci levé komory (≤ 35 %), kompletní blokádu levého raménka Tawarova a zůstávají symptomatičtí i při optimální medikamentózní léčbě [3 – 8]. U takových nemocných je jednoznačně potvrzena superiorita CRT v porovnání s pouze farmakologickou léčbou. Protože nebyl pozorován větší rozdíl v efektu CRT na morbiditu a mortalitu mezi pacienty ve funkční třídě NYHA II, IIIa těmi nemocnými s NYHA IV, kteří jsou sice významně symptomatičtí, ale nebyli v posledních 30 dnech hospitalizováni pro kardiální dekompenzaci („ambulantní“ NYHA IV), jsou v současnosti vydána společná doporučení pro celou tuto skupinu nemocných (tab. 1). Méně důkazů o účinnosti CRT je zatím u nemocných ve třídě NYHA I a pokročilé NYHA IV, kde je potřeba rozhodnutí o vhodnosti CRT individuálně zvažovat.
Table 1. Indikace CRT u pacientů se sinusovým rytmem. 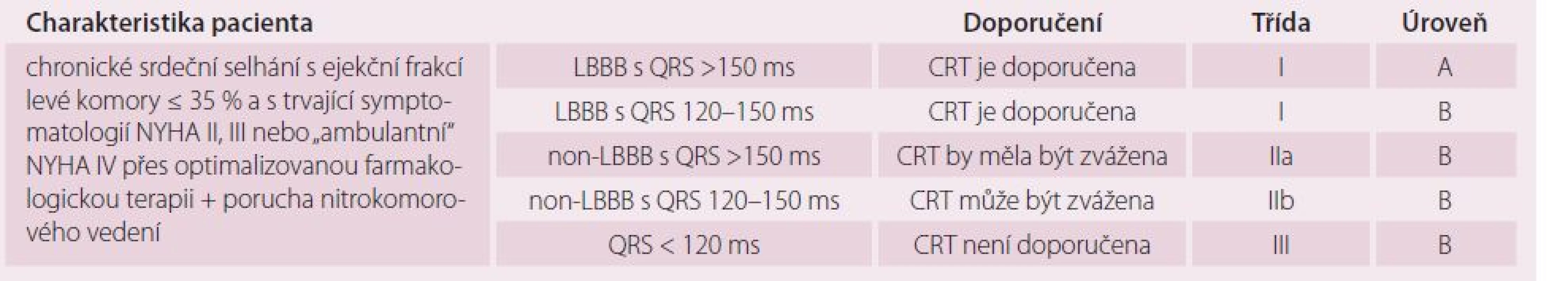
Zásadním posunem nových doporučení Evropské kardiologické společnosti z roku 2013 [9] je důraz kladený nejen na přítomnost nitrokomorové poruchy vedení, ale i na typ této poruchy a její stupeň, které do značné míry reflektují přítomnost, stupeň a charakter dyssynchronie. Subanalýzy randomizovaných studií a metaanalýzy totiž nasvědčují tomu, že CRT je účinná u nemocných s typickou blokádou levého raménka Tawarova (definice viz tab. 2), zatímco dopad této terapie u nemocných s jinými poruchami nitrokomorového převodu („non‑LBBB“, tj. nespecifická porucha převodu, blokáda pravého raménka Tawarova) je měnlivý, zejména pokud je blokáda nitrokomorového převodu jen mírnějšího stupně (šíře QRS komplexu nepřesahuje 150 ms). Naproti tomu nemocní s typickou blokádou levého raménka Tawarova mohou ze CRT profitovat i pokud je jejich QRS komplex užší (≥ 120 ms), obecně však lze větší efekt očekávat u těch, kde je šíře QRS ≥ 150 ms. Naopak u pacientů s úzkým QRS komplexem (< 120 ms) chybí evidence o účinnosti CRT, a tato léčba proto není u takových nemocných se srdečním selháním indikována bez ohledu na stupeň symptomů i typ poruchy nitrokomorového převodu.
Table 2. Definice nitrokomorových poruch převodu [9]. ![Definice nitrokomorových poruch převodu [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bf37f2245b1ac1b897fc75a291420f02.jpg)
Podle epidemiologických průzkumů má jen asi 36 % pacientů s dysfunkcí levé komory ejekční frakci nižší než 35 % a z toho jen 41 % má současně také rozšířený QRS komplex ≥ 120 ms (nejčastěji tvaru blokády levého raménka Tawarova) [10]. Podle uvedených kritérií je proto k CRT indikována relativně malá část populace nemocných se srdečním selháním (cca 5 – 10 %), v absolutních počtech se však i přesto jedná o poměrně velký počet jedinců (cca 400 kandidátů CRT/ milion obyvatel v EU) [10,11].
Subanalýzy dále naznačují, že větší efekt na morbiditu a mortalitu může mít CRT u pacientů s neischemickou kardiomyopatií a u žen, tato pozorování však bude nutné ještě dále verifikovat.
Pacienti s perzistující/ /permanentní fibrilací síní
Nemocní se srdečním selháním a perzistující/ permanentní fibrilací síní se od těch se sinusovým rytmem liší v několika směrech: nepravidelná a často rychlá komorová frekvence při fibrilaci síní může přispívat k progresi srdečního selhání, u části pacientů pak může být fibrilace síní dokonce i bezprostřední příčinou srdečního selhání (tzv. tachykardií indukovaná kardiomyopatie). V obou případech může kontrola komorové odpovědi sama o sobě podmínit významné zlepšení kardiální kompenzace. Fakt, že perzistující/ permanentní fibrilace síní se častěji vyskytuje u pacientů ve vyšším věku a s větším množstvím komorbidit, však může vysvětlovat poněkud horší prognózu pacientů se symptomatickým srdečním selháním a perzistující/ permanentní fibrilací síní a ovlivňovat rovněž účinnost CRT u této skupiny nemocných.
Přestože evidence o účinnosti CRT u pacientů se srdečním selháním a perzistující/ permanentní fibrilací síní je výrazně menší než u nemocných se sinusovým rytmem, převládá názor, že CRT je účinná i u této subpopulace nemocných, a to v obdobných indikacích (co se stupně dysfunkce levé komory a šíře QRS týká) jako u nemocných se sinusovým rytmem [9].Protože je málo dat o roli CRT u pacientů ve funkční třídě NYHA II, je tato léčba u jedinců s fibrilací síní indikována až při pokročilejších symptomech (NYHA III – IV) (tab. 3).
Table 3. Indikace CRT u pacientů s perzistující/permanentní fibrilací síní. 
CRT ale může být u obou podskupin nemocných (tj. u těch se sinusovým rytmem i s perzistující/ permanentní fibrilací síní) účinná pouze tehdy, je‑li zajištěno, že se biventrikulární stimulace bude uplatňovat ve > 99 % času. Toho je možné dosáhnout u pacientů se sinusovým rytmem relativně snadno úpravou atrioventrikulárního zpoždění (ekvivalent PQ intervalu). Nicméně u nemocných s fibrilací síní může nepravidelnost komorového převodu a nevyrovnaná komorová odpověď v klidu vs při zátěži významně snižovat % biventrikulární stimulace, a přispívat tak k horším výsledkům CRT u těchto jedinců. Proto pokud není u pacientů s fibrilací síní možné zajistit adekvátní kontrolu komorové odpovědi ani potencovanou bradykardizující terapií a biventrikulární stimulace se tak uplatňuje v < 99 % času, je na místě zvážit provedení ablace AV junkce (tab. 3, obr. 1).
Image 1. Indikace ablace AV junkce u pacientů se symptomatickou fibrilací síní a optimalizovanou farmakologickou léčbou [9]. ![Indikace ablace AV junkce u pacientů se symptomatickou fibrilací síní a optimalizovanou farmakologickou léčbou [9].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f4f4e21e6316ae5667436b7c5e2c79a5.jpg)
AV – atrio-ventrikulární, BiV – biventrikulární, CRT – srdeční resynchronizační terapie (cardiac resynchronization therapy), CRT-P – biventrikulární kardiostimulátor (pacemaker), CRT-D – biventrikulární defibrilátor, ICD – implantabilní kardioverter-defibrilátor Zvláštní skupinu představují nemocní, jejichž primárním problémem je nekontrolovatelná komorová odpověď při fibrilaci síní, pro kterou je indikována ablace AV junkce s následnou implantací kardiostimulátoru. Zpomalení a odstranění nepravidelnosti komorové frekvence totiž mohou vést samy o sobě k výraznému ústupu symptomů a známek srdečního selhání, a to i přesto, že arteficiální stimulace z hrotu pravé komory je podkladem značně dyssynchronní aktivace komor. Ta může u některých jedinců (zejména s již preexistující dysfunkcí levé komory) po čase převážit nad příznivým dopadem kontroly komorové odpovědi a podmínit rozvoj nebo zhoršení srdečního selhání na podkladě stimulací indukované dyssynchronie. CRT jejímu rozvoji může účinně předejít, a je proto vhodné zvažovat použití CRT i u pacientů, kteří podstupují ablaci AV junkce pro nekontrolovatelnou komorovou odpověď v rámci fibrilace síní a již před ablací mají vyjádřený určitý stupeň systolické dysfunkce (tab. 3, obr. 1), protože CRT u těchto nemocných může zlepšit kvalitu života a snížit počet hospitalizací pro kardiální dekompenzaci [12,13]. Použití CRT u pacientů, kteří jsou indikováni k ablaci AV junkce, ale mají zatím zachovalou systolickou funkci, je však otazné, protože CRT v této skupině nemocných nepřináší jednoznačný benefit v porovnání s konvenční stimulací z pravé komory.
Pacienti se srdečním selháním a indikací konvenční kardiostimulace
U nemocných se srdečním selháním se nezřídka setkáváme i s bradyarytmiemi, které jsou indikací ke konvenční kardiostimulaci. Ta je sice schopná účinně odstranit přítomnou bradyarytmii, ale dyssynchronie indukovaná konvenční stimulací z hrotu pravé komory může podmínit zhoršení nebo i de novo vznik dysfunkce levé komory a srdečního selhání. Řada studií potvrdila, že riziko rozvoje srdečního selhání stoupá v závislosti na tom, jak často se komorová stimulace uplatňuje (čím vyšší % komorové stimulace, tím vyšší riziko vzniku srdečního selhání a dalších komplikací dlouhodobé pravokomorové stimulace).
V klinické praxi se setkáváme s dvěma si-tuacemi (tab. 4):
- upgrade konvenčního kardiostimulátoru nebo defibrilátoru na CRT – častějším scénářem je pacient, který v minulosti podstoupil implantaci konvenčního kardiostimulátoru, resp. defibrilátoru z bradykardické indikace a u něhož v dlouhodobém horizontu dojde k poklesu ejekční frakce a rozvoji známek srdečního selhání. Existuje dostatečná evidence o tom, že u takovýchto nemocných je upgrade původního systému na CRT schopen příznivě ovlivnit symptomy, zlepšit hemodynamickou situaci a snížit nutnost hospitalizací pro kardiální dekompenzaci [14,15]. Podle různých registrů představuje dnes upgrade konvenčního kardiostimulátoru na CRT až 25 % všech implantací CRT [16].
- de novo implantace CRT – druhým scénářem je situace, kdy se pacient současně prezentuje jak dysfunkcí levé komory, resp. manifestním srdečním selháním, tak bradyarytmií, a vyžaduje tak de novo implantaci systému, který bude současně řešit bradyarytmii i již přítomnou dyfunkci a dyssynchronii. I když síla důkazů o účinnosti de novo implantace CRT není v takovýchto případech zatím vysoká, ukazuje se, že CRT má roli i u této podskupiny jedinců, kde může příznivě ovlivnit symptomy, kvalitu života a snížit počet hospitalizací pro kardiální dekompenzaci [17]. Je však vždy potřeba také zvážit, nakolik je klinicky manifestní srdeční selhání podmíněno samotnou bradyarytmií a nakolik se na něm podílí přítomná systolická dysfunkce.
Table 4. CRT u pacientů se srdečním selháním a indikací konvenční kardiostimulace pro bradyarytmie. 
Biventrikulární defibrilátor nebo biventrikulární kardiostimulátor?
Nejčastějšími příčinami úmrtí pacientů se symptomatickým srdečním selháním je buď progrese do terminálního kardiálního selhání, nebo náhlá smrt, nejčastěji na podkladě maligních komorových arytmií. Komplexní léčba pacienta se symptomatickým srdečním selháním proto zahrnuje jak prevenci další progrese srdeční remodelace, tak ovlivnění rizika náhlé arytmické smrti. CRT má své místo především ve zlepšení symptomů a kardiální kompenzace s výsledným poklesem hospitalizací pro kardiální dekompenzaci, ale ukazuje se, že cestou reverzní remodelace může částečně ovlivnit i riziko arytmické smrti. V prevenci náhlé arytmické smrti mají ale jinak svou nezastupitelnou úlohu především implantabilní kardioverter ‑ defibrilátory (ICD). Logickou úvahou proto je, že kombinací CRT a ICD lze dosáhnout výraznějšího snížení rizika arytmické smrti než samotnou léčbou pomocí CRT. Dosud však nemáme žádnou randomizovanou studii, která by obě terapie – biventrikulární defibrilátor (CRT ‑ D) a biventrikulární kardiostimulátor (CRT ‑ P) – srovnávala v tomto ohledu přímo. Provedené randomizované studie ale naznačují, že CRT ‑ D vede k výraznému zlepšení celkové i arytmické mortality v porovnání s optimalizovanou farmakologickou léčbou už v prvních 16 měsících, ale relativní snížení rizika arytmické smrti u CRT ‑ P je v tomto období jen hraniční [4,5]. Při delším sledování je však již možné jistý rozdíl detekovat i u CRT ‑ P (absolutní snížení rizika náhlé smrti o 5,6 % u CRT ‑ P v porovnání s optimalizovanou farmakologickou léčbou v horizontu 37 měsíců) [18], což může značit, že zatímco riziko úmrtí na progresi srdečního selhání snižuje CRT bezprostředně, redukce rizika náhlé arytmické smrti vyžaduje daleko delší čas, protože je vázáno na reverzní remodelaci srdce, ke které dochází zpravidla až v řádu měsíců. Přestože zatím chybí jasný důkaz o superioritě CRT ‑ D nad CRT ‑ P, převládá názor, že CRT ‑ D má schopnost snížit celkovou mortalitu i riziko arytmické smrti více než CRT ‑ P, a CRT ‑ D by proto měla být preferovanou léčbou [9]. Existují ale jisté faktory, které potenciálně snižují účinnost CRT ‑ D, resp. favorizují použití CRT ‑ P (tab. 5), a které je proto při volbě typu léčby vhodné zohlednit.
Table 5. Indikace kombinované terapie CRT + ICD (A) a faktory, které je vhodné při volbě mezi CRT-P a CRT-D zohlednit (B). 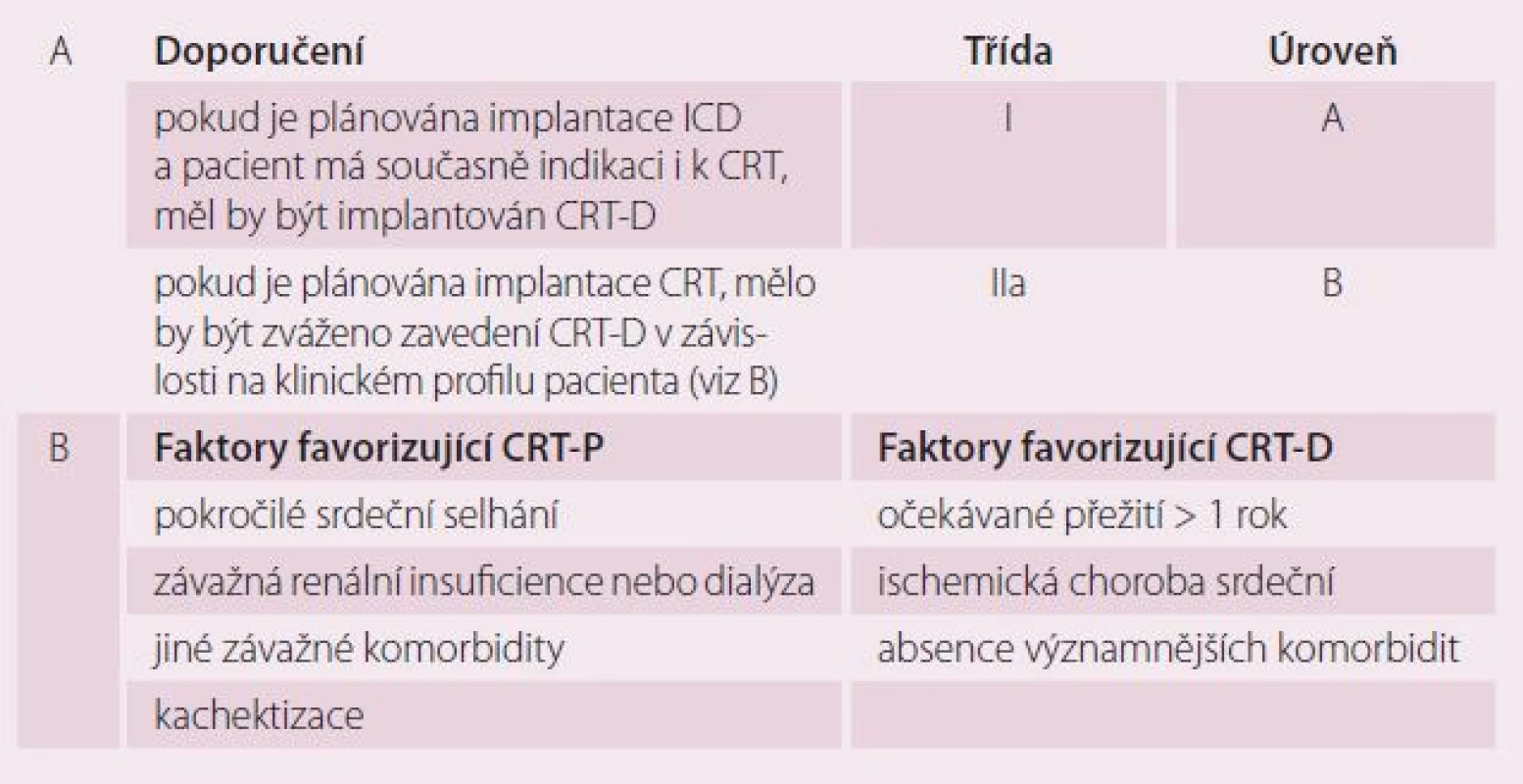
Závěr
O nezastupitelnosti CRT v léčbě symptomatického srdečního selhání dnes již není pochyb. Současná doporučení reflektují ty skupiny pacientů, u nichž má CRT jednoznačně prokázanou účinnost. Existuje však řada faktorů, které modifikují efektivitu této léčby, a jsou také skupiny jedinců, u kterých lze sice předpokládat příznivý dopad CRT, ale prozatím máme jen málo důkazů ve prospěch této léčby. Je možné očekávat, že pokračující výzkum na obou těchto polích přinese v budoucnosti další poznatky jak o mechanizmu působení CRT, tak i o dalších možných indikacích této léčby, resp. upřesnění indikací stávajících.
Doručeno do redakce: 9. 11. 2014
Přijato po recenzi: 28. 1. 2015
doc. MUDr. Lucie Riedlbauchová, Ph.D.
www.fnmotol.cz
lucie.riedlbauchova@fnmotol.cz
Sources
1. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787 – 1847. doi: 10.1093/ eurheartj/ ehs104.
2. Cohn JN, Archibald DG, Ziesche S et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Cooperative Study. N Engl J Med 1986; 314 : 1547 – 1552.
3. Cleland JG, Daubert JC, Erdmann E et al. Longer‑term effects of cardiac resynchronization therapy on mortality in heart failure [the CArdiac REsynchronization – Heart Failure (CARE ‑ HF) trial [extension phase]. Eur Heart J 2006; 27 : 1928 – 1932.
4. Bristow MR, Saxon LA, Boehmer J et al. Cardiac ‑ resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350 : 2140 – 2150.
5. Cleland JG, Daubert JC, Erdmann EE et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352 : 1539 – 1549.
6. Zareba W, Klein H, Cygankiewicz I et al. Effectiveness of cardiac resynchronization therapy byQRS morphology in the multicenter automatic defibrillator implantation trial ‑ cardiac resynchronization therapy (MADIT ‑ CRT). Circulation 2011; 123 : 1061 – 1072. doi: 10.1161/ CIRCULATIONAHA.110.960898.
7. Linde C, Abraham WT, Gold MR et al. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heartfailure symptoms. J Am Coll Cardiol 2008; 52 : 1834 – 1843. doi: 10.1016/ j.jacc.2008.08.027.
8. Tang AS,Wells GA, Talajic M et al. Cardiac ‑ resynchronization therapy for mild ‑ to ‑ moderate heart failure. N Engl J Med 2010; 363 : 2385 – 2395. doi: 10.1056/ NEJMoa1009540.
9. Brignole M, Auricchio A, Baron ‑ Esquivias G et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34 : 2281 – 2329. doi: 10.1093/ eurheartj/ eht150.
10. Khan NK, Goode KM, Cleland JG et al. Prevalence of ECG abnormalities in an international survey of patients with suspected or confirmed heart failure at death or discharge. Eur J Heart Fail 2007; 9 : 491 – 501.
11. Nieminen MS, Brutsaert D, Dickstein K et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J 2006; 27 : 2725 – 2736.
12. Doshi RN, Daoud EG, Fellows C et al. Left ventricular‑based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005; 16 : 1160 – 1165.
13. Brignole M, Gammage M, Puggioni E et al. Comparative assessment of right, left, and biventricular pacing in patients with permanent atrial fibrillation. Eur Heart J 2005; 26 : 712 – 722.
14. Hoijer CJ, Meurling C, Brandt J. Upgrade to biventricular pacing in patients with conventional pacemakers and heart failure: a double‑blind, randomized crossover study. Europace 2006; 8 : 51 – 55.
15. van Geldorp IE, Vernooy K, Delhaas T et al. Beneficial effects of biventricular pacing in chronically right ventricular paced patients with mild cardiomyopathy. Europace 2010; 12 : 223 – 229. doi: 10.1093/ europace/ eup378.
16. Dickstein K, Bogale N, Priori S et al. The European cardiac resynchronization therapy survey. Eur Heart J 2009; 30 : 2450 – 2460. doi: 10.1093/ eurheartj/ ehp359.
17. Curtis AB,Worley S Adamson PB et al. Biventricular pacing for atrioventricular block and systolic dysfunction. New Engl J Med 2013; 368 : 1585 – 1593. doi: 10.1056/ NEJMoa1210356.
18. Cleland JG, Freemantle N, Erdmann E et al. Long‑term mortality with cardiac resynchronization therapy in the Cardiac Resynchronization ‑ Heart Failure (CARE ‑ HF) trial. Eur J Heart Fail 2012; 14 : 628 – 634. doi: 10.1093/ eurjhf/ hfs055.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2015 Issue 1-
All articles in this issue
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- TDM antibiotik v klinické praxi
- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

