-
Medical journals
- Career
Upstream terapie u fibrilace síní
Authors: R. Lábrová; J. Špinar
Authors‘ workplace: Interní kardiologická klinika LF MU a FN Brno
Published in: Kardiol Rev Int Med 2011, 13(3): 160-166
Overview
Spouštěcí ektopie a arytmogenní substrát pro udržení fibrilace síní jsou spojené s elektrickou, strukturální a následně mechanickou remodelací myokardu síní a jsou výrazně ovlivňovány mnoha modulujícími faktory. Sama fibrilace síní remodelační změny ještě prohlubuje. Tzv. upstream terapie je časným zásahem do patogeneze vzniku fibrilace síní, do procesu remodelace a podává se v primární nebo sekundární prevenci. Renin-angiotenzin-aldosteronový systém se významně podílí na patofyziologii vzniku a také udržení fibrilace síní, významně ovlivňuje vývoj elektrické a strukturální remodelace. Blokáda tohoto systému se uplatní v prevenci vzniku a rekurence fibrilace síní a tím také sníží následky, které s sebou fibrilace síní nese. Jednoznačná indikace podání této terapie je u pacientů s hypertenzí a zvláště s přítomnou hypertrofií levé komory a se srdečním selháním a dysfunkcí levé komory. V těchto případech je léčba indikována i bez ohledu na fibrilaci síní. U pacientů s méně vyjádřeným strukturálním postižením srdce nebo i v sekundární prevenci nejsou výsledky tak průkazné. Podání statinů s protizánětlivým účinkem je indikováno v rámci primární prevence u postoperační fibrilace síní, zvláště u aortokoronárního bypassu či operace chlopenní vady; podání statinů lze zvážit u srdečního selhání, hypertenze, ischemické choroby srdeční. U pacientů bez kardiovaskulárního onemocnění nejsou blokátory renin-angiotenzin-aldosteronového systému a statiny indikovány v primární prevenci. Vliv různých protizánětlivých léků, kortikoidů, vícenenasycených mastných kyselin a dalších látek na fibrilaci síní nebyl jednoznačně prokázán, proto v rámci upstream terapie nejsou indikovány.
Klíčová slova:
fibrilace síní – síňová remodelace – upstream terapie – inhibitory angiotenzin konvertujícího enzymu – blokátory receptoru 1 pro angiotenzin II – statiny – steroidy – vícenenasycené mastné kyselinyÚvod
Fibrilace síní (FS) je nejčastější srdeční arytmií, je spojena se zvýšenou morbiditou a mortalitou. Mortalita u pacientů s FS je asi 2krát vyšší než u pacientů bez arytmie. Navíc FS a srdeční selhání často existují současně a mají vzájemný nepříznivý prognostický dopad [1].
Počet pacientů s jakoukoli formou FS v populaci neustále stoupá. Podle epidemiologické studie z Rochesteru došlo k dvoj - až trojnásobnému zvýšení prevalence FS v letech 1980–1989 ve srovnání s daty v období 1919–1960. Vyšší výskyt se nedá vysvětlit pouze stárnutím populace – byl vyšší i po korekci na věk, pohlaví a přidružená onemocnění. Předpokládá se, že v následujících 50 letech se zvýší počet pacientů s FS 2,5–5krát [2]. FS se tak stává naléhavým problémem nejen ve zdravotnictví, ale i v sociální a ekonomické oblasti.
Spouštěcí ektopie i arytmogenní substrát pro udržení arytmie jsou výrazně ovlivňovány mnoha modulujícími faktory. Mezi nové rizikové faktory FS patří zánět, obezita a metabolický syndrom, obstrukční spánková apnoe, diastolická dysfunkce levé komory s arteriální rigiditou. Který z rizikových faktorů má největší význam zatím není zcela jasné. Proto je odhalení a pochopení patofyziologie FS na všech úrovních nutné ke stanovení nejen účinné léčby, ale především prevence [3].
Upstream terapie
U osob s velkým rizikem vzniku FS by se měla zahájit určitá preventivní strategie, která by měla zabránit remodelaci síňového myokardu a tím vzniku nové FS, ale také u pacientů s již známou FS by se další léčebná strategie měla podílet na větší účinnosti zavedené antiarytmické terapie ke kontrole rytmu. Tzv. upstream léčba vede k prevenci a také léčbě remodelace síní, která se podílí na vzniku a udržení FS.
Upstream terapie je tedy časným zásahem do patogeneze FS, protože přímo ovlivňuje proces remodelace síňového myokardu. Elektrická, strukturální a mechanická remodelace myokardu síní je spojená se vznikem a udržováním FS. Sama FS potom remodelační proces udržuje a dále ještě prohlubuje a při neúčinné terapii paroxyzmální forma FS dále přechází v perzistentní až permanentní formu. Naopak nástupem sinusového rytmu se spouští pozitivní reverzní remodelace [4].
Podání upstream terapie v rámci primární prevence má u pacientů bez FS v anamnéze zabránit remodelačním změnám myokardu síní a tím vzniku nové FS. Upstream terapie v rámci sekundární prevence se potom podává u pacientů s již dokumentovanou arytmií. Má zabránit nejen progresi strukturální remodelace, ale také navodit pozitivní reverzní remodelaci. Reverzibilní změny však nemusí být úplné. Cílem léčby je předejít dalším recidivám FS nebo zabránit progresi do permanentní formy [5].
V upstream terapii se nejčastěji užívají blokátory renin-angiotenzin-aldosteronového systému (RAAS) – inhibitory angiotenzin konvertujícího enzymu (ACE-I) a blokátory angiotenzinových receptorů 1 pro angiotenzin II (ARB), dále statiny a také vícenenasycené mastné kyseliny (PUFA).
Remodelace myokardu síní
Podkladem elektrické remodelace je změna délky akčních potenciálů v čase i mezi jednotlivými oblastmi myokardu síní a je ovlivňována řadou modulujících faktorů [6]. Různorodost akčních potenciálů souvisí převážně s vápníkovými a draslíkovými iontovými kanály. Během FS se redukují L-typy kalciových proudů. Zkrácení efektivní refrakterní periody, zkrácení trvání akčního potenciálu a dále heterogenita refrakterních period vedou k udržování FS [7]. Čím jsou rychlost vedení a efektivní refrakterní perioda síňového myokardu delší, tím méně může být současně probíhajících reentry okruhů – tím je větší pravděpodobnost, že probíhající elektrický impuls narazí na refrakterní tkáň a reentry okruh vyhasne a FS se ukončí.
Jedním ze spouštěčů FS může být jak sympatikus, tak i parasympatikus, a to ovlivněním iontových kanálů v síňovém myokardu. Adrenergní stimulace zvyšuje vstup kalcia do buněk cestou kalciových iontových kanálů, tím zvyšuje kontraktilitu a potencuje ektopickou aktivitu. Cholinergní stimulace aktivuje draslíkové kanály, které jsou napojené na muskarinové receptory aktivující reentry okruhy.
Angiotenzin II také nepřímo ovlivňuje iontové kanály. Stimulace AT1 receptorů aktivuje fosfolipázu C, která vede k inozitol trifosfátem indukovanému uvolnění vápníku ze sarkoplazmatického retikula. Zvýšená hladina vápníku a redukce draslíku potom ovlivňují změnu síňové refrakterity [8].
Během několika měsíců dochází při strukturální remodelaci k rozvoji morfologických změn. Vzniká dilatace a hypertrofie síní, objevují se hypertrofie myocytů, myolýza, fibrotické změny, tuková infiltrace. Depozita vaziva mezi myocyty síní vedou k dalším elektrofyziologickým heterogenitám, které vedou ke vzniku reentry okruhů a tím se podílejí na vzniku a udržování FS [6,9]. Myolýza je spojená s úbytkem kontraktilních elementů v myocytech síní. Z toho důvodu nedochází po verzi FS na SR k úpravě síňové kontraktility hned, ale obnoví se až po několika týdnech [10]. Z toho důvodu je vysoké riziko vzniku trombu a následné trombembolie i po úspěšné verzi, proto je nutné alespoň jeden měsíc po verzi pacienta účinně warfarinizovat.
RAAS se podílí i na strukturální remodelaci síní. Pokud je vazebným místem pro angiotenzin II AT1 receptor, indukují se hypertrofie síňových myocytů, fibróza a dochází k postižení kontraktility síní. Stimulace AT2 receptoru má účinek opačný a proliferativní procesy inhibuje. AT1 receptorová deregulace potom souvisí s těžšími formami FS [11]. Angiotenzin II dále aktivuje proteinkinázy, které indukují apoptózu a fibrózu.
V důsledku strukturální remodelace dochází postupně k vývoji mechanické remodelace síní, při které se snižuje kontraktilita levé síně a také se snižuje výdejová rychlost ouška. Vytváří se podmínky pro krevní stázu a tím se zvyšuje riziko tvorby trombu a trombo-embolie. Při chybění síňového příspěvku může dojít ke snížení minutového srdečního výdeje až o 20 %, což může přispět především k dekompenzaci chronického srdečního selhání u pacienta s dysfunkcí levé komory.
ACE-inhibitory a blokátory angiotenzinových receptorů
U pacientů s kardiovaskulárním onemocněním a zvláště s přítomnou dysfunkcí levé komory se zvyšuje aktivace RAAS, který se podílí na regulaci rovnováhy vodního prostředí, minerálů a dále reguluje cévní odpověď na poškození a zánět. V poslední době je prokázané v řadě mezinárodních multicentrických studií, že inhibitory ACE a ARB snižují kardiovaskulární morbiditu, mortalitu a zabraňují vzniku nové FS u pacientů se srdečním selháním, dysfunkcí levé komory a po srdečním infarktu, po mozkové příhodě a s přítomnou arteriální hypertenzí [12].
Nejvíce údajů o účincích upstream terapie u FS je zatím pro preparáty zasahující do systému renin-angiotenzin-aldosteron, tedy ACE-I a ARB – sartany (obr. 1). Mechanizmus, kterým blokáda RAAS zabrání FS, zahrnuje snížení síňového napětí, snížení end-diastolického tlaku levé komory a následně tlaku levé síně, a tím předchází vzniku síňové fibrózy. Modifikuje sympatický tonus, moduluje iontové proudy a mění refrakteritu síní, čímž posiluje antiarytmické účinky. Inhibitory ACE snižují periferní cévní rezistenci a mají mírný venodilatační účinek. Způsobují pokles tlaku, ale nezvyšují baroreceptory zprostředkované zrychlení tepové frekvence. ARB na rozdíl od inhibitorů ACE účinkují, i když dojde k přeměně angiotenzinu I na angiotenzin II jinými cestami než prostřednictvím angiotenzin konvertujícího enzymu, například účinkem nespecifických tkáňových aminopeptidáz.
Image 1. Syntéza angiotenzinu a možná inhibice jeho účinku. Angiotenzinogen se syntetizuje v játrech, renin v ledvinách. Renin je enzym, který konvertuje angiotenzinogen na angiotenzin I, což je neúčinný dekapeptid. Konverzí dekapeptidu-angiontenzinu I na oktapeptid-angiotenzin II se získává jedna z nejúčinnějších presorických látek. Angiotenzin II se váže na specifický receptor AT<sub>1</sub>, čímž se vyvolá mohutná přímá vazokonstrikce a stimuluje se také vyplavení aldosteronu a noradrenalinu. Abychom zabránili účinkům angiotenzinu II, používáme inhibitory ACE, které inhibují angiontenzin konvertující enzym. Druhou možností je podání kompetitivních antagonistů AT<sub>1</sub> (blokátorů AT<sub>1</sub> receptorů) – sartanů, které tento receptor obsadí a tím zabrání působení angiotenzinu II. Inhibitory ACE brání rozpadu bradykininu a jeho zvýšenou koncentrací se mohou objevit jeho nežádoucí účinky jako kašel a angioneurotický edém. 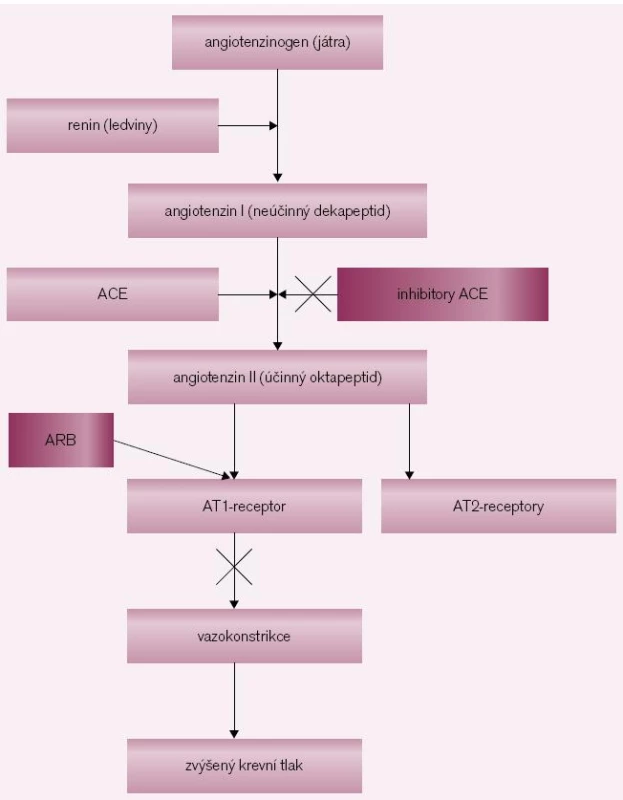
Mechanizmem účinku je hlavně omezení vlivu angiotenzinu II, který je největším stimulátorem fibrózy myokardu, jež je nejvýznamnějším rizikovým faktorem strukturální remodelace a tím se podílí na vzniku a udržování FS. Angiotenzin II dále způsobuje hypertrofii myokardu, poruchu mezibuněčného spojení a chybnou funkci iontových kanálů. Angiotenzin II vede k progresi zánětlivých změn, protože aktivuje různé zánětlivé mediátory, např. C-reaktivní protein, tumor nekrosis faktor alfa, interleukin 6, nukleární faktor kappa B, nukleární faktor alfa a také stimuluje infiltraci neutrofily [13].
Při pokročilejší remodelaci síní je menší pravděpodobnost k obnovení a udržení sinusového rytmu (SR), vznikají častější a delší ataky FS a následně paroxyzmální FS přechází v chronické formy. Zabráněním remodelace síní se zvýší pravděpodobnost udržení SR, což také ukazují studie se síňovými defibrilátory, kdy časná léčba atak FS vedla ke snížení četnosti paroxyzmů FS.
Vzhledem k tomu, že RAAS se významně podílí na vzniku a udržení FS, lze předpokládat, že blokáda RAAS inhibitory ACE a ARB může být prospěšná při léčbě FS. Proto byla provedena retrospektivní analýza multicentrických randomizovaných studií, aby se získala klinická data, která prokazují účinek inhibitorů ACE a ARB v léčbě, ale i v prevenci FS. Většina z těchto studií nebyla primárně vytvořena s tímto cílem a nebyla placebem kontrolována.
V roce 2005 byla publikována data metaanalýzy 11 randomizovaných klinických studií s 56 308 pacienty, kde se sledoval účinek blokády RAAS na FS. Čtyři studie byly u pacientů s přítomným srdečním selháním, tři u hypertoniků, dvě u pacientů po elektrické kardioverzi a dvě u pacientů po prodělaném infarktu myokardu [14]. ACE inhibitory a ARB redukovaly celkové relativní riziko vzniku AF o 28 %. Nebyl zjištěn statisticky významný rozdíl v účinku obou skupin – inhibitorů ACE (28 %) a ARB (29 %) (tab. 1, 2).
Table 1. Upstream léčba v primární prevenci FS. Modifikováno podle [37]. ![Upstream léčba v primární prevenci FS. Modifikováno podle [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/81ae6852eb38fa29d3cd3e59801029ba.jpg)
Table 2. Upstream léčba v sekundární prevenci FS. Modifikováno podle [37]. ![Upstream léčba v sekundární prevenci FS. Modifikováno podle [37].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f2e0cb3dc313e5a717baa06609e2d2cc.jpg)
Nejvýraznější byly výsledky ve studiích u pacientů se srdečním selháním (SS), např. při podání candesartanu u pacientů se srdečním selháním ve studii CHARM a podání valsartanu ve studii Val-HeFT [15,16]. U těchto pacientů se SS došlo ke snížení morbidity i mortality, ale také došlo k celkovému 44% snížení relativního rizika vzniku FS. Byl zde prokázán těsný vztah mezi tíží srdečního selhání a větší aktivací RAAS systému. Z toho důvodu u pacientů se SS vyplývá nutnost podání blokátorů RAAS jak v léčbě FS, tak i v důsledné prevenci jejího vzniku. Podávání ACE-I a ARB u pacientů se srdečním selháním a dobrá kardiopulmonální kompenzace vede ke snížení výskytu nově diagnostikované FS až o 30–48 % [17].
Blokáda RAAS také snižuje incidenci FS při dysfunkci levé komory a po prodělaném infarktu myokardu [18]. Ve studii TRACE byli zařazeni pacienti po infarktu myokardu s přítomnou dysfunkcí levé komory, kde trandolapril snížil incidenci FS o 47 % [19] (obr. 2). Ve studii HOPE byl prokázán 2krát nižší výskyt FS u pacientů léčených po srdečním infarktu ramiprilem oproti placebu [20]. Ve studii SOLVD došlo během tříletého sledování u pacientů s dysfunkcí levé komory, kterým byl podán enalapril, ke snížení incidence FS o 77 % [21].
Image 2. Studie TRACE: trandolapril ve srovnání s placebem snižuje riziko vzniku fibrilace síní o 47 % u pacientů po infarktu myokardu s dysfunkcí levé komory. Modifikováno podle [19]. ![Studie TRACE: trandolapril ve srovnání s placebem snižuje riziko vzniku fibrilace síní o 47 % u pacientů po infarktu myokardu s dysfunkcí levé komory. Modifikováno podle [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8f7fe7fcec2f6ab09654542d63f2f09e.jpg)
Hypertenze je nejčastějším rizikovým faktorem vzniku FS. Hypertenze a FS mají mnoho společného v patofyziologických mechanizmech jejich vzniku. Hypertenze vede ke snížené poddajnosti a k diastolické dysfunkci levé komory, což dále vede ke zvýšenému napětí síní a následně k jejich dilataci. Zánětlivý proces také hraje důležitou roli v etiologii obou chorob. Obě choroby jsou také protrombotickými stavy, které jsou rizikovými faktory vzniku mozkové příhody.
FS a hypertenze jsou samostatné rizikové faktory vzniku mozkové příhody. Riziko se zvyšuje ještě v kombinaci s diabetes mellitus a/nebo přítomností srdečního selhání. Přítomnost hypertenze u FS zvyšuje riziko mozkové příhody 2krát.
Jaký má vliv blokáda RAAS na vznik FS u hypertenze?
Souhrnná data ze tří hypertenzních studií LIFE (Losartan Intervention For Endpoints reduction in hypertension), CAPP (CAptopril Prevention Project) a STOP-H-2 s podáváním enalaprilu (Swedish Trial in Old Patients with Hypertension-2) redukovala vznik nově vzniklé FS. Studie STOP hodnotila i snížení rekurence FS, ale výsledky nevyšly statisticky významně, došlo pouze k 12% redukci relativního rizika. Nejlepších výsledků redukce vzniku FS se dosáhlo u hypertoniků s prokázanou hypertrofií levé komory ve studii LIFE. V substudii LIFE (LIFE new-onset AF substudy) byl podáván ARB – losartan (50–100 mg) nebo beta-blokátor – atenolol (50–100 mg) u hypertoniků s prokázanou hypertrofií levé komory, kde se předpokládá přítomnost diastolické dysfunkce levé komory. Pokud nedošlo k úpravě tlaku, přidával se k oběma skupinám hydrochlorothiazid (12,5–25 mg), ev. další antihypertenziva. Přestože došlo k podobnému snížení krevního tlaku u 9 193 pacientů ve větvi s ARB i beta-blokátorem, byla demonstrována významná redukce nově vzniklé FS ve skupině léčené losartanem. Pacienti s novým vznikem FS měli vyšší riziko kardiovaskulárních příhod.
Po 4,8 letech sledování losartan snížil incidenci FS o 33 % a následné CMP o 51 %; snížil kardiovaskulární mortalitu o 42 % u pacientů s anamnézou FS při vstupu do studie, infarkt myokardu o 42 %. Losartan snížil o 42 % riziko primárního složeného cíle – kardiovaskulárního úmrtí, CMP a infarktu myokardu u pacientů s anamnézou FS při zařazení do studie [22,23].
Tyto výsledky ukazují, že ARB oproti beta-blokátoru významně redukují vznik nové FS a také snižují protrombotické riziko.
Léčba hypertenze různými skupinami antihypertenziv může mít stejné antihypertenzní účinky, ale může se významně lišit v efektivitě léčby FS.
Pacienti s hypertenzí a přítomnou jakoukoli formou FS by měli medikovat inhibitory ACE nebo ARB. Hypertonici, zvláště s přítomnou hypertrofií levé komory, by měli mít ACE-I nebo ARB jako antihypertenzivum v rámci primární prevence, protože mají vysoké riziko vzniku nové FS.
Dvě prospektivní randomizované studie, ale ne placebem kontrolované, prokázaly statisticky významnou redukci rekurence FS u pacientů po elektrické kardioverzi pro dlouhodobě perzistující FS při podávání inhibitoru ACE (enalaprilu) nebo ARB (irbesartanu). Obě studie zdokumentovaly významné snížení rekurence FS, kdy převážně došlo k ovlivnění časných recidiv FS [24]. Někteří autoři popisují při blokádě RAAS inhibitory ACE nebo ARB po elektrické kardioverzi až 48% redukci relativního rizika vzniku FS.
Nedávno byla publikována práce, která sledovala účinek samotného amiodaronu oproti kombinaci amiodaronu s losartanem u pacientů s „lone“ paroxyzmální FS. „Lone“ FS je označení pro izolovanou FS u jinak zdravého člověka – bez prokázaného kardiovaskulárního onemocnění či jiné příčiny, která se mohla podílet na vzniku FS. V kombinační terapii došlo k významnému snížení výskytu paroxyzmů FS ze 41 na 19 % a také došlo ke zmenšení velikosti levé síně. Podobný pozitivní efekt mělo v klinických studiích i přidání enalaprilu a irbesartanu k amiodaronu [25]. Tyto studie naznačují synergický efekt antiarytmik a blokátorů RAAS, např. amiodaronu a ARB.
V roce 2009 byla publikována menší studie z pracoviště v Miláně, v níž byl sledován efekt podání inhibitorů ACE – ramiprilu oproti placebu v prevenci recidivy u pacientů s „lone“ FS, kde nebyla přítomná hypertenze ani srdeční selhání a poprvé zjištěná FS byla vertována intravenózním podáním propafenonu. Po verzi byli pacienti randomizováni do skupiny s podáváním 5 mg ramiprilu a druhá skupina dostávala placebo. Pacienti byli sledováni tři roky, v ramiprilové větvi došlo ke statisticky významnému snížení recidivy FS oproti větvi s podáváním placeba. Abychom však mohli paušálně všem pacientům s prvním záchytem FS doporučit preventivní podávání inhibitorů ACE či ARB, je potřeba tyto účinky ještě ověřit na větším počtu pacientů [26].
V prospektivních studiích se však pozitivní efekt ACE-I a ARB jednoznačně nepotvrdil, ať už šlo o hodnocení výskytu FS (studie GISSI AF, ANTIPAF) nebo hodnocení kardiovaskulárních příhod a rekurence FS u asi 9 000 pacientů s FS (studie ACTIVE-I: AF Clopidogrel Trial with Irbesartan for prevention of Vascular Events) [27–29].
Neúčinnost terapie byla pravděpodobně způsobena pozdním nasazením léčby u chronických forem FS, kde jsou již vyjádřené významné remodelační změny. K případnému zjištění efektu léčby je zřejmě potřeba delší doby sledování, než jaká byla ve studiích.
Ve studii ACTIVE-I byli zařazeni pacienti s jakoukoli formou FS, ale více než polovina pacientů – 64,4 % v placebové a 66,0 % v irbesartanové větvi –, byli pacienti s permanentní formou FS; 14,9 % vs 14,5 % s perzistentní FS, 20,5 % vs 19,6 % s paroxyzmální formou. Pouze pětina pacientů tedy byla s paroxyzmální formou FS, kde předpokládáme největší efekt blokády RAAS. U irbesartanové větve nedošlo při kombinovaném end--pointu k žádnému snížení cévních mozkových příhod, infarktů myokardu a vaskulární smrti. Při kumulativním sledování – cévních mozkových příhod, tranzitorních atak a embolizací mimo CNS došlo v irbesartanové větvi ke snížení o 13 %. Dále došlo ke snížení srdečního selhání o 14 %. U permanentní formy FS jsou podání a účinek upstream terapie již otázkou.
Statiny
Statiny mají v myokardu především účinek protizánětlivý, ale jejich efekt je zřejmě komplexní. Několik studií prokázalo příznivý vliv statinů na postoperační FS. V ostatních případech existují jen malé studie nebo jejich metaanalýzy. Ty prokazují snížení výskytu FS, zejména u pacientů se srdečním selháním, částečně také u hypertenze a ischemické choroby srdeční. V těchto případech a u postoperační FS lze preventivní použití statinů zvážit [30]. Podávání statinů po CABG vedlo ke statisticky významnému snížení rekurence FS, což bylo zřejmě důsledkem jejich protizánětlivého účinku u pacientů s ischemickou chorobou srdeční. Ve studii ARMYDA (Atorvastatin for Reduction of MYocardial Dysrhythmia After cardiac surgery) se podával atorvastatin v dávce 40 mg sedm dnů před kardiochirurgickým výkonem na mimotělním oběhu a pokračovalo se i pooperačně. Došlo ke snížení pooperační FS o 61 % [31].
V jedné studii byly podány statiny vs placebo u pacientů s ICHS, kdy statiny vedly ke statisticky významnému snížení rekurence FS, což bylo zřejmě také důsledkem protizánětlivého účinku [32]. Pozitivní účinek této neantiarytmické léčby v rekurenci FS je ještě nutné prokázat v klinických studiích s větším souborem pacientů.
N-3 nenasycené mastné kyseliny (PUFA)
V experimentálních studiích byly podány nenasycené mastné kyseliny a byl zjištěn jejich antiarytmický efekt a také byl zaznamenán snížený výskyt FS, zřejmě ovlivněním srdečního konexinu.
Další autoři podávali pacientům před a po provedeném aortokoronárním bypassu rybí olej [33]. U pacientů, kterým byl podán rybí tuk, došlo k redukci vzniku FS o 54 % ve srovnání s placebem. V další 12leté studii u osob s vyšší konzumací ryb, u kterých dochází k vyšší hladině nenasycených mastných kyselin v krvi, byl také prokázán významně nižší výskyt FS.
Ostatní protizánětlivé látky v upstream léčbě
Kortikosteroidy mají velmi silný protizánětlivý účinek, snižují uvolňování prozánětlivých cytokinů, které jsou uvolňovány při mimotělním oběhu. Podávání kortikoidů během operace významně sníží výskyt FS.
Ve studii Dernellise byly podávány glukokortikoidy u perzistentní FS jako léčba zánětu, kdy po jejich podání ve srovnání s placebem došlo ke snížení CRP i rekurence FS [34]. Podání kortikosteroidů může být provázené řadou nežádoucích účinků, z nejvážnějších jsou hyperglykemie s nutností podání inzulinu, krvácení do zažívacího ústrojí a rozvoj infekce.
Nesteroidní antirevmatika snižují vznik FS po CABG. Pro svou nefrotoxicitu mohou zhoršit pooperační renální insuficienci zvláště u starších pacientů [35].
Pozitivní účinek této neantiarytmické léčby v rekurenci FS je ještě nutné prokázat v klinických studiích s větším počtem pacientů. Zatím se v klinické praxi nedoporučuje.
Podle Registru Brno bylo na Interní kardiologické klinice FN Brno a LF MU od ledna 2005 do února 2009 hospitalizováno celkem 15 453 pacientů, z toho 4 006 pacientů (25,9 %), což je čtvrtina všech hospitalizovaných, měla některou z forem fibrilace síní. FS jako hlavní diagnóza byla u 52,2 % a FS jako vedlejší diagnóza u 47,3 %. V celém souboru převažovali muži, kterých bylo téměř 2krát více než žen, a ženy byly statisticky významně starší (medián věku 66 vs 71 let). Pacienti přijatí s FS jako hlavní diagnózou byli statisticky významně častěji bez organického postižení srdce – 44,1 % vs 13,5 % u pacientů s FS jako vedlejší diagnózou. U pacientů s FS vedlejší byly častější komorbidity – ICHS, kardiomyopatie, hypertenze, diabetes mellitus, prodělané CMP a TIA. U pacientů s FS jako vedlejší diagnózou převažovala funkční třída NYHA II ve 29,6 %, u FS jako hlavní diagnóze převažovala NYHA I ve 39,5 %. U FS vedlejší byla z krevních odběrů významně vyšší urea, kreatinin, NT-pro BNP, dále bylo vyšší i CRP, ale ne statisticky významně; dle echo srdce byla nižší EF levé komory a větší příčný rozměr levé síně. Pacienti s FS vedlejší byli tedy těžší polymorbidnější pacienti. Z nejčastějších rizikových faktorů FS byla zastoupena hypertenze u 72,6 % pacientů a ICHS u 51,8 %. Pacienti s FS byli léčeni blokátory RAAS v 70,7 %, inhibitory ACE byly podány u 57,9 % pacientů a sartany u 12,8 %. U pacientů, kteří podstoupili ve sledovaném období invazivní terapii FS – radiofrekvenční katetrovou ablaci, byla také nejčastějším rizikovým faktorem vzniku FS arteriální hypertenze, která byla zastoupena u 73,1 %.
Závěr
Jaké postavení má upstream terapie podle nových doporučení Evropské kardiologické společnosti z roku 2010?
Upstream terapie je časným zásahem do patogeneze vzniku FS, protože zasahuje do procesu remodelace síňového myokardu. Mechanizmem je hlavně omezení vlivu angiotenzinu II, který vede ke vniku fibrózy, hypertrofie myokardu, poruše mezibuněčného spojení, chybné funkci iontových kanálů a také k progresi zánětlivých změn. Blokáda RAAS se uplatní v prevenci vzniku a rekurence FS a tím také sníží následky, které s sebou fibrilace síní nese.
Jednoznačná indikace podání ACE-I, ev. ARB v primární prevenci je u pacientů s hypertenzí a zvláště s přítomnou hypertrofií levé komory a dále u pacientů se srdečním selháním a dysfunkcí levé komory. V těchto případech je léčba stejně indikovaná i bez ohledu na fibrilaci síní.
Poslední metaanalýza 26 studií u pacientů s FS a s méně vyjádřeným strukturálním postižením srdce nebo i v sekundární prevenci zaznamenává snížení vzniku FS o 35 % [36]. V prospektivních studiích nejsou výsledky tak průkazné. Zřejmě se jedná o pacienty s těžší formou FS s významnou strukturální remodelací a u těchto pacientů je zřejmě nutné delší podávání blokátorů RAAS a delší sledování, než dojde k pozitivní reverzní remodelaci myokardu. Např. ve studii ACTIVE I bylo kolem 65 % pacientů s permanentní formou FS, tzn. FS již zůstala jako základní rytmus.
V sekundární prevenci mohou být zváženy ACE-I/ARB jako počáteční léčba u pacientů s recidivující FS a současnou antiarytmickou léčbou. Mohou být užitečné k prevenci FS i bez strukturálního onemocnění srdce, pokud je ještě jiná indikace k jejich podání, např. hypertenze. Nebyl prokázán rozdíl mezi jednotlivými skupinami nebo preparáty.
Podání ACE-I, ev. ARB v upstream terapii lze tedy shrnout. Indikace IA pro podání ACE-I, ev. ARB jsou všichni nemocní s ischemickou chorobou srdeční, srdečním selháním či dysfunkcí levé komory, bez ohledu na přítomnost či nepřítomnost fibrilace síní.
Stejně tak každý hypertonik s fibrilací síní má jako lék první volby dostat ACE-I, resp. blokátor receptoru I pro angiotenzin II při intoleranci ACE-I.
Statiny jsou vhodné v primární prevenci nově vzniklé FS po kardiochirurgických operacích – především po CABG, ev. po operaci chlopně. Mohou být použity u pacientů se strukturálním onemocněním srdce, zvláště při přítomném srdečním selhání. V ostatních indikacích není pro léčbu statiny jak v primární, tak sekundární prevenci dostatek podkladů.
To platí i pro další zkoumané protizánětlivé léky, nesteroidní antirevmatika, kortikosteroidy, vícenenasycené mastné kyseliny a další látky pro ovlivnění remodelace síní. Ovlivnění FS těmito látkami není konzistentněji prokázáno, proto jejich použití v upstream léčbě FS není indikováno.
Upstream terapie s využitím ACE-I, ARB či statinů není indikována v primární i sekundární prevenci FS u pacientů bez jiného kardiovaskulárního onemocnění.
Práce byla podpořena VVZ MŠMT 0021622402.
Doručeno do redakce 4. 7. 2011
Přijato po recenzi 25. 7. 2011
doc. MUDr. Růžena Lábrová, Ph.D.
prof. MUDr. Jindřich Špinar, CSc.
Interní kardiologická klinika LF MU a FN Brno
labrova@seznam.cz
Sources
1. Stewart S, Murphy N, Walker A et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the UK. Heart 2004; 90 : 286–292.
2. Tsang TS, Petty GW, Barnes ME et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42 : 93–100.
3. McGovern PG, Jacobs DR Jr, Shahar E et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota Heart Survey. Circulation 2001; 104 : 19–24.
4. Lábrová R. Fibrilace síní v době katétrové ablace. Vnitř Lék 2010; 56 : 871–879.
5. Savelieva I, Camm AJ. Is there any hope for angiotensin-converting enzyme inhibitors in atrial fibrillation? Am Heart J 2007; 154 : 403–406.
6. Feng J, Yue L, Wang Z et al. Ionic mechanism of regional action potential heterogeneity in the canine right atrium. Circ Res 1998; 83 : 541–551.
7. Bosch RF, Scherer CR, Rüb NL et al. Molecular mechanisms of early electrical remodeling: transcriptional downregulation of ion channel subunits deduces I (Ca,L) an I(to) in rapid atrial pacing in rabbits. J Am Coll Cardiol 2003; 41 : 858–869.
8. Madrid AH, Escobar C, Rebollo JM et al. Angiotensin receptor blocker as adjunctive therapy for rhythm control in atrial fibrillation: results of the irbesartan-amiodarone trial. Card Electrophysiol Rev 2003; 7 : 243–246.
9. Douglas P. The left atrium: a biomarker of chronic diastolic dysfunction and cardiovascular disease risk. J Am Coll Cardiol 2002; 42 : 1206–1207.
10. Morillo CA, Klein GJ, Jones DL et al. Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation. Circulation 1995; 91 : 1588–1595.
11. Goette A, Arndt M, Röcken C et al. Regulation of angiotension II receptors subtypes during atrial fibrillation in humans. Circulation 2000; 101 : 2678–2681.
12. Freestone B, Beevers DG, Lip GY. The renin-angiotensin-aldosterone system in atrial fibrillation: a ne therapeutic target? J Hum Hypertens 2004; 18 : 461–465.
13. Das UN. Is angiotensin-II an endogenous pro-inflammatory molecule? Med Sci Monit 2005; 11 : 155–162
14. Healey JS, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45 : 1832–1839.
15. Magioni AP, Latini R, Carson PE et al. Val HeFT Investigators. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val HeFT). Am Heart J 2005; 149 : 548–557.
16. Olsson LG, Swedberg K, Duchampe A et al. CHARM Investigators. Atrial fibrillation and risk of clinical event in chronic heart failure with and without left ventricular dysfunction: results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol 2006; 46 : 1997–2004.
17. Zhang Y, Zhang P, MuY et al. The role of renin-angiotenzin blockade therapy in prevention of atrial fibrillation: a meta-analysis of randomized controlled trials. Clin Pharmacol Ther 2010; 88 : 521–531.
18. Špinar J, Vítovec J. Inhibitory ACE, nebo sartany v léčbě pacientů po infarktu myokardu. Cor Vasa 2009; 51 : 103–111.
19. Pedersen OD, Bagger H, Kober L et al. Trandolapril reduces the incidence of atrial fibrillation after acute myocardial infarction in patients with left ventricular dysfunction. Circulation 1999; 100 : 376–380.
20. Yusuf S, Sleight P, Pogue J et al. The HOPE investigators. Effects of angiotensin-converting-enzyme inhibitor ramipril, on cardiovscular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342 : 145–153.
21. Vermes E, Tardif JC, Bourassa MG et al. Enalapril decreases the incidence of atrial fibrillation in patients with left ventricular dysfunction. Insight from the Studies Of Left Ventricular Dysfunction (SOLVD) trials. Circulation 2003; 107 : 2926–2931.
22. Wachtel K, Hornestam B, Lehto M et al. Cardiovascular morbidity and mortality in hypertensive patients with a history of atrial fibrillation: The Losartan Intervention For Endpoints reduction in hypertension (LIFE) study. J Am Coll Cardiol 2005; 45 : 705–711.
23. Wachtel K, Lehto M, Olsen MH et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: The Losartan Intervention For Endpoints reduction in hypertension (LIFE) study. J Am Coll Cardiol 2005; 45 : 712–719.
24. Ueng KC, Tsai TP, Yu WC et al. Use of enalapril to facilitate sinus rhythm maintenance after external cardioversion of long-standing persistent atrial fibrillation. Results of prospective and cotrolled study. Eur Heart J 2003; 24 : 2090–2098.
25. Madrid AH, Bueno MG, Rebollo JMG et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002; 106 : 331.
26. Belluzzi F, Sernesi L, Preti P et al. Prevention of recurrent lone atrial fibrillation by the angiotensin-II converting enzyme inhibitor ramipril in normotensive patients. J Am Coll Cardiol 2009; 53 : 24–29.
27. Disertori M, Latini R, Barlera S et al. GISSI-AF Investigators. Valsartan for prevention of recurrent atrial fibrillation. N Engl J Med 2009; 360 : 1606–1617.
28. ACTIVE I Investigators. Yusuf S, Healey JS, Pogue J et al. Irbesartan in patients with atrial fibrillation. N Engl J Med 2011; 364 : 928–938.
29. Špinar J, Lábrová R. ACTIVE I a upstream terapie. Interv Akut Kardiol 2009; 8 : 325–327
30. Savelieva I, Camm AJ. Statins and polyunsaturated fatty acids for treatment of atrial fibrillation. Nat Clin Pract Cardiovasc Med 2008; 5 : 30–41.
31. Patti G, Chello M, Candura M et al. Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery: results of the ARMYDA-3 (Atorvastatin for Reduction of MYocardial Dysrhytmia After cardiac surgery) study. Circulation 2006; 114 : 1456–1461.
32. Young-Xu Y, Jabbour S, Goldberg R et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol 2003; 92 : 1379–1383.
33. Calò L, Bianconi L, Colivicchi F et al. N-3 fatty acids for the prevention of atrial fibrillation after coronary artery bypass surgery: a randomized, controlled trial. J Am Coll Cardiol 2005; 45 : 1723–1728.
34. Dernellis J, Panaretou M. Relationship between C-reactive protein concentrations during glucocorticoid therapy and recurrent atrial fibrillation. Eur Heart J 2004; 25 : 1100–1107.
35. Cheruku KK, Ghani A, Ahmad F et al. Efficacy of nonsteroidal anti-inflammatory medications for prevention of atrial fibrillation following coronary artery bypass graft surgery. Prev Cardiol 2004; 7 : 13–18.
36. Zhang Y, Zhang P, MuY et al. The role of renin-angiotenzin blockade therapy in prevention of atrial fibrillation: a meta-analysis of randomized controlled trials. Clin Pharmacol Ther 2010; 88 : 521–531.
37. Camm AJ, Kirchhof P, Lip GY et al. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2011 Issue 3-
All articles in this issue
- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Nefarmakologická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Upstream terapie u fibrilace síní
- Home monitoring nemocných s fibrilacemi síní
- Home monitoring a implantáty
- Telemonitoring krevního tlaku u nemocných s arteriální hypertenzí
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Home monitoring a implantáty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

