-
Medical journals
- Career
Choroby venózního systému
Authors: I. Hofírek
Authors‘ workplace: I. interní kardioangiologická klinika FN U svaté Anny a LF MU, Brno
Published in: Kardiol Rev Int Med 2005, 7(2): 77-81
Category: Editorial
Overview
Článek se zabývá venózními chorobami, častými nemocemi, jako jsou chronická žilní nedostatečnost tvořená převážně posttrombotickým syndromem, hlubokou žilní trombózou a žilními varixy. Dále přináší základní informace o venózních zánětlivých postiženích, malformacích a dalších degenerativních nemocech. Je členěn dle patofyziologických skupin žilních chorob.
Klíčová slova:
chronická žilní nedostatečnost - posttrombotický syndrom - hluboká žilní trombóza – antikoagulace – trombolýza – varixy - flebitidaÚvod
Onemocnění žil, v téměř 97-99 % případů žil dolních končetin, tvoří největší skupinu cévních chorob. Převažují chronická žilní nedostatečnost (posttrombotický syndrom), hluboká žilní trombóza a venózní varixy. V průmyslových zemích tvoří toto onemocnění vedle zdravotního i významný socioekonomický problém [1,2,3].
Žilní systém dolních končetin je tvořen povrchovým a hlubokým žilním systémem. Povrchový žilní systém je uložen supra nebo epifasciálně a hluboký žilní systém ve vnitřním prostoru končetiny. Hlavními místy spojení jsou v případě povodí v. saphena magna safenofemorální junkce v tříslech a v povodí v. saphena parva safenopopliteální junkce v podkolení. Dále mohou jednotlivé žilní systémy vzájemně komunikovat spojkami (jako příčkami žebříku). Fyziologický žilní krevní proud směřuje vždy k srdci, z povrchu do hloubky a proximálně [1,2].
Anamnéza a klinické vyšetření
Anamnéza a klinické vyšetření případně doplněné o funkční klinické testy (Trendelenburgův a Perthesův) tvoří převážnou část diagnostiky žilních onemocnění [4]. Základní instrumentální metodou vyšetřování žilního systému se stala duplexní sonografie, používaná s metodou barevného a dopplerovského mapování a kompresními testy. Vzhledem k ohromnému počtu žilních onemocnění si však stále své místo v prvotní diagnostice zachovává prosté dopplerovské ultrazvukové vyšetření. Pokud ale vzniknou diagnostické rozpaky, nemůže dopplerovská sonografie nahrazovat duplexní vyšetření. Přehled o celkové funkčnosti žilního systému na končetině může podat izotopová flebografie, která může být jednoduše rozšířena o prostou plicní perfuzní scintigrafii a poskytnout orientační informace o případné plicní embolizaci. Není ale vhodná k diagnostice hluboké žilní trombózy nebo k exaktní diagnostice plicní embolizace. K funkčnímu instrumentálnímu vyšetření se využívají také pletyzmografické metody, jednoduchá fotopletyzmografie nebo složitější „strain-gauge“ pletysmografie, hodnotící změny objemu v závislosti na žilním odtoku nebo refluxu. Kontrastní RTG flebografie je nadále zlatým standardem, avšak pro svoji invazivnost a možné následky je její užití omezeno na oblasti intervenčních výkonů na žilách a vyšetření oblastí špatně dostupných duplexnímu sonografickému vyšetření. Další rozvoj vyšetření žilního systému přináší flebografie prováděná pomocí spirální počítačové tomografie (spiral CT) a magnetické rezonance (MR). Zejména MR vyšetření může za určitých podmínek zastupovat RTG kontrastní metody (RTG a CT flebografii).
Chronická žilní nedostatečnost
Chronická žilní nedostatečnost (CVI) vzniká při narušení fyziologického směru proudu žilní krve, návratu krve (reflux) do distálních oblastí žilního systému nebo ztížením odtoku. Dochází k žilnímu krevnímu městnání a zvýšení žilního krevního tlaku, které se projevuje výrazněji v „nízkotlakém“ povrchovém než v hlubokém „vysokotlakém“ žilním systému. Nejčastěji jde o chronické následky hluboké žilní trombózy (DVT). Proto se někdy používá názvu posttrombotický syndrom (PS). CVI tvoří významný sociálně-ekonomický problém. Například v Německu se již v roce 1987 pohybovaly náklady za ztrátu pracovní doby z důvodů CVI kolem 500 miliónů € [3]. Četnost chronické žilní nedostatečnosti není přesně známa. Prevalance se většinou uvádí kolem 1,5-5,3 %, ale také až 7–12 %; vzrůstá s věkem [5].
Výskyt venózních ulcerací se uvádí mezi 0,1–1,3 % [1,2,4,6]. Posttrombotický syndrom v tíži odpovídající třídě 3–6 CEAP klasifikace se následně rozvíjí přibližně u 22-36 % pacientů s prodělanou DVT [7,8,9]. Zahrnují-li se i hraniční stavy (avšak rozvinuté následně po prodělané DVT), objevuje se posttrombotický syndrom až u 70-75 % pacientů do 5 let po DVT [1,4]. Většina případů CVI se rozvíjí na podkladu poškození a nedostatečnosti žilních chlopní. Následkem hluboké žilní trombózy a následné žilní rekanalizace dochází k morfologickému poškození chlopní a vzniku refluxu. Méně často se jedná o zneprůchodnění části hlubokého systému. Insuficience povrchového žilního systému mnohdy začíná místní regurgitací spojkou hlubokého a povrchového systému. Následné zvýšení tlaku v části povrchového žilního systému vede k jeho rozšíření a vzniku nedomykavosti chlopní v zatíženém úseku. Podobným procesem se poškození šíří dále. Postiženy mohou být kterékoli úseky povrchového žilního systému. CVI se může projevovat pocity tíhy a únavy končetin, paresteziemi, svěděním, bolestmi a křečemi v končetinách, intermitentními nebo trvalými otoky, pigmentacemi, trofickými změnami kůže, celulitidou, podkožními záněty, ulceracemi [1,4,6,7,10,11]. V diferenciální diagnostice je třeba myslet na hlubokou žilní trombózu, lymfedémy, hypotyreózu, zevní útlak žilního systému (například Backerova cysta, neoplazie), neurologická postižení, nefrologické poruchy, městnavou srdeční slabost, léky (například blokátory kalciového kanálu), ortopedické poruchy, erysipel a další. Asi 68 % pacientů (z 214) s chronickými otoky DKK mělo prokazatelnou žilní nedostatečnost. Žilní reflux z postižení chlopní mělo 52 % pacientů. U 16 % pacientů byla nalezena čerstvá žilní trombóza. Zbývající 1/3 pacientů s chronickými otoky DKK měla jiné než žilní příčiny potíží [12]. Pro klasifikaci CVI se používají různá schémata (tab. 1, 2) [1,4,6,7,10,11].
Posttrombotický syndrom se v naší praxi vyskytoval spíše u pacientů s postižením proximálních částí hlubokého žilního systému DK, při mnohočetném postižení bércových žil a po recidivujících flebotrombózách. Včasná a účinná terapie DVT snižovala pravděpodobnost následného rozvoje posttrombotického syndromu. V 10 případech ileofemorální flebotrombózy léčených se zpožděním byl následně rozvoj PS (ve třídě 3 CEAP klinické klasifikace a vyšší) pozorován v 7 případech. Mezi 14 pacienty včas léčenými (do 3–5 dnů od projevů onemocnění) se známky PS objevily jen v 5 případech. V další skupině pacientů, s ambulantně včas léčenou DVT (44 případů distální DVT a 21 případů proximální DVT), se PS do 2 let od onemocnění objevil jen u 12 pacientů (19 %).
V terapii již rozvinutého posttrombotického syndromu se navzájem musí doplňovat kompresní terapie DK, cvičení DK (chůze, cyklistika, plavání), elevace DK (několikrát denně) a vyvarování se statické zátěži DK (delší sezení, stání).
Kompresní terapie vyžaduje vyvinutí účinného tlaku na celý povrch končetiny a vyvíjený tlak musí být nejvyšší v oblasti nohy a kotníků (cca 30–40, příp. až 40–50 mm Hg) a musí klesat proximálním směrem [13].
V indikovaných případech jsou vhodné žilní rekonstrukční chirurgické postupy (venózní bypassy, venózní valvuloplastiky, segmentální žilní přenosy). Řešení insuficience chlopní hlubokého žilního systému je obtížné. Valvuloplastiky mohou být úspěšné, ale často jsou zatížené vznikem hluboké žilní trombózy. Externí žilní chlopňové bandáže doposud nemají jednoznačné výsledky. Žilní bypassy jsou vhodné jen pro přísně indikované pacienty, přínosnější jsou pravděpodobně spíše u nedostatečně průchodného hlubokého žilního systému [1,4,14].
Pomocnými prostředky mohou být účinná venofarmaka a reologika (pokud není chronická antikoagulační léčba). Použití venofarmak dosahuje zmírnění pocitů těžkosti v končetinách, možná zmírňuje otoky. Převážná většina prací s venofarmaky však nemá dostatečnou přesnost pro zhodnocení jejich účinku na CVI a jednoznačně neprokazuje redukci CVI [15].
Případná terapie CVI heparinem nebo p.o. antikoagulancii bude diskutována níže.
Hluboká žilní trombóza
Hluboká žilní trombóza (DVT; flebotrombóza) je onemocnění s tvorbou trombů v hlubokých žilách, nejčastěji dolních končetin. Akutní komplikací DVT je plicní embolizace (PE), chronické recidivující flebotrombózy, posttrombotický syndrom (PS) a chronická plicní hypertenze. Hluboká žilní trombóza a plicní embolizace se podílí až na 99 % chronické plicní hypertenze [1,10].
Dle postižení oblasti žilního řečiště se DVT dělí na skupinu proximálních DVT, kam náleží případy ilických, stehenních a podkoleních flebotrombóz, a distálních DVT s postižením jednotlivých bércových žil (pod větvením v. poplitea). K distální skupině hlubokých žilních trombóz (co do klinického významu) přiřazujeme i rozsáhlejší tromboflebitidy proximální (stehenní) části v. saphena magna.
Přesná incidence DVT není známa. Odhady se pohybují v různých hodnotách a jejich stanovení je velmi obtížné. Dle dat z National Center for Emergency Medicine Informatics (USA) se DVT vyskytne v 35–40 případech na 10 000 osob a rok; v asi 10–11 případech dojde k úmrtí.
Hodnoty zjištěné incidence PE se v závislosti na použité metodice pohybují okolo 11–18 případů na 10 000 osob / rok [15].
Proximální flebotrombóza (DVT) je ve 40-55 % případů doprovázena plicní embolizací různého rozsahu (od klinicky nepatrných příhod až po smrtelné události). Také distální DVT jsou zatíženy rizikem komplikací PE (riziko se uvádí mezi 2–10 % případů), a to obzvláště při postižení kmenů v. tibialis posterior. Příčina všech plicních embolizací je ve více než 90 % případů v hluboké žilní trombóze (DVT) dolních končetin [7,8,9,16].
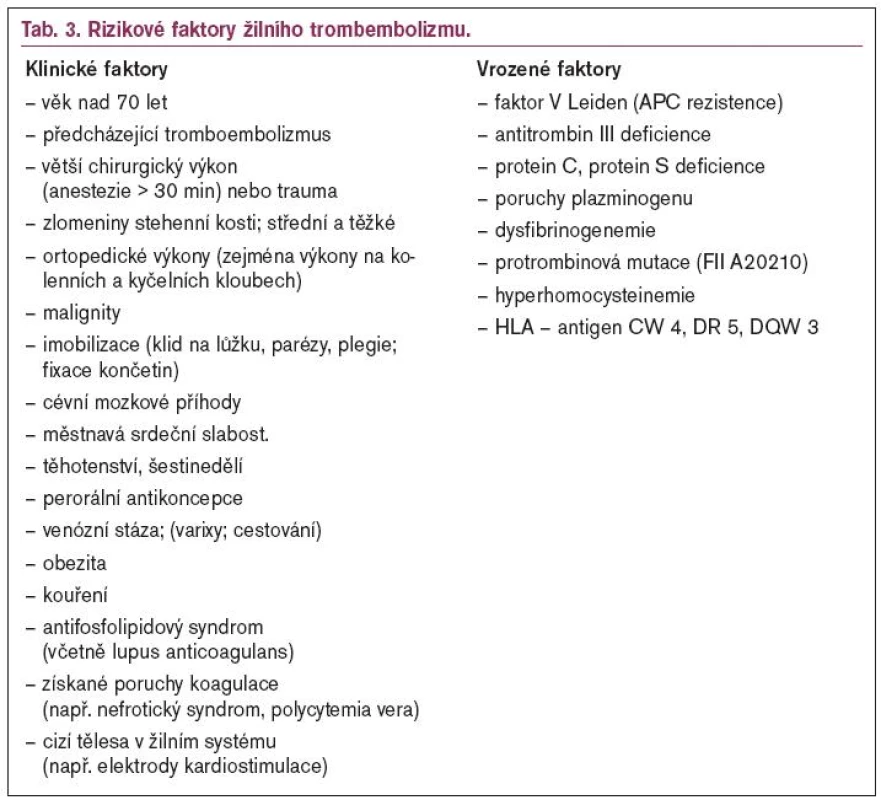
Základními kameny diagnózy hluboké žilní trombózy jsou anamnéza a klinické vyšetření. Důležitou součástí diagnostiky DVT je myslet na možnost onemocnění. V anamnéze je třeba aktivně pátrat po rizikových faktorech hluboké žilní trombózy a tromboembolické nemoci. Nejčastější souvislostí jsou traumata, imobilizace a ortopedické výkony na dolních končetinách (tab. 3) [4,8,14,15,17].
Příznaky akutní flebotrombózy mohou být nevýrazné a necharakteristické. Mnohdy pacienti pociťují pouze zvýšené napětí v postižené končetině a pozorují pouze drobný otok. V případě výrazného otoku končetiny, palpační rezistence, pozitivního Homanova a plantárního znamení či přítomnosti Prattových žil, je diagnóza DVT velmi pravděpodobná. Diferenciální diagnostika je podobná jako u chronické žilní nedostatečnosti [4].
Protože problematika hluboké žilní trombózy a tromboembolické choroby je závažná, je třeba se znovu zmínit o vyšetřovacích metodách. Standardním vyšetřením je duplexní barevná sonografie (duplex UZ) s využitím kompresních testů. Jejich senzitivita a specificita se v oblasti proximálního hlubokého žilního systému DK pohybuje mezi 92–99 %. Přesnější je v oblasti stehna a podkolení, méně již v bérci. Kvalitním vyšetřením se i v bérci dají dobře vyšetřit hlavní hluboké žilní kmeny bérce, vv. tibiales posteriores i vv. fibulares a proximální části vv. tibiales anteriores. Zlatým standardem je nadále kontrastní flebografie, postupně nahrazovaná CT a MR flebografií [19]. Jako orientační vyšetření se však může použít také jednoduché dopplerovské ultrazvukové vyšetření, které se však musí velmi pečlivě provést a zvažovat v souvislosti s klinickým nálezem. V případě pochybností jsou potřebná laboratorní vyšetření nebo duplexní sonografie.
Stanovování hladiny D-dimeru, fragmentu trombinu z čerstvého krevního koagula, má především význam jako negativní předpovědní faktor. Nepřítomnost D-dimeru významně snižuje pravděpodobnost přítomnosti aktivní čerstvé trombózy. Latex-fixační testy jsou pohotovější než ELISA, avšak méně přesné [14].
Léčení DVT se provádí heparinem, nefrakcionovaným heparinem (UFH) v i.v. infuzích nebo nízkomolekulárními hepariny (LMWH) s.c. V indikovaných případech je možná ambulantní terapie DVT nízkomolekulárními hepariny. Ta se upřednostňuje u spolupracujících pacientů s distální DVT, méně často u femorálních trombóz. Dávkování LMWH je za hospitalizaci i v ambulantní terapii stejné, 1 mg/kg s.c./12 hod, i když za hospitalizace se může využít podávání prodlouženě působících forem LMWH v dávce 1,5 mg/kg / 24 hod. LMWH jsou léky volby u trombóz žilního systému (i proximálního povrchového) u těhotných a možné je i několikaměsíční ambulantní podávání. Po úvodní léčebné dávce se obvykle pokračuje redukovaným množstvím aplikovaným jen 1krát denně.
Trombolýza, chirurgické výkony (trombektomie) či endovaskulární intervenční postupy jsou rezervovány pro komplikované případy rozsáhlých proximálních DVT (obzvláště v ileofemorální oblasti). Obě metody jsou limitovány stářím trombózy, i když trombolýza je proveditelná v poněkud delším časovém období než chirurgická tromboektomie. Chirurgická tromboektomie je rychlejší. Trombolýza je šetrnější, trvá déle a je více zatížená krvácivými komplikacemi, což může být omezeno endovaskulárním cíleným provedením. Při trombolýze s používá t-PA nebo rt-PA a současně se podává heparin nebo LMWH i.v., systémově v určitých případech doplněné antiagregační terapií.
V následné dlouhodobé fázi léčení se podávají p.o. antikoagulancia při udržování hodnot Quickova testu (protrombinový čas) kolem 0,30 nebo lépe INR (International Normalized Ratio) mezi 2,0–3,0. Ukončení terapie UFH nebo LMWH se s nasazením p.o. antikoagulace musí vzájemně překrývat. Podávání heparinů se ukončuje a pokračuje se jen v p.o. antikoagulaci obvykle až po dosažení účinných hodnot protrombinového času nebo INR po 2 následující dny. Délka podávání p.o. antikoagulace se v případech nekomplikovaných DVT doporučuje 3–6 měsíců, přičemž při delším podávání se pozoruje méně následných recidiv. V komplikovaných případech (recidivy, trombofilie) je antikoagulační terapie dlouhodobá, až 24 měsíců, nebo až doživotní. Jednoznačná pravidla k doporučení délky dlouhodobého podávání však nejsou. V případě zhoršujícího se posttrombotického syndromu, kde není možné jednoznačně vyloučit ani potvrdit recidivy drobných hlubokých žilních trombóz (zejména v bérci), je možné i u chronického stavu nasadit p.o. antikoagulaci, a to buď samostatně postupně, pomalu během až několika týdnů nebo rychleji, pak vždy společně s podáváním LMWH až do dosažení účinného INR.
Nedílnou součásti terapie DVT je komprese DKK, zpočátku onemocnění celodenně. Klid na lůžku se obvykle dodržuje prvních 24 hodin a následuje rehabilitace pacienta včetně chůze [4,15,20]. U antiagregační terapie a sulodexidu není jednoznačný příznivý vliv na terapii DVT prokázán [20].
Žilní varixy a fleboskleróza patří mezi degenerativní žilní choroby. Flebosklerózapostihuje nevarikózní i varikózní žíly. Dochází k fibróze intimy žil, převážně povrchových žil dolních končetin (v. saphena magna a jejích větvích). Zmenšuje kapacitu povrchových žil a brání reflexní vazokonstrikci. Fleboskleróza samotná nepostihuje žilní chlopně. Sekundárně se objevuje i u dlouhodobě trvajících varikozit.
Žilní varixy
Žilní varixy (Vx) jsou charakterizovány místně se měnícím průměrem žíly a vinutým průběhem. Chlopně nejsou u primárních varixů postiženy, k jejich nedomykavosti dochází při dilataci žíly. Postižení se týká povrchového žilního systému, protože jejich konstrukce a fascie zabraňuje hlubokým žilám končetin v dilataci (což se ale netýká žil oblasti malé pánve). Mnohdy bývají zpočátku postiženy úseky spojení povrchového a hlubokého žilního systému, odstupy v. saphena magna (VSM) a v. saphena parva (VSP) - tedy safenofemorální a safenopopliteální junkce nebo spojky - perforátory v oblasti Hunterova kanálu nebo proximálním bérci (Boydovy spojky). Histologicky se nachází místní hypertrofie a jinde atrofie medie žilní stěny. Jsou popisovány změny hladkých svalových buněk žilní stěny, vláken elastinu a kolagenu. Intimální změny nejsou přítomné, nebo jen mírně, a to fibróza. Přesná etiologie vzniku varixů není známa[21].
Etiologie není jasná, jejich vývoj u člověka může hypoteticky souviset se vzpřímeným postojem (podobně jako degenerativní onemocnění páteře) [2,10]. Četnost varixů není známa. Výskyt se v populaci na základě místních studií odhaduje na 5–35 %, obvykle se uvádí mezi 15–20 %. Na výskyt mají vliv i klimatické podmínky oblasti, v Evropě je v severských zemích incidence nižší než v jižních. Významným rizikovým faktorem je věk. Část varikozit se objevuje na přelomu mezi 2. a 3. deceniem, v některých případech již v období dospívání. Výskyt Vx pokračuje s věkem, koncem 6. decenia se jejich výskyt může zvyšovat významněji. K rozvoji varikozit přispívají vrozené dispozice (při výskytu varikozit u obou rodičů je cca 40-70% předpoklad jejich vzniku u dětí), dále obezita, statické zatěžování dolních končetin (delší sezení, stání), zvyšování nitrobřišního tlaku (např. těhotenství), p.o. antikoncepce. Ženy jsou postiženy častěji než muži (cca 2-3 : 1), avšak při některých lokálních šetřeních byly Vx pozorovány častěji u mužů [1,3,4,6,10].
Některé osoby nemají při varixech potíže, větší část ale pociťuje těžkost a únavu v končetinách, někdy pálivou bolest. Dyskomfort se objevuje po delší statické zátěži končetin a obvykle se mírní nebo mizí po fyzické dynamické činnosti.
Výraznější krvácení z varixů by mělo být řešeno za hospitalizace. Mírnější příhody se mohou léčit ambulantně, kompresí nebo kombinací se sklerotizací.
Základním terapeutickým postupem u primárních varixů je intervenční postup. Sklerotizace varixů s sebou může přinášet četné komplikace, jejichž výskyt může být snížen použitím pěnových preparátů určených k tomuto výkonu. I přes rozvoj moderních intervenčních endovenózních metod, jako jsou laserová terapie nebo radiofrekvenční ablace, zůstává zlatým standardem chirurgické odstranění (tzv. stripping) s kvalitním podvazem míst junkce nebo podvazy jednotlivých míst refluxu. Co nejšetrnější intervenční postup na varixech je výhodný pro možné budoucí využití povrchových žil při revaskularizačních výkonech. Intervence na Vx indikujeme raději v počátečních stadiích onemocnění, kdy jsou postiženy menší úseky žilního řečiště a nedošlo k rozvoji sekundárních kožní změn. Přesto mohou být recidivy Vx časté [22]. Před výkony na varixech je potřebné získat informace o funkčnosti hlubokého žilního systému a perforátorů. K tomu dobře slouží základní klinické testy: Trendelenburgův I a II a Perthesův [4]. Důležitou součástí terapie jsou režimová opatření (fyzikální cvičení a sprchování chladnou vodou) a vhodná komprese dolních končetin [13]. Venofarmaka jsou aditivním postupem, spíše ovlivňují edémy a subjektivní nepříjemné pocity v DK. Nemají vliv na vlastní rozvoj varixů.
Asi u 50 % pacientů s neléčenými varixy se objeví varikoflebitida.
Varikoflebitida
Varikoflebitida jezánětlivé postižení stěny varixů s následnou trombózou. Projevuje se zatuhnutím, bolestivostí a zarudnutím kůže v průběhu postižených varixů. Může se jednat i o rozsáhlé nepravidelné útvary velikosti až desítek centimetrů. Léčí především kvalitní kompresí končetiny a u proximálních nebo rozsáhlých případů (postižení žil na stehně, zejména kmeny VSM) s.c. aplikací nízkomolekulárních heparinů (LMWH) v dávkách cca 0,6-0,7 (ale až 1,0) mg/kg po 12 hodinách. Terapie LMWH se považuje v akutní fázi za výhodnější než chirurgické řešení, které může následovat po zklidnění stavu. Shoda nepanuje na případnou pokračující p.o. antikoagulační terapii, ale nejsou-li k ní kontraindikace, není její nasazení na závadu. Distální typy onemocnění (na bérci) mohou být ošetřeny lokálními antitrombotiky v kombinaci s protizánětlivými a antiedémovými látkami. Doplňující léčbou jsou venofarmaka; antibiotika nejsou u nekomplikovaných flebitid indikována, podávají se jen při infekčních komplikacích.
Ostatní terapie je podobná jako v části chronická žilní nedostatečnost.
Zánětlivá postižení žil
Zánětlivá postižení žil bývají nejčastěji varikoflebitidy, které tvoří asi 90 % celé skupiny. Vzácností nejsou prosté flebitidy vznikající po podráždění cévní stěny, například i.v. injekcí, aplikací léků, infuzí, ale i po opakovaných žilních odběrech. Flebitidy infekční etiologie jsou nejčastěji streptokokové a stafylokokové. Primární nejsou etiologicky jasné, častěji jde o druhotnou komplikaci prosté flebitidy. Možná jsou i jiná agens, např. spirochetové (zejména borelióza, pozorovány případy po bodnutí hmyzem, tzv. muchničkami), TBC a další. Zde jsou terapií volby příslušná antibiotika. V proximálních lokalizacích nebo při rozsáhlejším postižení se podávají LMWH, přibližně v 2/3 dávce oproti terapii DVT (viz výše). Flebitidy na dolních končetinách se mohou ve 2–3 % případů rozšířit do hluboké žilní trombózy (například prostupem přes spojky). U neléčené flebitidy proximálního kmene VSM není vyloučena ani plicní embolizace.
Migrující flebitida
Specifickou jednotkou je migrující flebitida (také flebitis saltans) - úsekovité, přechodné a „přeskakující“ záněty žil, nejčastěji povrchové, ale i viscerální. Etiologie není jasná. Onemocnění může být příznakem obliterující tromboangiitidy. Speciálním typem je Mondorova choroba, migrující flebitida s přeměnou postižených žil ve fibrotické pruhy, bez projevů zánětu a bez zarudnutí okolní kůže [22]. Postihuje zejména povrchové žíly na hrudníku. Některé flebitidy jsou podmíněny různými imunitními mechanizmy. Postižení žil při vaskulitidách bývá okrajové, pouze u Behcetovy choroby je dominantní [2,20,23].
Žilní malformace
Žilní malformace zahrnují vrozená postižení samostatných žil, včetně arteriovenózních spojek. Jsou obecně charakterizovány významnými poruchami struktury cévní stěny, zejména poškozením medie a hladkých svalových buněk [2,10,22].
Malformace velkých žil
Malformace velkých žil, ageneze, aplazie a hypoplazie velkých žil mají základ v embryonálním vývoji. Často mohou zůstat asymptomatické pro vyvinutý funkční kolaterální systém. Hypoplazie a aplazie chlopní hlubokých žil DK vede k časnému (obvykle kolem puberty) rozvoji chronické venózní nedostatečnosti. Flebektazie (charakterizované progresivní atrofií elastické a svalové složky žilní stěny) se vyskytují v difuzní a ložiskové formě. Postižené jsou častěji ženy. Pacienti jsou nejčastěji v péči dermatologů a plastických chirurgů. Aneuryzmata žil jsou velmi vzácným jevem, v oblasti velkých žil jsou doprovázena trombózou [2,21,23].
Venózní hemangiomy (útvary tvořené dysplastickými žilkami rozličné velikosti i podoby) se objevují v podkoží, ve svalech, mozku či v kostech a jiných lokalizacích. Často jsou součástí systémových cévních malformací a spojeny s přítomností a-v komunikací. Hemangiomy jsou obvykle benigní povahy a mohou zůstávat neodhalené (játra). Závažným problémem se stávají díky své lokalizaci (mozek, očnice apod.) a riziku krvácení. K intervenčnímu řešení jsou indikovány útvary přímo ohrožující funkci orgánů. Ze systémových žilních angiodysplazií se v klinické praxi nejčastěji setkáváme s Klippel-Trenaunay syndromem, známým také jako Klippel–Trenaunay–Weber syndrom. Charakterizovaný je malformacemi kožních kapilár, nadměrným růstem měkkých a kostních tkání postižené oblasti a venózními a lymfatickými malformacemi. Mnohočetné arteriovenózní mikrospojky jsou zde příčinou hypertrofie měkkých tkání a kostí, nesymetrického růstu končetin, „skvrn vínové barvy“ na kůži. Syndrom doprovází další angiodysplazie, hemangiomy, arteriovenózní spojky a rozličné malformace velkých žil [21,23]. Jeho řešení je velmi svízelným problémem vyžadujícím komplexní péči (dermatologů, plastických chirurgů, ortopedů, radiologů a dalších) od dětského věku [24].
MUDr. Ivo Hofírek
Narozen r. 1959. Studia LF MU v Brně ukončil v r. 1984. Po promoci získal v konkurzu místo na imunologickém oddělení IKEM Praha, ale nastoupil a pracoval na interním oddělení nemocnice ve Vyškově a v terénní praxi okresu. Dále pracoval jako lékař JIP v nemocnici v Tišnově, později jako lékař interní části ARO Nemocnice Milosrdných bratří v Brně. V roce 1991 po II. atestaci z vnitřního lékařství nastoupil na cévní oddělení I. interní kardioangiologické kliniky FN U sv. Anny. V letech 1993–2001 působil ve funkci zástupce přednosty kliniky pro LPP. Nyní se dále věnuje angiologické problematice, spolupracuje na endovaskulárních intervencích, zabývá se vaskulitidami, trombózami, hematologickou a imunologickou problematikou cévních chorob. Publikuje v odborném tisku, podílí se na pregraduální a postgraduální výuce vnitřního lékařství a angiologie, pracuje ve výzkumných programech.
Sources
1. Puchmayer V, Roztočil K. Praktická angiologie. Praha: Triton 2000 : 115-164.
2. Leu HJ, Lie JT: Vascular patology. London: Chapman & Hall Medical 1995 : 489-516.
3. Laing W. Chronic venous diseases of the leg. London: Office of Health Economics 1992.
4. Přerovský I: Doporučení pro diagnostiku a léčbu žilních chorob. Cor Vasa 1998; 40(8; Suppl K): 290-296.
5. International Task Force. The management of chronic venous disorders of the leg: an evidence-based report. Phlebology 1999; 14(Suppl 1): 23-34.
6. O’Donnell TF Jr, Welch HJ. Chronic venous insufficiency and varicose veins. In Young JR, Olin JW, Bartholomew JR. Peripheral vascular diseases. St Louis: Mosby-Year Book 1996.
7. Franzeck UK, Schalch I, Jäger KA et al. Prospective 12-year follow-up study of clinical and hemodynamic sequelae after deep vein thrombosis in low –risk patients (Zürich Study). Circulation 1996; 93(1): 74-79.
8. Hirsh J, Hoak J. Management of Deep Vein Thrombosis and Pulmonary Embolism. Circulation 1996; 93 : 2212-2245.
9. Prandoni P, Lensin AWA et al. The long-term clinical course of acute deep venous thrombosis. Ann Intern Med 1996; 125(1):1-7.
10. Tibbs DJ. Varicose veins and related disorders. Oxford: Butterworth-Heinemann 1992.
11. Beebe HG, Bergan JJ, Bergqvist D et al. Classification and grading of chronic venous disease in the lower limbs-a consensus statement. Organized by Straub Foundation with the cooperation of the American Venous Forum at the 6th annual meeting, February 22.-25. 1994, Maui, Hawaii. [Review]. Vasa 1995; 24(4): 313-8.
12. Tong Y, Royle J. Duplex ultrasound assessment of the venous status of the swollen leg. Aust N Z J Surg 1995; 65(11): 784-86.
13. Horáková M. Kompresivní terapie ve flebologii. Novinky v medicíně 52. Praha: Avicenum 1990 : 51-84.
14. Krška Z. Trombembolická nemoc v chirurgii. Trendy soudobé chirurgie. Praha: Galén 1998 : 2.vol: 19-22, 55-64, 95-107.
15. Boada JN. Therapeutic Effect of Venotonics in Chronic Venous Insufficiency. Clin Drug Invest 1999; 18(6): 413-432.
16. Lensing AWA, Prandoni P, Prins MH et al. Deep-vein thrombosis. Lancet 1999; 353 : 479-85.
17. Moser KM, Fedullo PF, Litte JF et al. Frequent asymptomatic pulmonary embolism in patients with deep venous thrombosis. JAMA 1994; 271(3): 223-5.
18. Janků K, Čupr Z, Bílková B et al. Výskyt plicních trombembolií na gynekologicko-porodnické klinice v Brně. Prakt Flebol 1993; 3-4 : 113-116.
19. Kearon C, Julian JA, Math M et al. Noninvasive diagnosis of deep venous thrombosis. Ann Intern Med 1998; 128(8): 663-677.
20. Goldhaber SZ. Management of Deep Venous Thrombosis and Pulmonary Embolism. Clin Cornerstone 2000; 2(4): 47-58.
21. Benditt EP, Schwartz SM. Blood vessels. In: Rubin E, Farber JL. Pathology. Philadelphia: JB Lippincott 1994 : 454-501.
22. Roztočil K, Přerovský I, Bergmann P. Sledování vývoje recidiv u pacientů po operaci varixů. Prakt Flebol 1993; 3-4 : 100-101.
23. Feit J. Pathology Images (http://www.ics.muni.cz/~feit/atlases/).
24. Feied CF. Peripheral venous disease. In: Rosen P, Barkin RM. Emergency Medicine Principles and Practice. St Louis: Mosby-Year Book 1998.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2005 Issue 2-
All articles in this issue
- Srovnání řízeného a nekontrolovaného aerobního tréninku nemocných s chronickou ischemickou chorobou srdeční
- Rehabilitace po infarktu myokardu (II): způsoby zátěže
- Choroby venózního systému
- Srovnání léčby hypertenze na interní klinice FN, na interním oddělení malé nemocnice a na specializované kardiologické klinice
- Současné možnosti léčby plicní arteriální hypertenze
- Denní a týdenní variace ve výskytu akutního srdečního infarktu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rehabilitace po infarktu myokardu (II): způsoby zátěže
- Choroby venózního systému
- Současné možnosti léčby plicní arteriální hypertenze
- Srovnání léčby hypertenze na interní klinice FN, na interním oddělení malé nemocnice a na specializované kardiologické klinice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career