-
Medical journals
- Career
Dyslipidemie u pacientů s chronickým onemocněním ledvin
Authors: Magdaléna Dušejovská 1,2; Marek Vecka 2; Ivan Rychlík 3; Aleš Žák 2
Authors‘ workplace: Dialyzační středisko Fresenius NephroCare, Praha Vinohrady 1; IV. interní klinika 1. LF UK a VFN v Praze 2; I. interní klinika 3. LF UK a FNKV, Praha 3
Published in: AtheroRev 2019; 4(3): 153-158
Category:
Overview
Chronické onemocnění ledvin (Chronic Kidney Disease – CKD) je velmi častou komplikací pacientů s diabetes mellitus (DM), arteriální hypertenzí a dyslipidemií. V celosvětovém měřítku se CKD vyskytuje přibližně u 12–15 % dospělé populace. Toto číslo však přesně neodpovídá reálným datům vzhledem k tomu, že v časných stadiích je onemocnění ledvin většinou asymptomatické. Dyslipidemie se u CKD vyskytuje jako konstantní metabolická komplikace, a to již od časných stadií. Pacienti s CKD mají vyšší riziko úmrtí na kardiovaskulární onemocnění a jejich komplikace než pacienti bez přítomnosti onemocnění ledvin. Aktuálním problémem zůstávají možnosti ovlivnění kardiovaskulárního rizika u CKD. Hypolipidemická terapie je jednoznačně indikována již při časných stadiích onemocnění ledvin, ale s klesající glomerulární filtrací se mění možnosti farmakoterapie i doporučení týkající se hypolipidemické terapie, obzvláště pak u pacientů s terminálním selháním ledvin závislých na některé formě náhrady funkce ledvin.
Klíčová slova:
: dyslipidemie – HDL-cholesterol – hypolipidemická terapie – LDL-cholesterol – náhrada funkce ledvin
Úvod
Chronické onemocnění ledvin (Chronic Kidney Disease – CKD) je definováno jako poškození struktury či funkce ledvin přetrvávající alespoň 3 měsíce, ze kterého plynou závažné důsledky pro zdravotní stav pacienta. Klasifikace CKD dle současných doporučení v sobě zahrnuje zhodnocení příčiny, která vedla k poškození ledvin, tíži albuminurie a snížení glomerulární filtrace (tab. 1) [1].
Table 1. CKD klasifikace a riziko progrese dle GF a albuminurie. Upraveno podle [1] ![CKD klasifikace a riziko progrese dle GF a albuminurie. Upraveno podle [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/abcd37534bc44e70fc19c6e10ec220f7.png)
riziko progrese CKD: černé pole – nízké riziko, šedé pole – středně zvýšené riziko, světlé modrozelené pole – vysoké riziko, tmavě modrozelené pole – velmi vysoké riziko
GF – glomerulární filtraceChronické onemocnění ledvin je v populaci velmi častým onemocněním nebo komplikací jiných onemocnění, jako je diabetes mellitus (DM) a arteriální hypertenze (AH): v České republice (ČR) je téměř 1 milion diabetiků a 4 miliony pacientů s AH. Podle světových statistik tedy lze predikovat, že v ČR je přibližně 1 500 000 pacientů s CKD, z toho 5 990 pacientů dospělo v roce 2018 do fáze konečného stadia onemocnění ledvin (End Stage Renal Disease – ESRD) a musela u nich být zahájena některá z náhrad funkce ledvin (hemodialýza, peritoneální dialýza, transplantace ledviny) nebo se rozhodli pro konzervativní řešení svého ESRD [2]. V počátečních stadiích onemocnění ledvin jsou pacienti asymptomatičtí a málokdy vyhledají lékařskou pomoc. Neexistuje o nich tedy přesná evidence a populační data jsou tak v této fázi CKD nekonzistentní. K lékaři se pacienti dostanou většinou až v pozdních fázích onemocnění ledvin, kdy již mají plně rozvinuté různé komplikace základního onemocnění.
Pacienti s CKD mají také akcelerovanou aterosklerózu a ve zvýšené míře umírají na kardiovaskulární onemocnění (CardioVascular Disease – CVD). Vedle tradičních (Framinghamských) rizikových faktorů aterosklerotického postižení se na jejich zvýšeném riziku úmrtí na CVD podílí i řada netradičních rizikových faktorů či komplikací vyplývajících z CKD (renální anémie, porucha kalcio-fosfátového metabolizmu, hyperhydratace, srdeční selhání, malnutrice), tab. 2. Často se jedná o jejich vzájemné ovlivnění.
Table 2. Konvenční a nové rizikové faktory podílející se na etiopatogenezi aterosklerotických změn u pacientů s CKD 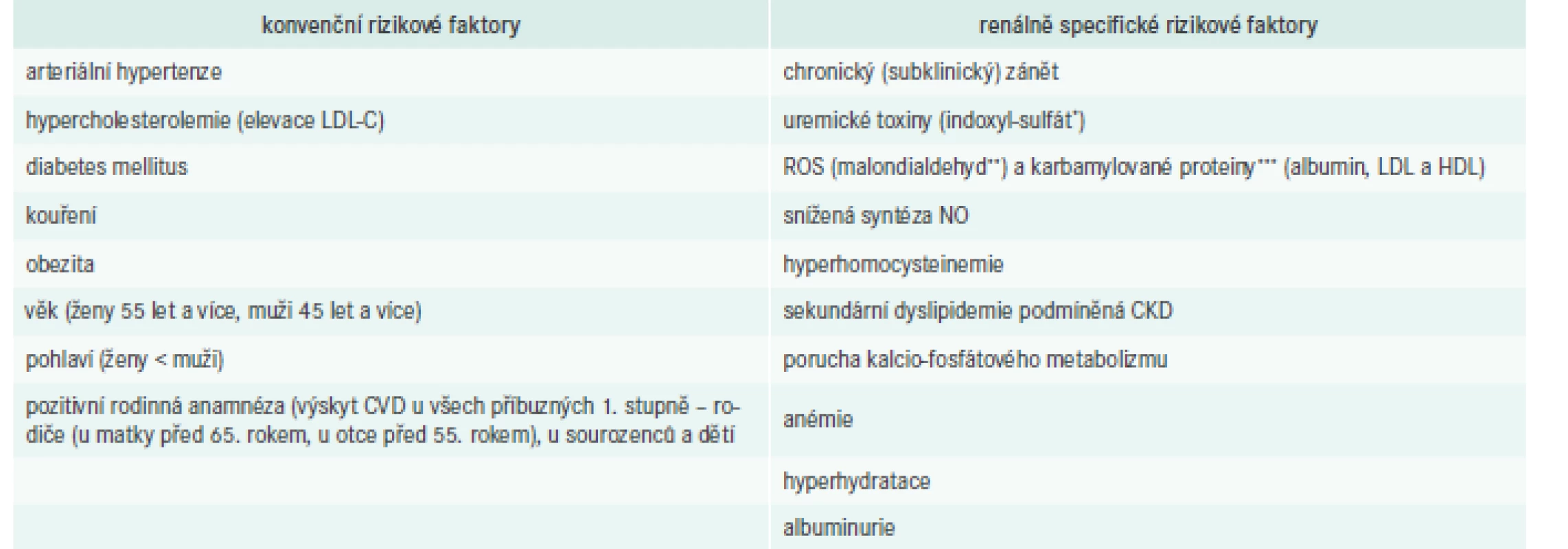
*indoxyl-sulfát je uremickým toxinem syntetizovaným ve střevě z bílkovin působením střevního mikrobiomu, který je indikátorem oxidačního stresu, současně je nefrotoxinem, up-reguluje cytoadhezní molekuly a inhibuje proliferaci endotelu
**malondialdehyd je vedlejším produktem peroxidace polynenasycených mastných kyselin, je využíván jako marker výskytu ROS, jeho hladina bývá pravidelně zvýšená u pacientů s CKD; LDL modifikovaná malondialdehydem je považována za indikátor koncentrace oxidovaného LDL
***karbamylované proteiny (albumin, LDL, HDL) vznikají posttranslační modifikací proteinů prostřednictvím urey; modifikace proteinů mění jejich strukturu, fyzikální a chemické vlastnosti, může ovlivnit jejich funkci a působit jako neoantige a indukovat tvorbu protilátek
ROS – reaktivní sloučeniny kyslíkuDyslipidemie se i u pacientů s CKD vyskytuje jako primární nebo sekundární porucha metabolizmu lipidů. Dyslipoproteinemie je u pacientů s CKD téměř konstantním znakem, zatímco ostatní, renálně specifické rizikové faktory – malnutrice, anémie a další se mohou vyskytovat nepravidelně [3]. Lipidový metabolizmus je narušen již při poklesu glomerulární filtrace < 0,9 ml/s (54 ml/min). Vzhledem k časnému rozvoji poruchy metabolizmu lipidů u pacientů s CKD je potřeba terapeuticky zasáhnout včas. Mnoho odborných skupin se zabývá mimo jiné i problematikou poruch metabolizmu lipidů s cílem najít společný prediktivní marker u pacientů s CKD (nejlépe i terapeuticky ovlivnitelný), který by pacienty s nefropatiemi stratifikoval, ev. indikoval k hypolipidemické terapii. Cílem možných intervencí je co nejvíce snížit kardiovaskulární (KV) riziko a následné komplikace vyplývající z CVD, a zlepšit tak kvalitu života pacientů s CKD.
Patofyziologie dyslipidemie u pacientů s nefropatií
Porucha metabolizmu lipidů a lipoproteinů je u pacientů s CKD komplexní povahy (nutriční a metabolické). V ledvinách se její důsledky projevují buď nepřímo prostřednictvím ovlivnění hemodynamiky v glomerulech (stenóza renální arterie a další), nebo přímo vlivem ektopického ukládání tuků a lipotoxicitou. V recentní práci Nishi popisuje propojení lipotoxického působení a progrese CKD. Dále se práce věnuje souvztažnosti extrarenálních komplikací, jako je renální anémie, srdeční selhání a sarkopenie s lipotoxicitou [3].
Ledviny se skládají z více typů specializovaných buněk (endotelie, vas afferens, vas efferens, tubulární buňky), které jsou vystaveny velkému objemu cirkulující krve a působkům obsažených v primární moči. Navíc, ledviny jsou také vystaveny působení mastných kyselin (Fatty Acid – FA), které ovlivňují jednotlivé typy ledvinných buněk, přičemž výsledný účinek závisí na množství komplexních lipidů, resp. mastných kyselin, které jsou jejich složkou, typu mastných kyselin a akumulaci lipidů v dané buňce [4]. Základními patogenetickými mechanizmy, které se uplatňují v patogenezi CKD, jsou stres endoplazmatického retikula, aktivace zánětu a oxidační stres. V lipotoxickém působení může svou roli sehrát i albuminurie doprovázející již počáteční stadia CKD. Sérové FA jsou vázány na albumin, v komplexu s FA můžou vyvolat i tubulointersticiální poškození [5]. Weinberg ve své práci z roku 2006 uvádí, že v buňkách proximálních tubulů může docházet u pacientů s albuminurií k intracelulárnímu hromadění lipidových depozit [6]. V konečném důsledku jsou tedy ledviny ovlivněny dyslipidemií, akumulací FA a endokrinními změnami (změny koncentrace adipokinu), které mění metabolizmus a složení lipidů krevní plazmy [7].
Pacienti s CKD mají typický lipoproteinový fenotyp charakterizovaný zvýšením koncentrace lipoproteinů o velmi nízké hustotě (Very Low Density Lipoprotein – VLDL) a lipoproteinů o intermediální hustotě (Intermediate Density Lipoprotein – IDL). Ve frakci VLDL je přítomen apoB48, což svědčí pro přítomnost remnantních chylomikronů. Vzestup koncentrací triacylglycerolů (TAG) je spojen s poklesem koncentrace cholesterolu v lipoproteinu o vysoké hustotě (HDL-cholesterol/High Density Lipoprotein – HDL-C); částice HDL jsou zároveň bohatší na TAG než u zdravých jedinců. Hladiny lipoproteinových částic o nízké hustotě (LDL-cholesterol/Low Density Lipoprotein – LDL-C) mívají tito pacienti často ve fyziologickém rozmezí nebo snížené s převahou malých denzních LDL (small dense LDL – sdLDL), které jsou schopny proniknout do cévní stěny, v níž ve zvýšené míře podléhají oxidační modifikaci [8]: tyto sdLDL jsou odpovědné za narušení endotelu. Po jeho poškození se váží na proteoglykany extracelulární matrix v arteriální intimě [9]. Koncentrace apoCII klesají, koncentrace apoCIII mají opačný trend. Další změnou v lipoproteinovém metabolizmu jsou vyšší koncentrace lipoproteinu(a) – Lp(a). Zvýšené koncentrace Lp(a) u pacientů s CKD jsou pravděpodobně zapříčiněny jeho zpomaleným katabolizmem, který probíhá v ledvinách. Po úspěšné transplantaci štěpu ledviny se koncentrace Lp(a) snižují [10]. Zvýšené plazmatické koncentrace Lp(a) u pacientů s ESRD korelují s parametry chronického zánětu – vysoce senzitivního CRP (hs-CRP – high sensitivity CRP) a interleukinu 6 (IL6) [11]. Mezi další změny lipoproteinového metabolizmu u pacientů s CKD patří modifikace HDL-částic. HDL-částice jsou v populaci pacientů bez CKD považovány za kardioprotektivní a mají pleiotropní působení. Primárně hrají důležitou funkci v reverzním transportu cholesterolu, dále působí protizánětlivě, antitrombogenně a antioxidačně. U pacientů s CKD jsou všechny funkce HDL narušeny. HDL-částice obsahují akumulované oxidované lipidy, které následně vedou k inhibici antioxidačních enzymů lokalizovaných na HDL (zejména paraoxonázy 1), mění strukturu apoAI, a tím zpomalují reverzní transport cholesterolu zprostředkovaný HDL. Ty přispívají k tvorbě oxidovaně modifikovaných LDL a k vaskulárnímu zánětu [12]. Snížení aktivit enzymů – paraoxonázy 1 (PON1), syntázy oxidu dusnatého (NO) a lecitin-cholesterol-acyltransferázy (LCAT) prohlubuje další dysfunkci HDL-částic u pacientů s CKD. Tyto dysfunkční HDL jsou ve zvýšené míře odpovědné za oxidaci fosfolipidů, akumulaci sérového amyloidu A (SAA) a CRP s následnou indukcí produkce cytokinů monocyty a dendritickými buňkami. Současně dojde v HDL k výměně apoAI za SAA; volný apoAI je katabolizován ledvinami. Částice HDL ochuzené o apoAI mají nižší schopnost vázat cholesterol v periferních tkáních, čímž je ochromena počáteční fáze reverzního transportu cholesterolu [13–14].
Kromě výše popsaných změn se u pacientů s CKD uplatňuje „cholesterolový paradox“; u běžné populace koreluje KV-mortalita pozitivně s hladinami celkového cholesterolu (Total Cholesterol – TC), zatímco u pacientů s CKD (obzvláště s ESRD) je tento vztah opačný. Tento inverzní vztah je dáván do souvislosti s chronickým zánětem ve spojení s malnutricí (syndrom MIA: malnutrition, inflammation, anorexia). Podstatná část dialyzovaných pacientů má syndrom MIA spojený s vaskulárními kalcifikacemi (syndrom MIAC: malnutrition, inflammation, anorexia, calcification) [15]. Chronický zánět je důsledkem oxidačního stresu. Na něm se podílejí nejen poruchy antioxidačních enzymů, ale i působení uremických toxinů a sekundární dyslipoproteinemie. Modifikované lipoproteinové částice změnou koncentrace, dysfunkcí či lipotoxickým působením přispívají k prohloubení chronického zánětu. Dále se na alteraci antioxidačního potenciálu podílí nedostatek stopových prvků (selen, zinek, měď) jako kofaktorů antioxidačních enzymů; významným zdrojem reaktivních forem kyslíku a dusíku je i kontakt krevních elementů s hemodialyzační membránou u pacientů s ESRD.
Specifika terapie dyslipidemie u pacientů s chronickým onemocněním ledvin
Režimová opatření
Režimová opatření při dyslipidemiích jsou u pacientů s pokročilým CKD značně omezená. Většina pacientů má v predialyzačním stadiu dietu s omezením bílkovin. V dialyzačním stadiu se doporučuje pokračovat v dietě s omezením draslíku, fosforu a tekutin. Speciální doporučení se týkají nemocných s CKD a přítomným DM. Řada pacientů má v rámci diabetické diety restrikci sacharidů, tedy dieta s omezením cholesterolu se dostává do pozadí. Fyzická aktivita je možná jen u pacientů, kteří jsou v dobré fyzické kondici. Většina pacientů v pokročilé fázi renálního onemocnění má řadu komorbidit a z nich vyplývajících symptomů, které jim fyzickou aktivitu znemožňují (dušnost, slabost, křeče, bolesti kloubů a další).
Farmakoterapie
Statiny
Statiny (dle účinnosti rosuvastatin, atorvastatin, simvastatin, lovastatin, fluvastatin) jsou heterogenní skupinou látek, které kompetitivně inhibují 3-hydroxy-3-metylglutaryl-CoA (HMG-CoA) reduktázu. Snížení intracelulární koncentrace cholesterolu v játrech zvyšuje expresi LDL-receptorů, což způsobí zvýšené vychytávání LDL a dalších lipoproteinů (LP) obsahujících apoB (IDL, VLDL). Statiny jsou indikovány u všech typů DLP se zvýšenými koncentracemi LDL-C (LDL-C > 3,40 mmol/l), tj. u izolované hypercholesterolemie a smíšené dyslipidemie. U smíšené hyperlipidemie je předpokladem vhodnosti statinu jako léku první volby koncentrace TAG < 5,17 mmol/l. Statiny se liší farmakokinetikou (absorpce, biologická dostupnost, vazba na bílkoviny, jaterní biotransformace cestou cytochromu P450). Mezi nežádoucí účinky patří myopatie (u 5–10 % léčených), elevace jaterních testů (< 2 %) a zvýšené riziko DM (10 %). Prospěch z léčby statiny na globální KV-riziko je zhruba 9krát vyšší než KV-riziko asociované s DM. Cílem léčby statiny je dosažení cílové koncentrace LDL-C podle kategorie rizika pro CVD, nebo alespoň 50% pokles LDL-C při podávání maximálně tolerovatelné dávky. V KV-prevenci mají významnou úlohu i pleiotropní účinky statinů – pozitivní ovlivnění endoteliální dysfunkce, antioxidační, antiinflamatorní, antiproliferační a antitrombogenní působení.
Pokud jde o typy statinů a renální funkce, zdá se, že atorvastatin je výhodnější než rosuvastatin [16–17]. Crouse v randomizované kontrolní studii (METEOR) popisuje, že větev pacientů s rosuvastatinem prokázala větší redukci lipidového profilu a současně vykazovala signifikantní snížení odhadované glomerulární filtrace (estimated Glomerular Filtration Rate – eGFR) ve srovnání se skupinou pacientů zařazených do větve s atorvastatinem [17]. S tímto faktem je tedy nutné u pacientů s CKD počítat a v hypocholesterolemické léčbě preferovat atorvastatin. Pokud je nutné použít rosuvastatin, je třeba začít terapii nízkými dávkami. U pacientů s pokročilým poklesem eGFR < 30 ml/min/1,73 m² (CKD ³ 4) rosuvastatin není doporučen vůbec. Při terapii rosuvastatinem je rovněž potřeba počítat s lékovými interakcemi, zejména s inhibitory protonové pumpy. Tyto jsou v chronické medikaci pacientů s nefropatií ve velké míře zastoupeny. Su a Zhang provedli v roce 2016 metaanalýzu 54 studií, která zhodnotila podávání statinů pacientům s různými stadii CKD. Závěrem této práce bylo shrnutí, že léčba statinem nezhoršuje riziko výskytu selhání ledvin u dospělých s CKD, kteří nejsou dependentní na pravidelné dialyzační léčbě (PDL). Statiny mohou mírně snížit proteinurii a rychlost progrese CKD. Kromě toho léčba statinem významně snížila riziko KV-příhod o 31 % u pacientů s CKD [18]. Fluvastatin je preferenčně využíván, pokud primární renální diagnóza vyžaduje použití imunosupresiv. Fluvastatin je metabolizován přes cytochromy CYP 2C9, 3A4, 2D6 a 2C8. Je nejméně účinný v oblasti KV-prevence, nicméně v této indikaci má své opodstatnění vzhledem k minimálním lékovým interakcím (imunosuprese, antibiotická a antimykotická terapie). V současné době zatím platí pro hypolipidemickou terapii doporučení pracovní skupiny Lipid Work Group KDIGO iniciativy (Kidney disease: Improving Global Outcomes) z roku 2013, která doporučují lékařům pečujícím o pacienty s CKD G3–5 terapii statiny nebo kombinační terapii statin/ezetimib zachovat. U pacientů v PDL navrhují hypolipidemickou terapii nezahajovat. Pokud však léčba byla zahájena v méně pokročilých stadiích CKD, doporučuje se v léčbě pokračovat [19].
Fibráty
Fibráty (fenofibrát, ciprofibrát) jsou lékem první volby u nemocných s TAG > 5,20 mmol/l. Snižují koncentrace TAG o 20–50 %, zvyšují koncentrace HDL-C a mají variabilní účinek na hladinu LDL-C. Jsou to agonisté nukleárních receptorů PPARa. Modulují expresi četných genů, které řídí lipidový a glycidový metabolizmus. Jejich hypolipidemický účinek je důsledkem urychleného katabolizmu lipoproteinů bohatých TAG (TAG-Rich Lipoproteins – TRL) v důsledku aktivace LPL a snížené exprese apo C-III v kombinaci s potlačením syntézy TAG. Podávání fibrátů příznivě ovlivňuje lačnou i postprandiální hypertriacylglycerolemii (HTAG), zvyšuje HDL-C a snižuje zastoupení sdLDL. V primárně a sekundárně preventivních studiích měly největší prospěch z podávání fibrátů osoby s HTAG, poklesem HDL-C a poměrem LDL-C/HDL-C > 5,0, včetně nemocných s aterogenní dyslipidemií. U pacientů s CKD měla terapie fenofibrátem za následek zvýšení hladin kreatininu v séru a sníženou rychlost glomerulární filtrace v primární prevenci [20]. Proto je nutno během podávání fibrátů pravidelné sledování renálních funkcí. Existuje několik hypotéz týkajících se mechanizmů, na nichž je založena nefrotoxicita spojená s fenofibrátem. Fenofibrát může zhoršit tvorbu vazodilatačních prostaglandinů, což vede k převaze vazokonstrikce aferentní arterioly; výsledkem jsou změny intraglomerulárního tlaku a pokles GFR [21]. Alternativně může fenofibrát kompetitivně inhibovat sekreci kreatininu v proximálním tubulárním lumen [22–24] nebo zvýšit produkci endogenního kreatininu [25]. Ukazuje se, že podávání fibrátů oddaluje u DLP vývoj porušené glukózové tolerance a vznik diabetes mellitus 2. typu (DM2T). Fenofibrát snižuje albuminurii u DM2T a brání rozvoji diabetické retinopatie. Mezi nežádoucí účinky fibrátů se řadí dyspepsie (< 5 %), zarudnutí kůže (< 2 %), myopatie, zvl. u nemocných s CKD (< 5,5 %) a cholelitiáza. Z laboratorních ukazatelů jsou s léčbou fibráty spojeny elevace plazmatických koncentrací kreatininu a homocysteinu [26]. Terapie fenofibrátem není vhodná u pacientů s CKD G4,5.
Ezetimib
Ezetimib je selektivním inhibitorem absorpce cholesterolu v tenkém střevě. V kartáčovém lemu enterocytů blokuje transportní protein Niemann-Pick C1-like protein 1 (NPC1L1), blokádou dochází ke sníženému vstřebávání cholesterolu do enterohepatální cirkulace. Na pokles cholesterolu v portální krvi reaguje hepatocyt zvýšenou expresí LDL-receptoru následovanou poklesem LDL-C. Ezetimib není vhodný v monoterapii hypercholesterolémie, neboť zpětnovazebnými mechanizmy je akcentována intracelulární syntéza cholesterolu. Rovněž není vhodný pro těhotné a děti, neboť je v 95 % vstřebáván z enterocytu do enterohepatální cirkulace. Pro pacienty s CKD je vhodný do kombinační terapie (simvastatin/ezetimib); studie SHARP potvrdila významné snížení velkých aterosklerotických KV-příhod o 17 %. V konečném stadiu onemocnění ledvin u pacientů závislých na dialýze se ukazuje, že změny v metabolizmu cholesterolu a fytosterolů jsou spojeny s vyšší absorpcí cholesterolu a narušením lipoproteinového metabolizmu. Tento fakt by mohl podpořit terapii ezetimibem zaměřenou právě na blokádu absorpce cholesterolu v enterocytu [4].
PCSK9-inhibitory
PCSK9-inhibitory (alirokumab, evolukomab), tedy inhibitory proprotein konvertázy subtilizin/kexin typu 9 (Proprotein Convertase Subtilisin/Kexin type 9 – PCSK9) patří do skupiny serinových proteáz. PCSK9 je exprimován v hepatocytech, enterocytech, ledvinách i mozečku. PCSK9 vytváří komplex s LDL-receptorem, který po navázání LDL-částice vede k internalizaci komplexu do cytosolu buňky, v lyzosomu je následně degradován celý komplex LDL-receptor – LDL-částice – PCSK9. LDL-receptor již dále není recyklován a zpětně exprimován na membráně buněk. Aktuálně jsou od roku 2018 v České republice k dispozici 2 preparáty – alirokumab a evolukomab. Pro pacienty s CKD jsou prozatím indikovány do stadia CKD3a, pokud nedosahují cílových hodnot LDL-C na maximální tolerované terapii statinem či kombinační terapii (statin/ezetimib) [27]. Nicméně v ČR je znám kazuistický případ pacienta s ESRD, s familiární hypercholesterolemií a statinovou myopatií, který byl indikován v sekundární prevenci k aplikaci PCSK9-inhibitorů – zatím s velmi dobrou tolerancí terapie.
Závěr
Chronické onemocnění ledvin je jedním z hlavních rizikových faktorů aterosklerotického CVD. Akcelerace aterosklerózy vede v počátečních stádiích CKD k časné manifestaci komplikací aterosklerózy a pacienti v této fázi umírají spíše na CVD a jejich komplikace než na primární nefrologické onemocnění [28]. Pacienti s CKD jsou kategorizováni do skupiny s velmi vysokým KV-rizikem a jejich hypolipidemická léčba má svá specifika. V ambulantní praxi by tedy měla být od časných stadií CKD mimo jiné snaha o důslednou prevenci progrese rizikových faktorů CVD, včetně spolupráce nefrologa s lipidologem. Dohoda o maximálně účinné hypolipidemické terapii (včetně kombinační léčby či indikace PCSK9-inhibitorů) by měla být vedena s cílem v co největší míře snížit riziko komplikací vyplývajících z CVD, a tak zlepšit kvalitu života pacientů s CKD.
Práce byla podpořena granty RVO-VFN64165 a PROGRES Q25/LF1/2.
MUDr. Magdaléna Dušejovská, Ph.D.
MAGDALENA.DUSEJOVSKA@FMC-AG.COM
Doručeno do redakce 2. 10. 2019
Přijato po recenzi 11. 10. 2019
Sources
- [KDIGO 2012]. Summary of Recommendation Statements. Kidney Int Suppl 2013; 3(1): 5–14. Dostupné z DOI: <http://dx.doi.org/10.1038/kisup.2012.77>.
- Rychlík I, Lopot F. Statistická ročenka dialyzační léčby v ČR 2018. Dostupné z WWW: <http://www.nefrol.cz/odbornici/dialyzacni-statistika>.
- Nishi H, Higashihara T, Inagi R. Lipotoxicity Kidney, Heart, and Skeletal Muscle Dysfunction. Nutrients 2019; 11(7). pii: E1664. Dostupné z DOI: <http://dx.doi.org/10.3390/nu11071664>.
- Vecka M, Dušejovská M, Staňková B et al. Non-cholesterol sterols and fatty acids in chronic hemodialysis patients. Nutr Metab Cardiovasc Dis (in print).
- Dupont B, Oberfield SE, Smithwick EM et al. Close genetic linkage between HLA and congenital adrenal hyperplasia (21-hydroxylase deficiency). Lancet 1977; 2(8052–8053): 1309–1312. Dostupné z DOI: <http://dx.doi.org/10.1016/s0140–6736(77)90362–2>.
- Weinberg JM. Lipotoxicity. Kidney Int 2006; 70(9): 1560–1566. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.ki.5001834>.
- Upadhyay A, Earley A, Lamont JL et al. Lipid-lowering therapy in persons with chronic kidney disease: A systematic review and meta-analysis. Ann Intern Med 2012; 157(4): 251–262. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–157–4-201208210–00005>.
- Kotani K, Tsuzaki K, Traniguchi N et al. LDL particle size and reactive oxygen metabolites in dyslipidemic patients. Int J Prev Med 2012; 3(3): 160–166.
- Galeano NF, Al-Haideri M, Keyserman F et al. Small dense low density lipoprotein has increased affinity for LDL receptor-independent cell surface binding sites: a potential mechanism for increased atherogenicity. J Lipid Res 1998; 39(6): 1263–1273.
- Kronenberg F, Kuen E, Ritz E et al. Lipoprotein(a) serum concentrations and apolipoprotein(a) phenotypes in mild and moderate renal failure. J Am Soc Nephrol 2000; 11(1): 105–115.
- Žák A, Zeman M. Sekundární dyslipidémie. In: Svačina Š (ed). Poruchy metabolismu a výživy. Galén: Praha 2010 : 271–288. ISBN 978–80–7262–676–2.
- Dodani S, Grice DG, Joshi S. Is HDL function as important as HDL quantity in the coronary artery disease risk assessment? J Clin Lipidol 2009; 3(2): 70–77. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2009.02.001>.
- Weichhart T, Kopecký C, Kubíček M et al. Serum amyloid A in uremic HDL promotes inflammation. J Am Soc Nephrol 2012; 23(5): 934–947. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2011070668>.
- Dušejovská M, Rychlík I, Žák A et al. Lipid Metabolism in Patients with End-Stage Renal Disease: A Five Year Follow-up Study. Curr Vasc Pharmacol 2018; 16(3): 298–305. Dostupné z DOI: <http://dx.doi.org/10.2174/1570161115666170530104143>.
- Tesař V. Metabolické aspekty nemoci ledvin. In: Svačina Š (ed). Poruchy metabolismu a výživy. Galén: Praha 2010 : 137–150. ISBN 978–80–7262–676–2.
- de Zeeuw D, Anzalone DA, Cain VA et al. Renal effects of atorvastatin and rosuvastatin in patients with diabetes who have progressive renal disease (PLANET I): a randomised clinical trial. Lancet Diabetes Endocrinol 2015; 3(3): 181–190. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(14)70246–3>.
- Crouse JR, Raichlen JS, Riley WA et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR trial. JAMA 2007; 297(12): 1344–1353. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.297.12.1344>.
- Su X, Zhang L, Lv J et al. Effect of Statins on Kidney Disease Outcomes: A Systematic Review and Meta-analysis. Am J Kidney Dis 2016; 67(6): 881–892. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2016.01.016>.
- [Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group]. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney Int Suppl 2013; 3(3): 259–305. Dostupné z DOI: <http://dx.doi.org/10.1038/kisup.2013.27>.
- Kim S, Ko K, Park S et al. Effect of Fenofibrate Medication on Renal Function. Korean J Fam Med 2017; 38(4): 192–198. Dostupné z DOI: <http://dx.doi.org/10.4082/kjfm.2017.38.4.192>.
- McQuade CR, Griego J, Anderson J et al. Elevated serum creatinine levels associated with fenofibrate therapy. Am J Health Syst Pharm 2008; 65(2): 138–141. Dostupné z DOI: <http://dx.doi.org/10.2146/ajhp070005>.
- Lipscombe J, Lewis GF, Cattran G et al. Deterioration in renal function associated with fibrate therapy. Clin Nephrol 2001; 55(1): 39–44.
- Ritter JL, Nabulsi S. Fenofibrate-induced elevation in serum creatinine. Pharmacotherapy 2001;21(9): 1145–1149. Dostupné z DOI: <http://dx.doi.org/10.1592/phco.21.13.1145.34623>.
- Ansquer JC, Dalton RN, Caussé E et al. Effect of fenofibrate on kidney function: a 6-week randomized crossover trial in healthy people. Am J Kidney Dis 2008; 51(6): 904–913. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2008.01.014>.
- Hottelart C, El Esper N, Rose F et al. Fenofibrate increases creatininemia by increasing metabolic production of creatinine. Nephron 2002; 92(3): 536–541. Dostupné z DOI: <http://dx.doi.org/10.1159/000064083>.
- Zeman M, Žák A, Vecka M et al. Treatment of hypertriglyceridemia with fenofibrate, fatty acid composition of plasma and LDL, and their relations to parameters of lipoperoxidation of LDL. Ann N Y Acad Sci 2002; 967 : 336–341. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1749–6632.2002.tb04289.x>.
- Toth PP, Dwyer JP, Cannon CP et al. Efficacy nad safety of lipid lowering by alirocumab in chronic kidney disease. Kidney Int 2018; 93(6): 1397–1408. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2017.12.011>.
- Coresh J, Selvin E, Stevens LA et al. Prevalence of chronic kidney disease in the United States. JAMA 2007; 298(17): 2038–2047. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.298.17.2038>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adults
Article was published inAthero Review

2019 Issue 3-
All articles in this issue
- Strategie kardiovaskulární prevence: to je oč tu běží!
- Editorial
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019
- Specifika léčby postižení cévního systému u pacientů s chronickým onemocněním ledvin
- Ľubomíra Fábryová, Pavol Holéczy a kolektív. Diabezita. Diabetes a obezita: nerozlučné dvojičky
- Vliv statinů na podocyty u nefrotického syndromu
- Dyslipidemie u pacientů s chronickým onemocněním ledvin
- Apolipoprotein L1 – etnicky specifický determinant renálního a srdečního selhání
- Observační studie léčby dyslipidemie v České republice
- Deficience lyzosomální kyselé lipázy: jedna z možných příčin dyslipidemie a hepatopatie
- Vitamín D a koronárne riziko detekované výpočtovou tomografiou
- Desatero použití ezetimibu aneb stručný průvodce jeho použitím v současnosti
- Strategie kardiovaskulární prevence: to je oč tu běží!
- Rešerše zajímavých článků ze zahraniční literatury
- Fellowship ČSAT: German Heart Center Munich – Technical University Munich 18. 2. 2019–17. 8. 2019
- Šobrův den 2019: Lipidologie opět na výsluní
- Athero Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Desatero použití ezetimibu aneb stručný průvodce jeho použitím v současnosti
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019
- Specifika léčby postižení cévního systému u pacientů s chronickým onemocněním ledvin
- Dyslipidemie u pacientů s chronickým onemocněním ledvin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

