-
Medical journals
- Career
Základní neuromodulační metody v léčbě chronické bolesti
Authors: J. Kozák 1; Š. Kozák 2; I. Vrba 3
Authors‘ workplace: Centrum pro léčení a výzkum bolestivých stavů při Klinice rehabilitace a tělovýchovného lékařství, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole 1; Ambulance léčby bolesti, Klinika anesteziologie a resuscitace, 3. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady 2; Anesteziologicko-resuscitační oddělení, Nemocnice Na Homolce 3
Published in: Anest. intenziv. Med., 30, 2019, č. 3-4, s. 153-161
Category:
Overview
Chronické bolesti nejsou vždy dostatečně ovlivnitelné standardními léčebnými postupy. Navíc je v současné době vyvíjen celosvětově tlak na lékaře omezit používání opioidů v léčbě chronické bolesti pro tzv. opioidní krizi a neuromodulační léčba by mohla být možným řešením. Neuromodulace se vyznačuje inhibicí, stimulací, modifikací či léčebnou alterací aktivity centrálního i periferního nervového systému použitím elektrické energie nebo léků. Nejdůležitějšími metodami neuromodulační protibolestivé léčby jsou neurostimulace a intraspinální (subarachnoidální) aplikace léků. Použití neuromodulačních metod prokazatelně vzrůstá v posledním desetiletí díky novým systémům, technickému pokroku a novým indikacím v léčbě chronické bolesti. V článku ukazujeme přehled základních neuromodulačních analgetických metod (spinální nervová stimulace a aplikace léků do subarachnoidálního prostoru) a současný stav v jejich použití při léčbě chronické bolesti.
Klíčová slova:
chronická bolest – neuromodulace – míšní stimulace – subarachnoidální aplikace léků
ÚVOD
Bolest je nepříjemná senzorická a emoční zkušenost, která zahrnuje komplexní proces nervového přenosu v periferním a centrálním nervovém systému. Chronická bolest (CHB) je definována jako přetrvávající bolest přes 3–6 měsíců. CHB není vždy dostatečně ovlivnitelná standardními léčebnými postupy [1].
Vzhledem ke vzniku opioidní krize či epidemie na podkladě nadužívání opioidů i pro léčebné účely, zejména v USA, Kanadě a Austrálii, vzniká celosvětově tlak na lékaře na racionální používání opioidů. Existuje několik možností, co s touto situací dělat (použití neopioidních analgetik, koanalgetik – adjuvantních léků, psychorehabilitačních a alternativních přístupů a intervenčních metod). Jednou z možností řešení tohoto problému je i častější terapeutické využití neuromodulačních analgetických metod.
Za neuromodulaci se považuje nedestruktivní a reverzibilní léčba, která zahrnuje použití implantovaných elektrických stimulačních systémů a chemické (lékové) neuromodulace. Neuromodulační analgetické metody umožňují léčbu velmi silných, jinak neovlivnitelných chronických bolestí. K neurostimulacím patří periferní nervová stimulace, stimulace míchy (zadních provazců míchy či ganglií), korová a hluboká mozková stimulace. Různě sofistikované systémy používáme k aplikaci léčiv do intraspinálního, převážně subarachnoidálního (s.a.) a výjimečně do intracerebroventrikulárního (komorového) prostoru.
Mezi neuromodulační analgetické metody dále počítáme pulzní radiofrekvenční léčbu (PRf) a léčbu s použitím neinvazivních neuromodulačních metod (např. repetitivní transkraniální magnetická stimulace – rTMS).
Neuromodulační metody jsou nejvíce rozšířené v USA a Evropě, každoročně se provádějí tisíce neuromodulačních výkonů, které pomáhají nemocným snížit či přímo odstranit bolest, kterou se jinými analgetickými metodami nepodařilo zvládnout. Neuromodulace nabízejí alternativu v léčbě těch případů, kde méně invazivní terapie nejsou účinné nebo jsou zatíženy nezvládnutelnými vedlejšími účinky, kauzální terapie není možná a pacient není indikován k neurodestruktivním výkonům. Pro úspěšnou léčbu neuromodulačními technikami je podstatné, aby byla stanovena vždy přesná diagnóza, zjištěna etiologie bolesti a určen typ bolesti. Neuropatický typ bolesti lépe odpovídá na léčbu neurostimulačními technikami než bolesti nociceptivní [2]. Nejrozšířenější indikací pro neuromodulační léčbu je postdiskotomický syndrom, tzv. failed back surgery syndrome (FBSS). Tvoří celosvětově kolem 60–70 % všech indikací k neuromodulační léčbě [4].
Vzhledem k tomu, že implantibilní systémy jsou dlouhodobě zavedené do organismu a současně finančně náročné pro plátce zdravotní péče, je správná a bezpečná funkce těchto systémů všemi poskytovateli zdravotní péče pečlivě sledována. Tyto metody jsou určeny zejména pro léčbu chronické nenádorové bolesti, i když v poslední době je na vzestupu i jejich použití, zejména s.a. aplikace léků – opioidů u bolestí nádorové etiologie. Provoz neuromodulačních systémů a jejich funkci nastavuje, průběžně sleduje a řídí lékař speciálními telemetrickými přístroji, které mohou měnit charakteristiky přístrojů (stimulačního generátoru u neurostimulace, elektronického čerpadla u pumpových systémů).
V prvé části našeho sdělení se věnujeme míšní stimulaci, základní a nejvíce používané neurostimulační analgetické metodě. Ve druhé části článku zmiňujeme druhou velkou skupinu neuromodulačních analgetických postupů – dlouhodobé analgetické lékové aplikace do subarachnoidálního prostoru.
MÍŠNÍ STIMULACE – NEUROSTIMULACE (SCS)
Neurostimulace znamená ovlivnění přenosu bolesti stimulací nervových tkání či struktur definovaným elektrickým proudem. Je využívána nízkonapěťová elektrická stimulace nervů, mozku a zvláště dorzálních míšních provazců (spinal cord stimulation – SCS), kde se blokuje přenos nervových signálů bolesti do mozku. Cílem neurostimulační léčby je snížení bolesti, omezení analgetické medikace, zlepšení funkčnosti a kvality života [5]. Při použití neuromodulačních metod je průměrná úleva od bolesti o 50–70 % u 80 % nemocných s neurostimulačním systémem [2]. Metoda vyžaduje vysoké náklady, a proto rozhodnutí o implantaci je prováděno za přísných výběrových kritérií.
Neuromodulační metody jsou velmi rozšířené a celosvětově počet neurostimulačních výkonů narůstá. Odhaduje se, že v současné době jsou neurostimulační systémy zaváděny 15–18 tisícům pacientům ročně, z tohoto počtu je 5–6 tisíc implantací v Evropě, všeobecně se nejvíce používají SCS.
SCS elektrody se zavádějí epidurálně ve všech míšních etážích, v krční, hrudní i bederní oblasti podle lokalizace bolestí. Klasickou indikací pro SCS je neuropatická bolest u FBSS. U FBSS je zaváděna jedna nebo dvě elektrody do dolních segmentů hrudní páteře. Elektroda do krční oblasti je indikována u závažných chronických bolestí v oblasti horních končetin a krku, méně často pro bolesti hlavy. V horní oblasti hrudní páteře se implantace SCS provádí nejčastěji u neztišitelných stenokardií. Z hlediska indikací je možné použití neurostimulace u více typů chronické bolesti, nejen u neuropatické, ale i u viscerální bolesti a funkčních poruch (tab. 1).
Table 1. Nejčastější indikace k míšní neurostimulaci 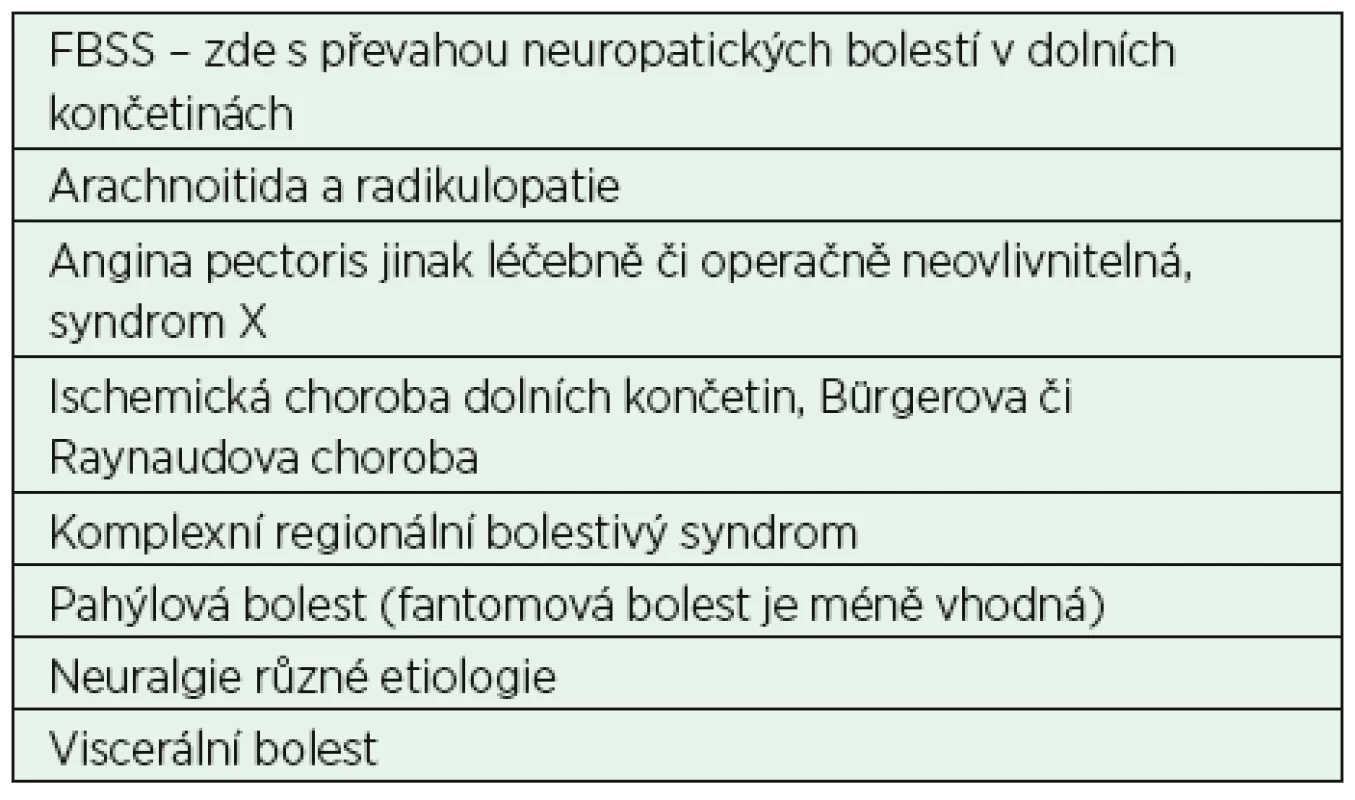
Poznámka: Výjimečně chronická bolest z nádorových příčin, zejména s výraznou neuropatickou složkou a dostatečnou dobou přežívání. Při výběru neurostimulačních přístrojů máme k dispozici plně implantovaný konvenční systém s vnitřním zdrojem energie nebo implantované systémy s možností zevního perkutánního dobíjení generátoru. Konvenční systémy stimulují frekvencí od 25 do 120 Hz. U konvenčního systému SCS pacient pociťuje při spuštění přístroje většinou příjemné parestezie a obvykle si stimulaci pouští několikrát denně.
Používají se i systémy vysokofrekvenční, které jsou zevně dobíjitelné i systémy kombinované, které zvládají více programovatelných režimů.
Vysokofrekvenční SCS používá stimulační frekvence řádově vyšší (10 kHz) [7] a charakter stimulace je odlišný – při vysokofrekvenční SCS pacient nevnímá stimulační parestezie, které mohou být nepříjemné až u 75 % pacientů s konvenční SCS [6]. Generátor u vysokofrekvenční SCS je neustále spuštěn a je dobíjen telemetrickým způsobem.
Vysokofrekvenční systém může být tedy příjemnější pro nemocného, ale je primárně dražší ve srovnání s generátorem bez možnosti dobíjení. V dlouhodobém provozu se náklady vyrovnávají [7].
Klasický neurostimulační systém se skládá ze zdroje energie, ze spojovacích kabelů a z elektrod (obr. 1 a 2). Naprogramování je kombinací – interakcí mezi amplitudou, šířkou pulsu a frekvencí elektrického proudu a zvolením optimální počtu a kombinací pólů na elektrodě + (anoda pól) a – (katoda pól) elektrody [8].
Image 1. Přístrojový set k SCS: generátor, prodlužovací kabely a perkutánní elektrody 
Image 2. Dva druhy klasických (konvenčních) generátorů vlevo nahoře, perkutánní elektrody, v pravém horním rohu a chirurgické v pravém dolním rohu snímku. Vlevo dole je pacientský ovladač k ovládání přístroje po definitivní implantaci generátoru do podkoží. 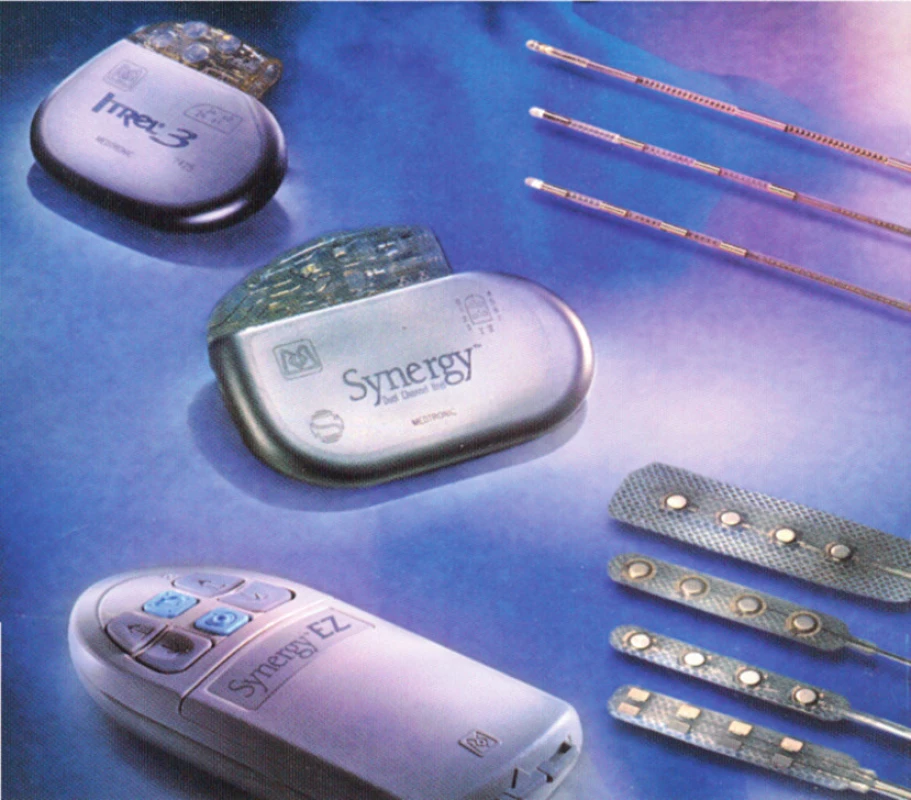
Výběr pacienta k SCS je dán splněním povinných vyšetření a kritérií. Nezbytná je diskuse s pacientem i s jeho rodinou o vlastní metodě, o očekávaných cílech, rizicích i režimu života s neuromodulačním systémem. Úspěšný výsledek zavedené metody není dán pouze poklesem intenzity bolesti. Součástí dobrého výsledku při zavedení SCS je i snížení analgetické medikace a zlepšení funkčnosti a kvality života [1], což se hodnotí při pravidelných kontrolách v daném neuromodulačním centru.
Multidisciplinární přístup je podstatný pro správný výběr pacienta i pro úspěšné provádění neuromodulačních metod a řešení případných komplikací. Skládá se z pěti fází:
- Výběr vhodného pacienta a jeho všeobecná příprava před plánovaným výkonem. Jedná se o soubor povinných vyšetření před výkonem, v jejich závěru je vyjádřen souhlas s plánovaným výkonem SCS. Jedná se o vyšetření algeziologické z neuromodulačního centra, neurochirurgické, psychologické, psychiatrické, imunologické a neurologické. Dále se doplňují pomocná vyšetření podle indikace jednotlivých odborníků, nejčastěji se indikují neurofyziologická vyšetření a zobrazovací metody.
- Předimplantační testování a schválení k neuromodulační metodě. Provádí se testováním pacienta pomocí invazivních přístupů, např. při použití kontinuální epidurální analgezie, na některých pracovištích se používají zevní stimulační metody, např. transkutánní elektrická neurostimulace (TENS).
- Perioperační stimulační test a zkušební období. Během operačního výkonu je provedeno zavedení elektrod do zadního epidurálního prostoru, do zvolené etáže páteře a peroperačně je elektroda testována. Vlastní detailní umístění se provádí až podle komunikace s pacientem během výkonu v lokální anestezii, hodnotí se kvalita analgezie – pokrytí bolestivé oblasti paresteziemi při testové stimulaci. Tato fáze odpadá u vysokofrekvenčních systémů, kde pacienti stimulované parestezie necítí ani po definitivním zavedení generátoru – zavedení elektrod se tedy provádí bez peroperačního stimulačního testu.
- Testovací období a implantace systému. Kompletní implantace neuromodulačního systému se provádí po 7–10 dnech testovacího období, zpravidla při hospitalizaci pacienta. Pacient má externalizovaný kabel k elektrodě, učí se pracovat se stimulací a hodnotí její efekt. Lékař podle sledování jeho záznamů bolesti, resp. popisu analgezie při spouštění SCS indikuje definitivní implantaci generátoru. Ten je umístěn v podkoží, nejčastěji v oblasti podbřišku u stimulace zad a dolních končetin (obr. 3) a pod klavikulou u implantace SCS pro oblast krku a horní části hrudní páteře. Pro zajištění stimulace lze použít i chirurgicky zavedenou elektrodu, která má své přednosti (větší účinná plocha), ale za cenu vyšší invazivity při zavádění s nutností použití celkové anestezie (obr. 4).
- Postimplantační dlouhodobá péče. Následná postimplantační péče o nemocného po zavedení neuromodulačního systému včetně generátoru spočívá v pravidelných kontrolách funkce – stimulace pomocí telemetrického měření, které ukazuje fyzikální parametry stimulace (napětí na elektrodě, frekvenci, impendanci) a využití přístroje pacientem – častost a intenzita stimulace a spotřeba energie generátoru. Během návštěvy pacienta je možné parametry stimulace měnit k zajištění optimální analgezie i energetické spotřeby. Součástí postimplantační péče je úprava farmakoterapie, žádoucí je vysazení nebo významná redukce analgetik, zejména opioidů, při dostatečné analgezii pomocí SCS. V dlouhodobém horizontu je pak pacient sledován na implantujícím pracovišti, které řeší technické úpravy parametrů stimulace i možné komplikace spojené s provozem neuromodulačního systému.
Image 3. Dvě perkutánně zavedené čtyřpólové elektrody s generátorem v oblasti podbřišku 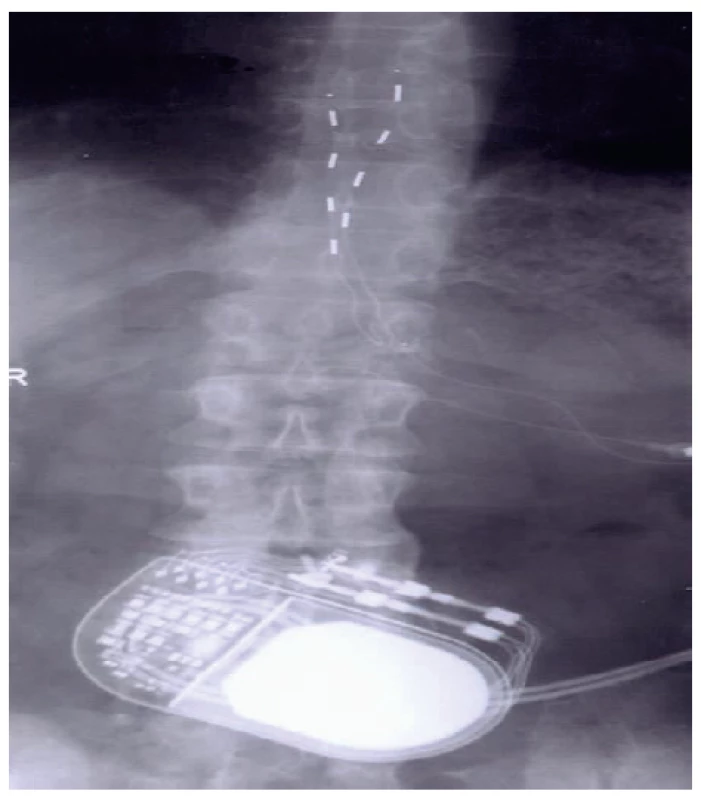
Image 4. Chirurgická elektroda s generátorem určeným pro opakované nabíjení 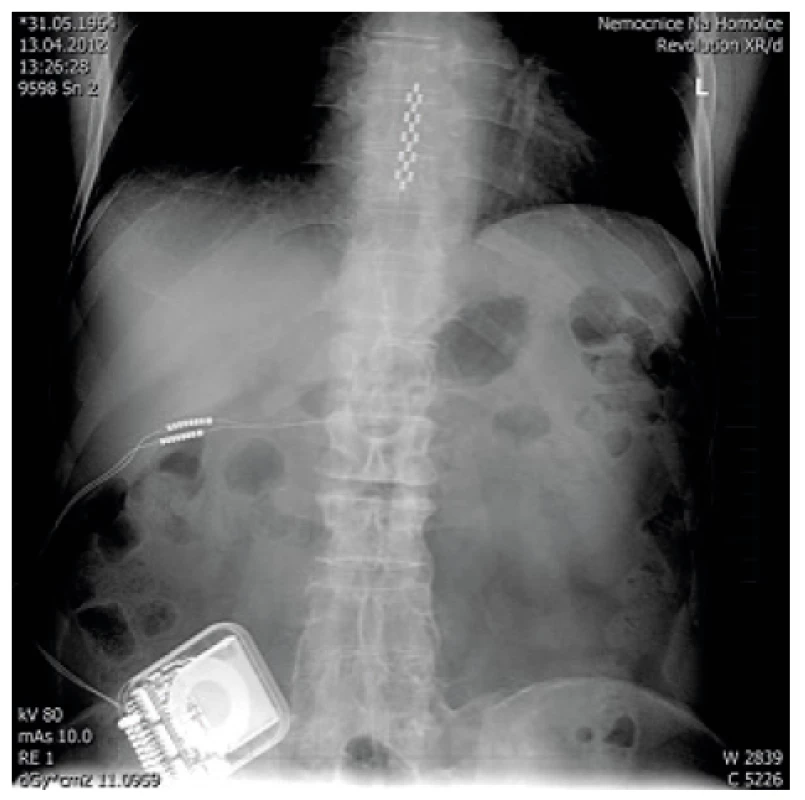
POPIS SCS V JEDNOTLIVÝCH ETÁŽÍCH PÁTEŘE
ZAVEDENÍ SCS V OBLASTI KRČNÍ PÁTEŘE
Zavádění SCS do cervikální oblasti je méně časté, uvádí se asi 5–10 % z celkového počtu zavedených míšních stimulací. Elektroda se perkutánně zavádí v meziobratlovém prostoru C7–Th1, resp. Th1–2 a hrot elektrody do úrovně 2.–3. krčního obratle pro stimulaci horní končetiny. Méně časté využívání SCS v této oblasti je dáno obtížností vlastního zavedení i výskytem vyšších rizik pro pacienta. Elektrodu zavádíme v oblasti krční intumescence. Navíc identifikace meziobratlového prostoru může být obtížná. Vlastní stimulace je většinou velmi spolehlivá a je ovlivněná polohou hlavy. Pacienti podle našich zkušeností zvládají polohování hlavy pro účinnou a bezpečnou stimulaci bez větších problémů.
Indikací ke krční SCS jsou neuropatické bolesti horní končetiny různé etiologie, nejčastěji se jedná o poškození více nervů nebo celého brachiálního plexu následkem úrazů, případně při vzniku chronické bolesti po komplikovaných rekonstrukčních výkonech v této oblasti.
Komplexní regionální bolestivý syndrom (KRBS) horní končetiny I. typu se indikuje častěji ke krční SCS než typ II. (kauzalgie), kde se primárně jedná o postižení určitého nervu, pak preferujeme periferní nervovou stimulaci (PNS) se zavedením elektrody k postiženému nervu.
Fantomové bolesti horních končetin reagují na SCS podle našeho souboru pacientů lépe než u pacientů se stejnou diagnózou na dolních končetinách. Pahýlové bolesti u amputovaných končetin jsou SCS lépe ovlivněny než bolesti fantomové.
K méně obvyklým indikacím krční stimulace patří deaferentační bolesti a bolesti krku a hlavy. Výjimečně se SCS používá např. u avulzí brachiálního plexu. U určitých chronických bolestí hlavy (např. migrény a neuralgické bolesti) se jednoznačně upřednostňuje okcipitální nervová stimulace (ONS) [8].
ZAVEDENÍ SCS V OBLASTI HRUDNÍ PÁTEŘE
Hrudní epidurální prostor je pro umístění elektrody nejčastěji používaným úsekem páteře. Z této oblasti je ovlivňována bolest nejen neuropatická při postižení nervových struktur v oblasti hrudníku (např. kořenové bolesti), dolních končetin, případně celého trupu, ale i bolest nociceptivní a viscerální. Velmi využívanou indikací pro zavedení SCS je stabilní angina pectoris (AP) bez významné koronární obstrukce a bez průkazu koronárních spasmů. Za nevhodnou indikaci k SCS se považuje nestabilní AP s projevy klidových a nočních bolestí [9].
U AP se implantuje u neurostimulačního systému elektroda i generátor v jedné době (na rozdíl od ostatních neurostimulačních postupů, mimo ONS). Tento postup je doporučen zejména proto, že psychogenní nadstavba u kardiálních onemocnění je na rozdíl od většiny chronických bolestivých stavů indikovaných k SCS významně nižší a příčina bolestí u AP syndromu je zcela jasná a průkazná [10]. Vpich při zavádění epidurální elektrody pro léčbu AP se provádí v oblasti Th 3–5 paramediálně a ipsilaterálně s polohou srdce, většinou tedy vlevo, elektroda se umísťuje v zadním epidurálním prostoru ve výši C 7–Th 1.
Další druhy viscerální bolesti představují pro použití SCS novější indikace a první literární zprávy o použití SCS jsou staré necelých dvacet let [11] (tab. 2). Charakteristika viscerální bolesti je různorodá, může se projevovat přenesenou bolestí do typických kožních oblastí, má difuzní charakter s obtížně definovatelnou lokalizací a hranicemi, mohou být rozšířené autonomní, eventuálně i motorické reflexní zóny, je popisována hyperalgezie kožní i hlubších tkání. Viscerální bolest je vyvolána rozličnými mechanismy a způsoby podráždění, distenzí, ischemií, zánětem, ale i svalovým spasmem či tahem za orgán fibrózními pruhy a srůsty. Ovlivnění chronických viscerálních bolestí neurostimulací je z epidurálního prostoru hrudní páteře, kde je elektroda, případně elektrody umístěny. Zavedení elektrod je provedeno přes vpich v etáži Th 10–11 nebo výše a hrot zavádíme nejvýše k obratli Th5. Přesné uložení elektrody stranově i výškově se provádí při peroperačním testování. U viscerální bolesti se většinou zavádí více elektrod současně [12] (obr. 5).
Table 2. Nejčastější diagnózy viscerální bolesti k použití SCS (upraveno podle Kapural, 2010 [11]) ![Nejčastější diagnózy viscerální bolesti k použití SCS
(upraveno podle Kapural, 2010 [11])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b2a966c1c2964bbc0d3ca1d5c704444f.png)
Image 5. Vícečetné zavedení elektrod pro SCS u viscerální bolesti 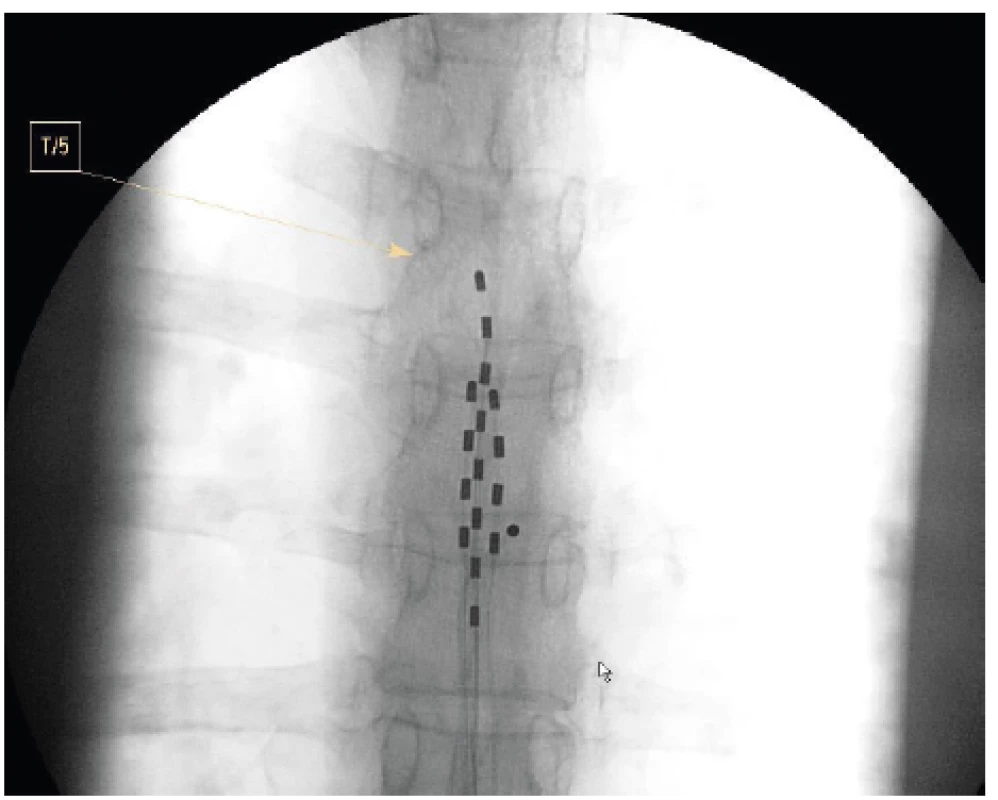
V hrudní oblasti je možné zavedení elektrod i při diagnostikované neuropatické bolesti různé etiologie v hrudní stěně. Nejčastější indikací je interkostální poúrazová neuralgie, častá je též pooperační bolest po torakotomii a postherpetická neuralgie nereagující na standardní léčbu.
Lumbosakrální zavedení SCS
Zavedení elektrody v lumbální oblasti se používá pro analgezii v distální a akrální části dolních končetin, někteří operatéři používají retrográdní postup vpichem v bederní oblasti a retrográdním (kaudálním) zavedením elektrody k dolnímu bedernímu obratli. Stimulace sakrálního úseku páteře se využívá zejména pro funkční poruchy – inkontinence močové a fekální s poruchami sfinkterů. Většinou stačí zavedení jedné speciální elektrody k otvoru kořene S3 [13]. Pro funkční poruchy je metoda sakrální stimulace v České republice již akceptována a hrazena zdravotními pojišťovnami.
SUBARACHNOIDÁLNÍ APLIKACE LÉKŮ PRO LÉČBU CHRONICKÉ BOLESTI
POUŽITÍ SUBARACHNOIDÁLNÍ APLIKACE LÉKŮ
Subarachnoidální (s.a.) aplikace léků pomocí implantibilních pumpových a katétrových systémů se používá od osmdesátých let minulého století k léčbě jinak nezvládnutelných chronických nádorových i nenádorových bolestivých stavů. Hlavní výhodou podávání léků do s.a. prostoru ve srovnání s ostatními léčebnými přístupy je blízká aplikace léků k místům jejich působení v míše. Použití nízkých dávek léků (až 300× nižší dávky ve srovnání s perorálním příjmem a asi 100× nižší než u intramuskulární či subkutánní aplikace) snižuje pravděpodobnost výskytu komplikací a nežádoucích vedlejších účinků. Tyto systémy mají své četné přednosti: silný a protrahovaný analgetický účinek při stabilní terapeutické hladině, prodloužené působení a snížení lékových komplikací.
DĚLENÍ SYSTÉMŮ PRO S.A. APLIKACI
Tyto systémy jsou buď zevní (používané např. v anesteziologické praxi), které jsou levné, ale pro dlouhodobou aplikaci nevýhodné a málo bezpečné. Dále se používají podkožní portové systémy, což jsou již podkožně implantabilní systémy bez možnosti nastavení kontinuálního a programovatelného dávkování. Tyto systémy jsou používány zejména v léčbě chronických bolestí nádorové etiologie pro jejich nižší finanční zátěž při omezené perspektivě přežití nemocných. Podkožně implantované pumpové systémy jsou na různé úrovni sofistikovaného provozu od „fixe rate“ systémů se stálou (neměnnou) dávkou aplikace léku (např. 1 ml/den) až po plně sofistikované systémy s možností nastavení aplikace dávky léků podle aktuálních či měnících se potřeb nemocného a i s možností pacientem kontrolované analgezie (PCA). Dlouhodobá aplikace léků je prováděna do s.a. prostoru, který má významné výhody oproti prostoru epidurálnímu: snadnější detekce prostoru i zavedení katétru, menší riziko obstrukce katétru, možnost použití nižších dávek (cca 10× nižších) a tím i nižšího výskytu vedlejších nežádoucích účinků [14].
INDIKAČNÍ KRITÉRIA PRO LÉČBU NEUROMODULAČNÍMI – PUMPOVÝMI TECHNIKAMI
K této léčbě jsou indikováni nemocní s chronickými, neztišitelnými a jinak těžko ovlivnitelnými bolestmi, zejména bolestmi nenádorové etiologie, které mohou být ovlivněny působením léků v s.a. prostoru. Aplikace léků do komorového systému mozku se používá zcela výjimečně u jinak neovlivnitelné bolesti v oblasti hlavy nádorové etiologie. U bolestí nádorové etiologie se používají různě sofistikované typy systémů podle předpokládané délky přežití nemocného, neurostimulační techniky se používají zcela výjimečně. Nejčastější indikací, stejně jako u neurostimulací, je FBSS, tedy stav přetrvávající bolesti po jedné či opakovaných v oblasti bederní páteře [15]. K dalším indikacím patří těžké stavy osteoporózy, degenerativní změny a stenózy v oblasti páteře, chronická onemocnění velkých kloubů, zejména dolních končetin a spastické stavy různé etiologie [16].
POSTAVENÍ S.A. APLIKACE LÉKŮ MEZI DALŠÍMI ANALGETICKÝMI METODAMI
Dlouhodobá s.a. aplikace je významnou neuromodulační metodou v dlouhodobé invazivní léčbě bolesti. Je součástí analgetických metod u multidisciplinárního a multifaktoriálního přístupu k léčbě bolesti [17]. Vzhledem ke své vysoké počáteční ceně (dlouhodobě je však cenově efektivnější ve srovnání se standardní lékovou léčbou), se používá spíše jako jedna z posledních možností v analgetické terapii. Na rozdíl od neurostimulace, která se v posledních letech používá ve více indikacích u léčby chronické nenádorové bolesti, se s.a. aplikace používají méně často.
PROVEDENÍ VLASTNÍ IMPLANTACE SYSTÉMU PRO S.A. APLIKACI LÉKŮ
Před zavedením plně programovatelného pumpového systému (u nás se používá SynchroMed II s rezervoárem 20 nebo 40 ml) (obr. 6) je nutné, aby pacienti neměli žádné celkové ani lokální infekční onemocnění. Implantace pumpového systému se provádí většinou v celkové anestezii v poloze na boku pod clonou antibiotické prevence. Nejprve se zavede katétr do s.a. prostoru pomocí Tuohyho jehly do oblasti L3–4, aby se vrchol katétru nacházel ve výši Th10–12. Přesnou pozici katétru, který je rtg kontrastní, je možné zkontrolovat pomocí rtg na sále nebo následně po implantaci (obr. 7). Po podkožní tunelizaci je katétr protažen k pumpě umístěné v podkožní kapse na břiše. Důležitá je pevná fixace katétru pod místem vyústění ze s.a. prostoru a jeho přišití k fascii a spolehlivé připevnění katétru k pumpě. Program pumpy je možné nastavit hned na sále, nebo až po příjezdu na oddělení. Po nastavení první dávky (tzv. priming bolus), která vytlačí likvor z prostoru katétru, je třeba u pacienta monitorovat životní funkce a mít připravené vybavení k případné alteraci ventilace při možném předávkování pacienta opioidem (morfinem). Ze začátku se nastavuje hodnota (množství léku/den), která zhruba odpovídá vytestované dávce léku ze zkušebního období, stanovená pomocí zevního systému. V dalším období se postupně nastaví nejvhodnější (nejnižší účinné) hodnoty a případná PCA aplikace k ovlivnění průlomové bolesti [16, 4].
Image 6. Pumpa Synchromed II 40 ml pro s.a. aplikaci léků (materiál Medtronic) 
Image 7. Rtg kontrola po zavedení systému pro s.a. aplikaci léků (foto autoři) 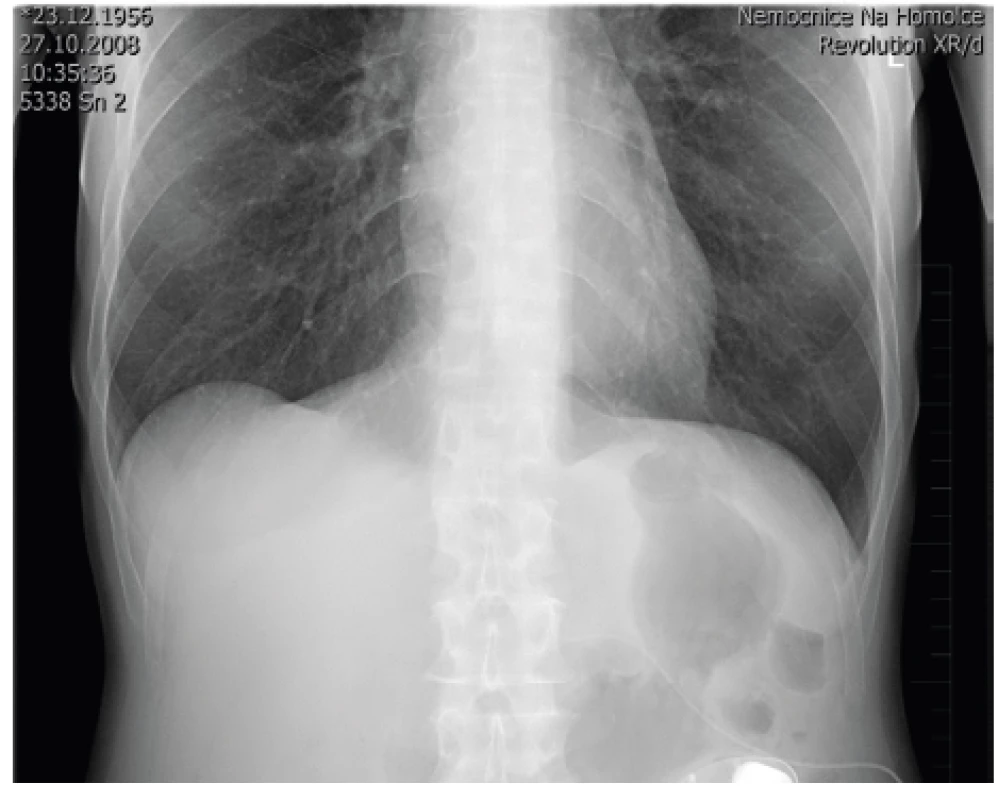
Table 3. 1. linie algoritmu pro s.a. aplikaci u lokalizované nociceptivní a neuropatické bolesti 
Table 4. 1. linie algoritmu pro s.a. aplikaci léků u difuzní nociceptivní a neuropatické bolesti 
POUŽITÍ LÉKŮ PRO DLOUHODOBOU APLIKACI LÉKŮ
Tabulky 3 a 4 ukazují 1. linii algoritmu doporučených léků pro s.a. léčbu chronické bolesti navrženého odborníky v roce 2016 [4]. Na rozdíl od předešlého algoritmu jsou léky navrženy a rozděleny na nádorovou a nenádorovou etiologii a na lokální a difuzní typ bolesti. Stále je v 1. linii morfin s neopioidním analgetikem zikonotidem a v dalším pořadí i jiné opioidy a jejich kombinace. Morfin (µ opioidní agonista) a zikonotid (neopioidní selektivní blokátor N-typu kalciových kanálů) spolu s baklofenem jsou dosud jediné léky schválené americkou FDA pro použití do s.a. prostoru [18, 21]. Podobně jako v předešlých algoritmech jsou v dalších liniích s.a. léčby použity léky, případně směsi léků s klesajícím doporučením k použití na podkladě snižující účinnosti a bezpečnosti.
DALŠÍ PÉČE O NEMOCNÉ PO ZAVEDENÍ SYSTÉMU PRO KONTINUÁLNÍ S.A. APLIKACI LÉKŮ
Zavedením neuromodulačního systému péče o tyto nemocné neuromodulačním centrem samozřejmě nekončí. Naopak je potřebné, aby tito nemocní byli co nejvíce informováni o péči a bezpečném a efektivním používání systému, měli u sebe průkaz nositele neuromodulačního systému a při problémech možnost konzultace s příslušným neuromodulačním centrem [16]. U pumpových systémů jsou kontroly v centrech častější pro nutnost plnění rezervoárů pump než u pacientů s neurostimulační léčbou (obr. 8).
Image 8. Systém pro aplikaci léku do rezervoáru podkožně implantované pumpy (foto autoři) 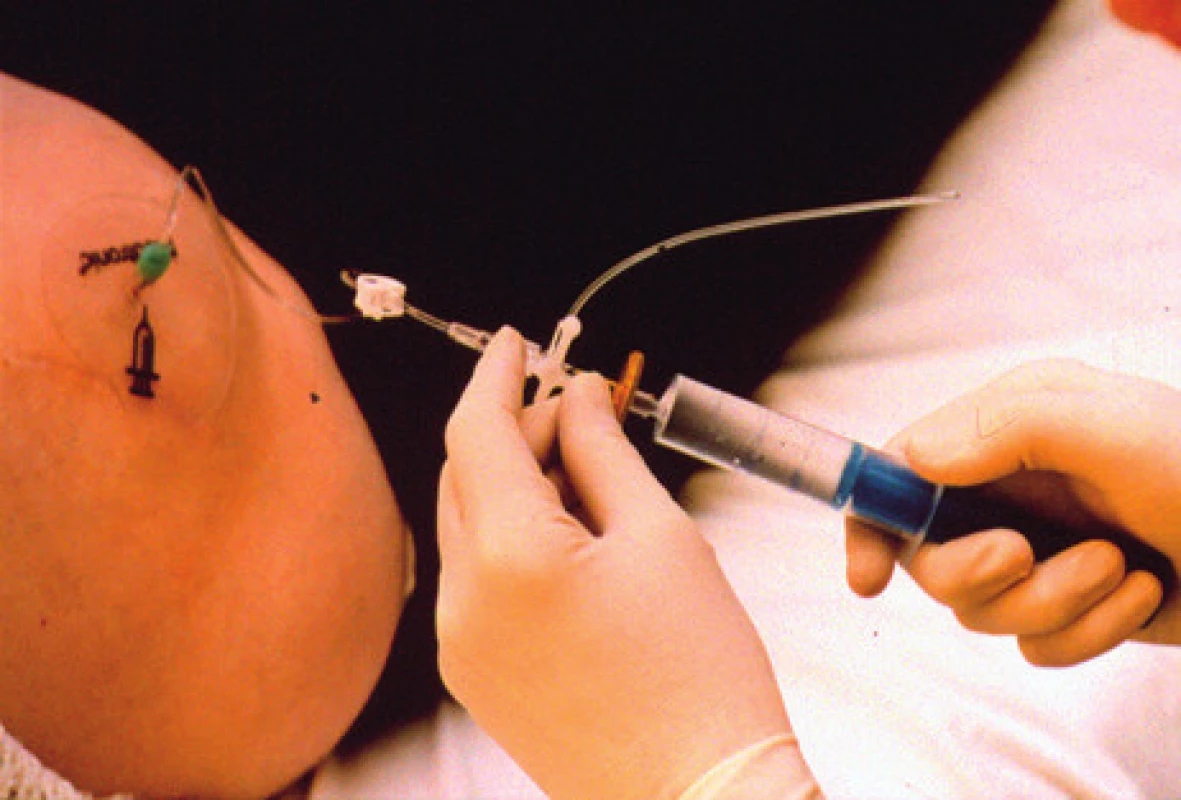
KOMPLIKACE NEUROMODULAČNÍ LÉČBY A MOŽNOSTI JEJICH PREVENCE
Komplikace vedou k nežádoucím výsledkům neuromodulační léčby, snižují její efektivnost, zvyšují náklady a znehodnocují její prestiž v očích medicínské veřejnosti. Komplikacím se nikdy nedá zcela zamezit či předejít, ale velmi důležitá je prevence chyb a problémů, na jejichž podkladě komplikace následně vznikají [19].
Základním preventivním opatřením vzniku komplikací je odpovědný výběr pacienta k neuromodulaci. Je potřebné, aby byl vybrán co nejvhodnější pacient po stránce fyzické, psychické, psychiatrické, sociální i anatomické [15]. Pacienti musí být o všech možných komplikacích a nežádoucích vedlejších účincích léků před zavedením neuromodulační léčby dostatečně informováni. To pomáhá, aby vzniklé komplikace pacienti co nejdříve odhalili a aby lékaři poté mohli co nejdříve diagnostikovat příčinu problému a co nejvhodněji jej řešit.
KOMPLIKACE A NEŽÁDOUCÍ ÚČINKY LÉKŮ U DLOUHODOBÉ SUBARACHNOIDÁLNÍ APLIKACE
Dělíme je na [20, 23]:
- nežádoucí lékové účinky,
- komplikace vyplývající z implantace systému (zdravotní komplikace),
- komplikace vyplývající ze selhání systému (technické komplikace).
ZÁVĚR
Neuromodulační analgetické metody jsou u vybraných nemocných efektivními a přitom dosti bezpečnými metodami léčby chronické bolesti, které nejenom snižují jinak často těžko ovlivnitelnou bolest, ale i zlepšují kvalitu života, zvyšují pracovní a rehabilitační možnosti a přitom snižují náklady na dlouhodobou léčebnou péči. I v naší republice se již neuromodulační léčba stala nedílnou a velmi účinnou součástí péče o nemocné s jinak refrakterní chronickou bolestí. Pro zabezpečení kvalitní neuromodulační péče je nezbytná dobrá spolupráce multidisciplinárního týmu, vhodné se ukazuje vytvoření specializovaných neuromodulačních center, ve kterých lékaři nemocné indikují a připravují na implantaci, systémy zavádějí a starají se dále o nemocné v postimplantačním období. V ČR je osm center pro léčbu neuromodulačními analgetickými metodami, ve kterých jsou vytvořeny vhodné podmínky pro bezpečné a účinné provádění neuromodulačních výkonů a komplexní péči o takto léčené pacienty.
Budoucností neuromodulačních systémů je individualizace terapie doslova na míru s rostoucí možností stále dokonalejšího anatomického pokrytí „generátorů bolesti“ na míšní i centrální úrovni. Vždy však bude imperativem pro dlouhodobý terapeutický efekt neuromodulace správný výběr pacienta s odpovědným stanovením správné indikace k neuromodulační analgetické léčbě.
Práce je původní, nebyla publikovaná ani není zaslána do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli a souhlasí s jeho zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Podíl autorů na vytvoření článku:
KJ: 60 %
VI: 35 %
KŠ: 5 %
Poděkování patří spolupracovníkům z Centra pro léčení a výzkum bolestivých stavů Fakultní nemocnice v Motole.
Do redakce došlo dne 16. 8. 2019.
Do tisku přijato dne 19. 9. 2019.
Adresa pro korespondenci:
doc. MUDr. Jiří Kozák, Ph.D.
Sources
1. Deer TR, Jain S, Hunter C, Chkravarthy K. Neurostimulation for intractable chronic pain. Brain Sci. 2019;9:art. 23.
2. Kozák J, Vrba I, Masopust V, et al. Neuromodulace v léčbě chronické bolesti. In: Bolest. Kršiak M, Kozák J, Rokyta R, eds. Praha: Tigis, 2012 : 595–621.
3. Vrba I, Chrobok J, Štětkářová. Typy bolesti a jejich léčba: Failed back surgery syndrome. In: Rokyta R, Kršiak M, Kozák J. Bolest: Monografie algeziologie. 2. vyd. Praha: Tigis, 2012 : 299–306.
4. Deer TR, Hayek SM, Pope JE, et al. The Polyanalgesic Consensus Conference (PACC): Recommendations for Trialing of Intrathecal Drug Delivery Infusion Therapy. Neuromodulation. 2017;20 : 133–154.
5. Gharibo Ch, Laux G, Forzani BR, et al. State of the field survey: Spinal cord stimulator use by academic pain medicine practices. Pain Med. 2014;15 : 188–195.
6. Russo M, Van-Buyten JP. 10-kHz-frequency SCS therapy: A clinical summary. Pain Med. 2015;16 : 934–942.
7. Chakravarthy K, Richter H, Christo PJ, et al. Spinal cord stimulation for treating chronic pain: Rewiewing preclinical and clinical data on paresthesia-free high frequency therapy. euromodulation. 2018;21 : 18–10.
8. Trentman TR, Zimmerman RS, Dodick DW. Occipital nerve stimulation: technical and surgical aspects of implantation. In: Peripheral Nerve Stimulation. Slavin KV, ed. Chicago, III: Karger, 2011 : 96–108.
9. Vrba I, Kozák J. Neurostimulace v léčbě ischemických bolestí typu anginy pectoris. In: Houdek M, a kol. Neuromodulace. Praha: Grada Publishing, 2007 : 131–142.
10. Osenbach RK, Haines SJ. Spinal cord stimululation for the treatment of refractory angina pectoris. Crit Rev Neurosurg. 2000;9 : 394–406.
11. Kapural L, Sessler D, Tluczek H, Nagem H. Spinal Cord Stimulation for visceral abdominal pain. Pain Med. 2010;11 : 347–355.
12. Derbyshire SW. Imaging visceral pain. Curr Pain Headache Rep. 2007;11 : 178–182.
13. Andres JD, Perotti L, Villaneuva-Perez V, Sensio-Samper JM, Fabregat-Cid G. Role of lumbosacral retrograde neuromodulation in the treatment of painful disorders. Pain Phys. 2013;16 : 145–153.
14. Ševčík P. Implantabilní infuzní pumpy. Houdek M, a kol. Neuromodulace. Praha: Grada Publishing, 2007 : 229–232.
15. Bolash R, Mekhail N. Intrathecal Pain Pumps – Indications, Patient Selection, Techniques, and Outcomes. Neurosurg Clin N Am. 2014;25 : 735–742.
16. Vrba I, Kozák J. Failed back surgery syndrome a neuromodulační léčba. Bolest. 2005;8 : 144–151.
17. Deer TR, Prager J, Lev R, et al. Polyanalgesic Consensus Conference - 2012: Recommendations to reduce morbidity and mortality in intrathecal drug delivery in the treatment of chronic pain. Neuromodulation. 2012;5 : 467–482b.
18. Adler JA, Lotz NM. Intrathecal pain management: a team-based approach. J Pain Res. 2017 : 10 : 2565–2575.
19. Deer TR, Pope JE, Hayek SM, et al. The Polyanalgesic Consensus Conference (PACC): Recommendations on intrathecal drug infusion systems best practices and guidelines. Neuromodulation. 2017;20 : 96–132.
20. Wunkelmüller W, Burchiel K, Van Buyten JP. Intrathecal opioid therapy for pain: Efficacy and outcomes. Neuromodulation. 1999;2 : 67–76.
21. Erdine S, De Andrés J. Drug delivery systems. Pain Pract. 2006;6 : 1–7.
22. Aló KM. Continuus intrathecal drug administartion trial method for complex benign pain: failed back surgery syndrome. J Pain Symptom Manag. 2000;20 : 41–50.
23. Dario A, Scamoni C, Picano M, et al. The infection risk of intrathecal drug infusion pumps after multiple refill procedures. Neuromodulation. 2005;8 : 36–39.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2019 Issue 3-4-
All articles in this issue
- Obtížné zajištění dýchacích cest u dospělých a u dětí; nový doporučený postup ČSARIM
- POCT – UZ v diagnostice diafragmatické dysfunkce po torakochirurgických výkonech
- Jak pracovat s Doporučeným postupem ČSARIM pro zajištění obtížných dýchacích cest?
- APACHE a qSOFA ve stratifikaci rizika při sepsi
- Léčba hypotenze po úvodu do celkové anestezie – multicentrická dotazníková studie
- Tako-tsubo syndrom v průběhu spondylochirurgického výkonu
- Vliv videolaryngoskopie na hloubku zavedení tracheální rourky a četnost endobronchiální intubace – prospektivní randomizovaná studie
- ARDS a obézní pacient
- Fasciální prostory na krku pro regionální anestezii
- Deeskalace antibiotické terapie jako součást strategie péče o kriticky nemocné
- TTM – řízená tělesná teplota v současném pojetí
- Základní neuromodulační metody v léčbě chronické bolesti
- Ambulantní kolonoskopie – čas propuštění po výkonu
- Pohled mladých anesteziologů a intenzivistů na specializační vzdělávání v oboru anesteziologie a intenzivní medicína v České republice: dotazníková studie
- Tako-tsubo kardiomyopatie jako perioperační komplikace karotické endarterektomie potvrzená MR zobrazením srdce
- Zajištění obtížných dýchacích cest u dospělých a dětí
- EKG lekce 5
- Farmakologie látek ovlivňujících fluidokoagulační rovnováhu
- Kapilární návrat – klinické vyšetření přítomnosti cirkulační koherence?
- Za primářem MUDr. Vladimírem Kynclem (19. 10. 1930 – 27. 5. 2019)
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kapilární návrat – klinické vyšetření přítomnosti cirkulační koherence?
- Základní neuromodulační metody v léčbě chronické bolesti
- Deeskalace antibiotické terapie jako součást strategie péče o kriticky nemocné
- Zajištění obtížných dýchacích cest u dospělých a dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

