-
Medical journals
- Career
Deeskalace antibiotické terapie jako součást strategie péče o kriticky nemocné
: V. Adámková
: Klinická mikrobiologie a ATB centrum, Ústav lékařské biochemie a laboratorní diagnostiky, Všeobecná fakultní nemocnice v Praze a 1. lékařská fakulta Univerzity Karlovy
: Anest. intenziv. Med., 30, 2019, č. 3-4, s. 145-152
: Intensive Care Medicine - Review Article
Jedním z největších problémů současné medicíny je extrémní nárůst rezistence bakterií k antibiotikům. Léčba antibiotiky se tak výrazně komplikuje, a to nejen u pacientů na jednotkách intenzivní péče, ale i v komunitě. Pro zachování účinnosti stávajících antibiotik je nutná multioborová spolupráce jak na úrovni diagnostiky infekcí, tak především správné volby antibiotik, aby byla používána pouze na léčbu bakteriálních infekcí, nikoliv kolonizace pacienta. Jednou ze strategií antibiotického stewardshipu je deeskalace antibiotické terapie, avšak u pacientů v intenzivní péči není její role zcela jasná. Vždy je třeba vzít v úvahu nejenom mikrobiologické nálezy, ale především klinický stav pacienta, aby nebyl úpravou antibiotické léčby poškozen.
Klíčová slova:
kolonizace – rezistence – multirezistentní bakterie – deeskalace
ÚVOD
Rezistence bakterií k antimikrobním přípravkům je známá od jejich uvedení do klinické praxe. Masivní nárůst rezistence v posledních letech spolu s omezeným spektrem nových účinných antibiotik je důvodem zamyslet se nad racionálním přístupem k antiinfekční terapii. Determinanty rezistence cirkulují v mikrobiomu miliony let a existovaly i před érou komerčně připravovaných antibiotik, jak dokládají metagenomické analýzy pravěké DNA z permafrostu, které identifikovaly geny kódující rezistenci k betalaktamům, tetracyklinům a glykopeptidům; a tyto geny jsou velmi podobné genům dnes izolovaným od rezistentních bakterií vyvolávajících infekce spojené s poskytovanou zdravotní péčí [1].
Aby byla zachována účinnost stávajících antibiotik a s tím související možnost efektivní léčby, je nezbytná aktivní spolupráce kliniků a mikrobiologů v monitorování a predikci výskytu rezistence. Systematicky prováděná surveillance umožňuje sledovat dlouhodobé trendy rezistence i vyhodnotit dopady intervenčních opatření zaměřených na snížení výskytu a šíření rezistentních bakterií. Narůstající problém s antibakteriální rezistencí vede k nutnosti správné klasifikace a definice jednotlivých rezistentních infekčních agens, proto Evropská společnost klinické mikrobiologie a infekčních chorob vydala návrh standardních definičních kritérií pro bakterie se získanou rezistencí. Jako MDR (multidrug-resistant) jsou definovány bakterie, které získaly rezistenci alespoň ke třem různým skupinám antibiotik, do kategorie XDR (extensively drug-resistant) patří bakterie se zachovanou citlivostí k jedné, maximálně dvěma skupinám antibiotik a PDR (pandrug-resistant) zahrnují bakterie rezistentní ke všem stávajícím kategoriím antibiotik [2].
Pro kategorizaci bakteriálních izolátů do výše uvedených skupin je tedy nutné laboratorní testování izolovaného agens vůči zástupcům všech existujících antibiotických skupin [2]. Problém narůstající rezistence je alarmující o to více, že v preklinickém výzkumu je jen velmi málo nových účinných molekul, a nelze proto v blízké budoucnosti očekávat zásadní rozšíření současného spektra dostupných antibiotik. Poznání mechanismů vzniku bakteriální rezistence je proto základním předpokladem nejen racionální antibiotické terapie u konkrétního pacienta, ale i předpokladem efektivní prevence selekce rezistentních kmenů.
MULTIREZISTENTNÍ BAKTERIE
Rychlý vznik a šíření bakteriální rezistence k antibiotikům je celosvětovým trendem nejenom u hospitalizovaných pacientů, ale stále častěji se přesouvá i do oblasti komunitních infekcí.
Ačkoliv jsou příčiny stoupající antibiotické rezistence multifaktoriální, je zřejmá korelace se selektivním tlakem antibiotik při jejich nadměrném a nevhodném užívání.
Zvýšená spotřeba antibiotik zvyšuje pravděpodobnost selekce rezistentních kmenů nejen u léčeného jedince, ale následně vede i k nárůstu rezistence na lokální úrovni. V klinické praxi se u kriticky nemocných s nadměrným a neindikovaným podáváním antibiotické léčby setkáváme často. Za hlavní příčinu antibiotické polypragmazie je považována obava z prodlení empirické terapie nebo podání neúčinných antibiotik, neboť neadekvátní a pozdě zahájená antibiotická terapie je faktorem zvyšujícím morbiditu i mortalitu kriticky nemocných. Proto je u pacientů s předpokládanou nebo prokázanou infekcí doporučováno časné zahájení léčby antibiotikem s co nejširším spektrem účinku (empirická terapie), nicméně je třeba se vyvarovat neadekvátně dlouhému podávání širokospektrých antibiotik bez provedení cílené úpravy podle mikrobiologických nálezů [3].
Poslední dekáda přinesla signifikantní nárůst rezistence napříč celým bakteriálním spektrem, a především bakterie sdružené pod akronym ESCAPE (vankomycinrezistentní enterokoky, meticilinrezistentní Staphylococcus aureus, Clostridium difficile, Acinetobacter baumanii, Pseudomonas aeruginosa, enterobakterie produkující širokospektré betalaktamázy či karbapenemázy) se staly skutečnou hrozbou pro zdraví celé lidské populace. Akronym ESCAPE reflektuje fakt, že tyto bakterie opravdu unikají našim terapeutickým snahám a je výstižnější než často používaný akronym ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter sp.), který nezohledňuje narůstající problém rezistence u ostatních zástupců čeledi Enterobacteriaceae (Escherichia coli či Proteus sp.) ani nejvíce prevalentního nozokomiálního původce Clostridium difficile [4, 5]. Z klinického pohledu je alarmující skutečnost, že dochází nejen ke vzestupu počtu infekcí vyvolaných rezistentními bakteriálními kmeny, ale i k signifikantnímu zvyšování počtu antibiotik, ke kterým jsou uvedené bakterie rezistentní. Infekce vyvolané multirezistentními kmeny jsou v porovnání s infekcemi vyvolanými citlivými kmeny spojeny s významně vyšší morbiditou i mortalitou [6]. U pacientů v intenzivní péči je antibiotická terapie frekventně indikována empiricky (tedy bez znalosti infekčního agens), a proto je v případě infekcí vyvolaných multirezistentními bakteriemi dokumentováno opoždění zahájení adekvátní antibiotické léčby až o pět dnů, neboť časně nasazená širokospektrá empirická antibiotická terapie již není účinná vůči vyvolávajícímu multirezistentnímu patogenu [7]. Opoždění adekvátní antibiotické terapie je přitom u kriticky nemocných spojeno s vyšší mortalitou, riziko nepříznivého klinického vývoje a úmrtí stoupá de facto úměrně s každou hodinou opoždění. Adekvátní a racionální antibiotická terapie proto vyžaduje senzitivní a specifickou laboratorní diagnostiku k potvrzení infekční etiologie stavu (biomarkery infekce); včasně a správně provedené mikrobiologické vyšetření k časné identifikaci vyvolávajícího agens (případně molekulární diagnostika patogenu); adekvátní empirickou antibiotickou léčbu (širokospektré antibiotikum a/anebo jejich kombinace, časná aplikace, adekvátní dávkování, adekvátní doba podávání) a v neposlední řadě identifikaci pacientských rizikových faktorů spojených s vyšším výskytem infekcí vyvolaných multirezistentními kmeny (tab. 1) [8].
1. Rizikové faktory výskytu MDR 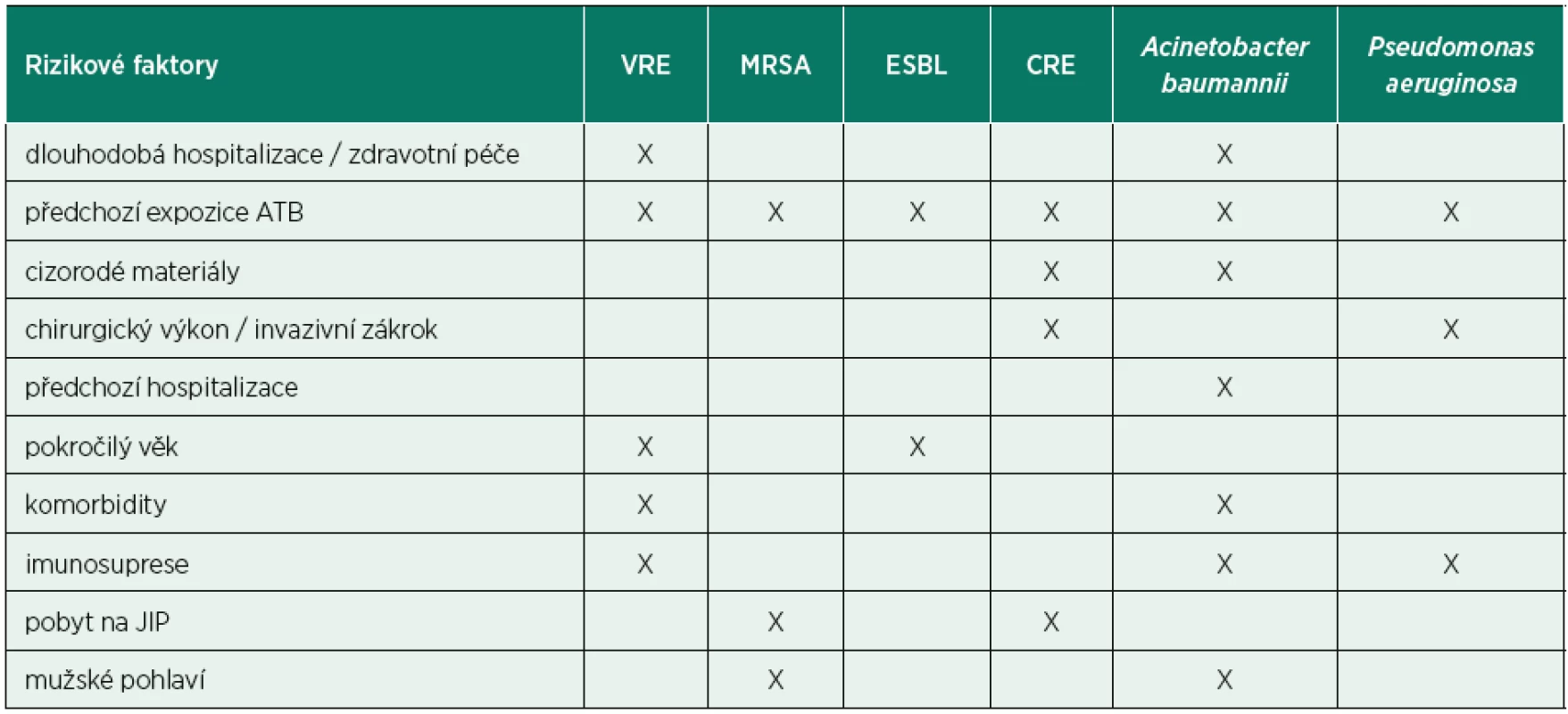
MDR – multidrug resistant bacteria, VRE – vankomycin rezistentní enterokoky, MRSA – meticilin rezistentní S. aureus, ESBL – enterobakterie produkující širokospektré betalaktamázy, CRE – karbapenem rezistentní enterobakterie, JIP – jednotka intenzivní péče Ačkoliv je nárůst bakteriální rezistence problém celosvětový, jsou mezi jednotlivými zeměmi zřejmé rozdíly jak v incidenci infekcí vyvolaných rezistentními kmeny, tak i ve spektru vyvolávajících patogenů. V Evropě se pozoruje dlouhodobě výrazný vzestup rezistence u bakterií z čeledi Enterobacteriaceae (především Escherichia coli, Klebsiella pneumoniae, dále jen K. pneumoniae) k cefalosporinům třetí generace (nejčastěji v důsledku produkce širokospektrých betalaktamáz), dále k fluorovaným chinolonům a aminoglykosidům. V případě K. pneumoniae je patrný signifikantní nárůst výskytu tzv. multirezistentních kmenů, tedy kmenů rezistentních ke třem a více různým skupinám antibiotik, kdy např. v České republice v roce 2015 bylo 41,5 % kmenů K. pneumoniae izolovaných z hemokultur multirezistentních, na Slovensku až 59,6 % [9]. Vzestup infekcí multirezistentními kmeny byl důvodem pro častější používání karbapenemů, avšak bakterie záhy zareagovaly vyselektováním karbapenem rezistentních kmenů, které jsou terapeuticky již velmi těžko ovlivnitelné. Velmi vysoký podíl karbapenem rezistentních kmenů K. pneumoniae je dlouhodobě pozorován v Řecku a Itálii, kde v roce 2015 byla míra rezistence ke karbapenemům 62,7 %, respektive 35,7 %. Rezistence ke karbapenemům je způsobena několika mechanismy (snížená permeabilita buněčné stěny, eflux, produkce karbapenemáz), epidemiologicky nejzávažnější je právě produkce tzv. karbapenemáz, enzymů degradujících nejenom karbapenemová antibiotika. U některých multirezistentních kmenů tak po získání rezistence bývá zachována citlivost pouze ke kolistinu či tigecyklinu, ale v klinické praxi se v současné době setkáváme i s infekcemi vyvolanými kmeny panrezistentními, které již nejsou laboratorně citlivé k žádnému stávajícímu antibiotiku.
Management infekcí vyvolaných kmeny produkujícími karbapenemázy je komplexní a zahrnuje nejenom samotnou antibiotickou terapii vyžadující vždy kombinaci antibiotik (kolistin, karbapenemy, tigecyklin, aminoglykosidy), ale i správnou laboratorní detekci produkce karbapenemáz, protože některé druhy mohou vykazovat relativně nízkou rezistenci ke karbapenemům (graf 1). Epidemiologická opatření jsou zcela esenciálním prvkem správné antibiotické terapie s cílem předcházet šíření infekce na další pacienty. Další zásadou správné antibiotické léčby je podávání antibiotik pouze pacientům se známkami infekce, naopak pacientům s kolonizací bez klinických projevů infekce by neměla být antibiotika podávána (graf 2) [10].
1. Management infekce u kriticky nemocného pacienta 
MDR – multi-drug resiatant (multirezistentní), ATB – antibiotikum, KO + dif. (krevní obraz s diferenciálním počtem), HCAI – Healthcare associated infection (infekce spojené s poskytovanou zdravotní péčí) 2. Postup při výskytu karbapenem rezistentního kmene enterobakterií (upraveno podle Tängdén T. [10]) ![Postup při výskytu karbapenem rezistentního kmene enterobakterií (upraveno podle Tängdén T. [10])](https://pl-master.mdcdn.cz/media/image_pdf/cd482117eff5a26c483a8de96af349ac.png?version=1575817721)
CPE – carbapenemase positive Enterobacteriacea, MIC – minimum inhibitory concentration DEESKALACE ATB TERAPIE
Infekční onemocnění tvoří více než třetinu příjmů ve většině zdravotnických zařízení, septický šok je komplikací až u 10 % pacientů v intenzivní péči [11]. Včasná a adekvátní antibiotická léčba je jednoznačně spojena s vyšší šancí na přežití, a proto je v rámci iniciální léčby indikováno podání antibiotika se širokým spektrem účinku, popřípadě jejich kombinace. Včasná aplikace širokospektré antibiotické terapie je tak základním předpokladem zvládnutí infekce, avšak na základě klinického vývoje a mikrobiologických nálezů by měla být co nejdříve provedena cílená úprava – deeskalace antibiotické léčby s cílem dosažení maximální efektivity léčby a minimálního rizika expozice mikrobioty s následnou selekcí rezistentních kmenů [12].
Deeskalace je doporučována v managementu antiinfekční terapie především u pacientů na jednotkách intenzivní péče [13] a podle aktuálních doporučení Surviving Sepsis Campaign by měla být antibiotická léčba přehodnocována denně [14]. Ačkoliv je hlavním smyslem deeskalace antibiotické léčby zachování maximální účinnosti a minimalizace rizika selekce rezistentních kmenů, nejsou v současnosti dostatečné důkazy pro tvrzení, že je deeskalace antibiotické léčby účinnou a bezpečnou strategií především u pacientů se sepsí či septickým šokem [15].
Hlavním a nejdůležitějším aspektem nejednoznačných údajů o efektivitě a bezpečnosti deeskalace je nejednotná definice „deeskalace antibiotické léčby“ v dostupné literatuře. V některých studiích je deeskalace chápána jako pouhé zúžení spektra účinku, tzn. přechod z antibiotik se širokým spektrem na antibiotika úzkospektrá [16, 17]. V jiných studiích je deeskalace popisována jako snížení počtu antibiotik podávaných v rámci empiricky zahájené kombinační léčby [18‒20]. V několika dalších studiích je deeskalace definována pouze jako zkrácení trvání antibiotické léčby [21]. Leon et al. v souvislosti s deeskalací používají koncept tzv. stěžejních antibiotik – obvykle širokospektrých betalaktamů v kombinaci s antibiotikem efektivním proti MRSA – a antibiotik doprovodných (aminoglykosidy, fluorochinolony či makrolidy). Deeskalace pak podle tohoto konceptu značí přechod ze stěžejních antibiotik na úzkospektrá a ukončení podávání doprovodných antibiotik třetí den léčby, včetně přípravků proti MRSA (pokud není MRSA původcem infekce) [17].
FAKTORY OVLIVŇUJÍCÍ ZAVEDENÍ DEESKALACE
Vzhledem k tomu, že správná antibiotická terapie je základním kamenem úspěšné léčby infekčních onemocnění, nelze přistupovat k deeskalaci ATB paušálně u všech pacientů, ale výhradně po pečlivém zhodnocení průběhu léčby a mikrobiologických nálezů. O deeskalaci antibiotické terapie lze uvažovat pouze u pacientů, u kterých dochází k úpravě klinického stavu i laboratorních parametrů a je prokázán vyvolávající patogen i jeho citlivost vůči různým antibiotikům [18, 22]. Deeskalace byla častěji prováděna u pacientů s mírnějším průběhem infekce (definované nižší hodnotou APACHE II a nižší hodnotou SOFA skóre v pátý den antibiotické terapie) [20]. Naopak jako faktory snižující používání deeskalace byly prokázány infekce vyvolané multirezistentními mikroorganismy [19, 23], stejně jako polymikrobiální etiologie či mnohočetné infekční komplikace [20, 24]; taktéž infekce s vysokým rizikem nediagnostikovatelných patogenů, jako jsou nitrobřišní infekce, které jsou naopak častěji spojeny s eskalací antibiotické terapie (tab. 2) [25].
2. Faktory spojované s antibiotickou deeskalací 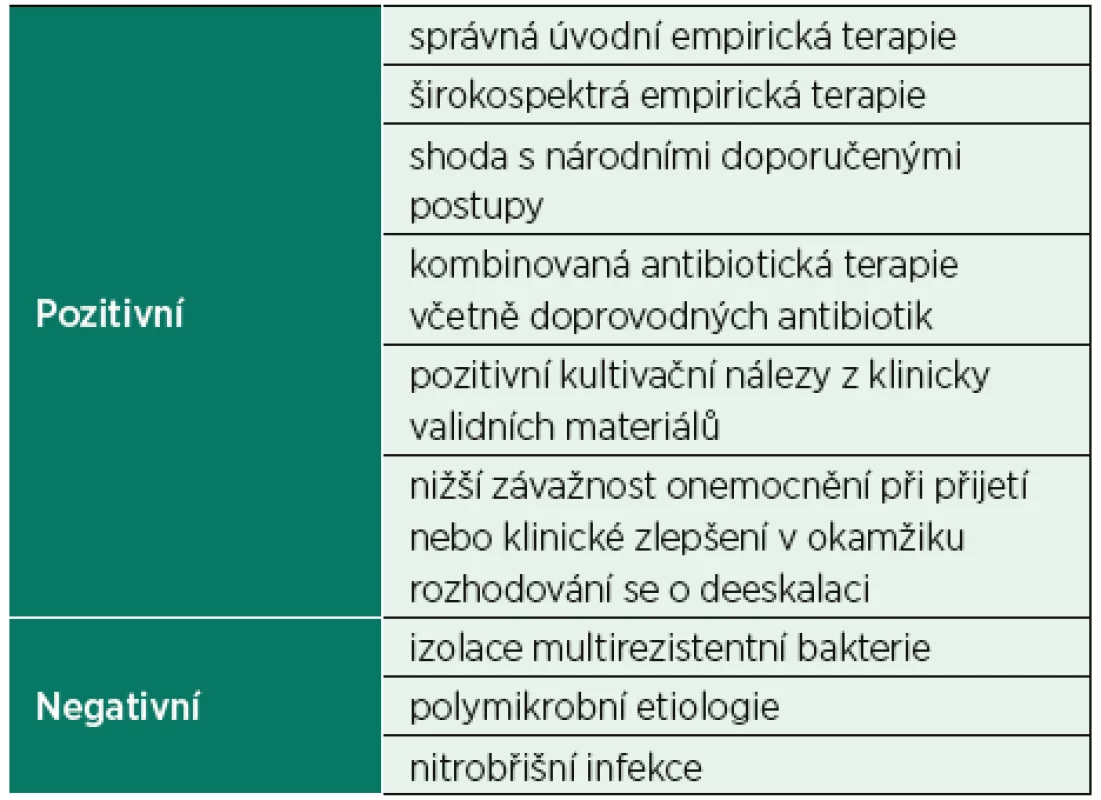
JAKÉ JSOU KLINICKÉ VÝSLEDKY/ZÁVĚRY PUBLIKOVANÝCH STUDIÍ S DEESKALACÍ ANTIBIOTICKÉ LÉČBY?
Interpretace výsledků klinických studií popisujících vliv deeskalace na relevantní parametry výsledků léčby (outcome) je poměrně obtížná, neboť jednotlivé studie se zásadně liší jak v definici a způsobu provedení deeskalace, tak i v indikačních kritériích pro zařazení pacienta do studie, ve sledovaných parametrech outcome a v neposlední řadě i v metodice samotných studií.
Jedním z hlavních rizik deeskalace je obava z rekurence infekce, případně rozvoje superinfekce. Vyšší incidence následných infekcí vyžadujících antibiotickou terapii u deeskalační strategie (deeskalace 27 % versus pokračování širokospektré ATB terapie 11 %, p = 0,03) byla popsána v randomizované klinické studii zabývající se deeskalací ATB terapie u pacientů s „těžkou sepsí“, přičemž u 44 % pacientů s následnou infekcí byla superinfekce vyvolána stejným původcem jako infekce primární; mortalita nedosahovala významných rozdílů mezi skupinou s deeskalací a skupinou s pokračující širokospektrou antibiotickou léčbou [17]. Naopak, v další studii popisující efekt deeskalace u kriticky nemocných pacientů včetně pacientů se septickým šokem byla deeskalace provedena u 45 % (paradoxně ve skupině s „těžkou sepsí“ a septickým šokem u 52 % pacientů) a ve skupině pacientů s deeskalací byla pozorována významně nižší incidence superinfekcí (5 % vs. 19 %, p = 0,01) než u pacientů bez provedené deeskalace; mortalita opět nebyla deeskalací významně ovlivněna [21]. V další studii sledující vliv deeskalace u pacientů s těžkou sepsí a septickým šokem byla deeskalace provedena u 34,9 % pacientů a byla identifikována jako nezávislý faktor spojený s redukcí mortality; naopak faktory asociované se zvýšenou mortalitou byly SOFA skóre a přítomnost septického šoku v den odběru mikrobiologického materiálu i neadekvátní iniciální antibiotická terapie [25]. Konstantně je snížení mortality u pacientů s provedenou deeskalací popisováno především ve studiích sledujících efekt deeskalace u definované skupiny pacientů s pneumonií a/anebo ventilátorovou pneumonií [16]. Deeskalace může být bezpečně provedena i u vysoce rizikových skupin, jako jsou neutropeničtí pacienti, kdy deeskalace byla efektivně a bezpečně (tedy bez zvýšení mortality) provedena u 44 % neutropenických pacientů se sepsí, a adekvátní iniciální antibiotická léčba i dodržování lokálních doporučení pro antibiotickou terapii (především pro preskripci protipseudomonádových antibiotik) byly identifikovány jako faktory spojené s deeskalací. K obdobným závěrům dospěla i prospektivní studie u vysoce rizikových hematoonkologických pacientů, u nichž byla důsledně dodržována doporučení ECIL (European Conference on Infection in Leukaemia) pro terapii febrilní neutropenie. U každého pacienta byla denně v kontextu klinického stavu a laboratorních nálezů přehodnocována skladba antibiotik a jejich dávkování. Antibiotika byla podávána nejméně sedm dnů, avšak karbapenemy a antibiotika s účinkem na grampozitivní bakterie byla vysazena kdykoliv, jestliže pro jejich použití nesvědčily adekvátní nálezy. U pacientů zařazených ve studii nedošlo k nárůstu infekčních komplikací ani k mortalitě, avšak byla signifikantně snížena spotřeba karbapenemových antibiotik [26, 27].
Pouze čtyři klinické studie porovnávaly délku trvání antibiotické léčby mezi skupinou pacientů s provedenou deeskalací a skupinou pacientů bez deeskalace. Ani jedna z těchto studií neprokázala pozitivní efekt deeskalace na délku trvání antibiotické léčby. Je opět nezbytné uvést, že kritéria pro ukončení terapie byla definována zcela nesourodě a na základě obvyklých praktik daného pracoviště [22, 23, 25, 26].
V současné době nejsou známa jednoznačná data z relevantních klinických studií, která by definovala vztah mezi deeskalací antibiotické terapie a selekcí. Gonzales et al. ve své práci neprokázali rozdíl v nosičství multirezistentních bakterií mezi oběma skupinami a Leon et al. publikovali výsledky dopadu deeskalace na lokální ekosystém v den 8, kde opět nebyl zaznamenán žádný efekt [17, 19].
ZÁVĚR
Systematické review dostupných studií zabývajících se problematikou deeskalace ATB terapie u kriticky nemocných konstatovalo, že existuje značná nejednotnost při definování deeskalace antibiotické terapie v klinické praxi i v klinických studiích. Deeskalace je častěji prováděna u pacientů se zlepšujícím se klinickým stavem, s aplikovanou kombinací širokospektrých antibiotik a při absenci průkazu multirezistentních kmenů. Deeskalační strategie nemá vliv na celkovou délku ATB terapie ani na délku hospitalizace a vliv deeskalace na selekci rezistentních kmenů nebyl dosud sledován v žádné studii vysoké metodologické kvality. Ačkoliv je patrný celkový benefit deeskalace na snížení mortality, jsou jednotlivé studie zatíženy příliš velkými metodologickými nedostatky, a tudíž nemůže být jednoznačně konstatován přímý benefit deeskalační strategie na redukci mortality kriticky nemocných [28].
Deeskalace antibiotické terapie je v současné době považována za jeden ze základních postupů racionální antibiotické terapie u kriticky nemocných. V odborné literatuře nadále chybí přesvědčivé důkazy o pozitivním efektu deeskalace na mortalitu a další relevantní parametry outcome i na selekci multirezistentních kmenů. Je nutné si uvědomit, že deeskalace samotná je jen jedním z pilířů racionální antibiotické terapie a neměla by být prováděna u všech pacientů rutinně, naopak vyžaduje pečlivé zhodnocení všech faktorů relevantních pro rozhodování o léčbě život zachraňující – léčbě antibiotické. V klinické praxi je proto nezbytné klást důraz na naplnění všech následujících faktorů:
- včasné podání empirické antibiotické terapie účinné na předpokládané patogeny,
- znalost lokálního mikrobiologického profilu oddělení,
- časné a správné provedení mikrobiologických odběrů a jejich následná správná interpretace (odlišení kolonizace od infekce),
- adekvátní dávkování antibiotik u kriticky nemocných pacientů, tedy pacientů se změněnou farmakokinetikou a biologickou dostupností léčiva v místě požadovaného účinku,
- denně prováděné hodnocení průběhu onemocnění (klinický stav; dynamika SOFA skóre apod.) a frekventní hodnocení laboratorních parametrů korelujících s bakteriální infekcí (prokalcitonin).
Deeskalace antibiotické terapie může být provedena bezpečně vzhledem ke klinickému stavu pacienta ke snížení rizika selekce multirezistentních kmenů pouze za předpokladu, že iniciální antibiotická léčba je efektivní a původce infekce byl jednoznačně prokázán.
POZNATKY PRO PRAXI
Znalost lokální epidemiologické situace je nezbytným předpokladem pro optimalizaci empirické antibiotické léčby.
Stoupající incidence infekcí vyvolaných rezistentními kmeny zvyšuje riziko podání neadekvátní empirické ATB terapie, není však důvodem pro paušální empirickou aplikaci karbapenemů a/anebo dalších záložních antibiotik. Pravidelné monitorování pacienta a adekvátní reakce na zjištěné laboratorní nálezy jsou dalším základním předpokladem racionální a efektivní antibiotické terapie.
Antibiotický stewardship a těsná spolupráce klinika, mikrobiologa a farmakologa se v éře multirezistentních mikroorganismů stávají medicínským i etickým imperativem.
Bezpečná deeskalace je možná pouze za podmínek naplnění všech dalších pilířů racionální antibiotické terapie, tedy u pacientů s adekvátní empirickou léčbou, s úpravou klinického stavu i laboratorních markerů bakteriální infekce a při znalosti vyvolávajícího patogenu (včetně jeho susceptibility k antibiotikům).
Práce je původní, nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autorka prohlašuje, že nemá střet zájmů v souvislosti s tématem práce.
Do redakce došlo dne 30. 10. 2018.
Do tisku přijato dne 24. 5. 2019.
Adresa pro korespondenci:
MUDr. Václava Adámková
Sources
1. D'Costa VM, King CE, Kalan L, et al. Antibiotic resistance is ancient. Nature. 2011;477 : 457–461.
2. Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistence. Clin Microbiol Infect. 2012;18 : 268–281.
3. Kumar A, Ellis P, Arabi Y. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009;136 : 1237–1248.
4. Peterson LR. Bad Bugs, No Drugs: No ESCAPE Revisited. CID. 2009;49 : 992–993.
5. Magill SS, Edwards JR, Fridkin SK. Emerging Infections Program Healthcare-Associated Infections and Antimicrobial Use Prevalence Survey Team. Survey of health care-associated infections. N Engl J Med. 2014;370 : 2542–2543.
6. Vardakas KZ, Dimitrios K, Matthaiou DK. Characteristics, risk factors and outcomes of carbapenem-resistant Klebsiella pneumoniae infections in the intensive care unit. J Infect. 2015;70 : 592–599.
7. Friedman ND, Temkin E, Carmeli Y. The negative impact of antibiotic resistence. Clin Microbiol Infect. 2016;22 : 416–422.
8. Pogue JM, Kaye KS, Cohen DA, Marchaim D. Appropriate antimicrobial therapy in the era of multidrug-resistant human pathogens. Clin Microbiol Infect. 2015;21 : 302–312.
9. http://atlas.ecdc.europa.eu/public/index.aspx.
10. Tängdén T, Giske CG. Global dissemination of extensively drug-resistant carbapenemase-producing Enterobacteriaceae: clinical perspectives on detection, treatment and infection control (Review). J Intern Med. 2015;277 : 501–512.
11. Annane D, Aegerter P, Jars-Guincestre MC, Guidet B. Current epidemiology of septic shock: the CUB-Rea Network. Am J Respir Crit Care Med. 2003;168 : 165–172.
12. Niederman MS. De-escalation therapy in ventilator-associated pneumonia. Curr Opin Crit Care. 2006;12 : 452–457.
13. Bassetti M, De Waele JJ, Eggimann P, et al. Preventive and therapeutic strategies in critically ill patients with highly resistant bacteria. Intensive Care Med. 2015;41 : 776–795.
14. Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock. 2012. Intens Care Med. 2013;39 : 165–228.
15. Silva BN, Andriolo RB, Atallah AN, Salomao R. De-escalation of antimicrobial treatment for adults with sepsis, severe sepsis or septic shock. Cochrane Database Syst Rev. 2013;3:CD007934. doi: 10.1002/14651858.CD007934.pub3.
16. Joung MK, Lee JA, Moon SY, et al. Impact of de-escalation therapy on clinical outcomes for intensive care unit-acquired pneumonia. Crit Care. 2011;15:R79.
17. Leone M, Bechis C, Baumstarck K, et al. AZUREA Network Investigators De-escalation versus continuation of empirical antimicrobial treatment in severe sepsis: a multicenter non-blinded randomized noninferiority trial. Intens Care Med. 2014;40 : 1399–1408.
18. Heenen S, Jacobs F, Vincent JL. Antibiotic strategies in severe nosocomial sepsis: Why do we not de-escalate more often? Crit Care Med. 2012;40 : 1404–1409.
19. Gonzalez L, Cravoisy A, Barraud D, et al. Factors influencing the implementation of antibiotic de-escalation and impact of this strategy in critically ill patients. Crit Care. 2013;17:R140.
20. Paskovaty A, Pastores SM, Gedrimaite Z, et al. Antimicrobial de-escalation in septic cancer patients: is it safe to back down? Intens Care Med. 2015;41 : 2022–2023.
21. Morel J, Casoetto J, Jospe R, et al. De-escalation as part of a global strategy of empiric antibiotherapy management: a retrospective study in a medico-surgical intensive care unit. Crit Care. 2010;14:R225.
22. De Waele JJ, Ravyts M, Depuydt P, et al. De-escalation after empirical meropenem treatment in the intensive care unit: fiction or reality? J Crit Care. 2010;25 : 641–646.
23. Alvarez-Lerma F, Alvarez B, Luque P, et al. ADANN Study Group. Empiric broad-spectrum antibiotic therapy of nosocomial pneumonia in the intensive care unit: a prospective observational study. Crit Care. 2006;10:R78.
24. Knaak E, Cavalieri SJ, Elsasser GN, et al. Does antibiotic de-escalation for nosocomial pneumonia impact intensive care unit length of stay? Infect Dis Clin Pract. 2013;21 : 172–176.
25. Garnacho-Montero J, Gutierrez-Pizarraya A, Escoresca-Ortega A, et al. De-escalation of empirical therapy is associated with lower mortality in patients with severe sepsis and septic shock. Intens Care Med. 2014;40 : 32–40.
26. Mokart D, Slehofer G, Lambert J, et al. De-escalation of antimicrobial treatment in neutropenic patients with severe sepsis: results from an observational study. Intens Care Med. 2014;40 : 41–49.
27. La Martire G, Robin Ch, Oubaya N, et al. De-escalation and discontinuation strategies in high-risk neutropenic patients: an interrupted time series analyses of antimicrobial consumption and impact on outcome. Eur J Clin Microbiol Infect Dis. 2018;37 : 1931–1940.
28. Tabah A, Cotta MO, Garnacho-Montero J. A Systematic review of the definitions, determinants, and clinical outcomes of antimicrobial de-escalation in the intensive care unit. CID. 2016 : 62;1009–1017.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2019 Issue 3-4-
All articles in this issue
- Obtížné zajištění dýchacích cest u dospělých a u dětí; nový doporučený postup ČSARIM
- POCT – UZ v diagnostice diafragmatické dysfunkce po torakochirurgických výkonech
- Jak pracovat s Doporučeným postupem ČSARIM pro zajištění obtížných dýchacích cest?
- APACHE a qSOFA ve stratifikaci rizika při sepsi
- Management of hypotension after general anaesthesia induction - multicenter questionnaire study
- Takotsubo syndrome during thoracic spinal surgery. Case report
- The impact of videolaryngoscopy on the depth of endotracheal tube placement and the rate of unintended endobronchial intubation – a prospective randomized study
- ARDS a obézní pacient
- The neck fascia plane for regional anesthesiology
- De-escalation of antibiotic therapy as a part of care strategy about critically ill patients
- TTM – řízená tělesná teplota v současném pojetí
- Basic neuromodulation methods in chronic pain management
- Ambulantní kolonoskopie – čas propuštění po výkonu
- The View of Anaesthesiology and Intensive Medicine Trainees on Specialty Education in the Czech Republic: Questionnaire Study
- Tako-tsubo kardiomyopatie jako perioperační komplikace karotické endarterektomie potvrzená MR zobrazením srdce
- Zajištění obtížných dýchacích cest u dospělých a dětí
- EKG lekce 5
- Farmakologie látek ovlivňujících fluidokoagulační rovnováhu
- Kapilární návrat – klinické vyšetření přítomnosti cirkulační koherence?
- Za primářem MUDr. Vladimírem Kynclem (19. 10. 1930 – 27. 5. 2019)
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kapilární návrat – klinické vyšetření přítomnosti cirkulační koherence?
- Basic neuromodulation methods in chronic pain management
- De-escalation of antibiotic therapy as a part of care strategy about critically ill patients
- Zajištění obtížných dýchacích cest u dospělých a dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

