-
Medical journals
- Career
Srdce jako zdroj systémových embolizací
: J. Rulíšek 1; Z. Hlubocká 2
: Klinika anesteziologie, resuscitace a intenzivní medicíny, Všeobecná fakultní nemocnice v Praze, 1. lékařská fakulta Univerzity Karlovy 1; Interní klinika, Všeobecná fakultní nemocnice v Praze, 1. lékařská fakulta Univerzity Karlovy 2
: Anest. intenziv. Med., 28, 2017, č. 6, s. 357-362
:
Systémová embolizace z oblasti srdečních oddílů a aorty má za následek závažnou mortalitu a morbiditu. Je příčinou přibližně jedné třetiny všech ischemických cévních mozkových příhod. Typicky se pojí se stavy dilatace srdečních síní, poruch srdečního rytmu charakteru fibrilace síní, flutteru síní. Dilatace srdečních komor s formováním aneuryzmatu mají vysokou prevalenci vzniku nitrokomorových trombů, které jsou významným rizikem systémové embolizace. Méně častou příčinu pak tvoří srdeční nádory (dominující je myxom), infekční endokarditidy bakteriální i nebakteriální, exulcerované aortální aterosklerotické pláty. Echokardiografie je základní vyšetřovací metodou pro diagnostiku a sledování úspěšnosti léčby. Jícnová a transtorakální echokardiografie jsou komplementárními diagnostickými nástroji společně s dalšími metodami (CT, MRI). Článek přináší přehled užití jednotlivých metod v klinické medicíně.
Klíčová slova:
echokardiografie – trombus – embolizace – ischemická cévní mozková příhodaÚVOD
Embolizace ze srdečních oddílů nebo hrudní aorty má za následek závažnou morbiditu a mortalitu. Zdrojem těchto embolů jsou srdeční dutiny, chlopenní aparát nebo nestabilní aterosklerotické aortální pláty. Ve většině případů emboly pocházejí z příslušného oddílu systémové nebo plicní cirkulace, výjimečně pak může docházet k paradoxní embolizaci při komunikaci mezi levostrannými a pravostrannými srdečními oddíly (defekt síňového septa). Následkem systémových embolizací jsou uzávěry periferních tepen. Uzávěr v oblasti magistrálních tepen mozku má za následek závažné klinické projevy ischemické cévní mozkové příhody, tranzitorní ischemické ataky. V ostatních oblastech systémového cévního větvení je následkem embolizace ischemie splanchnické oblasti, končetinové ischemie a další. Lze odhadovat, že 87 % cévních mozkových příhod je ischemických, ty jsou v západních zemích třetí nejčastější příčinou úmrtí [1]. Embolizace ze srdečních oddílů jsou odpovědné za přibližně jednu třetinu ischemických cévních mozkových příhod, zbylé jsou pak následkem embolizace z oblasti aorty a karotických tepen [2]. Srdeční emboly strukturálně představují srdeční tromby, infikované i sterilní vegetace, nádorové fragmenty, vápenné částečky a aterosklerotickou drť.
Echokardiografie je jednou ze základních diagnostických metod v určení zdroje embolizace [3]. Klade si za cíle nalezení embolizačního zdroje, stanovení jeho embolizačního potenciálu (pravděpodobnost další embolizace) a zhodnocení úspěšnosti léčby (eliminace) tohoto zdroje. V tabulce 1 jsou uvedeny faktory, které představují v části A vysoké a v části B nízké riziko systémové embolizace.
1. Výčet faktorů přinášejících A: vysoké embolizační riziko a B: nízké embolizační riziko ze srdečního zdroje 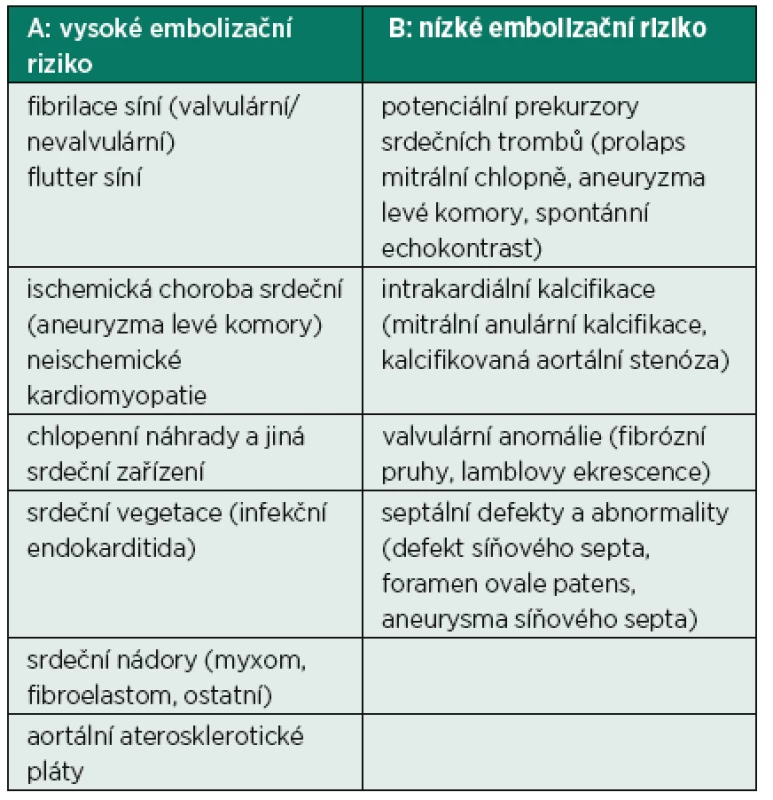
U některých patologických stavů může docházet ke kombinaci rizikových faktorů, např. v případě mitrální regurgitace dojde k fibrilaci síní, výskytu spontánního echokontrastu (SEK) a zvýšenému riziku infekční endokarditidy.
Transtorakální (TTE) a transezofageální (TEE) echokardiografie jsou komplementární metody pro stanovení zdroje kardioembolizace. TEE je metodou volby v případě podezření na infekční endokarditidu, podezření na zdroj v oblasti srdečních síní a jejich oušek, hledání zkratu na úrovni síňového septa. Pro iniciální přehled obsahu srdečních dutin, hodnocení průběhu léčby, hledání tumorové masy je pak vhodná TTE.
TEE je metodou, která je považována za semiinvazivní, i když riziko závažných komplikací je malé (udává se od 0,01 % do 0,09 %) [4], přesto je nutné se vyvarovat zbytečné indikace vyšetření, mezi něž patří hlavně případy vyšetření, jejichž výsledek nevede ke změně terapie, vyšetření kardioembolizačního zdroje, i když již byla příčina dříve objasněna, apod. Obecným pravidlem pro volbu mezi TTE nebo TEE je blízkost srdečního oddílu, který je vyšetřován. Proto oblast srdečních síní je lépe vyšetřitelná pomocí TEE (posteriorní oblasti), zatímco oblast srdečních komor je lépe zobrazitelná pomocí TTE (anteriorní oblasti). Pokud pacient nemá jasnou příčinu kardioembolizace (fibrilace síní, mitrální stenóza, endokarditida), je výsledek TTE zpravidla negativní a není nutné ho provádět, TTE není také nutné v případě, že již máme TEE naplánováno. Tabulka 2 ukazuje adekvátní použití TTE/TEE v jednotlivých situacích.
2. Senzitivita TTE a TEE pro jednotlivé patologické stavy v srdečních dutinách 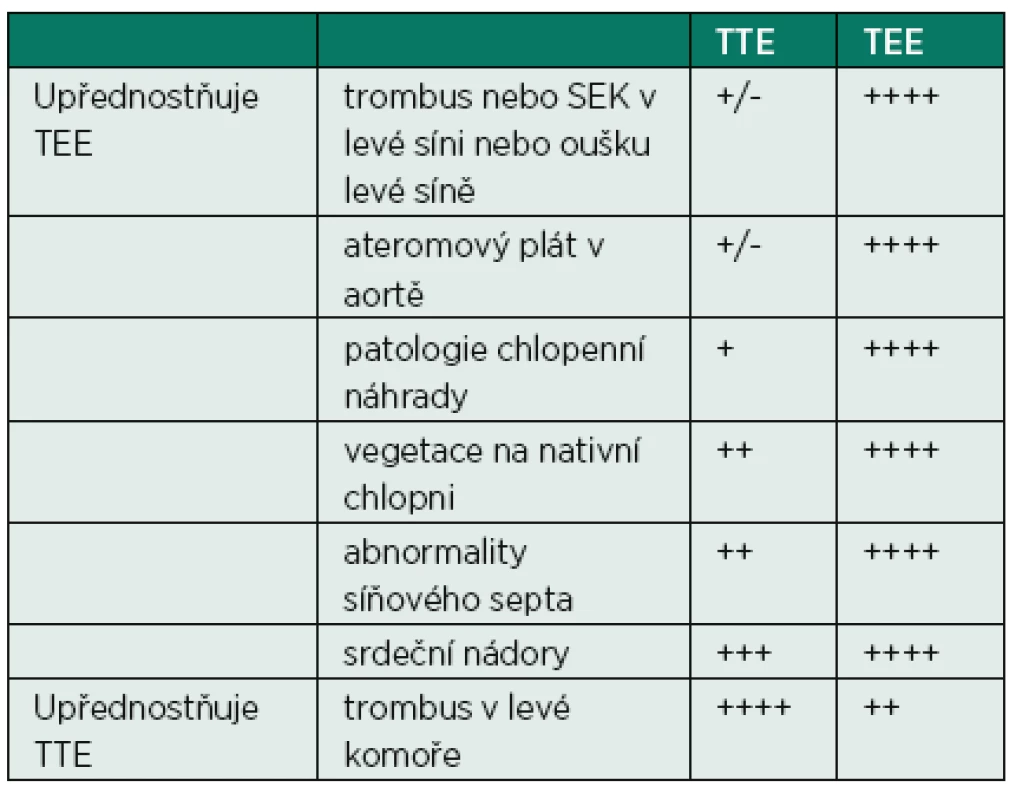
Komplementárními metodami k TTE/TEE vyšetření jsou počítačová tomografie (zobrazení aorty, karotických tepen, magistrálních tepen mozku apod.) [5], magnetická rezonance (hodnocení srdeční struktury a funkce, povahy srdečních nádorů) [6], angiografie.
EMBOLIZACE Z OBLASTI SRDEČNÍCH SÍNÍ A SÍŇOVÝCH OUŠEK
Srdeční síně, respektive síňové ouško, je embolizačním zdrojem s největší prevalencí pojící se typicky se síňovou fibrilací nebo síňovým flutterem. Metodou volby pro vyšetření přítomnosti síňového trombu, respektive trombu v oušku levé síně, a zhodnocení struktury a funkce ouška je TEE [7]. Prevalence fibrilace síní v populaci nad 20 let věku se odhaduje na 3 %, vzrůstající s věkem a kardiální morbiditou, u věkového mediánu pacientů v intenzivní péči jde o 5–10 % [8]. Odhaduje se, že síňové ouško je příčinou embolizace přibližně v 75 % všech případů embolizací. Detailní mechanismus formování trombu zůstává neznámý, nicméně spontánní echokontrast v oblasti levé síně, respektive ouška levé síně (obraz zpomaleného krevního toku), až po formování sludge jsou prekurzory vzniku trombu [9]. Histologicky se u pacientů s fibrilací síní nebo mitrální chlopenní vadou nachází fibrózní přestavba ouška, chybí epitelizace, je zvýšený tah na stěny síní, což vytváří prostředí vhodné k tvorbě trombu. Existuje mnoho rizikových faktorů, které se podílejí na zvýšené tvorbě síňového trombu, mezi něž patří hladina fibrinogenu, hladina Von Willebrandova faktoru [10], D-dimerů a další, stejně jako objem levé síně indexovaný na tělesnou plochu (LAVi). Objem levé síně je nejvýznamnějším parametrem pro odhad kardiovaskulárního rizika nad síňovými rozměry, u závažně dilatované síně (indexovaný objem na povrch těla > 32 ml pro sinusový rytmus, respektive > 72 ml pro pacienty s fibrilací síní, představuje až devítinásobné riziko kardiovaskulární příhody) [11]. Objem levé síně determinuje pravděpodobnost udržení sinusového rytmu po elektrické kardioverzi. TEE je vhodným nástrojem k ozřejmění přítomnosti trombu v oušku levé síně před plánovanou kardioverzí, především u pacientů, kde arytmie může trvat více než 48 hodin. Dvojitě slepá randomizovaná studie srovnávající pacienty tři týdny warfarinizované před kardioverzí a čtyři týdny po kardioverzi versus TEE, hodnocená větev bez třítýdenní warfarinizace před výkonem, neprokázala žádné rozdíly v četnosti mozkových příhod [12]. U pacientů, kteří nejsou antikoagulováni po dobu tří týdnů před výkonem, lze bezpečně přistoupit ke kardioverzi po TEE kontrole a dosažení účinné antikoagulace. Přítomnost trombu, stejně jako výtoková rychlost ouška levé síně (< 27cm/s) jsou nezávislými rizikovými faktory periprocedurální mozkové příhody [13]. Typický obraz trombózy ouška levé síně je na obrázku 1. TEE je nepostradatelným vyšetřením při invazivních srdečních procedurách, např. při izolaci plicních žil, v reálném čase je používána při implantaci okludéru (zabraňuje tvorbě trombů u pacientů s kontraindikací antikoagulace) ouška levé síně.
1. Trombus v oušku levé síně. Vyšetření jícnovou echokardiografií 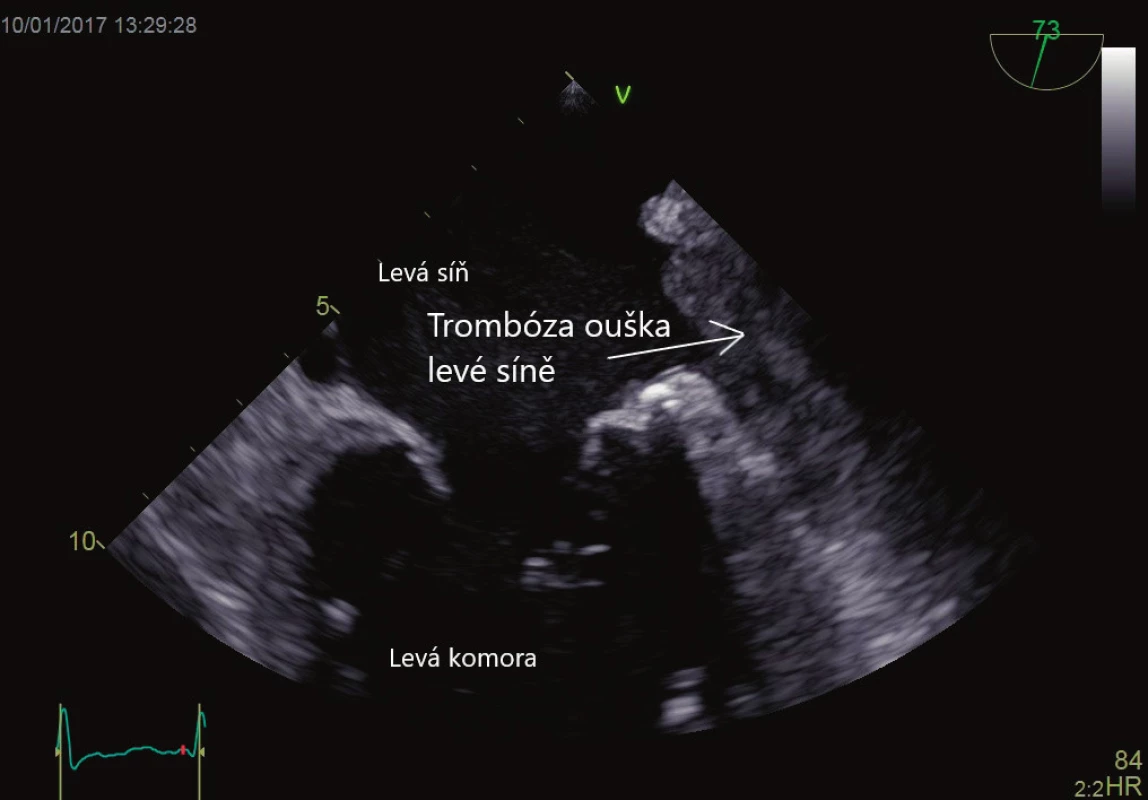
EMBOLIZACE Z OBLASTI SRDEČNÍCH KOMOR
Akutní koronární syndromy s proběhlým infarktem myokardu vedou zpravidla k poruše kontraktility srdeční svaloviny na podkladě myokardiální nekrózy. Tato oblast tvoří zákoutí se sníženým tokem, obnažením a dysfunkcí endokardu, v pokročilém stadiu pak vede k formování aneuryzmatu levé komory. Data o prevalenci nástěnné trombózy se liší, pohybují se od 5 % do 15 % [13, 14], v případě formování chronického srdečního aneuryzmatu může dosahovat až 50 % [15]. Více k formování trombu inklinují pacienti s prodělaným rozsáhlým infarktem a tvorbou poinfarktové jizvy. I přestože je incidence nitrokomorových trombů vysoká, jejich emboligenní potenciál a množství ischemických CMP je nízké. Největší riziko představuje infarkt myokardu s ST elevacemi přední stěny, kde je trombus zpravidla lokalizován v hrotovém aneuryzmatu, nicméně není ojedinělá jeho přítomnost i v jiných oblastech levé komory. Ukázka trombu v levé komoře srdeční je na obrázku 2. Dilatační kardiomyopatie vede k významné poruše kontraktility myokardu levé komory, vazivové přestavbě myokardu a v konečných stadiích pak pozorujeme přítomnost spontánního echokontrastu jako známky obleněného toku krve. Výskyt nitrokomorové trombózy se udává v retrospektivních studiích v širokém rozsahu 1,7–18 % [16]. Tromby uvnitř srdeční komory mohou mít různý tvar a pohyblivost. Nejméně emboligenní je trombus nástěnný, plochý, doširoka přisedlý. Trombus protrudující představuje mírně zvýšené riziko, největším rizikem jsou tromby mobilní, které jeví souhyb s krevním tokem. TTE má vynikající senzitivitu pro detekci komorových trombů, udává se > 95 % [17], a je první volbou. Přesto je třeba dávat pozor na známé artefakty, jako je reverberace, záměna trombózy za výraznou trabekularizaci levé komory nebo části závěsného aparátu mitrální chlopně, vyvarovat se zkrácení (foreshortening) apexu levé komory. Proto pro jistotu diagnózy provádíme vyšetření ve více na sebe kolmých rovinách. Vyšetření je indikováno u všech pacientů po infarktu myokardu (zvlášť kde se již formovalo aneuryzma) a pacientů s kardiomyopatií.
2. Trombus v hrotu levé komory srdeční. Vyšetření transtorakální echokardiografií 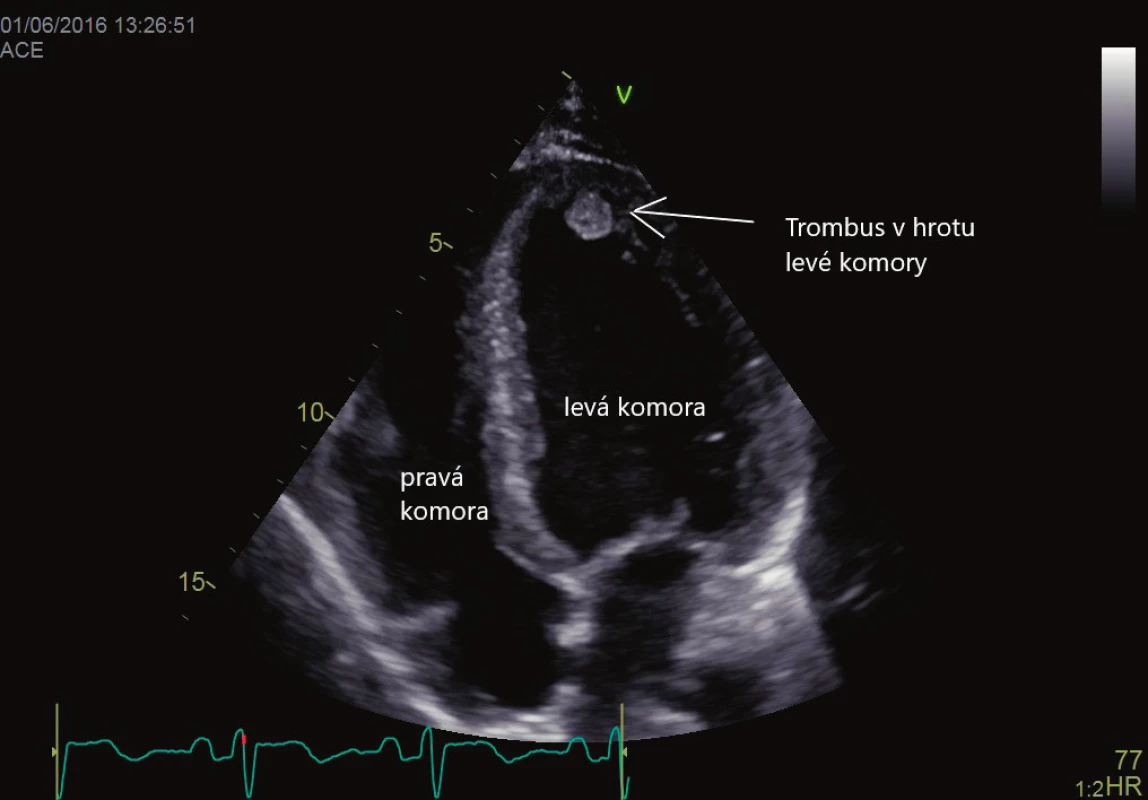
EMBOLIZACE Z OBLASTI SRDEČNÍCH CHLOPNÍ
Srdeční chlopně mohou být příčinou embolizace (infekční vegetace, kalcifikace, drobné tromby) do systémového i plicnicového řečiště. Zdrojem systémové embolizace je v případě nativních chlopní infekční endokarditida, papilární fibroelastom, nebakteriální trombotická endokarditida, mitrální anulární kalcifikace. Zdrojem mohou být také protetické chlopenní náhrady jak mechanické, tak biologické. U těchto náhrad dochází k infekční endokarditidě nebo trombotizaci chlopně. V případě infekční endokarditidy je echokardiografie základním vyšetřením pro stanovení diagnózy, která pak společně s nálezem pozitivních hemokultur, eventuálně dalších klinických známek endokarditidy, tvoří základní pilíř pro stanovení diagnózy. Znalost morfologie vegetací je velmi důležitá pro možnost záměny za jiné útvary. Vegetace mohou mít echogenitu myokardu, která se však u starších vegetací může zvětšovat z důvodu postupné kalcifikace. Tvarově i velikostně jsou vegetace značně proměnlivé, nejčastěji mají nepravidelný tvar (obrázek 3). Často bývají ve spojitosti s chlopenní regurgitací nebo formováním srdečního abscesu (echolucentní útvar v okolí chlopně). Záměna je možná se srdečním papilárním fibroelastomem, Lamblovými ekrescencemi, mobilní anulární kalcifikací. V případě chlopenních náhrad je třeba pátrat po odtržení sutury chlopně a následném paravalvulárním proudění. Vegetace mohou být zaměněny za zbytky závěsného aparátu, vazivové pruhy, tromby a mikrokavitace. Při vyšetřování je potřeba vždy myslet na možnou přítomnost těchto artefaktů. TTE se vyznačuje vysokou specificitou (> 90 %), senzitivita se však udává v rozmezí 62–79 % [18, 19], obecně je obtížné zachytit vegetace < 2–3 mm. TEE má oproti tomu vysokou specificitu i senzitivitu (> 90 %), tento rozdíl se pak ještě zvyšuje v případě prostetických náhrad. V případě mechanických chlopenních náhrad hrají TTE a TEE komplementární roli, neboť pro silný akustický stín TEE vizualizuje jen síňovou stranu chlopenní náhrady, zatímco TTE stranu srdeční komory. Při pátrání po infekční endokarditidě je vhodné provést jako první volbu TTE, je-li však vyšetření negativní, pak je indikována TEE, zvlášť v případě vysokého klinického podezření. Pokud je i TEE negativní a klinické podezření je stále vysoké, pak je vhodné vyšetření opakovat za sedm dní. Pravděpodobnost systémové embolizace je udávána v rozsahu 13–49 % [20], stoupá s velikostí vegetace (> 10 mm) [22], její mobilitou, více embolizují vegetace z mitrální chlopně. Kromě infekčních vegetací mohou být na chlopních i neinfekční trombotické afekce (Libmanova-Sacksova endokarditida, marantická endokarditida) ve spojení se systémovým lupus erytematodes, nádorovými onemocněními apod. Trombóza mechanické chlopenní náhrady se odhaduje na 1–2 % ročně, pro biologické chlopenní náhrady je to pak 0,5–1 % ročně. TEE je podstatně výhodnější ve srovnání s TTE pro stanovení diagnózy [22]. Odlišení trombů od vegetací není vždy jednoduché a pro stanovení diagnózy hraje zásadní roli další klinický obraz.
3. Infekční endokarditida, vlající vegetace na aortální chlopni. Vyšetření jícnovou echokardiografií 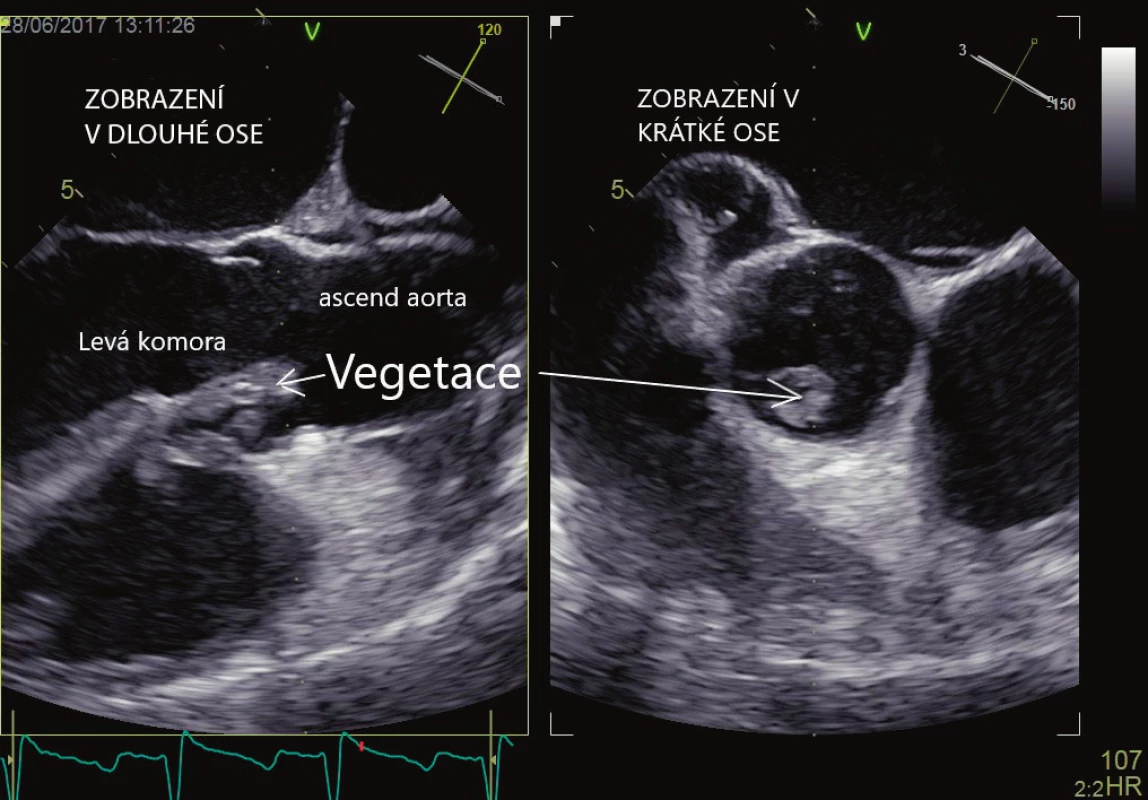
SRDEČNÍ NÁDORY
Primární srdeční nádory jsou velmi vzácné (prevalence 0,05 %), většinou mají benigní histologickou povahu, avšak mohou mít maligní následky v podobě embolizace do CNS. Nejčastějšími nádory jsou myxom (obr. 4) a papilární fibroelastom. Myxom je zpravidla stopkatý laločnatý nádor vyrůstající z fossa ovalis síňového septa s vysokým potenciálem embolizace, proto je vždy indikované chirurgické odstranění. Papilární fibroelastom je lokalizovaný na srdečních chlopních (nejčastěji aortální), má vysoký embolizační potenciál a je vždy indikováno jeho odstranění. Primárními maligními srdečními nádory jsou sarkomy, které však zpravidla rostou v pravostranných srdečních oddílech, a tak embolizují do plicnicového řečiště. Metastatické nádory mají 20krát vyšší výskyt než nádory primární. Jsou to melanomy, prsní, plicní, kolorektální karcinom a další. Metastatické nádory embolizují jen velmi vzácně.
4. Myxom vycházející z mezisíňového septa, propadající se do ústí mitrální chlopně. Vyšetření jícnovou echokardiografií 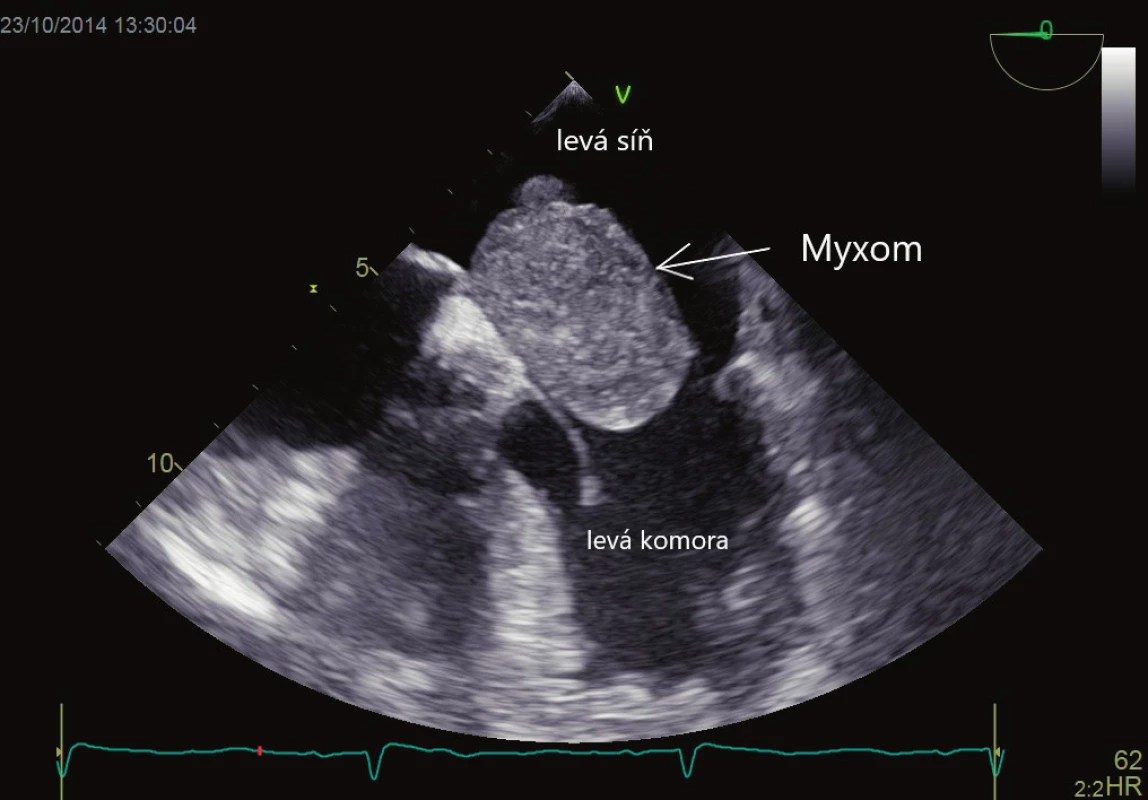
EMBOLIZACE Z OBLASTI AORTY
Ačkoli aorta není anatomicky srdeční součástí, zahrnujeme ji vždy do vyšetření embolizačního zdroje pro její blízkost srdečním strukturám a echokardiografickou zobrazitelnost. Její hodnocení je součástí standardních echokardiografických protokolů. Z aorty pocházejí dva typy embolů, tromby a cholesterolové krystaly. Cholesterolové krystaly mohou způsobovat mnohočetné sukcesivní embolizace s diskrétními projevy: v CNS postupná mentální deteriorace, renální selhání, syndrom modrého palce a další [23]. Pro potenciální maligní embolizaci je zásadní hodnocení ascendentní aorty. Ta je nejlépe vizualizována TEE vyšetřením v midesofageální projekci ve 120–150° nebo v kolmé rovině 30–50°. Existuje více skórovacích systémů na hodnocení emboligenního potenciálu aortálních plátů/trombů. Významně vyšší riziko představují pláty > 4 mm, pláty exulcerované a pláty s nasedlým trombem.
ZÁVĚR
TTE i TEE představují základní vyšetřovací metody pro identifikaci nitrosrdečního a aortálního zdroje systémové embolizace. Obě metody jsou komplementární. TEE je výhodnější pro hodnocení síní, chlopenního aparátu a ascendentní aorty. TTE je však vhodné volit jako metodu první volby pro nízkou invazivitu a dostupnost. Obě metody pak jsou komplementárními k dalším zobrazovacím metodám (CT, MRI).
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že v souvislosti s tématem práce nemají střet zájmů.
Oba autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Poděkování: Echokardiografický monitoring pacientů byl umožněn díky grantové podpoře EU z projektu reg. No. CZ.2.16/3.1.00/21565 OP Prague Competitiveness.
Do redakce došlo dne 7. 6. 2017.
Do tisku přijato dne 10. 10. 2017.
Adresa pro korespondenci:
MUDr. Jan Rulíšek
E-mail: jan.rulisek@vfn.cz
Sources
1. Adams HP Jr., Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24 : 35–41.
2. Strandberg M, Marttila RJ, Helenius H, Hartiala J. Transoesophageal echocardiography in selecting patients for anticoagulation after ischaemic stroke or transient ischaemic attack. J Neurol Neurosurg Psychiatry.2002;73 : 29–33.
3. Pepi M, Evangelista A, Nihoyannopoulos P, Flachskampf FA, Athanassopoulos G, Colonna P, et al. Recommendations for Echocardiography in the Diagnosis and Management of Cardiac Sources of Embolism. Eur J Echocardiogr. 2010;11 : 461–476.
4. Bavalia N, Anis A, Benz M, Maldjian P, Bolanowski PJ, Saric M. Esophageal perforation, the most feared complication of TEE: Early recognition by multimodality imaging. Echocardiography. 2011;28:E56–59.
5. Jin KN, Chun EJ, Choi SI, Ko SM, Han MK, Bae HJ, et al. Cardioembolic origin in patients with embolic stroke: spectrum of imaging findings on cardiac MDCT. AJR Am J Roentgenol. 2010;195:W38–44.
6. Arboix A, Alió J. Acute cardioembolic stroke: an update. Expert Rev Cardiovasc Ther. 2011;9 : 367–369.
7. Veinot JP, Harrity PJ, Gentile F, Khandheria BK, Bailey KR, Eickholt JT, et al. Anatomy of the normal left atrial appendage: a quantitative study of age-related changes in 500 autopsy hearts: implications for echocardiographic examination. Circulation. 1997;96 : 3112–3115.
8. 2016 ESC Guidelines for the management of atrial fi brillation developed in collaboration with EACTS. Paulus Kirchhof, Stefano Benussi, Dipak Kotecha, et al., European Heart Journal. 2016;37 : 2893–2962.
9. Lowe BS, Kusunose K, Motoki H, Varr B, Shrestha K, Whitman C, et al. Prognostic significance of left atrial appendage “sludge” in patients with atrial fibrillation: a new transesophageal echocardiographic thromboembolic risk factor. J Am Soc Echocardiogr. 2014;27 : 1176–1183.
10. Heppel RM, Berkin KE, McLenachan JM, Davies JA. Hemostatic and hemodynamic abnormalities associated with left atrial thrombosis in nonrheumatic atrial fibrillation. Heart. 1997;77 : 407–411.
11. Tsang TS, Abhayaratna WP, Barnes ME, Miyasaka Y, Gersh BJ, Bailey KR, et al. Prediction of cardiovascular outcomes with left atrial size: is volume superior to area or diameter? J Am Coll Cardiol. 2006;47 : 1018–1023.
12. Klein AL, Grimm RA, Murray RD, et al., Assessment of Cardioversion Using Transesophageal Echocardiography Investigators. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med. 2001;344 : 1411–20.
13. Chiarella F, Santoro E, Domenicucci S, Maggioni A, Vecchio C. Predischarge two-dimensional echocardiographic evaluation of thrombosis after acute myocardial infarction in the GISSI-3 study. Am J Cardiol. 1998;81 : 822–827.
14. Solheim S, Seljeflot I, Lunde K, Bjørnerheim R, Aakhus S, Forfang K, et al. Frequency of left ventricular thrombus in patients with anterior wall acute myocardial infarction treated with percutaneous coronary intervention and dual antiplatelet therapy. Am J Cardiol. 2010;106 : 1197–1200.
15. Nihoyannopoulos P, Smith GC, Maseri A, Foale RA. The natural history of left ventricular thrombus in myocardial infarction: a rationale support of masterly inactivity. J Am Coll Cardiol. 1989;14 : 903–911.
16. Koniaris LS, Goldhaber SZ. Anticoagulation in dilated cardiomyopathy. J Am Coll Cardiol. 1998;31 : 745–748.
17. Jugdutt BI, Sivaram CA. Prospective two-dimensional echocardiographic evaluation of left ventricular thromboembolism after acute myocardial infarction. J Am Coll Cardiol. 1989;13 : 554–64.
18. Jacob S, Tong AT. Role of echocardiography in the diagnosis and management of infective endocarditis. Curr Opin Cardiol. 2002;17 : 478–485.
19. O’Brien JT, Geiser EA. Infective endocarditis and echocardiography. Am Heart J. 1984;108 : 386–394.
20. Habib G. Embolic risk in subacute bacterial endocarditis: determinants and role of transesophageal echocardiography. Curr Cardiol Rep. 2003;5 : 129–136.
21. Thuny F, Di Salvo G, Belliard O, Avierinos JF, Pergola V, Rosenberg V, et al. Risk of embolism and death in infective endocarditis: prognostic value of echocardiography: a prospective multicenter study. Circulation. 2005;112 : 69–75.
22. Gueret P, Vignon P, Fournier P, Chabernaud JM, Gomez M, LaCroix P, et al. Transesophageal echocardiography for the diagnosis and management of nonobstructive thrombosis of mechanical mitral valve prosthesis. Circulation. 1995;91 : 103–110.
23. Amarenco P, Cohen A, Tzourio C, Bertrand B, Hommel M, Besson G, et al. Atherosclerotic disease of the aortic arch and the risk of ischemic stroke. N Engl J Med. 1994;331 : 1474–1479.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2017 Issue 6-
All articles in this issue
- Ultrasound-assisted continual infraclavicular block of the brachial plexus
- The heart as a source of systemic embolization
- Comparison of cardiac output monitoring with the Pulse Wave Transit Time technique versus arterial waveform analysis
-
The adult oncological patient in intensive care
Is it time to start saying "yes, we will consider" instead of just "no"? - TotalTrack VLM – a new tool for difficult airway management
- Statistics in biomedical research III
-
Anaesthesia in the Austro-Hungarian Empire during World War I and in the newly formed Czechoslovak Republic
Part III – Intravenous regional anaesthesia and neuraxial anaesthetic methods
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The heart as a source of systemic embolization
- Comparison of cardiac output monitoring with the Pulse Wave Transit Time technique versus arterial waveform analysis
- Ultrasound-assisted continual infraclavicular block of the brachial plexus
- TotalTrack VLM – a new tool for difficult airway management
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

