-
Medical journals
- Career
Frakcionovaná plazmatická separace a adsorpce neovlivňuje hemodynamické parametry u experimentálního akutního selhání jater
Authors: Lásziková Eva 1,5; Pražák Josef 2; Pantoflíček Tomáš 3,5; Ryska Ondřej 3; Koblihová Eva 3,5; Jurenka Božetěch 1; Ryska Miroslav 3,5
Authors‘ workplace: Anesteziologicko-resuscitační oddělení ÚVN Praha 1; Klinika anesteziologie, resuscitace a intenzivní péče 2. LF UK a ÚVN Praha 2; Chirurgická klinika 2. LF UK a ÚVN Praha 3; Chirurgická klinika 1. LF Praha UK, Nemocnice na Bulovce, Praha 4; Centrum buněčné terapie a tkáňových náhrad 2. LF UK a ÚVN Praha 5
Published in: Anest. intenziv. Med., 21, 2010, č. 4, s. 191-198
Category: Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Zhodnotit vliv frakcionované plazmatické separace a adsorpce (FPSA) na hemodynamiku u experimentálního modelu akutního jaterního selhání (ASJ) na velkém laboratorním zvířeti ve srovnání s kontrolní skupinou.Typ studie:
Experimentální studie.Pracoviště:
ARO – Ústřední vojenská nemocnice v Praze.Materiál a metoda:
Celkem u 21 laboratorních prasat, hmotnosti 25–45 kg jsme vyvolali ASJ metodou chirurgické devaskularizace. U 14 z nich jsme ASJ léčili pomocí FPSA. Dalších 7 zvířat jsme zařadili do kontrolní skupiny. Během pokusu jsme monitorovali parametry hemodynamiky v 0., 3., 6., 9. a 12. hodině, biochemické parametry a ICP. Data jsme statisticky analyzovali pomocí T-testu a Mannova-Whitneova neparametrického testu, za významný byl považován rozdíl p < 0,05.Výsledky:
V obou skupinách jsme zaznamenali signifikantní snížení indexované systémové vaskulární rezistence (SVRI) ve 3., 6., 9. a 12. hodině a signifikantní zvýšení tepové frekvence (HR) a indexovaného srdečního výdeje (CI) v 6., 9. a 12. hodině v porovnání s hodnotami na začátku pokusu. U skupiny zvířat s léčbou FPSA jsme nenašli signifikantní rozdíly středního arteriálního tlaku (MAP), indexované systémové vaskulární rezistence (SVRI) a laktátu (p > 0,05) ve srovnání s kontrolní skupinou. Významné snížení intrakraniálního tlaku (ICP) jsme pozorovali u skupiny léčené FPSA (p < 0,05). Ve 3. hodině jsme zaznamenali signifikantní snížení tepové frekvence (HR) ve skupině s FPSA. V 9. hodině bylo signifikantní zvýšení indexovaného srdečního výdeje (CI) a v 6. a 12. hodině signifikantní snížení tlaku v zaklínění (PAWP).Závěr:
Naše experimentální práce s léčbou akutního jaterního selhání pomocí přístroje Prometheus u velkého laboratorního zvířete neprokázala signifikantní změny hemodynamických parametrů.Klíčová slova:
experimentální akutní selhání jater – frakcionovaná plazmatická separace a adsorpce – hemodynamické parametryÚvod
Akutní selhání jater (ASJ) je relativně vzácné onemocnění s vysokou mortalitou. Kromě rozvoje encefalopatie a rizika fatálních infekčních komplikací bývá tento syndrom doprovázený hemodynamickou nestabilitou. Léčba pomocí FPSA – frakcionovaná plazmatická separace a adsorpce (přístroj Prometheus, Fresenius, Německo) – je novou metodou, která může být použita v terapii tohoto onemocnění [1, 2]. Eliminuje toxické substance rozpustné jak ve vodě, tak i vázané na albumin. Vliv FPSA na hemodynamiku při ASJ nebyl doposud prokázán. Cílem naší studie bylo zhodnotit vliv FPSA na hemodynamické parametry u velkého laboratorního zvířete, u kterého jsme ASJ navodili devaskularizační metodou (3).
Metody
I. Experimentální chirurgický model ASJ
V experimentu jsme použili celkem 21 laboratorních prasat o hmotnosti 25–45 kg, u kterých jsme navodili ASJ metodou devaskularizace s ligací a. hepatica a provedením portokavální anastomózy end-to-side (PCA) [3]. Nástup ASJ byl dokumentován hypoglykémií (< 3,5 mmol/l). Po nástupu ASJ byla celkem u 14 prasat zahájena terapie FPSA, zbylá zvířata sloužila jako kontrolní skupina. Pokus byl ukončen vždy 12 hodin po nástupu ASJ.
II. Anestezie
Zvířata jsme premedikovali 20 minut před chirurgickým výkonem intramuskulární injekcí směsi ketaminu 10 mg . kg-1 (Narkamon, Léčiva, Česká republika), atropinu 0,2 mg (Atropin Biotika, Hoechst-Biotika, Slovensko), azaperonu 4 mg . kg-1 (Stresnil, Janssen Pharmaceutica, Belgie) a medetomidinu 25 μg . kg-1 (Domitor, Pfizer, USA). K úvodu do celkové anestezie jsme použili fentanyl 4 μg . kg-1 (Fentanyl Torrex, Torrex Chiesi, Rakousko) a etomidát 0,3 mg . kg-1 (Hypnomidate, Janssen Pharmaceutica, Belgie), poté jsme zvířata zaintubovali. Po intubaci jsme zahájili umělou plicní ventilaci (Servoventilator, Siemens – Elema D 900, Švédsko) v režimu tlakově řízené ventilace (PCV) s FiO2 0,4, PEEP 5 cm H2O, F 16/min. s dechovým objemem 6–8 ml . kg-1 (TV) a udržováním normokapnie (paCO2 4,6–5,3 kPa). Inhalačně během celkové anestezie byl podáván isolfuran (Forane, Abbott Laboratories, Velká Británie), intravenózně jsme podávali v kontinuální infuzi fentanyl 6–10 μg . kg-1 . hod-1 (Fentanyl Torrex, Torrex Chiesi, Rakousko) a medetomidin 1 μg . kg-1 . min-1 (Domitor, Pfizer, USA). Bolusově jsme také během operačního výkonu podávali svalová relaxantia – pipecuronium 0,02 mg . kg-1 (Arduan, Gedeon Richter, Maďarsko). Amoxicillin 1,2 g i.v. (Amoksiklav, LEK PHARMACEUTICALS, Slovinsko) a famotidin 20 mg i.v. (Quamatel, Chemical Works of Gedeon Richter, Maďarsko) jsme použili jako antibiotickou profylaxi a prevenci stresového vředu. Punkční nebo preparační technikou jsme potom provedli kanylace a. a v. femoralis nutné pro připojení zvířete na přístroj Prometheus (FPSA) a k invazivnímu monitorování krevního tlaku. Chirurgickou preparací jsme detekovali v. jugularis int., touto cestou byl zaveden termodiluční plicnicový katétr (7F Arrow, USA) k monitorování hemodynamických parametrů.
III. Pooperační péče
Po operačním výkonu bylo zvíře uloženo na levý bok a analgosedováno podáváním kontinuální infuze propofolu 8–12 mg . kg-1 . hod-1 (Recofol, Leiras, Finsko), fentanylu 6–10 μg . kg-1 . hod-1 (Fentanyl Torrex, Torrex Chiesi, Rakousko) a medetomidinu 1 μg . kg-1 . hod-1 (Domitor, Pfizer, USA) – medikamentů s extrahepatální cestou eliminace. K monitorování nitrolebního tlaku jsme zavedli do pravé mozkové hemisféry intraparenchymově čidlo ICP (Codman, Johnson and Johnson, USA). Zvíře bylo uměle plicně ventilováno v režimu tlakově řízené ventilace, s dechovým objemem (TV) 6–8 ml . kg-1, s frekvencí 16/min a pozitivním přetlakem na konci výdechu (PEEP) 5 cm H2O s cílem udržení stabilních ventilačních parametrů, především normokapnie (paCO2 4,6–5,3 kPa). Střední arteriální tlak (MAP) nad 60 mm Hg jsme udržovali kontinuální infuzí krystaloidních a koloidních roztoků. Pokud tato léčba byla neefektivní, přistoupili jsme ke kontinuálnímu přívodu noradrenalinu (Noradrenalin, Léčiva, ČR). Hypoglykémie < 3,5 mmol . l-1 jako zásadní klinický projev ASJ [4] byla kompenzována k normoglykémii (3,5–5,0 mmol . l-1) kontinuálním podáváním roztoku 40% glukózy.
IV. Monitorování
Základní hemodynamické parametry (HR, MAP, CVP) byly monitorovány kontinuálně. Se začátkem pokusu a poté v tříhodinových intervalech (0., 3., 6., 9. a 12. hodina) byl monitorován indexovaný srdeční výdej (CI), indexovaná systémová vaskulární rezistence (SVRI), tlak v zaklínění (PAWP). Intrakraniální tlak (ICP) byl monitorován kontinuálně. Během celého pokusu byla sledována tělesná teplota (TT), parciální tlak oxidu uhličitého na konci výdechu (ETCO2), saturace krve kyslíkem (SpO2). V pravidelných intervalech jsme odebírali krevní vzorky ke stanovení acidobazické rovnováhy, glykémie, krevního obrazu, parametrů hemokoagulace a biochemických parametrů (jaterní testy, kreatinin, urea, amoniak).
V. Zapojení FPSA
Krev zvířete byla krevní pumpou přístroje Prometheus vedena z pravé femorální tepny do AlbuFlow filtru, ve kterém byla separována plazma včetně frakce albuminu a na něj vázaných substancí. Odtud byla sekundárním okruhem vedena do adsorbérů Prometh1 a Prometh2 (obr. 1). Albumin zbavený navázaných substancí byl následně vrácen zpět do krve. Plná krev byla mimoto vedena do klasického dialyzátoru (Hi-Flux), který odstranil pomocí hemodialýzy látky rozpuštěné ve vodě. Očištěná krev byla cestou levé femorální žíly vrácena do těla zvířete. Jako antikoagulans v průběhu léčby FPSA jsme použili heparin.
Image 1. Zapojení přístroje Prometheus k velkému laboratornímu zvířeti 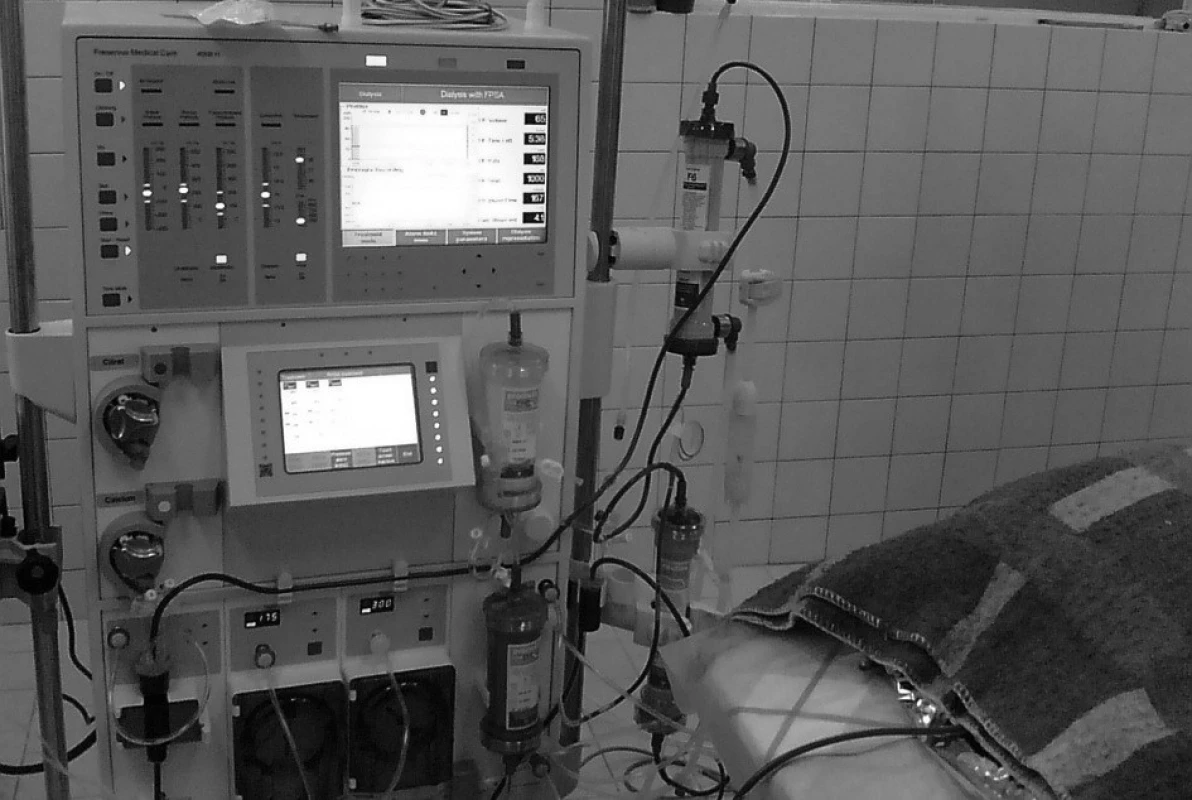
S ukončením experimentu byla zvířata humánně usmrcena letální dávkou thiopentalu a roztoku chloridu draselného. Poté byla provedena pitva zvířete s vizualizací orgánů dutiny břišní a kontrolou polohy všech katétrů.
Statistické zpracování výsledků
Získané hodnoty laboratorních vyšetření v průběhu léčby ASJ připojením na FPSA jsme porovnali s parametry kontrolní skupiny zvířat, u které bylo vyvoláno ASJ a která nebyla na eliminaci napojena. Získané údaje jsme statisticky zpracovali pomocí T-testu a Mannovým-Whitneyovým neparametrickým testem, za významný byl považován rozdíl p < 0,05.
Prohlášení
Předoperační přípravu, operaci a pooperační péči jsme prováděli v souladu se zákonem č. 312/2008 Sb., na ochranu zvířat proti týrání, a v souladu s vyhláškou č. 207/2004 Sb., o ochraně, chovu a využití pokusných zvířat. Protokol pokusu byl schválen odbornou i etickou komisí Institutu klinické a experimentální medicíny v Praze.
Výsledky
V rámci experimentu bylo použito celkem 25 laboratorních prasat, ze kterých bylo 21 statisticky hodnotitelných. Celkem 2 zvířata byla vyřazena pro předčasné úmrtí z důvodů nezvladatelného krvácení po chirurgickém výkonu. U dalších 2 zvířat nebylo ve druhé polovině pokusu možné sledovat ICP vzhledem k nitrolebnímu krvácení v místě zavedeného čidla. Všechna ostatní zvířata kontrolní i léčené skupiny přežila do 12. hodiny a byla plně monitorována. Průměrná délka operace byla 1 hodina a 40 minut. Léčba FPSA byla zahájena u 14 zvířat v průměru 3 hodiny 17 minut (rozmezí 2 hod. 15min. až 4 hod. 20 min.) po provedení devaskularizace a trvala průměrně 5 hodin 54 minut (rozmezí 5 hod. 45 min. až 6 hod.). Noradrenalin k udržení MAP nad 60 mm Hg byl podáván u 4 prasat léčených FPSA v malých dávkách 0,05–0,15 μg . kg-1 . min-1. Podávání noradrenalinu jsme zahájili ve všech čtyřech případech 3 hodiny po zahájení terapie FPSA. Ve třech případech jsme podávání noradrenalinu ukončili s ukončením terapie FPSA. V jednom případě jsme malé dávky noradrenalinu podávali do konce pokusu. Ve skupině kontrolní jsme podávali noradrenalin ve vyšších dávkách v průběhu celého pokusu ve všech případech. Statisticky byl rozdíl v dávkách noradrenalinu v kontrolní a skupině léčené FPSA nesignifikantní. Nepozorovali jsme žádné signifikantní rozdíly v MAP, SVRI a laktátu (p > 0,05) v průběhu pokusu v porovnání skupiny kontrolní se skupinou léčenou FPSA (tab. 1–3, grafy 1–3). V pokusu jsme nezaznamenali signifikantní rozdíl v HR ve srovnání s kontrolní skupinou v 6. hodině (78,3 ± 20 vs 84,7 ± 9,5), v 9. hodině (87,4 ± 22,2 vs 85,7 ± 11) a 12. hodině (100,1 ± 37,3 vs 101,7 ± 8,8). Zaznamenali jsme signifikantní snížení HR ve 3. hodině pokusu (75,3 ± 10,9 vs 64,3 ± 12,5) ve skupině léčené FPSA (p < 0,05).V 9. hodině pokusu jsme zaznamenali signifikantní snížení CI v kontrolní skupině v porovnání se skupinou léčenou FPSA (3,5 ± 0,5 vs 4,7±1,5). V pokusu jsme nezaznamenali signifikantní rozdíl v CI ve srovnání s kontrolní skupinou ve 3. hodině pokusu (3,9 ± 1 vs 3,6 ± 0,7) v 6. hodině (4,2 ± 1,1 vs 3,6 ± 0,6) a 12. hodině (3,7 ± 0,9 vs 3,5 ± 0,5). V 6. hodině (4,8 ± 4,1 vs 8,1 ± 2,1) jsme zaznamenali signifikantní snížení PAWP ve skupině kontrolní na rozdíl od skupiny léčené FPSA. V pokusu jsme nezaznamenali signifikantní rozdíl v PAWP ve srovnání s kontrolní skupinou ve 3. hodině pokusu (5,9 ± 3,8 vs 7,3 ± 2,9), v 9. hodině (6,4 ± 4,1 vs 9,3 ± 4) a 12. hodině (4 ± 2,9 vs 7 ± 2,9) – tabulky 4–6, grafy 4–6.
Table 1. Srovnání průměrných hodnot MAP včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05 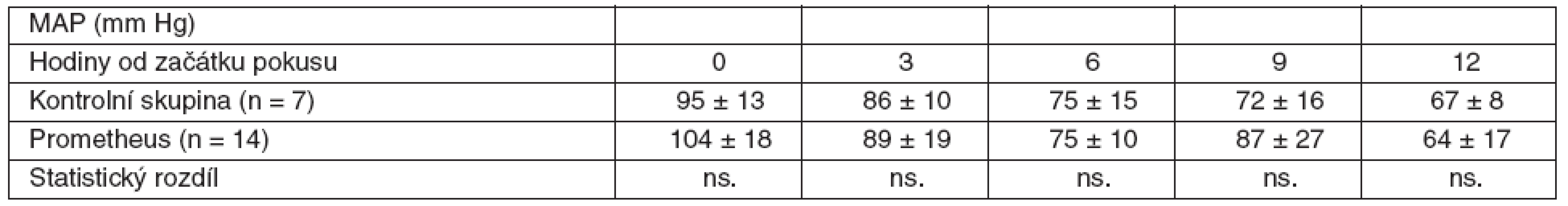
Table 2. Srovnání průměrných hodnot SVRI včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05 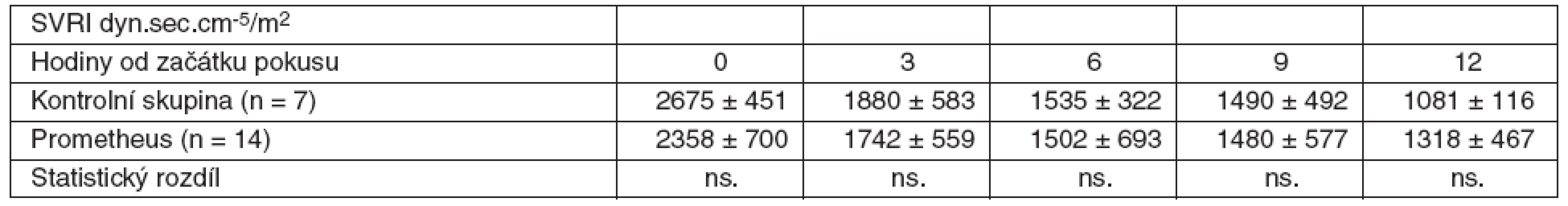
Table 3. Srovnání průměrných hodnot laktátu včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05 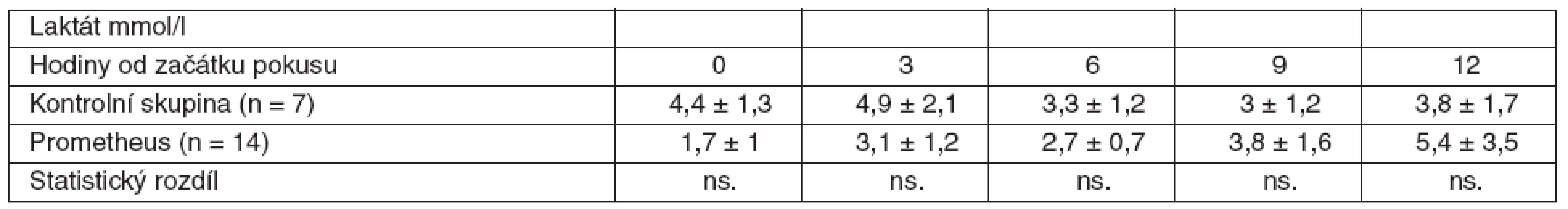
Graph 1. Srovnání hodnot MAP ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Graph 2. Srovnání hodnot HR ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Graph 3. Srovnání hodnot SVRI ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Table 4. Srovnání průměrných hodnot HR včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05, s.- statisticky významný rozdíl, p < 0,05 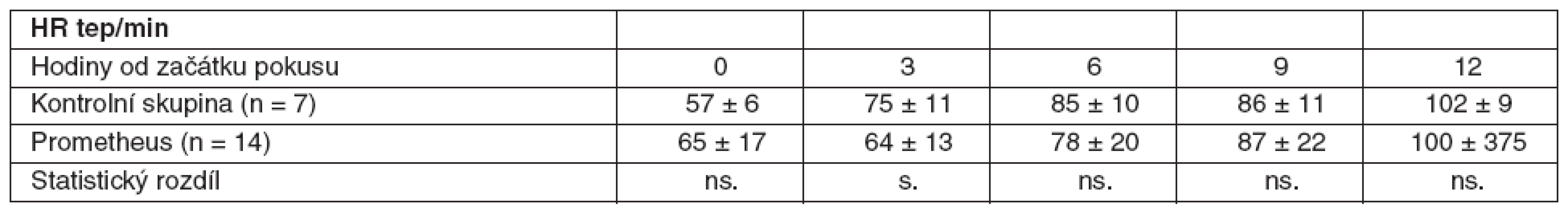
Table 5. Srovnání průměrných hodnot CI včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05, s. – statisticky významný rozdíl, p < 0,05 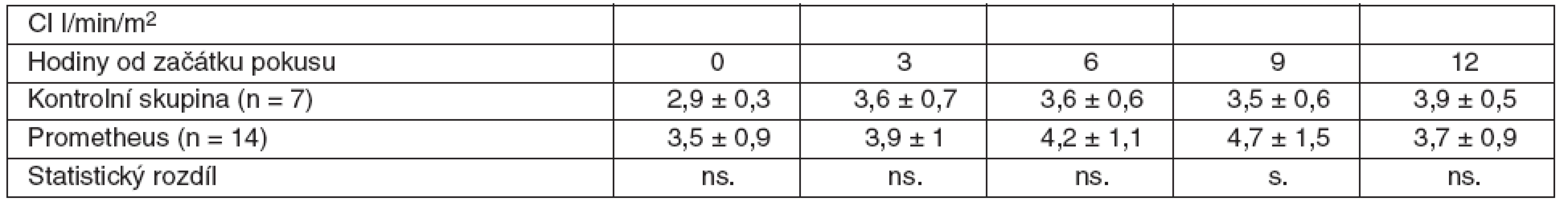
Table 6. Srovnání průměrných hodnot PAWP včetně SD ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby SD – standardní odchylka, ns. – neliší se, p > 0,05, s. – statisticky významný rozdíl, p < 0,05 
Graph 4. Srovnání hodnot CI ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Graph 5. Srovnání hodnot PAWP ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Graph 6. Srovnání hodnot laktátu ve skupině zvířat s ASJ léčeným FPSA a u kontrolní skupiny bez léčby 
Naopak jsme prokázali signifikantní snížení ICP u skupiny FPSA v porovnání s kontrolní skupinou (p< 0,05) od 9. hodiny po 12. hodinu: 9. hodina 19,1 ± 4,09 vs 24,1 ± 2,85, 10. hodina 21,9 ± 3,63 vs 25,1 ± 2,19, 11. hodina 22,5 ± 3,98 vs 26,3 ± 3,5 a 12. hodina 24,0 ± 4,66 vs 29,8 ± 5,88 mm Hg.
Diskuse
Akutní selhání jater a jeho vliv na hemodynamiku
Akutní selhání jater je relativně vzácné onemocnění s velmi špatnou prognózou. Nástup ASJ je doprovázený rychlou systémovou hemodynamickou dysfunkcí a nestabilitou, která se manifestuje hyperkinetickou cirkulací s charakteristickou systémou vazodilatací [5]. SVRI a MAP jsou sníženy, na druhé straně HR a CI jsou zvýšeny. Zvýšená nálož substancí s vazodilatačním potenciálem (NO) a uvolnění dalších vazoaktivních substancí (cytokinů) v rámci imunitní odpovědi na systémovou endotoxémii [6] spolu se sníženou citlivostí poškozených cév na vazokonstrikční agens hrají důležitou roli v rozvoji klinických projevů ASJ. Hypotenze a poškození endotelu se zvýšenou permeabilitou kapilár vedou k extravazaci tekutin do intersticia a k hypovolémii. Při progresi jaterního selhání dochází ke zhoršení hypoperfuze tkání, buněčné hypoxii a rozvoji multiorgánové dysfunkce. Nově bylo potvrzeno, že ASJ je spojeno s hypermetabolickým stavem v hepatosplachnické oblasti charakterizovaným zvýšenou glykolýzou a hyperlaktatémií. Právě hypermetabolický stav má vedle orgánové hypoxie největší vliv na hyperlaktatémii u ASJ [7, 8]. Na hyperlaktatémii se zjevně podílí i váznoucí clearance laktátu selhávajícími játry. Přesná patofyziologie hyperkinetické cirkulace kombinované s mikrocirkulačním poškozením, které se vyskytují u ASJ, není v současné době plně objasněna.
Model ASJ
Devaskularizační model s konstantní dobou nástupu ASJ na velkém laboratorním zvířeti je vhodný pro testování metody jako je FPSA. Jeho výhody spočívají v jednoduchosti provedení a spolehlivosti nástupu ASJ. Pouze 2 zvířata musela být ze studie vyloučena pro chirurgickou komplikaci. Další 2 prasata nemohla být hodnocena vzhledem k neúplnému monitorování ICP, když po 6 hodinách pokusu při koagulopatii vzniklé v rámci ASJ došlo ke krvácení v místě zavedeného parenchymatózního čidla. Vzhledem k předem stanovené délce pokusu na 12 hodin od nástupu ASJ jsme dobu přežití nezařadili mezi hodnocené parametry. Dalším důvodem jsou i literárně prokázané velké rozdíly v době přežívání s chirurgicky navozeným ASJ [9]. V rámci velkého rozptylu by tudíž rozdíly mezi léčenou a kontrolní skupinou nebyly statisticky hodnotitelné.
Frakcionovaná plazmatická separace a adsorpce
Přístrojem Prometheus je prováděna na podkladě frakcionované plazmatické separace a adsorpce eliminace toxických substancí rozpustných ve vodě i vázaných na albumin. Přístroj se skládá z dialyzačního přístroje FMC 4008H rozšířeného o modul pro frakcionovanou plazmatickou separaci albuminovým filtrem a dvěma adsorbéry (Prometh 01 a Prometh 02). Prometh 01 propouští molekuly do velikosti 250 kD. Tím dochází k adsorpci žlučových kyselin, aromatických aminokyselin a fenolických substancí. Prometh 02 se styrendivinylbenzen kopolymerem s prostorovou sítí 100 um, vychytává negativně nabité ligandy (nekonjugovaný bilirubin). Právě eliminace některých vazoaktivních substancí vázaných na albumin by mohla mít vliv na výše uvedené patofyziologické procesy [1, 4]. Provedení FPSA nebylo provázeno technickými problémy. Podmínkou byly vhodné cévní vstupy, které umožňovaly dostatečně rychlou cirkulaci v primárním oběhu, a nedocházelo tak ke srážení krve. Jako antikoagulans jsme použili heparin. Ani v jednom případě nedošlo k přerušení či ukončení pokusu z důvodů sražení krve v systému. Výhodou metody FPSA, oproti jiným nebiologickým eliminačním metodám používaným u ASJ, je fakt, že albumin s vázanými toxiny je přímo transportován na místo, na kterém jsou toxiny adsorbovány. Albumin není třeba do systému přidávat, a proto proces není limitován disociací z albuminu a difuzí tak, jak je tomu u předchozího nebiologického podpůrného přístroje MARS (molecular adsorbent recirculating system). Provoz metody FPSA je proto jednodušší a levnější.
FPSA u experimentálního ASJ a její vliv na hemodynamiku
V naší studii jsme v průběhu pokusu pozorovali signifikantní snížení SVRI a zvýšení HR a CI v kontrolní i léčené skupině, což koreluje s obrazem hemodynamických změn u ASJ [10].
V některých pracích bylo zaznamenáno signifikantní zvýšení MAP v průběhu terapie MARS [11, 12]. V naší studii jsme nenašli statisticky významný rozdíl v žádném relevantním hemodynamickém parametru v porovnávání léčené a kontrolní skupiny, což odpovídá popsanému obrazu hemodynamických změn při léčbě ASJ metodou FPSA [13]. Vzhledem k potvrzenému snížení ICP v experimentální práci s léčbou ASJ u velkého laboratorního zvířete [14] však nelze vyloučit, že k ovlivnění hemodynamických parametrů metodou FPSA dochází. V průběhu léčby FPSA bylo nutné kontinuálně podávat noradrenalin k udržení MAP jen v malých dávkách oproti skupině bez FPSA, rozdíl však nebyl statisticky signifikantní. Stejně tak možná eliminace vazoaktivních substancí (NO, prozánětlivé cytokiny) zodpovědných za rozvoj MODS metodou FPSA [15] potvrzuje domněnku ovlivnění hemodynamických parametrů v průběhu léčby FPSA. K potvrzení tohoto tvrzení je třeba provést další studie.
Závěr
Naše experimentální práce s léčbou akutního jaterního selhání pomocí přístroje Prometheus u velkého laboratorního zvířete neprokázala signifikantní změny hemodynamických parametrů.
Práce byla uskutečněna s podporou výzkumného projektu MO 8120 a Centra buněčné terapie a tkáňových náhrad LN00A065 (vedoucí prof. MUDr. E. Syková, DrSc.).
Adresa pro korespondenci:
MUDr. Eva Lásziková
ARO ÚVN Praha
U Vojenské nemocnice 1200
169 00 Praha 6
e-mail: eva.laszikova@uvn.cz
Sources
1. Laleman, W., Wilmer, A., Devenepoel, P., Elst, I. V., Zeegers, M., Zaman, Z., Verslype, C., Fevery, J., Nevens, F. Effect of the Molecular Adsorbent Recirculating System and Prometheus device on Systemic hemodynamics and Vasoactive Agents in Patiens with Acute-on-Chronic Alcoholic Liver Failure. Crit. Care, 2006, 10, 4, p. R108.
2. Rifai, K., Manns, M. P. Review Article: Clinical Experience With Prometheus. Ther. Apher. Dial, 2006, 10, 2, p. 132–137.
3. Ryska, M., Kieslichová, E., Pantoflíček, T., Ryska, O., Zazula, R., Skibová, J., Hájek, M. Devascularization Surigical Model of Acute Liver Failure in Minipigs. Eur. Surg. Res., 2004, 36, p. 179–184.
4. Rahman, T., Hodgson, H. Clinical management of acute hepatic failure. Intensive care Med., 2001, 27, p. 467–476.
5. Ytrebo, L. M., Sen, S., Pose, C., Davies, N. A. Nedredal, G. I., Fuskevaag, O. M., Ten Have, G. A., Prinzen, F. W., Williams, R., Deutz, N. E., Jalan, R., Revhaug, A. Systemic and regional hemodynamics in Pigs with acute Liver Failure and the Effect of albumin Dialysis. Scand. J. gastroenterol., 2006, 41, 11, p.1350–1360.
6. Kaptanoglu, L., Blei, A. T. Current status of liver support system. Clin. Liver. Dis., 2000, 4, p. 711–729.
7. Clemmesen, O., Ott, P., Larsen, F. S. Splanchnic Metabolism in Acute Liver Failure and Sepsis. Curr. Opin. Care, 2004, 10, 2, p. 152–155.
8. Murphy, N. D., Kodakat, S. K., Wendon, J. A., Jooste, C. A., Muesan, P., Rela, M., Heaton, N. D. Liver and Intestinale Lactate Metabolism in Patiens with Acute Liver Failure undergoing Liver Transplantation. Crit. Care Med., 2001, 29, 1, p. 2111–2118.
9. Newsome, P. N., Plevris, J. N., Nelson, L. J. Animal models of fulminant hepatic failure: A critical evaluation. Liver. Transplant., 2000, 1, p. 21–31.
10. Kieslichová, E., Ryska, M., Pantoflíček, T., Ryska, O., Zazula, R., Skibová, J. Hemodynamic Parameters in a Surgical Devascularisation Model of Fulminant Hepatic Failure in the Minipig. Physiol. Res., 2005, 54, p. 485–490.
11. Steiner, C., Mitzner, S. Experiences with MARS Liver Support Therapy in Liver Failure: Analysis of 176 Patients of the International MARS Registry. Liver, 2002, 22, p. 20–25.
12. Schmidt, L. E., Sorense, V. R., Svendsen, L. B., Hansen, B. A., Larsen, F. S. Hemodynamic Changes during a single Treatment with the Molecular Adsorbents recirculating System in Patiens with acute-on-chronic Livet Failure. Liver Transpl., 2001, 7,12, p. 1034–1039.
13. Dethloff, T., Tofteng, F., Frederiksen, H. J., Hojskov, M., Hansen, B. A., Larsen, F. S. Effect of Prometheus liver assist system on hemodynamics in patiens with cirrhosis: a randomized controlled study. World J. Gastroenterol., 2008, 14, 13, p. 2065–2071.
14. Ryska, M., Lásziková, E., Pantoflíček, T., Ryska, O., Pražák, J., Koblihová, E. Prometheus Significantly Decreases Intracranial Pressure on Acute Liver Failure. Experimental Study. Eur. Surg. Res., 2009, 42, 4, p. 230–235.
15. Stadlbauer, V., Krispen, P., Signet, B. et al. Effect of extracorporeal liver support by MARS and Prometheus on serum cytokines in acute-on-chronic liver failure. Crit. Care, 2006, 10, 6, p. R169.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 4-
All articles in this issue
- Pooperační bolesti v krku
- Dexmedetomidin v premedikaci před laparoskopickou cholecystektomií – prospektivní randomizovaná studie
- Fascie brachiálního plexu
- Frakcionovaná plazmatická separace a adsorpce neovlivňuje hemodynamické parametry u experimentálního akutního selhání jater
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pooperační bolesti v krku
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
- Fascie brachiálního plexu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

