-
Medical journals
- Career
Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
: Ročeň Milan 1; Kieslichová Eva 1; Merta Dušan 1; Pavlova Jelena 2; Čáp Jiří 1; Trunečka Pavel 3
: Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum IKEM, Praha 1; Oddělení imunogenetiky, Pracoviště laboratorních metod IKEM, Praha 2; Transplantcentrum IKEM, Praha 3
: Anest. intenziv. Med., 21, 2010, č. 4, s. 199-205
: Original Article
Cíl studie:
Přístroj Prometheus, založený na modifikované metodě frakcionované plazmatické separace a adsorpce, je používán pro přemostění k transplantaci u nemocných s akutním selháním jater. Protože terapeutický efekt není způsoben jen ovlivněním terminálních metabolitů, bylo cílem studie zjistit, jak metoda ovlivňuje hladiny cytokinů, markerů zánětu a regenerace. Rovněž byl sledován vliv na encefalopatii, hemodynamiku a dobu na čekací listině k transplantaci jater.Materiál a metoda:
Bylo sledováno 11 pacientů s akutním selháním jater. Tito pacienti podstoupili 37 terapeutických kúr na přístroji Prometheus. Byla sledována kinetika sérových koncentrací vybraných cytokinů, mediátorů zánětu a regenerace.Výsledky:
Před terapií byly nalezeny zvýšené hodnoty některých cytokinů a markerů zánětu. Během terapie došlo k signifikantnímu poklesu jen některých z nich. Naopak byl zaznamenán vzestup koncentrace hepatocytárního růstového faktoru. Metoda příznivě ovlivňuje encefalopatii a dobu transplantability vliv na hemodynamiku nebyl zaznamenán.Závěr:
Naše výsledky ukazují efektivitu přístroje Prometheus v odstraňování některých mediátorů zánětu a ovlivnění markerů zánětu a regenerace důležitých pří léčbě nemocných s akutním selháním jater.Klíčová slova:
akutní selhání jater – cytokiny – encefalopatie – markery zánětu – Prometheus – regeneraceÚvod
Akutní selhání jater (ASJ) je náhle vzniklé onemocnění způsobené zánikem hepatocytů u pacientů bez známek nemoci jater v předchorobí, charakterizované především vývojem jaterní encefalopatie, ikteru a koagulopatie. Tento patologický stav může dospět k multiorgánovému selhání (MOF) s vysokou mortalitou. I přes vývoj intenzivní péče a zavádění nových technologií podpůrné jaterní terapie je plně vyvinuté ASJ zatíženo 80% mortalitou. Mezi hlavní etiologické faktory patří virová hepatitida, toxiny nebo jaterní ischémie. V rámci akutního selhání jater se rozlišuje několik forem, a to podle časového intervalu mezi vznikem ikteru a rozvojem encefalopatie. U hyperakutního jaterního selhání je tento interval kratší než 7 dní, u akutního se pohybuje v rozmezí 7–28 dní a u subakutního je delší než 28 dní [1].
Toxiny, k jejichž masivnímu uvolnění dochází v rámci nespecifických obranných mechanismů organismu v přímé souvislosti s nekrózou jater, dále poškozují funkci jiných orgánů, a to především mozku, ledvin, plic, významnou měrou ovlivňují i kardiovaskulární systém [2, 3, 4, 5]. Může dojít k rozvoji systémové zánětlivé reakce (SIRS) a septického šoku.
Onemocnění je vzhledem k vysoké schopnosti regenerace jater do jisté míry potenciálně reverzibilní, nicméně pro většinu pacientů s ASJ představuje jedinou šanci na přežití provedení urgentní transplantace jater. Při rozhodování o prognóze jaterního selhání se užívá řada kritérií popisujících stav nemocného a základní anamnestická data. Selekční kritéria pro OTJ jsou založena na ukazatelích identifikujících nejhůře postižené s velmi špatnou prognózou při konzervativní terapii. Nejčastěji se užívají King’s College kritéria a Clichy kritéria [6]. Vzhledem k nedostatku vhodných orgánů však mnozí pacienti dříve zemřou nebo vyvinou kontraindikace k transplantaci, než se dočkají výkonu. Příčinou smrti jsou komplikace jaterního selhání, především nitrolební hypertenze a sepse. Faktorem, nejvíce ovlivňujícím přežití pacientů s akutním selháním jater, je čas.
Podpůrná přístrojová terapie jaterního selhání slouží k překlenutí doby čekání na možnost provedení OTJ nebo méně často doby, kdy může dojít ke spontánní regeneraci selhávajících jater. Cílem této terapie je odstranit toxické metabolity, amoniak, který je důležitým faktorem v rozvoji encefalopatie a rizikovým faktorem herniace mozkové tkáně, a prozánětlivé cytokiny uvolněné v souvislosti s nekrózou jaterní tkáně hrající roli v patogenezi SIRS a syndromu multiorgánové dysfunkce (MODS).
Obecné terapeutické cíle při použití přístrojové podpory u akutního selhání jater jsou:
- podpora funkce jater do spontánního zlepšení stavu bez nutnosti transplantace,
- bridging (přemostění) k transplantaci,
- podpora funkce jater při primární dysfunkci štěpu po transplantaci.
Prometheus (Fresenius Medical Care AG, Bad Homburg, Německo) je jedním z nejčastěji v Evropě užívaných arteficiálních systémů na podporu funkce jater. Principem eliminační techniky u tohoto systému je frakcionovaná plazmatická separace a adsorpce (FPSA). Přístroj se skládá z dialyzačního přístroje (FMC 4008H) rozšířeného o modul pro frakcionovanou plazmatickou separaci s albuminovým filtrem a dvěma adsorbéry [7, 8]. Albu-flow filtr s polysulfonovou membránou propouští molekuly do 250 kD včetně albuminu. Plazmatická frakce obsahující albumin prochází do dalšího okruhu s neutrálním pryskyřičným adsorbérem Prometh 1 adsorbujícím žlučové kyseliny, aromatické aminokyseliny, fenolické substance a toxiny, a s iontovým výměníkem Prometh 2 se styrendivinylbenzen kopolymerem, který vychytá negativně nabité ligandy (nekonjugovaný bilirubin). Tímto způsobem jsou z plazmy odstraněny toxiny vázané na albumin. Ve vodě rozpustné substance (amoniak) jsou odstraňovány dialýzou plné krve.
V klinické praxi se na začátku terapie akutního jaterního selhání provádí FPSA eliminace častěji, v případě nutnosti i denně. Postupně, po stabilizaci stavu, přibližně 2–3krát týdně do reparace jaterní tkáně nebo možnosti provedení OTJ. Doba trvání kúry je dána adsorpční kapacitou, která v čase klesá. Doba trvání je softwarově upravena až na 10 hodin, kúru lze případně ještě prodloužit. Jako optimální antikoagulace se ukázala regionální citrátová antikoagulace, u které bylo prokázáno mnohem méně komplikací v porovnání se systémovou antikoagulací heparinem. Velkou výhodou přístroje Prometheus je možnost současné náhrady funkce jater i ledvin, neboť jaterní selhání je často provázené selháním ledvin a rozvojem hepatorenálního syndromu.
Mezi kontraindikace FPSA eliminace patří nekontrolovatelné krvácení, DIC a výrazná trombocytopenie, dále významná hemodynamická nestabilita nebo septikémie. Tyto kontraindikace jsou jen relativní, indikace FPSA závisí především na klinickém stavu pacienta.
Pozitivní terapeutický vliv FPSA na pacienty s jaterním selháním je způsoben nejen snížením hladin koncových metabolitů (urea, kreatinin, amoniak, bilirubin), ale i ovlivněním hladin cirkulujících markerů zánětu a endotoxinů, uvolněných v souvislosti s nekrózou jaterní tkáně podílejících se na rozvoji SIRS a vedoucích k MODS. Lze předpokládat, že dochází k neselektivnímu vychytávání nejen prozánětlivých, ale i protizánětlivých substancí tak, jako k němu dochází i u jiných adsorpčních metod [9, 10, 11].
Znalost dynamiky markerů regenerace je důležitá nejen pro sledování efektu léčby, ale i pro odhalování pacientů, u kterých může dojít ke spontánní regeneraci jater bez nutnosti provedení OTJ.
Studie se týká pouze pacientů s AJS, nezahrnuje pacienty s akutním selháním na chronickém podkladě (acute on chronic), kterými se zabývá většina dosavadních publikací [12, 13].
Předpokládáme, že vzhledem k neselektivitě této adsorpční metody ovlivňuje FPSA koncentrace celé řady tkáňových působků, které hrají důležitou roli pro průběh onemocnění, nebo slouží jako důležité diagnostické markery. Cílem studie bylo zjistit, do jaké míry ovlivňuje terapie FPSA hladiny mediátorů zánětu a markerů regenerace jaterních buněk.
Soubor pacientů a metoda
Intervenční prospektivní studie byla posouzena etickou komisí a všechny procedury byly prováděny v souladu s Helsinskou deklarací (2000). Podmínkou zařazení do studie byl podpis srozumitelného informovaného souhlasu s terapeutickým postupem. Všichni pacienti s ASJ splňovali kritéria zařazení na čekací listinu (WL: waiting list) k OTJ v urgentním pořadí. Eliminační kúry na přístroji Prometheus byly prováděny za použití regionální citrátové antikoagulace.
Před zahájením procesu FPSA a během něj byli všichni nemocní stejným způsobem klinicky i laboratorně monitorováni. Z klinických parametrů bylo prováděno skórování APACHE II, SOFA skóre, u pacientů při vědomí byl sledován stupeň encefalopatie (čtyřstupňová škála), u sedovaných nitrolební tlak (ICP), byly zaznamenány vybrané hemodynamické parametry, a to tepová frekvence (TF), střední arteriální tlak (MAP), centrální žilní tlak (CVP) v případě rozšířeného monitorování hemodynamiky také srdeční index (CI) a indexovaná systémová vaskulární rezistence (SVRI), a dávka katecholaminů (noradrenalin).
K získání laboratorních dat byly před zahájením a po skončení terapeutické kúry odebírány vzorky venózní krve pacientů (po 9 ml), z nichž bylo bezprostředně po odběru odstředěním izolováno a zmrazeno krevní sérum. Do konečného zpracování byl materiál uchováván v mrazícím boxu při teplotě -40 °C. Ve všech odebraných vzorcích séra byly metodou ELISA stanovovány sérové hladiny chemokinů (IL 1a, IL 6, IL 8, IL 10, IL 12, IL18, TNF alfa, HGF a alfa1-fetoprotein), a dále hodnoty PCT a CRP.
Pro simultánní detekci koncentrací zvolených cytokinů (IL 1a, IL 6, IL 8, IL 10, 1L 12, 1L 18, HGF a TNF-alfa byl použit Luminex-based xMAP multiplex bead system (RD Systems, Minneapolis, USA). Technické provedení imunologické reakce bylo provedeno podle návodu výrobce. Fluorescence imunočástic byla měřena přístrojem Luminex100 IS 2,3 a hodnocena příslušným software, za pomoci standardních křivek získaných analýzou lidských rekombinantních cytokinů.
Prokalcitonin byl stanovován z krevního séra imunosoupravou Elecsys BRAHMS PCT (na základě elektrochemiluminiscenčního imunostanovení „ECLIA“) pro in vitro stanovení PCT v lidském séru a plazmě.
Před eliminační procedurou a po jejím skončení byl u sledovaných pacientů stanoven počet trombocytů a vybrané laboratorní parametry: sérový bilirubin přímý i nepřímý, sérové koncentrace AST, ALT, laktátu, amoniaku, CRP, albuminu. Laboratorní stanovování bylo prováděno na přístrojích Architect c16000 (Abbott Laboratories, Abbott Park, Illinois, USA).
Vzhledem k očekávané malé frekvenci nemocných s ASJ nebylo možno vytvořit kontrolní (neintervenční) skupinu. Alespoň pro rámcové porovnání vlivu léčby na délku období, kdy je pacient transplantabilní, tedy v dostatečně stabilizovaném stavu schopen podstoupit výkon, byla retrospektivně zpracována skupina pacientů, kteří byli zařazeni na čekací listinu k OTJ před zahájením studie v desetiletém rozmezí (1995–2005). Doba na čekací listině od zařazení až k provedení OTJ byla porovnána v obou skupinách.
Hodnoty sérových koncentrací každé sledované látky před a po terapii byly vyjádřeny jako průměry se směrodatnou odchylkou (v případě nerovnoměrného rozložení dat jako medián). Změna sérových koncentrací v čase byla graficky znázorněna pomocí krabicových grafů. Statistické hodnocení změn kinetiky sérových koncentrací sledovaných cytokinů, biochemických testů a klinických dat v průběhu jednotlivých léčebných procedur bylo provedeno metodou párových t-testů a neparametrického testu Mannova-Whitneyova. Statistické zpracování dat bylo provedeno pomocí programu Statistica v.8 (StatSoft).
Výsledky
Do historické skupiny 10 let před zahájením terapie přístrojem Prometheus (1995–2005) bylo zařazeno celkem 31 pacientů splňujících kritéria pro zařazení na čekací listinu k urgentní OTJ. U 22 z nich byla transplantace provedena. Jednalo se o 5 mužů a 17 žen, průměrný věk těchto pacientů byl 26,9 ± 11,7 roku, na čekací listině strávili v průměru 2,7 dne. Šest pacientů zemřelo po zařazení na WL v době čekání na vhodný štěp. Jednalo se o jednoho muže a pět žen v průměrném věku 26,7 ± 12,3 roku. Tito nemocní strávili na čekací listině v průměru 2,5 dne. Tři pacienti byli z čekací listiny vyřazeni (1 muž a 2 ženy, průměrný věk 32,6 ± 7,8 roku), v průměru po 2,7 dne od zařazení z důvodu reparace jaterních funkcí. V porovnání s historickou skupinou došlo při použití eliminační metody FPSA na přístroji Prometheus k signifikantnímu prodloužení doby na čekací listině, a tedy prodloužení období transplantability pacientů s ASJ (obr. 1).
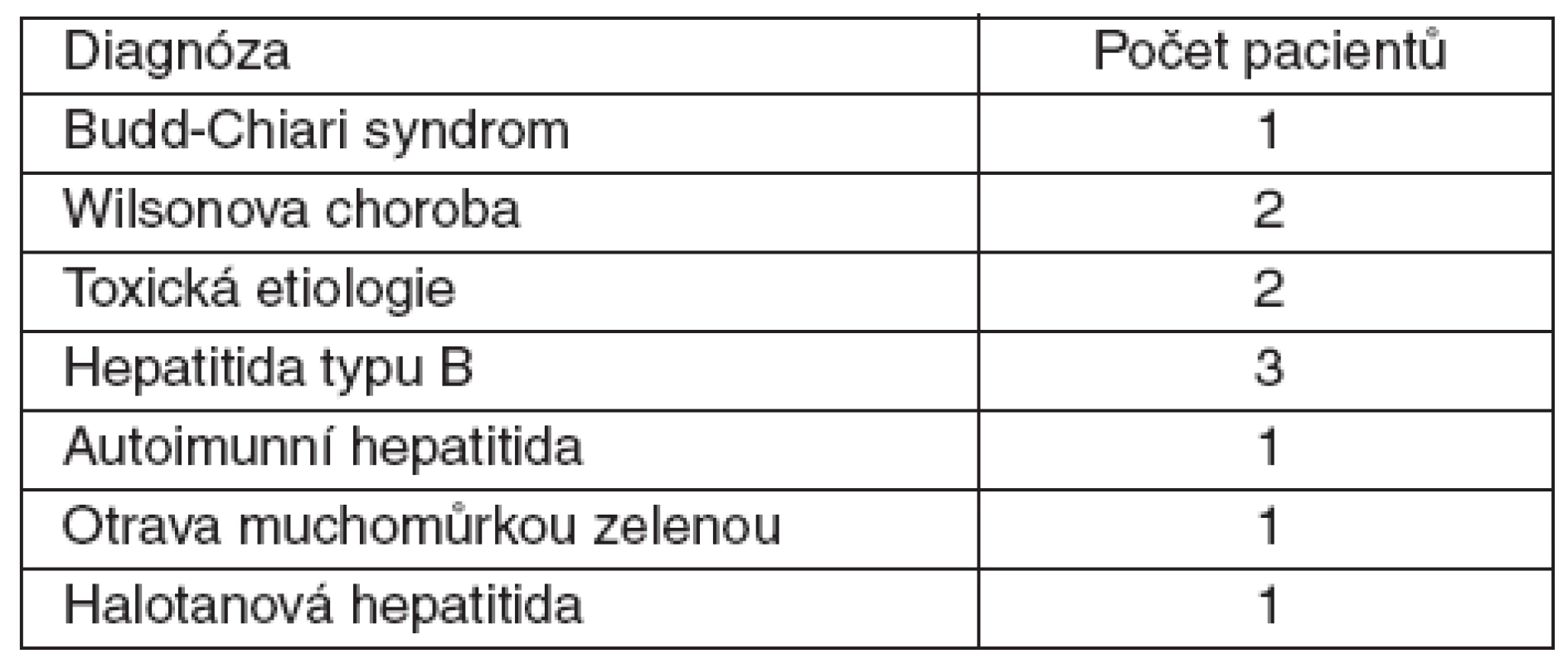
Intervenční skupinu tvořilo 11 pacientů, a to tři muži a osm žen, průměrný věk byl 39,6 ± 12,1 roku, medián 37 roků. Celkem bylo provedeno 37 terapeutických kúr, průměrně 3,4 ± 3,8, medián 2,0 na jednoho pacienta. Doba trvání jedné kúry byla 10,9 ± 2,0 hodiny. Průměrná doba strávená na čekací listině byla u těchto pacientů 7,5 ± 8,1 dne, medián 4,5 dne. Transplantace jater byla provedena u 9 z nich, v jednom případě došlo ke spontánní reparaci jaterních funkcí, 1 pacient zemřel. Podíl diagnóz je zobrazen v tabulce 1.
Průměrná vstupní hodnota APACHE II skóre u sledované skupiny byla 14,2 ± 8,1, SOFA před každou jednotlivou kúrou 12,7 ± 5,6.
Před zahájením terapie FPSA a po již proběhlé terapii byl v rámci sledování neurologického stavu nemocných zařazených do intervenční skupiny zaznamenáván stupeň encefalopatie, v případě nutnosti UPV a sedace, byla monitorována hodnota ICP. Před zahájením FPSA byl průměrný stupeň encefalopatie pacientů (n = 5) 1,47 ± 1,35 a po skončení 1,21 ± 1,40, rozdíl těchto hodnot dosahuje statistické významnosti (p ≤ 0,05). Průměrná hodnota ICP u pacientů (n = 6) před FPSA byla 10,7 ± 7,7 mm Hg a po skončení 11,0 ± 7,0 mm Hg, rozdíl těchto hodnot však nebyl statisticky významný. Výsledky ukazují, že v souvislosti s terapií FPSA došlo ke snížení stupně encefalopatie pacientů s ASJ zařazených na WL k transplantaci jater.
Stejným způsobem byly u sledovaných pacientů monitorovány parametry hemodynamiky, a to MAP, TF, CVP, CI, SVRI a dávka katecholaminů (noradrenalin). Průměrná hodnota MAP před zahájením FPSA byla 84,8 ± 13,0 mm Hg a po jejím skončení 87,4 ± 12,5 mm Hg, TF před FPSA 90,6 ± 11,3 t . min-1 a po skončení 87,4 ± 15,9 t . min-1. Průměrná hodnota CVP před zahájením FPSA byla 7,3 ± 4,1 mm Hg a po něm 7,9 ± 3,9 mm Hg, CI před FPSA 3,8 ± 1,1 l . min-1 . m-2 a po skončení 3,5 ± 1,0 l . min-1 . m-2, průměrná SVRI před FPSA byla 1684 ± 690 dyn. s. cm-5 . m-2 a po skončení 1912 ± 908 dyn.s.cm-5 . m-2. Dávka noradrenalinu za účelem udržení uspokojivého středního arteriálního tlaku (MAP > 65 mm Hg) byla před zahájením FPSA v průměru 0,18 µg . kg-1 . min-1 (rozmezí 0,00–2,80 µg . kg-1 . min-1) a po skončení terapie FPSA 0,10 µg . kg-1 . min-1 (rozmezí 0,00–1,04 µg . kg-1 . min-1). Naše výsledky neprokázaly statisticky významný efekt terapie FPSA na hemodynamiku, ani jeden ze sledovaných hemodynamických parametrů nebyl v souvislosti s terapií FPSA statisticky významně ovlivněn.
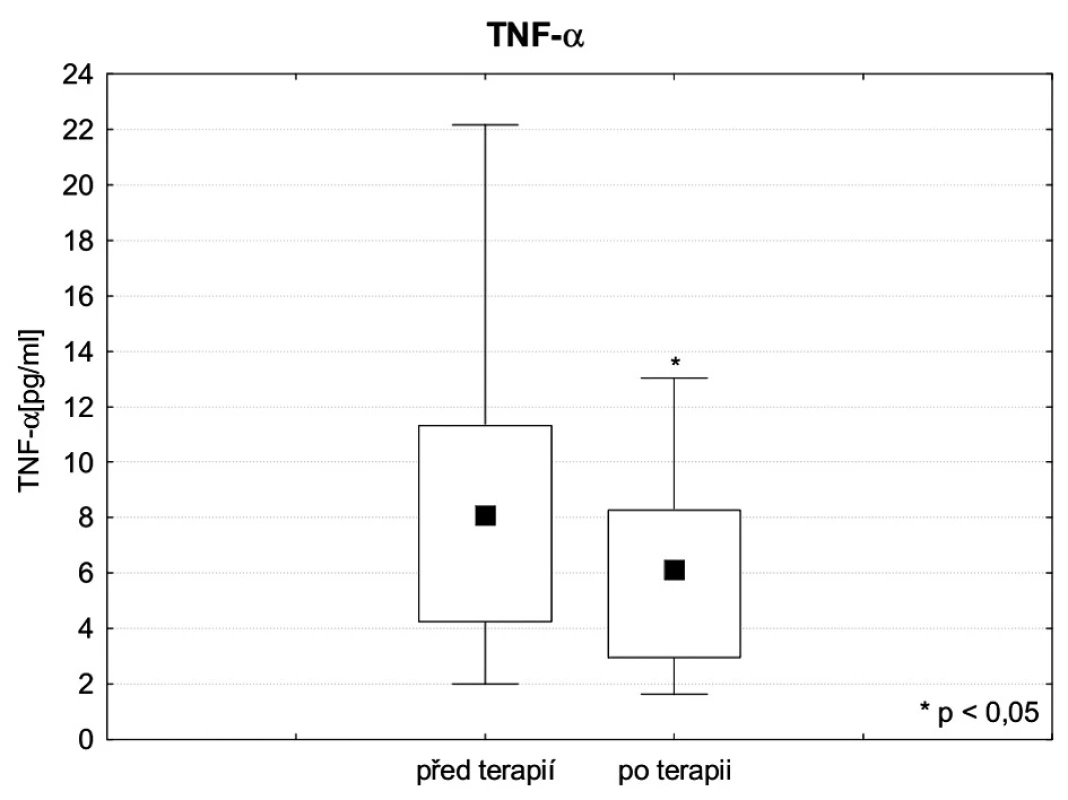
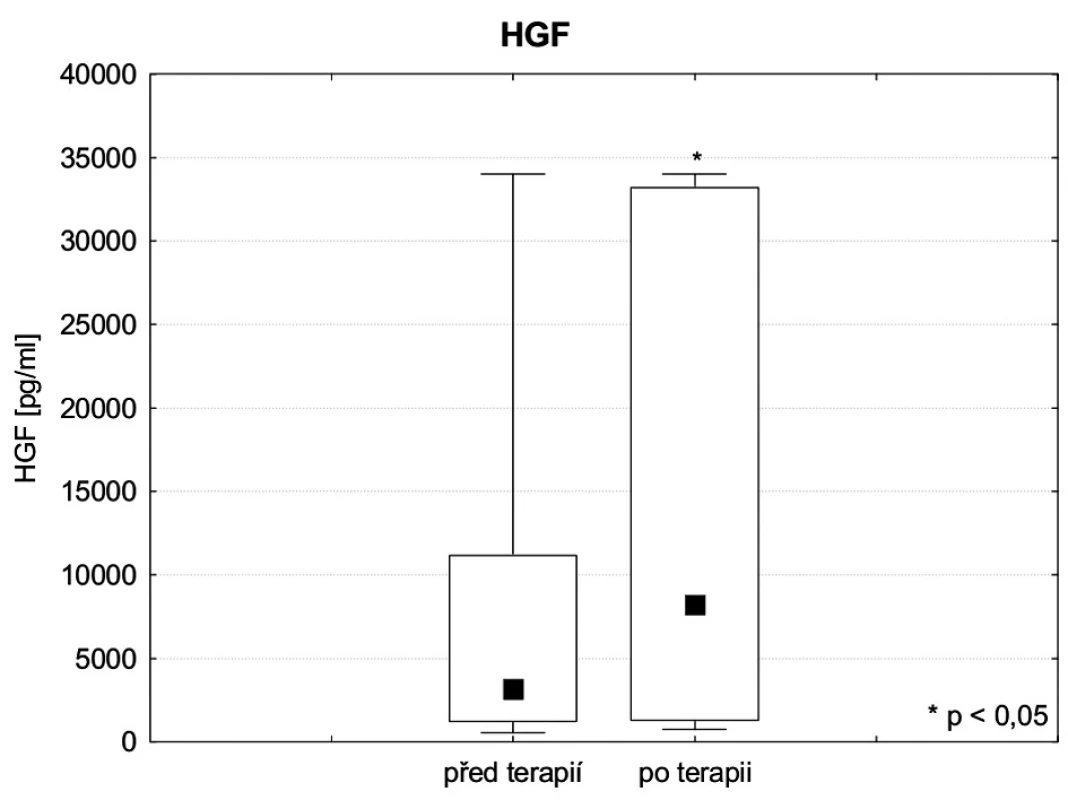
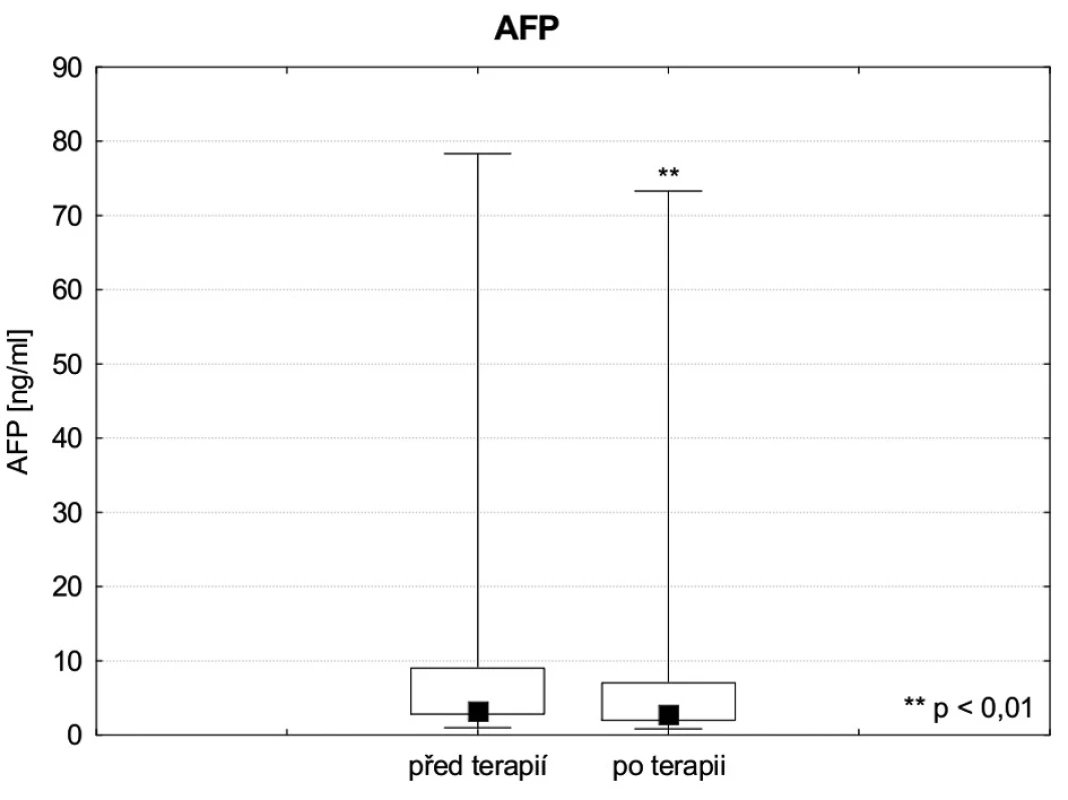
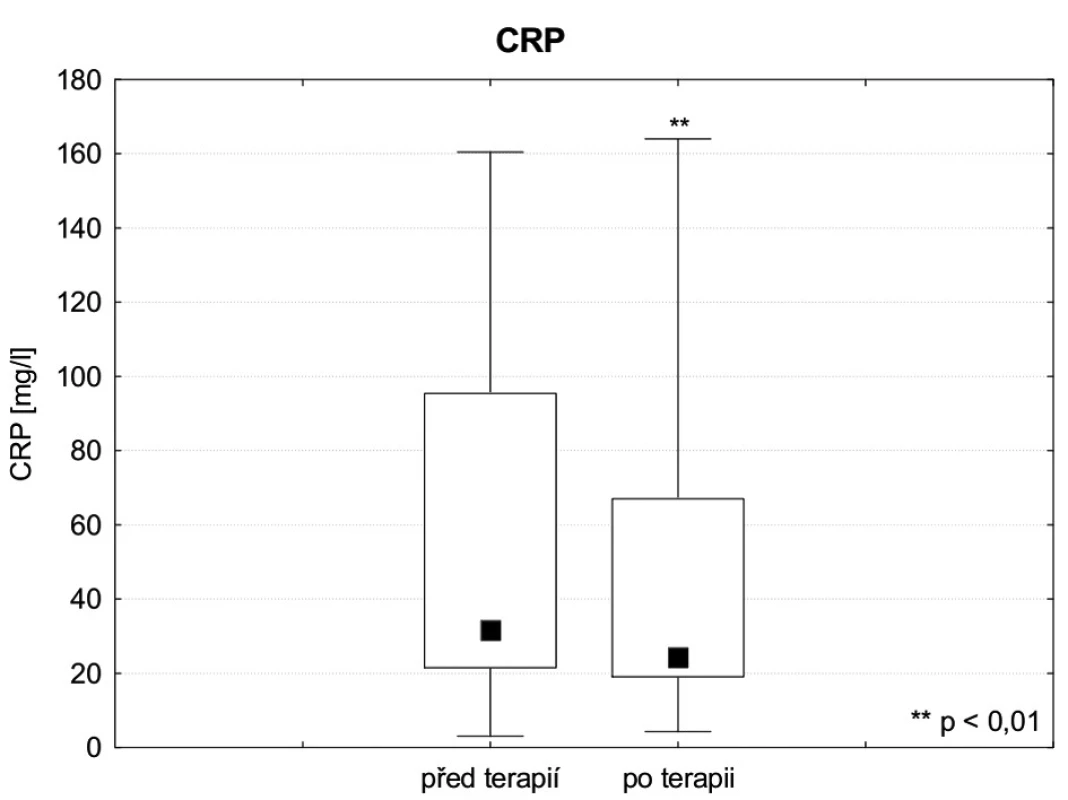
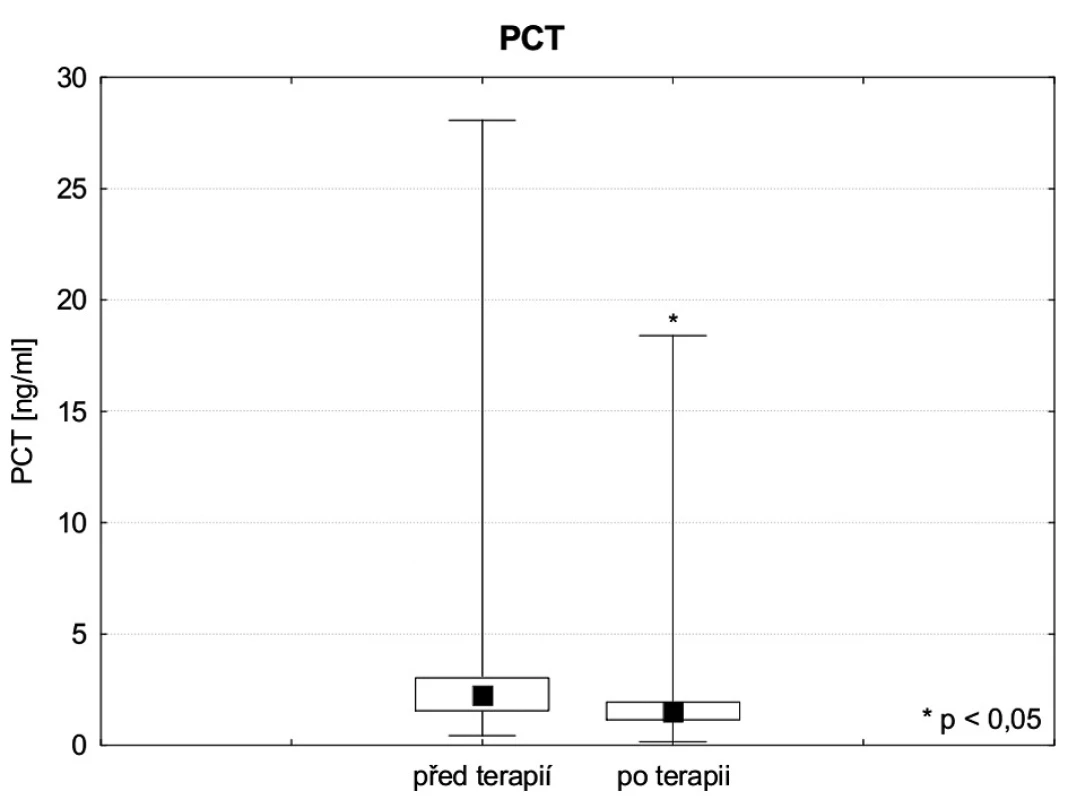
Sérové koncentrace (IL 1a , IL 6, IL8, IL 10, IL 12, IL18, TNF, HGF AFP, PCT a CRP) byly stanoveny před zahájením a po skončení terapie FPSA. Hladiny IL 1a, IL 12, IL18 byly ve fyziologických mezích. Sérová koncentrace IL-6 před zahájením FPSA byla v průměru 589,5 ± 2192,0 medián 21,1 pg . ml-1 a po skončení 796,5 ± 3056,8 medián 20,2 pg . ml-1, hodnota IL-8 před FPSA 470,0 ± 1466,8, medián 90,3 pg . ml-1 a po 115,9 ± 87,2, medián 92,8 pg . ml-1, a hodnota IL-10 před FPSA 27,8 ± 79,3, medián 8,3 pg . ml-1 a po skončení 10,8 ± 10,8, medián 6,7 pg . ml-1. Podle zjištěných výsledků eliminační kúra FPSA koncentrace těchto cytokinů ani v jednom případě významně neovlivnila. Naopak, průměrná sérová koncentrace TNF-alfa před zahájením FPSA byla 8,09 ± 4,8 pg . ml-1 a po skončení 5,54 ± 2,9 pg . ml-1, přičemž tento rozdíl dosahuje statistické významnosti (p ≤ 0,05) – obrázek 2. Průměrná koncentrace HGF před zahájením terapie byla 8158,4 ± 10746,3, medián 3141,0 pg . ml-1, po skončení 15495,4 ± 15047,5, medián 8214,0 pg . ml-1, tento rozdíl je statisticky významný (p ≤ 0,05), hladiny AFP před FPSA a po ní (10,15 ± 18,07 medián 3,23 ng . ml-1, respektive 8,63 ± 16,97, medián 2,72 ng . ml-1) byly rovněž významně změněny (p ≤ 0,01). Z výsledků je patrné, že eliminace FPSA významně ovlivnila hodnoty obou markerů regenerace, HGF i AFP – obrázky 3 a 4. Průměrná hodnota PCT sledovaných pacientů byla před zahájením FPSA 3,82 ± 5,85, medián 2,23 ng . ml-1, po skončení terapie 2,70 ± 3,91, medián 1,50 ng . ml-1, hodnota CRP pak před zahájením 53,23 ± 49,38 mg . ml-1 a po skončení 43,95 ± 41,72 mg . ml-1. Rozdíly hodnot obou těchto zánětlivých markerů před zahájením a po skončení eliminace FPSA dosahují statistické významnosti (p ≤ 0,01) a lze tedy shrnout, že FPSA významně ovlivňuje jejich sérovou koncentraci (obr. 5, 6).
Průměrný počet trombocytů nemocných před zahájením eliminace 124,4 ± 71,3 x 109 . l-1 se po jejím skončení významně snížil na 109,0 ± 62,5 . 109 . l-1 (p ≤ 0,01). FPSA mělo dále za následek významné snížení hodnot celkového i přímého bilirubinu. Průměrné hodnoty celkového bilirubinu byly před FPSA 464,98 ± 251,97 μmol . l-1 a po skončení 297,62 ± 164,97 μmol . l-1, přímého před zahájením FPSA 253,79 ± 157,55 μmol . l-1 a po ukončení 160,21 ± 123,06 μmol . l-1, tyto rozdíly jsou statisticky významné (p ≤ 0,01). Průměrná sérová hodnota AST nebyla zavedením FPSA významně ovlivněna (10,31 ± 17,89, medián 3,53 μkat . l-1 před zahájením a 6,99 ± 9,64, medián 3,37 μkat . l-1 po skončení procedury), naopak hodnota ALT se po proběhlé eliminaci významně snížila (11,04 ± 19,69, medián 3,31 μkat . l-1 před FPSA a 7,39 ± 12,30, medián 3,11μkat . l-1 po jeho skončení, p ≤ 0,05). FPSA neovlivnila plazmatickou hladinu laktátu ve sledované skupině pacientů. Před zahájením eliminace byla průměrná hodnota 3,26 ± 3,33, medián 2,15 mmol . l-1 a po skončení 2,88 ± 3,49, medián 1,85 mmol . l-1, tyto hodnoty nevykazují statisticky významný rozdíl. Naopak, amonémie byla po skončení FPSA eliminace u všech sledovaných nemocných významně snížena, průměrná amonémie před zahájením dosahovala 86,13 ± 69,85 μmol . l-1 a po skončení 72,23 ± 44,61 μmol . l-1, pokles hodnot byl statisticky významný (p ≤ 0,05). FPSA neměla vliv na hodnoty albuminu nemocných s jaterním selháním. Průměrná sérová koncentrace albuminu dosahovala před zahájením FPSA 24,75 ± 4,54 g . l-1 a po skončení 23,84 ± 5,26 g . l-1. Posledním ze sledovaných parametrů byly sérové koncentrace urey a kreatininu, odrážející úroveň renálních funkcí sledovaných pacientů. Před zahájením kúry FPSA byly průměrné hodnoty urey 9,38 ± 4,91 mmol . l-1 a kreatininu 127,54 ± 97,94 μmol . l-1, po skončení eliminace 2,87 ± 1,54 mmol . l-1 a 60,76 ± 35,16 μmol . l-1. Snížení hodnot urey i kreatininu účinkem FPSA je statisticky signifikantní (p ≤ 0,01), FPSA s dialyzačním modulem tedy účinně nahrazuje eliminační funkci ledvin.
Diskuse
Porovnávání dvou skupin pacientů z různého časového období je diskutabilní. Kritéria zařazení na čekací listinu byla sice shodná, nicméně způsob monitorování a metody orgánové podpory mohou vykazovat rozdíly. Historickou i intervenční skupinu tvořili pacienti středního věku, s mírnou převahou žen. V porovnání s historickou skupinou došlo při použití eliminační metody FPSA na přístroji Prometheus k signifikantnímu prodloužení doby na čekací listině, vedoucí k prodloužení období transplantability a tím i zvýšení počtu pacientů s ASJ, kteří se transplantace dočkali. Klinické hodnocení stavu sledovaných pacientů s akutním jaterním selháním pomocí skórovacích schémat (APACHE II, SOFA) odpovídá závažnému stavu s vysokou morbiditou a mortalitou.
Provedená studie prokázala příznivý vliv kúry FPSA na průběh encefalopatie, jak bylo prokázáno v dříve publikovaných pracích [14, 15], sledovanou skupinu však tvořilo jen 6 pacientů a hodnocení encefalopatie může být poznamenáno subjektivním pohledem hodnotitele. Pacienti s progresí encefalopatie do stupně III byli intubováni, sedováni, na umělé plicní ventilaci a u všech těchto nemocných byl monitorován ICP. Vliv FPSA na pokles ICP se v našem souboru prokázat nepodařilo. Je však nutné brát v úvahu malý počet pacientů, u kterých byl ICP monitorován.
Vliv FPSA na hemodynamiku lze hodnotit jen velmi obtížně. Eliminační procedura je relativně dlouhá (v průměru téměř 11 hod.) a hemodynamika podléhá celé řadě dalších faktorů, které nemají souvislost s eliminační metodou, nicméně ovlivňují stav oběhu. Jedná se např. o změnu tělesné teploty, objemovou terapii, korekci koagulační poruchy podáváním zmrazené plazmy apod. Samotná terapie ovlivňuje krevní oběh několika mechanismy. Úroveň ultrafiltrace reguluje volémii, nastavení teploty systémovou vaskulární rezistenci, a tím i krevní tlak a potřebu vazopresorů. V souladu se zjištěními Lalemana [16], která ale vycházela z hodnocení pacientů s akutní exacerbací alkoholického jaterního selhání, se nepodařilo prokázat vliv na hemodynamické parametry.
Výsledky provedené studie ukazují signifikantní pokles TNF-alfa na rozdíl od výsledků studií Stadlbauera a Rifaie, provedených u pacientů s akutním selháním jater na chronickém podkladě [12, 13]. Rozdíl může být způsoben i užitím jiných metod k laboratornímu stanovení těchto parametrů. Pokles hodnot zánětlivých markerů CRP a PCT při FPSA je nutno zohlednit v diferenciální diagnostice SIRS a sepse. Vzhledem ke snížené syntetické funkci selhávajících jater není CRP při ASJ vhodným laboratorním markerem infekce. Prokalcitonin je díky vyšší senzitivitě i specificitě markerem vhodnějším, nicméně je specifický pro bakteriální infekci, kdežto u ASJ je vysoká incidence mykotických infekcí. Odstraňování PCT během CRRT bylo již popsáno [17]. Metodou FPSA dochází k odstraňování alfa1-fetoproteinu, oproti tomu byl zaznamenán vzestup HGF. Vzestup HGF během terapie nelze jednoznačně interpretovat, je pravděpodobně způsoben degranulací z aktivovaných polymorfonukleárních lymfocytů, vliv může mít snížení koncentrace TNF-alfa. Vyšší plazmatická koncentrace HGF by mohla být způsobena zlepšením podmínek pro regeneraci jaterní tkáně, sama může mít na jaterní tkáň protektivní efekt (ochrana hepatocytů před apopotózou, protizánětlivý efekt) [18]. Na základě získaných dat nelze spolehlivě hodnotit dopad zvýšení koncentrace HGF na potřebu transplantace jater. Plazmatická koncentrace HGF je dobrým markerem regenerace jaterní tkáně, nicméně rozhodnutí, zda v konkrétním případě transplantovat, nebo čekat na reparaci, je možné jedině zhodnocením funkčních jaterních testů a celkového klinického stavu.
Bilirubin jak přímý, tak i nepřímý je metodou FPSA odstraňován, a to významně, v souladu s dříve publikovanými daty [7, 8]. Pokles bilirubinu může mít pozitivní vliv na regeneraci jater [19]. Albumin sice zůstává součástí plazmatické frakce v sekundárním okruhu, nicméně pokles není signifikantní.
Pokles trombocytů v systému, k němuž došlo i přes pečlivě monitorovanou antikoagulaci citrátem, lze vysvětlit tvorbou mikrotrombů v krevní části okruhu. Protrombinový čas a hladiny koagulačních faktorů nebyly hodnoceny jako měřítko syntetické funkce jater, protože získané výsledky by byly ovlivněny terapeutickým podáním zmrazené plazmy, popř. koncentrátu faktorů protrombinového komplexu.
Signifikantní snížení sérové koncentrace urey a kreatininu není překvapením, jedná se o modifikovaný dialyzační přístroj a látky ve vodě rozpustné o malé molekulové hmotnosti jsou dobře dialyzovány. Totéž platí i pro amoniak.
Delší terapeutická kúra (průměr téměř 11 hod.) byla zvolena za účelem dosažení pomalejších změn ve vnitřním prostředí u kriticky nemocných pacientů a udržení jejich oběhové stability.
Závěr
Eliminační kúra přístrojem Prometheus je podpůrnou terapií v léčbě akutního selhání jater. Vzhledem k principu této metody nepředstavuje ideální náhradu jaterních funkcí, nahrazuje pouze detoxikační funkci jater. V průběhu terapie FPSA došlo k významnému snížení stupně encefalopatie. Přesto, že se nepodařilo prokázat vliv na ICP a oběhové parametry, podařilo se signifikantně prodloužit klíčovou dobu tzv. terapeutického okna, potřebného k získání času pro provedení transplantace jater nebo k jejich spontánní regeneraci. Ve sledovaném souboru pacientů se podařilo prokázat, že během podpůrné terapie jaterního selhání přístrojem Prometheus dochází ke statisticky významnému snížení sérových koncentrací bilirubinu, urey, kreatininu, amoniaku, cytokinu TNF-alfa, markerů zánětu CRP a PCT. HGF není ve statisticky významném měřítku odstraňován adsorpcí, terapie přístrojem Prometheus vede naopak ke zvýšení hladin HGF, toto zvýšení by mohlo být z hlediska regenerace jater výhodné.
Podporováno grantem Ministerstva zdravotnictví České republiky IGA NR 9405.
Adresa pro korespondenci:
MUDr. Milan Ročeň
Klinika anesteziologie, resuscitace a intenzivní péče
Transplantcentrum IKEM
Vídeňská 1958/9
140 21, Praha 4
e-mail: mirc@medicon.cz
Sources
1. O´Grady, J. G., Schalm, S. W., Williams, R. Acute liver failure: Redefining the syndromes. Lancet, 1993, p. 273–275.
2. Sekiyama, K. D., Yoshiba, M., Thomson, A. W. Circulating proinflammatory cytokines (IL-1 beta, TNF-alpha, and IL-6) and IL-1 receptor antagonist (IL1Ra) in fulminant hepatic failure and acute hepatitis. Clin. Exp. Immunol., 1994, p. 71–77.
3. Muto,Y., Nouri-Aria, K. T., Meager, A. et al. Enhanced tumour necrosis factor and interleukin-1 in fulminant hepatic failure. Lancet,1988, p. 72–74.
4. Sheron, N., Goka, J., Wendon, J. A. et al. Highly elevated plasma cytokines in FHF: Correlations with multiorgan failure and death. Hepatology, 1990, p. 939.
5. Simpson, K. J. Cytokines, for better or worse? Eur. J. Gastroenterol. Hepatol., 1999, p. 957–966.
6. O’Grady, J. G., Alexander, G. J., Hayllar, K. M. et al. Early indicators of prognosis in fulminant hepatic failure. Gastroenterology, 1989, p. 439–445.
7. Rifai, K., Ernst, T., Kretschmer, U. et al. Prometheus – new extracoporeal system for treatment of liver failure. J. Hepatol., 2003, p. 984–990.
8. Falkenhagen, D., Strobl, W., Vogt, G. et al. Fractioned plasma separation and adsorption system: A novel system for blood purification to remove albumin bound substance. Artif. Organs, 1999, p. 81–86.
9. Bellomo, R., Tetta, C., Ronco, C. et al. Coupled plasma filtration adsorption. Int. Care Med., 2003, p. 1222–1228.
10. Winchester, J. F., Kellum, J. A., Ronco, C. et al. Sorbents in acute renal failure and the systemic inflammatory response syndrome. Blood Purif, 2003, p. 79–84
11. Tetta, C., Cavaillon, J. M., Schultze, M. et al. Removal of cytokines and activated komplement components in an experimental model of continuous plasma filtration coupled with sorbent adsorption. Nephrol. Dial. Transplant., 1998, p. 1458–1464.
12. Stadlbauer, V., Krisper, P., Aigner, R. et al. Effect of extracorporeal liver support by MARS and Prometheus on serum cytokines in acute-on-chronic liver failure. Critical Care, 2006, p. 169.
13. Rifai, K., Ernst, T., Kretschmer, U. et al. Removal selectivity of Prometheus: A new extracorporeal liver support device. World J. Gastroenterol., 2006, p. 940.
14. Parés, A., Deulofeu, R., Cisneros, L. et al. Albumin dialysis improves hepatic encephalopathy and decreases circulating phenolic aromatic amino acids in patients with alcoholic hepatitis and severe liver failure. Crit. Care, 2009, p. 8.
15. Bustamante, J., Rimola, A., Ventura, J. P. et al. Prognostic significance of hepatic encephalopathy in patients with cirrhosis. J.Hepatol., 1999, p. 890–895.
16. Laleman, W., Wilmer, A., Evenepoel, P. et al. Effect of the molecular adsorbent recirculating system and Prometheus devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit. Care, 2006, p. 108.
17. Level, C., Chauveau, P., Guisset, O. et al. Mass transfer, clearance and plasma concentration of procalcitonin during continuous venovenous hemofiltration in patients with septic shock and acute oliguric renal failure. Crit. Care, 2003, p. 160–166.
18. Matsushima, A., Ogura, H., Koh, T. et al. Hepatocyte Growth Factor in polymorphonuclear leukocytes is increased in patients with Systemic Inflammatory Response Syndrome. J. Trauma, 2004, p. 259–264.
19. Chamuleau, R. A., Aronson, D. C., Frederiks, W. M. et al. Liver regeneration after partial hepatectomy in rats with defective bilirubin conjugation or biliary excretion. Dig. Dis. Sci., 1991, p. 510–551.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 4-
All articles in this issue
- Postoperative sore throat
- Dexmedetomidine in premedication before laparoscopic cholecystectomy: Prospective randomised study
- Brachial plexus fascias
- Fractioned plasmatic separation and adsorption has no influence on the haemodynamic parameters in experimental acute liver failure
- Prometheus therapy in patients with acute liver failure – the effect on the inflammation and regeneration markers
- Prometheus – a new therapeutic option in liver failure in children
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postoperative sore throat
- Prometheus therapy in patients with acute liver failure – the effect on the inflammation and regeneration markers
- Prometheus – a new therapeutic option in liver failure in children
- Brachial plexus fascias
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career