-
Medical journals
- Career
Dexmedetomidin v premedikaci před laparoskopickou cholecystektomií – prospektivní randomizovaná studie
Authors: Málek Jiří 1; Mareček František 1; Hess Ladislav 2; Votava Martin 3; Kurzová Alice 1; Očadlík Martin 4
Authors‘ workplace: Klinika anesteziologie a resuscitace 3. LF UK a FNKV, Praha, 2Pracoviště experimentální medicíny IKEM, Praha, 3Ústav farmakologie 3. LF UK, Praha, 4Chirurgická klinika 3. LF UK a FNKV, Praha 1
Published in: Anest. intenziv. Med., 21, 2010, č. 4, s. 179-184
Category: Original Article
Overview
Cíl studie:
Alfa-2 sympatomimetika se stále častěji používají v premedikaci ke zlepšení perioperačního průběhu. Cílem práce bylo zhodnotit účinnost dexmedetomidinu v premedikaci před laparoskopickou cholecystektomií v porovnání s dosavadním postupem.Typ studie:
Prospektivní, randomizovaná, dvojitě slepá klinická studie.Typ pracoviště:
Fakultní nemocnice.Materiál a metoda:
Po souhlasu etické komise a pacientů byl zaslepeně a randomizovaně podán 15 minut před úvodem do anestezie do m. deltoideus atropin 0,5 mg + jedna ze 4 premedikací: dexmedetomidin 1,0 µg . kg-1 + ketamin 0,5 mg . kg-1 + fentanyl 1,0 µg . kg-1 (skupina DexKeFNT), petidin 1,5 mg . kg-1 (skupina Dolsin), dexmedetomidin 1,0 µg . kg-1 + morfin 0,05 mg . kg-1 (DexMor) a morfin 0,05 mg . kg-1 (skupina Morfin). Úvod a vedení anestezie byly standardní. Byly zaznamenávány hodnoty vitálních funkcí, nežádoucí reakce pacienta a doba do podání prvního analgetika po operaci. Výsledky byly zhodnoceny Kruskal-Wallisovým, chí-kvadrát testem a Fisherovým testem.Výsledky:
Do studie bylo zařazeno 61 pacientů indikovaných k laparoskopické cholecystektomii. Hypertenzní reakce na kapnoperitoneum byla nejčastější (68,7 %) ve skupině Dolsin (p < 0,001 oproti ostatním), ve skupině Dolsin byla i nejvyšší peroperační spotřeba fentanylu (165 ± 111 μg, p < 0,001 vs 13 ± 15 μg u DexMor, 25 ± 42 μg u Morfin i 31,5 ± 53,8 μg u DexKeFNT). Amnézii mělo 92,9 % v DexKeFNT (p < 0,001 oproti ostatním) a u obou skupin s dexmedetomidinem byla delší pooperační analgezie, p < 0,01 (DexMor 3,7 ± 1,0 h, Morfin 0,7 ± 1,1 h, Dolsin 0,9 ± 1,1 h, DexKeFNT 2,3 ± 1,0 h).Závěr:
Dexmedetomidin v kombinaci s fentanylem, ketaminem a atropinem potlačí nežádoucí oběhové účinky kapnoperitonea, snižuje peroperační spotřebu fentanylu, prodlužuje dobu pooperační analgezie a nemá významné vedlejší účinky.Klíčová slova:
premedikace – operace – hemodynamika – alfa-2 sympatomimetika – dexmedetomidin – anestetika – ketamin – analgetika – opioidyÚvod
Skupina alfa-2 sympatomimetik je v perioperačním období užívána stále častěji vzhledem ke svým jedinečným účinkům. Četné studie prokázaly, že snižují minimální alveolární koncentraci (MAC) inhalačních anestetik [1, 2]. Díky svým analgetickým vlastnostem rovněž snižují perioperační spotřebu opioidů a sedativ. Výhodou je, že ačkoliv kombinace alfa-2 sympatomimetika a opioidů působí synergicky na analgezii, není potencována dechová deprese způsobená opioidy [3–6]. Pro studium nového typu premedikace jsme vybrali kombinaci alfa-2 sympatomimetika dexmedetomidinu s různými typy opioidů a ketaminem.
Dexmedetomidin je vysoce selektivní alfa-2 sympatomimetikum, které, ačkoliv je registrováno zatím pouze ke krátkodobé intravenózní sedaci ventilovaných pacientů, je stále častěji používáno i mimo schválenou indikaci v perioperační péči. Dexmedetomidin inhibuje uvolňování noradrenalinu (NA). Výsledkem je sedace a analgezie. Dexmedetomidin rovněž svojí inhibicí NA potlačuje stresovou odpověď na operaci [7, 8]. K vedlejším účinkům, zejména při rychlém bolusovém podání, patří přechodná hypertenze a bradykardie. Mezi všemi látkami používanými k sedaci má dexmedetomidin jedinečné postavení, protože vyvolává sedaci, analgezii, potlačuje stresovou odpověď a nevyvolává depresi dechu [1, 2].
Jako další léky vhodné pro podání s dexmedetomidinem se jeví ketamin a opioidy. Kombinace dexmedetomidinu s ketaminem, který potencuje opioidní analgezii a brání vzniku tolerance, slibuje dlouhodobou účinnou analgezii. Opioidy tvoří základ analgetické terapie v perioperačním období, i když mají řadu známých nežádoucích účinků. Pro naší studii jsme zvolili fentanyl a morfin a pro srovnání ještě tradičně užívaný petidin.
Cílem naší studie je vytvořit nový typ premedikace s využitím dexmedetomidinu a s očekávanými následujícími vlastnostmi:
- rychlý nástup účinku;
- velmi dobrá kardiovaskulární stabilita jak během operace, tak během zotavení z anestezie;
- rychlé obnovení vědomí po operaci bez výskytů úzkosti, třesu a deliria;
- velmi dobrá pooperační analgezie;
- minimální ovlivnění dýchání (absence dechové deprese);
- nízký výskyt pooperační nevolnosti a zvracení.
Zároveň je nutné provést srovnání s dosud užívanými postupy.
Naše studie navázala na předchozí dobré zkušenosti s využitím klonidinu před laparoskopickou cholecystektomií [19]. Naší hlavní hypotézou bylo, že kombinace s dexmedetomidinem povede k významné oběhové stabilitě během operace, vedlejší hypotézou, že kombinace s dexmedetomidinem nebudou mít více nežádoucích účinků než premedikace bez dexmedetomidinu, popř. dojde i k jejich snížení (např. u PONV).
Soubor a metodika
Po souhlasu Státního ústavu pro kontrolu léčiv a institucionální etické komise byla provedena prospektivní randomizovaná dvojitě slepá studie u pacientů klasifikace ASA 1–2 indikovaných k plánované laparoskopické cholecystektomii (LACHE). LACHE je častá operace, o které je známo, že působením kapnoperitonea vzniká perioperačně významná hypertenzní reakce a pooperačně zvýšená incidence pooperační nauzey a zvracení (PONV). Vylučovacími kritérii zařazení do studie byla známá alergie na použitou medikaci či jakékoli jiné opioidy, chronicky užívaná psychiatrická medikace a opioidy, závažné souběžné onemocnění, které významně ovlivňuje funkci a výkonnost jakýchkoliv orgánových systémů (tj. klasifikace ASA 3 a více), těhotenství a laktace.
Při odhadu počtu pacientů nutných zařadit do souboru jsme vycházeli z předpokladu, že hemodynamická reakce na kapnoperitoneum bude v kontrolní skupině u 60 % pacientů [9], zatímco ve skupině s dexmedetomidinem se dá očekávat zhruba u 15 % pacientů. Při volbě obvyklých hodnot hladiny významnosti 0,05 a síly testu 80 % vychází minimální počet pacientů v jedné skupině n = 14 pro srovnání relativních četností chí-kvadrát testem. Protože dochází ke konverzi na otevřenou laparotomii a operace se někdy ruší, nebo odkládají, navýšili jsme počet pacientů v každé skupině na 16.
Po poučeném a písemném souhlasu byli pacienti náhodně rozděleni obálkovou metodou podle typu premedikace na skupiny (viz dále). Po příjezdu pacienta na operační sál byla kanylována periferní žíla a změřena tepová frekvence (P), krevní tlak (TK) neinvazivním způsobem a saturace krve kyslíkem (SpO2). Podle provedené randomizace byla aplikována premedikace. Pacienti ve všech skupinách dostali 15 minut před úvodem do celkové anestezie (CA) intramuskulárně do m. deltoideus atropin 0,5 mg a léky nebo kombinace léků popsané v tabulce 1. Aplikaci prováděl lékař, který se dále nepodílel na anesteziologické péči o pacienta, pacient i ostatní zdravotnický personál byli zaslepeni ohledně zařazení do skupiny.
Table 1. Seznam skupin podle použité premedikace 
Nástup účinku byl definován přítomností jasných známek sedace nebo jiného ovlivnění vědomí ať již objektivně, nebo podle sdělení pacienta. Po 15 minutách od aplikace premedikace následoval úvod do celkové anestezie. Úvod i vedení celkové anestezie byly standardní pro tento typ operace (propofol, atrakurium, oxid dusný a kyslík v poměru 1 : 1 a isofluran). Pacient byl zaintubován a řízeně ventilován. Svalová relaxancia a další analgetika byla přidávána podle potřeby, inhalační anestetika byla podávána v koncentraci 1 MAC. Po skončení operace byl pacient sledován na předsálí operačního sálu 15 minut za měření P, TK a SpO2 a pak předán na standardní oddělení po splnění běžných kritérií, tj. stabilizované vitální funkce, bdělost. Pokud by nebyla tato kritéria splněna do 15 minut po operaci, pacient by byl předán na jednotku intenzivní péče k dalšímu sledování.
Sledované parametry
Kromě hodnot vitálních funkcí rutinně měřených od doby před podáním premedikace a během celkové anestezie byly zaznamenávány následující údaje: spotřeba fentanylu během operace, hemodynamické změny o více než 30 % původní hodnoty, PONV, třes, doba do podání prvního opioidu po operaci a případné další nežádoucí reakce pacienta. Hodnoty vitálních funkcí a hodnoty Observers Assessment of Alertness Sedation Score (OAASS) – tabulka 2 – byly měřeny a zaznamenávány do standardního anesteziologického záznamu po 5 minutách až do úvodu do anestezie. Jako hypertenzi/hypotenzi jsme hodnotili změny krevního tlaku o více než 30 % nad/pod výchozí hodnotu, jako tachykardii/bradykardii změny tepové frekvence o více/méně než 30 % od výchozí hodnoty. Jako pozitivní reakci na tracheální intubaci (OTI) jsme hodnotili hypertenzi a/nebo tachykardii během intubace, jako pozitivní reakci na kapnoperitoneum hypertenzi nastupující do 10 minut od zavedení kapnoperitonea, ještě před další chirurgickou stimulací.
Table 2. OAASS: Observers Assessment of Alertness Sedation Score [26] ![OAASS: Observers Assessment of Alertness Sedation Score [26]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1b64108f5e583d460bddd36cf852587a.png)
Na oddělení bylo prováděno rutinní měření P a TK v hodinových intervalech po 4 hodiny po operaci. První analgetikum po operaci (petidin i. m.) dostal pacient na žádost. Pacienti byli poučeni a souhlasili s tím, že o prvé analgetikum požádají, až intenzita bolesti dosáhne stupně 4 z numerické škály 0–10. Pokud do 4 hodin od operace nepožádali o analgetikum sami, byl jim aplikován petidin podle rozpisu ošetřujícího lékaře.
Následující den po operaci byla provedena vizita u pacienta s cílem získat údaje o amnézii, výskytu pooperační nevolnosti a zvracení, popř. dalších komplikací v pooperačním průběhu, dále subjektivní hodnocení intenzity pooperační bolesti a byly získány hodnoty hemodynamických parametrů a doba aplikace první dávky petidinu z pacientova dekurzu.
Statistické zpracování
Zpracování výsledků bylo provedeno specializovaným biostatistickým pracovištěm. Pro kontinuální proměnné byly vypočítány základní statistické charakteristiky, např. průměry a směrodatné odchylky. Průběžné výsledky mezi jednotlivými skupinami byly statisticky zpracovány Kruskalovým-Wallisovým testem s mnohočetným srovnáváním a dále přesným testem podle Fishera. Relativní frekvence u různých skupin byly testovány chí-kvadrát testem. Adjustované standardizované rozdíly mezi pozorovanými a očekávanými četnostmi v jednotlivých buňkách byly aproximovány pomocí Z-skóre normálního rozdělení a použity k identifikaci velkých odchylek. Hodnota p < 0,05 byla považována za statisticky významnou. Ke statistické analýze byl použit statistický software BMDP (verze PC90).
Výsledky
Do studie byli zařazeni celkem 64 pacienti, kteří byli v letech 2008–2009 operováni na Chirurgické klinice 3. LF UK a FNKV v Praze. Sledováno a analyzováno jich bylo 61 : 2 pacienti ze skupiny Morfin nedostali určený typ premedikace, protože výkon byl odložen a anestezii pak podávala jiná skupina, která se studie neúčastnila; u 1 pacienta ze skupiny DexMor došlo ke konverzi laparoskopie na laparotomii. Základní data jsou v tabulce 3, mezi skupinami nebyly statisticky významné rozdíly. Ačkoliv sledování lokální reakce a bolesti na aplikovanou premedikaci nebylo součástí protokolu, žádný z pacientů si výslovně na významnou bolest při injekci nestěžoval, ani jsme nepozorovali místní reakci ve smyslu zarudnutí či podobně. Výsledky, které se týkají hlavních sledovaných parametrů shrnuje tabulka 4.
Table 3. Základní charakteristika souborů <em>Poznámka:</em> zkratky a premedikace u jednotlivých skupin viz tab. 1., SD – směrodatná odchylka. 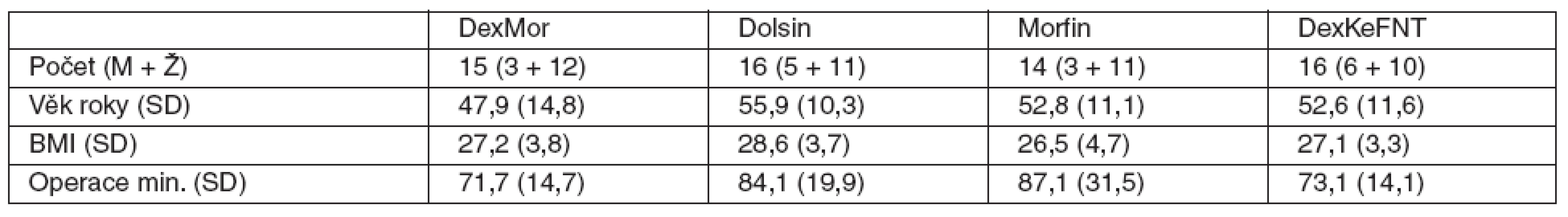
Table 4. Přehled sledovaných parametrů u jednotlivých skupin s dexmedetomidinem a kontrolních skupin <em>Poznámka:</em> Hodnoty jsou v procentech, pokud není uvedeno jinak. Zkratky a premedikace u jednotlivých skupin viz tab. 1., OAASS – viz tab. 2, SD – směrodatná odchylka, PONV – pooperační nevolnost a zvracení, *p < 0,05, **p < 0,01, ***p < 0,001, GCS – Glasgow Coma Scale. §Nástup nešel hodnotit vzhledem k absenci jasných známek sedace nebo jiného ovlivnění vědomí, ať již objektivně nebo podle sdělení pacienta. 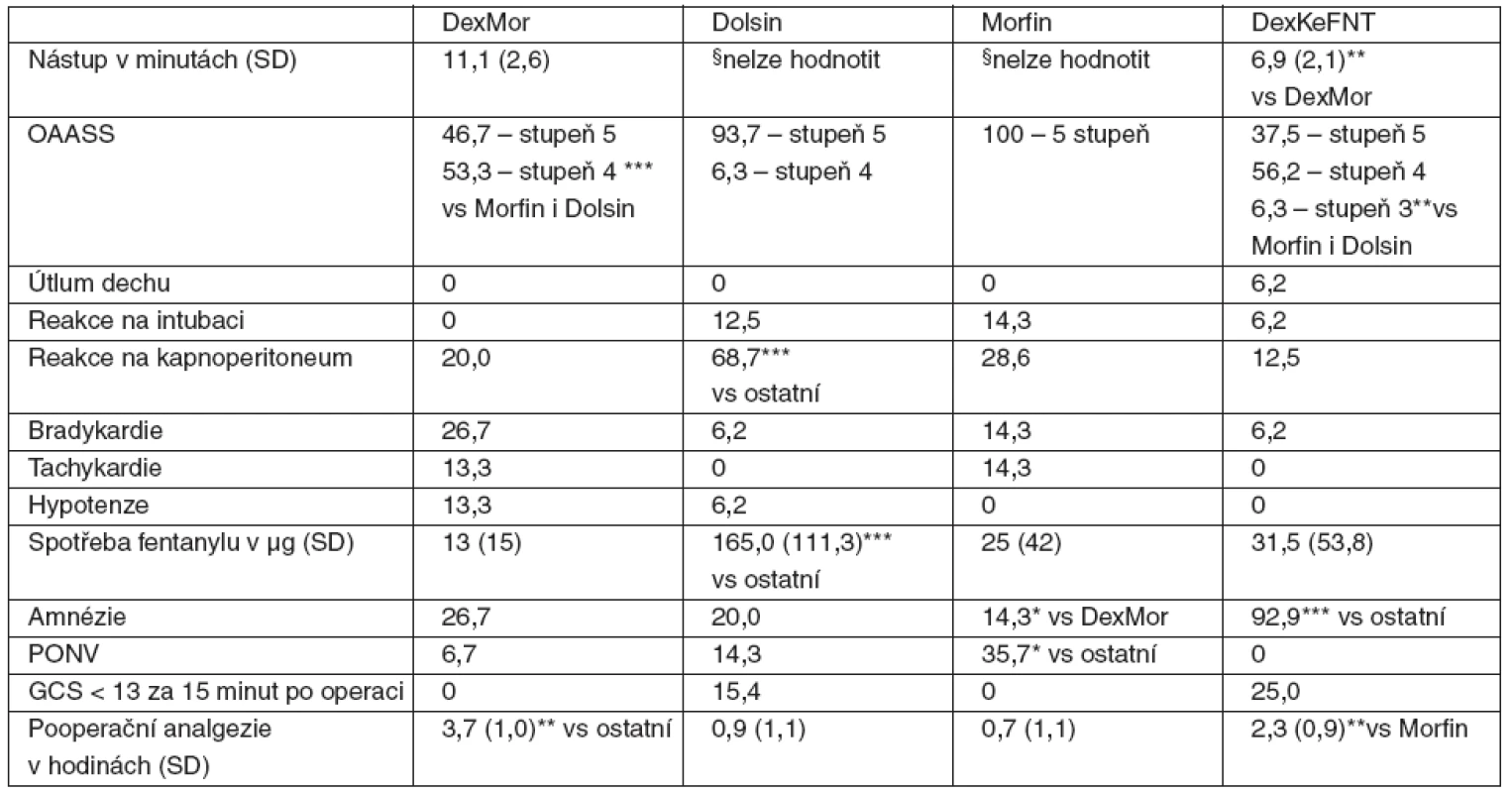
Diskuse
Je dlouho známo, že kapnoperitoneum během laparoskopické cholecystektomie působí významné hemodynamické změny, především zvýšení středního arteriálního tlaku a srdeční práce [9–12]. Hlavním vyvolávajícím momentem je zřejmě zvýšené vyplavování katecholaminů: noradrenalinu, dopaminu, vazopresinu a adrenalinu [13]. Právě z tohoto důvodu jsme zvolili laparoskopickou cholecystektomii k ověření naší hypotézy, že dexmedetomidin povede k významné hemodynamické stabilitě.
Tato hypotéza se potvrdila. V našem projektu jsme zvolili intramuskulární podání pro pomalejší nástup účinku, snížené riziko vedlejších účinků a do budoucna pro ověření možnosti využití v krizové situaci, kdy není možno zajistit přístup do žíly. Intramuskulární podání již bylo s úspěchem použito jako premedikace u gynekologických operací [14–16], kdy došlo k potlačení sympatomimetické odpovědi na operaci a kromě bradykardie u 3 pacientek, která reagovala na atropin, nebyly shledány žádné další nežádoucí vedlejší účinky (z tohoto důvodu dostali všichni naši pacienti standardně atropin v premedikaci, což mělo uvedené riziko eliminovat). Scheinin et al. [117] sledovali využitelnost intramuskulární premedikace dexmedetomidinem u pacientů indikovaných k plánované cholecystektomii, abdominální hysterektomii nebo oční chirurgii. Potlačení sympatické reakce dexmedetomidinem v premedikaci trvalo ještě asi 3–4 hodiny po operaci.
Ketamin je disociativní celkové anestetikum, které působí na více receptorových systémech. Nový impuls pro výzkum jeho vlastností znamenal objev, že působí jako nekompetitivní antagonista na N-metyl-D-aspartátovém receptoru (NMDA), o kterém se předpokládá, že hraje klíčovou roli ve vzniku a udržování centrální senzitizace a patologické bolesti [18]. V malých dávkách ketamin potencuje účinek opioidů, má vlastní analgetický efekt a potlačuje nežádoucí účinky opioidů i alfa-2 mimetik na oběh (bradykardii a hypotenzi) [18–21]. Jak dexmedetomidin, tak ketamin vedou ke snížení potřebné dávky anestetik a opioidů. To je velkou výhodou, protože opioidy s sebou nesou riziko poruch ventilace a vyššího výskytu pooperační nevolnosti a zvracení (PONV), retence moči a hypotenze.
Trojkombinace dexmedetomidin-ketamin-opioid + atropin v premedikaci ve srovnání se standardní premedikací na našem pracovišti (petidin + atropin) redukovala v průběhu operačního výkonu nežádoucí oběhové účinky kapnoperitonea a poskytla oběhovou stabilitu během celé operace. Bradykardizující účinek dexmedetomidinu, který jinak popisují ostatní autoři [20, 22, 23] jako častou komplikaci, byl v našem souboru vzácný, což mohlo být dáno jak již zmíněným preventivním podáním atropinu jako součásti testované kombinace, tak i tachykardizujícím účinkem ketaminu [20]. Můžeme jen spekulovat, že výskyt bradykardie ve skupině DexMor by mohl být nižší po přidání ketaminu do směsi. Tato hypotéza zaslouží další výzkum.
Kombinace dexmedetomidinu s dalšími léky měla dále potencovat žádoucí účinky premedikace, což se nám rovněž podařilo potvrdit. Zejména kombinace dexmedetomidinu a ketaminu s fentanylem navodila mírnou až střední sedaci s amnézií, která byla výhodná u pacientů před indukcí anestezie, přičemž nedošlo ke klinicky významnému útlumu dechu s poklesem SpO2. Další výhodou byla kvalitní analgezie po operaci, která souvisí zřejmě nejen s účinkem dexmedetomidinu, ale i s antagonistickým účinkem ketaminu na N-metyl D-aspartátové (NMDA) receptory [18, 21]. Antagonizace NMDA receptorů vede k potlačení centrální senzitizace a působí jako prevence vzniku hyperalgezie a vzniku tolerance na analgetické účinky opioidů. Pacienti s dexmedetomidinem a ketaminem v premedikaci udávali velmi nízkou průměrnou intenzitu pooperační bolesti a vysokou spokojenost s pooperačním průběhem ve srovnání s kontrolní skupinou, protokol studie však neumožnil tento rozdíl detailně sledovat a statisticky hodnotit. Pouze u 1 pacientky ve skupině s ketaminem se vyskytly barevné sny, které lze přičíst psychomimetickým účinkům ketaminu, byly však tranzitorní na začátku účinku premedikace a druhý den měla pacientka na tento jev amnézii.
Překvapením byl obecně nízký výskyt PONV ve všech skupinách, příčinou snad může být používání propofolu při úvodu do anestezie. Literatura [24] uvádí u LACHE až 65% výskyt PONV, což je nesrovnatelně více než u našeho nejhoršího výsledku (skupina Morfin). Stejná práce uvádí nejnižší výskyt u kombinace propofolu s dexametazonem – 15%, což je srovnatelné se skupinou Dolsin, ale je více než u obou skupin s dexmedetomidinem. Lze tedy nepřímo usuzovat, že dexmedetomidin má vlastní antiemetické účinky, popř. potencuje antiemetické účinky propofolu. Rovněž nás překvapilo, že nedošlo k významnému potlačení reakce na kapnoperitoneum ve skupině DexMor oproti Morfin a relativně krátká pooperační analgezie u skupiny DexMor. Lze jen spekulovat, že se na tom podílela velmi malá dávka morfinu (0,05 mg . kg-1) oproti standardnímu dávkování.
Jak již bylo uvedeno v úvodu, dexmedetomidin je registrován zatím pouze ke krátkodobé intravenózní sedaci ventilovaných pacientů, přesto v současnosti existuje nespočet prací, které popisují jeho bezpečné používání i v perioperační péči. Intramuskulární podání je narozdíl od kontinuální intravenózní aplikace relativně vzácné, přesto je popsáno již dlouhou dobu [15–17, 23]. Naše práce potvrdila, že kombinace s využitím intramuskulárního podání dexmedetomidinu má rychlý nástup účinku, poskytuje setrvalý účinek po dobu operace a nemá významné vedlejší účinky. Výhodou intramuskulárního podání je jednoduchost aplikace a spolehlivý efekt. Oproti tradičně podávané premedikaci do m. gluteus je výhodnější aplikovat premedikaci do m. deltoideus [Hess L., nepublikovaná data].
Závěr
Potvrdili jsme hypotézu, že intramuskulární premedikace zahrnující dexmedetomidin představuje spolehlivý prostředek k navození amnézie, sedace, analgezie a vegetativní stability během operace. Kombinace atropin 0,5 mg + dexmedetomidin 1 μg . kg-1 + ketamin 0,5 mg . kg-1 + fentanyl 1,0 µg . kg-1 aplikovaná do m. deltoideus splňuje všechna kritéria pro nový typ premedikace, který jsme si určili, tj. má rychlý nástup účinku, poskytuje velmi dobrou kardiovaskulární stabilitu jak během operace, tak během zotavení z anestezie, pacient po operaci není zbytečně utlumený, dochází k rychlému obnovení vědomí po operaci bez výskytů úzkosti, třesu a deliria, poskytuje velmi dobrou pooperační analgezii, nedochází k ovlivnění dýchání (absence dechové deprese) a pacienti po tomto typu premedikace udávají nízký výskyt pooperační nevolnosti a zvracení. Uvedená kombinace je využitelná nejen jako premedikace před operací, ale pravděpodobně i jako analgosedace použitelná i v přednemocniční péči a medicíně katastrof. Kombinace atropin 0,5 mg + dexmedetomidin 1 μg . kg-1 + morfin 0,05 mg . kg-1 se jeví jako slibná pro další výzkum s přidáním ketaminu do směsi.
Studie vznikla s podporou grantu IGA NR 9168.
Adresa pro korespondenci:
Doc. MUDr. Jiří Málek, CSc.
Klinika anesteziologie a resuscitace 3. LF UK a FNKV Praha
Šrobárova 50
100 34 Praha 10
e-mail: malekj@fnkv.cz
Sources
1. Pandharipande, P., Ely, E.W., Maze, M. Alpha-2 agonists: can they modify the outcomes in the Postanesthesia Care Unit? Curr. Drug Targets, 2005, 6, p. 749–754.
2. Carollo, D. S., Nossaman, B. D., Ramadhyani, U. Dexmedetomidine: a review of clinical applications. Curr. Opin. Anaesthesiol., 2008, 21, p. 457–461.
3. Gurbet, A., Basagan-Mogol, E., Turker, G., Ugun, F., Kaya, F. N., Ozcan, B. Intraoperative infusion of dexmedetomidine reduces perioperative analgesic requirements. Can. J. Anaesth., 2006, 53, p. 646–652.
4. Al-Zaben, K. R., Qudaisat, I. Y., Al-Ghanem, S. M., Massad, I. M., Al-Mustafa, M. M., Al Oweidi, A. S., Abu-Halaweh, S. A., Abu-Ali, H. M., Saleem, M. M. Intraoperative administration of dexmedetomidine reduces the analgesic requirements for children undergoing hypospadius surgery. Eur. J. Anaesthesiol., 2009, 27, p. 247–252.
5. Unlugenc, H., Gunduz, M., Guler, T., Yagmur, O., Isik, G. The effect of pre-anaesthetic administration of intravenous dexmedetomidine on postoperative pain in patients receiving patient-controlled morphine. Eur. J. Anaesthesiol., 2005, 22, p. 386–391.
6. Aantaa, R., Jalonen, J. Perioperative use of alpha2-adrenoceptor agonists and the cardiac patient. Eur. J. Anaesthesiol., 2006, 23, p. 361–372.
7. Ebert, T. J., Hall, J. E., Barney, J. A., Uhrich, T. D., Colinco, M. D. The effects of increasing plasma concentrations of dexmedetomidine in humans. Anesthesiology, 2000, 93, p. 382–394.
8. Khan, Z. P., Ferguson, C. N., Jones, R. M. Alpha-2 and imidazoline receptor agonists. Their pharmacology and therapeutic role. Anaesthesia, 1999, roč. č. 54, p. 146-65.
9. Málek, J., Knor, J.,Kurzová, A., Lopourová, M. Nežádoucí hemodynamické změny během laparoskopických cholecystektomií a možnost jejich potlačení clonidinem v premedikaci. Srovnání intravenózní a intramuskulární premedikace. Rozhl. Chir., 1999, 78, p. 286–291.
10. Hirvonen, E. A., Poikolainen, E. O., Paakkonen, M. E., Nuutinen, L. S. The adverse hemodynamic effects of anesthesia, head-up tilt, and carbon dioxide pneumoperitoneum during laparoscopic cholecystectomy. Surg. Endosc., 2000, 14, p. 272–277.
11. Dorsay, D. A., Greene, F. L., Baysinger, C. L. Hemodynamic changes during laparoscopic cholecystectomy monitored with transesophageal echocardiography. Surg. Endosc., 1995, 9, p. 128–133.
12. McLaughlin, J. G., Scheeres, D. E., Dean, R. J., Bonnell, B. W. The adverse hemodynamic effects of laparoscopic cholecystectomy. Surg. Endosc., 1995, 9, p. 121–124.
13. Joris, J. L., Chiche, J. D., Canivet, J. L., Jacquet, N. J., Legros, J. J., Lamy, M. L. Hemodynamic changes induced by laparoscopy and their endocrine correlates: effects of clonidine. J. Am. Coll. Cardiol., 1998, 32, p. 1389–1396.
14. Erkola, O., Korttila, K., Aho, M., Haasio, J., Aantaa, R., Kallio, A. Comparison of intramuscular dexmedetomidine and midazolam premedication for elective abdominal hysterectomy. Anesth. Analg., 1994, 79, p. 646–653.
15. Aantaa, R., Jaakola, M. L., Kallio, A., Kanto, J., Scheinin, M., Vuorinen, J. A comparison of dexmedetomidine, and alpha 2-adrenoceptor agonist, and midazolam as i.m. premedication for minor gynaecological surgery. Br. J. Anaesth., 1991, 67, p. 402–409.
16. Aantaa, R., Kanto, J., Scheinin, M. Intramuscular dexmedetomidine, a novel alpha 2-adrenoceptor agonist, as premedication for minor gynaecological surgery. Acta Anaesthesiol. Scand., 1991, 35, p. 283–288.
17. Scheinin, H., Jaakola, M. L., Sjovall, S., Ali-Melkkila, T., Kaukinen, S., Turunen, J., Kanto, J. Intramuscular dexmedetomidine as premedication for general anesthesia. A comparative multicenter study. Anesthesiology, 1993, 78, p. 1065–1075.
18. Bell, R. F., Dahl, J. B., Moore, R. A., Kalso, E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst. Rev., 2006, CD004603.
19. Iravani, M., Wald, S. H. Dexmedetomidine and ketamine for fiberoptic intubation in a child with severe mandibular hypoplasia. J. Clin. Anesth., 2008, 20, p. 455–457.
20. Levanen, J., Makela, M. L., Scheinin, H. Dexmedetomidine premedication attenuates ketamine-induced cardiostimulatory effects and postanesthetic delirium. Anesthesiology, 1995, 82, p. 1117–1125.
21. Berti, M., Baciarello, M., Troglio, R., Fanelli, G. Clinical uses of low-dose ketamine in patients undergoing surgery. Curr. Drug. Targets, 2009, 10, p. 707–715.
22. Wijeysundera, D. N., Bender, J. S., Beattie, W. S. Alpha-2 adrenergic agonists for the prevention of cardiac complications among patients undergoing surgery. Cochrane Database Syst. Rev., 2009, CD004126.
23. Erkola, O., Korttila, K., Aho, M., Haasio, J., Aantaa, R., Kallio, A. Comparison of intramuscular dexmedetomidine and midazolam premedication for elective abdominal hysterectomy. Anesth. Analg., 1994, 79, p. 646–653.
24. Fujii, Y., Nakayama, M. Prevention of postoperative nausea and vomiting with a small dose of propofol alone and combined with dexamethasone in patients undergoing laparoscopic cholecystectomy: A prospective, randomized, double-blind study. Surg. Endosc., 2008, 22, p. 1268–1271.
25. Virkkila, M., Ali-Melkkila, T., Kanto, J., Turunen, J., Scheinin, H. Dexmedetomidine as intramuscular premedication in outpatient cataract surgery. A placebo-controlled dose-ranging study. Anaesthesia, 1993, 48, p. 482–487.
26. Chernik, D. A., Gillings, D., Laine, H., Hendler, J., Silver, J. M., Davidson, A. B., Schwam, E. M., Siegel, J. L. Validity and reliability of the Observer’s Assessment of Alertness/Sedation Scale: study with intravenous midazolam. J. Clin. Psychopharmacol., 1990, 10, p. 244–251.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 4-
All articles in this issue
- Pooperační bolesti v krku
- Dexmedetomidin v premedikaci před laparoskopickou cholecystektomií – prospektivní randomizovaná studie
- Fascie brachiálního plexu
- Frakcionovaná plazmatická separace a adsorpce neovlivňuje hemodynamické parametry u experimentálního akutního selhání jater
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pooperační bolesti v krku
- Terapie přístrojem Prometheus u pacientů s akutním jaterním selháním – vliv terapie na markery zánětu a regenerace
- Prometheus – nová možnost léčby jaterního selhání u dětí
- Fascie brachiálního plexu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

