-
Medical journals
- Career
Erytropoetin a jiné léky stimulující erytropoezu na pozadí bezkrevní medicíny – nová éra v léčbě anémie?
: Stibor Bronislav; Schwameis Franz
: Abteilung für Anästhesie und Intensivmedizin, Landesklinikum Baden, Baden bei Wien, Rakousko
: Anest. intenziv. Med., 20, 2009, č. 2, s. 84-87
: Anaesthesiology - Review Article
Bezkrevní medicína se snaží nacházet a v praxi uplatňovat alternativy alogenních transfuzí. Největším rizikem krevní transfuze je přenos infekčních chorob. Od 80. let minulého století se v léčbě anémie používá lidský rekombinantní erytropoetin, jako první ze skupiny erytropoezu stimulujících látek. Jeho hlavní nevýhodou je nutnost častých aplikací, vzácně se objevuje i velmi závažná komplikace – čistá aplazie červené krevní řady. Druhou generaci představuje darbepoetin s pozměněnou chemickou strukturou i výhodnější farmakokinetikou. Nyní se do klinické praxe zavádí představitel třetí generace kontinuální aktivátor erytropoetinového receptoru s delším biologickým poločasem. Kvalitativním skokem je generace čtvrtá, kde se objevují preparáty tvořené bez pomoci genového inženýrství a dále preparáty aplikovatelné perorálně – léky začínající novou éru v léčbě anémie.
Klíčová slova:
bezkrevní medicína – erytropoezu stimulující látky – erytropoetin – darbepoetin – aplazie červené krevní řady – kontinuální aktivátor erytropoetinového receptoru – HematideÚvod
Krevní transfuze bývá v mnoha případech život zachraňující výkon. Její přínos je tedy nesporný. Zároveň však znamená transplantaci biologické materiálu, byť ve formě tekuté tkáně. Největším rizikem každé krevní transfuze je proto přenos infekčních chorob [1]. Přes všechny pokroky v transfuziologii – selekce dárců, jejich laboratorní testování i testování krevních jednotek – je úplné vyloučení tohoto rizika z principu nemožné. Každá krevní konzerva se totiž testuje pouze na několik málo běžných patogenů, na množství ostatních se krev netestuje, na některé patogeny ještě testovací metody neexistují a o spoustě infekčních agens doposud nevíme, že vůbec existují. Priony zajisté nebyly poslední v řadě. Různé pandemie, jako například HIV či nová varianta Jacobovy-Creutzfeldovy choroby (Jacob-Creutzfeld disease, JCD), nám tuto nepříjemnou skutečnost vždy připomenou.
Z těchto důvodů bychom měli každou transfuzi alogenní krve podat pouze v případě, kdy nemáme jinou možnost – tedy postup „ultimum refugium“. Tato myšlenka dala vzniknout odvětví, které se nazývá bezkrevní medicína a které prochází napříč jednotlivými obory. U jejího zrodu stáli anesteziologové a intenzivisté, kteří patří mezi lékaře nejčastěji provádějící krevní převody. Hlavním cílem je nacházet a v praxi uplatňovat alternativy alogenních transfuzí. Mnohokrát bylo prokázáno, že i velké krevní ztráty u operačních výkonů lze zvládnout bez alogenní transfuze [2, 3, 4, 5].
Vítaný útlum krevních transfuzí by v budoucnu měla přinést „umělá krev“. Přes veškeré nákladné výzkumy v posledních dvou desetiletích se však nepodařilo vyvinout žádný preparát, který by se mohl nasadit v klinické praxi. A to se vývoj omezil v podstatě jen na jednu jedinou, byť nejdůležitější, funkci krve, a sice přenos kyslíku a oxidu uhličitého – na nahrazení všech ostatních funkcí krve se rezignovalo. Cesta s purifikováním hovězí či jiné živočišné krve se ukázala právě díky infekci nové varianty JCD jako slepou uličkou.
Farmakoterapie představuje jeden ze základních pilířů bezkrevní medicíny. Kromě léků, které zastavují již vzniklé krvácení, sem patří léky, jež stimulují tvorbu pacientovi vlastní krve. Po poznání principu řízení její tvorby pomocí hormonu erytropoetinu se čekalo jen na rozvoj genového inženýrství – lidský rekombinantní erytropoetin byl poté na světě. Následně nastala éra vývoje a výroby různých dalších erytropoezu stimulujících látek (erythropoiesis stimulating agents, ESA).
Erytropoetin
Erytropoetin je hormon glykoproteinové povahy s molekulovou hmotností 30 400 D. Bílkovinná část molekuly představuje asi 60 % molekulové hmotnosti a je tvořena jedním polypeptidem se 165 aminokyselinami a dvěma disulfidovými můstky. Sacharidy tvoří necelých 40 % molekulové hmotnosti. Glykosylovaná místa se nachází na jednom místě molekuly erytropoetinu, jež je vzdálené od místa, kde se erytropoetin váže ke svému receptoru. Oligosacharidová část molekuly ovlivňuje nejen konformaci a stabilitu molekuly, ale i její imunogenicitu, biologickou účinnost i biologický poločas eliminace. Zbytky kyseliny sialové, jež jsou zakončením N-vázaných oligosacharidů, ovlivňují afinitu k receptoru. Celkový počet zbytků kyseliny sialové v molekule je variabilní (tzv. mikroheterogenita) a kolísá mezi 7 a 14 [6].
Více jak 90 % endogenního erytropoetinu je syntetizováno v ledvinách, zbytek převážně v játrech. Také u pacientů po bilaterální nefrektomii jeho produkce, byť v omezené míře, přetrvává. Tvorba erytropoetinu je řízena nasycením krve kyslíkem a právě tkáňová hypoxie je nejúčinnějším stimulem pro jeho tvorbu. Cílovým orgánem tohoto hormonu je kostní dřeň. Zde způsobuje proliferaci a maturaci erytroidních buněk, jejich zvýšený příjem železa, zabránění jejich apoptóze a následně i zvýšené uvolňování zralých erytrocytů do krevního oběhu.
Lidský rekombinantní erytropoetin – první generace ESA
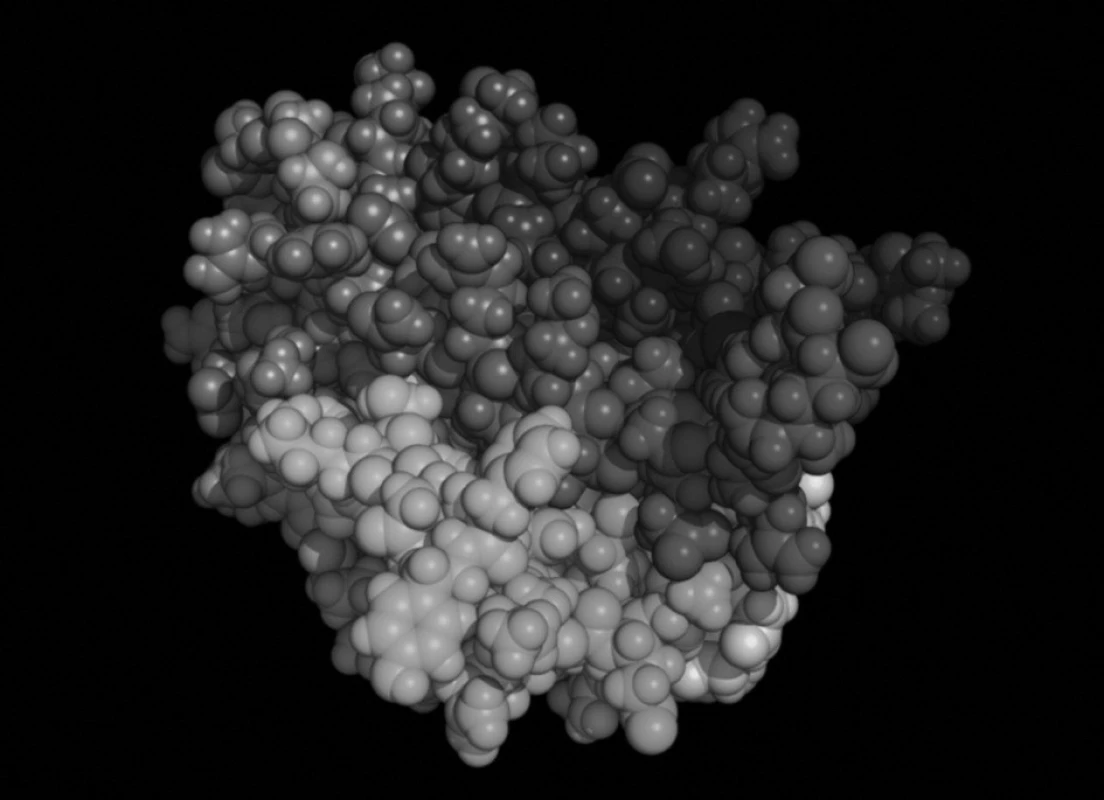
Před více než dvaceti lety se podařilo vyvinout pomocí ovariálních buněk čínského křečka lidský rekombinantní erytropoetin (recombinant human erythropoietin, rHu-Epo) – obrázek 1. Obsahuje směs izoforem 4-14. Začal se využívat v druhé polovině 80. let minulého století v nefrologii pro léčbu anémie dialyzovaných pacientů (preparát Epogen). Následně byl schválen pro léčbu anemických pacientů s chronickým renálním selháním, byť ještě nebyli v dialyzačním programu. Později byl uvolněn také pro pacienty s anémií způsobenou maligním onemocněním či jeho léčbou a stal se také součástí protokolu terapie HIV pozitivních pacientů léčených zidovudinem. Před šestnácti lety, v roce 1993, bylo v Japonsku poprvé schváleno jeho použití během odběru autotransfuzí v rámci předoperačního autologního krevního dárcovství (preoperative autologous blood donation – PABD). O rok později, v roce 1994, bylo téhož dosaženo v Evropské unii (preparát Procrit). A konečně v roce 1996 byl ve Spojených státech a Kanadě schválen pro léčbu tzv. chirurgické anémie, tedy anémie spojené s operačními výkony. Tímto se již erytropoetin dostává do oblasti perioperační intenzivní péče. Postupné zavádění erytropoetinu do těchto tří oborů – nefrologie, onkologie, anesteziologie a intenzivní medicína – se posléze stává typickým i pro všechny následující generace ESA.
Erytropoetin alfa a erytropoetin beta představují první generaci léků stimulujících erytropoezu. Svými účinky plně nahrazují přirozený erytropoetin. Významně zlepšily kvalitu života chronicky anemických pacientů, kteří byli do té doby léčeni především opakovanými krevními převody. U nich byla infekce přenesená transfundovanou krví jen otázkou času – nejčastěji se jednalo o některý typ infekční hepatitidy. Aplikaci rekombinantních preparátů provázelo minimum nežádoucích účinků. Podstatným způsobem se také snížila mortalita těchto pacientů. Zpočátku se podávaly výhradně intravenózně. Na základě mnoha studií však bylo zjištěno, že subkutánní aplikace vede k 5 až 10násobně delší biologické dostupnosti a umožňuje redukci dávky až o 50 % oproti aplikaci intravenózní, což vedlo k dalšímu zjednodušení jejich podávání [7].
S rychlým rozšířením jejich aplikace se dostaly do popředí tři okruhy problémů:
- Vysoká cena – velké množství studií se proto snažilo objevit dávkování, které by bylo co nejvíce cost-effective. Optimální dávkovací protokol se však ještě nalézt nepodařilo.
- Velmi závažná, život ohrožující komplikace léčby erytropoetinem – čistá aplazie červené krevní řady (pure red cell aplasia, PRCA) [8]. V letech 1998 až 2002 byla publikována u více než 250 pacientů s chronickým renálním selháním léčených erytropoetinem, v roce 2004 počet případů překročil 500 [9]. V sérech těchto pacientů byly nalezeny protilátky proti erytropoetinu, přičemž tyto protilátky reagovaly nejen s aplikovaným, ale zkříženě i s endogenním erytropoetinem. Klinicky se PRCA projevovala extrémní anémií a současně praktickou absencí erytroidních prekurzorů v kostní dřeni. Všechny její ostatní buňky jsou přítomny a kvantitativně i morfologicky v normě. Erytropoeza však byla blokována již na úrovni proerytroblastu. Usilovným výzkumem bylo zjištěno, že na imunogenitě se podílelo zejména uvolňování organických látek z nepotažené gumové zátky stříkaček naplněných erytropoetinem. Nejčastěji se PRCA objevovala u preparátu Eprex (erytropoetin alfa distribuovaný v Evropě, nikoliv však ve Spojených státech). Změna technologie výroby v dubnu 2003 vedla k prudkému poklesu výskytu této obávané komplikace [10, 11]. Její léčba spočívala v okamžitém vysazení ESA, v podávání kortikoidů, imunosupresiv a krevních transfuzí [12]. Tato terapie vedla většinou k odeznění aplazie, avšak renální anémie přetrvávala pochopitelně dál. Tito pacienti byli dále léčení opakovanými krevními převody jako před érou erytropoetinu. Teprve vývoj čtvrté generace ESA umožnil přechod zpět na farmakologickou léčbu anémie (viz níže).
- Poměrně krátký biologický poločas, jenž vede k nutnosti aplikace 2krát nebo 3krát týdně. Prodloužení dávkovacího intervalu vede obyčejně k výraznému snížení účinnosti, aplikace vysokých dávek je zase finančně velmi nákladná. Vývoj tedy směřoval k nalezení molekuly s výrazně prodlouženým účinkem. Ukázalo se, že na biologické (erytropoetické) účinnosti erytropoetinu se podílejí především oligosacharidy obsahující zbytky kyseliny sialové, které výrazně prodlužují jeho biologický poločas. Desialylovaný erytropoetin je sice velmi účinný in vitro, avšak in vivo prakticky nikoliv, neboť je velmi rychle degradován jaterními enzymy. Posléze se podařilo přidáním oligosacharidů obsahujících zbytky kyseliny sialové vytvořit molekulu, jež měla prodloužený biologický poločas eliminace a tím i vyšší biologickou účinnost. Látka, během výzkumu nazývaná nový erytropoezu stimulující protein (novel erythropoietin stimulating protein, NESP), dostala posléze název darbepoetin alfa.
Druhá generace ESA – darbepoetin alfa
Darbepoetin alfa představuje druhou generaci erytropoezu stimulujících látek. Od lidského erytropoetinu se liší celkem na 5 místech proteinového řetězce a také byl zvýšen počet navázaných oligosacharidů i zbytků kyseliny sialové. Mechanismus účinku i konečný efekt, tedy zvýšení hodnot červené krevní řady, je shodný s první generací. Biologický poločas se však zhruba trojnásobně prodloužil [13]. Pod komerčním názvem Aranesp byl v roce 2001 schválen pro léčbu anémie u chronického renálního selhání a v roce 2002 i pro léčbu chirurgické anémie. Hlavní výhodou je nízká frekvence podání – většinou stačí 1krát týdně. V udržovací fázi léčby renální anémie lze interval prodloužit až na tři týdny [14]. Při převádění pacientů z erytropoetinu alfa či beta na darbepoetin alfa se doporučuje 200 IU rHu-Epo nahradit přibližně 1 ∝g darbepoetinu alfa. Další předností je poměrně nízká imunogenita. Potenciální antigenní místa polypeptidového řetězce jsou zřejmě překryta navázanými oligosacharidy. Aplazie červené krevní řady je tedy extrémně vzácná [15].
Třetí generace ESA – kontinuální aktivátor erytropoetinového receptoru
V roce 2007 se po několika letech klinických zkoušek dostává do klinické praxe třetí generace ESA, a sice kontinuální aktivátor erytropoetinového receptoru (continuous erythropoietin receptor activator, CERA). Prvním komerčním preparátem se stává Mircera®(fa Roche), jež byl 15. listopadu 2007 uvolněn americkou FDA pro rutinní klinické užití. Chemicky se jedná o methoxy-polyethylene-glycolepoetin beta. Po Spojených státech byl preparát schválen v Rakousku, Švédsku, Německu, Velké Británii, Norsku a nyní pokračuje postupné schvalování v dalších zemích – tzv. mezinárodní roll-out. Tento medikament, ve srovnání s předchozími dvěmi generacemi ESA, vykazuje dramaticky delší biologický poločas, přibližně 6krát delší než u darbepoetinu a asi 20krát delší než u erytropoetinu [16]. To umožňuje dávkování jednou za měsíc, v udržovací fázi u renální anémie dokonce jednou za dva měsíce. Opět je možné podávání jak subkutánní, tak intravenózní. Bezpečnostní profil je shodný s prvními dvěma generacemi ESA. Nebylo prokázáno ovlivnění mortality, což ovšem ani nebylo očekáváno. Ve Velké Británii a Německu byly celkem ve 12 dialyzačních centrech provedeny velmi zajímavé studie, které sledovaly časovou úsporu personálu po přechodu na třetí generaci ESA. Výsledky studií se v obou zemích shodovaly a referovaly o úspoře cca 37–43 pracovních dnů za rok v každém dialyzačním centru. Nyní probíhá, zejména ve Velké Británii, konverze léčby dialýzovaných pacientů z erytropoetinu či darbepoetinu na CERA. Na klinické použití při léčbě chirurgické anémie a na JIP bude třeba ještě nějakou dobu počkat.
Čtvrtá generace ESA – nová éra v léčbě anémie?
Již v průběhu vývoje třetí generace se objevovaly velmi zajímavé informace o vývoji látek, které by sice představovaly numericky čtvrtou generaci ESA, ale v podstatě by se jednalo o kvalitativní skok v léčbě anémie – odtud název nová éra v její léčbě. Tyto látky však již nevznikaly další modifikací molekuly erytropoetinu, nýbrž se jedná o produkty působící na zcela jiné bázi. Jedná se např. o inhibitory prolylhydroxylázy, enzymu degradujícího faktor indukovaný hypoxií (hypoxia inducing factor, HIF). Firmou FibroGen byly vyvinuty dva tyto inhibitory, a sice FG-2216 a FG-4592. V současné době probíhají klinické zkoušky firmou Astellas. Ukazuje se, že tyto léky zvyšují hladinu hemoglobinu indukcí erytropoezy, přičemž se ale hladiny endogenního erytropoetinu nemění [17]. Vynikající vlastností je však aplikační cesta, jedná se totiž o první erytropoezu stimulující látky, které lze podávat perorálně.
Druhým převratným preparátem, který by měl již nalézt uplatnění v léčbě chirurgické anémie a na JIP, by se měl stát lék Hematide od firmy Affymax. Jde o čistě syntetický polypeptid, vyráběný bez pomoci genového inženýrství. Působí též na erytropoetinový receptor, má ale několik vlastností, které ho odlišují od ostatních ESA [18]. Především je to sekvence aminokyselin, která je zcela odlišná od endogenního i všech ostatních rekombinantních erytropoetinů. Nemůže tedy vyvolat aplazii červené krevní řady, naopak byl velmi úspěšně použit v její léčbě. Dalšími výhodami je relativně jednoduchá syntéza, velká stabilita, možnost uchovávání při pokojové teplotě a taktéž aplikace jednou měsíčně, jak vyplývá z právě probíhajících klinických zkoušek ve fázi III.
Závěr
V příštích letech lze očekávat zavedení několika převratných léků, které by měly významně ovlivnit léčbu anémie. Veškeré léky podporující tvorbu lidské krve jsou však omezeny časovým faktorem, neboť tvorba červených krvinek, respektive vzestup hemoglobinu po jejich aplikaci, se objevuje až po několika dnech a plný efekt se dostavuje v řádech týdnů. V léčbě akutního krvácení se proto bude nadále používat krevní transfuze. Aplikace léků bude vždy podpůrným prostředkem, a to až do doby, kdy bude do klinické praxe zavedena umělá krev. Pak se stane transfuze lidské krve úkonem poměrně raritním. Bezkrevní medicína by dosáhla svého cíle.
Došlo 26. 9. 2008.
Přijato 20. 1. 2008.
Adresa pro korespondenci:
MUDr. Bronislav Stibor
Modřická 25
664 48 Moravany u Brna
e-mail: stiborovi@volny.cz
Sources
1. Kitchen, A. D., Barbara, J. A. Current information on the infectious risks of allogeneic blood transfusion. Transfusion Alternatives in Transfusion Medicine, 2008, 10, 3, p. 102–111.
2. Cundrle, I., Vlach, O., Zimova, I., Pospisilova, M. Initial experience with peroperative autotransfusion in spinal surgery. Acta Chir. Orthop. Traumatol. Cech., 1993, 60, 2, p. 93–97.
3. Gal, R., Cundrle, I. Acute normovolemic haemodilution for management 4 200 ml large blood loss during radical prostatectomy. Bratisl. Lek. Listy, 2002, 103, 6, p. 198–200.
4. Gal, R. Acute normovolemic haemodilution for management of blood loss during radical prostatectomy. Bratisl. Lek. Listy, 2008, 109, 3, p. 144–146.
5. Segal, J. B., Blasco-Colmenares, E., Norris, E. J., Guallar, E. Preoperative acute normovolemic hemodilution: a meta analysis. Transfusion, 2004, 44, p. 632–644.
6. Tesař, V., Tesařová, P. Darbepoetin alfa. Farmakoterapie, 2006, 5, p. 514–522.
7. Kampf, D., Kahl, A., Passlick, J., Pustelnik, A. et al. Single dose kinetics of recombinant human EPO (rhEPO) after i.v., s.c. and i.p. administration. Control. Nephrol., 1989, 76, p. 106–111.
8. Cournoyer, D., Toffelmire, E. B., Wells, G. A., Baeber, D. L. et al. Anti-Erythropoietin Antibody-Mediated Pure Cell Aplasia after Treatment with Recombinant Erythropoietin Products: Recommendations for Minimization of Risk. J. Am. Soc. Nephrol., 2004, 15, p. 2728–2734.
9. McKoy, J. M., Stonecash, R. E., Cournoyer, D., Rossert, J., Nissenson, A. R., Raisch, D. W. et al. Epoetin-associated pure red cell aplasia: past, present, and future consideration. Transfusion, 2008, 48, 8, p. 1752–1762.
10. Bennett, C. L., Luminari, S., Nissenson, A., Tallman, M. S. et al. Pure Red-Cell Aplasia and Epoetin Therapy. N. Engl. J. Med., 2004, 351, p. 1403–1408.
11. Schellekens, H., Jiskoot, W. Erythropoietin-Associated PRCA: Still an Unsolved Mystery. J. Immunot., 2006, 3, p. 123–130.
12. Chang, W. J., Tan, L. K., Liu, T. C. Cyclosporine treatment for patients with CRF who developed pure red blood cell aplasia following EPO therapy. Am. J. Kidney Dis., 2003, 41, p. 692–695.
13. Dostupné na: Amgen Inc. Product Information. http://www.aranesp.com
14. Macdougall, I. C., Gray, S. J., Elston, O., Breen, C. et al. Pharmacokinetics of novel erythropoiesis stimulating protein compared with epoetin alfa in dialysis patients. J. Am. Soc. Nephrol., 1999, 10, p. 2392–2395.
15. Summers, S. A., Matijevic, A., Almond, M. K. Successful re-introduction of recombinant human erythropoietin following antibody induced pure cell aplasia. Nephrol. Dial. Transplant., 2004, 19, p. 2137–2139.
16. Macdougall, I. C. CERA (continuous erythropoietin receptor activator): a new erythropoiesis-stimulating agent for treatment of anemia. Curr. Hematol. rep., 2005, 4, p. 436–440.
17. Macdougall, I. C. Novel Erythropoiesis-Stimulating Agents: A New Era in Anemia Management. J. Am. Soc. Nephrol., 2008, 3, p. 200–207.
18. Stead, R. B., Lamber, J., Wessels, D., Iwashita, J. et al. Evaluation of the safety and pharmacodynamics of Hematide, a novel erythropoietic agent, in a phase1, double-blind, placebo-controlled, dose-escalation study in healthy volunteers. Blood, 2006, 108, p. 1830–1834.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 2-
All articles in this issue
- Anaphylaxis after induction to general anaesthesia: Four case reports
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- The influence of continuous positive pressure ventilation on the degree of inflammatory reaction and organ function – experimental study
- Hypocholesterolaemia on the medical intensive care unit: The process of cholesterol synthesis and absorption is altered in the acute phase of disease
- Evaluation of changes in brain tissue oxygen levels (PbtO2) for detection of vasospasm in patients after subarachnoid haemorrhage
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
- Assoc. Prof. MUDr. Josef Hoder, CSc., in the memories of his colleagues and friends
- Assoc. Prof. MUDr Josef Hoder, CSc. (1912–1987)
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anaphylaxis after induction to general anaesthesia: Four case reports
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career