-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Onemocnění jater související s alkoholem (ALD)
Alcohol-related liver diseases (ALD)
The main aim of this educational article ( narrative review ) is to reflect clinical practice guidelines of the European Association for the Study of the Liver (EASL) published in J Hepatol 2018, contrasting with the 2012 guidelines especialy in the new terminology of alcohol-related liver diseases (ALD). The strong emphasis on prevention of alcohol use disorders (AUD) may be exert at all stages of public health care. Another aim of the article are ALD history, epidemiology, metabolism of alcohol and clinical pictures of ALD.
Keywords:
alcohol – liver – abusus – EASL guidelines – disorders
Autoři: Jiří Ehrmann; Květoslava Aiglová; Ondřej Urban; Silvia Cveková; Pavol Dvoran
Působiště autorů: II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc
Vyšlo v časopise: Vnitř Lék 2020; 66(5): 39-51
Kategorie: Přehledové články
Souhrn
Jde o článek charakteru narrative review o onemocněních jater spojených s alkoholem. Věcný obsah je opřen o doporučené postupy (guidelines), které vydala European Association for the Study of the Liver v červenci roku 2018. V uvedeném článku je navíc historie a metabolismus alkoholu. Od minulých doporučení se toto poslední liší zejména důrazem na prevenci a časnou diagnostiku abúzu alkoholu a alkoholismu. Nejedná se o doslovný překlad celých guidelines. Doslovně jsou v článku zmíněna závěrečná doporučení.
Klíčová slova:
abúzus – alkohol – guidelines EASL – játra – poškození
Úvod
Odborná lékařská, ale i laická veřejnost měla a často stále má při slovech nadměrná nebo nepřiměřeně velká konzumace alkoholu na mysli především poškození jater. „Tvrdnutí jater“ je obávanou chorobou nadměrných pijáků alkoholu. Když však sledujeme odbornou literaturu týkající se problematiky abúzu alkoholu, publikací na téma alkohol/játra ubývá. Již od začátku vědeckého zájmu o účinky alkoholu na zdraví byla pozornost věnována i jiným chorobám než jaterním, nehledě pak na studium psychosociálních důsledků, jak vyplývá z jednotlivých článků supplementu časopisu Journal of Studies on Alcohol and Drugs, které bylo napsané k 75letému výročí vzniku časopisu (1). Proč tomu tak je, když třetina až polovina jaterních chorob vzniká v důsledku abúzu alkoholu? Možná také proto, že téma alkohol/játra nepřináší v posledních letech zásadně nové poznatky. Až teprve v souvislosti s horkým tématem medicíny – NAFLD (non‑alcoholic fatty liver disease) se opět zvýšil zájem o ALD (alcoholic liver disease). Ačkoliv je etiopatogeneze obou nemocí odlišná, histologický a klinický obraz jsou podobné, včetně nepříznivých důsledků. Pro všechny lékaře, ale hlavně gastroenterology a hepatology je proto příznivá zpráva, že EASL (European Association for the Study of the Liver) vypracovala a vydala doporučené postupy managementu alkoholem podmíněných onemocnění jater a publikovala je v časopise Journal of Hepatology (2018; 69 : 154–181) s názvem: EASL Clinical Practice Guidelines: management of alcohol‑related liver disease (2). To je to aktuální v hepatologii a autoři tohoto článku o onemocnění jater souvisejících s alkoholem doporučené postupy EASLzohledňují a zdůrazňují. Předtím EASL vydala a v časopise J Hepatol publikovala podobná guidelines v roce 2012. Nicméně, guidelines jsou o managementu a není např. zmiňována patogeneze, historie a některé další konsekvence. Je rovněž třeba uvést, že předložený článek není překladem originálního anglického textu. Ten je napsán na 28 stranách a opírá se o 360 citací. To by přesáhlo prostor v časopisu Vnitřní lékařství, ale hlavně guidelines musí být dílem České hepatologické společnosti s aplikací na podmínky u nás. Doslovně jsou ale přeložena závěrečná doporučení jednotlivých oblastí managementu a nová terminologie. Ta je v Tab. 1. Jednotlivá doporučení jsou souhrnně uvedena rovněž v příloze článku. Guidenlies EASL vznikla na podkladě publikovaných prací do října roku 2017. V GRADE systému je úroveň síly důkazů vyjádřena stupni 1–3 a síla doporučení písmeny A (silné doporučení, musí být, EASL silně doporučuje) nebo B (slabé doporučení, EASL navrhuje, dává podnět). Již v prosinci roku 2016 až březnu roku 2017 byla vypracována 1. verze doporučení, která byla podrobena připomínkovému řízení odborníků a v červenci roku 2018 byla publikována definitivní verze.
Historie
Babyloňané a Asyřané věnovali velkou pozornost inspekci jater a byli přesvědčeni, že bohové jim dají vzhledem orgánů obětovaných zvířat, a tedy i jater, znamení před důležitými rozhodnutími. Haruspikové byli přesvědčeni, že nejdůležitější znamení lze číst z velikosti jater. Játra byla původně považována za sídlo emocí, ale i sexuální potence. Ale až Hippokrates (460–377 před Kristem) a jeho žáci položili vědecké základy pro pochopení onemocnění jater (3).
Asociaci konzumace alkoholu se vznikem jaterní cirhózy popsal Matthew Bailiie v roce 1793 a později Thomas Addison, který pozoroval zejména tukovou jaterní degeneraci v důsledku nadměrné konzumace alkoholu. Tvrdá játra s patrnými uzlíky na povrchu byla pozorovaná již ve starověku, ale až v roce 1819 René Théophile Hyacinthe Laennec (1781–1826) zavedl termín jaterní cirhóza, který odvodil od řeckého cirrhos, tj. žlutohnědý, poněvadž na povrchu jater i na řezu prominovaly uzlíky žluto‑červeno‑hnědé barvy. Ačkoliv se později ukázalo, že příčinou těchto lézí jsou hlavně fibrotické přeměny, termín cirhóza byl tak zavedený, že se užívá do dnešní doby. Na druhé straně termín cirhóza není užíván pro jaterní fibrózu bez průkazu uzlové přestavby. Dnes se již názvů Laennecova cirhóza nebo také portální cirhóza neužívá, dříve však byla tak nazývaná jaterní cirhóza alkoholového nebo virového původu. Termín akutní žlutá atrofie jater poprvé užil Carl von Rokitansky (1804–1878) a William Bowman (1816–1892) v roce 1842 stanovil histologická kritéria pro jaterní steatózu, nejčastěji alkoholem podmíněné jaterní poškození (4).
Vědecky podložené poznatky o nepříznivém účinku alkoholu na lidské zdraví vznikly na Ústavu aplikované fyziologie v Yale (USA), jehož prvním ředitelem byl v letech 1920–1926 Yandell Henderson. On spolu s dalším lékařem a laboratorním pracovníkem Howard W. Haggardem se původně zabývali patofyziologii dýchání, nicméně svoji pozornost zaměřili rovněž na toxikologii, zejména na bojové plyny, užité poprvé ve Velké válce (1. světové válce). Haggard byl kapitánem vojenské chemické jednotky, a tak se do středu jeho zájmu dostaly účinnost plynových masek, průmyslové jedy, výfukové automobilové plyny apod. Vedlejším produktem jejich výzkumu bylo studium účinku alkoholu na lidský organismus a jeho zdraví, zejména v souvislosti s důsledky „grand experiment of National Prohibition“ a následně pak s kolapsem prohibice a legalizací konzumace alkoholu v USA. US Congress později užíval výstupů Hendersonova a Haggardova výzkumu v otázkách souvisejících s konzumací alkoholu (5). Laboratoř byla postupně přejmenovávána až na dnešní Rutgers Center of Alcohol Studies. V roce 1940 tato vědecká instituce založila časopis Quartelry Journal of Studies on Alcohol, který dnes nese název Journal of Studies on Alcohol and Drugs. K. M. Jellinek a N. Jolliffe v prvním čísle tohoto časopisu v článku a názvem „Effects of Alcohol on the Individua“ prezentovali na 78 stranách analýzu do té doby publikovaných prací o účinku alkoholu na lidský organismus. Již v tomto prvním čísle byly dále publikovány práce: Alkohol – studium sociální ambivalence, Faktory vzniku alkoholové závislosti, Nepříznivý vliv alkoholu na trávicí trakt, Alkohol a jeho účinek na zdravé a nemocné ledviny, Vliv alkoholu na dostatečnost vitaminu B. Jaterní alkoholové cirhóze byl věnován jen jeden 9stránkový článek Cirrhosis of the Liver napsaný Charlesem L. Connorem (6). V roce 1971 byla v USA založena instituce National Institute on Alcohol Abuse and Alcoholism (NIAAA) jako jedna z 27 amerických institucí a center sdružených v National Institutes of Health (NIH). Hlavním programem NIAAA je redukovat důsledky alkoholem podmíněných stavů, ať již jde o přímé poškození zdraví či důsledky psychosociální, kulturní, či ekonomické. Cílem NIAAA je výzkum a jeho praktická aplikace v medicíně a sociálních vědách, ale také celospolečenské vzdělávání a výchova.
I když se přímé poškození jater alkoholem dávno předpokládalo, za důležité kofaktory v etiopatogeneze poškození jsou mimo ostatní považovány příčiny rozvoje závislosti, genetické faktory a stav výživy. Klíčovou studii dokazující kauzální význam alkoholu v patogenezi alkoholové jaterní fibrózy provedli Mak et al. Autoři v ní sledovali v jaterních biopsiích paviánů ultrastrukturu lipocytů (Ito buněk) a jejich změnu v progresi jaterní fibrózy vlivem 10leté diety, v níž polovina energetického obsahu byla tvořena alkoholem, a ve druhé kontrolní skupině alkohol v potravě nebyl. Tato práce byla vyhlášena časopisem J Hepatology (tiskový orgán EASL) za jednu z milníkových publikací 2. poloviny 20. století (7, 8).
Metabolismus a vylučování etylalkoholu
Etanol se po požití rychle absorbuje do krve, zčásti již v dutině ústní, dále v žaludku a v duodenu. Maximum jeho koncentrace v krvi po jednorázovém požití dosahuje za 0,5–1 hod. Rychleji se vstřebávají nápoje teplé a obsahující CO2, pomaleji sladké a chladné. Absorpce etanolu závisí nejen na množství a druhu nápoje a na délce jeho pití, ale i na složení potravy, se kterou je případně konzumován. Jeho oxidace probíhá již v trávicím traktu a vstřebané množství do systémové cirkulace se tak může snížit až o 20 %. Po resorpci snadno difunduje do všech tělních tekutin a rychle se krví přenáší zejména do CNS. Jeho distribuční prostor představuje u mužů 60 % a u žen 70 % hmotnosti. Vypije‑li např. 70kilogramový muž 100 ml 38% destilátu, tj. 30 g etanolu, vytvoří se v jeho vnitřním prostředí koncentrace 0,6 g/l, tj. 0,6 ‰ etanolu.
Etanol je z těla odstraňován z 90–98 % oxidačními procesy a ze 2–10 % je vylučován dechem a močí. V lidském těle se metabolizuje hlavně v játrech cestou alkoholdehydrogenázovou, dále cestou mikrozomálního systému oxidace etanolu (MEOS, cytochrom P450IIE1) a konečně pomocí katalázy z peroxizomů. Schopnost oxidovat etanol je od narození, teprve ale od 5 roků je oxidace účinná. To je jedním z důvodů, proč nepodávat alkohol dětem. U žen je obecně oxidace horší, a také se zhoršuje s věkem. Při jednorázovém požití velkého množství etanolu může jeho eliminace oxidací zahltit více než 3/4 oxidační schopnosti organismu. Kvantitativně nejvýznamnější je alkoholdehydrogenázová cesta, kterou se oxiduje až 90 % přijatého alkoholu. Klíčovými enzymy této cesty jsou cytozolová alkoholdehydrogenáza (ADH) a aldehyddehydrogenáza (ALDH). Kromě jater je jejich aktivita v řadě jiných orgánů, např. v žaludku. U příležitostných pijáků je etanol z těla eliminován rychlostí 0,08–0,15 ‰/hod. Při poruše izoenzymu ALDH 2 vzniká syndrom akutní alkoholové intolerance. Tento genetický defekt existuje u řady etnik v Asii a po požití alkoholu se projevuje vzestupem koncentrace acetaldehydu s rozvojem antabusové reakce. Ta se projevuje nevolností, zvracením, dušností, zarudnutím, bolestí hlavy a hypotenzí v důsledku zvýšené koncentrace acetaldehydu v organismu. Disulfiram inhibuje ALDH a antabusová reakce je principem jeho podávání v léčbě alkoholové závislosti.
U chronických pijáků je alkohol eliminován cestou MEOS, popsanou v roce 1968 Lieberem a DeCarlim. Jde o jeden z izoenzymů cytochromu P450 označovaného P450IIE1 nebo CYP2E1. Jsou jím metabolizována xenobiotika, zejména etanol, benzen, fenol, ale i vitaminy A a D. Je indukovatelný nejen alkoholem, ale řadou dalších látek, které oxiduje. Indukce CYP2E1 je přítomna také v Kupfferových buňkách, které se podílejí na fibrogenezi jaterní tkáně.
Oxidace etanolu katalázou hraje nejméně významnou roli v metabolismu etanolu (9, 10).
Terminologie (2)
Jak vyplyne z níže napsaného, ukazuje se potřeba upravit terminologii pro onemocnění jater související s alkoholem mimo ostatní také proto, že dosavadní terminologie může být stigmatizující, osoby nadměrně konzumující alkohol nemusí být alkoholici. Inovovaná terminologie je uvedena v Tab. 1.
Tab. 1. Doporučená terminologie alkoholového jaterního poškození podle Guidelines EASL 2018 (2) 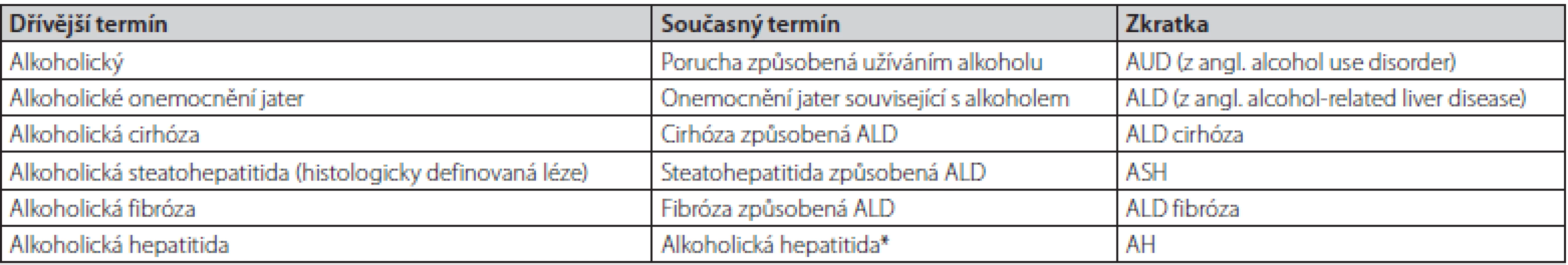
*V současnosti je termín alkoholická hepatitida příliš standardizovaný, aby bylo možné ho změnit, ale může k tomu dojít v dalších doporučených postupech. Veřejné zdraví a konzumace alkoholu
Podle údajů WHO (Word Health Organization) z roku 2014 (11) je škodlivá konzumace alkoholu příčinou asi 3,3 miliónů úmrtí ročně, což představuje 5,9 % všech úmrtí. U mužů je procento větší (7,6 % oproti 4,0 % u žen). Podle stejného zdroje je nadměrná konzumace alkoholu celosvětově příčinou 5,1 % všech nemocí a poškození zdraví. V uvedených datech však existují geografické rozdíly patrné již v Evropě. V jižní a západní Evropě se pije více vína, ve středoevropských zemích se pije spíše pivo, v severní a východní Evropě více destiláty. Dle současných údajů se v Evropě na spotřebě alkoholu z 37 % podílí pivo, 34 % připadá na destiláty a 26 % na víno. Podle údajů OECD (Organisation for Economic Co‑Operation and Development) z roku 2017 (12) je celosvětově průměrné množství konzumace alkoholu na jednu osobu a rok 6,13 l čistého alkoholu. V Evropě je to 10,9 l. V letech 1990–2014 byl sice v Evropě zaznamenán určitý pokles konzumace alkoholu, hlavně v bohatších zemích Západu, nicméně v zemích střední Evropy a jihovýchodní Evropy je konzumace stejná nebo dokonce narůstá. Nárůst je ale v posledních 20 letech patrný např. i ve Velké Británii nebo Finsku. V České republice se ročně konzumuje 11,1 l čistého alkoholu na osobu za rok a to ji řadí mezi největší konzumenty alkoholu na světě. Podle údajů WHO z roku 2011 se u nás vypije v přepočtu 14,97 l čistého alkoholu na dospělou osobu starší 15 let, čímž se zařazujeme na 1. místo celosvětového žebříčku před Andoru (14,08 l), Estonsko (13,77 l), Irsko (13,39 l) a Francii (13,3 l). Podle údajů z roku 2008 bylo v populaci ČR v posledním roce přibližně 10 % abstinentů, z nichž nejvíce ve věkové kategorii 55–65 let (13 %) a nejméně v kategorii 15–24 let (7 %). Mládež v České republice patří podle studie ESPAD z hlediska množství, frekvence konzumace a opilosti k nejvíce postiženým v Evropě. V ČR je SDR (Standartized Death Rate) pro cirhózu, nádory a úrazy spojené s alkoholem v rozmezí 40–49 úmrtí/100 000. Dle studie z roku 2007 se odhadují přímé zdravotní náklady na péči o nemocné v souvislosti s alkoholem na 2,6 mld. Kč za rok. Škody vzniklé v důsledku pití alkoholu představují v EU asi 125 miliard eur ročně. Alkohol je v EU příčinou každé 4. vraždy (2 000 obětí), každé 6. sebevraždy (10 000 mrtvých) a každé 3. smrtelné dopravní nehody (17 000 obětí) (13, 14).
Jak dokumentují staré texty, škodlivý účinek alkoholu, zejména při jeho nadměrné konzumaci, znali lidé již dávno. Stejně silně však přisuzovali alkoholu, zejména vínu, jeho prospěšnost pro zdraví. Je dobré v této souvislosti připomenout definici Světové zdravotnické organizace o cílech péče o veřejné zdraví, která říká, že „zdraví je stav úplné tělesné, duševní a sociální pohody, nejenom nepřítomnost nemoci nebo vady“. Zdravotní rizika civilizace, mezi která konzumace alkoholu také patří, by měli odborníci a celá veřejnost posuzovat tímto pohledem. Kontroverzní výsledky jsou však při posuzování doporučovaného množství. V publikovaných studiích bylo v posledních letech konstatováno, že protektivní účinek na rozvoj a komplikace AS je pouze při nízké dávce alkoholu asi 20 g denně. Konzumace alkoholu nad 50 g/den má vliv zcela opačný, a to nejen na riziko onemocnění jater, ale i na riziko rozvoje kardiomyopatie a poruch srdečního rytmu. Riziko vzniku a průběhu hypertenze stoupá o více než 100 %. Alkohol je uvažován jako rizikový faktor nádorového bujení. Např. acetaldehyd je definován jako kancerogen, který již působí v dutině ústní, a také v celém trávicím traktu. Je obtížené přesně definovat dávku a podíl vlivu etanolu na vznik nádorů kvůli jeho relativně časté konzumaci a přítomnosti dalších faktorů, např. stravovacích návyků. Celkem se odhaduje, že alkohol vyvolává 10 % nádorů u mužů a 3 % u žen. Riziko vzniku hepatocelulárního karcinomu u pacientů s jaterní cirhózou je 4,5–7× vyšší při konzumaci 80 g etanolu denně. Při současné chronické hepatitidě C je toto riziko 50–130× vyšší. Podíl alkoholu je prokázán na vzniku nádorů horního části trávicího traktu, ve 30–70 % takových případů je jedním z vyvolávajících faktorů nepřiměřená konzumace alkoholu, která je signifikantně zvýšená při současném kouření. Při konzumaci 100 g etanolu denně je riziko vzniku nádoru v této oblasti 6× vyšší než u populace, která alkohol nekonzumuje. Abúzus alkoholu nad 40 g etanolu/den je asociován i s rizikem vzniku kolorektálního karcinomu. Pro často zmiňovaný vznik karcinomu prsu u žen v souvislosti s abúzem alkoholu nejsou zatím jednoznačné důkazy, stejně tak pro riziko vzniku karcinomu plic nebo pankreatu (15). Konzumace alkoholu v průběhu těhotenství poškozuje plod a vyvolává fetální alkoholový syndrom, projevující se předčasným porodem, nízkou porodní hmotností, snížením intelektu a orgánovými změnami. Tento syndrom není nijak vzácný, ve Francii se takto rodí 700 postižených dětí ročně (12). Význam termínů mírné, přiměřené, zdravotně přiměřené nebo zdraví neškodné pití alkoholu je chápán velmi subjektivně. V mnoha studiích bylo zohledňováno pouze množství vypitého alkoholu bez ohledu na jeho druh. Rozdílná koncentrace alkoholu v jednotlivých druzích vedla ke snaze o jejich aproximaci. Již ale v tak základních druzích alkoholických nápojů jakými jsou pivo, víno či destiláty existují rozdíly z hlediska obsahu dalších látek. Nicméně, za konsenzuální úspěch lze považovat, že mírou konzumace alkoholu je celosvětově uznáván jeden „drink“. Přes všechny rozdíly a obtíže při sjednocování názoru na jeden drink (ve Velké Británii se rovná 8 g alkoholu, v Japonsku téměř 20 g) je v nejčastěji publikovaných údajích považován za standardní jeden drink nápoj o obsahu 13 g etanolu, což je 330 ml 5stupňového piva nebo 1,5 dl vína či 40 ml destilátu (16, 17).
Důsledky konzumace alkoholu jako civilizačního zdravotního rizika jsou nejen v oblasti orgánového postižení, ale dnes v první řadě v oblasti psychosociální, týkající se zejména mladé a střední generace. Pracovní a společenské propady, rozvraty rodin, sebevraždy, úrazy či usmrcení jsou v této sféře hlavními důsledky nadměrné konzumace alkoholu (18–20).
Důležité pro zdravotnickou a laickou veřejnost je zjištění, že neexistuje žádná zdraví prospěšná jeho dávka. Alkohol v malých dávkách může být „neškodný“, ale není zdraví prospěšný (21).
Alkoholismus a abúzus alkoholu
Abúzus neboli škodlivé užívání, znamená užívání látky vedoucí k poruše somatického nebo psychického stavu. Sem patří také nadměrná konzumace alkoholu, tedy abúzus alkoholu. Na druhé straně závislost, v případě alkoholu alkoholismus, je psychická porucha, charakterizovaná psychopatologickými, behaviorálními a kognitivními příznaky, které se vyvíjí po opakovaném užití substance (v případě alkoholismu alkoholu). U alkoholismu, na rozdíl od jiných závislostí, nedochází k zvýšení tolerance, ale naopak v důsledku jaterního poškození k jejímu snížení. Specifická léčba abúzu alkoholu se v praxi nepovažuje za nutnou na rozdíl od alkoholismu. Pro jednoduchou orientaci, zda se u nemocného jedná o prostý abúzus alkoholu nebo již alkoholismus bývá doporučován dotazník CAGE, resp. AUDIT (Alcohol Use Disorders Inventory Test) – Tab. 2 a 3. U více než 2 kladných odpovědí je pravděpodobnost závislosti, tedy alkoholismu vysoká. V Tab. 4 jsou uvedeny typy alkoholové závislosti podle cravingu (důvodů touhy po pití). V případě jaterního poškození se nejčastěji jedná o typ II (13). V doporučeném postupu EASL je významně zohledňovaná prevence nepřiměřené konzumace alkoholu. Ještě s větší naléhavostí by lékaři na všech úrovních měli zavčas odhalit tendenci k abúzu alkoholu. Proto jsou v doporučeném postupu EASL i další kritéria. DSM‑V (Diagnostic and Statistical Manual of Mental Disorders, 5th edition) definuje AUD konzumaci alkoholu, která vede ke klinicky signifikantní poruše zdraví a jejíž tíže závisí na počtu z dotazníkových kritérií zjištěných při návštěvě lékaře v posledním roce (Tab. 5) (2).
Tab. 2. Dotazník CAGE k průkazu abúzu alkoholu, resp. alkoholismu (2, 23) 
Tab. 3. Dotazník AUDIT k průkazu abúzu alkoholu, resp. alkoholismu (2) 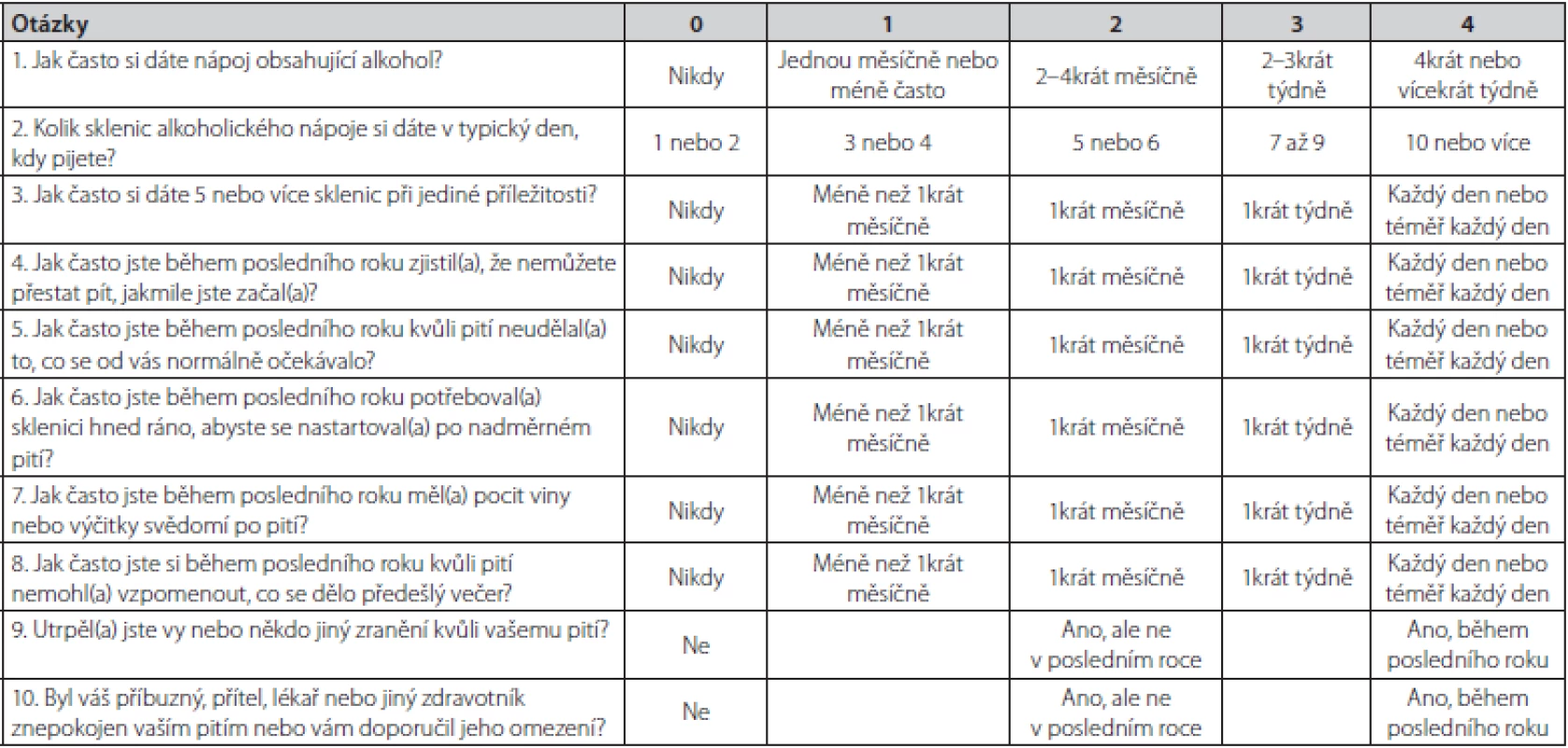
Tab. 4. Typy závislostí na alkoholu podle druhu cravingu (dle Lesche) 
Tab. 5. Dokument DSM-V (2) 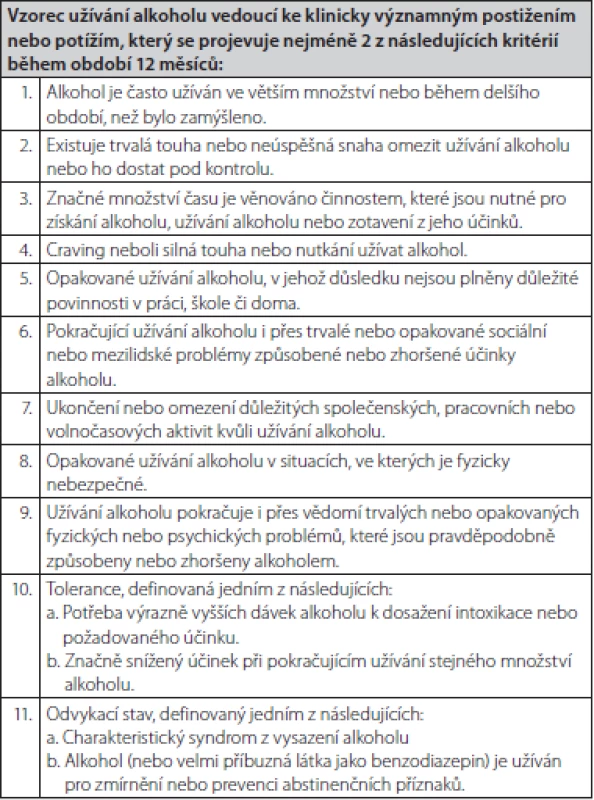
Přítomnost nejméně 2 z těchto kritérií ukazuje na AUD (porucha způsobená užíváním alkoholu).
Závažnost AUD je definována následovně:
Mírná: Přítomnost 2–3 kritérií
Středně závažná: Přítomnost 4–5 kritérií
Závažná: Přítomnost 6 a více kritériíLéčba alkoholové závislostí je komplexní, dlouhodobá, náročná pro všechny účastníky, tj. pacienta, zdravotníky, ale i okolí, zejména rodinu. Dnes se zdůrazňuje, že v terapii je efektivnější se zpočátku zaměřit na pacientovu motivaci k léčbě než na jeho vůli. Motivaci musí podporovat všichni, tj. praktický lékař, hepatolog, gastroenterolog, internista a další. Ti se nesmí cudně vyhýbat zmínce o pacientově závislosti s tím, že je to problém někoho jiného, ale při každé kontrole a znovu a znovu o závislosti hovořit a motivaci k odvykání zvyšovat (13). Čtenářům tohoto článku se může zdát, že textu k včasnému odhalení abúzu alkoholu nebo alkoholismu a dalším souvislostem s konzumací alkoholu je věnován příliš velký prostor s ohledem na název článku. Nicméně, z doporučení EASL je patrné, že včasná, důsledná a na všech úrovních zdravotní péče prováděná prevence nepřiměřené konzumace alkoholu je rozhodující k snížení prevalence, incidence a léčbě ALD. Farmakoterapie závislosti je v podávání senzitivujících preparátů, tedy medikamentů zhoršujících snášenlivost alkoholu. Dnes se u nás užívá disulfiram (Antabus). Po požití alkoholu vznikne do 15 min antabusová reakce. Druhou skupinou jsou anticravingové léky. Jde o léky blokující mozkové receptory k snížení touhy (cravingu) po alkoholu. Jsou to např. akamprosat, baklofen, ondasetron, od roku 2012 u nás nalmefen a další. Některé z nich jsou však kontraindikované u dekompenzovaného jaterního onemocnění (2, 13).
Epidemiologie ALD (onemocnění jater související s alkoholem)
ALD vzniká u konzumentů více než 2 drinků denně. Většina z nich má větší či menší hepatomegalii v důsledku steatózy, stavu relativně benigního a hlavně reverzibilního po 6–8 týdnech abstinence. Avšak pouze u 20–35 % těchto konzumentů se rozvine steatohepatitida a jen u 8–20 % jaterní fibróza nebo cirhóza. Proč tomu tak je, není dosud jasné. Nekropticky je jaterní cirhóza prokazovaná jen asi u 18 % pitvaných s údajem o těžké konzumace alkoholu během života a v bioptických nálezech jen u 17–31 % (22).
Nicméně, relativní riziko vzniku cirhózy rychle stoupá v závislosti na množství a celkové době konzumace alkoholu. Ve srovnání s 20gramovou denní konzumací po dobu 10–12 roků je 6× vyšší při požívání 40–60 g alkoholu denně a dokonce 14× vyšší při 60–80 g denně. Podle Lelbacha vznikne jaterní cirhóza u 50 % denních konzumentů 210 g alkoholu za 22 roků a u 80 % těch, kteří konzumují stejné množství 33 let. Obecně se udává, že jistá cirhóza vznikne při denním pití 180–200 g za 25 roků. U žen jsou uváděné hodnoty podle většiny studií menší až o polovinu. Na druhé straně abstinence zlepšuje průběh již existující alkoholové cirhózy (15).
Podle studie GDB (Global Burden of Disease) bylo v roce 2010 registrováno více než milion úmrtí v důsledku jaterní cirhózy, což představuje 2,0 % ze všech úmrtí, a z toho alkoholová jaterní cirhóza představovala téměř 48 %. U 31 milionů osob byla jaterní cirhóza příčinou DALY (Distability Adjusted Life Year), tj. agregovaného parametru vyjadřujícího roky ztraceného zdravého života. Alkoholová jaterní cirhóza z toho představovala opět téměř 47 %. Hepatocelulární karcinom (HCC) v terénu alkoholové jaterní cirhózy byl v roce 2010 příčinou 80 600 úmrtí (0,15 % ze všech úmrtí) a příčinou DALY u 2 142000 osob (0,09 ze všech DALY) (18, 20).
K faktorům, které je nutno zohlednit v epidemiologických studiích, patří také pravidelnost či nárazovost pití (tzv. binge drinking) a konzumace alkoholu nalačno či v průběhu jídla. Z hlediska poškození jater je nárazové pití alkoholu méně nebezpečné než menší, ale denní konzumace, poněvadž játra mají čas se regenerovat. Člověk by neměl pít alkohol alespoň 2 dny v týdnu. Příznivější je také konzumace alkoholu k jídlu než tak zvaná „out of meals“. Poškození jater nesouvisí s druhem nápoje, ale jen s množstvím alkoholu, který obsahuje (23).
Zatímco informace o prevalenci alkoholové cirhózy jsou ve vyspělých zemích poměrně přesné a úmrtí na cirhózu bývá mírou konzumace alkoholu, nelze totéž říci o steatóze či lehké nebo středně těžké fibróze. Odhaduje se, že celosvětově je alkohol příčinou asi 50 % všech jaterních cirhóz, ovšem se značnými geografickými rozdíly (např. převažujícím náboženstvím). V islámských zemích je to jen 10 %, ve Francii až 90 %. U nás je způsobeno alkoholem asi 30 % všech jaterních cirhóz, s větším podílem na jižní Moravě (22).
Diagnostické metody onemocnění jater související s alkoholem (ALD)
Jaterní biopsie
Jaterní biopsie je důležitá pro definitivní diagnózu ALD, exaktní stážování a k vyloučení případných dalších příčin jaterního onemocnění. Asi u 20 % pacientů s historií nepřiměřené konzumace alkoholu a abnormálními jaterními testy je současně prokázaná další příčina jaterního onemocnění. Proto se také provádí jaterní biopsie v II., resp. III. fázi klinických studií, týkajících se ALD (2). Dnes v praxi ve většině případů diagnostikujeme ALD na základě klinického obrazu, laboratorních nálezů a neinvazivních pomocných vyšetřovacích metod. Proto není obecně jaterní biopsie k diagnostice ALD nutná, již také ne proto, že je zatížená 2% rizikem komplikací včetně fatálních (24, 25).
Morfologické spektrum nálezů, které jsou u ALD v precirhotickém stadiu hlavně v centrální zóně lalůčku, zahrnuje: makrovezikulární, resp. smíšenou steatózu, hepatocelulární kulatobuněčnou infiltraci, balónovou degeneraci, Malloryho hyalin, fibrózu nebo cirhózu, resp. HCC. Z toho pak vyplývají klinické diagnózy: ASH (steatóza, resp. steatohepatitida způsobená ALD), AH (alkoholická hepatitida), fibróza jater způsobená ALD, cirhóza jater způsobená ALD a HCC (2, 24, 25).
Když v roce 1980 J. Ludwig et al (26) na základě histologicko/klinického nálezu označili NASH (Non‑alcoholic Steatohepatitis) jako samostatnou dosud nepopsanou nozologickou jednotku, otevřeli otázku, jak v praxi odlišit NASH od ASH. Histologický obraz obou je velmi podobný, i když zkušený patolog odlišnosti najde. Nicméně, konzultace s klinikem je vždy nutná (2, 27).
Laboratorní testy konzumace alkoholu
Biochemická vyšetření při ALD se v podstatě neliší od laboratorních vyšetření hepatopatií jiné etiologie. Nicméně, v případě i podezření AUD je nutné provést vyšetření laboratorních testů na konzumaci alkoholu. Dělíme je na přímé a nepřímé (2).
Nepřímé metody (2,28)
Stanovení GGT (gamaglutamyltransferáza). Odráží chronický excesivní abúzus alkoholu. Senzitivita pro abúzus je 42–86 %. Specificita 40–84 %. Interpretace výsledků vychází z poznání, že k patologickému zvýšení GGT dochází především u hepatobiliárních onemocnění. Řada xenobiotik z oblasti léků, průmyslových i zemědělských chemikalií a přírodních i syntetických jedů dokáže v hepatocytech indukovat syntézu mikrozomálního izoenzymu GGT de novo. To platí i o etanolu, a proto bývá stanovení GGT používáno jako screeningový test abúzu alkoholu. Existence řady uvedených nespecifických induktorů a možný vliv souběžného hepatocelulárního poškození a/nebo cholestázy však hodnotu tohoto testu silně limitují. Akutní intoxikace alkoholem je spjata až s 10násobným zvýšením GGT a toto zvýšení bývá relativně výraznější než zvýšení aminotransferáz. U chronické alkoholové hepatitidy, kde hodnoty také dosahují až 10násobku normy, se navíc předpokládá solubilizační účinek etanolu na membrány a uvolnění vázaného enzymu. Pro snazší interpretaci výsledku vyšetření GGT se někdy používá poměru (indexu, kvocientu) katalytických koncentrací GGT a AST. Poměr GGT/ AST nad 6 je typický pro chronickou alkoholovou hepatitidu, hodnoty 3–6 se vyskytují u obstrukcí a cirhóz. Kombinace těchto 3 parametrů má senzitivitu 27–52 % a specificitu 85–90 %. GGT klesá v průběhu abstinence a při opětovném abúzu hodnota GGT rychle stoupá.
Stanovení AST (aspartátaminotransferáza). Odráží chronický excesivní abúzus alkoholu. Senzitivita pro abúzus je 43–68 %. Specificita 56–93 %. Hodnoty mohou být ovlivněny (zvýšené) zejména při akutní hepatitidě různé etiologie, svalovým postižením (infarkt myokardu, rabdomyolýza).
Stanovení ALT (alaninaminotransferáza). Odráží chronický excesivní abúzus alkoholu. Senzitivita pro abúzus je 30–50 %. Specificita 51–92 %. Hodnoty mohou být ovlivněny (zvýšeny) jakýmkoliv akutním nebo chronickým onemocněním jater.
U alkoholové jaterní choroby zřídkakdy překročí hladiny aminotransferáz v séru hodnotu 5 μkat/l. To se částečně vysvětluje úbytkem pyridoxalfosfátu, který je koenzymem aminotransferáz a jehož nedostatek je pro chronické alkoholiky typický. Aktivita AST je více zvýšena než ALT, takže poměr AST ku ALT je obvykle vyšší než 2. Lékové a alkoholové intoxikace mívají mnohem mírnější vzestup aminotransferáz než např. intoxikace chlorovanými uhlovodíky.
Stanovení MCV (mean corpuscular volume). Odráží chronický excesivní abúzus alkoholu. Senzitivita pro abúzus je 24–74 %. Specificita 70–98 %. Hodnoty mohou být ovlivněny (zvýšené) při deficitu vitaminu B12 a kyseliny listové a při některých hematologických onemocněních.
Stanovení % CDT (karbohydrát‑deficientní transferin). Při chronickém abúzu alkoholu se v krvi a v likvoru zvyšuje zastoupení molekulových forem transferinu, které mají méně zbytků kyseliny sialové nebo je postrádají úplně. Jedná se tedy o částečně nebo zcela desialovaný transferin, pro nějž se vžilo nevhodné označení přejaté z anglosaské literatury „karbohydrát‑deficientní transferin“, neboli CDT. Po určité době abstinence jsou nepoškozená játra schopna znovu syntetizovat převážně tetrasialotransferin. Stanovení sumy všech desialovaných forem transferinu má proto specifický význam při diagnostice alkoholizmu a při sledování efektu protialkoholní léčby. Stanovení CDT patří mezi senzitivní a specifické markery abúzu alkoholu s poločasem 12 dní a cut‑off 2,5–3 %. Senzitivita testu je 24–45 %. Specificita 70–98 %.
Z dalších laboratorních vyšetření je vhodné stanovení koncentrace triacylglycerolů v krevním séru. Alkohol ovlivňuje spektrum krevních lipidů, zvyšuje HDL, avšak ve vyšších dávkách a při dlouhodobé konzumaci působí sekundární dyslipoproteinemii. Při jednorázovém alkoholovém excesu nebo akutní intoxikaci alkoholem se v krvi několikanásobně zvýší koncentrace triacylglycerolů a částečně i cholesterolu. Tento obraz je podstatně výraznější u chronických pijáků. V roce 1958 popsal L. Zieve stav, nazývaný po něm Zieveho syndrom, charakterizovaný ikterem, hyperlipidemií a hemolytickou anémií po nadměrné konzumaci alkoholu u nemocných se steatózou nebo již alkoholovou cirhózou. Klinický průběh takového stavu může být i fatální (29).
Nespecifické změny v séru při akutním a chronickém alkoholismu zahrnují zvýšení hodnot kyseliny mléčné a kyseliny močové. Kromě toho nadprodukce acetyl‑CoA vede k tvorbě acetacetátu a acetonu. Vzniká laktátová acidóza a ketoacidóza. V těchto stavech je tedy aktuální vyšetření pH a krevních plynů (Astrup). Pokles glykemie se popisuje po jednorázovém požití alkoholu a při intoxikacích alkoholem, je však typičtější u dětí. Vyšetření glykemie je zcela nezbytné, neboť hypoglykemii je třeba korigovat infuzemi. Aktivita fibrotizačního procesu se posuzuje podle koncentrace propeptidů kolagenu. Zejména u chronických intoxikací klesají hladiny magnezia a fosfátů.
Přímé metody (2)
Stanovení etanolu v dechu. Senzitivita je 97 % specificita 93 %. Detekční okno je 4–12 hod.
EtG (ethylglukuronid) – možné stanovení i v moči. Jedná o molekulu modifikovanou etanolem. Detekční okno do 80 hod. Pokud se stanoví ve vlasech, pak i 6 měsíců. Senzitivita je 89 %, specificita 99 %. K dalším podobným patří etylestery mastných kyselin, fosfatidylethanol, ev. ethylsulfát.
Další metody zjišťování konzumace alkoholu, zejména matematické modely a metody zobrazovací, jsou zmíněny u jednotlivých ALD.
Spektrum jaterních poškození v důsledku abúzu alkoholu
Jsou to prostá jaterní steatóza, steatohepatitida, fibróza, cirhóza a HCC. Intenzivně je studována otázka množství a délky konzumace alkoholu k progresi jedné formy do další pokročilejší až do cirhózy, ev. HCC. V dánské studii T. Duleurana et al (30) byla prokázána progrese biopticky verifikované steatohepatitidy v průběhu 5 let do jaterní cirhózy v 16 %, zatímco u těch, kteří měli jen prostou steatózu, byla progrese do cirhózy pouze v 6,9 %. Typ jaterního poškození je tedy důležitý pro predikci progrese, ale i v případě prosté steatózy je nutná abstinence. Jak vyplývá ze studie C. Lacknera et al (31), mortalita z důvodu ALD je 17 %, pokud byla diagnóza jaterní fibrózy stanovena brzo, na rozdíl od 43 %, pokud byla stanovena pozdě. Co se týká konverze jaterní fibrózy do cirhózy, existují ještě další rizikové faktory mimo alkohol. Je to zejména kouření (31), na rozdíl od kávy, jejíž konzumace má vliv opačný (32). Dalšími rizikovými faktory jsou pohlaví, obezita, diabetes mellitus, infekce HBV, resp. HCV a HIV infekce. Progresi do cirhózy mohou urychlovat některé léky (methotrexát) nebo přetížení organismu železem. Dnes se rovněž intenzivně studují faktory genetické, jako je polymorfismus genu PNPLA3 (2). Nicméně, praktické výstupy pro zastavení nebo zpomalení progrese jaterní fibrózy do cirhózy jsou v totální abstinenci, zákazu kouření, redukci hmotnosti, kontrolované léčbě cukrovky, uvážlivém užívání léků, vyvarování se polypragmazie a v účinné léčbě infekce HBV, resp. HCV. Venepunkce je indikovaná u přetížení železem jen v případě prokázané hereditární hemochromatózy. Naopak pití kávy může být faktorem protektivním. Co se týká konzumace alkoholu a vzniku HCC, obecně platí, že excesivní abúzus je karcinogenním faktorem, a to nejen pro HCC, ale i jiných malignit.
Zatím nejsou studiemi ověřené léky, které by přímo ovlivňovaly progresi fibrózy do cirhózy, i když kandidátů je řada, zejména ty, které ovlivňují proces fibrogeneze/fibrolýzy v jaterní tkáni. Tak zvaná hepatoprotektiva nesplňují na úrovní zatímních EBM očekávání, nicméně je i dlouhodobě podáváme hlavně z motivačních důvodů.
Steatóza/steatohepatitida způsobená ALD (ASH)
Jaterní steatóza – ztučnění jater („fatty liver“, fatty liver change) je nejčastějším a obvykle prvním typem jaterního poškození u pacientů s abúzem alkoholu, vyskytujícím se u nich přibližně v 90 %. Jde o histologickou jednotku, řadící se v patologii mezi dystrofické reverzibilní změny v jaterních buňkách. Charakterizuje ji hromadění triacylglycerolů (TG) v cytoplazmě hepatocytů ve formě kapének – vakuol. O steatóze mluvíme, když v hepatocytech je uloženo více než obvyklých 5 % tuku. Typ steatózy označujeme podle velikosti tukových kapének – makrovezikulární, smíšená a mikrovezikulární. Na Obr. 1 je histologie prosté makrovezikulární steatózy, typické u nemocných s abúzem alkoholu. Stupeň jaterní steatózy hodnotíme podle rozsahu postižení, pokud je postiženo méně než 25 % hepatocytů, mluvíme o lehké steatóze, u těžké steatózy je ztučněním postiženo více než 75 % hepatocytů. Histologické změny jsou reverzibilní. K regresi vede absolutní alkoholová abstinence. Naopak pokračující konzumace alkoholu vede k rozvoji steatohepatitidy a následně k progresi v jaterní fibrózu a cirhózu. Steatohepatitida již není benigním onemocněním. Kromě nadměrného ukládání tuku v hepatocytech je histologicky obraz charakterizován kulatobuněčným zánětlivým infiltrátem (v precirhotickém stadiu v centrální zóně lobulů, později i portálně). Dále přítomností regresivních (balónových) změn hepatocytů a Malloryho‑Denkova hyalinu (Obr. 2). Již v roce 1954 v monografii editované Sherlockovou (33), tedy ještě před rutinním prováděním jaterní biopsie (34), je uvedeno, že hlavní příčiny jaterní steatózy jsou nutriční a metabolické, tedy v praxi nadváha, diabetes mellitus 2. typu a nepřiměřená konzumace alkoholu. Mělo se za to, že úprava životosprávy, léčba cukrovky a dyslipidemie a úplná abstinence povedou během 6–8 týdnů k ústupu steatózy, normalizaci aminotransferáz a výrazné úpravě obrazu „světlých“ jater při abdominální US. V mnoha případech je to pravda a prostá steatóza byla a je stále považovaná za relativně benigní reverzibilní poruchu. Proto také nebyla (a stále není) specifická farmakologická léčba s tím, že úplná abstinence a léčba základních chorob, které se vznikem steatózy souvisí, je dostatečným léčebným opatřením.
Obr. 1. Makrovesikulární jaterní steatóza vzniká u 90–95 % konzumentů > 40 g alkoholu/den. Na obrázku je středně těžká smíšená steatóza s postižením minimálně 50 % hepatocytů 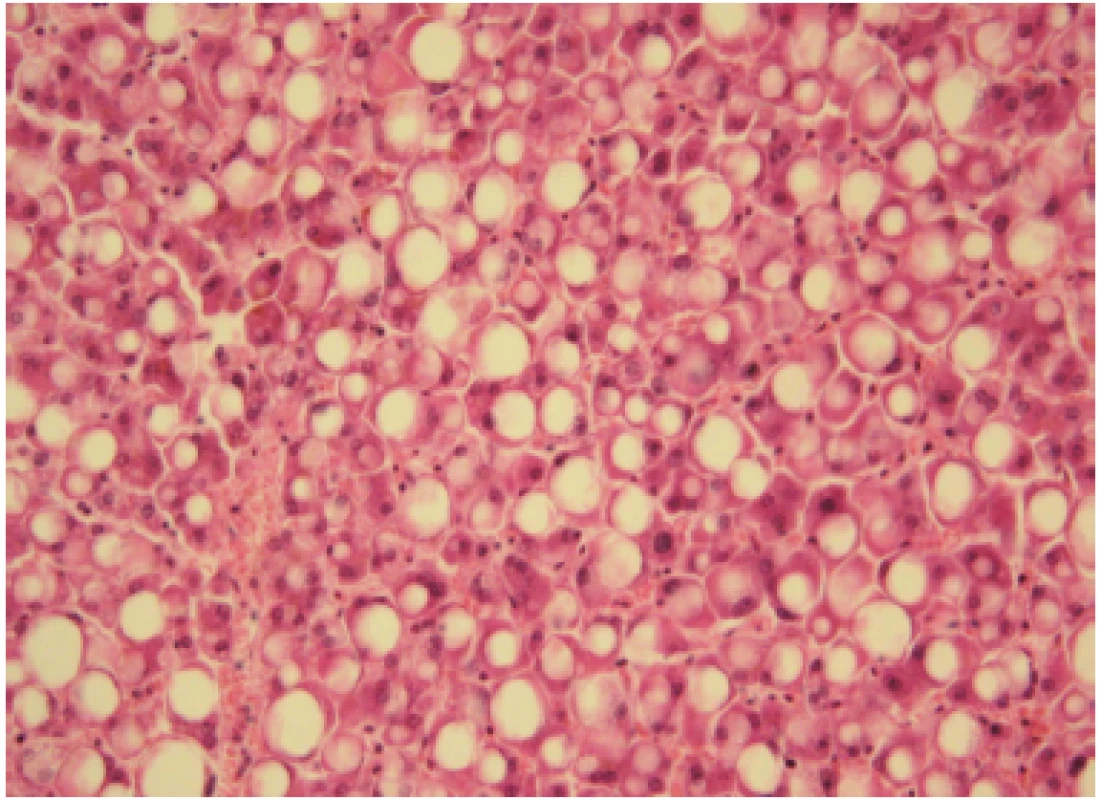
Obr. 2. Steatohepatitida způsobená ALD. Na obrázku jsou zobrazeny znaky poškození hepatocytů – balónová degenerace (*), Malloryho hyalin (žlutá šipka), kulatobuněčný infiltrát (bílá šipka) 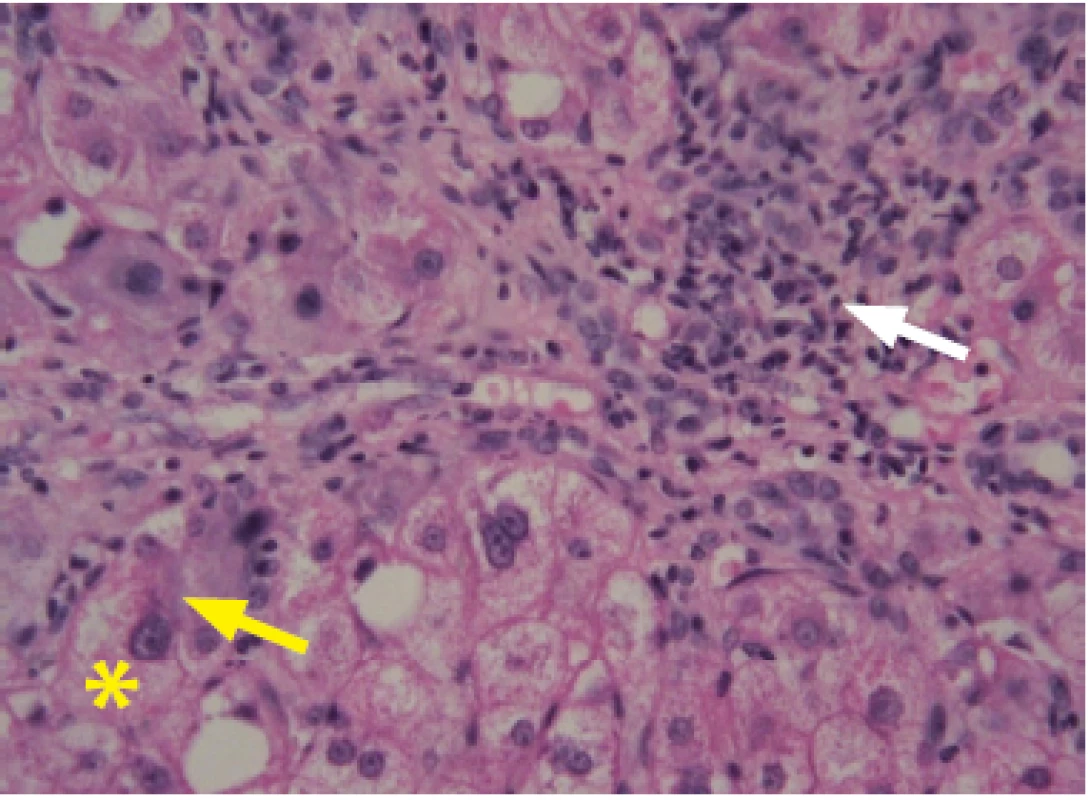
Zájem výzkumníků, ale i kliniků o ASH se akceleroval zavedením nové samostatné nozologické jednoty NASH (26). Hovoří‑li se o ústupu steatózy při dodržování zmíněných opatření v průběhu 6–8 týdnů, je třeba vědět, že laboratorní a zobrazovací metody odhalí steatózu, až když je v hepatocytech obsah tuku větší než 30 %, a to platí i pro iniciální stadia steatohepatitidy. Osud „nepoznaným“ NASH, resp. ASH, a vývoj nových citlivějších metod neinvazivní detekce ASH i NASH jsou horkým tématem dnešní hepatologie. Steatohepatitida ale není jen rizikem rozvoje jaterní fibrózy, resp. cirhózy či HCC, ale i vzniku mimojaterních projevů (35).
Subjektivní stesky nemocných jsou různorodé. Mnohdy potíže chybí a nemocný je indikován k hepatologickému vyšetření na podkladě patologických jaterních testů zjištěných při vyšetření z jiného důvodu (preventivní vyšetření, předoperační vyšetření). U těžších steatóz se vyskytuje tlak v pravém podžebří, zažívací obtíže, nevolnost, zvracení, průjmy, nadýmání, váhový úbytek. Při fyzikálním vyšetření nacházíme játra zvětšená s hladkým povrchem.
Laboratorní nález je popsán v předchozím textu. V diagnostice je možné užít i matematické modely, např. Steato Test, který je odvozen od FibroTestu navýšením o BMI, cholesterol, TG a glykemii. Zobrazovací metody, jakými jsou sonografie, počítačová tomografie a magnetická rezonance, ukazují změny jaterního parenchymu, které však nejsou specifické podle etiologie. Sonografie jater ukazuje v případě jaterní steatózy obraz „světlých jater“.
Nejvíce signifikantním sérovým testem steatohepatitidy je detekce fragmentu cytokeratinu 18 M65, resp. 18 M30.
Léčba prosté jaterní alkoholové steatózy spočívá především v abstinenci. Ta vede k ústupu potíží, zlepšení celkové kondice pacienta, normalizaci laboratorních nálezů a UZ nálezu. Medikace hepatoprotektiv má ve srovnání s abstinencí význam spíše podpůrný, stejně jako vitaminy. Jako hepatoprotektiva doporučujeme silymarin nebo esenciální fosfolipidy. Horkým tématem hepatologie je léčba steatohepatitidy, která může perzistovat nebo progredovat i přes nemocným uváděnou abstinenci. V takových případech je třeba vyloučit a léčit NASH. Často ale je neúspěch v tom, že pacienti abstinenci – totální abstinenci – nedodržují.
Alkoholická hepatitida (AH)
Alkoholická hepatitida je klinický syndrom charakterizovaný nově vzniklým ikterem s nebo bez jiných známek jaterní dekompenzace (ascites nebo encefalopatie) u pacientů s abúzem alkoholu. Není však neobvyklé, že se symptomy objeví i u pacientů, kteří již ukončili konzumaci alkoholu před několika dny či týdny. Vzniká za několik dní po alkoholovém excesu. Množství požitého alkoholu se individuálně liší. Symptomatologie je různá v závislosti na průběhu. Lehké formy jsou mitigovány alkoholovým abúzem. Projevují se většinou dyspeptickými obtížemi za několik dnů po alkoholovém excesu. Těžké formy akutní alkoholické hepatitidy vedou k jaternímu selhání. Nemocný je ikterický, stav vědomí je ovlivněn jaterní encefalopatií, ale mnohdy i delirantními stavy v důsledku alkoholismu. Mohou být projevy krvácení při trombopenii a koagulopatii, projevy portální hypertenze s ascitem a jícnovými varixy, febrilie a leukocytóza (2).
Těžký průběh akutní alkoholické hepatitidy bývá asociován s vyšším věkem, akutním selháním ledvin, vysokými hodnotami bilirubinu, leukocytózou, konzumací alkoholu > 120 g/den, přítomností infekce, jaterní encefalopatií a krvácením do gastrointestinálního traktu.
Cholestatický průběh akutní alkoholické hepatitidy má velmi špatnou prognózu, horší než formy bez cholestázy (36).
Alkoholická hepatitida může také probíhat jako chronická, kdy během několika let dochází postupně k fibrotizaci v játrech a jaterní cirhóze.
Z diagnostických testů AH jsou to zejména: mnohonásobně zvýšené ALT a AST, hodnoty De Ritisova koeficientu se blíží 2, elevace GMT, v případě cholestázy i ALP, hyperbilirubinemie, snížení hodnot albuminu, haptoglobinu a transferin, zvýšení α2-makroglobuminu, ceruloplazminu a všech tříd imunoglobulinů, leukocytóza, trombopenie a makrocytóza.
Zobrazovací metody, jako jsou sonografie nebo počítačová tomografie, popisují sice změny, ale ty nejsou specifické pro alkoholickou hepatitidu (37).
Biopsie jater potvrdí diagnózu a vyloučí jiný původ klinického stavu, event. se může podílet na prognóze. V praxi ji provádíme v případech diagnostické nejistoty. Na druhé straně u pacientů s jaterní cirhózou, u kterých jsme neindikovali biopsii, by měla být zvlášť pečlivě zhodnocena klinická a laboratorních kritéria AH (25). Na druhé straně je biopsie indikovaná zejména u nemocných s protrahovaným průběhem AH, kdy během 6–8 měsíců abstinence není dosaženo zásadního zlepšení. V histologickém obrazu nacházíme změny popsané již v předešlých kapitolách.
Prognóza alkoholové hepatitidy je u těžkého průběhu vážná. K odhadu krátkodobého přežívání lze užít tzv. Maddreyho skóre: index přežívání= (4,6× zvýšení tromboplastinového času v sekundách) + bilirubin (mg/100 ml).
Hodnoty vyšší než 32, a také jaterní encefalopatie, signalizují velmi špatnou prognózu (22).
Podobný prognostický význam je přičítán Glasgow alcoholic hepatitis score (GAS). Má 5 parametrů: věk, počet leukocytů, urea, INR a bilirubin. Hodnotě každého parametru přísluší určitý počet bodů, jejich součet potom určuje závažnost průběhu AH (15).
Základem léčby je, stejně jako u jiných onemocnění jater způsobených alkoholem, absolutní abstinence. K jejímu udržení je mnohdy nutná i farmakologická prevence abstinenčních příznaků.
U všech nemocných je nutná dostatečná hydratace a nutriční podpora, byl zjištěn příznivý vliv enterální výživy. Podáváme rovněž antioxidačně působící látky – vitaminy A, C, E, selen, koenzym Q10, silymarin.
Antibiotika jsou podávána s cílem ovlivnit střevní flóru a jaterní encefalopatii, léčit spontánní bakteriální peritonitidu a infekční komplikace. V léčbě jaterní encefalopatie doporučujeme na prvním místě lactulózu, při nedostatečném efektu podání rifaximinu.
U nemocných se spontánní bakteriální peritonitidou volíme k léčbě nejčastěji cefotaxim, alternativou je amoxicilin s kyselinou klavulanovou.
U závažného průběhu alkoholové hepatitidy je indikováno podání pentoxifylinu a glukokortikoidů. Pentoxifylin inhibuje produkci TNFα, který je u alkoholové hepatitidy zvýšen. Glukokortikoidy příznivě ovlivňují průběh těžké alkoholové hepatitidy. Jejich indikaci podporují výsledky skórovacích systémů: Maddrey skore ≥ 32 a GAS ≥ 9. Podáváme prednison v iniciální dávce 40 mg denně až 28 dnů, s postupným snižováním při dosažení zlepšení.
Součástí léčby jsou také inhibitory protonové pumpy k prevenci krvácení do GIT (38). Další dlouhodobé přežití nemocných, kteří překonali alkoholovou hepatitidu, závisí na jejich dlouholeté abstinenci (36).
Acute on chronic liver failiure (ACLF) a alkoholická hepatitida
ACLF je charakterizovaný akutní dekompenzací chronicky probíhajícího jaterního onemocnění asociovaného se selháním orgánů a vysokou krátkodobou mortalitou. Až 40–50 % ACLF nemá objasněný spouštěč, v ostatních případech je to hlavně aktivní abúzus alkoholu, sepse nebo virová hepatitida. Průběh ACLF je dynamický a mění se v průběhu hospitalizace. Většina pacientů má jasnou prognózu mezi 3. a 7. dnem od přijetí do nemocnice a klinická rozhodnutí nebo diskuze o cílech péče by měla být přizpůsobena klinickému skóre (39). Závažná alkoholická hepatitida představuje přibližně 25 % případů ACLF (2). Její závažnost je podmíněná vznikem orgánového selhání, spojeného se systémovou zánětlivou reakcí organismu. Systémový zánět může být způsoben bakteriální infekcí, která se vyskytuje přibližně u 30 % pacientů přijatých do nemocnice se závažnou alkoholickou hepatitidou (37). Nadměrná konzumace alkoholu je spojena s intestinální dysbiózou a zvýšenou permeabilitou střev, což podporuje translokaci bakterií (40). To může vysvětlovat, proč je spontánní bakteriální peritonitida nejčastější infekcí u pacientů s AH (37). Je však také pozorovaná u pacientů bez klinicky zjistitelné bakteriální infekce a nejsou jasné mechanismy vysvětlující její vznik. Některé prozánětlivé molekuly jsou v játrech u pacientů s AH exprimovány nadměrně, což naznačuje, že tyto molekuly mohou rozšířit a dosáhnout systémové cirkulace (37). Terapií akutně probíhajícího jaterního onemocnění nasedajícího na chronicky poškozená játra jsou extrakorporální systémy podpory jater MARS nebo Prometheus. Prospektivní studie ukázaly, že MARS je schopen zlepšit příznaky cholestázy, funkci jater a ledvin a hemodynamiku, vliv na přežití však není přesvědčivý. Transplantace jater představuje definitivní léčbu (41–45). Pokud nejsou žádné kontraindikace, mělo by být u všech pacientů přehodnoceno její provedení. Nicméně transplantace v tomto kontextu je brzděna nedostatkem dárců a také vysokou četností kontraindikací, pro které tito pacienti mohou být „příliš nemocní k transplantaci“ (46).
Jaterní fibróza a cirhóza způsobené ALD
Významná dlouholetá konzumace alkoholu směřuje k rozvoji fibrotických změn v játrech a jejich progresi v jaterní cirhózu. Jaterní fibrózu definujeme jako strukturální změnu jaterní tkáně s nadměrným ukládáním vazivové hmoty, kdy došlo k poruše regulace její syntézy a degradace ve prospěch tvorby (47). Histologický obraz jaterní fibrózy je na Obr. 3. Jaterní cirhózu definujeme jako chronické, obvykle progredující onemocnění histologicky charakterizované nekrózami hepatocytů a větší či menší zánětlivou kulatobuněčnou infiltrací (znaky aktivity, tedy perzistence etiologického agens), proliferací vaziva a nodulární regenerací (znaky fibrózy a přestavby) a ztrátou a transformací lobulární struktury a poruchou intrahepatální a intraacinózní mikrocirkulace (znaky portální hypertenze). Fibrotizace u alkoholového postižení postupuje pericelulárně a centrolobulárně. Histologický obraz jaterní cirhózy je na Obr. 4. Podle velikosti uzlů rozlišujeme velkouzlový, malouzlový a smíšený typ cirhózy. V případě alkoholové příčiny je typická malouzlová cirhóza s průměrem uzlů do 0,3 cm. Riziko pokročilého jaterního onemocnění s různým stupněm fibrózy je již při množství konzumovaného alkoholu větší než 30 g denně nebo více než 7 drinků týdně u žen a 14 drinků u mužů (2). Kromě množství konzumovaného alkoholu záleží také, jak bylo již výše uvedeno, na frekvenci pití, protože každodenní konzumace neposkytuje játrům žádný čas na regeneraci, a na návaznosti na jídlo. Progrese jaterní fibrózy do cirhózy není podmíněna jen samotným alkoholem, ale i dalšími faktory, které byly rovněž zmíněny výše. Rychlejší progrese jaterní fibrózy je popsána u žen. Jsou i etnické rozdíly, horší prognózu mají Hispánci.
Obr. 3. Histologický obraz mikronodulární jaterní cirhózy při různých zvětšeních 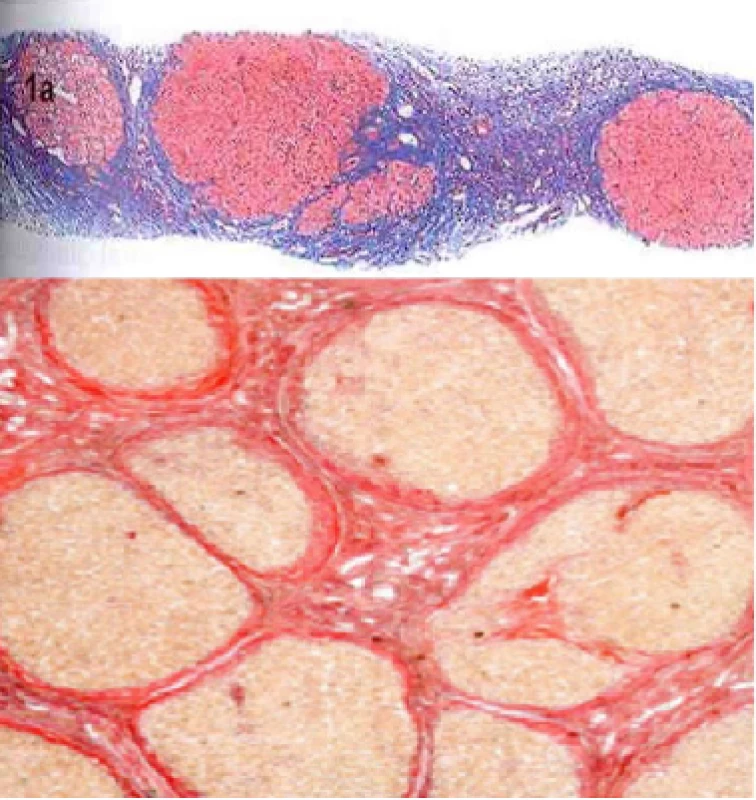
Obr. 4. Obraz jaterní alkoholové steatofibrózy. Vazivová tkáň je označena * 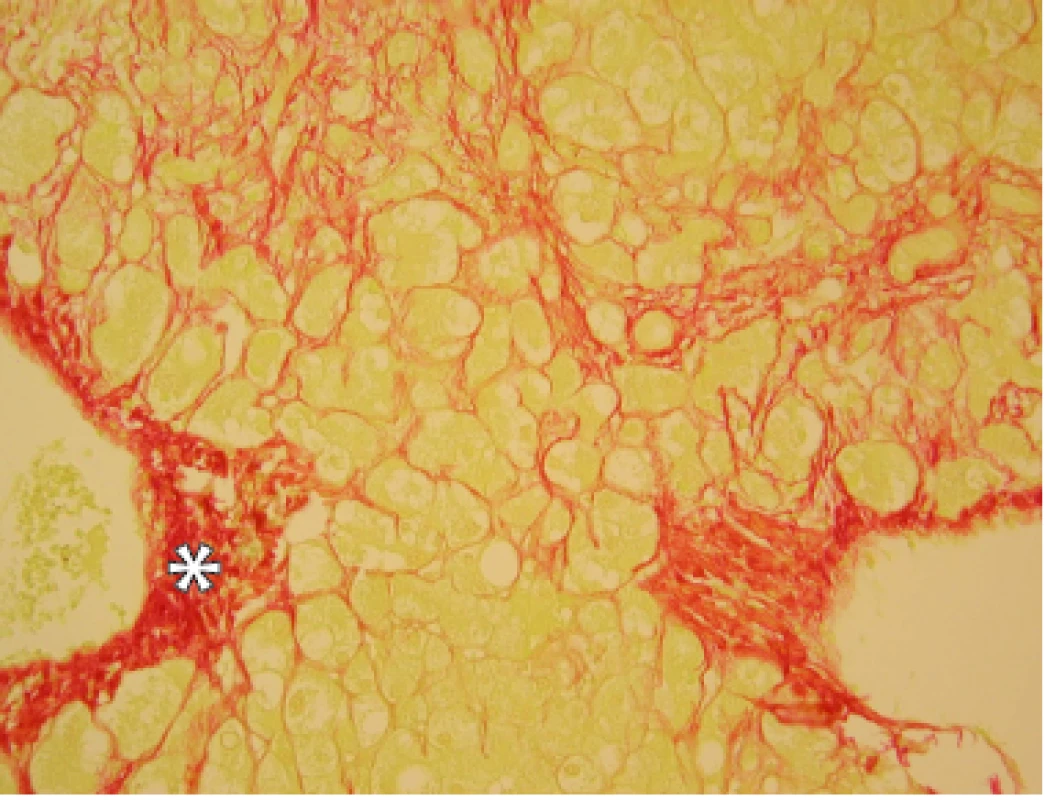
Parametry ukazující na abúzus alkoholu jsou rovněž zmíněny výše.
Klinický obraz alkoholové cirhózy, tedy cirhózy způsobené ALD, je v podstatě stejný jako při cirhóze z jiných příčin. Často je nemocný dlouho asymptomatický a k lékaři přichází až ve stadiu manifestním s obrazem kompenzované nebo dekompenzované cirhózy, tj. s příznaky portální hypertenze, metabolického selhání, cholestázy nebo HCC. Vyšetření jaterní fibrózy obecně, tedy i v případě alkoholového původu, doznalo v posledním desetiletí zásadních změn. Tzv. zlatým standardem v diagnostice jaterní fibrózy je stále jaterní biopsie. Jde však o invazivní výkon, zatížený rizikem komplikací, a proto velkého rozmachu dosáhly neinvazivní metody diagnostiky jaterní fibrózy i jaterní cirhózy (48, 49). Výhodou těchto metod je opakovatelnost, pro pacienta jsou přijatelnější než jaterní biopsie. K vyšetření jaterní fibrózy vedou v zásadě dvě neinvazivní cesty: elastografické metody a sérové markery a testy jaterní fibrózy.
Elastografické metody jsou založeny na měření tuhosti jaterní tkáně. Výsledek měření v kPa odpovídá určitému stupni fibrózy označovanému F1–F4 (F4 je již cirhóza). Užívány jsou Fibroscan, ShearWave elastografie, Acoustic Radiation Force Impuls Elastography (ARFIE).
Elastografie pomocí Fibroscanu je neinvazivní metoda vyšetření jaterní fibrózy, založená na měření tuhosti jaterní tkáně. Fibroscanem je vyšetřen okrsek jaterní tkáně odpovídající tvarem válci o průměru 1 cm a délce 4 cm. Objem vyšetřené tkáně je asi 100× větší než objem tkáně získané jaterní biopsií. Nicméně, měření elasticity jaterní tkáně pomocí Fibroscanu komplikuje ascites, obezita, městnání krve v játrech a cholestáza, způsobená obstrukcí žlučových cest. Výhodou ARFIE a Shear Wave elastografie ve srovnání s Fibroscanem je možnost anatomického zobrazení, detekce izoechogenních lézí a menší limitace ascitem nebo obezitou (48).
Stanovení sérových markerů jaterní fibrózy I. třídy odráží proces fibrogeneze a fibrodegradace, nejčastěji jsou užívány kyselina hyaluronová, α2-makroglobulin, N‑terminální peptid prokolagenu typu III (P III NP), tkáňový inhibitor matrix metaloproteinázy I (TIMP1). Sérové markery II. třídy jsou označovány jako tzv. rutinní, byly odvozeny od standardních laboratorních testů, nesouvisí bezprostředně s patogenezí fibrózy, ale při fibróze a cirhóze se mění. Byly vybírány tak, aby za použití různých matematických modelů poskytovaly co nejlepší nástroj pro detekci fibrózy a pro staging a grading jaterního onemocnění. Bylo navrženo mnoho různých kombinací parametrů, včetně ukazatelů porušené integrace hepatocytů – AST, ALT, dále koagulačních testů, stanovení bilirubinu, haptoglobinu, apolipoproteinu A1, GGT, cholesterolu a dalších. Některé testy zohledňují i věk a pohlaví (49).
Z testů k vyšetření jaterní fibrózy získal největší věhlas komerčně nabízený Fibro Test, který je počítán z těchto parametrů: věk, pohlaví, α2-makroglobulin, bilirubin, aktivita GGT, apolipoprotein A1 a haptoglobin.
U nemocných s alkoholovým postižením jater, jsou k vyšetření jaterní fibrózy a jejímu sledování vhodnější matematické testy z těchto parametrů: protrombinový čas, GGT, apolipoprotein A1, α2-makroglobulin nebo Rosenbergův test: hyaluronová kyselina, P III NP, TIMP 1 nebo FibroMeter: trombocyty, protrombinový čas, AST, α2-makroglobulin, kyselina hyaluronová, urea a věk.
Asi nejjednodušším testem k posouzení přítomnosti významné fibrózy, je AP test – viz následující vzorec, který po zadání je komerčně vypočítán.
- věk (roky):
- < 30 = 0
- 30–39 = 1
- 40–49 = 2
- 50–59 = 3
- 60–69 = 4
- ≥ 70 = 5
- trombocyty (×109/l)
- ≥ 225 = 0
- 200–224 = 1
- 175–199 = 2
- 150–174 = 3
- 125–149 = 4
- < 125 = 5
- AP je součtem výše uvedených výsledků (možné výsledky 0–10).
- AP index 6 a vyšší je signifikantní pro pokročilou fibrózu.
Jaterní fibróza je dynamický děj, je reverzibilní. Kauzální léčba, tedy abstinence, může zabránit progresi do jaterní cirhózy a rozvoji portální hypertenze. Při pokračujícím abúzu alkoholu dospěje pacient k jaterní cirhóze s možnými dalšími komplikacemi.
Ze subjektivních potíží nemocní často uvádějí únavu, nechutenství, tlak nebo bolesti pod POŽ, meteorismus, průjmy, váhový úbytek, poruchy menstruačního cyklu, erektilní dysfunkci, projevy krvácení s tvorbou hematomů. V latentním stadiu bývají ale bezpříznakoví. V objektivním nálezu dlouho nemusíme shledat žádnou patologii, posléze se objevují pavoučkové névy na horní části trupu, palmární erytém a další příznaky patřící do obrazu manifestní jaterní cirhózy. Dekompenzace jaterní cirhózy spočívá v progresi portální hypertenze, zhoršení eliminačních a syntetických funkcí jater, vzniku cholestázy, ev. HCC. Komplikace alkoholové jaterní cirhózy se neliší od cirhóz jiné etiologie a stejná i jejich léčba. Mortalitu nemocných s alkoholovou jaterní cirhózou významně zvyšují bakteriální a septické komplikace, které komplikují nebo mnohdy i zapříčiní ACLF (49), tedy o multiorgánové selhání vyžadující komplexní terapii.
Alkoholová jaterní cirhóza představuje riziko vzniku HCC. Jeho vývoji nedokážeme zabránit, abstinence však může riziko zmenšit. Pravidelnými sonografickými kontrolami můžeme zjistit HCC ve stadiu dovolujícím kurativní léčbu, tj. resekci nebo transplantaci jater.
Transplantace jater
Indikační rozvaha o vhodnosti transplantace jater (LT) řeší 2 základní otázky. Je onemocnění pacienta natolik závažné, že LT i přes svá rizika přináší vyšší pravděpodobnost přežití než jiná léčba? Za druhé, přinese LF nemocnému opravdu očekávaný bendit a je nemocný náročného výkonu schopen a je také schopen celoživotní další spolupráce? (50) Po transplantaci je roční přežití pacienta a štěpu přibližně 80–85 %. Výsledky poukazují na zlepšení přežívání pacientů i štěpů, podobné těm, které byly pozorovány po transplantaci pro jiné etiologie (50–52). Ačkoli pouze menšina pacientů s AUD splňuje přísná kritéria požadovaná pro LT, počet provedených transplantací pro pacienty s ALD se během posledních 2 desetiletí zvýšil. Mezi lety 2004 a 2013 byl počet nových transplantací jater pro ALD v USA zvýšen o 45 % (51). Změna právních předpisů, rozšířená kritéria vhodných dárců, investice do zdravotní péče, infrastruktury a vzdělávání jsou důležitými otázkami pro zvýšení počtu dárců orgánů. Přestože ALD je zařazen mezi 3 nejčastější indikace pro LT v Evropě a USA (51), je nadále nejvíce kontroverzní z hlediska veřejné reakce (53). Široká veřejnost a odborníci v oblasti lékařství nadále zpochybňují stupeň priority, který by měly programy poskytovat pacientům s ALD (51, 52). Transplantace u pacientů s abúzem alkoholu zůstává vzácným příkladem, kdy osobní morální úsudek může ovlivnit etické výkony v medicíně. Průzkumy veřejného mínění, které používají anonymní dotazníky, ukázaly, že široká veřejnost a rodinní lékaři negativně upřednostňují LT u pacientů s AUD a je větší pravděpodobnost, že přidělí orgány pacientům s dědičnými nebo získanými nemocemi, které jsou méně přímo spojeny s chováním. Hlavním problémem je nalézt pacienty, u kterých lze očekávat abstinenci, proto je potřebné psychosociální posouzení stanovení pravděpodobnosti dlouhodobé abstinence. Vzhledem k tomu, že zneužívání alkoholu a závislost může být spojena s osobnostními poruchami, depresí, úzkostí, zneužíváním více látek a jinými psychiatrickými poruchami, je nezbytné psychiatrické hodnocení stavu pacienta (51). Je pak nutný multidisciplinární přístup, který vyhodnocuje nejen lékařskou, ale i psychologickou vhodnost pro transplantaci. Mezi 3 hlavní rizikové faktory alkoholového relapsu patří délka trvání abstinence před transplantací, slabé sociální zázemí a rodinná anamnéza alkoholismu. Většina programů vyžaduje u pacientů 6měsíční období abstinence. Předpokládá se, že 6měsíční období abstinence umožní některým pacientům zotavit se z jejich jaterního onemocnění a odstranit potřebu LT, a zároveň identifikovat podskupiny pacientů, kteří pravděpodobně udržují abstinenci pro LT (50, 52). Mnoho studií skutečně podpořilo platnost 6měsíčního abstinenčního kritéria, avšak také poznamenalo, že jeho použití samo o sobě přinutilo značný počet kandidátů s relativně nízkým rizikem relapsu, aby ostali na čekací listině. Navzdory častému používání 6měsíčního pravidla Mezinárodní transplantologická společnost, United Network for Organ Sharing (UNOS), klinické praktické pokyny EASL pro ALD a transplantaci toto opatření nepotvrdila jako formální doporučení (2, 51, 52, 54).
Závěrečná doporučení managementu chorob jater souvisejících s alkoholem (ALD) podle EASL z roku 2018 s úrovní důkazů 1, resp. 2, a silou doporučení A, resp. B v GRADE systému (2)
(z anglického originálu provedlo překlad Centrum pro výuku cizích jazyků Lékařské fakulty Univerzity Palackého v Olomouci)
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Jiří Ehrmann, CSc., ehrmannj@fnol.cz
II. interní klinika – gastroenterologická a geriatrická LF UP a FN, I. P. Pavlova 6, 775 20 Olomouc
Zdroje
1. Pandida RJ. Introduction to alcohol studies: 75 years in review. Journal of Studies on Alcohol and Drugs March 2014; Suppl. 17; 5–7.
2. European Association for the Study of the Liver. EASL clinical practice guidelines: management of alcohol‑related liver disease. J Hepatol 2018; 69; 154–181.
3. Brodanová M, Ehrmann J. Historie. In: Hůlek P, Urbánek P et al (eds.) Hepatologie. 3. vydání. Praha: Grada Publishing 2018; 3–16.
4. Franken FH, Falk H. History of liver disease. In: McIntyre N, Benhamou JP, Bircher J et al (eds.): Oxford Textbook of Clinical Hepatology. Oxford University Press 1991; 1455–1460.
5. Candon PM, Ward JH, Pandina RJ. The Journal of Studies on Alcohol and Drugs and the Rutgers Center of Alcohol Studies. A History of the evolution of alcohol research. J Stud Alcohol Drugs 2014; Suppl. 17; 8 - 17.
6. Connor CL. Cirrhosis of the liver. Quarterly J Studies Alcohol 1940; 1; 95–104.
7. Mak KM, Leo MA, Liber CS Alcohol liver injury in babbons: transformation of lipocytes to transitional cells. Gastroenterology 1984; 87; 188–200.
8. Bissell DM. Commentary on article. Mak H et al. Alcohol liver injury in babbons: transmformation of lipycytes to transitional cells. enterology. J Hepatol. 2004; 40; 887–890.
9. Zima T, Fialová L, Mestek O, et al. Oxidative stress, metabolism of etanol and alcohol‑related disease. J Biomed Sci 2001; 8; 59–70.
10. Schneiderka P. Metabolismus a vylučování etylalkoholu. In: Hůlek P, Urbánek P (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 339–342.
11. WHO. Global Status Report on non communicable disease 2014. WHO Library Cataloguing‑in‑Publication Data; 2014.
12. OECD. Alcohol Consumption among adults. In: Healthat a Glance 2017; 1217; 72–73.
13. Routhu M, Hosák L. Alkoholismus a abúzus alkoholu. In: Hůlek P, Urbánek P (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 364–375.
14. Ehrmann J, et al. Alkoholové jaterní poškození. Postgrad Gastroent Hepatol 2015; 1; 206–2017.
15. Ehrmann J, et al. Alkoholem podmíněné jaterní poškození. In: Hůlek P, Urbánek P (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 336–362.
16. WHO. Food based dietary guidelines 2003.
17. DHHS, DoA.2015–2020 Dietary Guidelines for Americans. In 8th ed. http://health.gov/ dietaryguidelines/2015/guidelines /2015.
18. WHO. Global status report on alcohol. Geneva: WHO department of Mental Health and Substance abuse; 2011.
19. Association APOD. American Psychiatric Association Substance use and addiction – related disorders. In Diagnostic and Statistical Manual of Mental Disorders, 5th Edison. American Psychiatric Association 2013; 481–589.
20. Rehm J, et al. Alcohol use disorders in primary health care: what do we know and where do we go? Alcohol 2016; 51; 422–427.
21. Burton R, Sheron N. No level of alcohol consumption improves health. Lancet 2018; 392; 987–988.
22. Ehrmann jr. J. Alkoholická jaterní cirhóza. In: Ehrmann jr. J, Schneiderka P, Ehrmann J (eds.): Alkohol a játra. Praha: Grada Publishing 2006, 69–87.
23. Sherlock S, Dooley J. Alkohol a játra. In: Nemoci jater a žlučových cest. Český překlad 11. vydání – Diseases of the Liver and Biliary System. Hradec Králové, O. Čermáková 2004, 381–398.
24. Filingery V, et al. Restrospective analysis of 1.011 percutaneous liver biopsies in performed in patients with liver transplantation or liver disease: ultrasonography can reduce complications? Eur Rev Med Phat Sci 2016; 20; 3609–3617.
25. Ehrmann jr. J, Aiglová K. Jaterní biopsie. In: Hůlek P, Urbánek P (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 121–139.
26. Ludwig J, et al. Non‑alcoholic steatohepatitis. Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc 1980; 55; 434–438.
27. Sakhuja P. Pathology of alcoholic liver disease, can it be differentiated from non alcoholic steatohepatitis? World J Gastroenterol 2014; 20; 1674–1679.
28. Schneiderka M, et al. Laboratorní vyšetření a metody detekce a stanovení etanolu v biologickém materiálu. In: Hůlek P, Urbánek P (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 347–350.
29. Zieve L. Jaundice, hyperlipidemia, and hemolyticanemia: here to for eunrecognized syndrome associated with fatty liver and cirrhosis. Ann Intern Med 1958; 48; 471.
30. Deleuran T, et al. Cirrhosis and mortality risk of biopsy‑verified alcoholic pure steatosis and steatohepatitis: a nationwide registry‑based study. Aliment Pharmacol Ther 2012; 35; 1336–1342.
31. Lacnetr C et al: Histological parametres and alcohol abstinence determine long‑term prognosis in patiens with alcoholic liver disease. J Hepatol 2017; 66; 610–618.
32. Kennedy OJ, et al. Systematic review with meta‑analysis: coffee consumption and risk of cirrhosis. Aliment Pharmacol Ther 2016; 43; 562–574.
33. Sherlock S. Nutritional disease. In: Diseases of the Liver and Biliary System. Illionis USA, Charles C Thomas Publisher 1954, 276–304.
34. Menghini G. One‑second needle biopsy of the liver. Gastroenterology 1958; 35; 190.
35. Amstrong MJ, et al. Extrahepatic complication of nonalcoholic fatty liver disease. Hepatology 2014; 59; 1174–1197.
36. Sandahl TD, Jepsen P, Thomsen KL, et al. Incidence and mortality of alcoholic hepatitis in Denmark 1999–2008: a nationwide population based cohort study. J Hepatol 2011; 54 : 760–764.
37. Michelena J, Altamirano J, Abraldes JG, et al. Systemic inflammatory response and serum lipopolysaccharide levels predict multiple organ failure and death in alcoholic hepatitis. Hepatology 2015; 62 : 762–772.
38. Maddrey WC, Boitnott JK, Bedine MS, et al. Corticosteroid therapy of alcoholic hepatitis. Gastroenterology 1978; 75 : 193–199.
39. Moreau R, Jalan R, Gines P, et al. Acute‑on‑chronic liver failure is a distinct syndrome that develops in patiens with acute decompensation of cirrhosis. Gastroenterology 2013; 144 : 1426–1437.
40. Kribben A, Gerken G, Haag S, et al. Effects of fractionated plasma separation and adsorption on survival in patients with acute‑on‑chronic liver failure. Gastroenterology 2012; 142; 782–789.
41. Kjaergard LL, Liu J, Nielsen B, et al. Artificial and bioartificial support systems for acute and acute‑on‑chronic liver failure: a systematic review. JAMA 2003; 289 : 217–222.
42. Arroyo V, Moreau R, Kamath PS, et al. Acute‑on‑chronic liver failure in cirrhosis. Nat Rev Dis Primers 2016; 2 : 41–160.
43. Heemann U, Treichel U, Loock J et al. Albumin dialysis in cirrhosis with super imposed acute liver injury: a prospective, controlled study. Hepatology 2002; 36; 949–958.
44. Bañares R, Nevens F, Larsen FS, et al. Extracorporal albumin dialysis with the molecular adsorbent recirculating system in acute‑on‑chronic liver failure: the RELIEF trial. Hepatology 2013; 57 : 1153–1162.
45. Finkenstedt A, Nachbaur K, Zoller H, et al. Acute‑on‑chronic liver failure: excedent outcomes after liver transplantation but high mortality on the wait list. Liver Transpl 2013; 19 : 879–886.
46. Adam R, McMaster P, O’Grady, et al. Evolution of liver transplantation in Europe: report of the European Liver Transplant Registry. LiverTranspl 2003; 9 : 1231–1243.
47. Friedman SL. Liver fibrosis – from bench to bedside. J Hepatol 2003; 38: (Suppl. 1); 38–53.
48. Aiglová K. Noninvasive alteratives of liver biopsy. In Takahashi H (ed.) Liverbiopsy. Rijeka: Intech open Access 2016; 297–304.
49. Jalan J, Olson JC, et al. Acute‑on‑chronic liver failure. J Hepatol 2012; 57; 1336–1348.
50. Trunečka P. Transplantace jater. In: Hůlek P, Urbánek P et al (eds.): Hepatologie 3. vydání. Praha: Grada Publishing 2018, 625–647.
51. Aiglová K. Jaterní fibróza a její diagnostika. Postgrad med 2012; 3; 297–304.
52. Burra P, Senzolo M, Adam R, et al. Liver transplantation for alcoholic liver disease in Europe: a study from the ELTR (European Liver Transplant Registry). Am J Transplant 2010; 10 : 138–148.
53. Addolorato G, Bataller R, Burra P, et al. Liver transplantation for alcoholic liver disease. Transplantation 2016; 100 : 981–987.
54. MacSween RN, Burt AD. Histologic spectrum of alcoholic liver disease. Semin Liver Dis 1986; 6 : 221–232.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Pulmo‑renální syndromČlánek Praluent (alirokumab)
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





