-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Bioimpedometrie a její využití v dialyzační léčbě
Bioimpedometry and its utilization in dialysis therapy
Measurement of living tissue impedance – bioimpedometry – started to be used in medicine some 50 years ago, first exclusively for estimation of extracellular and intracellular compartment volumes. Its most simple single frequency (50 kHz) version works directly with the measured impedance vector. Technically more sophisticated versions convert the measured impedance in values of volumes of different compartments of body fluids and calculate also principal markers of nutritional status (lean body mass, adipose tissue mass). The latest version specifically developed for application in dialysis patients includes body composition modelling and provides even absolute value of overhydration (excess fluid). Still in experimental phase is the bioimpedance exploitation for more precise estimation of residual glomerular filtration. Not yet standardized is also segmental bioimpedance measurement which should enable separate assessment of hydration status of the trunk segment and ultrafiltration capacity of peritoneum in peritoneal dialysis patients.
Key words:
assessment – bioimpedance – excess fluid – fluid status – glomerular filtration – haemodialysis – nutritional status – peritoneal dialysis
Autoři: František Lopot 1,2
Působiště autorů: Interní oddělení Strahov VFN v Praze 1; Ústav biofyziky a informatiky 1. LF UK, Praha 2
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 6): 47-54
Kategorie: Přehledné referáty
Souhrn
Měření impedance živé tkáně – bioimpedometrie – se v medicíně začala používat již před asi 50 lety, zprvu výhradně jako prostředek k odhadu objemu extracelulární a intracelulární tekutiny. Její nejjednodušší jednofrekvenční (50 kHz) varianta pracuje přímo s vektorem naměřené impedance. Technicky sofistikovanější multifrekvenční varianty převádějí naměřenou impedanci na hodnoty objemů jednotlivých kompartmentů tělesných tekutin a dokáží počítat i základní ukazatele nutričního stavu (aktivní tělesnou hmotu a množství tuku). Poslední, speciálně pro oblast dialýzy vyvinutá varianta s matematickou nadstavbou ve formě modelu tělesného složení udává dokonce absolutní hodnotu převodnění. Zatím ve fázi experimentální aplikace je využívání bioimpedometrie ke zpřesnění odhadu zbytkové glomerulární filtrace. Standardizováno rovněž dosud není segmentové bioimpedanční měření, které by mělo umožnit separátní hodnocení hydratace trupového segmentu a ultrafiltrační účinnosti peritonea u pacientů podstupujících peritoneální dialýzu.
Klíčová slova:
bioimpedance – glomerulární filtrace – hemodialýza – hodnocení – hydratace – míra převodnění – nutriční stav – peritoneální dialýzaÚvod
Nejčastější příčinou úmrtí u pacientů s chronickým selháním ledvin léčených dialýzou jsou kardiovaskulární problémy. Ty jsou do značné míry důsledkem neadekvátního řízení tekutinové bilance, pro které je klíčovým faktorem správný odhad míry převodnění (OH – overhydration). Pro zpřesnění jeho odhadu, dosud dělaného většinou na základě klinických příznaků, byla vyvinuta celá řada metod od různých antropometrických vzorců, přes biochemické markery až po přístrojové techniky jako např. ultrasonografické měření dolní duté žíly, echokardiografie, kontinuální měření změn krevního objemu a další. Mezi ně již několik desítek let patří bioimpedanční měření.
Bioimpedometrie, resp. bioimpedanční analýza (BIA) je založena na faktu, že odpor, který živé tkáně kladou průchodu elektrického proudu, výrazně závisí na míře jejich hydratace. To metodu přímo předurčuje k hodnocení hydratace a jejich změn. Zjištění, že proudy nižších frekvencí procházejí pouze extracelulární tekutinou a teprve proudy vyšší frekvence i intracelulárním prostorem, umožňuje dále odlišit extracelulární a intracelulární prostor (extra/intracellular volume – ECV/ICV). Je-li tělo nebo jeho měřená část brána jako prostorový (objemový) vodič, lze z hodnot impedance a základních tělesných rozměrů spočítat objemy jednotlivých kompartmentů tělesných tekutin, resp. celkovou tělesnou vodu (CTV). A konečně rozdíly v normální hydrataci libové (svalové) a tukové tkáně je možné využít k hodnocení tělesného složení a nutričního stavu.
Článek shrnuje vývoj této svébytné metody, rozebírá současný stav techniky pro BIA měření a možnosti využití BIA ve všech zmíněných oblastech včetně speciálních aplikací pro zpřesnění odhadu glomerulární filtrace nebo posouzení ultrafiltrační kapacity peritoneální dialýzy. Je poněkud tristní, že BIA je dnes už v široké míře využívána v zařízeních pro volnočasové aktivity, a dokonce i v domácích osobních váhách, zatímco medicína s jejím masivnějším nasazením zůstává pozadu. Probudí-li článek mezi nefrology a nutričními terapeuty zájem nebo pomůže snížit jejich nedůvěru v metodu BIA, bude cíl jeho sepsání bohatě naplněn.
Stručná historie bioimpedometrie
Historie BIA je delší než půl století. Thomasset [1] se jako první pokusil využít měření bioimpedance střídavým proudem o nízké a vysoké frekvenci k odhadu objemů extracelulární tekutiny a celkové tělesné vody. Důvodem použití střídavého proudu byla eliminace polarizačních jevů na rozhraní elektroda-tkáň. Vhodným teoretickým aparátem pro vysvětlení výsledků měření při nízkých frekvencích byla shledána Hanaiova teorie elektrického odporu emulzí s rozptýlenými nevodivými částicemi (obdoba tkáně složené z buněk „ponořených“ v extracelulární tekutině [2]). Dalším milníkem ve vývoji metody bylo použití Cole-Coleova modelu [3] elektrických vlastností živé tkáně, resp. jejich simulace paralelní kombinací odporu Re, charakterizujícího rezistivitu extracelulární tekutiny, a sériové kombinace dalšího odporu Ri, odpovídajícího rezistivitě intracelulární tkání, a kapacity C (kondenzátoru) jako prvku charakterizujícího chování buněčné membrány při průtoku proudu o různých frekvencích. Odpor takového obvodu vůči průtoku střídavého elektrického proudu se vyjadřuje komplexní impedancí Z, která má tzv. reálnou část – rezistanci (R) a imaginární část – reaktanci (X). Zobrazit ji lze jako 2rozměrný vektor s hodnotou R na vodorovné ose a hodnotou X na svislé ose – schéma. Alternativně lze Z charakterizovat délkou vektoru a tzv. fázovým úhlem φ (úhel mezi vektorem Z a vodorovnou osou). Při zvyšování frekvence protékajícího proudu opisuje vektor Z v rovině R/X půlkružnici z výchozího bodu na ose R pro nulovou frekvenci (hodnota R je v něm rovna hodnotě Re náhradního elektrického obvodu, protože větví s kondenzátorem proud s nulovou frekvencí, tedy stejnosměrný, neteče) až po konečný bod pro velmi vysoké frekvence (f → ∞). Ten je opět na ose R a hodnota R je v něm rovna paralelní kombinaci odporů Re a Ri [Re × Ri/(Re + Ri)], protože pro velmi vysoké frekvence je impedance samotného kondenzátoru prakticky nulová.
Nyboer [4] použil patrně jako první 4elektrodové uspořádání při měření bioimpedance během dialýzy. Jeho důvodem je minimalizace vlivu přechodových odporů mezi elektrodou a tkání a používá se dodnes. Při celotělovém měření jsou dvojice elektrod nalepeny na hřbetu ruky a na nártu. Distálními elektrodami se přivádí a odvádí měřicí proud a proximálně umístěnými elektrodami se snímá napětí – obr. 1. Hodnota bioimpedance Z je počítána podle Ohmova zákona jako podíl snímaného napětí a budicího proudu I : Z = U/I.
U nás rozvíjel BIA metodu už v 70. a 80. letech minulého století MUDr. Šalanský v tehdejším Výzkumném ústavu traumatologickém v Brně. Pro svá měření zkonstruoval s Ing. Kyselkou dokonce vlastní měřicí zařízení [5], se kterým pak byla také provedena první bioimpedanční měření u dialyzovaných pacientů na strahovském dialyzačním středisku.
Aplikace BIA k hodnocení míry hydratace
Vývoj měřicích metod na bázi BIA vždy do určité míry odrážel stav dostupné elektroniky. První BIA přístroje měly jen jedinou frekvenci a pracovalo se u nich většinou přímo s velikostí impedančního vektoru Z a jeho fázovým úhlem. Tato varianta BIA metody se označuje jako BIVA (BioImpedance Vector Analysis). Pokud se stanovovala CTV, počítala se jako vážená suma ECV a ICV, přičemž tyto objemy byly z impedančních dat získávány pomocí různých empirických rovnic.
Multifrekvenční impedometrie [6] byla vyvinuta později. Multifrekvenční bioimpedanční analýza (MFBIA) pracuje s Cole-Coleovým modelem a Hanaiovou teorií, tj. stanovuje hodnoty Re, Ri a C náhradního elektrického modelu fitováním na půlkružnicovou trajektorii (schéma) a pro konverzi na objemy jednotlivých kompartmentů tělesných tekutin (obvykle jen ECV a CTV) používá náhradu měřených úseků těla soustavou válcových vodičů a lineární regresní vztahy získané současným měřením objemů některými radionuklidy. BIA metoda označovaná jako multifrekvenční bioimpedanční spektroskopie (MFBIS) má oproti MFBIA ještě určitou matematickou nadstavbu, pomocí které počítá kromě ECV a ICV, resp. CTV i některé parametry tělesného složení.
Schéma. Typický průběh bioimpedančního vektoru v komplexní rovině při frekvenci proměnné od nuly až po řádově MHz a schéma náhradního elektrického obvodu simulujícího impedanci živé tkáně 
V zásadě může být kterákoli ze zmíněných variant použita kromě celotělového měření i v segmentové variantě k měření jen určité části těla, např. lýtka [7].
Jednofrekvenční bioimpedanční vektorová analýza (BIVA)
Celotělová BIVA prováděná na frekvenci 50 kHz je velmi propracovaná díky pracím Picolliho [8,9]. Pracuje přímo s impedančním vektorem Z v komplexní rovině se složkami R a X, vynášenými ale do grafu po vydělení výškou pacienta (H), tedy v jednotkách Ω/m – graf 1. To umožňuje pracovat pro různě velké jedince s jedinou velikostí grafu. Program pro zpracování naměřených hodnot je volně přístupný na internetu [10]. Vektor je v komplexní rovině zobrazen vždy spolu s tzv. pravděpodobnostními elipsami. Průsečík jejich hlavní a vedlejší osy ukazuje polohu průměrného vektoru v dané skupině (Picolli provedl velké množství BIVA měření u pacientů s různými chorobami a v jeho pracích lze nalézt charakteristické elipsy pro řadu chorob, mezi nimi i pro renální selhání). Tři soustředné elipsy značí významnost odchylky umístění koncového bodu vektoru při měření konkrétního pacienta vůči střednímu referenčnímu vektoru v dané skupině. V pravé části obrázku je vidět vliv základních změn v tělesném složení na polohu vektoru: při změnách hydratace se vektor Z posouvá podél hlavní osy elipsy. Větší převodnění dává kratší vektory s menším fázovým úhlem, s postupným odvodňováním se naopak vektor prodlužuje a fázový úhel zvyšuje. Změny v množství aktivní (libové) i tukové hmoty způsobují změny polohu vektoru Z podél vedlejší osy elipsy. Posun směrem doleva a vzhůru ukazuje na anabolický stav, k přesunu opačným směrem dochází při nástupu malnutrice.
Graf 1. Hodnoticí graf při bioimpedančním měření metodou BIVA. 
Upraveno podle [10] Obr. 1. Umístění elektrod ve 4elektrodovém uspořádání při celotělovém BIA měření 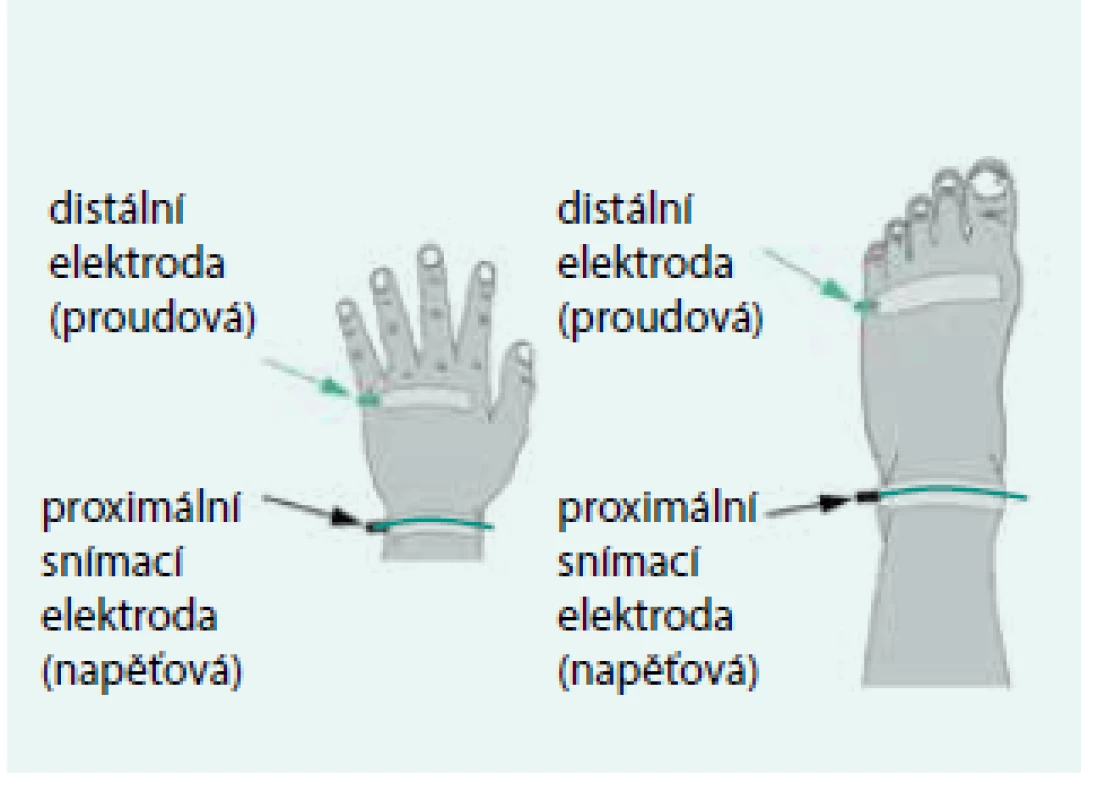
Multifrekvenční impedometry zpravidla dávají kromě přímých hodnot objemů ECV a CTV a různých nutričních indexů samostatně i hodnoty X a R pro jednotlivé frekvence, tedy i 50 kHz, a lze je proto použít i pro práci s Picolliho grafy BIVA, byť jsou primárně určeny pro pokročilejší MFBIA nebo MFBIS.
Multifrekvenční bioimpedanční analýza (MFBIA) a spektroskopie (MFBIS) a kvantifikace převodnění
Multifrekvenční impedometrie (MFBIA) nejprve pouze převáděla celotělové impedanční měření na objemy jednotlivých kompartmentů pomocí náhrady těla sestavou 3 válcových vodičů (horní končetina, trup, dolní končetina), jejichž rozměry byly odvozovány od základních antropometrických údajů – hmotnosti pacienta, jeho výšky a pohlaví – obr. 2. Po zabudování další matematické nadstavby se metoda začala označovat jako MFBIS.
Obr. 2. Náhrada těla měřeného pacienta soustavou válcových vodičů pro převod impedančních dat na objemy extra/intracelulárního kompartmentu 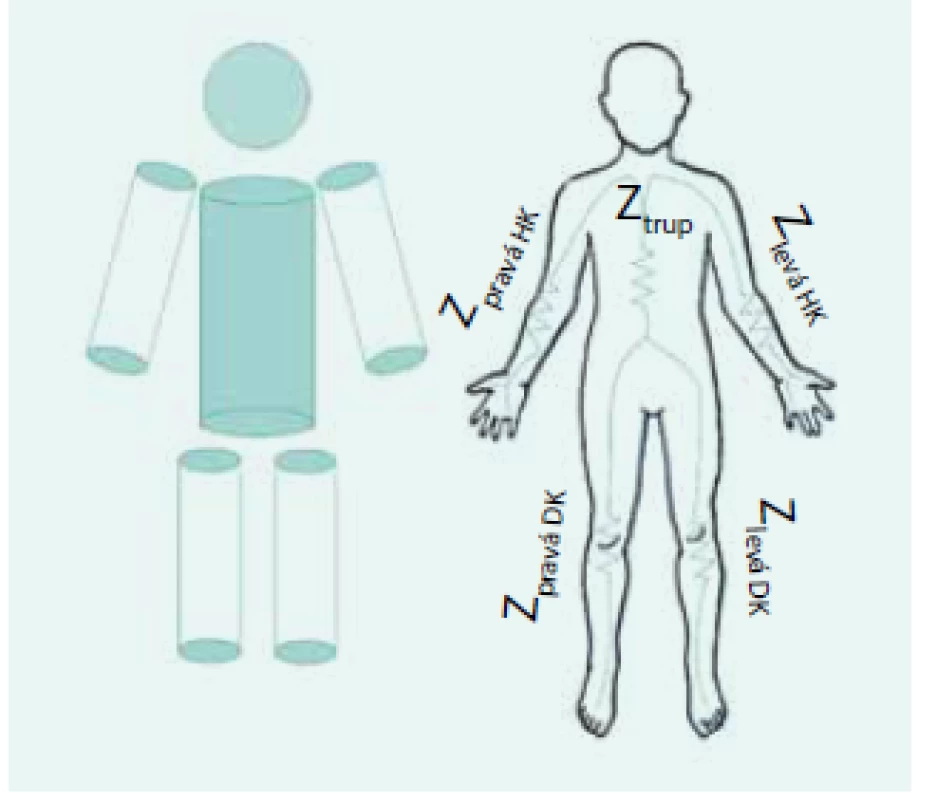
I když se obecně přijímá jako fakt, že voda, která se u dialyzovaných pacientů hromadí v mezidialyzační době, zůstává prakticky výlučně v extracelulárním prostoru, samotné byť relativně přesné zjištění ECV pomocí MFBIA nebo MFBIS neumožňuje přímé stanovení absolutní míry převodnění (OH) v litrech. Za tímto účelem bylo vyvinuto několik postupů, vesměs spočívajících na závislosti ECV, resp. jeho poměru k objemu celkové tělesné vody vůči některému ze základních antropometrických parametrů:
Historicky první takový způsob stanovení hodnoty OH navrhl Katzarski [11]: pomocí MFBIS měřil ECV a celkovou tělesnou vodu (CTV) ve skupině normotenzních a hypertenzních dialyzovaných pacientů před a po dialýze a ve skupině zdravých jedinců – viz tab. 1. Když u dialyzovaných hypertoniků postupně zvyšoval předepisovanou ultrafiltraci, až se dostal na podialyzační hodnotu ECV kolem 25 % tělesné hmotnosti, odpovídající kontrolní skupině nedialyzovaných, zaznamenal výrazný pokles potřeby antihypertenziv. Hodnotu ECV rovnou 25 % „suché váhy“ následně doporučil jako cílovou.
Tab. 1. Katzarského tabulka s průměrnými hodnotami CTV a ECV a jejich směrodatnými odchylkami 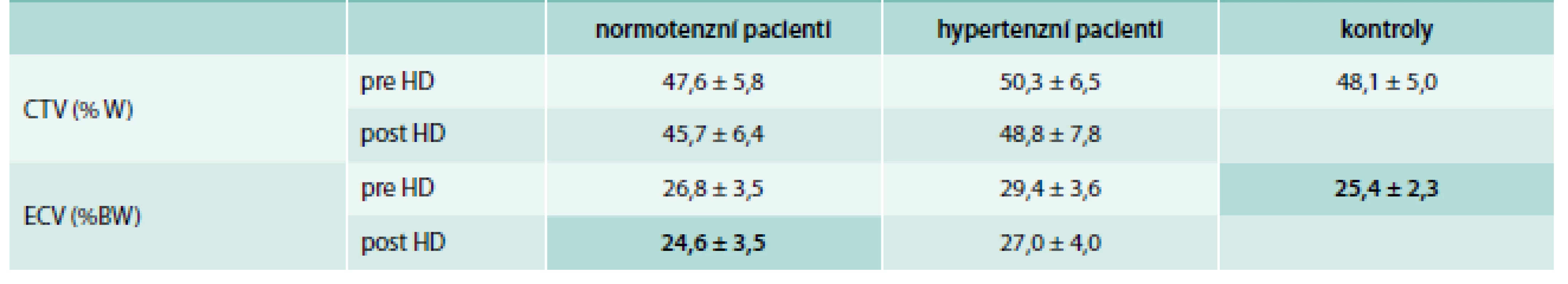
CTV – celkovou tělesnou vodu ECV – extracelulární prostor (extracellular volume) HD – hemodialýza Velmi podobný byl přístup Chamneyho [12], označovaný jako metoda dvojího sklonu (dual slope method): hodnota ECV vynášená do grafu vůči tělesné hmotnosti (BW – Body Weight) dává u zdravých jedinců přímkovou závislost se sklonem (k) výrazně menším než 1,0 a s relativně malým rozptylem – graf 2. Matematicky to lze zapsat rovnicí ECV = k × BW
Graf 2. Princip stanovení OH metodou „dvojího sklonu“. 
Upraveno podle [12] Dialyzovaný pacient s určitou predialyzační tělesnou hmotností je zpravidla více či méně převodněný, „jeho bod“ tedy leží nad onou normální přímkou a ultrafiltrací by se na ni měl přesunout. A protože odstranění jednoho litru ultrafiltrátu během dialýzy odpovídá změně tělesné hmotností o 1 kg, je tento přesun vyjádřen druhou přímkou, tentokrát se sklonem 1,0 (odtud název dual slope method) a žádaný cílový stav je určen průsečíkem obou přímek. Absolutní míra převodnění OH v litrech (kilogramech) je dána vzdáleností průmětu výchozího pacientova bodu a průsečíku obou přímek na vodorovnou osu. Ve skupině zdravých osob, se kterými Chamney při formulaci metody pracoval, zjistil k = 0,214 l/kg. Matematicky lze vztah pro stanovení OH z hodnot ECV a BW zjištěných před dialýzou (ECVpre, BWpre) odvodit z předchozí rovnice dosazením těchto hodnot snížených o OH:
(ECVpre – OH) = k × (BWpre – OH)
a po úpravě
OH = (ECVpre – k × BWpre)/(1 – k)
Obdobně jako „dual slope“ metoda funguje i stanovení míry převodnění ze závislosti poměru ECV/CTV na věku, vyvinuté souběžně na strahovském dialyzačním pracovišti [13]. S použitím MFBIS u skupiny zdravých osob byl zjištěn lineární růst poměru ECV/CTV s věkem (graf 3) s korelační rovnicí:
Graf 3. Princip stanovení OH pomocí závislosti ECV/CTV na věku. 
Upraveno podle [13] ECV/CTV (%) = 38,35 + 0,118 × věk
Predialyzační hodnota poměru ECV/CTV je zpravidla větší, než je tomu u bodu zdravého jedince shodného věku. Jeho bod je tedy nad danou referenční korelační přímkou a hodnotu OH lze stanovit ze vzdálenosti bodu od přímky. Matematicky lze vztah pro výpočet OH odvodit shodným postupem jako u metody dvojího sklonu dosazením ECV = ECVpre – OH a CTV = CTVpre – OH:
OH = ECVpre – (0,3835 + 0,00118 × věk) × CTVpre/(0,6165 – 0,00118 × věk)
Lindleyová později [14] zpřesnila vztah mezi ECV/CTV a věkem zpracováním dat od většího množství pacientů a jejich rozdělením na muže a ženy:
ECV/CTV (%) = 40,02 + 0,0714 × věk (muži)
ECV/CTV (%) = 43,28 + 0,0470 × věk (ženy)
Odchylky OH počítaného z původní rovnice a z těchto modifikovaných rovnic jsou ale jen malé.
MFBIS s modelováním tělesného složení (Body Composition Modelling – BCM) a přímým stanovením míry převodnění
Zlom v přímém numerickém stanovení míry převodnění OH (v litrech či kilogramech) nastal v roce 2006. Firma Fresenius doplnila dobře prověřený algoritmus stanovení objemů ECV a ICV a množství libové a tukové tkáně (LTM – lean tissue mass, ATM – adipose tissue mass) metodou MFBIS, vytvořený u firmy Xitron (přístroj 4000, později 4200 Hydra), o pokročilý model tělesného složení, jehož základním předpokladem bylo procento obsahu vody v libové a tukové tkání ve zdraví 71 % a 20 % [15,16]. Výsledkem byla trojice jednoduchých algebraických rovnic:
BW = LTM + ATM + OH
ECV = 0,27 × LTM + 0,13 × ATM + OH
ICV = 0,44 × LTM + 0,07 × ATM
V nich při znalosti pacientových hodnot BW, ECV, ICV, LTM a ATM před dialýzou zůstala jediná neznámá – převodnění OH. Soustava rovnic je snadno řešitelná a výsledkem je přímo hodnota OH. Výše zmíněných 71 % představuje součet poměrných zastoupení extracelulární a intracelulární vody v libové tkáni (0,27 + 0,44) a obdobně 20 % odpovídá součtu poměrného zastoupení extracelulární a intracelulární vody v tukové tkáni (0,13 + 0,07) [17]. Celý algoritmus je zabudován v impedometru BCM firmy Fresenius, používaném nyní na dialyzačních pracovištích po celém světě, včetně České republiky. Reprodukovatelnost všech výstupních parametrů impedančního měření je velmi vysoká (lepší než 1 %) a nejistota stanovení OH je podle firemních údajů ± 1 litr, tedy výrazně lepší než odhad založený výlučně na klinických příznacích. Příklady vlivu hodnoty OH na postavení impedanční půlkružnice, zobrazované na přístroji BCM ukazuje graf 4, která tvoří základ následného výpočtu jak objemových tak nutričních parametrů.
Graf 4. Zobrazení půlkružnice impedančního vektoru na přístroji BCM Fresenius – vliv převonění u 3 žen 
[výška 165–175 cm, BMI 27–32, zleva doprava: OH = -2 l (dehydratace), OH = 0 (euvolemie) a OH = 2 l (hyperhydratace)]; svislá osa X/H, vodorovná R/H, obě v Ω/m Celotělové měření je třeba provádět u dialyzovaných nemocných s podkožním cévním přístupem vždy kontralaterálně k umístění přístupu, cévní přístup na končetině mění míru její hydratace, i když dopad na celkové ECV, resp. CTV je jen malý [18,19]. Elektrody by také neměly být umísťovány na končetiny v místě výrazného otoku. Není-li z jakýchkoli důvodů proveditelné spolehlivé měření se standardní konfigurací elektrod „ruka-noha“, lze nouzově provést měření „ruka-ruka“ [20]. Rozdíly v hodnotě OH při měření v obou konfiguracích byly překvapivě malé, na úrovni desetin litru.
Dlužno doplnit, že míra převodnění stanovená všemi výše zmíněnými postupy [11–13,15] nebyla v žádné studii srovnávána [21]. Na pracovišti autora bylo provedeno srovnání pouze mezi metodou ECV/CTV vs věk a Moisslovým přístupem. Jak je zřejmé z graf 5, je korelace výsledků dosažených oběma postupy velmi dobrá.
Graf 5. Korelace hodnot OH u neselektivní skupiny pacientů HDS Strahov stanovených metodou ECV/CTV vs věk [13] ![Korelace hodnot OH u neselektivní skupiny pacientů HDS Strahov stanovených metodou ECV/CTV vs věk [13]](https://pl-master.mdcdn.cz/media/image/9742d7863299f07a871525d4966f76cb.png?version=1537795420)
(OH-ECV/CTV – na svislé ose) a metodou BCM [15] (OH-BCM – na vodorovné ose) Velmi pokročilý a vysoce automatizovaný systém řízení tekutinové bilance u hemodialyzovaných pacientů, založený na kombinaci bioimpedančního stanovení OH místo na klasického konceptu „suché váhy“ a výskytu nežádoucích příznaků během dialýzy, vytvořil (a zavedl do rutinní praxe) dr. Machek na dialyzačním středisku v Mostu [22].
Aplikace BIA k hodnocení nutričního stavu
Doplnění klasické bioimpedometrie o model tělesného složení, které vyústilo ve stanovení absolutní hodnoty převodnění v litrech již zmiňovaným přístrojem BCM Fresenius současně jasně ukazuje na možnosti impedometrie i v hodnocení nutričního stavu. Dokladem důležitosti nutričního stavu pro úspěšnou dialyzační léčbu je i existence samostatného doporučení EBPG (European Best Practice Guidelines) [23]. Kromě biochemických a antropometrických parametrů doporučených pro hodnocení nutričního stavu obsahuje dokument i doporučené přístrojové metody pro tento účel použitelné. Mezi nimi je uvedena i BIA. Literární odkazy, které jsou ale v dokumentu k metodě BIA uvedeny, jsou vesměs relativně staré, to znamená, že práce byly prováděny se starší a méně dokonalou BIA technikou, než jaká je k dispozici dnes. V důsledku toho vyznívá hodnocení spolehlivosti BIA metody v EBPG dokumentu poněkud pesimisticky.
Daleko příznivější hodnocení BIA dávají doporučení evropské společnosti pro nutrici (ESPEN – European Society for Clinical Nutrition and Metabolism) [24]. Např. BIVA metoda je v dokumentu ESPEN klasifikována jako spolehlivě použitelná u zdravé i nemocné populace. U dlouhodobě nemocných jsou její výsledky považovány za spolehlivější než např. sledování změn tělesné hmotnosti. MFBIA (MFBIS) je hodnocena jako dobře využitelná pro posuzování tělesné skladby v širokém rozmezí hodnot BMI od 18 do 34 kg/m2. Pro hodnoty BMI nad 34 kg/m2 je zmíněna možná potřeba korekce specifické rezistivity tkání, považované u nižších hodnot BMI za konstantní. BIA metoda by neměla být používána u osob zjevně edematózních a měření by nemělo být prováděno na končetině s cévním přístupem. Výslovně se v dokumentu uvádí vhodnost MFBIS pro neinvazivní monitorování metabolických změn i u dialyzovaných pacientů s proměnnou mírou převodnění a segmentová BIA je doporučována k měření v případě, že se jedná o hodnocení hydratace trupu.
Určitým problémem v nasazení BIA metod pro hodnocení nutričního stavu je nejednotná terminologie (např. body cell mass, active body mass a lean body mass, resp. fat-free mass, fat mass a adipose tissue mass nejsou zcela záměnné, a přesto jsou takto často používány).
Při relativně rezervovaném přístupu k BIA metodám v nefrologické komunitě je celkem překvapivé, že se BIA metody dostaly do vyhlášky českého ministerstva zdravotnictví [25] o technickém vybavení zdravotnických zařízení. Ta pro dialyzační pracoviště požaduje mimo jiné „systém detekce hydratace pacienta“, což může být prakticky kromě bioimpedometru pouze zařízení pro sledování změn krevního objemu. Explicitně je potřeba bioimpedometrie uvedena pro pracoviště nutričního terapeuta.
Aplikace BIA ke zpřesnění odhadu GFR
S použitím BIA k hodnocení nutričního stavu, resp. k analýze tělesného složení úzce souvisí i její využití ke zpřesnění odhadu glomerulární filtrace (eGFR). Většina existujících rovnic pro odhad GFR pracuje s hodnotou sérového kreatininu a některými antropometrickými ukazateli (tělesná hmotnost – BW), plocha povrchu těla (Body Surface Area – BSA) a jiné). Tyto ukazatele ale zpravidla dostatečně neodrážejí interindividuální variabilitu v množství svalové hmoty, které významně ovlivňuje produkci kreatininu, a tím i jeho sérovou koncentraci. Zavedení množství svalové hmoty nebo ukazatele, který by s ním dostatečně těsně koreloval, by proto mělo odhad GFR výrazně zpřesnit. Vztahy zahrnující některý z ukazatelů odvozených z BIA měření odvodila celá řada autorů. Jako příklad lze uvést rovnici Macdonalda [26], pracující mimo hodnoty sérového kreatininu (Cr – v mg/dl) také s tělesnou hmotností pacienta BW (kg) a impedometricky zjištěnou aktivní tělesnou hmotou (LBM – lean body mass):
eGFR = 1,008 – 1,014 × Cr + 0,01644 × LBMBIA + 0,07108 × BW
Dalším příkladem jsou statistické vztahy odvozené Donadiem [27] odděleně pro muže a ženy. V nich se kromě sérového kreatininu ze standardních antropometrických ukazatelů používá tělesná plocha BSA a z hodnot stanovených bioimpedometrií celková buněčná hmota těla měřeného pacienta (BCM – Body Cell Mass):
eGFR = (BCMBIA × 2,979 × Cr – 7,65) × 1,73/BSA (muži)
eGFR = (BCMBIA × 2,231 × Cr – 2,73) × 1,73/BSA (ženy)
Cigarrán [28] při zkoumání řady publikovaných vztahů pro eGFR, obsahujících bioimpedanční parametry, shledal jejich přesnost zcela srovnatelnou s rovnicemi MDRD a CKD-EPI. Přes všechna tato povzbudivá zjištění ale žádná z dosud publikovaných rovnic nedosáhla všeobecného přijetí, obdobného rovnicím MDRD nebo CKD-EPI.
Aplikace BIA v peritoneální dialýze
Rovněž v oblasti peritoneální dialýzy již byla publikována celá řada prací, a to jak z posuzování stavu hydratace, tak z hodnocení nutričního stavu. V práci [29] lze nalézt výsledky evropské studie s výše zmíněným impedometrem BCM firmy Fresenius u peritoneálně dialyzovaných (PD) pacientů. V souhlasu s řadou dřívějších prací našla i tato práce stav převodnění u asi 40 % PD pacientů. Nebyla však zjištěna tak jednoznačná souvislost míry převodnění s hypertenzí těchto pacientů, jak se očekávalo. Rovněž vztah míry převodnění a zbytkové diurézy byl jen slabý, což bylo přičteno v současnosti relativně častému používání hypertonických výměn u výrazněji převodněných pacientů.
I v hodnocení nutričního stavu pomocí bioimpedometrie byly shledány některé specifické odlišnosti PD populace od pacientů na hemodialýze a zdravých jedinců – nižší hladina draslíku, menší množství dusíku v organizmu, v širokých mezích kolísající poměr ECV/ICV. Zatímco korelace mezi aktivní tělesnou hmotou stanovenou DXA metodou a pomocí MFBIS je relativně dobrá, hodnota obsahu kostních minerálů (BMC – bone mineral kontent) počítaná jako rozdíl bioimpedometricky stanových hodnot „fat-free mass“ a „lean body mass“ (BMC = FFM – LBM) je metodou BIA podhodnocována. Je zřejmé, že pro zvýšení spolehlivosti hodnocení nutričního stavu pomocí bioimpedančních měření bude třeba získat spolehlivé korelační vztahy mezi výsledky DXA a BIA speciálně pro PD populaci.
Všechny publikované práce z celotělové impedometrie u PD pacientů se shodují v neschopnosti stávající 4elektrodové celotělové BIA postihnout změny hydratace v oblasti trupu v průběhu jedné výměny, což je základním předpokladem pro vyhodnocování ultrafiltrační kapacity peritonea. Pro tento účel bude třeba vyvinout standardizované víceelektrodové uspořádání s možností následného rozlišení jednotlivých tělesných segmentů. Jeden elegantní způsob takového měření ukazuje obr. 3 z práce [30]. Vhodnou volbou vždy jen dvou dvojic (jedna dvojice proudových elektrod a jedna dvojice snímacích napěťových elektrod) lze samostatně získat hodnoty impedance všech pěti základních tělesných segmentů (pravá a levá horní a dolní končetina a trup).
Obr. 3. Víceelektrodové BIA měření umožňující stanovení impedance jednotlivých segmentů těla 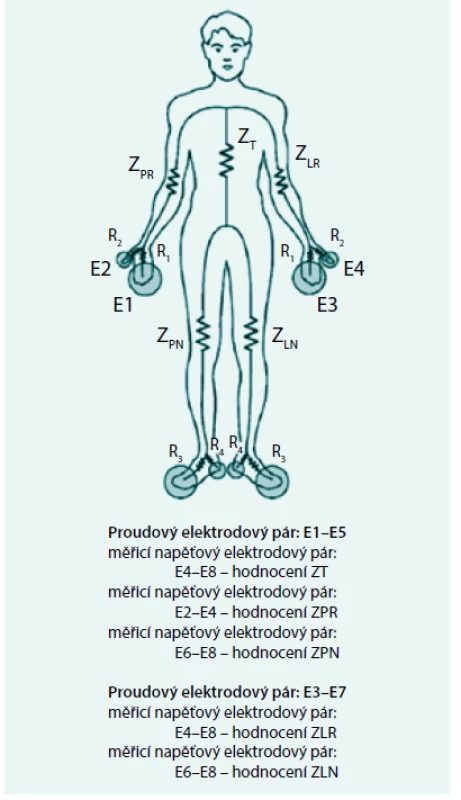
Malé odpory mezi proudovou elektrodou a nejbližší elektrodou napěťovou se při analýze naměřených hodnot Z neuplatňují. ZT – impedance trupu ZLA a ZRA – impedance levé a pravé horní končetiny ZLL a ZRL – impedance levé a pravé dolní končetiny Upraveno podle [30] Závěry
Bioimpedometrie je neinvazivní, levná metoda, při jejímž použití není pacient vystaven žádnému ionizujícímu záření. Přístroje pro její provádění jsou zpravidla malé, snadno přenosné. Reprodukovatelnost měření je vysoká a jeho výsledky jsou prakticky nezávislé na osobě, která BIA měření provádí.
Kombinace multifrekvenční bioimpedanční spektroskopie jako dnes nejpokročilejší varianty BIA s modelem tělesného složení je v současné době jedinou metodou umožňující kvantitativní hodnocení hydratace, resp. míry převodnění. Tento postup byl navíc validován pro populaci dialyzovaných pacientů. Spolehlivé výsledky dává rovněž hodnocení nutričního stavu pacienta a jeho změn – stanovení zastoupení aktivní (libové, svalové) tkáně a tuku v organizmu pacienta.
Uvedené charakteristiky platí i pro hodnocení hydratace a nutričního stavu u pacientů podstupujících peritoneální dialýzu. Současné 4elektrodové celotělové měření ale neumožňuje posouzení ultrafiltrační kapacity peritonea. Pro tento účel bude nutné propracovat některou z variant vícelektrodového segmentového měření.
Aplikace BIA pro přesnější stanovení zbytkové glomerulární filtrace je zatím v experimentálním stadiu a bude vyžadovat další studie pro potvrzení dosavadních výsledků.
doc. Ing. František Lopot, CSc.
f.lopot@vfn.cz
1. LF UK a Interní oddělení Strahov VFN v Praze
www.vfn.cz
Doručeno do redakce 29. 8. 2016
Přijato po recenzi 13. 10. 2016
Zdroje
1. Thomasset A. Proprietés bio-électrique des tissus, appréciation par la mesure de l´impédance de la teneur ionique extra-cellulaire et la teneur intra-cellulaire en clinique. Lyon Med 1963; 209 : 1325–1350.
2. Hanai T. Electrical properties of emulsions. In: Sherman PH (ed). Emulsion science. Academic Press: London 1968 : 354–477.
3. Cole KS. Membranes, ions and impulses. A chapter of classical biophysics. University of Califormia Press 1968. ISBN 978–0520002517.
4. Nyboer J, Sedensky JA. Bioelectric impedance during renal dialysis. Proc Clin Dial Transplant Forum 1974; (4): 214–219.
5. Salanský I, Kyselka D. Impedometrie tkáňových tekutin in vivo. Lékař a technika 1982; 13(3): 47–49.
6. Matthie JR. Bioimpedance measurements of human body composition: critical analysis and outlook. Expert Rev Med Devices 2008; 5(2): 239–261. Dostupné z DOI: <http://dx.doi.org/10.1586/17434440.5.2.239>.
7. Zhu F, Kuhlman M, Kotanko P et al. A Device for Monitoring Hydration State in Hemodialysis Patients Using a Calf Bioimpedance Technique. In Scharfetter H, Merwa R (Eds): 13th International Conference on Electrical Bioimpedance and the 8th Conference on Electrical Impedance Tomography. ICEBI 2007. IFMBE Proceedings 2007; 17 : 775–778. ISBN 978–3-540–73840–4 (Print) 978–3-540–73841–1 (Online). Dostupné z DOI: <http://dx.doi.org/10.1007/978–3-540–73841–1_200>.
8. Picolli A, Ross B, Pillon L et al. A new method for monitoring body fluid variation by bioimpedance analysis: the RXC graph. Kidney Int 1994; 46(2): 534–539.
9. Picolli A, Ross B, Pillon L et al. Body fluid overload and bioelectrical impedance analysis in renal patients. Mineral Electrolyte Metab 1996; 22(1–3): 76–78.
10. BIVAconfidence and BIVAtolerance are two Excel files for the Bioelectrical Impedance Vector Analysis with the RXc Graph method. Dostupné z WWW: <http://www.renalgate.it/formule_calcolatori/BIVAguide.pdf>.
11. Katzarski K, Charra B, Laurent G et al. Multifrequency bioimpedance in assessment of dry weight in hemodialysis. Nephrol Dial Transplant 1996; 11(Suppl 2): S20-S23.
12. Chamney PW, Kraemer M, Rode C et al. A new technique for establishing dry weight in hemodialysis patients via whole body bioimpedance. Kidney Int 2002; 61(6): 2250–2258.
13. Lopot F, Nejedlý B, Novotná H et al. Age-related extracellular to total body water volume ratio (ECV/TBW) – can it be used for “dry weight” determination in dialysis patients? – application of multifrequency bioimpedance measurement. Int J Artif Organs 2002; 25(8): 762–769.
14. Lindley E, Devine Y, Hall L et al. A ward-based procedure for assessment of fluid status in peritoneal dialysis patients using bioimpedance spectroscopy. Perit Dial Int 2005; 25(Suppl 3): S46-S48.
15. Moissl UM, Wabel P, Chamney PW et al. Body fluid volume determination via body composition spectroscopy in health and disease. Physiol Meas 2006; 27(9): 921–933.
16. Chamney PW, Wabel P, Moissl UM et al. A whole-body model to distinguish excess fluid from the hydration of major body tissues. Am J Clin Nutr 2007; 85(1): 80–89.
17. Chamney PW. Bioimpedance Master Class. 40th EDTNA/ERCA Conference. Ljubljana 2011. ISBN 978–80–260–0222–2.
18. Booth J, Pinney J, Davenport A. The effect of vascular access modality on ganges in fluid content in the arms as determined by multifrequency bioimpedance. Nephrol Dial Transplant 2011; 26(1): 227–231. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfq331>.
19. Panorchan K, Nongnuch A, El-kateb S et al. Does the presence of an arteriovenous fistula alter ganges in body water following hemodialysis as determined by multifrequency bioelectrical impedance assessment? Hemodial Int 2015; 19(4): 484–489. Dostupné z DOI: <http://dx.doi.org/10.1111/hdi.12282>.
20. Keane DF, Lindley E. Use of hand-to-hand measurement for body composition in patients with inaccessible or amputated feet. J Renal Care 2015; 41(1): 28–32. Dostupné z DOI: <http://dx.doi.org/10.1111/jorc.12091>.
21. Abbas SR, Liu L, Sipahioglu MH et al. Comparison of bioimpedance techniques to detect ganges in fluid status in hemodialysis patients. Blood Purif 2014; 37(1): 48–56. Dostupné z DOI: <http://dx.doi.org/10.1159/000356830>.
22. Machek P, Jirka T, Moissl U et al. Guided optimization of fluid status in haemodialysis patients. Nephrol Dial Transplant 2010; 25(2): 538–544. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfp487>.
23. Fouque D, Vennegoor M, ter Wee P et al. EBPG guidelines on nutrition. Nephrol Dial Transplan 2007; 22(Suppl 2): ii45-ii87.
24. Kyle UG, Bosaeus I, De Lorenzo AD et al. ESPEN guidelines, Bioelectrical impedance analysis – part II: utilisation and clinical practices. Clin Nutr 2004; 23(6): 1430–1453.
25. Vyhláška č. 92/2012 Sb. o požadavcích na technické a věcné vybavení zdravotnických zařízení a kontaktních pracovišť domácí péče. Dostupné z WWW: <https://portal.gov.cz/app/zakony/zakonPar.jsp?idBiblio=77185>.
26. Macdonald JH, Marcora SM, Jibani M et al. Bioelectrical impedance can be used to predict muscle mass and hence improve estimation of glomerular filtration rate in non-diabetic patients with chronic kidney disease. Nephrol Dial Transplant 2006; 21(12): 3481–3487.
27. Donadio C, Consani C, Ardini M et al. Prediction of glomerular filtration rate from body cell mass and plasma creatinine. Curr Drug Discov Technol 2004; 1(3): 221–228.
28. Cigarrán S, Castro MJ, Pousa M. Glomerular filtration rate (GFR) estimated by bioelectrical impedance (BIA) is so accurate as MDRD and CKD-EPI formula. Blood Purif 2009; 28(4): 327. In: 27th Annual Meeting of the International Society of Blood Purification (ISBP – Abstracts). September 17–19, 2009, Stockholm, Sweden. Blood Purif 2009; 28(4): 293–330. Dostupné z DOI: <http://DOI:10.1159/000235632>.
29. Van Biesen W, Williams JD, Covic AC et al. Fluid Status in Peritoneal Dialysis Patients: The European Body Composition Monitoring (EuroBCM) Study Cohort. PLoS ONE 2011; 6(2): e17148. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0017148>.
30. Medici G, Mussi C, Fantuzzi AL et al. Accuracy of eight-polar bioelectrical impedance analysis for the assessment of total and appendicular body composition in peritoneal dialysis patients. Eur J Clin Nutr 2005; 59(8): 932–937. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.ejcn.1602165>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Prof. Tomáš Ganz, MD, PhD., a prof. Peter Ganz, MD, synovia košického rodáka prof. Viliama Ganza, MD, PhD., FACC, navštívili Košice
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Prof. MUDr. Otto Schück, DrSc. – stálice na českém nefrologickém nebi
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Bioimpedometrie a její využití v dialyzační léčbě
- Obdiv k zakladatelům a zodpovědnost pokračovatelů
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Theralite a mnohočetný myelom
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



