-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vplyv rekombinantného ľudského prokalcitonínu na fagocytovú a kandidacídnu schopnosť polymorfonukleárnych leukocytov a na cídne mechanizmy séra a krvi voči baktériám Staphylococcus aureus a Escherichia coli
Influence of recombinant human procalcitonin on phagocytic and candidacidal ability of polymorphonuclear leukocytes and on killing mechanisms of serum and blood against bacteria Staphylococcus aureus and Escherichia coli
Procalcitonin (PCT) is a highly selective and specific marker for early diagnosis of sepsis. There is enough information confirming that procalcitonin should be considered as an important mediator in the pathophysiology of sepsis. The aim of our work was to evaluate the effect of recombinant human procalcitonin (rhPCT) on phagocytic and candidacidal activity of polymorphonuclear leukocytes (PMNL) in blood, as well as on killing mechanisms of fresh serum and blood against Escherichia coli (E. coli) and Staphylococcus aureus (S. aureus). Our results show that rhPCT dose dependently decreased both phagocytic and candidacidal activity of polymorphonuclear leukocytes (p < 0.001). RhPCT inhibited also the microbicidal activity of both serum and blood on E. coli that was found by inoculation of suspension on culture plates. We found that rhPCT supported the E. coli colony count increase during the incubation in the presence of both serum and blood. The effect of rhPCT on the S. aureus colony count increase was not statistically significant. Conclusion: Our results indicate a suppressive effect of rhPCT on phagocytic and microbicidal activity of polymorphonuclear leucocytes.
Key words:
phagocytosis - immunity - microorganism - polymorphonuclear leukocytes - procalcitonin - sepsis
Autoři: T. Pinčíková 1; M. Bucová 1; L. Slobodníková 2
Působiště autorů: Imunologický ústav Lekárskej fakulty UK, Bratislava, Slovenská republika, prednosta prof. MUDr. Milan Buc, DrSc. 1; Mikrobiologický ústav Lekárskej fakulty UK, Bratislava, Slovenská republika, prednosta prof. MUDr. Daniela Kotulová, CSc. 2
Vyšlo v časopise: Vnitř Lék 2005; 51(12): 1365-1370
Kategorie: Původní práce
Souhrn
Prokalcitonín (PCT) je včasný a vysoko selektívny a špecifický ukazovateľ rozvoja a priebehu sepsy. Množstvo údajov potvrdzuje úlohu PCT ako dôležitého mediátora v patofyziológii systémovej baktériovej infekcie. Cieľom práce bolo zistiť vplyv rekombinantného ľudského PCT (rhPCT) na fagocytovú a kandidacídnu schopnosť polymorfonukleárnych leukocytov (PMNL) z plnej krvi, ako aj na cídne mechanizmy čerstvého séra a plnej krvi voči Escherichia coli (E. coli) a Staphylococcus aureus (S. aureus). Výsledky vyšetrení ukázali, že RhPCT dávkovo závisle inhiboval fagocytovú aktivitu, fagocytový index ako aj kandidacídnu schopnosť polymorfonukleárnych leukocytov (p < 0,001). Inhibičný vplyv rhPCT na cídiu plnej krvi a séra sa prejavil aj pri testovaní vplyvu rhPCT na cídne mechanizmy séra a plnej krvi voči E. coli vyočkovaním na kultivačné platne. Zistili sme nárast počtu kolónií E. coli počas inkubácie v prostredí séra aj krvi v prítomnosti rhPCT. Vplyv rhPCT na cídne mechanizmy séra a plnej krvi voči S. aureus nebol štatisticky signifikantný. Výsledky poukazujú na supresívny vplyv rhPCT na fagocytovú a mikrobicídnu schopnosť polymorfonukleárnych leukocytov.
Kľúčové slová:
fagocytóza - imunita - mikroorganizmy - polymorfonukleárne leukocyty - prokalcitonín - sepsaÚvod
Prokalcitonín (PCT), prekurzor hormónu kalcitonínu, bol pôvodne charakterizovaný ako 116-aminokyselinový proteín s relatívnou molekulovou hmotnosťou 14,5 kDa [1]. Je členom rodiny peptidov kalcitonínových génov [2] a jeho syntéza je regulovaná génom CALC-I na 11. chromozóme (11p15.4) [3]. Bez prítomnosti systémovej infekcie je transkripcia CALC-I génu v bunkách ľudského tela potlačená a je selektívne zadaná len pre neuroendokrinné bunky štítnej žľazy a pľúc [4,5]. Plazmová/sérová koncentrácia PCT u zdravého dospelého človeka nepresahuje 0,5 ng x ml-1 [6,7].
Systémová mikróbna infekcia, hlavne baktériová, ale aj mykotická a parazitová indukuje ubikvitárne zvýšenú expresiu CALC-I génu a uvoľňovanie kalcitonínových prekurzorov z rôznych tkanív a buniek celého tela [5,8]. K výraznej syntéze PCT dochádza v monocytoch a granulocytoch periférnej krvi ľudí pod stimulačným vplyvom prozápalových cytokínov IL-1β, IL-6, TNF-α, ale tiež IL-2, lipopolysacharidu (LPS) a S. aureus [9,10]. Po stimulácii LPS sa PCT vo zvýšenej miere produkuje v mnohých tkanivách a orgánoch, dôležitá úloha sa pripisuje hepatosplanchnickej oblasti. Najvyššie koncentrácie PCT sú v pečeni, obličke, aorte, tukovom tkanive, ováriách, nadobličke [11], v mozgu, pľúcach, semenníkoch a koži [5]. A tak, z hľadiska globálnej syntézy PCT, možno za septických okolností na celé telo pacienta nazerať ako na endokrinnú žľazu [5,8]. Pre túto skutočnosť ako aj pre fakt, že PCT je peptid determinovaný génom z rodiny génov kódujúcich endokrinné peptidy, označuje sa niekedy aj ako „hormokín“ [8,12]. Iní autori ho z hľadiska úlohy pri zápale zaraďujú do siete zápalových mediátorov a proteínov akútnej fázy [13,14].
Za patologických okolností stúpa koncentrácia PCT v plazme/sére na hodnoty mierne zvýšené pri syndróme systémovej zápalovej odpovede (SIRS) neinfekčnej etiológie (0,5 - 2,0 ng x ml-1), stredne zvýšené pri systémovej baktériovej infekcii (2,0 - 10,0 ng x ml-1) a veľmi vysoké pri ťažkej sepse (> 10,0 ng x ml-1) [15]. Hodnoty koncentrácie PCT, na rozdiel od nešpecifických a častokrát zavádzajúcich hodnôt CRP a množstva leukocytov [5], prispievajú k diferenciácii SIRS neinfekčnej etiológie (postoperačný, sprevádzajúci popáleniny, pri chemickej pneumonitíde) od sepsy, pri ktorej sú hodnoty PCT signifikantne vyššie [16,17,18,19,20].
Diagnostická a prediktívna hodnota PCT v medicíne predbehla poznatky o jeho fyziologickej a imunologickej funkcii, ktorých je veľmi málo [21]. Cieľom našej práce bolo vyšetriť vplyv PCT na jeden z nešpecifických mechanizmov imunity - fagocytózu, zistiť, či rhPCT ovplyvňuje fagocytovú a mikrobicídnu schopnosť polymorfonukleárnych leukocytov (PMNL).
Materiál a metódy
20 zdravým dobrovoľníkom sme odobrali venóznu krv do heparínu (10 IU heparínu na 1 ml krvi) a na sérum, ktoré sme používali v testoch.
- Vplyv rhPCT na fagocytovú schopnosť polymorfonukleárnych leukocytov (PMNL): Saccharomyces cerevisiae sme 30 min povarili a nariedili na konečnú koncentráciu 2,5 x 107 ml-1 fyziologického roztoku. Rekombinantný ľudský prokalcitonín (rhPCT; Brahms GmbH, Germany) sme nariedili vo fyziologickom roztoku na tri pracovné koncentrácie tak, aby výsledná koncentrácia vo vzorke bola: PCT1 - 1 ng x ml-1 rhPCT, PCT5 - 5 ng x ml-1 rhPCT a PCT10 - 10 ng x ml-1 rhPCT. 450 µl krvi zmiešanej s 50 µl suspenzie Saccharomyces cerevisiae sme inkubovali 60 minút pri 37 °C za stáleho miešania (Coulter Mixer, Veľká Británia) s pridaným rhPCT alebo bez rhPCT. Zo vzoriek sme vyhotovili krvné nátery, zafarbili ich podľa Wrighta a pod imerzným objektívom svetelného mikroskopu hodnotili fagocytovú aktivitu (FA), čo je percento fagocytujúcich PMNL z vyšetrovanej populácie buniek (200) a fagocytový index (FI) - priemerný počet kvasiniek pohltených jedným PMNL.
- Vplyv rhPCT na kandidacídnu schopnosť polymorfonukleárnych leukocytov (PMNL): Pripravili sme suspenziu Candida albicans (1 x 107 ml-1) a pracovné koncentrácie rhPCT (viď vyššie). 100 µl plnej krvi a 100 µl séra sme zmiešali s 50 µl suspenzie Candida albicans a inkubovali 60 min pri 37 °C za stáleho miešania (Coulter Mixer, Veľká Británia) v prítomnosti rhPCT a bez rhPCT. Pridali sme 2,5% deoxycholát sodný za účelom rozbitia všetkých buniek, 0,01% metylénovú modrú na zafarbenie mŕtvych kandíd, vzorky centrifugovali 10 minút pri 400 g a v sedimente sme imerzným objektívom svetelného mikroskopu vyhodnotili kandidacídnu aktivitu (CA) PMNL, čo je percento usmrtených kandíd [22].
- Vplyv rhPCT na cídne mechanizmy séra a krvi voči baktériám Staphylococcus aureus (S. aureus) a Escherichia coli (E. coli): Pripravili sme suspenzie S. aureus a E. coli tak, aby výsledná koncentrácia baktérií vo vzorke bola 1 - 3 x 103 ml-1 a nariedili rhPCT na dve pracovné koncentrácie tak, aby výsledná koncentrácia vo vzorke bola: PCT1 - 1 ng x ml-1 rhPCT a PCT10 - 10 ng x ml-1 rhPCT. 1 ml krvi a 1 ml séra, ktoré sme zmiešali s 10 µl suspenzie S. aureus (n = 11) alebo E. coli (n = 12), sme inkubovali (60 min, 37 °C) za stáleho miešania (Culture tube rotator SC1, Bibby Sterilin Ltd., Veľká Británia) s pridaným rhPCT alebo bez rhPCT. Z každej vzorky sme vyočkovali po 100 µl na krvný agar pred a po inkubácii [23]. Po 24-hodinovej kultivácii agarov pri 37 °C sme určili pomer počtu kolónií (PPK) vyrastených po vyočkovaní vzorky po 60-minútovej inkubácii a počtu kolónií vyrastených po vyočkovaní tej istej vzorky v čase 0, vyjadrený v percentách [PPK = (vzorka 60/vzorka 0) x 100 %].
Štatistické vyhodnotenie
Výsledky udávame ako priemer (AVE) ± štandardná chyba priemeru (SEM). Na štatistické hodnotenie našich výsledkov sme použili analýzu variancie (repeated measures ANOVA) s Bonferroniho post-testom. Za signifikantné sme považovali zmeny s p < 0,05 (*), p < 0,01 (**) a p < 0,001 (***). Na zhodnotenie súvislosti medzi koncentráciou PCT pridávaného do vzorky a sledovanou veličinou (FA, FI, CA, PPK) vo vzorke sme použili neparametrický Spearmanov test.
Výsledky
- Vplyv rhPCT na fagocytovú schopnosť polymorfonukleárnych leukocytov (obr. 1, obr. 2). RhPCT vo všetkých testovaných koncentráciách štatisticky signifikantne znížil fagocytovú aktivitu (FA) (p < 0,001) aj fagocytový index (FI) (p < 0,001) PMNL oproti vzorkám bez prítomnosti rhPCT. Medzi koncentráciou rhPCT a hodnotou FA aj FI bola vysoko signifikantná negatívna korelácia (p < 0,0001).
- Vplyv rhPCT na kandidacídnu schopnosť polymorfonukleárnych leukocytov (obr. 3). RhPCT vo všetkých testovaných koncentráciách štatisticky signifikantne znížil kandidacídnu aktivitu (CA) PMNL (p < 0,001) oproti vzorkám bez prítomnosti rhPCT. Medzi koncentráciou rhPCT a hodnotou CA bola vysoko signifikantná negatívna korelácia (p < 0,0001).
- Vplyv rhPCT na cídne mechanizmy séra a krvi voči baktériám S. aureus a E. coli. RhPCT zvýšil nárast počtu kolónií E. coli po 60-minútovej inkubácii aj vo vzorke séra, aj vo vzorke krvi (obr. 4). RhPCT vo vzorke séra spôsobil pokles počtu kolónií S. aureus počas 60 minútovej inkubácie, vo vzorke krvi bol však jeho vplyv nejednotný - kým nižšia koncentrácia PCT (PCT1) spôsobila nárast počtu kolónií, vyššia koncentrácia PCT (PCT10) viedla k poklesu počtu kolónií po 60 min inkubácie (obr. 5). Uvedené zmeny neboli štatisticky signifikantné.
Obr. 1. Vplyv testovaných koncentrácií rhPCT na fagocytovú aktivitu PMNL. 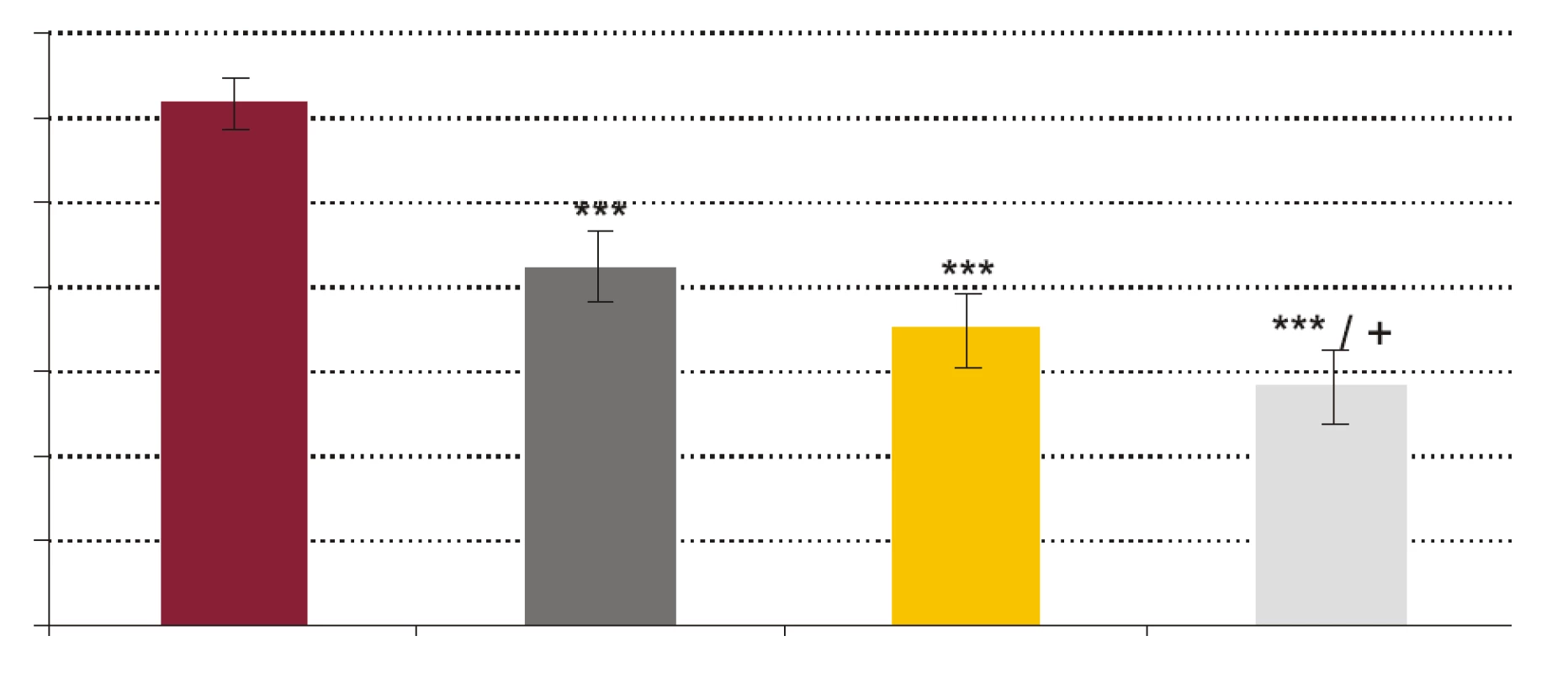
FR - krv + fyziologický roztok + kvasinky, PCT1 - krv + 1 ng x ml-1 rhPCT + kvasinky, PCT5 - krv + 5 ng x ml-1 rhPCT + kvasinky, PCT 10 - krv + 10 ng x ml-1 rhPCT + kvasinky. *** p < 0,001 porovnané so vzorkou FR; + p < 0,05 porovnané so vzorkou PCT1. Hodnoty sú udané ako priemer ± SEM, p - repeated measures ANOVA Bonferroni. Obr. 2. Vplyv testovaných koncentrácií rhPCT na fagocytový index (FI) PMNL. 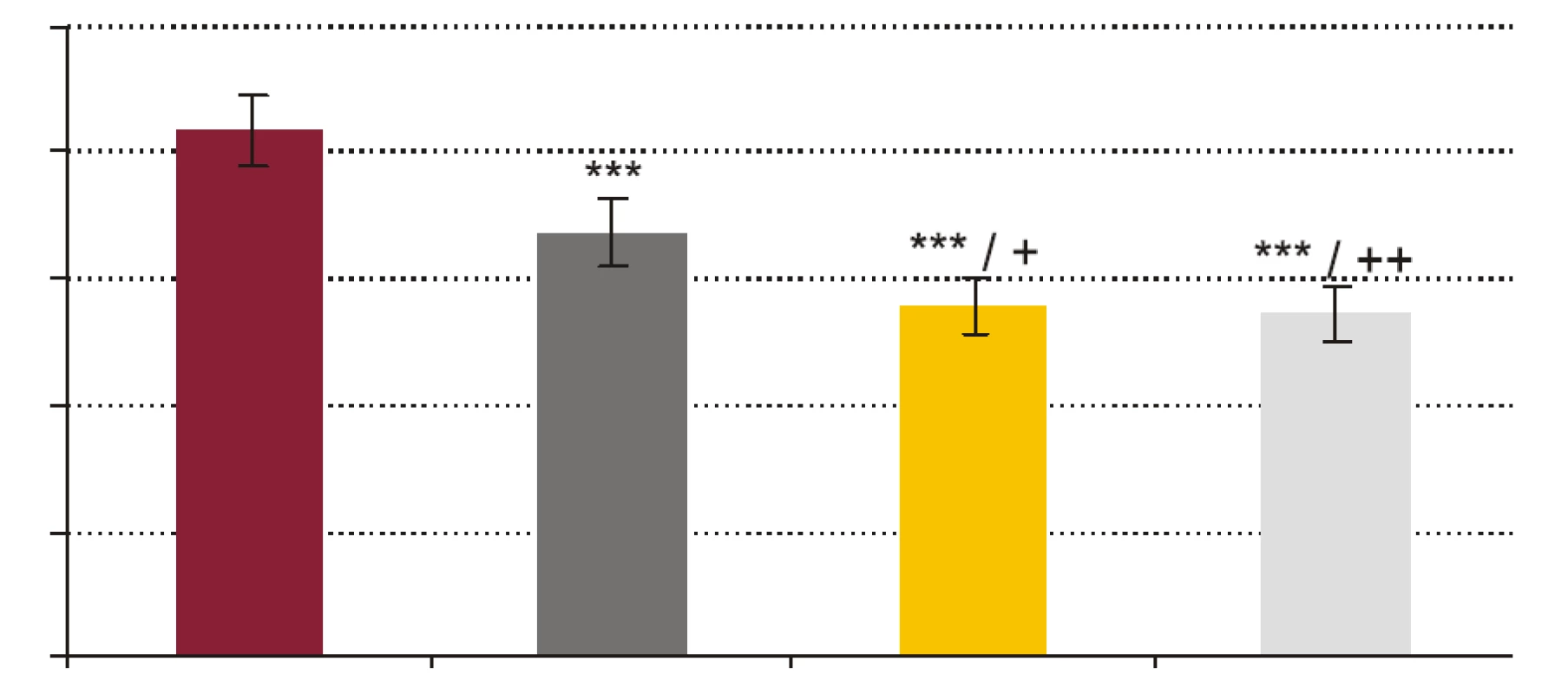
FR - krv + fyziologický roztok + kvasinky, PCT1 - krv + 1 ng x ml-1 rhPCT + kvasinky, PCT5 - krv + 5 ng x ml-1 rhPCT + kvasinky, PCT 10 - krv + 10 ng x ml-1 rhPCT + kvasinky. *** p < 0,001 porovnané so vzorkou FR; + p < 0,05, ++ p < 0,01 porovnané so vzorkou PCT1. Hodnoty sú udané ako priemer ± SEM, p - repeated measures ANOVA Bonferroni. Obr. 3. Vplyv testovaných koncentrácií rhPCT na kandidacídnu aktivitu (CA) fagocytov vyjadrenú percentom cídie. 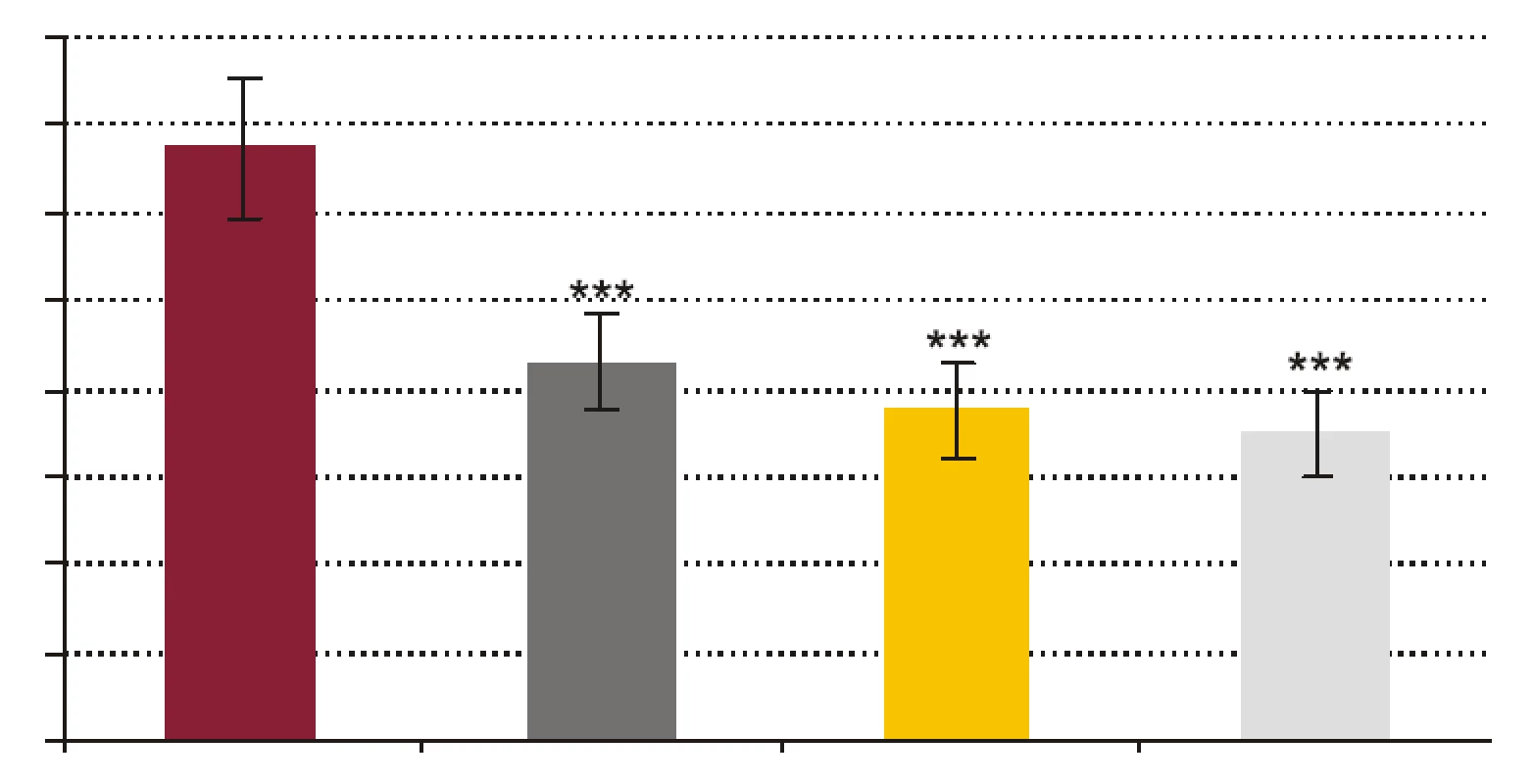
FR - krv + fyz. roztok + kandidy, PCT1 - krv + 1 ng x ml-1 rhPCT + kandidy, PCT5 - krv + 5 ng x ml-1 rhPCT + kandidy, PCT10 - krv + 10 ng x ml-1 rhPCT + kandidy. *** p < 0,001 porovnané so vzorkou FR. Hodnoty sú udané ako priemer ± SEM, p -repeated measures ANOVA Bonferroni. Obr. 4. Pomery počtu kolónií E. coli vyrastených po vyočkovaní vzorky po 60-minútovej inkubácii a počtu kolónií vyrastených po vyočkovaní tej istej vzorky v čase 0, t.j. (vzorka 60/vzorka 0) x 100 %. 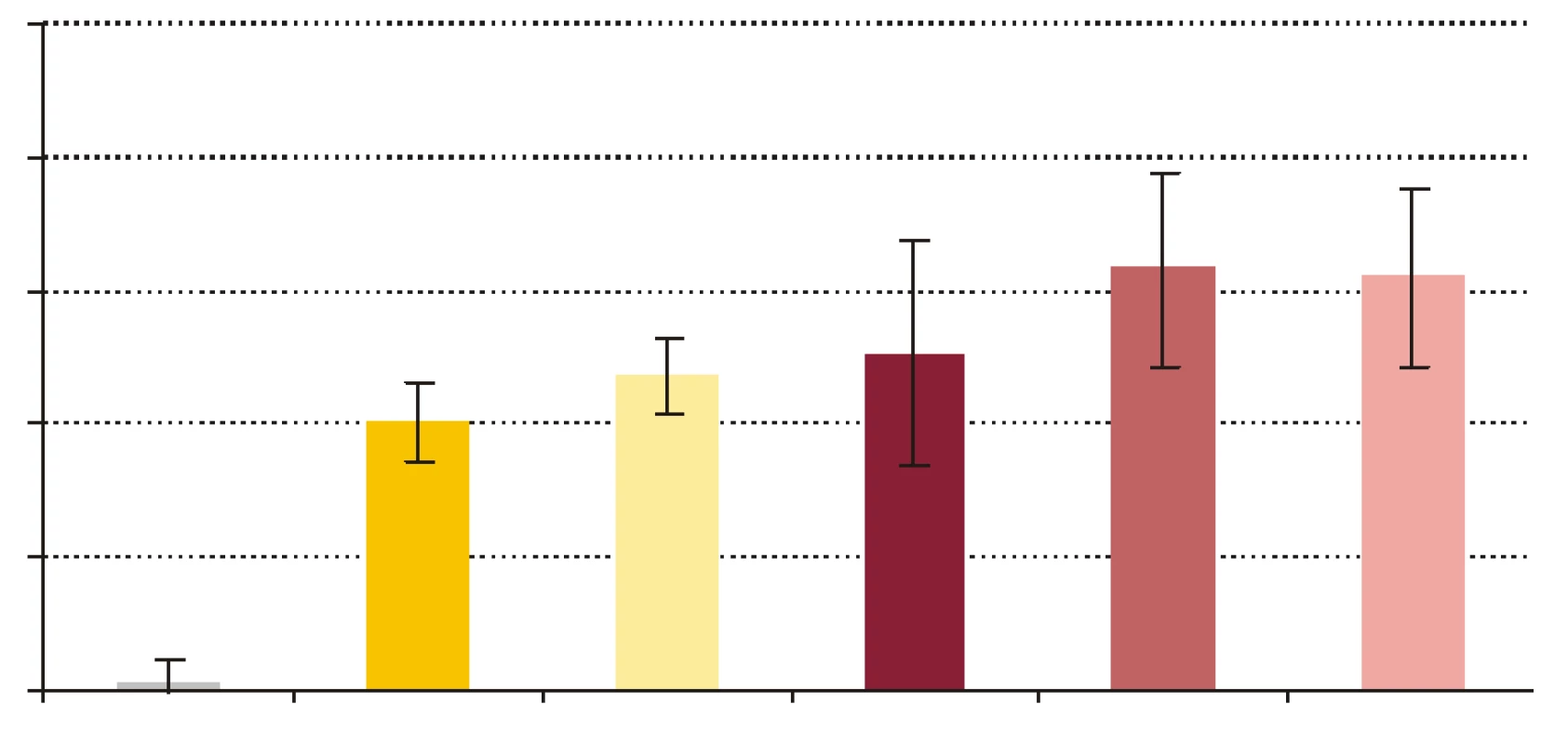
KTRL - kontrola, S - sérum + fyziologický roztok, SP - sérum s PCT10, K - krv + fyziologický roztok, KP1 - krv s PCT1, KP10 - krv s PCT10. Hodnoty sú udané ako priemer ± SEM. Obr. 5. Pomery počtu kolónií S. aureus vyrastených po vyočkovaní vzorky po 60- minútovej inkubácii a počtu kolónií vyrastených po vyočkovaní tej istej vzorky v čase 0, t.j. (vzorka 60/vzorka 0) x 100 %. 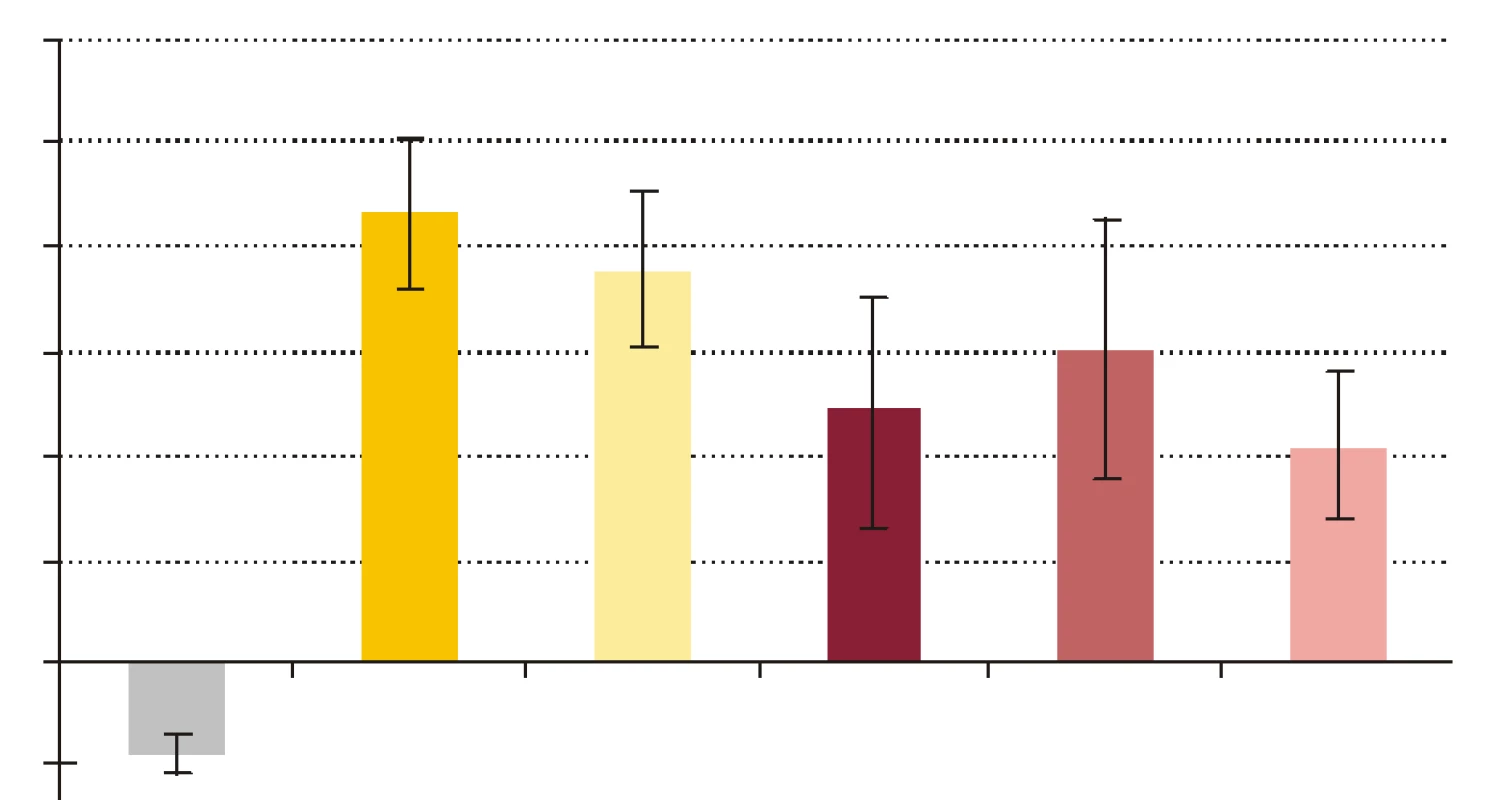
KTRL - kontrola, S - sérum + fyziologický roztok, SP - sérum s PCT10, K - krv + fyziologický roztok, KP1 - krv s PCT1, KP10 - krv s PCT10. Hodnoty sú udané ako priemer ± SEM. Diskusia
Stanovenie koncentrácie PCT v sére/plazme sa síce využíva ako senzitívny a vysoko špecifický ukazovateľ systémovej baktériovej, parazitovej a mykotickej infekcie, reflektujúc jej závažnosť [24] a prognózu pacienta [25,26], informácií o jeho biologickej funkcii je však dodnes veľmi málo [13]. Napriek tomu existuje dostatočné množstvo údajov, ktoré potvrdzujú navrhnutú predstavu PCT ako humorálnej zložky, ktorá má dôležitú úlohu v patofyziológii sepsy [27]. Úlohu PCT ako sekundárneho mediátora sepsy potvrdzujú aj Becker et al [12], ktorí zistili, že kým podanie PCT zdravým zvieratám nie je škodlivé, podanie PCT septickým zvieratám signifikantne zvyšuje ich mortalitu. S týmto zistením koreluje aj nález Hoffmana et al [28], ktorí sledovali vplyv PCT na expresiu iNOS. Zistili, že samotný PCT nenavodzuje expresiu iNOS, avšak efektívne amplifikuje indukciu expresie iNOS cytokínmi TNF-α a INFγ. PCT tak moduluje zápalovú odpoveď. Na pohyblivosť monocytov pôsobí PCT tiež dvojako - kým migráciu monocytov zvyšuje, chemotaxiu navodenú chemoatraktantom FMLP (formyl-metionyl-leucyl-fenylalanín) inhibuje [29]. Zistilo sa tiež, že PCT dávkovo závisle znižuje LPS a FMLP vyvolaný vzostup expresie CD11b, integrínu, ktorý sa zúčastňuje na procese diapedézy monocytov a neutrofilov. Môže tak prispievať k potlačeniu zápalu [30].
Pokiaľ ide o moduláciu špecifickej imunitnej odpovede, ukázalo sa, že PCT pôsobí minimálne dvojakým mechanizmom [31]. PCT zvyšuje aktivitu autológnych kľudových lymfocytov, potláča však mitogénnu aktivitu T-lymfocytov aktivovaných fytohemaglutinínom ako aj schopnosť T-lymfocytov ovplyvnených PCT následne sa aktivovať v prítomnosti fytohemaglutinínu a konkanavalínu A, akoby jeho úlohou bolo udržať aktivitu T-lymfocytov v určitom rozmedzí. S týmito výsledkami súvisia poznatky o dynamike sepsy, o polarizácii imunitnej odpovede počas sepsy [32,33]. Rozvoj SIRS sprevádza totiž mohutná tvorba prozápalových cytokínov a to za účelom mobilizácie organizmu s cieľom zvládnuť infekciu. V prípade prestrelenia tejto reakcie môže, hlavne vo včasnej fáze sepsy, pacient zomrieť za príznakov hyperinflamácie, ktorá vznikla na podklade nadmernej snahy organizmu vysporiadať sa s infekciou za každú cenu, pričom tento proces nebol regulačne zvládnutý. Takmer súčasne po vyplavení prozápalových cytokínov dochádza aj k uvoľneniu protizápalových cytokínov, ktoré pôsobia kontraregulačne a snažia sa zmierniť negatívny dopad, ktorý vyplýva z prehnanej aktivity prozápalových cytokínov. Rozvíja sa kompenzačný antagonistický mechanizmus CARS (syndróm kompenzačnej protizápalovej odpovede), ktorý v ideálnom prípade vedie k nastoleniu rovnovážneho stavu cytokínov - MARS (mixed antagonistic response syndrome - syndróm zmiešanej antagonistickej odpovede), kedy má pacient najväčšiu šancu na úzdravu. V prípade, ak mechanizmy CARS prestrelia, dostáva sa pacient do stavu imunoparalýzy a zomiera za príznakov imunodepresie, ktorá je charakteristická, hlavne pre neskoršiu fázu sepsy [32].
Výsledky našej práce podporujú teóriu možnej imunosupresívnej úlohy prokalcitonínu. Signifikantné zníženie FA, FI a CA PMNL navodené pridaním už najnižšej testovanej koncentrácie rhPCT (1 ng x ml-1) a následné prehlbovanie sa tohto inhibičného efektu so stúpajúcou koncentráciou pridávaného rhPCT jednoznačne poukazuje na to, že prokalcitonín by mohol významne potláčať schopnosť fagocytózy a cídie PMNL a tlmiť tak mechanizmy bunkovej zložky nešpecifickej imunity.
Počet baktérií E. coli v sére počas inkubácie značne stúpol, čo znamená, že došlo k inhibícii mikrobicídie a mikroorganizmy sa v prítomnosti PCT lepšie množili. Baktérie boli v sére vystavené iba humorálnym mechanizmom nešpecifickej imunity, ktoré zahŕňajú β-lyzín, properdín, interferóny a ostatné cytokíny, proteíny akútnej fázy, lyzozým a komplement ako najúčinnejší z nich [34]. Jeden z dôvodov relatívnej rezistencie baktérií na účinok komplementu je, že boli použité zbierkové kmene, a nie kmene, ktoré bežne kolujú v populácii. S použitými kmeňmi baktérií sa teda dobrovoľní darcovia séra pravdepodobne ešte nestretli. Pravdepodobná neprítomnosť špecifických protilátok IgG proti testovaným kmeňom baktérií v sére darcov eliminovala možnosť aktivácie komplementu klasickou cestou, a preto sa mohla uplatniť len alternatívna resp. lektínová cesta. Koncentrácia rhPCT 10 ng x ml-1 vo vzorke séra spôsobila zvýšenie nárastu počtu kolónií E. coli, čo by mohlo znamenať potlačenie účinku humorálnych mechanizmov nešpecifickej imunity. Čo sa týka baktérií S. aureus, PCT spôsobil zníženie nárastu počtu kolónií, ktoré, hoci bolo nesignifikantné, predstavuje opačný účinok PCT než bol tento pri E. coli. Potenciálnym vysvetlením by mohol byť fakt, že keďže je S. aureus G+ a E. coli G - baktéria, majú výrazne odlišné zloženie bakteriálnej steny, ktorú mechanizmy nešpecifickej imunity odlišným spôsobom atakujú [34].
Pri porovnávaní pomeru počtu kolónií (PPK) baktérií získaných vyočkovaním vzoriek obsahujúcich ako nosné médium krv, sme pridávaním rhPCT do vzoriek sledovali jeho vplyv na usmrcovanie baktérií v procese fagocytózy. PCT s koncentráciou 1 ng x ml-1 vo vzorke navodil zvýšenie nárastu počtu kolónií S. aureus aj E. coli počas 60-minútovej inkubácie. Dalo by sa to interpretovať tak, že rhPCT znížil efektivitu cídnych mechanizmov pôsobiacich na baktérie vo vzorke, t.j. znížil cídnu schopnosť fagocytov. Potenciálny supresívny vplyv rhPCT na cídnu schopnosť fagocytov sa v prípade cídie E. coli zvýšením koncentrácie rhPCT vo vzorke na 10 ng x ml-1 zosilnil, keďže nárast počtu kolónií sa ešte výraznejšie zvýšil. Iná situácia bola v pokuse s baktériou S. aureus, kedy rhPCT s koncentráciou 10 ng x ml-1 vo vzorke mal opačný účinok než rhPCT s koncentráciou 1 ng x ml-1, t.j. nárast počtu kolónií počas inkubácie znížil. Je možné, že PCT sa vylučuje na podnet imunitných mechanizmov resp. mediátorov aktivovaných výraznejšie G - baktériami než G+, a následne tieto mechanizmy resp. mediátory ovplyvňuje. Zodpovedá tomu aj skutočnosť, že najvyššie koncentrácie PCT sa našli pri G - sepse [35,36], zatiaľ čo pri niektorých stafylokokových systémových infekciách hodnoty PCT neboli vôbec zvýšené [37].
Výsledky našej práce poukazujú na supresívny vplyv PCT na fagocytózu. Je možné domnievať sa, že PCT ako jeden z protizápalových cytokínov potláča mechanizmy bunkovej nešpecifickej imunity v snahe zabrániť rozvoju hyperinflamácie. Prestrelená tvorba PCT pravdepodobne prispieva ku vzniku imunodepresie v neskoršej fáze septického syndrómu, čo by mohli dokumentovať aj naše výsledky, ktoré poukázali na dávkovo závislú inhibíciu fagocytárnej a kandidacídnej schopnosti PMNL. Túto skutočnosť potvrdzuje aj známa korelácia vysokých hladín PCT so zlou prognózou [38,39].
Štúdia bola umožnená aj vďaka podpore grantu VEGA 1/0528/03 MŠ SR. Ďakujeme firme Brahms (Germany), ktorá nám darovala rhPCT za výskumným účelom.
MUDr. Mária Bucová, CSc.
www.fmed.uniba.sk
e-mail: maria.bucova@fmed.uniba.sk
Doručeno do redakce: 11. 7. 2005
Přijato po recenzi: 5. 9. 2005
Zdroje
1. Le Moullec JM, Jullienne A, Chenais J, et al. The complete sequence of human preprocalcitonin. FEBS Lett 1984; 167 : 93-97.
2. Becker KL, Müller B, Nylén ES at al. Calcitonin gene family of peptides. Structure, molecular biology and effects. In: Bilizikian JP, Raisz LG, Rodin GA (eds). Principles of Bone Biology. 2nd ed. San Diego: Academic Press 2002 : 616-639.
3. Broad PM, Symes AJ, Thakker RV et al. Structure and methylation of the human calcitonin/alpha-CGRP gene. Nucleic Acids Res 1989; 17 : 6999-7011.
4. Becker KL, Müller B, Nylén ES et al. Calcitonin gene family of peptides. In: Principles and Practice of Endocrinology and Metabolism. Philadelphia: J. B. Lippincott 2001 : 520-534.
5. Müller B, White JC, Nylén ES et al. Ubiquitous expression of the calcitonin-1 gene in multiple tissues in response to sepsis. J Clin Endocrinol Metab 2001; 86 : 396-404.
6. Brunkhorst FM, Wegscheider K, Forycki ZF et al. Procalcitonin for early diagnosis and differentiation of SIRS, sepsis, severe sepsis, and septic schock. Intens Care Med 2000; 26 : 148-152.
7. Jimeno A, García-Velasco A, Del Val O et al. Assessment of procalcitonin as a diagnostic and prognostic marker in patients with solid tumors and febrile neutropenia. Cancer 2004; 100 : 2462-2469.
8. Müller B, Becker KL. Procalcitonin: how a hormone became a marker and mediator of sepsis. Swiss Med Wkly 2001; 131 : 595-602.
9. Balog A, Ocsovszki I, Mandi Y. Flow cytometric analysis of procalcitonin expression in human monocytes and granulocytes. Immunol Lett 2002; 84 : 199-203.
10. Oberhoffer M, Stonans I, Russwurm S et al. Procalcitonin expression in human peripheral blood mononuclear cells and its modulation by lipopolysaccharides and sepsis-related cytokines in vitro. J Lab Clin Med 1999; 134 : 49-55.
11. Morgenthaler NG, Struck J, Chancerelle Y et al. Production of procalcitonin (PCT) in non-thyroidal tissue after LPS injection. Horm Metab Res 2003; 35 : 290-295.
12. Becker KL, Nylén ES, Snider RH et al. Immunoneutralization of procalcitonin as therapy of sepsis. Journal of Endotoxin Research 2003; 9 : 367-374.
13. Meisner M, Muller V, Khakpour Z et al. Induction of procalcitonin and proinflammatory cytokines in an anhepatic baboon endotoxin shock model. Shock 2003; 19 : 187-190.
14. Maruna P, Nedelnikova K, Gürlich R. Physiology and genetics of procalcitonin. Physiol Res 2000; 49 : 57-61.
15. Meisner M, Brunkhorst FM, Reith HB et al. Clinical experiences with a new semi-quantitative solid phase immunoassay for rapid measurement of procalcitonin. Clin Chem Lab Med 2000; 38 : 989-995.
16. Al-Nawas B, Krammer I, Shah PM. Procalcitonin in diagnosis of severe infections. Eur J Med Res 1996; 1 : 331-333.
17. Selberg O, Hecker H, Martin M et al. Discrimination of sepsis and systemic inflammatory response syndrome by determination of circulating plasma concentrations of procalcitonin, protein complement 3a, and interleukin-6. Crit Care Med 2000; 28 : 2793-2798.
18. Tugrul S, Esen F, Celebi S et al. Reliability of procalcitonin as a severity marker in critically ill patients with inflammatory response. Anaesth Intensive Care 2002; 30 : 747-754.
19. Wanner GA, Keel M, Steckholzer U et al. Relationship between procalcitonin plasma levels and severity of injury, organ failure, and mortality in injured patients. Crit Care Med 2000; 28 : 950-957.
20. Zazula R, Průcha M, Spálený A et al. Prokalcitonin nejen v diferenciální diagnostice zánětlivé odpovědi organismu. Anest Neodkl Péče 2002; 13 : 86-91.
21. Meisner M. Pathobiochemistry and clinical use of procalcitonin. Clin Chim Acta 2003; 328 : 199.
22. Chýlková J, Procházková J. Baktericidní aktivita krve. In: Procházková J, John C, Lochman I et al. Vybrané diagnostické metody lékařské imunologie. Praha: Avicenum 1986, 209-211.
23. Bucová M. Určenie fagocytárnej schopnosti polymorfonukleárnych leukocytov. In: Buc M, Absolonová O, Bózner P et al. Praktické cvičenia z imunológie. Bratislava: Lekárska fakulta UK 1992 : 38-41.
24. Assicot M, Gendrel D, Carsin H et al. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993; 341 : 515-518.
25. Müller B, Becker KL, Schächinger H et al. Calcitonin precursors are reliable markers of sepsis in the medical intensive care unit. Crit Care Med 2000; 28 : 977-983.
26. Ruokonen E, Ilkka L, Niskanen M et al. Procalcitonin and neopterin as indicators of infection in critically ill patients. Acta Anaesthesiologica Scandinavica 2002; 46 : 398.
27. Russwurm S, Wiederhold M, Oberhoffer M et al. Molecular aspects and natural source of procalcitonin. Clin Chem Lab Med 1999; 37 : 789-797.
28. Hoffman G, Czechowski M, Schobersberger W et al. Procalcitonin amplifies nitric oxide synthase gene expression and nitric oxide production in vascular smooth muscle. Crit Care Med 2002; 30 : 2091-2095.
29. Wiedermann FJ, Kaneider N, Egger P et al. Migration of human monocytes in response to procalcitonin. Crit Care Med 2002; 30 : 1112-1117.
30. Monneret G, Arpin M, Venet F et al. Calcitonin gene related peptide and N-procalcitonin modulate CD11b upregulation in lipopolysaccharide activated monocytes and neutrophils. Intensive Care Med 2003; 29 : 923-928.
31. Bucová M, Záhorec R, Buc M. Immunosuppressive effect of recombinant human procalcitonin on mitogenic activity of lymphocytes. J End Res 2005, prijaté do tlače.
32. Bucová M. Úloha cytokínov v rozvoji lokálneho a systémového zápalu a septického šoku. Vnitř Lék 2002; 48 : 755-762.
33. Bucová M. Polarizácia lymfocytov T a úloha cytokínov v iniciálnom procese rozvoja autoimunity. Rheumatologia 2002, 16 : 117-124.
34. Murray PR (ed). Medical Microbiology. 3rd ed. New York: Mosby - Year Book, Inc. 1998 : 109-114.
35. Fleischhack G, Kambeck I, Cipic D et al. Procalcitonin in pediatric cancer patients: its diagnostic relevance is superior to that of C-reactive protein, interleukin 6, interleukin 8, soluble interleukin 2 receptor and soluble tumour necrosis factor receptor II. British Journal of Haematology 2000; 111 : 1093.
36. Svaldi M, Hirber J, Lanthaler AI et al. Procalcitonin-reduced sensitivity and specificity in heavily leucopenic and immunosuppressed patients. British Journal of Haematology 2001; 115 : 53.
37. Giamarellou H, Giamarellos-Bourboulis EJ, Repoussis P et al. Potential use of procalcitonin as a diagnostic criterion in febrile neutropenia: experience from a multicentre study. Clinical Microbiology & Infection 2004; 10 : 628.
38. Bucová M. Prokalcitonín - prohormón, hormokín, mediátor zápalu, diagnostický a prognostický marker systémového zápalu. Československá fyziologie 2005; 54 : 97.
39. Průcha M, Herold I, Zazula R et al. Srovnání prokalcitoninu, interleukinu 6 a C-reaktivního proteinu v diferenciální diagnostice pacientu JIP se syndromem sepse. Vnitř Lék 2003; 49 : 541
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Studie ASCOT: konec léčby hypertenze beta-blokátory? – editorial
- Vztah refluxní choroby jícnu k astmatu bronchiale a horním cestám dýchacím
- Obsah bakterií v probioticích dostupných na českém trhu
- Vliv dlouhodobé substituční terapie růstovým hormonem na tělesné složení, kostní tkáň a některé metabolické parametry u dospělých osob s deficitem růstového hormonu
- Vplyv rekombinantného ľudského prokalcitonínu na fagocytovú a kandidacídnu schopnosť polymorfonukleárnych leukocytov a na cídne mechanizmy séra a krvi voči baktériám Staphylococcus aureus a Escherichia coli
- Možnosti ultrasonografické diferenciace krčních a axilárních lymfadenopatií
- Idiopatická plicní fibróza
- Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie (diferenciální diagnóza a terapie ve světle nových poznatků)
- Prevence kardiovaskulárních příhod antihypertenzní léčbou amlodipinem a perindoprilem ve srovnání s atenololem a bendroflumetiazidem. Výsledky studie ASCOT (Anglo-Scandinavian Outcomes Trial: blood pressure lowering arm) - multicentrická, randomizovaná, kontrolovaná studie. Mezník ve vývoji názorů na kombinační léčbu hypertenze? (komentář)
- Atypická lokalizace pyoderma gangraenosum u nemocného s ulcerózní kolitidou
- Diagnostika a léčba hepatocelulárního karcinomu
- Nesnášenlivost potravin - příčina či následek trávicích poruch?
-
Dopis redakci
Přínos pioglitazonu u pacientů s diabetes mellitus 2. typu a kardiovaskulárními komplikacemi - 75 let prof. MUDr. Karla Trnavského, DrSc.
- 200 let od narození Josefa Škody (10. 12. 1805 - 13. 6. 1881)
- XII. výroční kongres České internistické společnosti ČLS J. E. Purkyně Praha 23. - 25. 10. 2005
- Z odborné literatury
-
Jmenný rejstřík
Původní práce, editorialy, přehledné referáty, doškolování, popisy případů a krátká sdělení - Věcný rejstřík
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Idiopatický hypereozinofilní syndrom a chronická eozinofilní leukemie (diferenciální diagnóza a terapie ve světle nových poznatků)
- Možnosti ultrasonografické diferenciace krčních a axilárních lymfadenopatií
- Vztah refluxní choroby jícnu k astmatu bronchiale a horním cestám dýchacím
- Idiopatická plicní fibróza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



