-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVliv mechanických faktorů na pozdější výsledek plastiky předního zkříženého vazu
Influence of mechanical factors to the later result of recostruction of the anterior cruciate ligament
The goal of this retrospective study is an evaluation of the effect of some mechanical factors on the knee stability after anterior cruciate ligament reconstruction with a graft from the middle third of patellar ligament.
From the mechanical factors, the author monitored the effect of location of tibial and femoral channel on the joint stability, the most frequent combinations of the location of these channels, furthermore the shape of the tibial channel and the effect of tibial channel enlargement on the joint stability.
In the period from 1996 to 2003 there were totally 284 patients in the Department of Trauma Surgery in Pardubice who underwent a reconstructtion of the anterior cruciate ligament. The file included 205 patients with an isolated rupture of this ligament. All patients were examined with arthrometer KT 1000 and the results were evaluated according to form IKDC (International Knee Documentation Committee).Key words:
anterior cruciate ligament, placement of a graft, radiology findings, residual point laxity, arthrometer KT 1000.
Autoři: Jan Vanáč
Působiště autorů: Institute of Health Studies, Pardubice University ; Ústav zdravotnických studií, Univerzita Pardubice ; Department of Traumatic Surgery, Trauma centre of the Regional Hospital Pardubice ; Oddělení úrazové chirurgie, Traumacentrum Krajské nemocnice Pardubice
Vyšlo v časopise: Úraz chir. 14., 2006, č.3
Souhrn
Cílem této retrospektivní studie je zhodnocení vlivu některých mechanických faktorů na stabilitu kolenního kloubu po provedené plastice předního zkříženého vazu štěpem ze střední třetiny ligamenta patellae.
Autor sledoval vliv umístění tibiálního a femorálního kanálu na stabilitu kloubu, nejčastější kombinace umístění těchto kanálů, dále pak tvar tibiálního kanálu a vliv rozšíření tibiálního kanálu na stabilitu kloubu.
V letech 1996–2003 byla provedena na Oddělení úrazové chirurgie v Pardubicích celkem u 284 pacientů náhrada předního zkříženého vazu. Do souboru bylo zařazeno 205 pacientů s izolovanou rupturou tohoto vazu. Všichni pacienti byli vyšetřeni artrometrem KT 1000 a výsledky byly zhodnoceny podle formuláře IKDC (International Knee Documentation Committee).Klíčová slova:
přední zkřížený vaz, umístění štěpu, RTG nálezy, reziduální laxita kloubu, artrometr KT 1000.Úvod
Ruptura předního zkříženého vazu patří mezi nej častější vazivové poranění kolenního kloubu a existuje velké množství operačních technik, používaných ke korekci vzniklé nestability kolenního kloubu. Náhrada předního zkříženého vazu je nejčastějším chirurgickým výkonem v dnešní sportovní medicíně. Každým rokem se například v USA podrobuje náhradě předního zkříženého vazu 50 000 pacientů [22]. Mnoho studií se zabývá kinematikou nepoškozeného LCA a srovnává jej se štěpem, který má tento vaz nahradit, stejně tak jako jsou porovnávány výsledky různých operačních technik, použitých k náhradě tohoto vazu.
Přes všechny snahy dosud není možné plně nahradit normální LCA a jeho funkci vzhledem k jeho složité architektuře [3, 6, 9].
Rovněž technicky zatím není možné plně napodobit anatomický úpon tohoto vazu na kloubní povrch tibie a femuru [4]. Dalším, často diskutovaným problémem, je dosažení správného napětí štěpu při provádění operace [12]. Jeli napětí příliš velké, je omezená plná flexe kolena a postupně dochází k přetížení štěpu a jeho následné degeneraci a pozdějšímu selhání, jeli naopak příliš nízké, je stabilita kloubu již od počátku nedostatečná. Přesto neexistuje žádné doporučení ke způsobu provedení exaktního napětí štěpu při jeho fixaci [1, 12].
Velký vliv na pozdější výsledek operace má rovněž umístění štěpu. Všeobecně se uvádí, že větší vliv má umístění femorálního kanálu [9]. Příliš ventrální umístění štěpu na femuru vede k vysokému napětí štěpu při flexi, což může nejprve vést k omezení flexe kolena, později i ke vzniku nestability [1]. Příliš dorzální umístění štěpu oproti tomu vede k postupnému oslabování štěpu při plné extenzi [12]. Správné umístění štěpu je co nejblíže izometrickému svazku vláken původního vazu.
Dalším faktorem, o jehož vlivu na pozdější selhání plastiky se často diskutuje, je zvětšení tibiálního kanálu. Příčina tohoto zvětšení je dosud neznámá. Existuje velké množství hypotéz na vznik tohoto fenoménu. Autoři nacházejí zvětšení tibiálního kanálu již jeden měsíc od plastiky a stupeň tohoto rozšíření nezávisí na délce intervalu od provedené operace. Tento jev byl nejprve popsán u plastik s použitím alogenního štěpu, kdy tkáň alograftu může být vlastní příčinou osteolýzy, způsobené imunologickou reakcí proti štěpu.
Za základní příčinu rozšíření kanálu jsou v poslední době nejčastěji uváděny především mechanické faktory [6, 7, 8, 23]. Mezi tyto faktory patří především pohyb štěpu v kanálu [7, 23], příliš agresivní rehabilitace [12] a špatné umístění kanálu [20]. U operace provedené z jedné incize je kostní bloček umístěn v distální třetině kanálu a v proximální části kanálu může docházet k příčnému pohybu interligamentózní části štěpu [23]. Efekt transverzálního pohybu intraosální část štěpu v kanále se nazývá syndrom „okenního stěrače” [23].
Materiál a metoda
Od 1. ledna 1996 do 31. prosince 2003 bylo u 205 pacientů (28 žen, 177 mužů) provedeno 205 náhrad předního zkříženého vazu pro izolovanou rupturu tohoto vazu. Od roku 2001 začaly být využívány k fixaci štěpu rovněž biodegradabilní šrouby, kterými byla provedena do 31. prosince 2003 fixace u 40 pacientů.
Do souboru sledovaných pacientů nebyli zařazeni pacienti s provedenou náhradou LCA na obou kolenních kloubech (4 pacienti), pacienti s poraněním předního zkříženého vazu staršího data na druhostranné končetině a pacienti se současným poraněním vnitřního postranního vazu jakéhokoliv stupně na téže končetině (75 pacientů). Současné poranění menisků bylo zjištěno u 52 pacientů. U žádného pacienta ze souboru se nejednalo o replastiku předního zkříženého vazu a zároveň u žádného z pacientů nebyla provedena náhrada vazu štěpem z hamstringů nebo alograftem.
Klinická vyšetření byla provedena na základě formuláře IKDC, měření laxity kloubu bylo provedeno artrometrem KT 1000, RTG vyšetření kolenních kloubů byla provedena v AP projekci, bočné projekci a tunelové projekci se stejnou ohniskovou vzdáleností 1000 mm a výsledky byly zpracovány podle statistické metody 4 faktorového rozptylu hodnot. Reziduální laxitou kloubu rozumíme rozdíl hodnot translace v sagitální rovině mezi zdravým kolenním kloubem a kloubem po provedené náhradě předního zkříženého vazu. Věkový průměr pacientů v souboru byl 26 let (16 – 48 let).
Nejčastější příčinou poranění byly sportovní úrazy (86,3 %), úrazy vzniklé při běžné denní aktivitě představovaly 10,2 % a dopravní úrazy činily 3,5 %.
Ze sportovních úrazů byla nejčastější příčinou poranění kopaná, při které vzniklo 68,3 % ruptur, dále pak lyžování (24,8 %) a zbytek poranění LCA (6,9 %) vzniklo při ostatních sportech (ragby, basketbal, házená).
Z 205 poranění se jednalo v 140 případech o poranění pravého kolenního kloubu, v 65 případech byl poraněn levý kolenní kloub. Interval mezi úrazem a operací byl 8 měsíců (2–34 měsíců). Artroskopie bezprostředně po úraze byla provedena v 182 případech, bez předchozí artroskopie na základě pozitivního nálezu na MRI bylo operováno celkem 18 pacientů. Všichni pacienti ze souboru byli vyšetřeni artrometrem KT 1000, a to v průměru 55 měsíců (18–118) od operace (tab. 1).
Tab. 1. Demografický popis studované skupiny pacientů 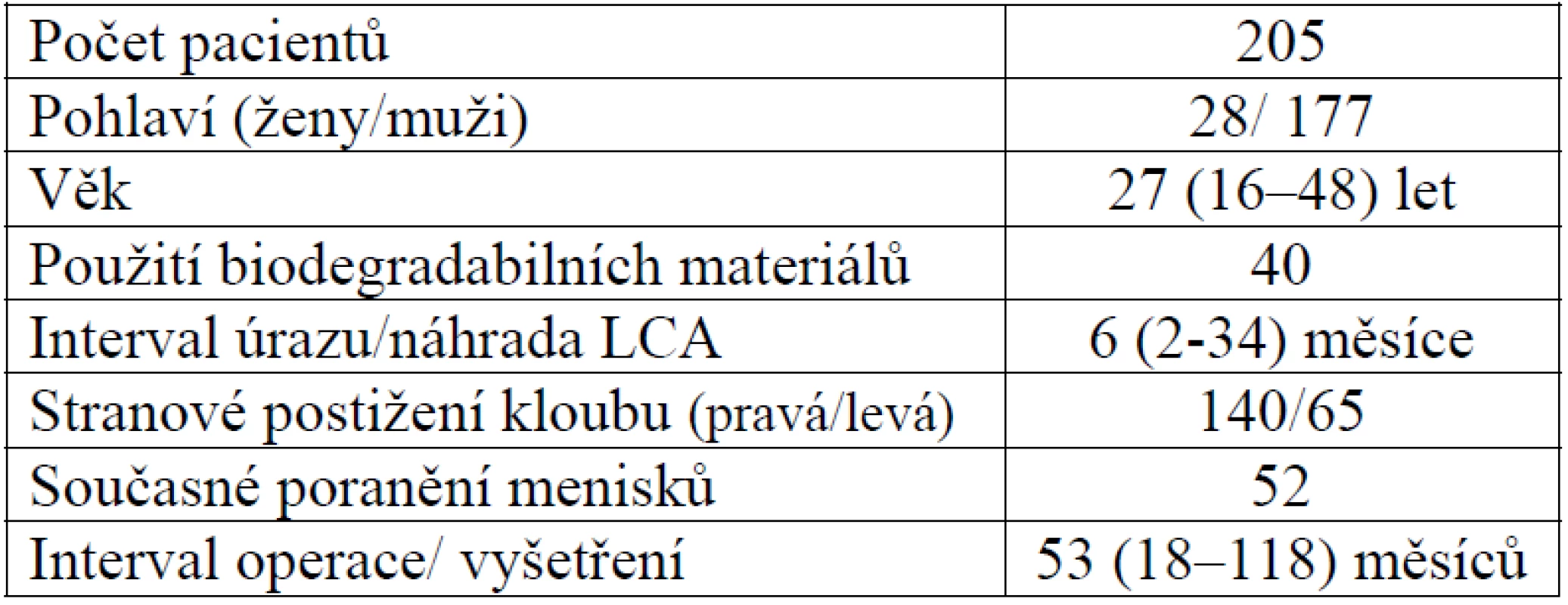
Tegnerovo skóre denní aktivity v souboru dosáhlo hodnoty 8 bodů (3–10), Lysholmovo skóre bylo 87 bodů (rozmezí 14–100). Reziduální laxita proti zdravé končetině byla měřena artrometrem KT 1000 a rozsah pohybu (ROM) byl měřen goniometrem. Vyšetřujícím lékařem nebyl operatér.
Rehabilitace po operaci:
Všichni pacienti se podrobili jednotnému rehabilitačnímu programu podle moderního protokolu [18]. Vertikalizace s pomocí francouzských holí a pasivní rozcvičování kolenního kloubu (CPM) byly zahájeny 1. pooperační den. Žádnému pacientovi nebyla přiložena ortéza ani jiná fixace kolenního kloubu. Po 6 týdnech byla umožněna plná extenze, běh po 12 týdnech, kontaktní a pivotální sporty byly umožněny za 6 měsíců od operace.
Přístrojová analýza a měření:
Celý soubor pacientů byl vyšetřen artrometrem KT 1000 (San Diego, USA), RTG vyšetření bylo provedeno přístrojem Siemens s ohniskovou vzdáleností 1000 mm v AP projekci, bočné projekci a tunelové projekci (40 st. flexe kloubu) a výsledky byly zpracovány podle protokolu IKDC.
Hodnocení polohy femorálního kanálu v sagitální rovině:
K posouzení souvislosti mezi polohou femorálního kanálu a reziduální laxitou kloubu po operaci bylo provedeno vyšetření kolenního kloubu ve 3 projekcích (AP, bočná a tunelová), vždy s ohniskovou vzdáleností 1000 mm.
V přesné bočné projekci byla nejprve identifikována Blumensaatova linie (označující strop interkondylické fosy). Průsečík této linie se zadním obrysem laterálního kondylu stehenní kosti byl označen jako bod A. Dále byl stanoven dorzální bod ohybu Blumensaatovy linie (bod B) a v něm byla vztyčena kolmice k Blumensaatově linii. Na tuto kolmici byla vynesena vzdálenost bodu A od bodu B. Takto získaný čtverec byl dále přenesen směrem ventrálním a byly tak získány 4 možné polohy femorálního kanálu v sagitální rovině (čtverce 1, 2, 3, 4). Velikost těchto čtverců je ovlivněna anatomickou variabilitou především femorálního kondylu u každého z pacientů a sklonem interkondylické fosy (obr. 1, 2).
Obr. 1. Konstrukce možných poloh femorálního kanálu v sagitální rovině 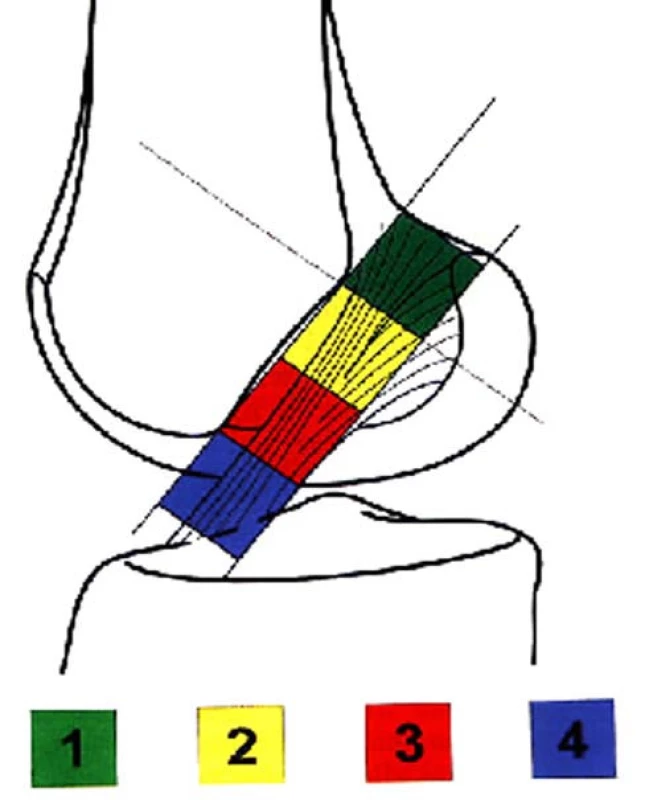
Obr. 2. Vyznačení kanálu v sagitální rovině na RTG 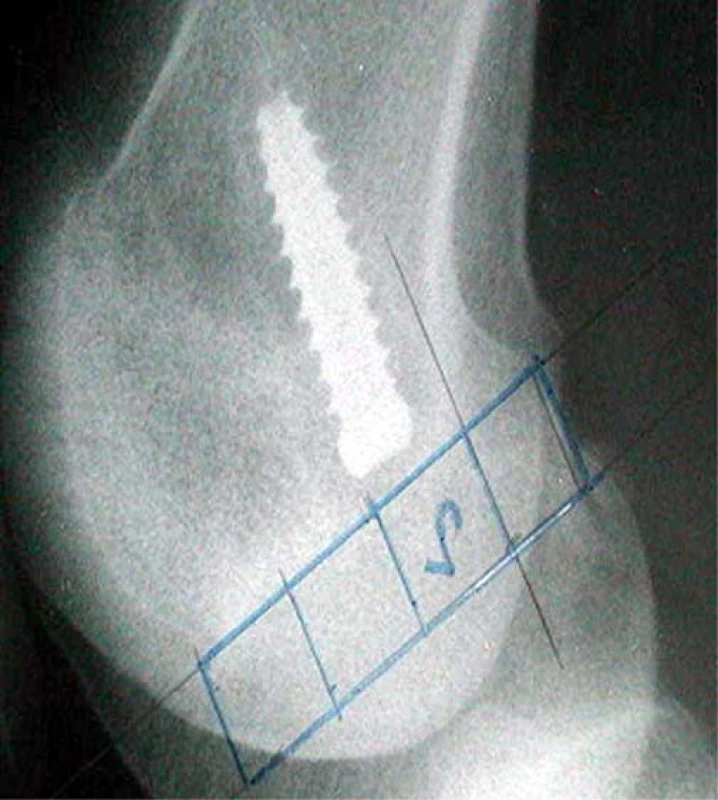
Hodnocení polohy femorálního kanálu ve frontální krajině:
Umístění kanálu bylo hodnoceno z RTG provedených v tunelové projekci (40 st. flexe kolenního kloubu), která umožňuje zobrazení interkondylického prostoru stehenní kosti.
Uprostřed interkondylické fosy byla opsána kružnice, jejíž čtvrtina kopíruje stěnu laterálního kondylu a laterální část stropu interkondylické fosy a tato kružnice byla rozdělena na 3 stejné výseče. Jako 4. doplňující výseč byla připojena výseč z mediální části stropu interkondylické fosy. Tento kruhový průmět interkondylické fosy byl zkonstruován na základě propozic ESSKA (European Society of Sports Traumatology, Knee Surgery and Arthroscopy) [1] (obr. 3).
Obr. 3. Schematické zobrazení možných poloh femorálního kanálu v tunelové projekci 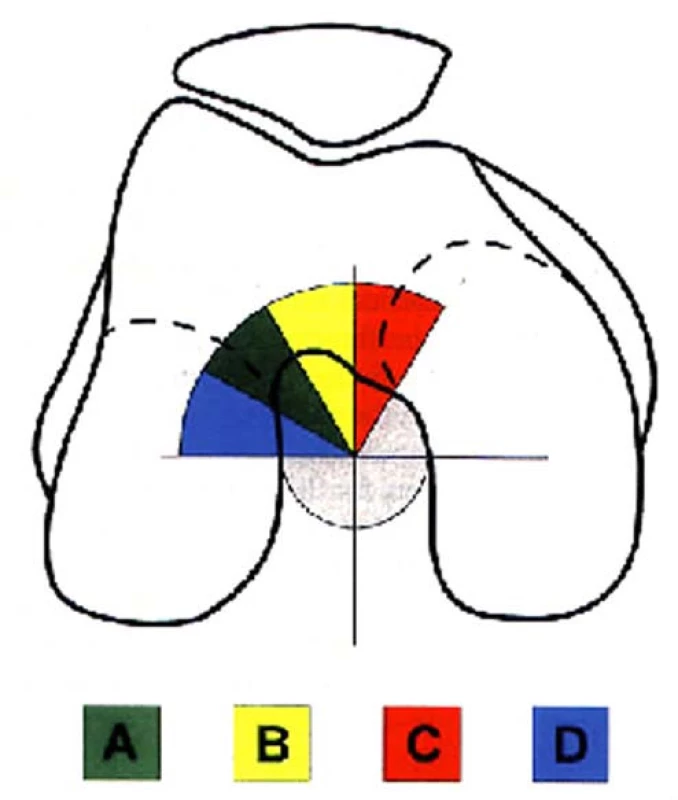
Umístění tibiálního kanálu
Hodnocení tibiálního kanálu bylo prováděno opět na základě RTG vyšetření, a to v bočné projekci. Bylo hodnoceno umístění tibiálního kanálu ve vztahu k Blumensaatově rovině.
Ve studii jsme posuzovali vliv těchto mechanických faktorů:
- Faktor A1 poloha tibiálního kanálu v sagitální rovině.
- Faktor A2 poloha femorálního kanálu v sagitální rovině.
- Faktor A3 poloha femorálního kanálu ve frontální rovině.
- Faktor A4 rozšíření tibiálního kanálu v sagitální rovině.
Cílem studie bylo potvrzení nebo vyvrácení těchto pracovních hypotéz.
Hypotéza I:
Jeden z faktorů A 1, A2, A3, A4 ovlivňuje výsledek operace.
Hypotéza II:
Jedna z kombinací faktorů A1, A2, A3, A4 ovlivňuje výsledek operace.
Výsledky
Femorální kanál:
Nejčastějším umístěním femorálního kanálu v sagitální rovině byla zóna 2, a to ve 170 případech, v zóně 3 bylo umístěno 26 štěpů, v zóně 1 bylo 9 štěpů a nezaznamenali jsme štěp v zóně 4 (tab. 3).
Nejčastějším umístěním femorálního kanálu ve frontální rovině byla zóna B, a to v počtu 178 štěpů, v zóně A 21 štěpů a v zoně C 6 štěpů. Nezaznamenali jsme ani jeden štěp v zóně D (tab. 4).
Tab. 2. Umístění femorálního kanálu v sagitální rovině 
Tab. 3. Umístění femorálního kanálu ve frontální rovině 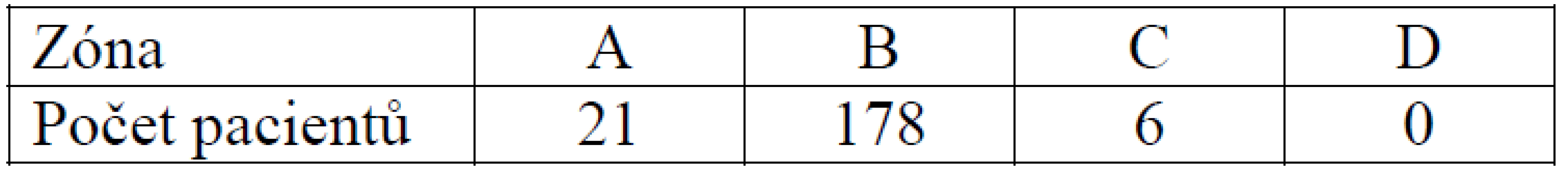
Tibiální kanál:
Nejčastějším umístěním tibiálního kanálu v sagitální rovině byla zóna 1, a to v 188 případech, v zóně 2 bylo umístěno 16 štěpů a v zóně 3 jeden štěp. Nezaznamenali jsme přítomnost štěpu v zóně 4 (tab. 5).
Tab. 4. Umístění tibiálního kanálu v sagitální rovině 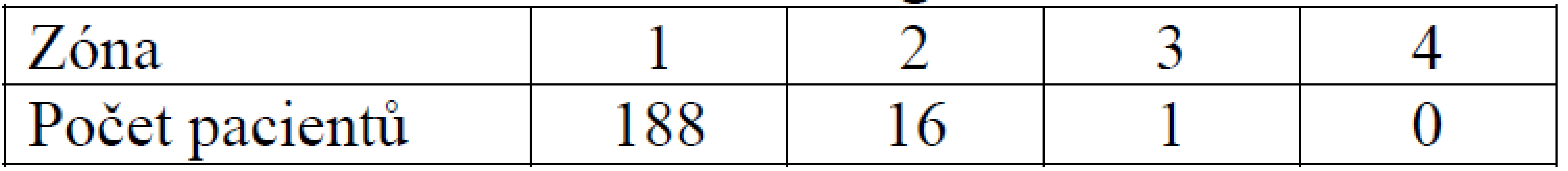
Obr. 4. RTG kolenního kloubu v tunelové projekci 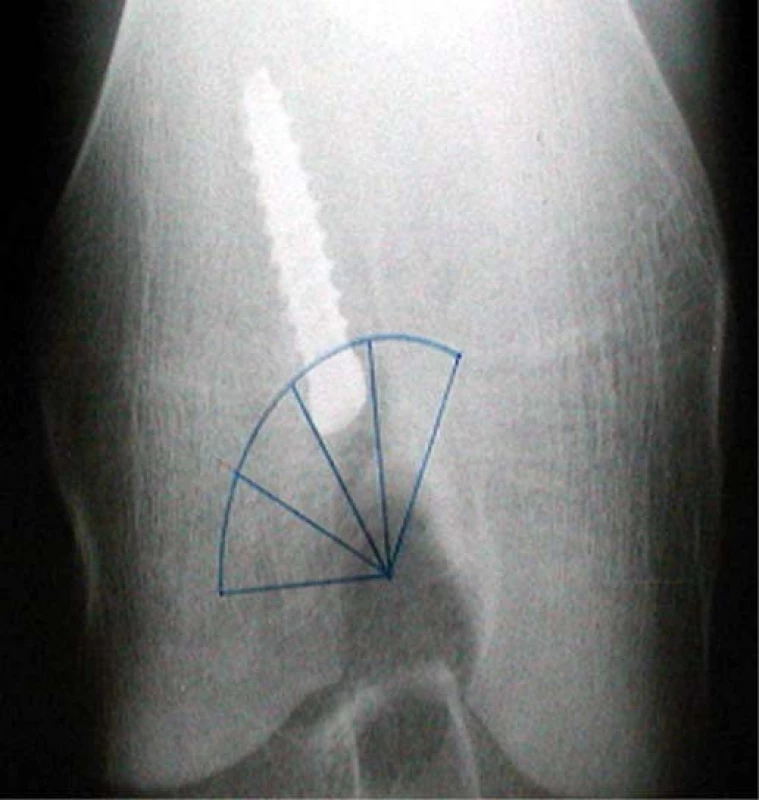
Obr. 5. Schematické zobrazení možných poloh tibiálního kanálu 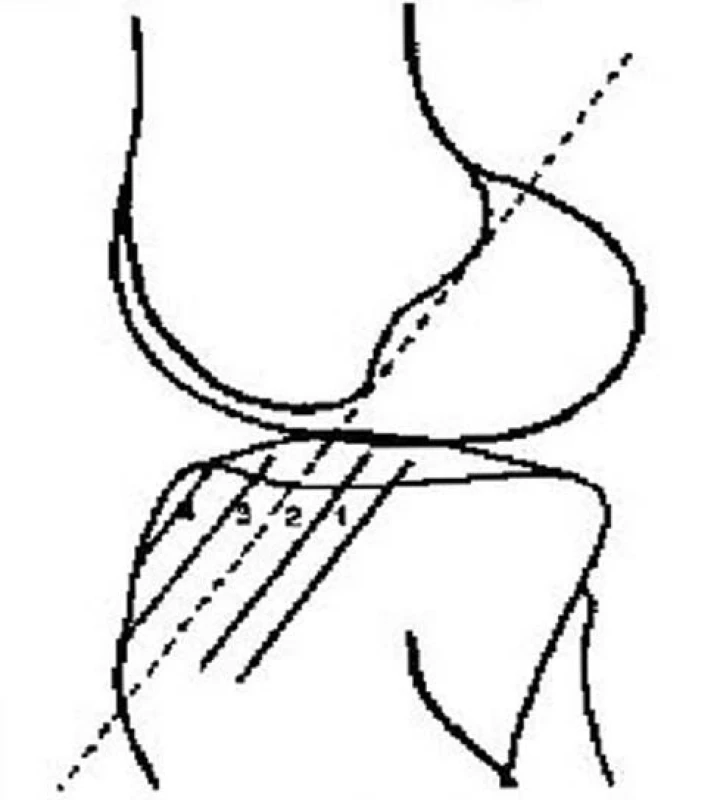
Konický tvar tibiálního kanálu se vyskytl v 154 případech, lineární u 48 provedených plastik a dutinový tvar u 3 pacientů (tab. 6).
Tab. 5. Tvar tibiálního kanálu 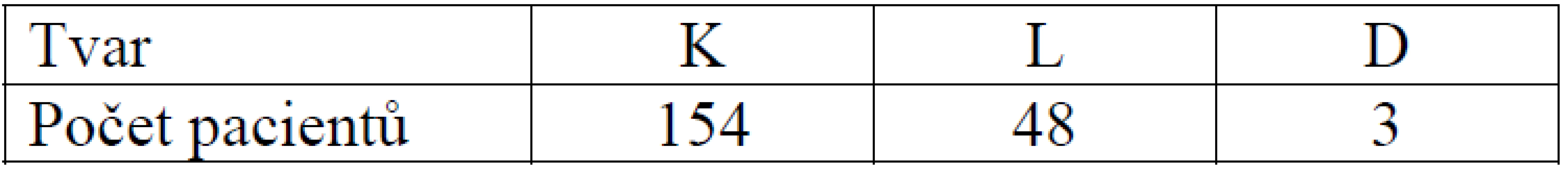
Nejčastější kombinací poloh kanálů (faktory A1–A4) byla poloha 1x2xB s konickým tvarem tibiálního kanálu.
Všichni pacienti byli podrobeni měření reziduální laxity artrometrem KT 1000 a výsledky byly vyhodnoceny podle statistické metody 4 faktorového rozptylu hodnot.
Statistické zpracování:
Zjištěné hodnoty byly zpracovány 4faktorovou analýzou rozptylu hodnot a zjistili jsme, že hladina významnosti v hodnotě nižší než 0,05 nebyla nalezena u žádného z faktorů ani u vzájemných kombinací jednotlivých faktorů. Neprokázali jsme tedy vliv polohy a tvaru kanálů na hodnoty reziduální laxity kloubu po operaci.
Závěr
Na základě statistických výsledků jsme dospěli k závěru, že umístění jednotlivých kanálů zjištěných v našem souboru a rovněž tvar tibiálního kanálu nemá vliv na pozdější výsledek operace.
Obr. 6. Schematické zobrazení možných poloh tibiálního kanálu 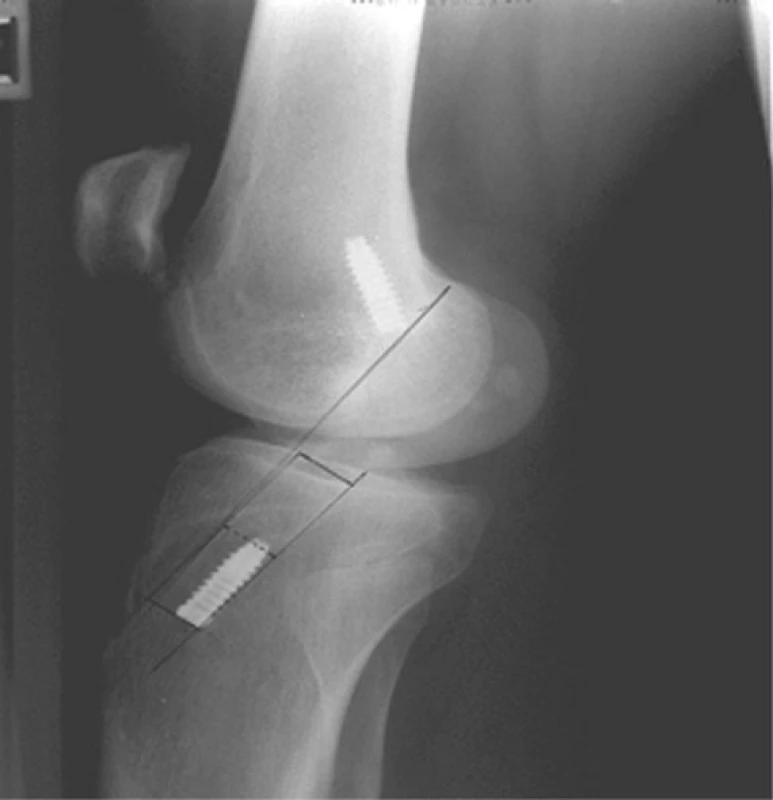
Je však nutné poukázat na to, že v souboru se nevyskytly polohy femorálního respektive tibiálního kanálu v hraničních zonách, které by svědčily již pro potenciálně chybné umístění štěpu.
V posledních letech byla vypracována celá řada recentních studií, které se zabývají biomechanickou úlohou LCA a různými operačními technikami používanými k provedení náhrady tohoto vazu [13]. S neustále se zvyšujícím počtem provedených operací tohoto typu také stoupá počet selhávajících rekonstrukcí a autoři diskutují nejen o příčinách tohoto selhání, ale také o možném způsobu dalšího řešení následně vzniklé nestability kolenního kloubu. Neuspokojivé výsledky po plastice LCA jsou uváděny v rozmezí 10 %–25 % [16, 17].
Většina autorů se shoduje na vlivu správného umístění femorálního kanálu, především v sagitální rovině, na výsledný efekt operace [1, 4, 5, 9, 13, 15], jiní autoři upozorňují na poměrně velkou variabilitu v umístění tibiálního kanálu [18, 22]. Správné umístění středu tibiálního kanálu (místo zavedení Ki drátu) autoři uvádějí 3 mm za středem střední třetiny šíře tibiálního plató v sagitální rovině. U plastiky s transtibiálně cíleným femorálním kanálem má chybné umístění tibiálního kanálu přímou souvislost s chybným umístěním femorálního kanálu ve frontální rovině [11, 12]. V našem souboru nebyly nalezeny případy s ventrálněji umístěným tibiálním kanálem, než v zóně 3, takže nemůžeme posoudit vliv tohoto příliš ventrálního umístěného tibiálního kanálu (zóna 4).
U všech plastik s umístěním štěpu v zóně 3 byly provedeny artroskopické notch plastiky stropu interkondylické fosy.
V našem souboru bylo nejčastější umístění tibiálního kanálu v zóně 1 (cílena pod úhlem 70 st.), což vedlo nejčastěji k následnému umístění femorálního kanálu do zóny B ve frontální rovině. Většina autorů však preferuje umístění femorálního kanálu do zóny A, a to především proto, že štěp probíhá méně strmě. U takto umístěného štěpu by translace kolenního kloubu v sagitální rovině měla být menší než u štěpu umístěného v zóně B. Vzhledem k tomu, že stoupavost tibiálního kanálu je ovlivněna délkou odebraného štěpu, nabízí se možnost cílení femorálního kanálu u delších štěpů z mediálního artroskopického portu. My jsme však v našem souboru pacientů této možnosti nevyužívali a femorální kanál jsme vždy cílili transtibiálně. V našem souboru jsme však nenalezli rozdíl ve stabilitě kloubu v závislosti na poloze femorálního kanálu vrtaného v zóně A nebo B.
Dalším faktorem, o jehož vlivu na pozdější selhání plastiky se často diskutuje, je zvětšení tibiálního kanálu. Příčina tohoto zvětšení je dosud neznámá. Existuje velké množství hypotéz na vznik tohoto fenoménu. Autoři nacházejí zvětšení tibiálního kanálu již jeden měsíc od plastiky a stupeň tohoto rozšíření nezávisí na délce intervalu od provedené operace.
V poslední době jsou nejčastěji uváděny především mechanické faktory za základní příčinu rozšíření kanálu [6, 7, 8, 23]. Mezi tyto faktory patří především pohyb štěpu v kanálu [7, 23], příliš agresivní rehabilitace [12] a špatné umístění kanálu [20]. Agresivní rehabilitace snižuje incidenci artrofibrózy a omezení hybnosti po operaci; tyto rehabilitační protokoly zahrnují již iniciálně plnou extenzi, velmi rychlou zátěž končetiny a rychlý návrat původního rozsahu pohybu. Někteří autoři uvádějí tento typ rehabilitace za příčinu rozšíření tibiálního kanálu. Podle nich dochází k předčasnému pohybu štěpu v tibiálním kanálu, a to ještě před jeho biologickou inkorporací. Kadaverické studie rovněž prokázaly 3–4x větší zatížení štěpu u příliš ventrálně umístěného štěpu [25, 26] a tyto síly přenášené na štěp pak mohou být příčinou zvětšení kanálu.
Klinický význam zvětšení tibiálního kanálu je stále diskutován. Někteří autoři tvrdí, že existence zvětšení tibiálního kanálu je irelevantní pro subjektivní i objektivní hodnocení výsledku operace [7, 22]. Jiní autoři oproti tomu však uvádějí, že zvětšení tibiálního kanálu může být časnou známkou selhání štěpu a jeho časná detekce může zabránit vzniku osteoartrózy [5]. V našem souboru byl tento jev pozorován u 158 pacientů, což představuje 77 % pacientů. Neprokázali jsme vliv rozšíření tibiálního kanálu na pozdější výsledek operace.
Podle mnohých autorů se zvětšující se vzdáleností od pomyslného bodu, kterým procházel nejvíce izometrický svazek vláken původního vazu (v našem případě zóna 2), stoupá hodnota reziduální laxity kloubu.
Z tohoto důvodu se domníváme, že by se operatér během operace měl zaměřit především na správnou vizualizaci stropu interkondylické fosy a v případě, že se jedná o méně zkušeného chirurga či v případě výskytu jakýchkoliv pochybností o zadní hraně interkondylické fosy lze peroperačně využít kontroly pozice Ki drátu pod C ramenem. Toto peroperační využití C ramene je rovněž velmi výhodné u provádění plastiky předního a zadního zkříženého vazu v jedné době. Dalším řešením je jistě i použití počítačové navigace k cílení obou kanálů, což je na našich některých pracovištích zdárně využíváno.
Závěrem bych se chtěl zmínit o faktoru, který není často v odborné literatuře diskutován, a tím je volba iniciálního napětí štěpu při zavádění tibiálního šroubu.
V našem souboru jsme úzkostlivě dbali na to, aby tibiální šroub byl zaváděn do kanálu přísně před bloček a v případě výskytu jakýchkoliv pochybnosti o pevnosti fixace, byl vyměněn na šroub většího průměru. Zavádění šroubů jsme prováděli v 20 st. flexi kloubu, v plném tahu za implantát za současného provádění zadní zásuvky asistentem.
Vlastní provedení napětí štěpu je plně individuální, záleží většinou pouze na zvyklostech operatéra a podle mého názoru je jedním z nejdůležitějších faktorů, ovlivňující pozdější výsledek operace. Vzhledem k této poměrně značné variabilitě v provádění tonizace štěpu se domnívám, že této otázce by měla být na stránkách našeho časopisu věnována ještě další pozornost.
MUDr. Jan Vanáč
K. Šípka 282
Pardubice
530 09
Zdroje
1. Amiel, D., Klweiner, J.B., Akeson, W.H. The natural history of the anterior cruciate ligament autograft of patellar tendon origin. Am J Sports Med. 1986, 14, 449–462.
2. Arnoczky, S.P., Warren, R.F., Ashlock, M. A Replacement of the anterior cruciate ligament using a patellar tendon allograft. An experimental study. J Bone Joint Surg. 1986, 68B, 376–385.
3. Höher, J., Miller, H.D., Fu F.H. Bone tunnel enlargement after anterior cruciate ligament reconstruction: fact or fiction? Knee Surg. Sports Traumatol Arthrosc. 1998, 6, 231–240.
4. Flandy, W.G., Narechania, R.G., Rosenberg R.D, et al. Anterior and posterior cruciate reconstruction in rhesus monkeys. J Bone Joint Surg. 1981, 63A, 1270–1284.
5. Daniel, D.M., Stone, M.L., Dobson, B. et al. Fate of the ACLinjured patient. A prospective outcome study. Am J Sports Med. 1994, 22, 632–644.
6. Dyer, C.R., Elrod, B.F. Tibial and femoral bone tunnel enlargement of the anterior cruciate ligament. Arthroscopy. 1995, 11, 353–354.
7. Fahey, M., Indelicato, P.A. Bone tunnel enlargement after anterior cruciate ligament replacement. Am J Sports Med. 1994, 22, 410–414.
8. Frank, C.B. Bone tunnel enlargement after anterior cruciate ligament replacement. Comment of Fahey et al. Am J Sports Med. 1994, 22, 410–414.
9. Friedman, R.J., black, J., Galante, J.O. et al. Current concepts in orthopaedic biomaterials and implant fixation. J Bone Joint Surg. 1993, 75, 1086–1096.
10. Harner, C.D. Editorial commentrevision ACL surgery. Clin Orthop. 1996, 1, 325.
11. Harrner, C.D., Irrang, J.J., Silverstein, S. et al. Loss of motion after cruciate ligament reconstruction. Am J. Sports Med. 1992, 20, 499–506.
12. Harner, C.D., Olson, E., Irrang, J.S. et al. Allograft versus autograft anterior cruciate ligament reconstruction. Clin Orthop. 1996, 324, 134–144.
13. Höher, J., Withrow, J.D., Livesay, G.A. et al. Early stress cause graft tunnel motion in hamstring grafts. Ortop Res Soc. 1998, 23, 44.
14. Howel, S.M., Gotlieb, J.E. Endoscopic fixation a doublelooped semitendinosus and gracilis anterior cruciate ligament graft using bone mulch screw. Oper Tech Orthop. 1996, 6, 152–160.
15. Ishibashi, Z., Rudy, T., Livesay, G.A. et al. The efect of anterior cruciate ligament graft fixation site at the tibia on knee stability. Evaluation using a robotic testing system. Arthroscopy. 1997, 13, 177–182.
16. Jackson, D.W., Windler, G.E., Simon T.M. Intraarticular reaction with the use of freeze dried, ethylene oxid sterilized bone patella tendonbone allografts in the reconstruction of the anterior cruciate ligament. Am J Sports Med. 2000, 18, 1–10.
17. Jackson,D., W., Grood, E.S., Arnoczky, S.P. Freeze dried anterior cruciate ligament allografts. Preliminary studies in a goat modell. Am J Sports Med. 1987, 15, 295–303.
18. Kartus, J., Magnusson, L., Stener, S. et al. Complications following arthroscopic anterior cruciate ligament reconstruction. Knee Surg. Sports Traumatol Arthrosc. 1999, 7, 2–8.
19. Juareguito, J.W., Paulos, L.E. Why grafts fail: Clin Orthop. 1996, 325, 25–41.
20. Jiranek, W.A., Machalo, M., Jasty, M., et al. Productions of cytokines around loosened cemented acetabular components. J Bone Joint Surg. 1993, 75A, 836–879.
21. Linn, R.M., Fischer, D.A., Smith, J.P., et al. Achilles tendon allograft reconstruction of the anterior cruciate ligamentdeficient knee. Am J Sports Med. 1993, 21, 825–831.
22. L´insalata, J.C., Klatt, B., Fu, F.H. et al. Tunnel expansion following ACL reconstruction: A comparision of hamstring and patellar tendon autografts. Knee Surg. Sports Traumatol Arthrosc. 1997, 5, 234–238.
23. Maloney, W.J., Jasty, M., Hartus, W.H. et al. Endosteal erosion in assotiation with stable uncemented femoral components. J Bone Joint Surg. 1990, 72A, 1025–1034.
24. Shapiro, M.M., Markolf, K.L, Burchfield, D.M. et al. Biomechanical consequences of replacement of the anterior cruciate ligament with a patellar ligament allograft. J Bone Joint Surg. 1996, 78A, 1728–1734.
25. Peyrache, M.D., Dijan, P., Chrástek, P. et al. Tibial tunnel enlargement after anterior cruciate ligament reconstruction by autogennous bonepatellar tendonbone graft. Knee Surg. Sports Traumatol Arthrosc. 1996, 2–8.
26. Tomita, F., Yasuda, K., Mikami, S. Comparision of intraosseos graft healing between the double flexor tendon graft and the bonepatellar tendonbone graft in anterior cruciate ligament reconstruction. Arthroscopy. 2001, 17, 461–476.
27. Weiler, A., Hoffmann, R.F., Bail, H.J. et al. Tendon healing in a bone tunnel. Arthroscopy. 2002, 18, 124–135.
Štítky
Chirurgie všeobecná Traumatologie Urgentní medicína
Článek vyšel v časopiseÚrazová chirurgie
Nejčtenější tento týden
2006 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- II. bilaterální sympozium s mezinárodní účastí
- ZÁPIS ze zasedání výboru České společnosti pro úrazovou chirurgii, které se konalo 11. října 2006 při příležitosti VIII.Ostravských traumatologických dnů v Rožnově pod Radhoštěm
- NESTABILNÉ ZLOMENINY PANVY A KRVÁCANIE – ÚVODNÉ OPATRENIA
- Kinematická navigace při rekonstrukci předního zkříženého vazu kolenního kloubu
- Úskalí operační techniky artroskopické rekonstrukce předního zkříženého vazu pomocí šlachy m. semitendinosus s fixací EndoButton position – šestileté zkušenosti
- Vliv mechanických faktorů na pozdější výsledek plastiky předního zkříženého vazu
- Úrazová chirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Úskalí operační techniky artroskopické rekonstrukce předního zkříženého vazu pomocí šlachy m. semitendinosus s fixací EndoButton position – šestileté zkušenosti
- NESTABILNÉ ZLOMENINY PANVY A KRVÁCANIE – ÚVODNÉ OPATRENIA
- Vliv mechanických faktorů na pozdější výsledek plastiky předního zkříženého vazu
- Kinematická navigace při rekonstrukci předního zkříženého vazu kolenního kloubu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



