-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Trombotické mikroangiopatie – dostupnost diagnostických metod a léčebných možností v ČR v roce 2021: výsledky syndikovaného průzkumu mezi klinickými hematology
Thrombotic microangiopathies – availability of diagnostic methods and treatment options in the Czech Republic in 2021: results of a syndicated survey among clinical haematologists
From September to October 2021, at the request of the Centre for Thrombotic Microangiopathies Ostrava (C4TMO) and the Czech Group for Thrombotic Microangiopathies (CS4TMA), an online survey prepared by IQVIA based on CS4TMA data was conducted among clinical haematologists to verify the awareness of clinical haematologists about the rules and availability of care for patients with thrombotic microangiopathies. The professional basis for the development of the questionnaire was the formulation of good clinical practice guidelines for the care of patients with thrombotic thrombocytopenic purpura. A total of 49 interviews were conducted. The results of the survey indicate very good clinical practice for the care of patients with acute thrombotic microangiopathy at the respondents‘ institutions. However, the spectrum of departments that participated in the survey does not correspond to the actual spectrum of haematology departments in the Czech Republic. In particular, data from small outpatient clinics within type II hospitals or outside hospitals are missing.
Keywords:
thrombotic microangiopathies – thrombotic thrombocytopenic purpura – haemolytic-uremic syndrome – HELLP syndrome – archiving of biological material – exchange plasmapheresis – ADAMTS13 – PLASMIC score – French score – complement
Autoři: J. Gumulec 1-3; M. Lánská 3,4; I. Hrachovinová 3,5; P. Salaj 3,5; Z. Kořístek 1,2; I. Demel 1,2; D. Buff 1,2; L. Broskevičová 1,2; M. Pulcer 2,6; P. Kovářová 2,7; J. Martínek 2,8; P. Žák 2,3
Působiště autorů: Klinika hematoonkologie LF OU a FN Ostrava 1; Centrum pro trombotické mikroangiopatie Ostrava 2; Česká skupina pro trombotické mikroangiopatie 3; IV. interní hematologická klinika FN Hradec Králové 4; Ústav hematologie a krevní transfuze Praha 5; Ústav laboratorní medicíny, LF OU a FN Ostrava 6; Krevní centrum FN Ostrava 7; Oddělení imunologie a alergologie, Zdravotní ústav se sídlem v Ostravě 8
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. Supplementum 3, p. 7-15.
doi: https://doi.org/10.48095/cctahd20233S7Souhrn
Během září a října roku 2021 proběhl na popud Centra pro trombotické mikroangiopatie Ostrava (C4TMO) a České skupiny pro trombotické mikroangiopatie (CS4TMA) formou on-line dotazování připraveného společností IQVIA podle podkladů CS4TMA mezi klinickými hematology průzkum s cílem ověřit povědomí klinických hematologů o pravidlech a dostupnosti péče o pacienty s trombotickými mikroangiopatiemi. Odborným základem pro vytvoření sady otázek byly formulace pravidel správné klinické praxe péče o pacienty s trombotickou trombocytopenickou purpurou. Celkem bylo provedeno 49 rozhovorů. Výsledky průzkumu svědčí o velmi dobré klinické praxi péče o pacienty s akutní trombotickou mikroangiopatií na pracovištích respondentů. Spektrum pracovišť, které se zúčastnily průzkumu však neodpovídají skutečnému spektru hematologických pracovišť v České republice. Chybí data především z malých ambulancí v rámci nemocnic II. typu nebo mimo nemocnice.
Klíčová slova:
trombotické mikroangiopatie – trombotická trombocytopenická purpura – hemolyticko-uremický syndrom – HELLP syndrom – archivace biologického materiálu – výměnná plazmaferéza – ADAMTS13 – PLASMIC skóre – French skóre – komplement
ÚVOD
Trombotické mikroangiopatie (TMA) jsou vzácná onemocnění s vysokým rizikem rozvoje závažného orgánového postižení a smrti v případě pozdní nebo neadekvátní léčby [1–4]. Mortalita neléčené trombotické trombocytopenické purpury (TTP) je 90 % a k polovině úmrtí dochází během prvních 24 h [5,6]. Zavedení terapeutické výměnné plazmaferézy (TPEX) v kombinaci s kortikosteroidy do terapie snížilo mortalitu na 10–20 % [7–9]. U atypického hemolyticko-uremického syndromu (aHUS) vede včasná TPEX k léčebné odpovědi u 30–70 % případů [10–13]. S výjimkou aHUS pacientů se známou abnormalitou membránového kofaktorového proteinu (MCP nebo CD46) je TPEX indikovaná do okamžiku, kdy je dostupný eculizumab [13,14]. Kromě těchto situací je TPEX indikovaná u všech pacientů s doposud nejasným typem TMA [15]. TMA je tedy třeba diagnostikovat a její typ definovat rychle.
Diagnostika akutní ataky TMA je jednoduchá s výsledkem dostupným během 3–6 h, pokud lékař na TMA myslí. Z anamnézy a klinického obrazu poutají pozornost rozvíjející se známky orgánového postižení, event. horečka, projevy anemie a/nebo krvácení. V laboratorním obraze je trombocytopenie, hemolytická anemie a známky orgánového poškození. Vysoká aktivita laktátdehydrogenázy (LDH), průkaz schistocytů v krevním nátěru a negativní přímý antiglobulinový test (PAT) jsou potvrzením neimunní intravaskulární hemolýzy [14,16–23]. Žádná další vyšetření není třeba pro diagnostický závěr akutní TMA provádět. Nutný je start léčby sérií TPEX a před zahájením této léčby doplnění odběrů krve k vyšetření mj. aktivity ADAMTS13, protilátek proti ADAMTS13 a k další diferenciální diagnostice TMA [16,22,24–33]. Není-li dostatečně rychle dostupný výsledek vyšetření aktivity ADAMTS13, je možné odhadnout pravděpodobnost získané/imunitní TTP (iTTP) podle PLASMIC nebo French skóre [34–37]. Pro komplementem mediovaný HUS (CM-HUS) neexistuje žádný spolehlivý, dostatečně rychlý a specifický test. Proto je nutné u pacientů s akutní atakou TMA vyloučit TTP, s infekcí asociovaný HUS (IA-HUS) a různé sekundární TMA [16]. Pokud po maximálně pěti provedených TPEX není dosaženo odpovědi nebo orgánové postižení progreduje, má být zahájena terapie inhibitory komplementu. Čím dříve je léčebné inhibice komplementu dosaženo, tím menší jsou finální následky postižení tkání a orgánů [38–40].
V České republice je péče o pacienty s TMA vedena podle zahraničních doporučení, žádné „národní“ doporučení diagnostiky a léčby TTP, HUS a sekundárních TMA v době publikace tohoto článku neexistuje. S dostupností stanovení ADAMTS13, cílené léčby iTTP (kaplacizumab), resp. CM-HUS (eculizumab, ravulizumab), poznatků o účinnosti TPEX u TMA asociovaných s graviditou a se související odbornou diskuzí se významně zlepšilo povědomí o TMA u odborné veřejnosti.
Během září a října roku 2021 proběhl na popud Centra pro trombotické mikroangiopatie Ostrava (C4TMO) a České skupiny pro trombotické mikroangiopatie (CS4TMA) formou on-line dotazování připraveného společností IQVIA podle podkladů CS4TMA mezi klinickými hematology průzkum s cílem ověřit povědomí lékařů o pravidlech a dostupnosti péče o pacienty s TMA. Odborným základem pro vytvoření sady otázek byly formulace pravidel správné klinické praxe péče o pacienty s TTP [41]. Vzorek byl vytvořen pomocí stratifikovaného náhodného výběru respondentů. Jako bázi pro konstrukci vzorku (výběrový soubor) byla použita OneKey™ databáze IQVIA™. Celkem bylo provedeno 49 rozhovorů. V článku uvádíme výsledky průzkumu a jejich interpretaci s respektem k dostupným poznatkům a zkušenostem s péčí o pacienty s akutní TMA.
Tab. 1. Průměrný počet pacientů s akutní atakou různých typů TMA v aktivní péči hematologa v průběhu jednoho běžného roku. 
Tab. 2. Dostupnost stanovení počtu schistocytů, aktivity LDH, výsledku PAT, koncentrace haptoglobinu, hemopexinu a vysoce senzitivního troponinu. 
Tab. 3. Dostupnost metody stanovení aktivity ADAMTS13, antigenu ADAMTS13, titru protilátek proti ADAMTS13 a inhibitoru ADAMTS13 na pracovištích respondentů. 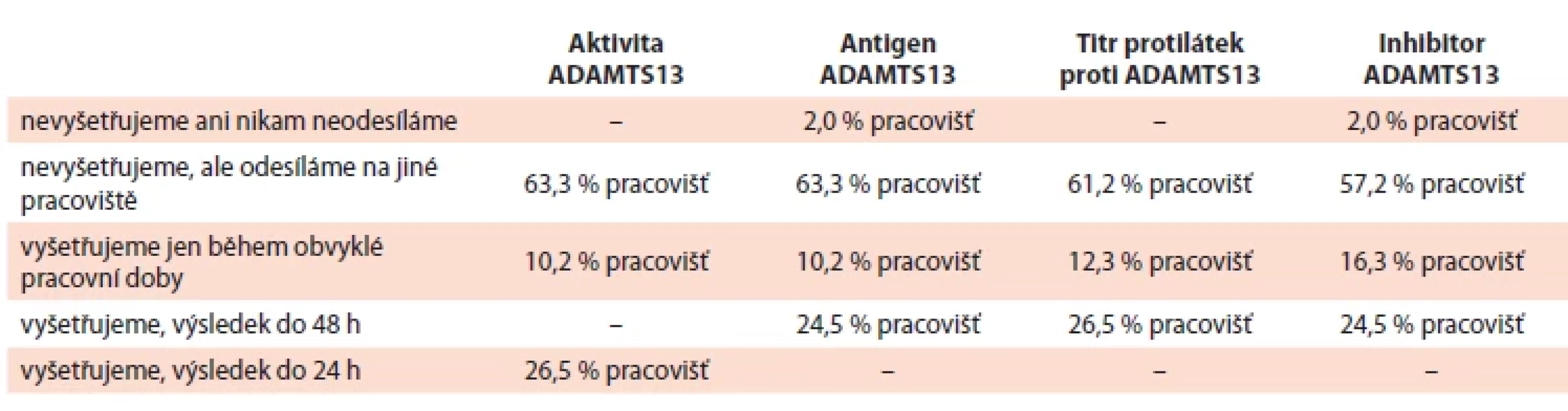
POČET A SPEKTRUM OSLOVENÝCH HEMATOLOGŮ
Celkem bylo s dotazníkem osloveno 612 hematologů a 49 (8 %) z nich vyplnilo dotazník. 42 % všech oslovených lékařů uvedlo, že pacienty s TMA neléčí. 23 % lékařů slíbilo, že dotazník vyplní, ale neučinili tak nebo vyplnění dotazníku odmítli nebo do dotazníku vstoupili, ale nevyplnili jej. 27 % kontaktovaných hematologů se nepodařilo zastihnout.
Ze 49 hematologů, kteří vyplnili dotazník, 41 % pracovalo v době průzkumu v Centru intenzivní hematologické péče, 29 % v Centru s rozšířenou hematologickou péčí, 24 % v hematologické ambulanci v rámci nemocnice II. typu a 6 % v samostatné ambulanci mimo nemocnici. 82 %, resp. 10 % respondentů byli atestovaní hematologové s klinickou praxí delší, resp. kratší než 10 let a 2 %, resp. 6 % byli absolventi lékařské fakulty pracující na hematologickém pracovišti po, resp. před absolvováním tzv. interního kmene.
SPEKTRUM A POČTY OŠETŘOVANÝCH PACIENTŮ
Oslovení hematologové aktivně v průběhu jednoho běžného roku pečují v mediánu o 1,8 pacienta akutní atakou TMA, o 1,9 pacienta iTTP, o 0,4 pacienta aHUS, resp. o 0,6 pacientek s HELLP syndromem (detaily viz tab. 1). V dispenzární péči hematologů v době průzkumu bylo průměrně 3,9 pacientů s anamnézou iTTP, 0,5 žen s anamnézou HELLP syndromu, 0,4 pacientů s anamnézou aHUS a 0,3 pacientů s jiným typem TMA. Nejvíce pacientů s TMA je do péče hematologa referováno z interních oddělení (40,8 %), následují gynekologicko-porodnická oddělení (16,9 %), jiná, blíže nespecifikovaná pracoviště (14,3 %), pracoviště urgentního příjmu (12,0 %), neurologická oddělení (10,7 %) a pracoviště praktických lékařů nebo terénních specialistů (5,3 %).
DOSTUPNOST DIAGNOSTICKÝCH METOD A VYUŽÍVÁNÍ SKÓROVACÍCH SYSTÉMŮ
Stanovení počtu schistocytů, aktivity LDH, výsledku přímého antiglobulinového testu (PAT) a koncentrace vysoce senzitivního troponinu je na naprosté většině pracovišť dostupné kdykoli do 4 až 6 hodin. Výsledek stanovení koncentrace haptoglobinu, resp. hemopexinu je do 4–6 h dostupný na 59,2 %, resp. 16,3 % pracovišť (detaily viz tab. 2).
Na otázku, je-li na pracovišti respondenta možné zhodnocení PLASMIC, resp. French skóre pro stanovení pravděpodobnosti diagnózy iTTP před dostupností výsledku vyšetření aktivity ADAMTS13 odpovědělo pozitivně 75,5 %, resp. 55,1 % hematologů. 24,5 %, resp. 44,9 % hematologů s PLASMIC, resp. French skóre nepracuje.
Dostupnost metody stanovení, resp. výsledku vyšetření aktivity ADAMTS13, antigenu ADAMTS13, titru protilátek proti ADAMTS13 a inhibitoru ADAMTS13 je popsána v tab. 3 a 4. Pro stanovení aktivity ADAMTS13 byla v době průzkumu na 88,9 % pracovišť používaná ELISA metoda, na 27,8 % rychlý screeningový test a na 22,2 % pracovišť chemiluminiscenční metody.
Průkaz infekce Shiga toxin produkujícími kmeny Escherichia coli je podle 61,2 % respondentů prováděna pomocí kultivačního vyšetření stolice a podle 28,6 % respondentů i PCR detekcí genů kódujících Shiga toxin ve stolici nebo v séru. Při podezření na infekci Streptococcus pneumoniae je podle 59,2 % respondentů využíván PCR průkaz pneumokoka v krvi nebo mozkomíšním moku.
Dostupnost metody stanovení, resp. výsledku vyšetření C3 a C4 složek komplementu, aktivity komplementu klasickou cestou (CH50), alternativní cestou (AH50), koncentrace solubilního terminálního komplexu (sC5b-9), faktoru H (CFH) a exprese CD46 na leukocytech (zpravidla granulocytech) je uvedena v tab. 5 a 6. Mutační analýza genů komplementu je dostupná podle 6,1 % respondentů.
ZPRACOVÁNÍ A ARCHIVACE BIOLOGICKÉHO MATERIÁLU
Zpracování vzorků krve nabraných před zahájením léčby k archivaci, tj. separace séra nebo plazmy, rozdělení vzorků do alikvotů, jejich evidence a zamrazení je kdykoli možné podle 59,2 % respondentů. Podle 14,3 % respondentů je na jejich pracovištích možné archivaci provádět jen během běžné pracovní doby a na stejně velkém podílu pracovišť je archivace možná, ale rutinně se neprovádí. Pro 12,2 % pracovišť není archivace vzorků dostupná. Na pracovištích, kde je archivace vzorků prováděna, jsou alikvoty séra nebo plazmy, resp. vzorky krve pro budoucí izolaci deoxyribonukleové kyseliny zamrazovány při –80 °C (72,1 % pracovišť), –40 °C (30,2 % pracovišť), resp. při –25 až –28 °C (32,6 % pracovišť).
Tab. 4. Dostupnost výsledku stanovení aktivity ADAMTS13, antigenu ADAMTS13, titru protilátek proti ADAMTS13 a inhibitoru ADAMTS13 na pracovištích respondentů. 
Tab. 5. Dostupnost metody stanovení C3 a C4 složek komplementu, CH50, AH50, sC5b-9, CFH a exprese CD46 na leukocytech na pracovištích respondentů. 
Tab. 6. Dostupnost výsledku stanovení C3 a C4 složek komplementu, CH50, AH50, sC5b-9, CFH a exprese CD46 na leukocytech na pracovištích respondentů. 
DOSTUPNÉ MOŽNOSTI TERAPIE
Celkem 51 % respondentů uvedlo, že na jejich pracovišti je možné provádět terapii akutní ataky TMA, pokud u nich byla diagnostikovaná. 49 % pracovišť referuje pacienty s TMA k léčbě do jiného zdravotnického zařízení.
TPEX je dostupná do 12–24 h pro 57,1 % respondentů. Pro 2 % respondentů pouze během běžné pracovní doby na (detaily viz tab. 7). 79,3 % hematologů, kteří se průzkumu zúčastnili má k dispozici centrifugační a 55,2 % filtrační plazmaferézu. U pacientů s akutní atakou TMA se na většině pracovišť provádí 1,0–1,5 plazmatického objem. Zhruba čtvrtina respondentů uvedla, že používají větší a jeden lékař uvedl, že používají menší plazmatický objem. V době prováděného průzkumu používalo jako náhradní roztok 89,7 % respondentů mraženou plazmu a 10,3 % směsnou, virově inaktivovanou plazmu (S/D plazma, Octaplas LG®). Pro 40,8 % respondentů není TPEX dostupná a pacienti musí být referováni do jiných zdravotnických zařízení. Akutní hemodialýza je dostupná na naprosté většině zkoumaných pracovišť.
V době průzkumu mělo zkušenosti s léčbou rituximabem, eculizumabem, kaplacizumabem, resp. ravulizumabem 91,8 %, 44,9 %, 26,5, resp. 12,2 % respondentů. Vlastní zkušenost s vedením klinických studií u pacientů s TMA mělo 10,2 % respondentů.
Tab. 7. Doba do startu první TPEX u pacienta s první atakou TMA. 
ZAVEDENÉ A VYHODNOCOVANÉ DIAGNOSTICKO-TERAPEUTICKÉ ALGORITMY
Celkem 57,1 %, resp. 55,1 % respondentů uvedlo, že na pracovišti mají zavedený a pravidelně vyhodnocovaný diagnostický, resp. terapeutický algoritmus.
DISKUZE
S dostupností diagnostických a terapeutických možností a se související odbornou diskuzí se v odborné veřejnosti v České republice významně zlepšilo povědomí o TMA. Před nastavením dalšího směrování edukačních a organizačních aktivit a před plánovanou přípravou doporučených postupů péče o TMA pacienty iniciovala C4TMO a CS4TMA průzkum mezi klinickými hematology. Celkem bylo osloveno 612 hematologů. Většina ze 49 (8 %) hematologů, kteří vyplnili dotazník pracovalo v době průzkumu v hematologických centrech a mělo více než desetiletou praxi v oboru. Jen asi třetina respondentů pracovala v hematologické ambulanci v nemocnici II. typu nebo mimo nemocnici. Získané informace tedy pocházejí především od zkušených hematologů z center s velmi dobrým diagnostickým a terapeutickým zázemím. Velká část oslovených lékařů (42 %) uvedlo, že pacienty s TMA neléčí a dalšího průzkumu se neúčastnilo. Průzkum tedy poskytl jen velmi málo informací ze sítě malých hematologických pracovišť, kde by měla být zachycena většina pacientů s akutní TMA. Tomuto typu pracovišť bude do budoucna nutné věnovat podporu.
Oslovení hematologové pečují nejčastěji o pacienty s iTTP a podílejí se na péči o ženy s HELLP syndromem. Pacientů s aHUS mají v péči méně. Jedním z důvodů může být skutečnost, že tito nemocní bývají k aktivní léčbě předáváni do specializovaných nefrologických center. Nejvíce pacientů s TMA je do péče hematologa referováno z interních oddělení, ženy s preeklampsií nebo HELLP syndromem přicházejí zpravidla z gynekologicko-porodnických oddělení.
Laboratorní potvrzení podezření na mikroangiopatickou hemolytickou anemii je s ohledem na dostupnost vyšetření počtu schistocytů, aktivity LDH a výsledku PAT na více než 90 % pracovišť možné do 4–6 h, pokud lékař na TMA myslí.
PLASMIC, resp. French skóre pro rychlý kvalifikovaný odhad pravděpodobnosti diagnózy iTTP využívá 75,5 %, resp. 55,1 % respondentů. V této souvislosti z průzkumu nevyplývají tři zásadní informace: 1) zdali tyto skórovací systémy využívají hematologové, kteří se z různých důvodů průzkumu nezúčastnili, 2) zdali je vysoké skóre akceptovaným argumentem pro rychlé předání nemocného na pracoviště s dostupnou TPEX, resp. léčbou kaplacizumabem a 3) zdali je u pacientů s vysokým skóre na pracovištích s dobrou dostupností stanovení aktivity ADAMTS13 zvažováno podání kaplacizumabu v době, kdy ještě není výsledek stanovení dostupný. Lze předpokládat, že rutinní využívání těchto skórovacích systémů v rámci hematologických konsilií u pacientů s novou trombocytopenií a (hemolytickou) anémií by mohlo zvýšit záchyt pacientů s TMA, resp. iTTP. Vysoká pravděpodobnost TTP u konkrétního pacienta s obrazem TMA je indikací léčby kombinací TPEX s kortikosteroidy [34–37]. Není-li to možné na pracovišti, kde byla akutní ataka TMA diagnostikována, má být pacient bezodkladně předán na pracoviště s dostupností této terapie. Lze-li očekávat výsledek aktivity ADAMTS13 do 72 h a jde-li o pacienta s vysokou pravděpodobností TTP, má být zváženo zahájení léčby kaplacizumabem ještě před dostupností výsledku laboratorního vyšetření. Je-li výsledek aktivity ADAMTS13 pod 10 %, má být v léčbě pokračováno, při hodnotě nad 20 % má být léčba kaplacizumabem zastavena a hraniční hodnota v rozmezí 10–20 % je důvodem pro individuální postup [37].
Dostupnost vyšetření aktivity ADAMTS13 i titru anti-ADAMTS13 se v České republice v posledních letech významně zlepšila. Na 71 % oslovených pracovišť je výsledek obou testů dostupný do 72 h a na téměř 20 % pracovišť během prvních 24 h od průkazu TMA. To je velmi dobrý standard umožňující rychlou diferenciální diagnostiku a cílenou léčbu TMA [37,41,42]. Pro stanovení aktivity ADAMTS13 byla v době průzkumu na většině pracovišť (88,9 %) používaná ELISA metoda (nejčastěji TECHNOZYM® ADAMTS-13 activity ELISA – výrobce Technoclone Rakousko), na 27,8 % pracovišť rychlý semikvantitativní screeningový test (TECHNOSCREEN® ADAMTS-13 activity (výrobce Technoclone Rakousko) a na 22,2 % pracovišť rychlý chemiluminiscenční test (HemosIL AcuStar ADAMTS13 Activity, výrobce Instrumentation Laboratory, Werfen Company, Bedford, USA).
Pro rozlišení IA-HUS od CM-HUS a od ostatních TMA je třeba vyloučit infekci Shiga toxin produkujícími kmeny E. coli, Shigella nebo Campylobacter. Přítomnost nebo absence gastrointestinálních projevů pro diferenciální diagnostiku nestačí. Pro potvrzení infekce E. coli a Shigella je nejvhodnější průkaz genů kódujících Shiga toxin pomocí polymerázové řetězové reakce (PCR). Druhou možností je klasická kultivace stolice z výtěru rekta s respektem k přísným pravidlům preanalytické fáze vyšetření [14,19,43–46]. Průkaz STEC je podle 61,2 % respondentů prováděn pomocí kultivačního vyšetření stolice a podle 28,6 % respondentů PCR detekcí genů kódujících shigatoxin ve stolici nebo v séru. U pacientů s podezřením na HUS navozený infekcí Streptococcus pneumoniae je třeba průkaz antigenu v moči nebo PCR průkaz pneumokoka v krvi a/nebo mozkomíšním moku. Podle 59,2 % respondentů je využíván PCR průkaz pneumokoka v krvi nebo mozkomíšním moku.
aHUS vzniká na základě genetické, autoimunitní nebo idiopatické dysregulace alternativní cesty komplementu [47]. Identifikace specifických genetických mutací není pro diagnózu aHUS nutná, je ale silným prognostickým faktorem [4,48]. Genetické varianty v regulačních proteinů komplementu se vyskytují u 50–60 % pacientů s aHUS a asi 30–50 % pacientů identifikovatelnou mutaci nemá [10]. Diagnózu genetického aHUS lze určit na základě patogenní varianty nebo variant v jednom nebo více souvisejících genech, vč.: C3, CD46 (MCP), CFB, CFH, CFI, DGKE, CD141 (THBD) a změn počtu kopií v CFHR1-5 [10,49,50]. Výsledek bývá zpravidla dostupný v řádu týdnů.
Diagnóza aHUS se v praxi nevyšetřuje ani nepotvrzuje pomocí krevních testů, protože jsou nedostatečně citlivé a specifické [51]. Rychlá identifikace HUS pomocí spolehlivých biomarkerů by teoreticky mohla přispět ke snížení morbidity a mortality spojenou s tímto onemocněním. Potenciální testy pro hodnocení stavu aktivace/dysregulace komplementu užitečné v klinické diagnostice aHUS zahrnují markery terminální cesty komplementu (depozice C5b-9 na endoteliálních buňkách v kultuře a kvantifikace solubilních hladin C5b-9), hemolytický test na ovčích červených krvinkách, test alternativní cesty komplementu (AP50) a modifikovaný Hamův test [52,53]. aHUS je možné u pacientů s podezřením na toto onemocnění identifikovat podle nízkých hladin C3, CH50 (aktivita klasické cesty komplementu), AH50 (aktivita alternativní cesty komplementu) a CFB se současně zvýšenými hladinami C5a, C5b-9 a Bb. Tyto biomarkery by mohly být užitečné v době, kdy výsledek genetického testování není nedostupný [54]. Z průzkumu vyplynulo, že mutační analýza genů komplementu je dostupná pro 6,1 % respondentů, a že uspokojivě dostupné jsou výsledku vyšetření C3 a C4, CH50, AH50, sC5b-9, CFH a exprese CD46 na leukocytech (zpravidla granulocytech).
Odběry krve pro stanovení aktivity ADAMTS13, anti-ADAMTS13 a testů nutných k další diferenciální nebo doplňující diagnostice (k vyloučení antifosfolipidového syndromu, systémového onemocnění pojiva, biomarkery aktivace/dysregulace komplementu et cetera) je třeba provést před zahájením TPEX nebo podáním plazmy [37,41,42]. Z výsledků průzkumu vyplývá, že zpracování vzorků krve nabraných před zahájením léčby k archivaci (tzn. separace séra nebo plazmy, rozdělení vzorků do alikvotů, jejich evidence a zamrazení) je kdykoli během dne možné podle 59,2 % respondentů. Na 72,1 % pracovišť respondentů mohou být vzorky zamrazovány při –80 °C, resp. na 30,2 % pracovišť při –40 °C. Lze předpokládat, že jde o pracoviště, kde je současně dostupná i plnohodnotná terapie TMA. Na téměř třetině dotazovaných pracovišť je možné archivaci provádět jen během běžné pracovní doby nebo je sice možné ji provádět, ale rutinně se neprovádí. Jaká je praxe na pracovištích, která se průzkumu nezúčastnila není jasné. Pro klinickou praxi je to další důvod pro bezodkladné předání pacientů s nově diagnostikovanou TMA do center poskytujících komplexní péči.
Pacienti s akutní atakou TMA mají být ošetřováni v zařízeních s možností intenzivní péče (JIP), vč. nepřetržitého monitorování neurologického stavu, srdečního stavu a saturace kyslíkem. U těchto nemocných může dojít k rychlému zhoršení stavu a k rozvoji závažné orgánové dysfunkce (kóma, ischemická cévní mozková příhoda, křeče, infarkt myokardu, městnavé srdeční selhání, arytmie, mezenterická ischemie, pankreatitida, akutní poškození ledvin). Všechny tyto komplikace vyžadují včasné odhalení, monitorování a rychlé terapeutické zásahy. Kromě toho TPEX může být spojena se vzácnými nežádoucími účinky, jako jsou anafylaktické reakce, které je nejlépe možné zvládnout se zázemím JIP [55,56]. Z průzkumu vyplývá, že terapii akutní ataky TMA je možné provádět na pracovištích, která potřebným zázemím disponují. 49 % respondentů průzkumu referuje pacienty s akutní atakou TMA k léčbě do jiného zdravotnického zařízení. V reálné klinické praxi je těchto typů pracovišť podstatně více.
Včas zahájená TPEX je zásadní pro prognózu pacientů s akutní atakou iTTP [7–9], nezbytná u pacientů s aHUS není-li dostupný eculizumab [13,14] a u pacientů s doposud nejasným typem akutní TMA [15]. Podle průzkumu je možné do 12–24 h od průkazu TMA zahájit TPEX na 57,1 % pracovišť. Na 2 % pracovišť je to možné pouze během běžné pracovní doby.
Centrifugační aferéza je principiálně možná s použitím nižšího průtoku krve, nicméně v klinické praxi jsou preferovány vysoko průtokové kanyly. Membránová filtrace apriori vyžaduje vyšší průtoky krve, a proto i katétry s větším průměrem [57–61]. Tyto skutečnosti je u TMA pacientů s těžkou trombocytopenií provázenou krvácivými projevy třeba zvažovat, protože profylaktické transfuzi destičkových přípravků je doporučeno se u akutních TMA vyhýbat [41,42]. Podle průzkumu má 79,3 % pracovišť k dispozici centrifugační a 55,2 % filtrační plazmaferézu.
U pacientů s akutní atakou TMA je doporučováno provádět TPEX denně s výměnnou 1,0–1,5 plazmatického objemu (tj. 40–60 ml/kg) [15,41]. S tímto doporučením korespondují i výsledky průzkumu. Na 72,4 % pracovišť se zpravidla mění 1,0–1,5 plazmatického objemu a na 24,1 % pracovišť větší a pouze na 3,4 % pracovišť menší plazmatický objem. V době prováděného průzkumu používalo jako náhradní roztok 89,7 % pracovišť mrazenou plazmu a 10,3 % S/D plazmu, tj. přípravek, který je ve srovnání s mrazenou plazmou spojen se sníženým rizikem alergické potransfuzní reakce a přenosu virových infekcí [62]. V současnosti se S/D plazma používá na hematologických pracovištích jako náhradní roztok při TPEX častěji.
Na pracovištích 40,8 % respondentů není TPEX dostupná a pacienti musí být referováni do jiných zdravotnických zařízení. Přesto se naprostá většina pacientů s novou TMA dostane k TPEX během prvních 24 h (viz tab. 7). To je další skutečnost svědčící o velmi dobré klinické praxi v České republice.
Protože u aHUS má TPEX omezenou účinnost [10–13], je v léčbě preferováno co možná nejčasnější podání eculizumabu [13,14]. V době průzkumu mělo zkušenosti s léčbou eculizumabem 44,9 % respondentů. To je poměrně vysoké číslo. Bohužel z průzkumu nevyplývá, jak časně byla léčba zahajována. Zkušenosti s léčbou kaplacizumabem mělo v době průzkumu 26,5 % respondentů. Lze předpokládat, že v současnosti jsou zkušenosti bohatější, byť nejspíše omezené na srovnatelný počet velkých hematologických center.
Zajímavé je, že přes aktuální neexistenci „národního“ doporučení péče o pacienty s TMA, TTP nebo HUS 57,1 %, resp. 55,1 % respondentů uvedlo, že na pracovišti mají zavedený a pravidelně vyhodnocovaný vnitřní diagnostický, resp. terapeutický algoritmus.
ZÁVĚRY
Výsledky průzkumu svědčí o velmi dobré klinické praxi péče o pacienty s akutní TMA na pracovištích respondentů. Spektrum pracovišť, které se zúčastnily průzkumu však neodpovídá skutečnému spektru hematologických pracovišť v České republice. Chybí data především z malých ambulancí v rámci nemocnic II. typu nebo mimo nemocnice. Těmto typům pracoviště je potřeba do budoucna věnovat pozornost a podporu.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
J.G., M.L., I.H. – příprava designu studie
J.G., M.L., I.H., P.S., Z.K., I.D., D.B., L.B., M.P., P.K., J.M., P.Ž. – interpretace výsledků průzkumu
J.G. – příprava první verze rukopisu
PODĚKOVÁNÍ
Podpořeno MZ ČR – RVO-FNOs/2017
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 21. 8. 2023.
Přijato po recenzi dne: 24. 10. 2023.MUDr. Jaromír Gumulec
Klinika hematoonkologie
Fakultní nemocnice Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
e-mail: jaromir.gumulec@fno.cz
Zdroje
1.0Tsai HM, Lian EC. Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. N Engl J Med. 1998; 339 (22): 1585–1594. doi: 10.1056/NEJM199811263392203.
2.0Furlan M, Robles R, Solenthaler M, Wassmer M, Sandoz P, Lammle B. Deficient activity of von Willebrand factor-cleaving protease in chronic relapsing thrombotic thrombocytopenic purpura. Blood. 1997; 89 (9): 3097–3103.
3.0George JN, Nester CM. Syndromes of thrombotic microangiopathy. N Engl J Med. 2014; 371 (19): 1847–1848. doi: 10.1056/NEJMc14 10951.
4.0Moake JL. Thrombotic microangiopathies. N Engl J Med. 2002; 347 (8): 589–600. doi: 10.1056/NEJMra020528.
5.0Amorosi EL, Ultmann JE. Thrombotic thrombocytopenic purpura: report of 16 cases and review of the literature. Medicine. 1966; 45 : 139–159.
6.0Scully M, Yarranton H, Liesner R, et al. Regional UK TTP registry: correlation with laboratory ADAMTS 13 analysis and clinical features. Br J Haematol. 2008; 142 (5): 819–826. doi: 10.1111/j.1365-2141.2008.07276.x.
7.0Rock GA, Shumak KH, Buskard NA, et al. Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group. N Engl J Med. 1991; 325 (6): 393–397. doi: 10.1056/NEJM199108083250604.
8.0Sarode R, Bandarenko N, Brecher ME, et al. Thrombotic thrombocytopenic purpura: 2012 American Society for Apheresis (ASFA) consensus conference on classification, diagnosis, management, and future research. J Clin Apher. 2014; 29 (3): 148–167. doi: 10.1002/jca.21 302.
9.0Rock G, Shumak K, Kelton J, et al. Thrombotic thrombocytopenic purpura: outcome in 24 patients with renal impairment treated with plasma exchange. Canadian Apheresis Study Group. Transfusion. 1992; 32 (8): 710–714.
10.0Noris M, Caprioli J, Bresin E, et al. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. Clin J Am Soc Nephrol: CJASN. 2010; 5 (10): 1844–1859. doi: 10.2215/CJN.02210310.
11.0Sellier-Leclerc AL, Fremeaux-Bacchi V, Dragon-Durey MA, et al. Differential impact of complement mutations on clinical characteristics in atypical hemolytic uremic syndrome. J Am Soc Nephrol: JASN. 2007; 18 (8): 2392–2400. doi: 10.1681/asn.2006080811.
12.0Loirat C, Garnier A, Sellier-Leclerc AL, Kwon T. Plasmatherapy in atypical hemolytic uremic syndrome. Semin Thromb Hemost. 2010; 36 (6): 673–681. doi: 10.1055/s-0030-1262890.
13.0Clark WF, Huang SS, Walsh MW, Farah M, Hildebrand AM, Sontrop JM. Plasmapheresis for the treatment of kidney diseases. Kidney Int. 2016; 90 (5): 974–984. doi: 10.1016/ j.kint.2016.06.009.
14.0Loirat C, Fakhouri F, Ariceta G, et al. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol (Berlin, Germany). 2016; 31 (1): 15–39. doi: 10.1007/s004 67-015-3076-8.
15.0Winters JL. Plasma exchange in thrombotic microangiopathies (TMAs) other than thrombotic thrombocytopenic purpura (TTP). Hematology Am Soc Hematol Educ Prog. 2017; 2017 (1): 632–638. doi: 10.1182/asheducation-2017. 1.632.
16.0Campistol JM, Arias M, Ariceta G, et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrologia. 2015; 35 (5): 421–447. doi: 10.1016/j.nefro.2015.07.005.
17.0Scully M, Cataland S, Coppo P, et al. Consensus on the standardization of terminology in thrombotic thrombocytopenic purpura and related thrombotic microangiopathies. J Thromb Haemost. 2017; 15 (2): 312–322. doi: 10.1111/jth.13571.
18.0Scully M. Thrombocytopenia in hospitalized patients: approach to the patient with thrombotic microangiopathy. Hematology Am Soc Hematol Educ Prog. 2017; 2017 (1): 651–659. doi: 10.1182/asheducation-2017.1.651.
19.0Laurence J, Haller H, Mannucci PM, Nangaku M, Praga M, Rodriguez de Cordoba S. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. Clin Adv Hematol Oncol. 2016; 14 (Suppl 11): 2–15.
20.0Zini G, d‘Onofrio G, Briggs C, et al. ICSH recommendations for identification, diagnostic value, and quantitation of schistocytes. Int J Labor Hematol. 2012; 34 (2): 107–116. doi: 10.1111/j.1751-553X.2011.01380.x.
21.0Shen YM. Clinical evaluation of thrombotic microangiopathy: identification of patients with suspected atypical hemolytic uremic syndrome. Thromb J. 2016; 14 (Suppl 1): 19. doi: 10.1186/s12959-016-0114-0.
22.0Afshar-Kharghan V. Atypical hemolytic uremic syndrome. Hematology Am Soc Hematol Educ Prog. 2016; 2016 (1): 217–225. doi: 10.1182/asheducation-2016.1.21.7
23.0Williams LA, Marques MB, Education Committee of the Academy of Clinical Laboratory, Scientists. Pathology consultation on the diagnosis and treatment of thrombotic microangiopathies (TMAs). Am J Clin Pathol. 2016; 145 (2): 158–165. doi: 10.1093/ajcp/aqv086.
24.0Loirat C, Saland J, Bitzan M. Management of hemolytic uremic syndrome. Presse Medicale (Paris, France: 1983). 2012; 41 (3 Pt 2): e115–e135. doi: 10.1016/j.lpm.2011.11.013.
25.0Angioi A, Fervenza FC, Sethi S, et al. Diagnosis of complement alternative pathway disorders. Kidney Int. 2016; 89 (2): 278–288. doi: 10.1016/j.kint.2015.12.003.
26.0Gavriilaki E, Yuan X, Ye Z, et al. Modified Ham test for atypical hemolytic uremic syndrome. Blood. 2015; 125 (23): 3637–3646. doi: 10.1182/blood-2015-02-629683.
27.0Nester CM, Barbour T, de Cordoba SR, et al. Atypical aHUS: State of the art. Mol Immunol. 2015; 67 (1): 31–42. doi: 10.1016/ j.molimm.2015.03.246.
28.0Hughes C, McEwan JR, Longair I, et al. Cardiac involvement in acute thrombotic thrombocytopenic purpura: association with troponin T and IgG antibodies to ADAMTS 13. J Thromb Haemost. 2009; 7 (4): 529–536. doi: 10.1111/j.1538-7836.2009.03285.x.
29.0Scully M, Hunt BJ, Benjamin S, et al. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. Br J Haematol. 2012; 158 (3): 323–335. doi: 10.1111/j.1365-2141.2012.09167.x.
30.0Noris M, Galbusera M, Gastoldi S, et al. Dynamics of complement activation in aHUS and how to monitor eculizumab therapy. Blood. 2014; 124 (11): 1715–1726. doi: 10.1182/blood - 2014-02-558296.
31.0Benhamou Y, Boelle PY, Baudin B, et al. Cardiac troponin-I on diagnosis predicts early death and refractoriness in acquired thrombotic thrombocytopenic purpura. Experience of the French Thrombotic Microangiopathies Reference Center. J Thromb Haemost. 2015; 13 (2): 293–302. doi: 10.1111/jth.12790.
32.0Noris M, Mescia F, Remuzzi G. STEC-HUS, atypical HUS and TTP are all diseases of complement activation. Nature reviews. Nephrology. 2012; 8 (11): 622–633. doi: 10.1038/nrneph. 2012.195
33.0Kolev M, Kemper C. Detection of cell membrane-bound CD46 using flow cytometry. Methods Mol Biol. 2014; 1100 : 329–339. doi: 10.1007/978-1-62703-724-2_27.
34.0Bendapudi PK, Hurwitz S, Fry A, et al. Derivation and external validation of the PLASMIC score for rapid assessment of adults with thrombotic microangiopathies: a cohort study. Lancet Haematol. 2017; 4 (4): e157-e164. doi: 10.1016/S2352-3026 (17) 30026-1.
35.0Upadhyay VA, Geisler BP, Sun L, et al. Utilizing a PLASMIC score-based approach in the management of suspected immune thrombotic thrombocytopenic purpura: a cost minimization analysis within the Harvard TMA Research Collaborative. Br J Haematol. 2019; 186 (3): 490–498. doi: 10.1111/bjh.15932.
36.0Coppo P, Schwarzinger M, Buffet M, et al. Predictive features of severe acquired ADAMTS13 deficiency in idiopathic thrombotic microangiopathies: the French TMA Reference Center experience. PLoS One. 2010; 5 (4): e10208. doi: 10.1371/journal.pone.0010208.
37.0Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for the diagnosis of thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020; 18 (10): 2486–2495. doi: 10.1111/jth.15006.
38.0Legendre CM, Licht C, Muus P, et al. Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med. 2013; 368 (23): 2169–2181. doi: 10.1056/ NEJMoa1208981
39.0Fakhouri F, Zuber J, Fremeaux-Bacchi V, Loirat C. Haemolytic uraemic syndrome. Lancet. 2017; 390 (10095): 681–696. doi: 10.1016/S0 140-6736 (17) 30062-4.
40.0Wijnsma KL, Duineveld C, Wetzels JFM, van de Kar N. Eculizumab in atypical hemolytic uremic syndrome: strategies toward restrictive use. Pediatr Nephrol (Berlin, Germany). 2019; 34 (11): 2261–2277. doi: 10.1007/s00467-018-4091-3.
41.0Zheng XL, Vesely SK, Cataland SR, et al. Good practice statements (GPS) for the clinical care of patients with thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020; 18 (10): 2503–2512. doi: 10.1111/jth.15009
42.0Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for treatment of thrombotic thrombocytopenic purpura. J Thromb Haemost. 2020; 18 (10): 2496–2502. doi: 10.1111/jth.15010.
43.0Salvadori M, Bertoni E. Update on hemolytic uremic syndrome: diagnostic and therapeutic recommendations. World J Nephrol. 2013; 2 (3): 56–76. doi: 10.5527/wjn.v2.i3.56.
44.0Jokiranta TS. HUS and atypical HUS. Blood. 2017; 129 (21): 2847–2856. doi: 10.1182/blood - 2016-11-709865.
45.0Karch H, Tarr PI, Bielaszewska M. Enterohaemorrhagic Escherichia coli in human medicine. Int J Med Microbiol. 2005; 295 (6–7): 405–418. doi: 10.1016/j.ijmm.2005.06.009.
46.0Tarr PI, Gordon CA, Chandler WL. Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet. 2005; 365 (9464): 1073–1086. doi: 10.1016/S0140-6736 (05) 711 44-2.
47.0Yoshida Y, Kato H, Ikeda Y, Nangaku M. Pathogenesis of atypical hemolytic uremic syndrome. J Ather Thromb. 2019; 26 (2): 99–110. doi: 10.5551/jat.RV17026.
48.0Oh J, Oh D, Lee SJ, et al. Prognostic utility of ADAMTS13 activity for the atypical hemolytic uremic syndrome (aHUS) and comparison of complement serology between aHUS and thrombotic thrombocytopenic purpura. Blood Res. 2019; 54 (3): 218–228. doi: 10.5045/br.2019.54.3.218.
49.0Puraswani M, Khandelwal P, Saini H, et al. Clinical and immunological profile of anti-factor H antibody associated atypical hemolytic uremic syndrome: a nationwide database. Front Immunol. 2019; 10 : 1282. doi: 10.3389/fimmu. 2019.01282.
50.0Richards A, Kathryn Liszewski M, Kavanagh D, et al. Implications of the initial mutations in membrane cofactor protein (MCP; CD46) leading to atypical hemolytic uremic syndrome. Mol Immunol. 2007; 44 (1–3): 111–122. doi: 10.1016/j.molimm.2006.07.004.
51.0Cofiell R, Kukreja A, Bedard K, et al. Eculizumab reduces complement activation, inflammation, endothelial damage, thrombosis, and renal injury markers in aHUS. Blood. 2015; 125 (21): 3253–3262. doi: 10.1182/blood - 2014-09-600411.
52.0Cataland SR, Holers VM, Geyer S, Yang S, Wu HM. Biomarkers of terminal complement activation confirm the diagnosis of aHUS and differentiate aHUS from TTP. Blood. 2014; 123 (24): 3733–3738. doi: 10.1182/blood-2013-12-547067.
53.0Nguyen MH, Mathew JJ, Denunzio TM, Carmichael MG. Diagnosis of atypical hemolytic uremic syndrome and response to eculizumab therapy. Hawaii J Med Public Health. 2014; 73 (9 Suppl 1): 22–24.
54.0Raina R, Sethi SK, Dragon-Durey MA, et al. Systematic review of atypical hemolytic uremic syndrome biomarkers. Pediatr Nephrol (Berlin, Germany). 2022; 37 (7): 1479–1493. doi: 10.1007/s00467-022-05451-2.
55.0Mörtzell M, Berlin G, Nilsson T, et al. Analyses of data of patients with thrombotic microangiopathy in the WAA registry. Transf Apher Sci. 2011; 45 (2): 125–131. doi: 10.1016/ j.transci.2011.07.001.
56.0Shatzel JJ, Taylor JA. Syndromes of thrombotic microangiopathy. Med Clin North Am. 2017; 101 (2): 395–415. doi: 10.1016/j.mcna. 2016.09.010.
57.0Spindler JS. Subclavian vein catheterization for apheresis access. J Clin Apher. 1983; 1 (4): 202–205. doi: 10.1002/jca.2920010403.
58.0Haller W, Milford DV, Goodship TH, Sharif K, Mirza DF, McKiernan PJ. Successful isolated liver transplantation in a child with atypical hemolytic uremic syndrome and a mutation in complement factor H. Am J Transplant. 2010; 10 (9): 2142–2147. doi: 10.1111/j.1600-6143.2010.03228.x.
59.0Kalantari K. The choice of vascular access for therapeutic apheresis. J Clin Apher. 2012; 27 (3): 153–159. doi: 10.1002/jca.21225.
60.0Golestaneh L, Mokrzycki MH. Vascular access in therapeutic apheresis: update 2013. J Clin Apher. 2013; 28 (1): 64–72. doi: 10.1002/jca. 21267.
61.0Tanhehco YC, Zantek ND, Alsammak M, et al. Vascular access practices for therapeutic apheresis: results of a survey. J Clin Apher. 2019; 34 (5): 571–578. doi: 10.1002/jca.21 726.
62.0McGonigle AM, Patel EU, Waters KM, et al. Solvent detergent treated pooled plasma and reduction of allergic transfusion reactions. Transfusion. 2020; 60 (1): 54–61. doi: 10.1111/trf. 15600.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo Supplementum 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Archivace biologického materiálu nabraného u pacientů s akutní atakou trombotické mikroangiopatie
- Hodnocení krevního obrazu a přítomnost schistocytů v nátěru krve
- Komplementový systém – poruchy a diagnostika
- Editorial
- Vrozená trombotická trombocytopenická purpura
- Věnování
- Trombotické mikroangiopatie – dostupnost diagnostických metod a léčebných možností v ČR v roce 2021: výsledky syndikovaného průzkumu mezi klinickými hematology
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení krevního obrazu a přítomnost schistocytů v nátěru krve
- Komplementový systém – poruchy a diagnostika
- Vrozená trombotická trombocytopenická purpura
- Trombotické mikroangiopatie – dostupnost diagnostických metod a léčebných možností v ČR v roce 2021: výsledky syndikovaného průzkumu mezi klinickými hematology
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



