-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní léčba akutní myeloidní leukemie
Modern therapy of acute myeloid leukaemia
Acute myeloid leukaemia is a clonal malignant disease affecting mainly elderly patients. This previously nearly always fatal disease is now curable in 35–40 % of younger patients. The basis of curative therapy has for several decades been induction chemotherapy using the protocol “7 + 3”, followed by consolidation therapy. A large proportion of patients treated with chemotherapy alone undergo relapse soon after treatment and die from disease progression. Allogeneic stem cell transplantation remains the most effective consolidation strategy for patients with intermediate and unfavourable prognosis based on cytogenetics. Cytogenetic and molecular-biology analyses show high heterogeneity of the disease. Acute myeloid leukaemia often arises from recurrent genetic changes that represent potential therapeutic targets for new drugs. Modern treatment modalities should involve molecularly targeted therapy, capable of stopping proliferation, in combination with chemotherapy and eradication of malignantly modified hematopoietic cells in the bone marrow without the need for allogeneic stem cell transplantation, analogously to the treatment of acute promyelocytic leukaemia. As the population ages, the number of patients with acute myeloid leukaemia is constantly growing and the need for new drugs is becoming urgent. A better understanding of disease biology and the development of new classes of drugs are essential prerequisites for improving patient prognosis. The article presents a review of current therapeutic strategies and new treatment modalities in the field of acute myeloid leukaemia therapy.
KEY WORDS:
acute myeloid leukaemia – induction chemotherapy – consolidation – transplantation – hypomethylating agents – FLT3 inhibitors
Autoři: M. Čerňan; T. Szotkowski
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 1, p. 16-28.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Akutní myeloidní leukemie je klonální maligní onemocnění krvetvorby postihující převážně starší nemocné. Dříve téměř vždy fatální onemocnění je dnes vyléčitelné u 35–40 % mladších nemocných. Základem kurativní léčby je již několik desítek let indukční chemoterapie podle protokolu “7 + 3”, následovaná konsolidační léčbou. Velká část pacientů léčených jen samotnou chemoterapií však záhy po léčbě prodělá relaps a umírá na progredující onemocnění. Alogenní transplantace krvetvorných buněk nadále představuje nejúčinnější konsolidační léčbu pro nemocné se střední a nepříznivou cytogenetickou prognózou. Cytogenetická a molekulárněbiologická vyšetření ukazují na velkou heterogenitu onemocnění. Akutní myeloidní leukemie vzniká často na podkladě rekurentních genetických změn, které představují možné terapeutické cíle pro nové léky. Perspektivou moderní léčby je molekulárně cílená terapie, která bude schopna v kombinaci s chemoterapií zastavit proliferaci a eradikovat maligně změněné hematopoetické buňky v kostní dřeni bez nutnosti podstoupit alogenní transplantaci krvetvorných buněk, analogicky léčbě akutní promyelocytární leukemie. Vzhledem ke stárnutí populace pacientů s akutní myeloidní leukemií neustále přibývá, a potřeba nových léků se tak stává urgentní. Lepší pochopení biologie onemocnění s vývojem nových skupin léků jsou předpokladem pro zásadní zlepšení prognózy nemocných. Článek přináší přehled současných terapeutických přístupů i nových léčebných modalit na poli léčby akutní myeloidní leukemie.
KLÍČOVÁ SLOVA:
akutní myeloidní leukemie – indukční chemoterapie – konsolidace – transplantace – hypometylační látky – FLT3 inhibitoryÚVOD
Akutní myeloidní leukemie (AML) představují heterogenní skupinu maligních onemocnění krvetvorby. Vznikají maligní transformací krvetvorné kmenové buňky. AML je charakterizovaná klonální expanzí a akumulací blastů v organismu, zejména v kostní dřeni, s útlakem fyziologické krvetvorby a z toho plynoucích projevů onemocnění. Medián věku při diagnóze je přibližně 65–70 let, přičemž incidence s věkem narůstá [1]. Vzhledem ke stárnutí populace pacientů s AML neustále přibývá, léčebné postupy se však navzdory pokrokům ve výzkumu a pochopení biologie onemocnění v posledních 4 desetiletích zásadně nezměnily.
Prognostické faktory a klasifikace
Nejdůležitějším prognostickým faktorem onemocnění je karyotyp, který spolu s výsledky molekulární biologie podmiňuje stratifikaci nemocných do 3 prognostických skupin predikujících pravděpodobnost dosažení kompletní remise (KR), riziko relapsu i 5leté přežití. Ve skupině nemocných s příznivou cytogenetickou prognózou podle MRC 2010 klasifikace bylo celkové 5leté přežití 55–65 %, se střední prognózou 25 až 40 % a 5–14 % u pacientů s nepříznivou prognózou [2, 3]. Pokračující výzkum cytogenetických a molekulárně biologických charakteristik AML odhalil další markery, které se staly podkladem revidované Klasifikace akutních myeloidních leukemií podle Světové zdravotnické organizace (WHO) 2016 (tab. 1) a též aktuální Klasifikace prognostických skupin AML podle National Comprehensive Cancer Network (NCCN) 2016 (tab. 2) [4, 5]. Alterace genu TP53 představuje nový prognostický marker asociovaný s komplexním karyotypem, který je spojený s velmi nepříznivou prognózou onemocnění. Pravděpodobnost dosažení KR po indukční chemoterapii i celkové 3leté přežití bylo ve srovnání s nemocnými s komplexním karyotypem bez alterace genu TP53 signifikantně nižší (28 vs. 50 %, p = 0,01, respektive 3 vs. 28 %, p < 0,0001) [6].
Tab. 1. Klasifikace akutních myeloidních leukemií podle WHO 2016 [4] ![Klasifikace akutních myeloidních leukemií podle WHO 2016 [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ac1594ee1fe62c859ad671e556491d91.png)
Tab. 2. Klasifikace prognostických skupin podle NCCN 2016 [5] ![Klasifikace prognostických skupin podle NCCN 2016 [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/031c31e19bd3fbaa1a6d82d17970c96c.png)
Věk nemocných a terapie
Zásadní vliv na prognózu i výběr vhodného léčebného přístupu má věk nemocných v době diagnózy. Mladší nemocní (< 60 let) mají pravděpodobnost dosažení KR 70–80 %, starší nemocní (≥ 60 let) přibližně 50 %, následně však až 85 % z nich prodělá do 3 let relaps, celkové přežití tak nadále zůstává velmi nízké [7]. Na obecně horších výsledcích léčby AML u starších nemocných má kromě výskytu komorbidit limitujících intenzivní léčebné přístupy významný podíl i odlišná biologie základního onemocnění s častějším výskytem nepříznivých prognostických markerů. Tawfik et al. ve skupině 277 nemocných s nově diagnostikovanou AML prokázali signifikantně nižší zastoupení příznivých cytogenetických změn v podskupině 144 nemocných ≥ 60 let (medián věku 70 let) ve srovnání s nemocnými < 60 let (medián věku 47 let, 3 vs. 26 %, p < 0,0001) a současně vyšší prevalenci komorbidit – CCI (Charlson Comorbidity Index) ≥ 1 (58 vs. 26 %, p < 0,001). Kompletní remise dosáhlo 73,3 % mladších a jen 52,1 % starších nemocných (p = 0,0003) se statisticky významně kratším mediánem celkového přežití (23,1 vs. 8,7 měsíců, p < 0,0001) [8].
Léčba AML u starších nemocných
Doporučení pro výběr vhodné léčebné modality u starších pacientů s AML publikovala ELN (European LeukemiaNet) v roce 2010. Nemocní byli v doporučeních rozděleni do 2 skupin podle věku: 60–74 let a ≥ 75 let. Pro pacienty mladší 75 let je při dobrém performance statusu a nepřítomnosti závažných komorbidit doporučována indukční chemoterapie podle protokolu “7 + 3” následovaná konsolidací s redukovanými dávkami cytostatik. Ve skupině nemocných s příznivým a intermediárním rizikem je indukcí dosaženo přibližně 50 % KR, což představuje základní předpoklad dlouhodobého celkového přežití. Pravděpodobnost dosažení KR u starších nemocných s nepříznivou cytogenetikou je méně než 30 %, při celkovém přežití < 5 %. U této skupiny nemocných, podobně jako u pacientů neschopných podstoupit intenzivní chemoterapii, by měla být zvážena non-intenzivní, případně studiová léčba [3, 9]. Metaanalýza Deschlera et al. integrující výsledky 36 studií zahrnujících 12 370 nemocných (medián věku 70 let) s vysoce rizikovým myelodysplastickým syndromem (MDS) a AML ukázala, že přibližně 50 % starších nemocných bylo léčeno intenzivně, 30 % non-intenzivně a 20 % dostalo nejlepší podpůrnou péči. Medián celkového přežití v intenzivně léčené skupině pacientů byl 30 týdnů, v non-intenzivně léčené skupině 12 a 7,5 týdne ve skupině dostávající nejlepší podpůrnou péči [10]. AML je dnes vyléčitelná u 35–40 % nemocných mladších 60 let, ale jen u 5–15 % starších nemocných (≥ 60 let). Nepříznivou prognózu mají i pacienti s onemocněním primárně rezistentním k indukční léčbě nebo časným relapsem (< 12 měsíců po dosažení KR) [11, 12].
Výzkum a nové léky
Navzdory pokračujícímu výzkumu na poli molekulární biologie a genetiky u AML, umožňujícímu lepší pochopení biologie nádorového onemocnění, snahy o inovaci základní léčebné strategie (indukční chemoterapie) zatím nepřinesly zásadní průlom v léčbě AML. Přehledový článek přináší sumář současných terapeutických přístupů i nových léčebných modalit v managementu nemocných s AML. Tato práce se nezabývá problematikou akutní promyelocytární leukemie, vzhledem k odlišné terapii i prognóze tohoto onemocnění.
SOUČASNÉ STANDARDY LÉČBY AML
Zahájení samotné léčby vždy předchází terapeutická rozvaha, zdali bude nemocný léčen s kurativním záměrem (intenzivní chemoterapie ± transplantace krvetvorných buněk) nebo non-intenzivně, paliativně (hypometylační látky, nízkodávkovaný cytosinarabinosid – Ara-C, nejlepší podpůrná péče). Výběru vhodného léčebného přístupu předchází zhodnocení faktorů na straně pacienta (věk, komorbidity, celkový stav i osobní preference) a charakteristiky základního onemocnění (cytogenetika, molekulární biologie, předcházející chemoterapie/radioterapie či klonální hematologické onemocnění). Cytogenetické a molekulárně biologické vyšetření dnes představují integrální součást diagnosticko-terapeutické rozvahy u nemocných s nově diagnostikovanou AML [13].
Kurativní léčba
Zahájení léčby a cytoredukce
Stanovení diagnózy AML je považováno za emergentní stav v hemato-onkologii vyžadující časné zahájení léčby. V retrospektivní analýze autorů Sekeres et al. byl interval > 5 dnů do začátku indukční terapie u mladších nemocných (< 60 let) asociovaný se signifikantně nižším počtem KR a kratším celkovým přežitím. U starších nemocných (≥ 60 let) nebyla podobná asociace prokázána [14]. Naopak Bertoli et al. neprokázali prognostický význam času do zahájení terapie (TDT – time from diagnosis to treatment) ve srovnání s věkem nemocných, sekundární AML, cytogenetickou a molekulárně biologickou charakteristikou onemocnění [15]. Prodleva v zahájení terapie při čekání na výsledky cytogenetického a molekulárněbiologického vyšetření, které mohou pomoci při personalizaci terapie AML (klinické studie, molekulárně cílená léčba), zůstává stále diskutovanou otázkou.
Hyperleukocytóza (> 100 . 109/l) je při určení diagnózy přítomná přibližně u 5–20 % nemocných s AML. Mezi život ohrožující komplikace hyperleukocytózy patří diseminovaná intravaskulární koagulace (DIC), syndrom leukostázy a syndrom nádorového rozpadu (TLS – tumour lysis syndrome). U nemocných s hyperleukocytózou nebo klinickými známkami leukostázy musí být emergentně zahájená cytoredukční léčba (leukocytaferéza a/nebo hydroxyurea) spolu s prevencí TLS (hydratace, allopurinol, monitorace vnitřního prostředí). Cytoredukční terapie hydroxyureou u nemocných s leukocytózou (> 50 . 109/l) vedla k signifikantnímu poklesu časné mortality ve srovnání s nemocnými, kteří urgentně zahájili intenzivní léčbu AML bez předchozí cytoredukce (19 vs. 34 %, p = 0,047) [16, 17].
Indukční chemoterapie
Základním principem kurativní léčby nadále zůstává indukce remise onemocnění, následovaná několika cykly udržovací (konsolidační) chemoterapie a/nebo transplantací krvetvorných buněk (TKB). Standardem pro indukční léčbu je chemoterapie podle protokolu “7 + 3” složená ze 7denní aplikace Ara-C v dávce 100–200 mg/m2 tělesného povrchu kontinuální infuzí na 24 hodin a 3 dávek antracyklinu (daunorubicin 60 až 90 mg/m2, případně idarubicin 10–12 mg/m2 tělesného povrchu) [3]. Optimální dávkování daunorubicinu bylo předmětem několika studií. Dávky 90 mg/m2 tělesného povrchu byly spojeny se signifikantně vyšším počtem dosažených KR a delším celkovým přežitím ve srovnání s 45 mg/m2 (70,6 vs. 57,3 %, p < 0,001, respektive 23,7 vs. 15,7 měsíce, p = 0,003) [18]. Vyšší dávky daunorubicinu (90 vs. 45 mg/m2) vedly ve skupině 813 nemocných ≥ 60 let k signifikantně vyššímu počtu dosažených KR (64 vs. 54 %, p = 0,002). Z eskalovaných dávek profitovali nejvíc nemocní ve věkové skupině 60–65 let, kde byl zaznamenán statisticky nejvýznamnější rozdíl v počtu KR (73 vs. 51 %, p = 0,02) a celkovém 2letém přežití (38 vs. 23 %, p = 0,007) ve srovnání se stejnou věkovou skupinou dostávající dávky 45 mg/m2 [19]. Burnett et al. v britské studii srovnávali 60 vs. 90 mg/m2 daunorubicinu v indukci u 1 206 nemocných s AML se závěrem, že nižší dávkování je při stejném počtu dosažených KR asociováno s menší toxicitou léčby [20]. Tři dávky daunorubicinu v množství 60 mg/m2 tělesného povrchu v průběhu indukční léčby jsou proto nyní považovány za standardní dávkování prokazující dobrou účinnost při přijatelné toxicitě.
Konsolidační léčba
Indukční chemoterapie je následována konsolidační léčbou, jejímž cílem je eradikace minimální rezi-duální nemoci (minimal residual disease – MRD), což je předpoklad navození dlouhodobé remise a vyléčení onemocnění. Existují 2 základní konsolidační strategie – chemoterapie a TKB. Obě můžou být použity samostatně nebo v kombinaci, v závislosti na typu základního onemocnění (příznivá vs. intermediární/nepříznivá cytogenetická prognóza, primárně rezistentní a relabovaná AML), stavu nemocného (komorbidity, věk) a dostupnosti vhodného dárce kmenových buněk. Základem post-indukční léčby u nemocných s příznivou genetickou prognózou (tzv. Core-Binding Factor – CBF AML – t(8;21)(q22;q22) a inv(16)(p13q22)/t(16;16)(p13;q22), dále AML s normálním karyotypem a izolovanou mutací NPM1 (bez přítomnosti FLT3-ITD) nebo izolovanou bialelickou mutací CEBPA) jsou 3–4 cykly chemoterapie složené z vysoko-dávkovaného Ara-C (1,5–3 g/m2 tělesného povrchu podávaného 1., 3. a 5. den cyklu) [3, 21, 22]. Alogenní TKB je u této skupiny pacientů indikována jen při relapsu. Pro nemocné se středním a vysokým rizikem představuje alogenní transplantace nejefektivnější typ post-remisní léčby. Autologní TKB je diskutována jako potenciální konsolidační léčba u nemocných s intermediární prognózou a negativní MRD, při pozitivitě MRD jsou pacienti indikováni k alogenní TKB [23]. Během vyhledávání dárce mohou být podány 1–2 cykly ‘přemosťující’ konsolidační chemoterapie. Naplánování případné ‘up-front’ transplantace je třeba individuálně zvážit, konsolidační léčba je zatížená určitým rizikem morbidity a mortality, a oddaluje tak potenciálně kurativní transplantaci.
Pokroky v podpůrné léčbě i možnosti alternativních dárců (haploidentické transplantace) rozšiřují dostupnost transplantace jako konsolidační strategie [3]. Studie prokázaly, že alogenní TKB po redukovaném přípravném režimu mají i u starších nemocných v dobrém celkovém stavu a KR významný vliv na zlepšení prognózy onemocnění. Například v souboru 114 pacientů s mediánem 65 let, kteří podstoupili alogenní TKB po redukovaném režimu, zaznamenali Devine et al. celkové 2leté přežití 48 % [24, 25]. Alternativou pro starší nemocné neschopné podstoupit alogenní TKB je konsolidační chemoterapie s redukovanými dávkami Ara-C (1 g/m2/dávka), případně autologní TKB [26].
Léčba primárně refrakterní a relabované AML
Přibližně 10–40 % nově diagnostikovaných nemocných nedosáhne po standardní indukční chemoterapii KR. Taková AML je pak označována jako primárně refrakterní. Základem terapie pro nemocné s refrakterním a relabovaným onemocněním je tzv. záchranná (salvage) terapie následována alogenní TKB [11]. Cílem salvage chemoterapie před TKB je dosažení remise (případně alespoň redukce poolu blastů), která je základním předpokladem dlouhodobého přežití po transplantaci [27]. Zatím neexistuje jednoznačný konsenzus, který z chemoterapeutických režimů by měl být použit k re-indukci. Záchranná léčba obsahuje přidaná vysoko-dávkovaná cytostatika, která nebyla (alespoň zčásti) použita v prvním cyklu indukční léčby. Mezi často používané protokoly patří MEC (mitoxantron, etoposid, Ara-C), ICE (idarubicin, Ara-C, etoposid) a FLAG-IDA (fludarabin, Ara-C, granulocytární kolonie stimulující faktor, idarubicin). Pravděpodobnost dosažení KR re-indukcí je 40–60%, při relapsu s trváním první remise méně než 1 rok však klesá na 10–15 %. Větší šance na dosažení druhé KR je u mladších nemocných, příznivé cytogenetické prognóze a první KR delší než 6 měsíců [11].
Armistead et al. v souboru 490 nemocných s refrakterní/relabovanou AML prokázali signifikantně delší celkové přežití u pacientů, kteří v 2. KR (po záchranné léčbě) podstoupili alogenní TKB ve srovnání s nemocnými léčenými jen samotnou chemoterapií (11,7 vs. 5,6 měsíců, p < 0,001) [28]. Dosažení dlouhodobé remise onemocnění bez alogenní TKB je u pacientů s refrakterní/relabovanou AML nepravděpodobné. V případě, kdy provedení alogenní TKB jako jediné potenciálně kurativní léčebné modality není možné (komorbidity nebo nesouhlas nemocného, nedostupný dárce, floridní onemocnění refrakterní k salvage terapii), by měla vždy být pacientovi nabídnuta účast v klinické studii, případně zvážená jen non-intenzivní léčba [11].
Samostatnou problematikou je pak výběr vhodné léčebné modality u starších nemocných s refrakterním nebo relabovaným onemocněním. Podání intenzivní salvage terapie pacientům (> 60 let) s relabovanou AML ve studii Ferrara et al. vedlo k signifikantnímu prodloužení celkového přežití ve srovnání s non–intenzivní/paliativní léčbou (5 vs. 3 měsíce, p = 0,01). Při trvání 1. KR méně než 12 měsíců bylo však celkové přežití při intenzivní, respektive non-intenzivní léčbě podobné (4 vs. 3 měsíce, p = 0,10). Mortalita při použití agresivní re-indukce byla ve studii 22 %, přičemž 2. KR s mediánem trvání 8 měsíců byla dosažena jen u 36 % nemocných. Non-intenzivní léčba byla spojena se signifikantně kratší délkou hospitalizace (13 vs. 32 dní, p = 0,003), kratším trváním intravenózní antibiotické léčby (6 vs. 18 dní, p = 0,009) a nižší transfuzní závislostí. Výsledky studie ukazují, že starší nemocní mohou profitovat i z non-intenzivního přístupu k terapii [29]. Při selhání výše uvedených postupů jsou pak nemocní indikováni k paliativní léčbě s cílem prodloužení života v přijatelné kvalitě. Algoritmus léčby refrakterního/relabovaného onemocnění znázorňuje obrázek 1.
Obr. 1. Algoritmus pro léčbu refrakterní/relabované AML (volně upraveno podle Thol et al., 2015, [11]) ![Algoritmus pro léčbu refrakterní/relabované AML (volně upraveno podle Thol et al., 2015, [11])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6564d30d69c66f532693afa6f004dfb2.jpg)
Vysvětlivky: CHT – chemoterapie LDAC – nízce dávkovaný cytarabin TKB – transplantace krvetvorných buněk DLI – infuze dárcovských lymfocytů Non-intenzivní a paliativní léčba
Léčebné možnosti u pacientů, kteří nemohou podstoupit intenzivní léčbu (věk, komorbidity, performance status) nebo při selhání konvenčních kurativních postupů a nemožnosti zařazení do klinické studie jsou omezené na nízko-dávkovaný cytarabin (LDAC, low-dose Ara-C), hypometylační látky (azacitidin, decitabin) a nejlepší podpůrnou péči (best supportive care – BSC) skládající se z cytoredukce hydroxyureou (HU), léčby infekčních komplikací a podávání transfuzí.
Nízko-dávkovaný cytarabin
LDAC v dávce 20 mg subkutánně 2krát denně po dobu 10 dní (s opakováním cyklu po 4 týdnech) vedl ve skupině non-intenzivně léčených nemocných k dosažení 18 % KR, s mediánem trvání 8 měsíců. U pacientů s nepříznivou cytogenetikou nebylo podání LDAC účinné [30]. Heiblig et al. srovnávali dosažení KR a délku celkového přežití u 234 nemocných (≥ 70 let) s nově diagnostikovanou AML. Pacienti dostávající intenzivní léčbu dosáhli KR signifikantně častěji ve srovnání s LDAC (56 vs. 7 %, p < 0,0001), celkové přežití v obou skupinách se však statisticky významně nelišilo (12,4 vs. 9,6 měsíce, p = 0,07). Nemocní léčení jen BSC měli celkové přežití proti LDAC signifikantně kratší (3,4 vs. 9,6 měsíce, p = 0,001) [31].
Hypometylační látky
Další léčebnou modalitu pro nemocné s AML, kteří nemohou podstoupit intenzivní léčbu, představují hypometylační látky. Předpokládá se, že jejich antineoplastické účinky se uskutečňují pomocí mnoha mechanismů, zahrnujících cytotoxicitu na abnormální hematopoetické buňky v kostní dřeni či hypometylaci DNA s ovlivněním genů regulujících buněčný cyklus. Azacitidin (AZA) u pacientů (≥ 65 let) s nově diagnostikovanou AML s více než 30 % blastů v kostní dřeni vedl ve studii AZA-AML-001 k prodloužení celkového přežití ve srovnání s konvenčními léčebnými postupy (10,4 vs. 6,5 měsíce, p = 0,1009). Studiově podávaná dávka byla 75 mg/m2/den po dobu 7 dní s opakováním cyklu v intervalu 4 týdnů. Kompletní remise (včetně KR s neúplnou regenerací hematopoézy – KRi) dosáhlo ve skupině s AZA 27,8 % a v kontrolní skupině 25,1 % (p = 0,5384) nemocných, přičemž u indukční chemoterapie bylo dosaženo 47,7 % KR, u LDAC 25,9 % a BSC 0 % KR. AZA vedl ke statisticky významnému prodloužení celkového přežití u nemocných s nepříznivou cytogenetikou (6,4 vs. 3,2 měsíce, p = 0,0185) [32]. AZA ve srovnání s konvenčními léčebnými postupy u nemocných s 20–30 % blastů v kostní dřeni, kteří nebyli indikováni k intenzivní léčbě, vedl také k signifikantně delšímu celkovému přežití (24,5 vs. 16,0 měsíců, p = 0,005) a celkově kratší době strávené v nemocnici (26,0 vs. 50,9 dní/rok, p < 0,001) [33]. V ČR je nyní AZA registrovaný k léčbě dospělých pacientů (nezpůsobilých k transplantaci hematopoetických kmenových buněk) s AML, MDS a chronickou myelomonocytární leukemií [34].
Nejlepší podpůrná péče
BSC je indikována u nemocných, kteří nemohou podstoupit jinou léčbu nebo při selhání ostatních léčebných modalit včetně klinických studií. Cílem BSC je prodloužení života při zachování jeho přijatelné kvality. Petti et al. však popsali dosažení KR u 5/12 (42 %) nemocných s relabovanou nebo sekundární AML při podávaní HU v dávce 100 mg/kg/den [35].
NOVÉ MOŽNOSTI TERAPIE AML
Sekvenování genomu u 200 nemocných s de novo AML ukázalo na přítomnost průměrně 13 genových mutací, z toho 5 na genech rekurentně mutovaných u AML. Téměř každý nemocný měl aspoň jednu non-rekurentní mutaci v genech hrajících roli v patogenezi onemocnění [36]. Slibným terapeutickým cílem pro nové léky se jeví mutace v protoonkogenech – FLT3, NPM1, c-KIT, IDH1, IHD2 či CEBPA [11, 37]. Další potenciální terapeutické cíle u AML ukazuje obrázek 2. Je však nepravděpodobné, že cílená terapie zasahující jen jednu patologickou dráhu by mohla být dlouhodobě efektivní, v důsledku přirozené nebo získané rezistence – aktivace paralelní signální dráhy, mutace cílového genu. Obecně se nabízí 2 přístupy – přidání nových léků ke standardní chemoterapii nebo kombinace cílených léků se synergickým účinkem k prevenci vývoje rezistence [38, 39].
Obr. 2. Potenciální terapeutické cíle u AML 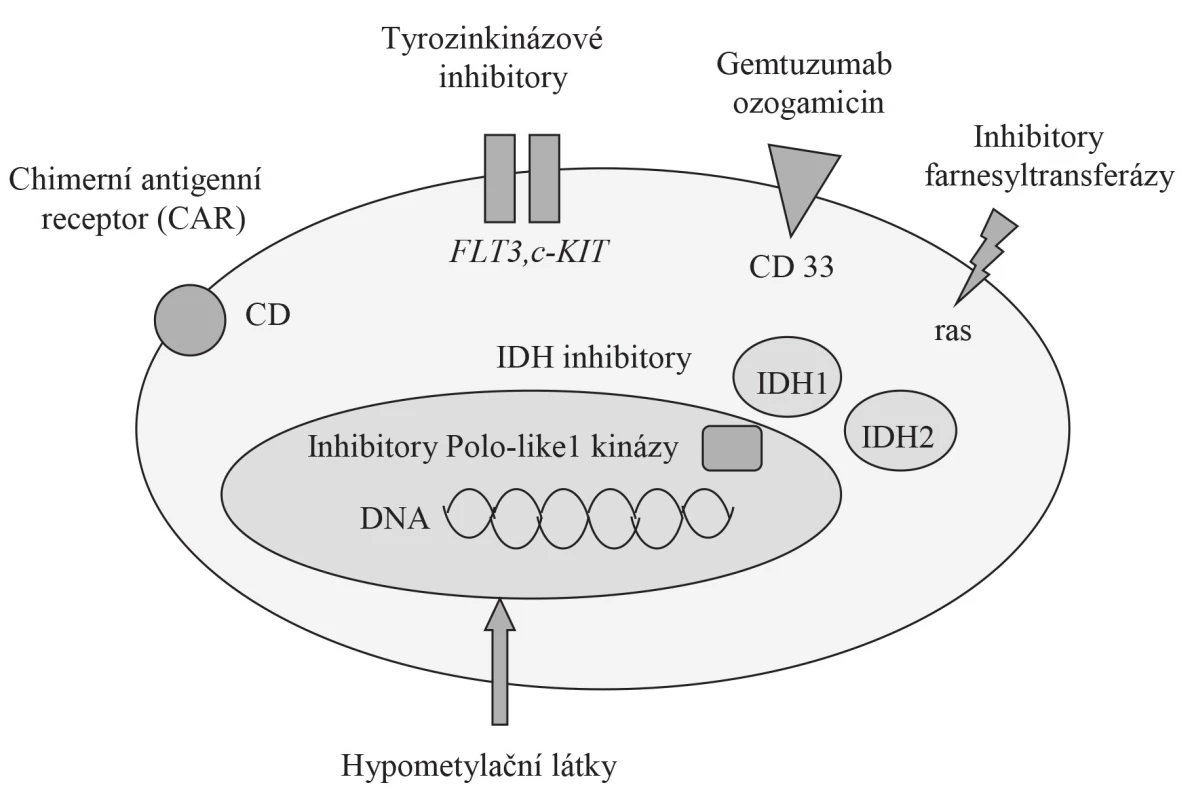
Vysvětlivka: IDH – isocitrát dehydrogenáza (volně upraveno podle Thol et al., 2015, [11]) V posledních letech bylo objeveno několik nových skupin léků určených k léčbě AML, avšak jen část z nich se dostala do 2. fáze klinických studií. Mezi nejvíce studované skupiny patří inhibitory, které budou blokováním klíčové signální dráhy schopny v kombinaci s chemoterapií zastavit proliferaci a eradikovat maligně změněné hematopoetické buňky v kostní dřeni, analogicky léčbě akutní promyelocytární leukemie kombinací all-trans retinové kyseliny s cytostatiky. Přehled vybraných nových terapeutických modalit v léčbě AML přináší tabulka 3, detailnější popis léků je pak uveden v následujících odstavcích.
Tab. 3. Přehled vybraných nových léčiv v terapii AML 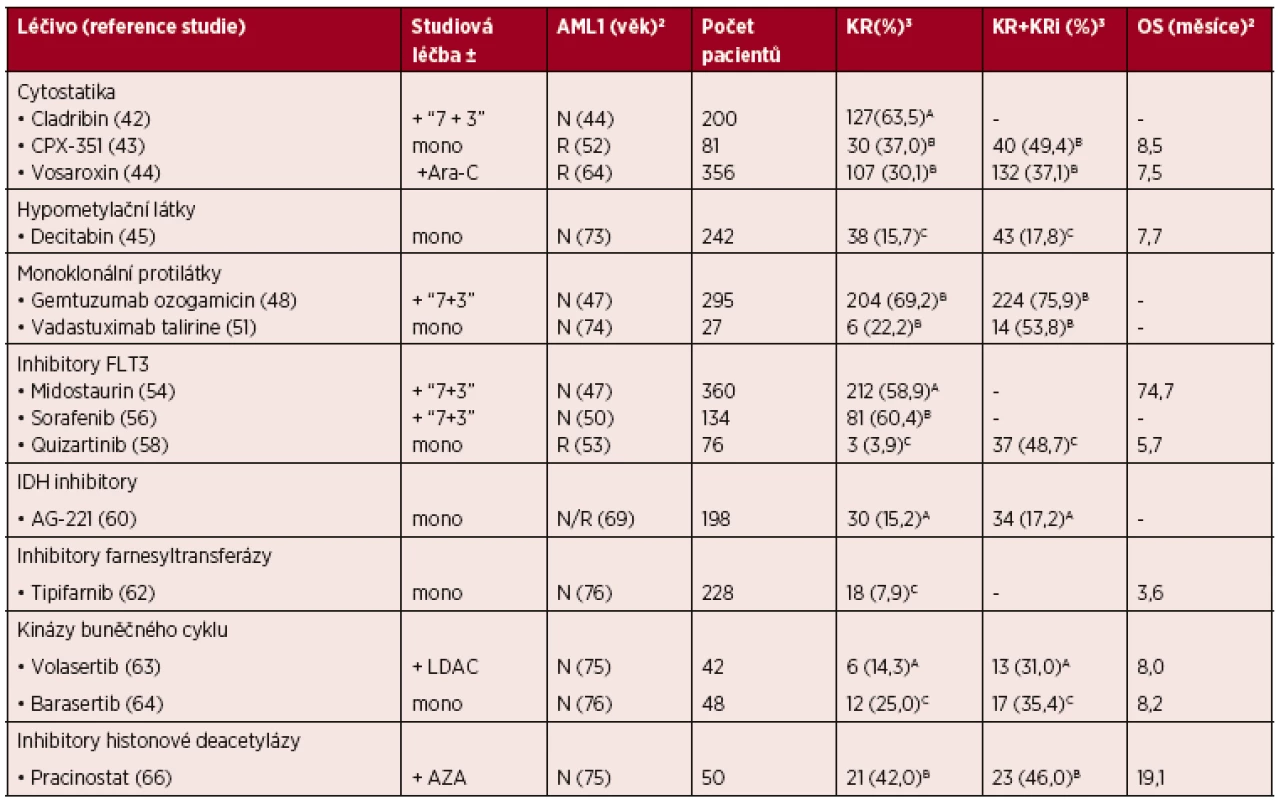
Vysvětlivky: 1AML – neléčená (N), relabovaná/refrakterní (R), 2medián pro daný parametr, 3procento kompletních remisí (KR) a kompletních remisí s neúplnou regenerací hematopoézy (KRi) po 1 cyklu (A), 1–2 cyklech (B) a více cyklech (C) studiové indukční léčby, ze všech nemocných ve studii; další zkratky: “7+3” – indukční chemoterapie 7+3 (cytosinarabinosid/daunorubicin), mono – monoterapie, Ara-C – cytosinarabinosid, LDAC – nízko-dávkovaný Ara-C, AZA – azacitidin, OS – overall survival (celkové přežití). Cytostatika
Synergický efekt v kombinaci s Ara-C byl popsán u některých purinových analog – např. fludarabinu, cladribinu nebo clofarabinu, zvýšením jeho intracelulární dostupnosti nebo blokací reparačních mechanismů DNA [9, 40]. Clofarabin v monoterapii (40 mg/m2/5dní) prokázal vysokou míru léčebné odpovědi u nemocných s molekulárním relapsem AML, a mohl by tak v budoucnu představovat optimální přemosťující terapii k alogenní TKB [41]. Přidání cladribinu v dávce 5 mg/m2/den po dobu 5 dní ke standardní indukci "7+3" (Ara-C 7krát 200 mg/m2, daunorubicin 3krát 60 mg/m2) vedlo k signifikantně vyššímu počtu dosažených KR (63,5 vs. 47,0 %, p = 0,0009) po jednom cyklu léčby [42]. Dalším příkladem synergického účinku cytostatik je CPX-351, liposomální preparát Ara-C a daunorubicinu ve fixním molekulárním poměru 5 : 1, s delším plazmatickým poločasem a vyšší mírou akumulace v kostní dřeni. Podávání CPX-351 vedlo u nemocných s relabovanou a cytogeneticky nepříznivou AML ve srovnání s re-indukcí (Ara-C, antracyklin a etoposid/gemtuzumab ozogamicin) k signifikantnímu prodloužení celkového přežití (6,6 vs. 4,2 měsíce, p = 0,02) [43].
Vosaroxin – inhibitor topoizomerázy II má na rozdíl od antracyklinů jen malou kardiotoxicitu, a může tak v budoucnu představovat jejich alternativu v indukční chemoterapii u nemocných s kardiální komorbiditou. Ve studii VALOR vedlo přidání vosaroxinu (90 mg/m2 podaných 1. a 4. den cyklu) k Ara-C (1 g/m2 1.–5. den cyklu) ke statisticky významně vyššímu počtu KR u nemocných s relapsem/refrakterní AML ve srovnání s monoterapií Ara-C (30,1 vs. 16,3 %, p < 0,0001). Primární cíl studie, signifikantní prodloužení celkového přežití však nebyl dosažen (7,5 vs. 6,1 měsíce, p = 0,061) [44].
Použití synergicky působících cytostatik v indukční chemoterapii má obecně vliv na zvýšení její efektivity, prodloužení celkového přežití, ale i na nárůst léčebné toxicity. Potenciál zásadního zlepšení výsledků léčby AML jen kombinací cytostatik bez dalších léčebných modalit zohledňujících značnou heterogenitu onemocnění se však nyní zdá být již vyčerpán.
Hypometylační látky
Decitabin v dávce 20 mg/m2 tělesného povrchu a den po dobu 5 dní (s opakováním cyklu co 4 týdny) ve studii DACO-016 prokázal statisticky nevýznamné prodloužení celkového přežití ve srovnání s BSC a LDAC (7,7 vs. 5,0 měsíce, p = 0,108). U pacientů léčených decitabinem bylo zaznamenáno 15,7 % dosažených KR, s mediánem 4,1 měsíce do dosažení KR [45]. V ČR je decitabin registrován k léčbě dospělých pacientů s nově diagnostikovanou de novo nebo sekundární AML, kteří nemohou podstoupit standardní indukční chemoterapii. Aktuálně však chybí úhrada ze zdravotního pojištění [46]. Dále probíhají studie s použitím decitabinu v nových dávkovacích schématech (5 vs. 10 dní) nebo v kombinacích s jinými léky u AML a dalších myeloproliferativních onemocnění.
Monoklonální protilátky
Gemtuzumab ozogamicin (GO) je humanizovaná monoklonální anti-CD33 protilátka konjugovaná s kalicheamycinem (protinádorové antibiotikum izolované z Micromonospora calichensis). Po internalizaci komplexu antigen-protilátka do leukemické buňky (80–90 % je CD33-pozitivních na rozdíl od hematopoetických prekurzorů) se intracelulárně uvolní proteolyticky a DNA destruktivně působící kalicheamicin a indukuje apoptózu. FDA schválila v roce 2000 GO pro léčbu prvního relapsu AML u nemocných ≥ 60 let, kteří nejsou schopni podstoupit jiný typ re-indukční terapie. Očekávaný přínos proti alternativním léčebným postupům se však neprokázal, navíc v kombinované terapii vedl GO k významnému vzestupu celkové toxicity léčby, a proto byl v roce 2010 stažen z trhu. Doporučené dávkování GO 9 mg/m2 tělesného povrchu v 2hodinové infuzi v odstupu 14 dní, celkem tedy 2 podání, vedlo v registrační studii k dosažení KR u 23/142 (16 %) a KRi u 19/142 (13 %) nemocných s prvním relapsem AML [47]. Studie srovnávající efektivitu indukční léčby “7 + 3” (Ara-C 7krát 100 mg/m2 + daunorubicin 3krát 45 mg/m2) s přidáním GO v dávce 6 mg/m2 4. den indukce, referovala u de novo AML ve srovnání s kontrolní skupinou (Ara-C 7krát 100 mg/m2 + daunorubicin 3krát 60 mg/m2)shodný podíl dosažených KR (69 vs. 70 %, p = 0,59) po 1–2 cyklech indukce. Ve skupině s GO byla popsána signifikantně vyšší mortalita indukční terapie (5 vs. 1 %,p = 0,0062). Celkově tedy přidání GO ve studii s 595 nemocnými neprokázalo pozitivní efekt na dosažení KR ani celkové přežití [48]. Ve studii byly však v obou ramenech použity rozdílné dávky daunorubicinu (45 vs. 60 mg/m2), proto by potenciální efektivita přidání GO mohla být zkreslená, navíc 5% mortalita indukční léčby u AML je uváděna i u konvenční léčby [49]. Dále probíhají klinické studie u nemocných s CD33-pozitivní AML a v kombinaci s all-trans retinovou kyselinou u relapsu akutní promyelocytární leukemie. V ČR není GO v současnosti pro léčbu registrován.
Dalším zástupcem ze skupiny anti-CD33 monoklonálních protilátek je vadastuximab talirin (33A), konjugovaný se 2 molekulami pyrolobenzodiazepinu. Přidání 33A v dávce 0,01-0,02 mg/kg 1. a 4. den indukční chemoterapie "7 + 3" (Ara-C 7krát 100 mg/m2+ daunorubicin 3krát 60 mg/m2) vedlo ve skupině mladších nemocných (medián věku 45,5 let) k dosažení 78 % kompletních remisí (včetně KRi) [50]. U starších nemocných vedl 33A v monoterapii (dávka 0,04 mg/kg s opakováním po 3 týdnech) k 54 % remisí, v kombinaci s hypometylačními látkami dokonce k 73 % kompletních remisí (včetně KRi). Výsledky prvních studií prokazující vysoký počet léčebných odpovědí a nízkou časnou mortalitu (i ve skupině starších nemocných) jsou povzbuzující. Indikace 33A v konsolidační a potransplantační udržovací terapii jsou nyní předmětem dalších studií [51, 52].
FLT3 inhibitory
FLT3 (FMS-like tyrosin kináza-3) je receptorová tyrozinkináza s vysokou mírou exprese v hematopoetických a progenitorových buňkách. Mutace (nejčastěji ITD – internal tandem duplication) se vyskytuje přibližně u 40 % AML (hlavně u nemocných s normálním karyotypem). Přítomnost FLT3-ITD mutace je asociována s nepříznivou prognózou a vysokým rizikem relapsu, potřeba vývoje efektivního FLT3 inhibitoru se tak stává urgentní [53]. Zástupcem inhibitorů 1. generace s širokým spektrem antitumorózní aktivity je midostaurin. Multikinázová aktivita zahrnuje působení proti různým kinázovým mutacím, včetně c-KIT a FLT3 u AML. In vitro vykazuje inhibiční aktivitu nejen u ITD a D835Y mutací, ale také u nemutované varianty (WT – wild type) FLT3. Monoterapie midostaurinem (3krát 75 mg/den) vedla k přechodné redukci blastů o ≥ 50 % v periferní krvi u 70 % nemocných, v kostní dřeni pak u 30 % nemocných s FLT3 pozitivní AML. Kombinace midostaurinu (50 mg 2krát denně) se standardní indukční a konsolidační léčbou vedla u nemocných < 60 let s de novo diagnostikovanou FLT3 pozitivní AML ve studii RATIFY k vyššímu počtu KR (59 vs. 54 %, p = 0,18) a signifikantně delšímu celkovému přežití (74,7 vs. 25,6 měsíců, p = 0,007) ve srovnání se standardní léčbou [54].
Sorafenib je představitel multikinázových inhibitorů 2. generace s efektivitou proti FLT3 a jiným kinázovým mutacím (RAF-1, VEGFR, PDGFR, c-KIT). V monoterapii u nemocných s relapsem, refrakterní FLT3-ITD pozitivní AML vedla monoterapie sorafenibem v dávce 200–400 mg 2krát denně k přechodné redukci počtu blastů u 12/13 (92 %) nemocných, žádný však nedosáhl KR. Ke ztrátě léčebné odpovědi došlo u pacientů, kteří nebyli transplantováni a pokračovali v léčbě sorafenibem v mediánu 72 (54–287) dnů [55]. Nemocní dostávající sorafenib v průběhu indukce, konsolidace a následně 12 měsíců jako udržovací léčbu (2krát 400 mg denně) měli signifikantně delší medián EFS – event-free survival (21 vs. 9 měsíců) a nižší kumulativní incidenci relapsů po 3 letech (34 vs. 49 %, p = 0,033) ve srovnání se skupinou dostávající placebo [56]. Sorafenib je v ČR v současnosti registrován pro léčbu hepatocelulárního, renálního karcinomu a diferencovaného karcinomu štítné žlázy.
Quizartinib je kinázový inhibitor 2. generace se selektivní aktivitou u FLT3-ITD mutací. Quizartinib prokázal efektivitu v monoterapii u nemocných s relapsem, refrakterní FLT3-ITD pozitivní AML s 50 % dosažených remisí (včetně KRi) shodně v ramenech s 30 a 60 mg denně. Alogenní TKB podstoupilo po přemosťující terapii quizartinibem 25/76 (33 %) nemocných ve studii. K významným nežádoucím účinkům terapie patří prodloužení QT intervalu se závislostí na dávce. Udržovací léčba quizartinibem vedla u nemocných s FLT3-ITD pozitivní AML po alogenní TKB k nižšímu výskytu relapsů ve srovnání s historickými kohortami [57, 58].
Perspektiva použití FLT3 inhibitorů je v kombinaci s indukční a konsolidační chemoterapií i jako následná udržovací léčba snižující riziko relapsu onemocnění. Základním problémem terapie však zůstává vznik sekundární rezistence (nové bodové mutace, globální změny v genové expresi) se ztrátou léčebné odpovědi. Lepší pochopení molekulárních mechanismů rezistence a signálních drah může přispět k vývoji efektivnější terapie FLT3 inhibitory.
Inhibitory isocitrát dehydrogenázy (IDH)
Enzymy ze skupiny IDH jsou zapojeny do buněčného dýchání a produkce NAPDH. Mutace v genech pro IDH1 a IDH2 vedou k alteraci buněčného metabolismu, akumulaci abnormálních metabolitů s následnou poruchou proliferace a diferenciace. V humánní onkologii byly mutace IDH popsány téměř výhradně u gliomů a AML, kde představují současně potenciální marker pro monitorování MRD a možný terapeutický cíl pro nové léky. IDH1 mutace se vyskytuje přibližně u 5–10 % a IDH2 u 10–15 % dospělých nemocných s AML, častá je asociace s normálním karyotypem [59]. První klinické studie s IDH1 inhibitorem – AG-120 a IDH2 inhibitorem – AG-221 ukázaly povzbudivé výsledky. AG-221 vedl ve skupině 128 nemocných s relabovanou/refrakterní AML k dosažení 18 % KR. Celková léčebná odpověď (včetně parciální remise, eradikace blastů v kostní dřeni a KRi) byla popsána u 41 % nemocných, s mediánem trvání 6 měsíců. Terapie AG-221 byla zahájená dávkou 50–60 mgdenně, s následnou eskalací na 450 mg. Ve studii s AG-120 byla léčebná odpověď zaznamenána u 31 % a dosažení KR u 15 % nemocných (59,60). Dobrá tolerance a indukce léčebné odpovědi i u výrazně předléčených nemocných dávají naději pro další klinické studie. V aktuálně probíhajících studiích se zkouší účinnost IDH inhibitorů v kombinaci s konvenční chemoterapií nebo AZA u nemocných s neléčenou AML.
Inhibitory farnesyltransferázy
Tipifarnib je orální selektivní inhibitor farnesyltransferázy, blokující aktivovanou signální dráhu ras, která ovlivňuje buněčnou proliferaci a diferenciaci. Ve skupině 74 nemocných s AML a vysoce rizikovým MDS (medián věku 50 let) vedlo přidání tipifarnibu k indukční chemoterapii (Ara-C 4x 1,5 g/m2 + idarubicin 3krát 12 mg/m2) k dosažení KR u 48 (65 %) a KRi u 9 (12 %) nemocných. Studiová dávka tipifarnibu byla 200–300 mg 2krát denně po dobu 21 dní. Ve srovnání s historickými kohortami nepřineslo přidání tipifarnibu významné zlepšení výsledků indukční léčby, navíc až 53 % nemocných vyžadovalo přerušení léčby nebo redukci dávek pro nežádoucí účinky, hlavně průjem a hyperbilirubinémii [61]. Monoterapie tipifarnibem v dávce 600 mg 2krát denně po dobu 21 dní (opakování cyklu po 28 dnech) u nemocných nad 70 let nevedla ke zlepšení celkového přežití ve srovnání s BSC (107 vs. 109 dní, p = 0,843) [62]. V preklinických modelech prokázal tipifarnib velký antileukemický potenciál, který se však v prvních klinických studiích nepotvrdil. V přípravě jsou další studie s tipifarnibem v kombinaci s indukční chemoterapií u dospělých a záchrannou léčbou u primárně rezistentní dětské AML.
Kinázy buněčného cyklu
Volasertib – inhibitor polo-like 1 kinázy vedl ve skupině starších nemocných s AML (medián věku 75 let) v kombinaci s LDAC k dosažení vyššího procenta KR (31,0 vs. 13,3 %, p = 0,052) a signifikantně delšímu celkovému přežití (8,0 vs. 5,2 měsíce, p = 0,047) ve srovnání s kontrolní skupinou dostávající LDAC samostatně [63]. Studiová léčba inhibitorem Aurora B kinázy – barasertibem byla u starších nemocných (≥ 60 let) s nově diagnostikovanou AML spojena se signifikantně vyšším počtem remisí (KR + KRi) a prodloužením celkového přežití (35 vs. 12 %, p < 0,05, respektive 8,2 vs. 4,5 měsíce, p = 0,663) ve srovnání s LDAC [64]. Kinázy buněčného cyklu vedly k signifikantně vyššímu procentu léčebné odpovědi a prodloužení celkového přežití ve srovnání s konvenčními modalitami u starších nemocných. Nyní probíhají další studie hodnotící efektivitu v kombinaci s indukční chemoterapií (Ara-C + idarubicin).
Inhibitory histonové deacetylázy
Pracinostat je perorální inhibitor histonových de-acetyláz patřících do skupiny epigenetických regulátorů, které chemickou modifikací DNA podmiňují expresi tumor supresorových genů. Kombinace pracinostatu (3krát 60 mg) a azacitidinu (7krát 75 mg/m2) vedla ve studii u 23/50 (46 %) nemocných k dosažení remise (KR + KRi) s mediánem trvání 17,2 měsíce. Dále probíhají studie s pracinostatem v kombinaci s azacitidinem u nemocných s AML (s komorbiditami neumožňujícími podání standardní chemoterapie a u nemocných starších 75 let), MDS a s ruxolitinibem u myelofibrózy [65, 66].
ZÁVĚR
Navzdory pokrokům v pochopení biologie a genetického pozadí AML, prognóza většiny nemocných zatím zůstává nepříznivá a dlouhodobé výsledky léčby neuspokojivé. Základní principy léčby AML nezaznamenaly v posledních desetiletích výraznější změny. I když bylo objeveno několik nových skupin potenciálních léků, jen malá část z nich se však dostala z in vitro studií ke klinickému použití. Mezi nové léky s největším potenciálem patří kinázové inhibitory, jejichž intenzivní výzkum nadále probíhá v mnoha klinických studiích. Navzdory prvotním slibným výsledkům cílené terapie se zdá být nepravděpodobné, že by zasažení jediné patologické signální dráhy mohlo vést k vyléčení nemoci. Odhalení molekulárních mechanismů leukemogeneze a rezistence může přispět k lepšímu pochopení signálních drah a vývoji účinnější terapie. Další intenzivní výzkum a vývoj nových léků nadále probíhá, aplikace jejich výsledků do klinické praxe je tak příslibem pro zlepšení prognózy a dlouhodobých léčebných výsledků AML.
Poděkování
Tato práce byla podpořena grantem IGA-LF-2016-001 a MZ ČR – RVO (FNOL, 00098892).
Podíl autorů na přípravě rukopisu
MČ – hlavní autor práce
TS – korespondující autor, spoluautor práce
Čestné prohlášení autorů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů, a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Tohle prohlášení se vztahuje i na spoluautora.
Doručeno do redakce dne 20. 12. 2016.
Přijato po recenzi dne 25. 1. 2017.
doc. MUDr. Tomáš Szotkowski, Ph.D.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: tomas.szotkowski@fnol.cz
Zdroje
1. Kouchkovsky ID, Abdul-Hay M. Acute myeloid leukemia: a comprehensive review and 2016 update. Blood Cancer J 2016; 6(7): e441.
2. Grimwade D, Hills RK, Moorman AV, et al. Refinement of cytogenetic classification in acute myeloid leukemia: determination of prognostic significance of rare recurring chromosomal abnormalities among 5876 younger adult patients treated in the United Kingdom Medical Research Council trials. Blood 2010; 116 : 354–365.
3. Döhner H, Estey EH, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood 2010; 115(3): 453–474.
4. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia. Blood 2016; 127 : 2391–2405.
5. NCCN Clinical practice guidelines in oncology: Acute myeloid leukemia. Version 2.2016. https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf
6. Rücker FG, Schlenk RF, Bullinger L, et al. TP53 alterations in acute myeloid leukemia with complex karyotype correlate with specific copy number alterations, monosomal karyotype, and dismal outcome. Blood 2012; 119(9): 2114–2121.
7. Burnett A, Wetzler M, Löwenberg B. Therapeutic advances in acute myeloid leukemia. J Clin Oncol 2011; 29(5): 487–494.
8. Tawfik B, Pardee TS, Isom S, et al. Comorbidity, age, and mortality among adults treated intensively for acute myeloid leukemia (AML). J Geriatr Oncol 2016; 7(1): 24–31.
9. Sanz MA, Iacoboni G, Montesinos P, Venditti A. Emerging strategies for the treatment of older patients with acute myeloid leukemia. Ann Hematol 2016; 95(10): 1583–1593.
10. Deschler B, de Witte T, Mertelsmann R, et al. Treatment decision-making for older patients with high-risk myelodysplastic syndrome or acute myeloid leukemia: problems and approaches. Haematologica 2006; 91 : 1513–1522.
11. Thol F, Schlenk RF, Heuser M, Ganser A. How I treat refractory and early relapsed acute myeloid leukemia. Blood 2015; 126 : 319–327.
12. Döhner H, Weisdorf DJ, Bloomfield CD. Acute myeloid leukemia. N Engl J Med 2015; 373 : 1136–1152.
13. Ossenkoppele G, Löwenberg B. How I treat the older patient with acute myeloid leukemia. Blood 2015; 125 : 767–774.
14. Sekeres MA, Elson P, Kalaycio ME, et al. Time from diagnosis to treat-ment initiation predicts survival in younger, but not older, acute myeloid leukemia patients. Blood 2009; 113 : 28–36.
15. Bertoli S, Bérard E, Huguet F, et al. Time from diagnosis to intensive chemotherapy initiation does not adversely impact the outcome of patients with acute myeloid leukemia. Blood 2013; 121 : 2618–2626.
16. Röllig C, Ehninger G. How I treat hyperleukocytosis in acute myeloid leukemia. Blood 2015; 125 : 3246–3252.
17. Manez AC, Raffoux E, Chevret S, et al. Pre-treatment with oral hydroxyurea prior to intensive chemotherapy improves early survival of patients with high hyperleukocytosis in acute myeloid leukemia. Leuk Lymphoma 2016; 57(10): 2281–2288.
18. Fernandez HF, Sun Z, Yao X, et al. Anthracycline dose intensification in acute myeloid leukemia. N Engl J Med 2009; 361 : 1249–1259.
19. Löwenberg B, Ossenkoppele GJ, van Putten W, et al. High-dose daunorubicin in older patients with acute myeloid leukemia. N Engl J Med 2009; 361(13): 1235–1248.
20. Burnett AK, Russell NH, Hills RK, et al. A randomized comparison of daunorubicin 90 mg/m2 vs 60 mg/m2 in AML induction: results from the UK NCRI AML17 trial in 1206 patients. Blood 2015; 125(25): 3878–3885.
21. Bloomfield CD, Lawrence D, Byrd JC, et al. Frequency of prolonged remission duration after high-dose cytarabine intensification in acute myeloid leukemia varies by cytogenetic subtype. Cancer Res 1998; 58 : 4173–4179.
22. Weick JK, Kopecky KJ, Appelbaum FR, et al. A randomized investigation of high-dose versus standard-dose cytosine arabinoside with daunorubicin in patients with previously untreated acute myeloid leukemia: a Southwest Oncology Group study. Blood 1996; 88(8): 2841–2851.
23. Cornelissen JJ, Blaise D. Hematopoietic stem cell transplantation for patients with AML in first complete remission. Blood 2016; 127(1): 62–70.
24. Karas M. Akutní myeloidní leukemie u nemocných nad 60 let, možnosti její léčby a potenciální role alogenní transplantace krvetvorných buněk. Onkologie 2011; 5(2): 91–95.
25. Devine SM, Owzar K, Blum W, et al. Phase II study of allogeneic transplantation for older patients with acute myeloid leukemia in first complete remission using a reduced-intensity conditioning regimen: results from Cancer and Leukemia Group B 100103 (Alliance for Clinical Trials in Oncology). Blood and Marrow Transplant Clinical Trial Network 0502. J Clin Oncol 2015; 33(35): 4167–4175.
26. Juliusson G, Antunovic P, Derolf Å, et al. Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry. Blood 2009; 113 : 4179–4187.
27. Ossenkoppele GJ, Janssen JJ, Loosdrecht AA. Risk factors for relapse after allogeneic transplantation in acute myeloid leukemia. Haematologica 2016; 101(1): 20–25.
28. Armistead PM, de Lima M, Pierce S, et al. Quantifying the survival benefit for allogeneic stem cell transplantation in relapsed acute myeloid leukemia. Biol Blood Marrow Transplant 2009; 15(11): 1431–1438.
29. Ferrara F, Morabito F, Latagliata R, et al. Aggressive salvage treat-ment is not appropriate for the majority of elderly patients with acute myeloid leukemia relapsed from first complete remission. Haematologica 2001; 86(8): 814–820.
30. Burnett AK, Milligan D, Prentice AG, et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer 2007; 109(6): 1114–1124.
31. Heiblig M, Elhamri M, Tigaud I, et al. Treatment with low-dose cytarabine in elderly patients (age 70 years or older) with acute myeloid leukemia: A single institution experience. Mediterr J Hematol Infect Dis 2016; 8(1): e2016009.
32. Dombret H, Seymour JF, Butrym A, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood 2015; 126(3): 291–299.
33. Fenaux P, Mufti GJ, Hellström-Lindberg E. Azacitidine prolongs overall survival compared with conventional care regimens in elderly patients with low bone marrow blast count acute myeloid leukemia. J Clin Oncol 2010; 28(4): 562–569.
34. SÚKL: Vidaza 25mg/ml. Souhrn údajů o přípravku; www.sukl.cz.
35. Petti MC, Tafuri A, Latagliata R, et al. High-dose hydroxyurea in the treatment of poor-risk myeloid leukemias. Ann Hematol 2003; 82(8): 476–480.
36. The Cancer Genome Atlas Research Network. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia. N Engl J Med 2013; 368 : 2059–2074.
37. Saultz JN, Garzon R. Acute myeloid leukemia: A concise review. J Clin Med 2016; 5 : 33.
38. Shafer D, Grant S. Update on rational targeted therapy in AML. Blood Rev 2016; 30(4): 275–283.
39. Wander SA, Levis MJ, Fathi AT. The evolving role of FLT3 inhibitors in acute myeloid leukemia: quizartinib and beyond.Ther Adv Hematol 2014; 5(3): 65–77.
40. Žák P, Ráčil Z, Zavřelová A. Význam clofarabinu v léčbě akutních myeloidních leukemií. Farmakoterapie 2009; 3 : 264–268.
41. Racil Z, Toskova M, Dvorakova D, et al. Treatment of molecular relapse in patients with acute myeloid leukemia using clofarabine monotherapy. Am J Hematol 2012; 87(2): 211–213.
42. Holowiecki J, Grosicki S, Robak T, et al. Addition of cladribine to daunorubicin and cytarabine increases complete remission rate after a single course of induction treatment in acute myeloid leukemia. Multicenter, phase III study. Leukemia 2004; 18 : 989-997.
43. Cortes JE, Goldberg SL, Feldman EJ, et al. Phase II, multicenter, randomized trial of CPX-351 (cytarabine:daunorubicin) liposome injection versus intensive salvage therapy in adults with first relapse AML. Cancer 2015; 121(2): 234–242.
44. Ravandi F, Ritchie EK, Sayar H, et al. Vosaroxin plus cytarabine versus placebo plus cytarabine in patients with first relapsed or refractory acute myeloid leukaemia (VALOR): a randomised, controlled, double-blind, multinational, phase 3 study. Lancet Oncol 2015; 16(9): 1025–1036.
45. Nieto M, Demolis P, Béhanzin E, et al. The European Medicines Agency review of decitabine (Dacogen) for the treatment of adult patients with acute myeloid leukemia: Summary of the scientific assessment of the committee for medicinal products for human use. Oncologist 2016; (6): 692–700.
46. SÚKL: Dacogen 50mg. Souhrn údajů o přípravku; www.sukl.cz.
47. Sievers EL, Larson RA, Stadtmauer EA, et al. Efficacy and safety of gemtuzumab ozogamicin in patients with CD33-positive acute myeloid leukemia in first relapse. J Clin Oncol 2001; 19(13): 3244–3254.
48. Petersdorf SH, Kopecky KJ, Slovak M, et al. A phase 3 study of gemtuzumab ozogamicin during induction and postconsolidation therapy in younger patients with acute myeloid leukemia. Blood 2013; 121(24): 4854–4860.
49. Rowe JM, Löwenberg B. Gemtuzumab ozogamicin in acute myeloid leukemia: a remarkable saga about an active drug. Blood 2013; 121 : 4838–4841.
50. Erba HP, Levy MY, Vasu S, et al. A phase 1b study of vadastuximab talirine in combination with 7+3 induction therapy for patients with newly diagnosed acute myeloid leukemia (AML). Blood 2016; 128(22): 211.
51. Bixby DL, Stein AS, Fathi AT, et al. Vadastuximab talirine monotherapy in older patients with treatment naive CD33-positive acute myeloid leukemia (AML). Blood 2016; 128(22): 590.
52. Fathi AT, Erba HP, Lancet JE, et al. Vadastuximab talirine plus hypomethylating agents: A well-tolerated regimen with high remission rate in frontline older patients with acute myeloid leukemia (AML). Blood 2016; 128(22): 591.
53. Gazdová J, Dvořáková D, Ježíšková I, Rázga F, Jurček T, Mayer J. Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie. Transfuze Hematol Dnes 2009; 4 : 229–236.
54. Stone RM, Mandrekar S, Sanford BL, et al. The multi-kinase inhibitor midostaurin (M) prolongs survival compared with placebo (P) in combination with daunorubicin (D)/cytarabine (C) induction (ind), high-dose C consolidation (consol), and as maintenance (maint) therapy in newly diagnosed acute myeloid leukemia (AML) patients (pts) age 18-60 with FLT3 mutations (muts): An international prospective randomized (rand) P-controlled double-blind trial (CALGB 10603/RATIFY [Alliance]). Blood 2015; 126 : 6.
55. Man ChH, Fung TK, Ho Ch, et al. Sorafenib treatment of FLT3-ITD+ acute myeloid leukemia: favorable initial outcome and mechanisms of subsequent nonresponsiveness associated with the emergence of a D835 mutation. Blood 2012; 119 : 5133–5143.
56. Röllig C, Serve H, Hüttmann A, et al. Addition of sorafenib versus placebo to standard therapy in patients aged 60 years or younger with newly diagnosed acute myeloid leukaemia (SORAML): a multicentre, phase 2, randomised controlled trial. Lancet Oncol 2015; 16(16): 1691–1699.
57. Sandmaier BM, Khaled SK, Oran B, et al. Results of a phase 1 study of quizartinib (AC220) as maintenance therapy in subjects with acute myeloid leukemia in remission following allogeneic hematopoietic cell transplantation. Blood 2014; 124 : 428.
58. Cortes JE, Tallman MS, Schiller G, et al. Results of a phase 2 randomized, open-label, study of lower doses of quizartinib (AC220; ASP2689) in subjects with FLT3-ITD positive relapsed or refractory acute myeloid leukemia (AML). Blood 2013; 122 : 494.
59. Stein EM, Tallman MS. Emerging therapeutic drugs for AML. Blood 2016; 127 : 71–78.
60. Stein EM, Di Nardo C, Altman JK, et al. Safety and efficacy of AG-221, a potent inhibitor of mutant IDH2 that promotes differentiation of myeloid cells in patients with advanced hematologic malignancies: results of a phase 1/2 trial. Blood 2015; 126 : 323.
61. Alvarez RH, Kantarjian H, Garcia-Manero G, et al. Farnesyl transferase inhibitor (tipifarnib, Zarnestra; Z) in combination with standard chemotherapy with idarubicin (Ida) and cytarabine (ara-C) for patients (pts) with newly diagnosed acute myeloid leukemia (AML) or high-risk myelodysplastic syndrome (MDS). Blood 2006; 108 : 565a–566a.
62. Harousseau JL, Martinelli G, Jedrzejczak WW, et al. A randomized phase 3 study of tipifarnib compared with best supportive care, including hydroxyurea, in the treatment of newly diagnosed acute myeloid leukemia in patients 70 years or older. Blood 2009; 114 : 1166–1173.
63. Döhner H, Lübbert M, Fiedler W, et al. Randomized, phase 2 trial of low-dose cytarabine with or without volasertib in AML patients not suitable for induction therapy. Blood 2014; 124 : 1426–1433.
64. Kantarjian HM, Martinelli G, Jabbour EJ, et al. Stage I of a phase 2 study assessing the efficacy, safety, and tolerability of barasertib (AZD1152) versus low-dose cytosine arabinoside in elderly patients with acute myeloid leukemia. Cancer 2013; 119 : 2611–2619.
65. Garcia-Manero G, Atallah E, Khaled SK, et al. Phase 2 study of pracinostat and azacitidine in elderly patients with acute myeloid leukemia (AML) not eligible for induction chemotherapy: response and long-term survival benefit. Blood 2016; 128(22): 100A.
66. Garcia-Manero G, Atallah E, Khaled SK, et al. Final results from a phase 2 study of pracinostat in combination with azacitidine in elderly patients with acute myeloid leukemia (AML). Blood 2015; 126 : 453.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2017 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Úvodník
-
Zemřel MUDr. Vladimír Veselý, CSc.
(30. 5. 1931–25. 5. 2016) - Vzpomínka na pana profesora MUDr. Ivo Krče, DrSc.
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



