-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
Chronic myeloid leukaemia – standardization of BCR-ABL1 transcript level monitoring in the Czech Republic
Molecular monitoring of patients with chronic myeloid leukaemia has become a crucial part of therapeutic practice in the era of tyrosine kinase inhibitors. Introduction of BCR-ABL1 transcript quantification requires harmonization across laboratories worldwide. A network of BCR-ABL1 laboratories, that regularly undergo standardization and annual external quality controls, has been created in the Czech Republic since 2007. The progressive introduction of European LeukemiaNet recommendations for the management of CML and its molecular monitoring has increased in the increased reliability of BCR-ABL1 transcript level monitoring used for therapeutic decision making as well as the comparability of results from different laboratories.
KEY WORDS:
chronic myeloid leukaemia – BCR-ABL1 monitoring – standardization
Autoři: K. Zemanová 1; H. Žižková 1; T. Jurček 2; D. Dvořáková 2; J. Zach 1; V. Polívková 1; K. Vlčanová 1; M. Divoká 3; L. Křupková 3; K. Hrochová 4; M. Karas 5; K. Machová Poláková 1
Působiště autorů: Oddělení molekulární genetiky, Ústav hematologie a krevní transfuze, Praha 1; Centrum molekulární biologie a genové terapie, Interní hematologická a onkologická klinika, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity Brno 2; Laboratoř molekulární biologie, Hemato-onkologická klinika, Fakultní nemocnice Olomouc LF UP v Olomouci 3; Ústav klinické biochemie a diagnostiky, Fakultní nemocnice Hradec Králové 4; Molekulárně genetická laboratoř, Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň 5
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 1, p. 56-64.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Molekulární monitorování pacientů s chronickou myeloidní leukemií je v době používání inhibitorů tyrozinkináz klíčovou součástí léčebného protokolu. Zavedení postupů pro kvantifikaci transkriptů BCR-ABL1 vyžaduje harmonizaci napříč laboratořemi u nás i v zahraničí. V České republice se podařilo vytvořit stabilní síť laboratoří, které v posledních osmi letech procházejí procesem standardizace a každoročních externích kontrol kvality. Postupné zavádění doporučení pro monitorování a hodnocení léčebné odpovědi předkládaných skupinou European LeukemiaNet vede ke zvýšení spolehlivosti analýz klíčových pro klinická rozhodování a také k jednotnosti výsledků mezi laboratořemi vyjadřovaných v mezinárodním měřítku.
Klíčová slova:
chronická myeloidní leukemie – BCR-ABL1 monitorování – standardizaceMOLEKULÁRNĚ-GENETICKÁ DIAGNOSTIKA CML V LÉKAŘSKÉ PRAXI
Chronická myeloidní leukemie (CML) je klonál-ní onemocnění hematopoetické kmenové buňky spojené s translokací chromozomů 9 a 22 – t(9;22)(q34;11), která vede ke vzniku tzv. Filadelfského chromozomu (Ph chromozom) [1, 2]. Důsledkem této chromozomové aberace je vznik fúzního genu BCR-ABL1, jenž kóduje stejnojmenný chimérický onkoprotein Bcr-Abl. Tato tyrozinkináza, je pak v cytoplazmě buněk konstitutivně aktivována, čímž ovlivňuje řadu signálních drah a má zásadní vliv na leukemogenezi [3, 4].
V rámci potvrzení diagnózy je prokazována přítomnost transkriptů (mRNA) BCR-ABL1 ve vzorku krve nebo kostní dřeně pacienta, přičemž je charakterizován typ přestavby BCR-ABL1 pomocí multiplexní reverzně transkriptázové polymerázové řetězové reakce (multiplex RT-PCR) [5]. Charakterizace typu přestavby je důležitá pro následné sledování hladin transkriptů. Pokud by byla u pacienta sledována nesprávná přestavba k vydávání falešně negativních výsledků. Diagnóza je zároveň potvrzena základním cytogenetickým vyšetřením, které dále slouží k hodnocení tzv. cytogenetické odpovědi na léčbu inhibitory tyrozinkináz (TKI), především v prvních měsících léčby do doby dosažení kompletní cytogenetické odpovědi. Poskytuje také informaci o případné přítomnosti dalších chromozomálních abnormalit, či souběžné myelodysplazie, které mají vliv na prognózu léčených pacientů [6].
Po zahájení léčby pacientů s CML pomocí (TKI) – imatinib, dasatinib, nilotinib a další) je pacient podle doporučení Evropské leukemické sítě (European LeukemiaNet, ELN) dále monitorován každé 3 měsíce [6]. Toto pravidelné sledování je založeno na měření hladiny transkriptů BCR-ABL1 s použitím RT-PCR v reálném čase (RT-qPCR) [7, 8]. Kvantitativní stanovení transkriptů BCR-ABL1 v průběhu léčby odráží množství CML leukemických buněk, a tedy míru úspěšnosti léčby TKI. Pravidelné molekulárně-genetické vyšetřování umožňuje včas zachytit selhání léčby (podle definice ELN), spojené často s rozvojem rezistence na léčbu TKI, kdy jednou z možných příčin je výskyt mutací v kinázové doméně (KD) Bcr-Abl [6]. V případě varovných příznaků či selhání léčby se podle ELN doporučení provádí laboratorní vyšetření založené na přímém sekvenování kódující oblasti BCR-ABL1. Pravidelné sledování CML pacientů pomocí molekulárně-genetických analýz je tedy zcela zásadní pro hodnocení celkové efektivity a úspěšnosti léčby TKI.
SOUČASNÁ LÉČEBNÁ DOPORUČENÍ
CML je v současné době nádorovým onemocněním, které se dá označit za úspěšně léčitelné. Přispívají k tomu následující skutečnosti:
- Cílená léčba pomocí TKI, první, druhé a už i třetí generace velmi účinně inhibuje aktivitu chimérického onkoproteinu Bcr-Abl, což vede k redukci leukemického klonu.
- Podle aktualizovaných terapeutických doporučení lze stávající léčbu každého pacienta ohodnotit a případně změnit na základě dosažených výsledků molekulárně-genetického monitorování, tabulka 1. [6].
- Systém molekulárně-genetického monitorování pa-cientů se do značné míry standardizoval, a proto existují doporučené postupy pro laboratorní vyšetření, hodnocení a interpretaci výsledků, kdy řada laboratoří vyjadřuje své výsledky v jednotné mezinárodní škále (International Scale, IS). Začínají se objevovat první referenční materiály [9]. U 99 % pacientů s CML je přítomen transkript BCR-ABL1 s přestavbou Major (b2a2, b3a2), proto byla standardizace monitorování hladiny mRNA BCR-ABL1 zaměřena na kvantifikaci této přestavby. Kvantifikace raritních přestaveb transkriptu BCR-ABL1 (např. minor – e1a2; mikro – e19a2) se řídí stejnými principy a doporučeními jako pro přestavbu Major, nicméně v současné době neexistuje mezinárodní měřítko pro jednotné vyjadřování hladiny mRNA BCR-ABL1 s raritními přestavbami.
Tab. 1. Definice odpovědí na léčbu TKI v první linii se zaměřením na hodnocení hladiny BCR-ABL1 transkriptů 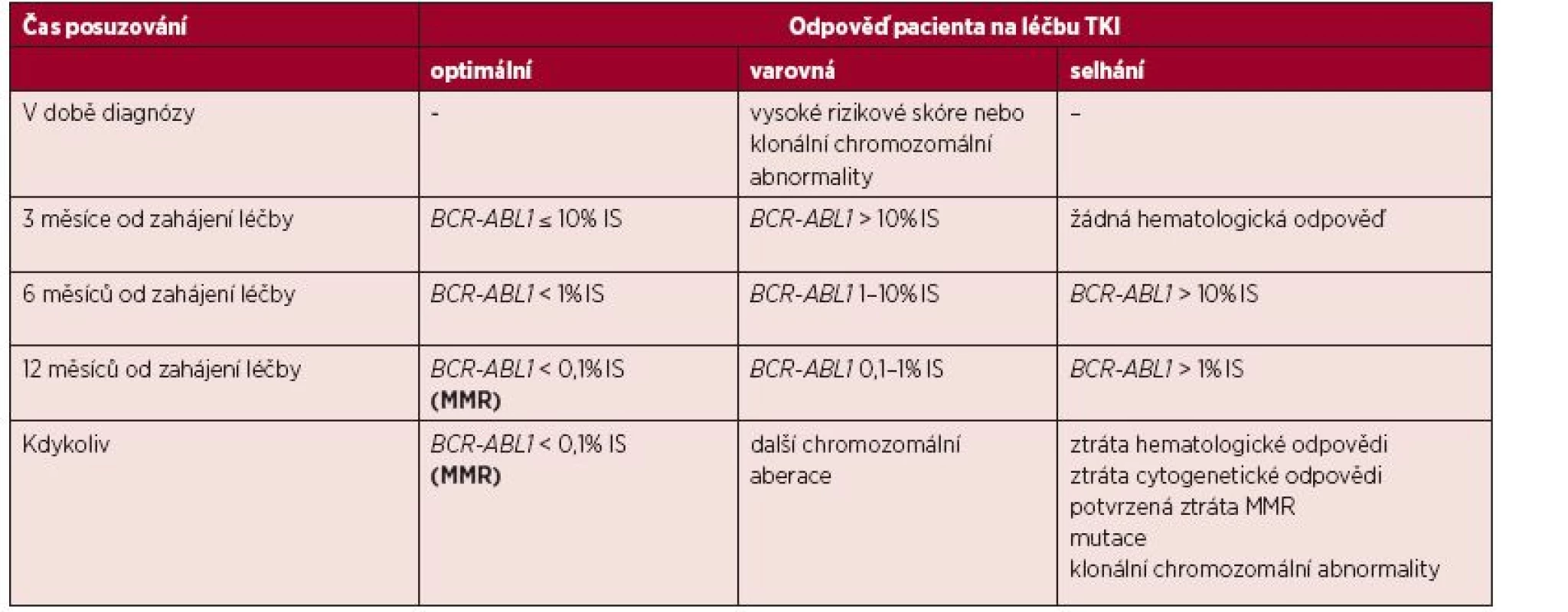
(Upraveno podle Baccarani et al., 2013; hodnocení cytogenetické odpovědi tato tabulka nezobrazuje.) Definice odpovědí na léčbu TKI jsou určeny pro pacienty v chronické fázi CML, v akcelerované fázi i blastickém zvratu a jsou aplikovatelné na prvoliniovou léčbu a druholiniovou léčbu, která byla nasazena pro intoleranci. Pokud pacient odpovídá v daném časovém intervalu od diagnózy optimálně, není důvod pro změnu léčby a pacient je nadále monitorován, ideálně à 3 měsíce. Pokud je podle naměřené hladiny transkriptu BCR-ABL1 (nebo výsledku cytogenetického, popř. hematologického vyšetření) pacient v kategorii selhání, je to důvodem ke změně léčby. Před změnou léčby by měl být pacient vyšetřen na přítomnost mutací v kinázové doméně genu BCR-ABL1. Výsledek tohoto vyšetření může napomoci k výběru tyrozinkinázového inhibitoru pro další linii léčby. Pacienti vykazující hodnoty v rozsahu varovné odpovědi by měli být pod zvýšenou pozorností lékaře a jejich monitorování by mělo být častější. Výsledky přepočtené do IS by měly zajistit, že se měření pacientských vzorků neodchyluje od měření ostatních standardizovaných laboratoří, respektive od měření laboratoře referenční. Na druhou stranu je třeba vnímat variabilitu analýz, která odpovídá mnohastupňovému procesu od zpracování primárního vzorku (nejčastěji periferní krve) až po konečný výpočet výsledku. Variabilita měření stoupá s klesající hladinou BCR-ABL1 ve vzorku. Nejistoty měření jsou vypočteny na základě testování reprodukovatelnosti, přičemž toto testování by mělo být v rámci validace metody provedeno každou laboratoří (určitému rozmezí hodnot hladiny transkriptů BCR-ABL1 pak odpovídá příslušný interval, v němž je daný výsledek považován za správný). V případě, že si lékař není jistý, jak posoudit např. hraniční aktuální výsledek pacienta v daném období, je vhodné měření hladiny transkriptů BCR-ABL1 zopakovat mimo interval běžného monitorování.
ZÁSADY PRO KVANTIFIKACI HLADIN TRANSKRIPTŮ BCR-ABL1
Preanalytická fáze vyšetření se skládá z několika kroků. Začíná zpracováním primárního vzorku periferní krve (popř. i kostní dřeně) pacienta, kdy je pomocí lyzačního roztoku připraven z celkových leukocytů buněčný lyzát. Jako lyzační agens se používají různé roztoky, např. Trizol® (Invitrogen), RLT – Rneasy Lysis Buffer (Qiagen), ITG – Guanidine Isothiocyanate (Thermofisher). Od jejich použití se odvíjí způsob izolace celkové RNA. Celková RNA (nesoucí mimo jiné mRNA) se pak pomocí reverzní transkriptázy přepíše do tzv. komplementární DNA (cDNA), která je výchozím templátem pro vlastní kvantitativní PCR. Analytická fáze, tedy RT-qPCR, probíhá s použitím různých přístrojů (Qiagen, Thermo Fisher Scientific, Bio-Rad, Roche, atp.). Aby se ve výsledku zohlednila účinnost pre-analytické fáze, měří se ve stejném množství vzorku cDNA nejen počet kopií fúzního transkriptu BCR-ABL1, ale také počet kopií transkriptu referenčního genu. Vhodný referenční gen je ten, který je v analyzovaných buňkách exprimován se stálou intenzitou a stabilitou a nejedná se o pseudogen. Jako referenční gen se pro vyšetření BCR-ABL1 ve většině světových laboratoří používá ABL1, GUSB, případně BCR [10]. Kopie fúzního i kontrolního genu se detekují zpravidla ve dvou nebo třech paralelách v jedné analýze RT-qPCR. Výsledná hodnota, která je poskytována lékařům na výsledkovém protokolu, je podle nejnovějšího doporučení ELN poměr součtu kopií transkriptu fúzního genu BCR-ABL1 a součtu kopií transkriptů referenčního genu ve všech paralelách daného vzorku [11].
Nejednotný výběr kontrolního genu, použitá přístrojová platforma a různý způsob přípravy templátu jsou zdrojem vysoké variability v měření mezi laboratořemi. Stejný vzorek pak může být v jedné laboratoři změřen s výsledkem až desetinásobně rozdílným oproti měření v jiné laboratoři. Na základě těchto možných diskrepancí v měření je nutností, aby metodika vyšetření hladin BCR-ABL1 transkriptů procházela procesem standardizace.
HISTORIE STANDARDIZACE MONITOROVÁNÍ HLADIN BCR-ABL1 S PŘESTAVBOU MAJOR U PACIENTŮ S CML: OD KLINICKÉ STUDIE IRIS PO SOUČASNOST
První velkou randomizovanou studií, která ukázala význam standardizovaného monitorování pro klinickou praxi, byla studie IRIS (The International Randomized Study of Interferon and STI571) [12]. Ve studii byly porovnávány dva léčebné postupy, podávání interferonu alfa (IFNα)/cytarabinu vs. podávání imatinibu, vůbec prvního použitého tyrozinkinázového inhibitoru, který představoval průlomovou terapii CML. Výsledky studie ukázaly obrovskou účinnost imatinibu u nově diagnostikovaných pacientů s CML v chronické fázi. Hodnocení léčebné odpovědi srovnávaných terapeutických postupů bylo prováděno na úrovni hematologické a cytogenetické. Jakmile pacient dosáhl úplné cytogenetické odpovědi (tj. 0/minimálně 20 mitotických jader v metafázi buněk kostní dřeně pozitivních na Ph chromozom), bylo nutné jej monitorovat na bázi molekulárně-genetické. Měření hladin transkriptů BCR-ABL1 se v rámci studie IRIS prováděla pouze ve třech laboratořích, které své metodiky sjednotily (Adelaide, AUS; Seattle, USA a Londýn, UK) [13]. Díky této studii stoupl význam kvantifikace transkriptů BCR-ABL1, především pro přesné hodnocení tzv. velké molekulární odpovědi (Major Molecular Response, MMR) odpovídající hladině 0,1 % BCR-ABL1 mRNA, která slouží jako klíčový molekulární marker úspěšné odpovědi na léčbu. Tato hodnota byla v rámci IRIS studie klasifikovaná jako pokles hladiny mRNA BCR-ABL1 o tři řády od hodnoty standardizované základní hladiny 100 %, která byla vypočtena jako medián hladin transkriptů BCR-ABL1 s přestavbou Major u 30 vzorků pacientů v době diagnózy naměřených ve všech třech laboratořích [13, 14].
V roce 2003 byl v rámci programu Europe Against Cancer (EAC) sestaven standardní protokol vhodný pro kvantifikaci BCR-ABL1 pomocí RT-qPCR [10]. Tato doporučení pro optimalizaci postupu vyšetření vznikla na základě testování vlastností vybraných referenčních genů, validace setů připravených primerů, hydrolyzačních sond a plazmidových standardů pro generování standardních křivek umožňujících výpočet množství kopií referenčního a BCR-ABL1 genu [15].
Nejvýznamnější událostí v procesu standardizace metodiky byl mezinárodní sjezd expertů konaný v National Institutes of Health (NIH) v Bethesdě v roce 2005 [16]. Zde bylo navrženo, aby hladina transkriptů BCR-ABL1 byla vyjadřována v mezinárodní škále ukotvené na dvou hodnotách ustavených v rámci studie IRIS: standardizovaná vstupní hladina BCR-ABL1 (100 % IS) a standardizovaná hodnota MMR odpovídající hladině transkriptů BCR-ABL1 0,1 % IS. Doporučená citlivost metodik byla stanovena na hladinu minimálně 0,01 % BCR-ABL1 (IS) odpovídající 4řádovému poklesu hladiny od standardizované vstupní hladiny. Cílem bylo harmonizovat lokální metodiky laboratoří v rámci mezilaboratorní standardizace, čehož mělo být dosaženo výměnou referenčních materiálů s hodnotami změřenými v centrální referenční laboratoři. Na základě těchto kroků bylo doporučeno vytvořit dostatečné množství referenčních materiálů pro kontroly kvality standardizovaných protokolů monitorování BCR-ABL1 [16].
Pod záštitou ELN byl v roce 2007 zahájen projekt EUTOS for CML (The EUropean Treatment Outcome Study for CML), který mezi své hlavní úkoly zařadil vytvoření standardizované metodiky pro monitorování hladiny BCR-ABL1 na molekulární úrovni a vybudování sítě referenčních laboratoří v každé z evropských zemí. Standardizace molekulárního monitorování a srovnávání dat se ujaly laboratoře v Institute of Medical and Veterinary Science v Adelaide v Austrálii, Medizinische Fakultät, University of Heidelberg v německém Mannheimu a National Genetics Reference Laboratory (Wessex) v Salisbury (UK) (17). V roce 2007 proběhlo mezinárodní testování variability měření hladin transkriptů BCR-ABL1 v 39 laboratořích ze 14 evropských zemí a současně byl jako externí kalibrátor/standard testován připravený plazmid pME-2 nesoucí sekvence současně pro geny BCR-ABL1, ABL1 a GUSB. Testování poskytlo základ pro další harmonizaci postupů při použití rozdílných protokolů pro preanalytickou a analytickou fázi a pro vytvoření mezinárodního standardu [8].
V roce 2008 bylo za účasti 57 evropských laboratoří zahájeno testování, v němž byla ve dvou krocích ověřena funkčnost metodik a vypočten nejprve preliminární a později také validovaný konverzní faktor (CF) pro vyjadřování výsledků v IS. Výsledky potvrdily, že pomocí CF lze do značné míry sjednotit výsledky rozdílných analytických postupů [18]. Současně s reportováním výsledků v IS byl vyzdvihnut význam externích i interních kontrol kvality, určení přesnosti a reprodukovatelnosti metod a nutnost odlišení analytické variability měření od klinicky relevantních změn [19].
Procedura validace a revalidace CF je finančně i časově náročná a je dostupná jen pro omezený počet laboratoří, protože pro laboratoře je problematické získat potřebné množství vhodných vzorků pro testování. Také je otázkou, jak často CF opakovaně validovat, jak postupovat v případě laboratoří, jejichž RT-qPCR metodika nesplňuje stanovené parametry analýzy (linearita měření, dostatečný počet kopií kontrolního genu, citlivost) atp. [19, 20]. V současné době jsou již definovány všechny kroky analýzy, tj. od přípravy templátu přes podmínky provedení RT-qPCR, až po vyhodnocení výsledků a jejich dokumentace v IS [11, 15]. Důležité aspekty jsou shrnuty v následujícím přehledu:
1. Preanalytická fáze
- Uchování primárního vzorku v lednici do provedení izolace (optimálně do 48 hodin) a stabilizace leukocytů.
- Zachování maximální kvality celkové RNA při/po izolaci.
- Volba vhodné reverzní transkriptázy a optimální množství RNA vstupující do reverzní transkripce.
2. Analytická fáze
- Optimální množství cDNA vstupující do RT-qPCR.
- Použití doporučených primerů a sond pro BCR-ABL1 a referenční geny ABL1, GUSB, BCR.
- Validovaný přístroj pro qPCR.
3. Vyhodnocení RT-qPCR analýzy
- Kontrola bez templátu (NTC = No Template Control) nesmí překročit prahovou hodnotu (angl. threshold), která je hraniční pro záznam detekce nárůstu fluorescence, tj. amplifikace cílové sekvence.
- Hranice pozitivity BCR-ABL1 je určena: Ct vzorku ≤ Ct (intercept) + 1.
- V případě detekovaného počtu kopií < 3 je nutné hodnoty extrapolovat na počet kopií 3.
- Minimální počet kopií referenčního genu v každém replikátu musí být v případě ABL1 ≥ 10 000 a GUSB ≥ 24 000.
- Počty kopií v replikátech se sčítají.
- Použití validovaného CF pro přepočet výsledku do IS.
- Hodnocení výsledku v IS z hlediska hloubky molekulární odpovědi (MR).
- Výsledek je součet kopií BCR-ABL1/součet kopií ABL1 (respektive GUSB). CF 100 %.
Pro kalibraci měření v IS je v dnešní době k dispozici komerčně dostupný referenční materiál ERM-AD623a-f (9). Jde o sadu plazmidových standardů nesoucích současně sekvence pro geny BCR-ABL1, ABL1, BCR a GUSB a může být používán přímo pro diagnostické analýzy vzorků cDNA nebo nepřímo pro kalibraci lokálního plazmidového standardu.
VZNIK SÍTĚ CERTIFIKOVANÝCH LABORATOŘÍ PRO STANDARDIZOVANÉ MONITOROVÁNÍ BCR-ABL1 S PŘESTAVBOU MAJOR V ČR
V roce 2006 začalo Oddělení molekulární genetiky Národní referenční laboratoře pro DNA diagnostiku (NRL), při Ústavu hematologie a krevní transfuze (ÚHKT) v Praze, ověřovat svoji odbornou způsobilost pomocí mezilaboratorních porovnávacích zkoušek (MPZ) na mezinárodní úrovni. V roce 2007 se na workshopu České leukemické skupiny pro život CELL diskutovalo o myšlence vytvoření sítě BCR-ABL1 laboratoří v ČR. NRL ÚHK byla navržena skupina odborníků CELL jako koordinátor MPZ a standardizace molekulárního monitorování pacientů s CML pro Českou republiku na zasedání ELN v roce 2008. V témže roce získala NRL ÚHKT od ELN referenční laboratoře (Scientific Laboratory, III. Medizinische Klinik; Medizinische Fakultät Mannheim der Universität Heidelberg, Mannheim, Německo) revalidovaný CF k vyjadřování výsledků v IS. Současně NRL ÚHKT požádala Český institut pro akreditaci, o. p. s. (www.cia.cz) o statut pilotního pracoviště provádějícího MPZ v oblasti kvantifikace transkriptů BCR-ABL1. Již v roce 2008 proběhlo první mezilaboratorní porovnávání. MPZ je nabízeno všem laboratořím v ČR poskytujícím monitorování hladiny BCR-ABL1. Tohoto procesu se již několik let pravidelně účastní 4 laboratoře, které jsou součástí velkých hematologických center v ČR (Laboratoř molekulární biologie Hemato-onkologická klinika (HOK) Fakultní nemocnice Olomouc, Centrum molekulární biologie a genové terapie Interní hematologické a onkologické kliniky (IHOK) Fakultní nemocnice Brno, Ústav klinické biochemie a diagnostiky Fakultní nemocnice Hradec Králové, Molekulárně genetická laboratoř Hematologicko-onkologické oddělení Fakultní nemocnice Plzeň. Laboratoře IHOK FN Brno a HOK FN Olomouc pravidelně získávají CF z ELN referenční laboratoře v Mannheimu, jelikož obdobně jako NRL ÚHKT úzce spolupracují v ELN projektech standardizace monitorování hladin transkriptů BCR-ABL1.
Testovací vzorky pro MPZ připravuje NRL ÚHKT postupem doporučeným v rámci mezinárodní standardizace monitorování hladin transkriptů BCR-ABL1 [20]. Stručně lze popsat, že buněčné lyzáty testovaných vzorků jsou připraveny v příslušných lyzačních roztocích tak, aby vykazovaly hladinu BCR-ABL1 řádově 10 %, 1 %, 0,1 %, 0,01 % IS. Výsledné hodnocení testovaných laboratoří se provádí na základě porovnání naměřených hodnot hladin transkriptů BCR-ABL1 zjištěných v dané testované laboratoři s hodnotami získanými v NRL ÚHKT, které jsou vyjadřovány v IS pomocí aktuálně validovaného CF. U získaných výsledků v testovaných laboratořích je hodnocena linearita měření v celém rozsahu kvantifikace (10 % – 0,01 % IS), dostatečná citlivost metody, tj. úspěšná kvantifikace vzorku s hodnotou transkriptů BCR-ABL1 odpovídající hladině 0,01 % IS, a v neposlední řadě počet kopií referenčního genu, který odráží citlivost metody v případě, že je vzorek BCR-ABL1 negativní. Pro testovanou laboratoř je stanoven orientační přepočtový koeficient, který zohledňuje odchýlení měření vzhledem ke standardizovaným výsledkům NRL. Laboratoře, které splní kritéria MPZ, mohou přistoupit k validaci CF, kterou jim zajistí referenční laboratoř. Validace CF pro vyjadřování hodnot BCR-ABL1 v mezinárodní stupnici spočívá v jeho stanovení a ověření na souboru 20–30 reálných vzorků CML pacientů, které jsou paralelně analyzovány v lokální a referenční laboratoři podle instrukcí ELN [20]. Vzorky by měly svou hladinou transkriptů BCR-ABL1 rovnoměrně pokrýt škálu od 10 do 0,01 % IS. Validovaný CF by měl být každoročně revalidován.
Orientační přepočtové koeficienty jednotlivých laboratoří v ČR vypočtené na základě výsledků MPZ od roku 2008 shrnuje tabulka 2. Jak je patrné, orientační přepočtové koeficienty, vyjadřující systematické odchýlení naměřených výsledků od výsledků NRL ÚHKT, vyjádřených v IS se s časem stále více přibližují hodnotě 1, tedy hodnotě naměřené NRL ÚHKT. V průběhu mezilaboratorního porovnávání se úpravami postupů v preanalytické fázi ve smyslu přiblížení se doporučovaným a ověřeným metodikám dařilo zvyšovat kvalitu izolované RNA a syntetizované cDNA, což vedlo ke zpřesnění výsledků a zvýšení citlivosti metod.
Tab. 2. Orientační přepočtové koeficienty odrážející odchylku měření hladiny BCR-ABL1 transkriptů testovaných laboratoří od NRL 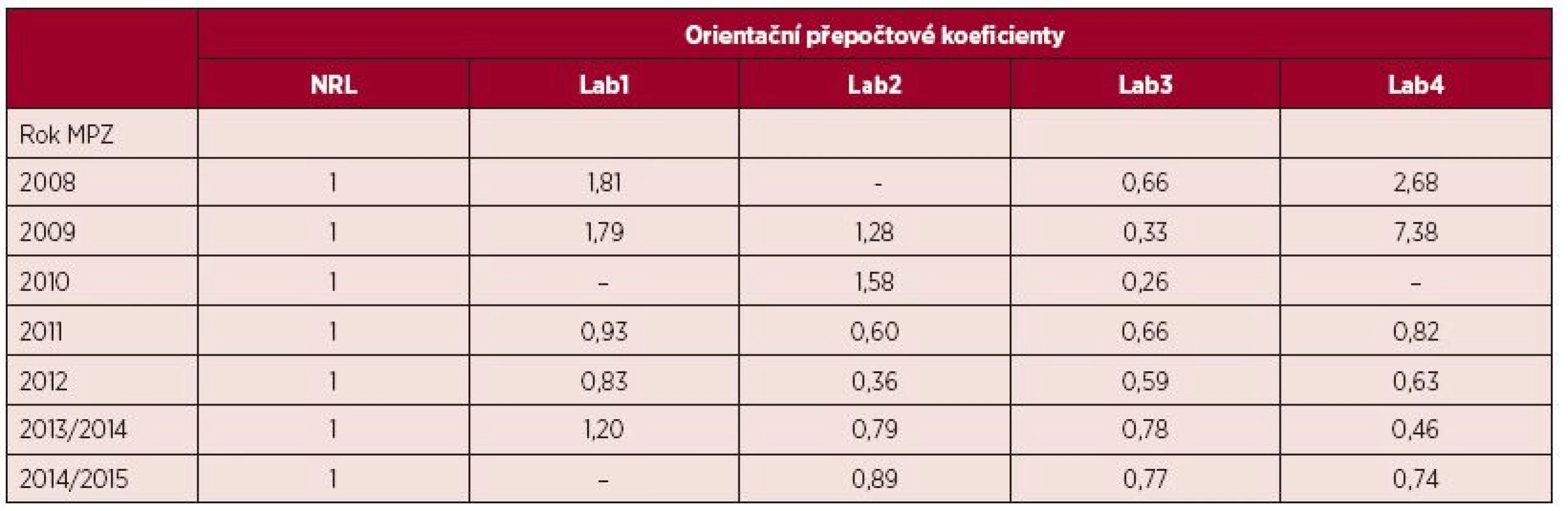
Poznámka: Laboratoře NRL a Lab1-Lab4 jsou součástí hematologických center. MPZ – mezilaboratorní porovnávání zkoušek, NRL – národní referenční laboratoř Úloha NRL ÚHKT v ČR nespočívá jen v provádění a hodnocení MPZ, ale pomáhá také vyřešit konkrétní úskalí metodik zúčastněných laboratoří a poskytuje jim podporu např. v podobě školení. Jednou za dva roky pořádá NRL ÚHKT pod záštitou CELL a České hematologické společnosti odborný workshop (www.workshopcml.cz) s aktuální tematikou monitorování transkriptů BCR-ABL1 a detekce mutací v kinázové doméně BCR-ABL1, na němž přednáší odborníci z České republiky i ze zahraničí.
DEFINICE A TESTOVÁNÍ HLUBOKÉ MOLEKULÁRNÍ ODPOVĚDI
Zavedením TKI 2. generace (dasatinib, nilotinib) začalo docházet k rychlejšímu a efektivnějšímu dosahování hlubších molekulárních odpovědí pod úrovní MMR u většího počtu pacientů [11]. V rámci klinických studií bylo testováno přerušení léčby TKI (po minimálně 3 letech léčby) u pacientů s dlouhodobou hlubokou MR a první výsledky ukázaly, že u některých pacientů hluboká MR přetrvává i bez léčby TKI [21, 22]. Studie EURO-SKI (European LeukemiaNet Stop Tyrosin Kinase Inhibitor study) se zabývá hledáním prognostických markerů, které by indikovaly, že po vysazení TKI pacienti trvale zůstanou v hluboké MR [23].
Hladinu transkriptů BCR-ABL1 je třeba v případě hluboké MR měřit s vyšší citlivostí (do hloubky minimálně MR4.5 odpovídající 0,0032 % IS BCR-ABL1) a vytvořit standardizovanou a funkční definici této odpovědi. Od termínu kompletní molekulární odpověď (CMR, Complete Molecular Response) se již upustilo. Úroveň hluboké molekulární odpovědi je definována podle počtu řádů poklesu hladin transkriptů BCR-ABL1 od IRIS standardizované hranice 100 % IS následovně:
- MR4.0: pokles o ≥ 4 řády od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,01 % IS BCR-ABL1, nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci ≥ 10 000 kopií ABL1, respektive ≥ 24 000 kopií GUSB v každé z testovaných paralel.
- MR4.5: pokles o ≥ 4,5 řádů od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,0032 % IS BCR-ABL1, nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci součtu ≥ 32 000 kopií ABL1, respektive ≥ 77 000 kopií GUSB.
- MR5.0: pokles o ≥ 5,0 řádů od IRIS standardizované hranice, tj. buď detekovatelná choroba na hladině ≤ 0,001 % IS BCR-ABL1, nebo nedetekovatelná choroba (0 kopií BCR-ABL1) při detekci součtu ≥ 100 000 kopií ABL1, respektive ≥ 240 000 kopií GUSB.
Citlivost metody je úměrná počtu kopií referenčního genu naměřeného v analyzovaném množství templátu cDNA a souvisí tedy s kvantitou a kvalitou RNA a cDNA. Citlivost lze zvyšovat úpravou diagnostického postupu, např. přípravou koncentrovanějšího lyzátu leukocytů, zvýšením kvality izolované RNA, použitím efektivnější reverzní transkriptázy či úpravou množství cDNA v RT-qPCR reakci. Aby bylo možné výsledek vyjádřit jako MR příslušné úrovně, je nutné dosáhnout definované hodnoty součtu kopií kontrolního genu, a to jak v případě vzorku negativního na BCR-ABL1, tak v případě jeho pozitivity [11]. Dále byla definována kritéria hraničních hodnot pozitivity vzorku, pravidla pro negativní kontroly a NTC, hranice pro počty kopií referenčního genu. Při nesplnění jednotlivých kritérií či pravidel není výsledek validní [11].
Schopnost laboratoří dosahovat použitím lokálních metodik úroveň MR4.0, MR4.5, případně MR5.0 byla testována v rámci projektu EUTOS for CML v součinnosti s klinickou studií ENEST1st a vybranými EUTOS laboratořemi [20, 24, 25]. V roce 2014 proběhlo již třetí testování v rámci „EUTOS MR4.5 trial Evaluation Performance“ a certifikát o tom, že laboratoř je schopna detekovat MR4.5 u vysokého podílu vzorků, obdrželo téměř 80 % zúčastněných laboratoří.
Nadějnou metodou pro citlivé a vysoce přesné měření MR je metoda digitální PCR (dPCR), jejíž předností je absolutní kvantifikace bez nutnosti použití referenčních materiálů či standardů a vysoká citlivost umožňující přesně kvantifikovat zbytkové množství sledovaného genu či transkriptu. Podstatou dPCR je rozdělení reakční směsi na stovky až miliony dílčích vzorků o nano - až pikolitrových objemech. Z analýz lze vypočítat počet kopií cílového genu na 1 μl objemu.
ZÁVĚR
Kvantifikace hladin BCR-ABL1 transkriptů je nedílnou a důležitou součástí sledování efektivity léčby pacientů s CML. Ošetřující lékař podle výsledků monitorování BCR-ABL1 vyhodnocuje odpověď pacienta na léčbu a v případě nutnosti reaguje úpravou terapie. Laboratoře, které nabízejí vyšetřování kvantifikace BCR-ABL1 transkriptů, by měly splňovat podmínky nutné pro klinicky relevantní vydávání výsledků. Těmito podmínkami se rozumí: používání standardizované metodiky podle publikovaných doporučení, pravidelná účast v externích zkouškách způsobilosti u příslušné certifikované referenční laboratoře a existence validovaného konverzního faktoru CF pro vydávání výsledků v mezinárodním měřítku IS. V České republice se podařilo vytvořit síť certifikovaných laboratoří specializovaných na kvantitativní vyšetření BCR-ABL1, které pravidelně spolupracují s referenční laboratoří NRL pro DNA diagnostiku ÚHKT Praha. V současné době lze konstatovat, že po několikaletém období úzké spolupráce mezi jednotlivými laboratořemi se podařilo diagnostiku BCR-ABL1 transkriptů harmonizovat, což je cílem projektu „EUTOS for CML“, českých odborných konsorcií CELL a CAMELIA, a všech hematologických center v ČR.
Doporučená literatura
Cross NCP, White HE, Colomer D, et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leukemia 2015; 29 : 999–1003; doi: 10.1038/leu.2015.29; Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of CML. Blood 2013; 122 : 872–874; White H, Deprez L, Corbisier P, et al. A certified plasmid reference material for the standardisation of BCR–ABL1 mRNA quantification by real-time quantitative PCR Leukemia 2015; 29 : 369–376; doi:10.1038/leu.2014.217
Seznam použitých zkratek
cDNA – komplementární DNA
CELL – Czech Leukemia Study Group – for Life, Česká leukemická skupina pro život
CF – conversion factor, přepočtový koeficient
CML – chronická myeloidní leukemie
CMR – complete molecular response, kompletní molekulární odpověď
dPCR – digitální PCR
EAC – Europe Against Cancer, Evropa proti rakovině
ELN – European LeukemiaNet, Evropská leukemická síť
EUTOS – The European Treatment Outcome Study
IS – international scale, mezinárodní měřítko
KD – kinázová doména
MMR – major molecular response, velká molekulární odpověď
MPZ – mezilaboratorní porovnávání zkoušek
MR – molecular response, molekulární odpověď
NIH – National Institutes of Health, Národní ústav zdraví
NRL – Národní referenční laboratoř
Ph chromozom – Filadelfský chromozom
RT-PCR – reverzně transkriptázová polymerázová řetězová reakce
RT-qPCR – reverzně transkriptázová kvantitativní PCR v reálném čase
TKI – tyrozinkinázový inhibitor
Podíl autorů na přípravě rukopisu
ZK – příprava první verze rukopisu
ŽH – hodnocení dat, podíl na psaní rukopisu, úprava revidované verze rukopisu, souhlas s finální verzí
DD – kritická revize, souhlas s finální verzí
VK – příprava testovacích materiálů, kritická revize, úprava revidované verze rukopisu, souhlas s finální verzí
JT, DM, KL, HK, ZJ, PV – provádění analýz, kritická revize, souhlas s finální verzí
KM – evaluace dat, kritická revize, souhlas s finální verzí
MPK – koncept rukopisu, kritická revize, úprava revidované verze rukopisu, souhlas s finální verzí rukopisu
Poděkování
Poděkování patří pracovníkům Oddělení molekulární genetiky ÚHKT za jejich neúnavnou práci a též všem laboratořím kooperujícím v rámci standardizace monitorování BCR-ABL1 v ČR. Poděkování patří rovněž pracovním skupinám CELL a CAMELIA. Tato práce byla podpořena projektem MZČR pro koncepční rozvoj výzkumné organizace 00023736.
Věnování
Tento článek věnujeme památce naší drahé kolegyně a kamarádky Janě Karavdič, která zásadním způsobem stála u zrodu pořádání mezilaboratorního porovnávání zkoušek pro monitorování BCR-ABL1 v ČR a u vytvoření a zavedení systému pro pořádání MPZ v naší Národní referenční laboratoři pro DNA diagnostiku, Oddělení molekulární genetiky, ÚHKT.
Kolektiv pracovníků Oddělení molekulární genetiky, ÚHKT
Čestné prohlášení autorů
MPK – Novartis – grant podporující přípravu testovacích materiálů pro standardizaci kvantifikace hladin BCR-ABL1 transkriptů.
Doručeno do redakce dne 28. 12. 2015.
Přijato po recenzi dne 28. 1. 2016.
Mgr. Kateřina Machová Poláková, Ph.D.
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: katerina.machova@uhkt.cz
Zdroje
1. Nowel PC, Hungerford DA. A minute chromosome in human granulocytic leukemia. Science 1960; 132 : 1497.
2. Rowley JD. Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 1973; 243 : 290–293.
3. Van Etten R, Jackson P, Baltimore D. The mouse type IV c-abl gene product is a nuclear protein, and activation of transforming ability is associated with cytoplasmic localization. Cell 1989; 58(4): 669–678.
4. Nichols GL, Raines MA, Vera JC, Lacomis L, Tempst P and Golde D. Identification of CRKL as the constitutively phosphorylated 39-kD tyrosine phosphoprotein in chronic myelogenous leukemia cells. Blood 1994; 84(9): 2912–2918.
5. Cross NCP, Melo JV, Feng L, Goldman JM. An optimized multiplex polymerase chain reaction (PCR) for detection fusion mRNAs in haematological disorders. Leukemia 1994; 8(1): 186–189.
6. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of CML. Blood 2013; 122 : 872–874.
7. Silvy M, Mancini J, Thirion X, Sigaux F, Gabert J. Evaluation of real-time quantitative PCR machines for the monitoring of fusion gene transcripts using the Europe against cancer protocol. Leukemia 2005; 19 : 2305–2307.
8. Muller MC, Erben P, Saglio G, et al. Harmonization of BCR-ABL mRNA quantification using a uniform multifunctional control plasmid in 37 international laboratories. Leukemia 2008; 22 : 96–102.
9. White H, Deprez L, Corbisier P, et al. A certified plasmid reference material for the standardisation of BCR–ABL1 mRNA quantification by real-time quantitative PCR.Leukemia 2015; 29 : 369–376.
10. Beillard E, Pallisgaard N, van der Velden VHJ, et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using „real-time“ quantitative reverse - transcriptase polymerase chain reaction (RQ PCR) – a Europe Against Cancer Program. Leukemia 2003; 17 : 2474–2486.
11. Cross NCP, White HE, Colomer D, et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leukemia 2015; 29 : 999–1003.
12. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348 : 994–1004.
13. Hughes TP, Kaeda J, Branford S, et al. Frequency of major molecular response to imatinib or interferon alfa plus cytarabin in newly diagnosed CML. N Engl J Med 2003, 349 : 1423–1432.
14. Druker BJ, Guilhot F, O’Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408–2417.
15. Gabert J, Beillard E, van der Velden VHJ et al. Standardization and quality control studies of „real-time“ quantitative reverse polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia – A Europe Against Cancer program. Leukemia 2003; 17 : 2318–2357.
16. Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with TKIs, Blood 2006; 108 : 28–37.
17. Branford S, Cross NCP, Hochhaus A, et al. Rationale for the recommendations for harmonizing current methodology for detecting BCR-ABL transcripts in patients with chronic myeloid leukemia. Leukemia 2006; 20 : 1925–1930.
18. Müller MC, Cross NCP, Erben P, et al. Harmonization of molecular monitoring of CML therapy in Europe. Leukemia 2009; 23 : 1957–1963.
19. Branford S, Fletcher L, Cross CP, et al. Desirable performance characteristics for BCR-ABL measurement on an international reporting scale to allow consistent interpretation of individual patient response and comparison of response rates between clinical trials, Blood 2008; 112 : 3330–3338.
20. Cross NCP, White HE, Müller MC, Saglio G and Hochhaus A. Standardized definitions of molecular response in chronic myeloid leukemia. Leukemia 2012; 26 : 2172–2175.
21. Mahon FX, Rea D, Guilhot J, et al. Discontinuation of imatinib in patients with CML who have maintained complete molecular remission for at least two years (STIM trial). Lancet Oncol 2010; 11 : 1029–1035.
22. Legros L, Rousselot P, Giraudier S, et al. Second attempt to discontinue imatinib in CP-CML patients with a second sustained complete molecular response. Blood 2012; 12(9): 1959–1960.
23. https://clinicaltrials.gov/ct2/show/NCT01596114.
24. Giles FJ, Rosti G, Ossenkoppele G, et al., Phase IIIb multicentre open-label study of nilotinib in adult patients with newly diagnosed BCR-ABL1 positive CML in chronic phase: A European Clinical Initiative with EUTOS Collaboration for Standardization of Molecular Remission. Blood 2011; 118 : 1186–1187.
25. https://clinicaltrials.gov/ct2/show/NCT01061177.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
- Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinemie
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s vrozenou hemofilií a s inhibitorem FVIII/FIX
- Úvodník
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Výběr z tisku a zprávy o knihách
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Prognostické faktory u chronické myeloidní leukemie: můžeme kombinací získat více?
- Chronická myeloidní leukemie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií
- Analýza vztahu poměru volných lehkých řetězců (FLC-r, FreeliteTM), párů těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM) v séru a výsledků multiparametrické průtokové cytometrie plazmocytů k „progression free survival“u mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



