-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
Klener P.: Use of monoclonal antibodies for anticancer therapy
Monoclonal antibody-based therapeutic approaches have a significant impact in the treatment of hematologic malignancies and solid tumors. Rituximab in conjunction with chemotherapy is now standard treatment for follicular lymphoma, chronic lymphocytic leukemia and diffuse large B-cell lymphoma. Furthermore, based on our knowledge of antigen expression on the surface of lymphoma cells has led to development of the other monoclonal antibodies. Those, in clinical use or in clinical trials are shortly described. Similarly many monoclonal antibodies have been introduced for the treatment of solid tumors. These are directed against different targets such as growth factors (e.g. bevacizumab) or against the extracellular domain of epidermal growth factor (i.e. trastuzumab, cetuximab). For improving therapeutic efficacy, conjugated antibodies have been developed. Antibodies conjugated with radioisotopes (90Y), cytotoxic drugs (calicheamycin) or toxins (estafenatox) are used or are under investigation. Knowledge gained from molecular and cellular biology over past decades has driven the development of a new generation of monoclonal antibodies (bispecific/trifunctional antibodies, diabodies, peptibodies, intrabodies, immunocytokines).
Key words:
monoclonal antibodies, mechanism of action, monospecific antibodies, conjugated antibodies, bispecific antibodies, antibodies of new generation.
Autoři: P. Klener
Působiště autorů: 1. interní klinika 1. LFUK (VFN) a ÚHKT Praha
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 1, p. 6-11.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Využití monoklonálních protilátek významně obohatilo možnosti léčby hematologických malignit i solidních nádorů. Rituximab v kombinaci s chemoterapií se stal standardním léčebným postupem u folikulárních lymfomů, chronické lymfocytární leukemie a difuzního velkobuněčného lymfomu. Znalost exprese povrchových antigenů na lymfomových buňkách umožnilo konstrukci většího počtu dalších monoklonálních protilátek. Je uvedena charakteristika používaných nebo zkoušených protilátek. Podobně jsou zaváděny monoklonální protilátky i k léčbě solidních nádorů. Jsou směrovány proti různým cílovým strukturám, jako jsou růstové faktory (např. bevacizumab) nebo proti extracelulární doméně epidermálního růstového faktoru (např. trastuzumab, cetuximab). Ke zvýšení terapeutické účinnosti byly připraveny konjugované protilátky. V klinickém použití nebo testování jsou protilátky konjugované s radionuklidem (90Y), s cytostatikem (calicheamycin) nebo s toxinem (estafenatox). Prohlubující se poznatky z oblasti molekulární a buněčné biologie umožnily vývoj nové generace protilátek (bispecifické/trifunkční protilátky, diabodies, peptibodies, intrabodies, imunocytokiny).
Klíčová slova:
monoklonální protilátky, mechanismus účinku, monospecifické protilátky, konjugované protilátky, bispecifické protilátky, protilátky nové generace* * *
Monoklonální protilátky (MoAb) jsou protilátky produkované jedním klonem B-lymfocytů a vykazují tudíž shodnou antigenní specifitu. Dlouhou dobu se používaly hlavně k diagnostickým účelům. Teprve v r. 1997 povolil americký úřad pro kontrolu léčiv (FDA) klinickou aplikaci historicky první monoklonální protilátky anti-CD20 (rituximabu) k léčbě nádorového onemocnění. Od té doby jsou do klinické praxe zaváděny každoročně desítky nových MoAb k léčebným účelům (a to nejen v onkologii) a jejich celkový počet již přesáhl stovku.
I. Monospecifické MoAB
V klinické praxi se dosud používají převážně monospecifické MoAb tj. protilátky obsahující dvě identická vazebná ramena. Patří většinou do třídy IgG. (1). Mají schopnost vázat se na epitopy konkrétních povrchových nádorových antigenů či solubilních proteinů (CD20, CD33, CD40, CD52 atd.), dále na růstové faktory (VEGF), na membránové receptory (EGFR, VEGFR), či na adhezivní molekuly (EpCAM, integriny). První MoAb zaváděné do klinické praxe byly směrovány na povrchové znaky nádorových resp. lymfomových či leukemických buněk.
Mechanismus jejich účinku je znázorněn na obrázku 1. Fab fragment (antibody binding) slouží k vazbě antigenu, Fc fragment zprostředkovává vazbu a aktivaci pomocných buněk imunitního systému (makrofágů, NK-buněk). Tento mechanismus se označuje jako ADCC (antibody dependent celular cytotoxicity). Z cytotoxických buněk se uvolňuje perforin, granzym, které mají význam pro indukci apoptózy. Dalším mechanismem je aktivace komplementu (CDC – complement dependent cytotoxicity), jehož složky pak penetrují buněčnou membránu a mají cytolytický účinek. Kromě toho mají MoAb i přímý cytotoxický účinek (2).
Obr. 1. Mechanismus účinku monospecifických monoklonálních protilátek. 
Terapeutický účinek MoAb u solidních nádorů může spočívat v blokádě vazby ligandu na specifický receptor buď neutralizací ligandu (bevacizumab), nebo vazbou na extracelulární doménu receptoru (cetuximab, trastuzumab). V obou případech blokuje MoAb aktivaci příslušné signální dráhy (transdukční kaskády) a proto lze léčbu MoAb zahrnout pod širší pojem cílené léčby (3).
Používané monoklonální protilátky lze rozdělit podle jejich původu a způsobu přípravy na čistě lidské nesoucí koncovku mumab, čistě myší (momab), chimerické (ximab) nebo humanizované (zumab) (obr. 2). Praktičtější je dělení MoAb podle cílové struktury, které uvádíme v tomto sdělení.
Obr. 2. Typy monoklonálních protilátek. Skladba dle původu (myší, lidský) s uvedením příkladů. 
Protilátky proti membránovým antigenům leukocytů se používají hlavně v hematologické onkologii (tab. 1). Nejpoužívanější je chimerická MoAb anti-CD20 – rituximab (Mabthera), jejíž postavení v léčbě lymfoproliferativních onemocnění je dostatečně známé (4). V kombinaci s chemoterapií se stal rituximab zlatým standardem pro léčbu folikulárních lymfomů, chronické lymfocytární leukemie (CLL) i difuzních velkobuněčných lymfomů (DLBCL). Uplatňuje se i v udržovací léčbě folikulárních lymfomů. V současné době probíhá několik set multicentrických studií, které zkoumají možnosti jeho širšího uplatnění. Ofatumumab (Arzerra) je podobně jako rituximab protilátka IgG kapa anti-CD20, ale rozeznává epitop CD20 na odlišných místech než rituximab, což napovídá, že by mohl být účinný i u nemocných rezistentních na rituximab. Z klinických studií vyplývá jeho účinnost zejména u folikulárních lymfomů, u lymfomů z plášťové zóny (MCL) a u CLL (5). Veltuzumab je další z anti-CD20 protilátek s aktivitou u difuzních velkobuněčných lymfomů (DLBCL), epratuzumab u folikulárních NHL rezistentních na rituximab. K léčbě rezistentních NHL se doporučuje též galiximab (Primatized), chimerická protilátka anti-CD80, kterou je možno kombinovat s rituximabem. Dosud však není schválen ke klinickému použití. SGN-30 je rovněž chimerická protilátka anti-CD30, antigenu, který je exprimován na Hodgkinových a Sternbergových buňkách a na buňkách anaplastických velkobuněčných lymfomů (6). Její uplatnění se předpokládá právě u těchto onemocnění. K léčbě CLL jsou k dispozici dvě protilátky. Lumiliximab (Lucid) anti-CD23 se zdá být předurčen k terapii CLL, neboť antigen CD23 je exprimován na všech buňkách CLL. Kromě obvyklých mechanismů účinku byl prokázán stimulační účinek lumiliximabu na apoptózu, neboť snižuje expresi BCL-2 a aktivuje kaspázy. Jeho účinnost se v současné době prověřuje v klinických studiích. U rezistentních forem CLL se osvědčil alemtuzumab (MabCampath). Je účinný nejen u rezistentních forem CLL, ale používá se též k likvidaci reziduální choroby (7). Zanolimumab je čistě lidská protilátka, která se zkouší u mycosis fungoides, Sézaryho syndromu a dalších lymfoproliferací exprimujících CD4 (angioimunoblastický lymfom, T-velkobuněčný lymfom). Lintuzumab (Zamyl) (SGN33) je protilátka proti antigenu CD33 exprimovanému na povrchu buněk akutní myeloidní leukemie (AML) Protilátky anti-CD40 dacetuzumab a lucatumumab, podobně jako elotuzumab se zkouší v léčbě mnohočetného myelomu, ale jeví účinnost i u dalších lymfoproliferací (8).
Tab. 1. Protilátky proti membránovým antigenům leukocytů. 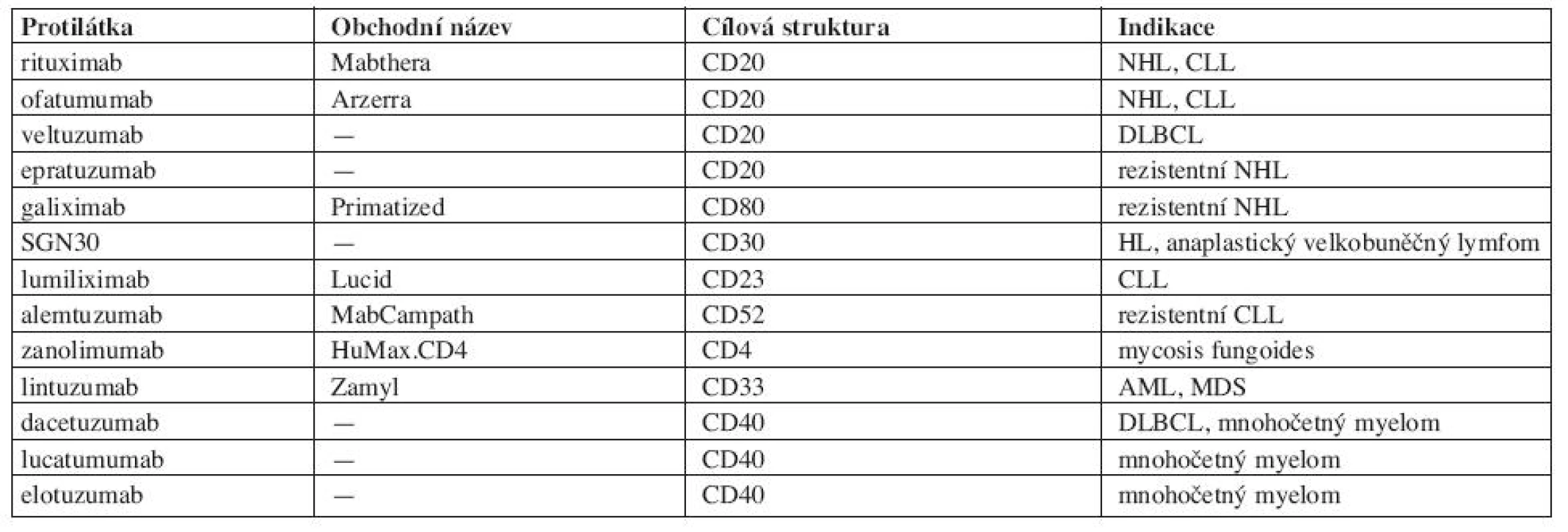
Protilátky proti receptorům rodiny EGFR/ERBB/ /HER se uplatňují především v léčbě solidních nádorů (tab. 2). Trastuzumab (Herceptin) je protilátka proti receptoru ERBB2/HER2/NEU zvýšeně exprimovaného u pacientek s karcinomem prsu, ale zvýšená exprese byla prokázána též u karcinomu prostaty a ovaria (9). Pertuzumab (Omnitarg) se váže na odlišný epitop než trastuzumab, zdá se, že má synergní účinek s trastuzumabem. Cetuximab (Erbitux) je protilátka proti extracelulární doméně receptoru pro epidermální růstový faktor (EGFR/ERBB/ /HER1). Vazba na receptor zablokuje aktivaci signálního přenosu kaskády MAPK a pAKT. Indikační podmínkou je nemutovaný stav genu KRAS u buněk nádorové tkáně (cca 60 % nemocných) V případě mutace je signální dráha trvale stimulována bez ohledu na blokádu EGFR a proto se podávání cetuximabu v těchto případech jeví jako neúčelné (10). Kromě kolorektálního karcinomu je cetuximab indikován k terapii lokálně pokročilých forem spinocelulárního karcinomu ORL oblasti. Panitumumab je protilátka s vysokou afinitou k receptoru EGFR. Má podobné indikace i podobná indikační omezení jako cetuximab. Nimotuzumab má mít omezenější nežádoucí účinky. V r. 2008 získal status „orphan drug“ (přípravek pro vzácná onemocnění) pro léčbu karcinomu pankreatu.
Tab. 2. Protilátky proti receptorům rodiny EGFR/ERBB/HER. 
Různé perspektivní a testované protilátky shrnuje tabulka 3. Kromě bevacizumabu jde většinou o protilátky, které jeví v klinickém testování protinádorovou účinnost, ale jejich přesné indikace se dosud prověřují.
Tab. 3. Různé testované protilátky. 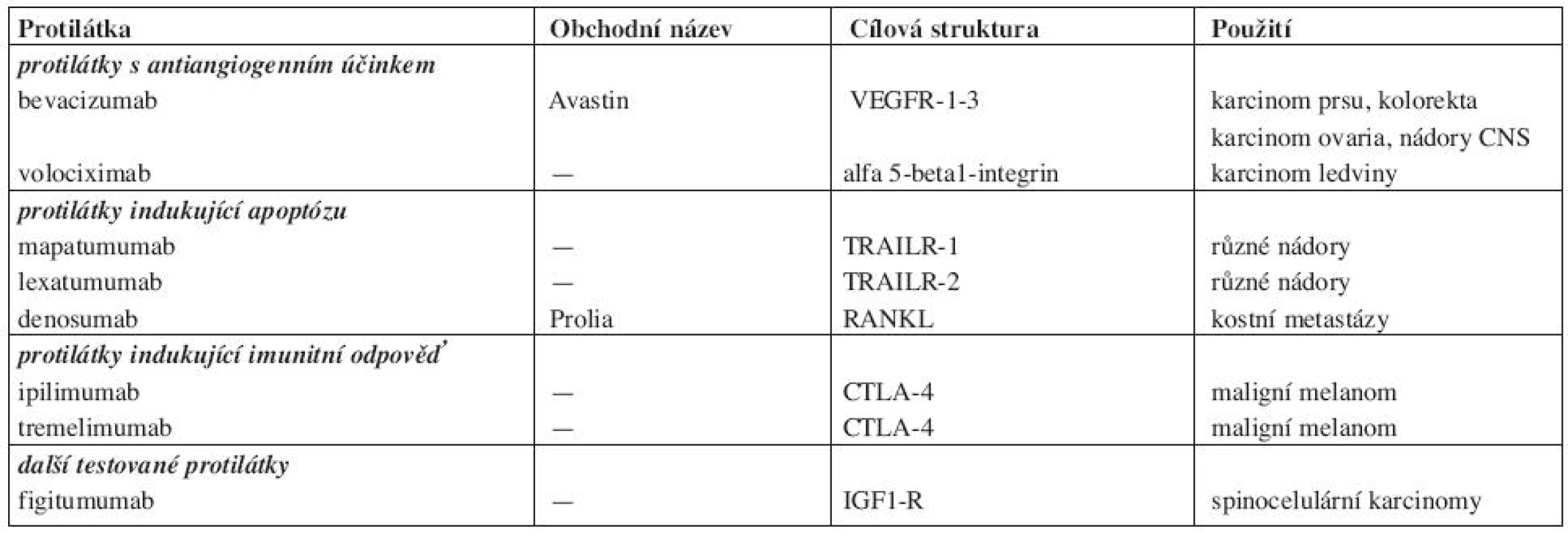
Protilátky s antiangiogenním účinkem jsou v popředí zájmu, neboť inhibice angiogeneze může významně ovlivnit růst nádoru a jeho metastazování. Nejvíce zkušeností je s neutralizační protilátkou proti ligandu VEGF, který se váže na receptory VEGFR1-3, takže jeho neutralizace komplexně blokuje novotvorbu cév v nádoru (11). Touto protilátkou je bevacizumab (Avastin). V kombinaci s chemoterapií se podává v léčbě kolorektálního karcinomu, karcinomu prsu, karcinomu plic, ledviny i nádorů CNS. Ranibizumab je fragment bevacizumabu pro nitrooční aplikaci. VEGF-trap a volociximab (protilátka proti alfa 5 beta1 integrinu) jsou předmětem klinického testování (12).
Protilátky indukující apoptózu jsou agonistické protilátky proti receptorům TRAIL R1 - a TRAIL-R2 (TRAIL = TNF related apoptosis inducing ligand) stimulují tzv. death ligandy, které vazbou na „smrtící receptory“ spouští extrinsickou (receptorovou) apoptotickou kaskádu (13). U různých nádorů se zkoušejí dvě plně lidské protilátky mapatumumab a lexatumumab. Výsledky klinických zkoušek potvrdily posílení protinádorového účinku při jejich aplikaci s chemoterapií. Denosumab je blokační protilátka anti-RANKL, která omezuje proapoptotickou aktivitu nukleárního faktoru kappa B (NFkB). Vazba RANKL na RANK totiž aktivuje signální dráhu NFkB, aktivuje osteoklasty, stimuluje jejich proliferaci a inhibuje apoptózu. Perspektivní využití je v léčbě kostních metastáz karcinomu prostaty a karcinomu prsu (14).
Protilátky indukující imunitní odpověď mohou působit jednak blokádou inhibičních molekul (např. CTLA-4) nebo stimulací kostimulačních molekul (protilátka anti 4-1BB). CTLA-4 se vyskytuje na povrchu T-lymfocytů a patří spolu s antigenem CD28 k hlavním regulárorům imunologické odpovědi. CTLA-4 tlumí imunitní odpověď a jeho blokáda protilátkou umožní dlouhodobou aktivaci a proliferaci T-lymfocytů a v ideálním případě napadení a destrukci nádorových buněk cytotoxickými T-lymfocyty (15). V současné době se zkouší dvě lidské MoAb blokující CTLA-4, a to ipilimumab (IgG1 MoAb) a tremelimumab (homologní IgG2 protilátka), obě s příznivými efekty u maligního melanomu (16).
Pozornosti se těší i další plně lidská protilátka proti IGF1R figitumumab, která se testuje v kombinaci s chemoterapií popř. s jinými MoAbs (s bevacizumabem) u nemalobuněčného karcinomu plic (NSCLC).
II. Konjugované protilátky jsou konstruovány se záměrem posílit protinádorovou účinnost. Nejčastěji se používá konjugace s radionuklidem s cytostatikem nebo s toxinem (tab. 4). Navázaná látka je protilátkou dopravena do cílové tkáně, kde pak uplatní svůj cytotoxický účinek (17). V případě navázaného radionuklidu se podle povahy zářiče cytotoxický účinek projeví i na elementech uvnitř nádorové masy.
Tab. 4. Konjugované monoklonální protilátky. 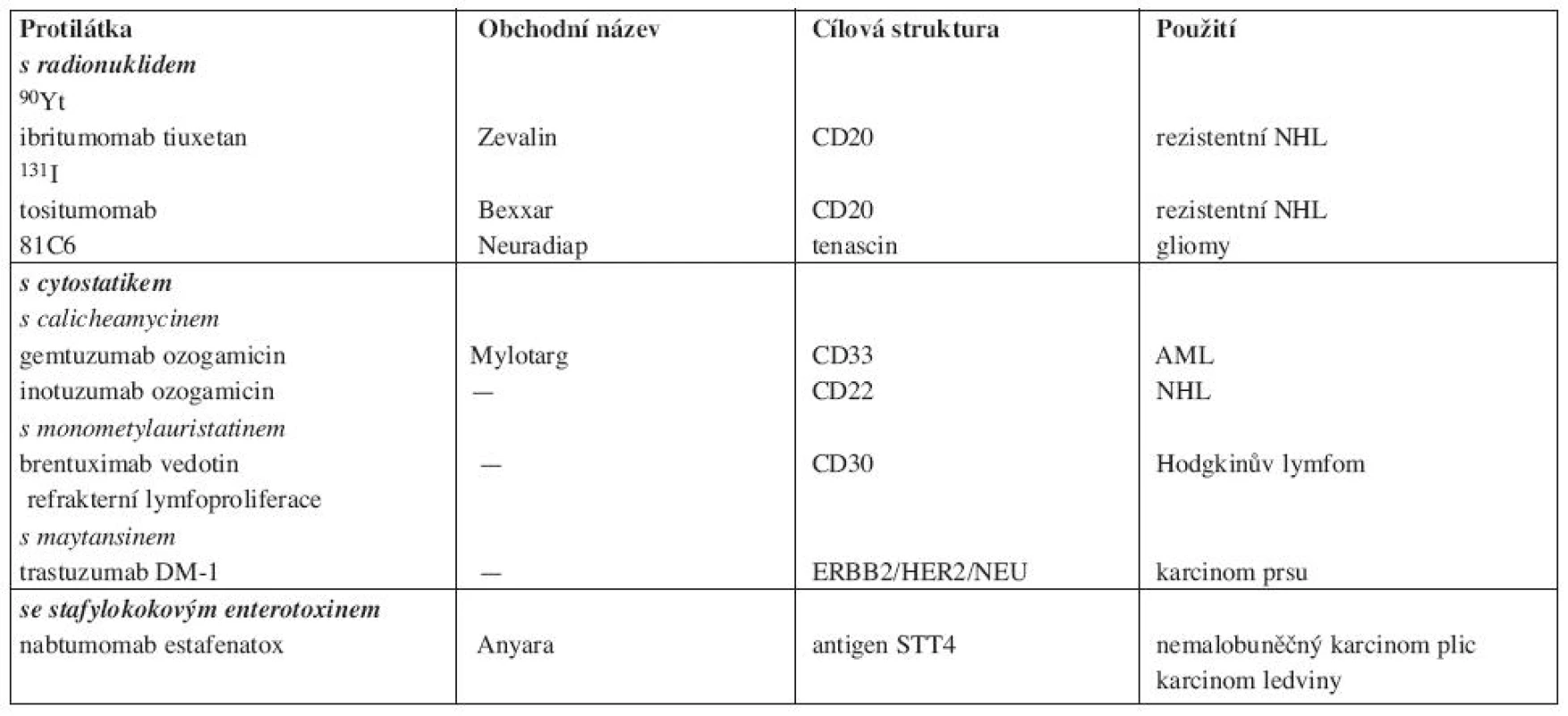
U nás se používá ibritumomab tiuxetan (Zevalin) – protilátka anti-CD20 konjugovaná s yttriem 90. 90Y je beta zářič s průnikem do vzdálenosti 11,9 mm působící cytolýzu i v omezeně vaskularizovaném nádoru. Efektivní poločas zářiče je 30 hodin (18). Protilátka je indikována k léčbě rezistentních forem NHL. Tositumomab (Bexxar), protilátka s navázaným jodem (131I) u nás není k dispozici. Gemtuzumab ozogamicin (Mylotarg) je anti-CD33 protilátka konjugovaná s calicheamycinem, cytostatikem izolovaném z micromonospora calichensis působícím zlomy DNA. Používala se v léčbě rezistentních AML (19). Její aplikace je však byla provázena značnou myelotocicitou, takže její výroba byla pozastavena.
Brentuximab vedotin (SGB-35) je chimerická protilátka anti-CD30 konjugovaná enzymaticky štěpitelnou vazbou s monometylauristatinem E (MMAE). V cirkulaci je přípravek stabilní, po vazbě na cílovou buňku se rychle internalizuje a odštěpený MMAE působí zánik buňky. Testuje se u refrakterních lymfoproliferací a u Hodgkinova lymfomu. TrastuzumabDM1 - je označení trastuzumabu konjugovaného s myatansinem (cytostatikum inhibujcím mikrotubuly) s předpokládanou účinností u karcinomu prsu a to i v případech rezistentních na trastuzumab (20). Nabtumomab estafenatox je protilátka konjugovaná se stafylokokovým enterotoxinem E (estafenatox). Jde v postatě o fúzní protein – imunotoxin. Látka byla schválena v EU pro karcinom ledviny, testuje se u NSCLC (21).
III. Bispecifické/trifunkční monoklonální protilátky obsahují dva různé Fab fragmenty a mají proto schopnost vázat dva odlišné antigeny (22). Při přípravě klasickou hybridomovou technikou vznikají tzv. protilátky trifunkční, které mají kromě dvou odlišných Fab fragmentů též Fc fragment (obr. 3). Tím aktivují pomocné buňky (makrofágy, dendritické buňky, NK-buňky), jinými slovy indukují ADCC (23). Jedním fragmentem Fab vážou nádorový antigen, kdežto druhým atrahují T-lymfocyty do místa nádoru. Navíc, pomocné buňky kostimulují navázané T-lymfocyty, což dále zesiluje protinádorový účinek protilátky.
Obr. 3. Znázornění klasické (monospecifické) protilátky, bispecifické (trifunkční) protilátky a protilátkových fragmentů (diabodies). 
Bispecifické /trifunkční protilátky jsou zatím předmětem klinického testování.
IV. Monoklonální protilátky nové generace. Mezi monoklonální protilátky nové generace lze zahrnout několik variant.
Diabodies (Db) jsou rekombinantně připravené protilátkové fragmenty (24). Fv fragment je část Fab fragmentu, která reálně váže antigen, svFV (single chanin fragment variable) je tvořen dvěma Fv fragmenty spojenými rekombinantně do jednoho řetězce. Diabodies mohou být bivalentní monospecifické (homodimer dvou scFv fragmentů se stejnou antigenní specifitou, nebo bivalentní bispecifické (heterodimer dvou scFV fragmentů s odlišnou antigenní specifitou) (obr. 3). Výhodou diabodies je jejich malá molekulární hmotnost v porovnání s klasickou protilátkou, nevýhodou je absence Fc fragmentu. Rekombinantním spojením více scFv mohou vznikat multivalentní multispecifické protilátky triabodies, tatrabodieas apod.
Příkladem bispecifické Db je blinatumomab, obsahující 4 scFV v jednom řetězci. Z toho dva se vážou na CD19, dva na komplex CD3. V r. 2009 byl blinatumomab schválen jako orphan drug pro léčbu ALL, zkouší se také u NHL. Jinou bispecifickou Db je MT 110, vážící EpCAM a CD3 komplex. Zkouší se u gastrointestinálních nádorů a NSCLC.
Peptibodies jsou rekombinantně připravené fúzní proteiny Fc fragmentů s polypeptidy vykazujícími vazebnou afinitu ke specifickým molekulám (ligandům, receptorům a p.) (25).
Mezi peptibodies patří např romiplostim (Nplate), fúzní protein Fc fragmentu a IgG polypeptidu s vazebnou (stimulační) afinitou k receptoru pro trombopoetin. Podobně jako nativní trombopoetin stimuluje trombocytopoezu. Jiný fúzní protein Fc fragmentu IgG a polypeptidu s neutralizační vazebnou afinitou proti angiogenním faktorům ANG1 a ANG2 je AMG-386. Blokuje interakce angiopoetinů s receptory Tie-2 a omezuje angiogenezu.
Imunocytokiny jsou fúzní proteiny cytokinů a monoklonálních protilátek, u nichž se předpokládá kombinace terapeutického účinku protilátky s lokální imunostimulací v místě nádoru (26). Příkladem může být tucotuzumab celmoleukin, fúzní protein IL-2 s humanizovanou protilátkou proti antigenu EpCAM (epithelial adhesion molecule), který je zvýšeně exprimován až u 80 % karcinomů. Tento imunocytokin jeví aktivitu zejména u karcinomu ovaria a kolorektálního karcinomu.
Intrabodies jsou neutralizační intracelulární protilátky. Představují nové možnosti genové terapie jako účinný nástroj posttranslační inhibice proteinové exprese. Vnesením genu pro MoAb do nádorových buněk s následnou expresí MoAb proti konkrétním intracytoplazmatickým proteinům uvnitř buňky představuje rozšíření možného účinku MoAb. Vhodnou formou intrabodies jsou především diabodies, pro svou malou velikost.
Chimerické imunoreceptory jsou další perspektivní alternativou využití MoAb. MoAb specifické pro určitý cytokin/růstový faktor se mohou svým modifikovaným Fc-fragmentem vázat na povrch nádorových buněk a působit jako tzv. decoy receptor, neboli falešný (chimerický) imunoreceptor, což vede k depleci klíčových stimulačních molekul z nádorového mikroprostředí.
Závěr
Monoklonální protilátky představují významné obohacení léčebných možností u hematologických malignit i u solidních nádorů. Konjugací čistých monospecifických protilátek s radionuklidem, cytostatikem nebo toxinem lze dosáhnout posílení terapeutického účinku. Výsledky klinických studií prokázaly zvýšenou účinnost monoklonálních protilátek v kombinaci s protinádorovou chemoterapií, bez rizika posílení nežádoucích účinků.
Seznam zkratek
ADCC – antibody dependent cellular cytotoxicity (cytotoxicita závislá na buňkách)
ALL – akutní lymfoblastická leukemie
AML – akutní myeloidní leukemie
ANG – angiopoetin
CDC – complement dependent cytotoxicity (cytotoxicita závislá na komplementu)
CLL – chronic lymphocytic leukema (chronická lymfocytární leukemie)
CTL – cytotoxický T-lymfocyt
DLCBL – diffuse large cell B-lymphoma (difuzní velkobuněčný B-lymfom)
EGFR – epidermal growth factor receptor (receptor pro epidermální růstový faktor)
EpCAM – epithelial cell adhesion molecule (adhezní molekula pro epitelové buňky)
HL – Hodgkinův lymfom
IGF1 – insulin growth factor 1 (insulinu podobný růstový faktor)
MCL – mantel cell lymphoma (lymfom z plášťové zóny)
MDS – myelodysplastický syndrom
MMAE – monomethyalauristatin E
MoAb – monoclonal antibody (monoklonální protilátky)
NFkB – nuclear factor kappa B (nukleární faktor kappa B)
NHL – non-Hodgkin´s lymphoma (nehodgkinský lymfom)
NSCLC – non small cell lung cancer (nemalobuněčný karcinom plic)
RANK – receptor activator for nuclear factor kB (receptor aktivující nukleární faktor kB)
RANKL – RANK ligand
TRAIL – TNF-related apoptosis inducing ligand (TNF podobný ligand indukující apoptózu)
VEGF – vascular endothelial growth factor, cévní (endoteliální růstový faktor)
VEGFR – vascular endothelial growth factor (receptor pro VEGF)
Prof. MUDr. Pavel Klener, DrSc.
1. interní klinika VFN
U nemocnice 2
128 08 Praha 2
e-mail: pavel.klener@ruk.cuni.czPodpořeno výzkumným záměrem MSM 0021620808
Doručeno do redakce: 13. 1. 2011
Přijato po recenzi: 24. 1. 2011
Zdroje
1. Adams GP, Weiner LM. Monoclonal antibody therapy of cancer. Nature Biotechnol 2005; 23 : 1147-1157.
2. Klener P, Klener P jr. Nová protinádorová léčiva a léčebné strategie v onkologii Grada Publishing a.s. Praha, 2010.
3. Weiner LM, Surana R, Wang S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Natur Rev 2010; 10 : 317-327.
4. Fanale MA, Younes A. Monoclonal antibodies in the treatment of non-Hodgkinęs lymphoma. Drugs 2007; 67 : 333-350.
5. Belada D. Monoklonální protilátky v léčbě lymfomů. Remedia 2008; 6 : 416.423
6. Castillo J, Winer E, Quinsberry O. Newer monoclonal antibodies for hematological malignancies. Exp Hematol 2008; 36 : 755-768.
7. Wierda WG, Kipps TJ, Keatimg MJ, et al. Self-administered. subcutaneous alemtuzumab to treat residual disease in patients with chronic lymphocytic leukemia. Cancer 2011; 117 : 116-124.
8. Khubchandani S, Czuczman MS, Hernandes-Ilizalituri FJ. Dacetuzumab, a humanized mAb against CD40 for the treatment of hematological malignancies. Curr Opin Invest Drugs 2009; 10 : 579-598.
9. Palácová M. Trastuzumab. Remedia 2009; 20 : 4-13.
10. Van Cutsem E. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer New Engl J Med 2009; 369 : 1408-1417.
11. Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of antitumor activity. Cancer 2008; 8 : 579-591.
12. Ricart AD, Tolcher AW, Liu G, et al. Volociximab, a chimeric monoclonal antibody that specifically binds alpha5beta1 integrin: a phase 1, pharmacokinetic, and biological correlative study. Clin Cancer Res 2008; 14 : 7924-7929.
13. Leong S, Cohen RB, Gustavson GL, et al. Mapatumumab, an antibody targeting TRAIL-R1, in combination with paclitaxel and carboplatin in patients with advanced solid malignancies - results of a phase I and pharmacoklinetic study. J Clin Oncol 2009; 27 : 4413-4421.
14. Lipton A, Goessi C. Clinical development of anti-RANKL therapies for treatment and prevention of bone metastasis. Bone 2011; 48 : 96-99.
15. Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nature rev 2010; 10 : 301-316.
16. Weber J. Ipilmumab: controversies in its development, utility and autoimmune adverse events. Cancer Immunol Immunother 2009; 58 : 823-830.
17. Carter PJ, Senter PD: Antibody-drug conjugates for cancer therapy. Cancer J 2008; 14 : 154-169.
18. Cicone F, Russo E, Carpaneto A, et al. Follicular lymphoma at relapse after rituximab containing regimens: comparison of time to event intervals prior to and after (90)Y-ibritumomab-tiuxetan. Hematol Oncol 2010; (epub ahead of print).
19. Estey E. New drugs in acute myeloid leukemia. Semin Oncol 2008; 35 : 439-448.
20. Lewis Phillips GD, Druger DL, Crocker LM. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate. Cancer Res 2008; 68 : 9280-9290.
21. Younes A, Bartlett NL,Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD-30-positive lymphomas. New Engl J Med 2010; 363 : 1812-1821.
22. Forsberg G, Skartved NJM, Wallén-Ohman M, et al. Naptumomab estafenatox, an engineered antibody-superantigen fusion protein with low toxicity and reduced antigenicity. J Immunother 2010; 33 : 492-499.
23. Kontermann RE. Recombinant bispecific antibodies for cancer. Acta pharmacol 2005; 26 : 1-9.
24. Goldenbereg DM, Cardillo IM, Shi V, et al. Bispecific anti CF20/22 antibodies inhibit B-cell lymphoma proliferation by unique mechanism of action. Blood 2008; 111 : 2211-2219.
25. Nelson AI, Reichert JM. Development trends for therapeutic antibody fragments. Nature Biotechnol 2009; 27 : 331-337.
26. Reichert JM. Antibodies to watch in 2010. Mabs 2010; 2 : 28-45.
27. Holden SA, Lan Y, Pardo AM, et al. Augmentation of antitumor activity of an antibody-interleukin 2 immunocytokine with chemotherapeutic agents. Clin Cancer Res 2001; 7 : 2862-2869.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Alogenní transplantace krvetvorných buněk po režimu s redukovanou intenzitou ve složení busulfan, fludarabin a antithymocytární globulin (ATG Fresenius): dlouhodobé výsledky
- A novel prognostic model in elderly patiens with acute myeloid leukemia: results of 909 patients entered into the prospective AML 96 trial
- Vyšetření pozitronovou emisní tomografií u nemocných s Hodgkinovým lymfomem
- Rebalanced hemostasis in patiens with liver disease: evidence and clinical consequences
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Náhlá progrese mnohočetného myelomu charakterizovaná parciálním „light-chain escape“ fenoménem a sekundární translokací t(8;14)
- A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia
- Comparable survival after HLA-well-matched unrelated or matched sibling donor transplantation for acute myeloid leukemia in first remission with unfavorable cytogenetics at diagnosis
- Zprávy odborných společností
- Molekulárně genetická vyšetření u trombofilních stavů spojených se žilním tromboembolismem a jeho komplikacemi – konsensus České společnosti pro trombózu a hemostázu ČLS JEP, Společnosti pro lékařskou genetiku ČLS JEP, České hematologické společnosti ČLS
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
- VYHODNOCENÍ RIZIKOVÝCH FAKTORŮ HLUBOKÉ ŽILNÍ TROMBÓZY (HŽT) U CHIRURGICKÝCH PACIENTŮ
- Základní imunohematologická laboratorní vyšetření červené řady – Obecné zásady a technické postupy
- Úvodník
- Předtransfuzní laboratorní vyšetření
- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Předtransfuzní laboratorní vyšetření
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



