-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analýza regresivních změn v lymfatických metastázách plicního karcinomu po indukční chemoterapii
Analysis of Regressive Changes in the Lung Carcinoma Lymphatic Metastases Following Induction Chemotherapy
Background:
Prognosis of higher stages of non-small cell lung cancer (NSCLC) is very poor. Only 13% of patients in stage IIIA survive 5 years after the diagnosis determination. The purpose of neoadjuvant (inductive) therapy is to eliminate haematogenous and lym-phogenous metastases and to cause a cytoreduction in the primary tumor before the resection. Especially detection of lymphogenous metastases is the main factor in the indication of the pre-operative chemotherapy, but this therapy is frequently indicated according to CT without any bioptic verification. The authors suppose such a discrepancy in radiological and histo-pathological staging to influence in a positive sense rather optimistic results of therapeutic protocols, which include the pre-operative chemotherapyMethods:
A biopsy of the lymph nodes was performed as a part of the staging. If the metastasis was proved, the lymph node was labeled and the patient was treated by 3 cycles of the pre-operative chemotherapy. The 57 labeled lymph nodes were removed during the subsequent lung resection and lymphadenectomy. An analysis of regressive alterations in the lymphatic metastases of lung cancer after an inductive chemotherapy and comparison with the pre-operative bioptic findings have quantificated the chance of the inductive therapy to eliminate lymphatic metastases.Results:
The clinical down-staging was stated in 21 cases (36.8%), but the viable malignant cells rested in the majority 50 (87.7%) of the taken labeled lymph nodes 57 (100 %) even after the neoadjuvant therapy. On the other hand, the satisfactory tumor regression changes was proven in 49 (86%) lymphatic metastases.Conclusin:
The results of the study may modify an indicating judgment in the therapy of locally advanced stages of lung cancer because it has brought a new view to the results of neoadjuvant therapy.
Autoři: J. Klein 1; T. Tichý 2; V. Král 1; Č. Neoral 1; T. Bohanes 1; M. Szkorupa 1; V. Kolek 3; M. Heřman 4; T. Janásková 5
Působiště autorů: I. chirurgická klinika LF UP a FN Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc. 1; Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc, přednosta: prof. MUDr. V. Kolek, DrSc. 2; Ústav patologie LF UP a FN Olomouc, přednosta: prof. MUDr. Z. Kolář, DrSc. 3; Radiologická klinika LF UP a FN Olomouc, přednosta: prof. MUDr. M. Heřman, Ph. D. 4; Plicní oddělení Vítkovické nemocnice, a. s., primář: MUDr. T. Janásková 5
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 4, s. 206-211.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Prognóza vyšších stupňů nemalobuněčné rakoviny plic (NSCLC) je velmi špatná. Jen 15 % pacientů ve stadiu IIIA přežije 5 let od stanovení diagnózy. Účelem neoadjuvantní (indukční) terapie je vyloučit hematogenní a lymfogenní metastázy a způsobit cytoredukci v primárním nádoru před samotnou chirurgickou resekcí. Detekce lymfogenních metastáz je hlavní indikační parametr pro nasazení předoperační chemoterapie, ale tato léčba je často indikována podle CT bez jakékoli bioptické verifikace. Rozpor mezi radiologickým a histopatologickým stagingem pak může v pozitivním smyslu ovlivňovat spíše optimistické výsledky kombinovaných léčebných protokolů zahrnujících předoperační chemoterapii.Metodika:
V rámci předoperačního stagingu byla provedena biopsie mediastinálních uzlin. Pokud byly prokázány mediastinální lymfatické metastázy, uzlina byla označena hemostatickým klipem a nemocný byl indikován ke 3 cyklům neoadjuvantní chemoterapie. Pokud nedošlo k progresi, nemocný byl indikován ke kurativní resekci, v rámci lymfadenektomie byla označená uzlina odebrána a odeslána separátně k vyšetření. Byl porovnán rentgenologicky stanovený down-staging s definitivním histopatologickým nálezem a vyhodnoceny regresivní změny v takto označených 57 uzlinách.Výsledky:
Klinický down-staging byl prokázán v 21 případě (36,8 %), ale viabilní nádorové buňky byly po indukční chemoterapii nalezeny v 50 (87,7 %) označených lymfatických uzlinách z 57 (100 %). Na druhé straně, uspokojivý stupeň regresivních změn byl verifikován v 49 (86 %) lymfatických metastázách.Závěr:
Vzhledem k několika nově prokázaným aspektům efektu neoadjuvantní terapie by tato studie mohla určitých způsobem modifikovat indikační rozvahu při terapii lokálně pokročilých stadií rakoviny plic.ÚVOD
Diseminace bronchogenního karcinomu do lymfatických uzlin plíce a mediastina je jedním ze základních prognostických faktorů. Správné zhodnocení postižení lymfatických uzlin je zásadním předpokladem pro volbu nejvhodnějšího terapeutického postupu a dovoluje předpovědět perspektivu nemocného. V klinické praxi se u plicního karcinomu obvykle kombinují chirurgické postupy s radioterapií nebo chemoterapií. Nutnost kombinovat jednotlivé léčebné postupy je dána agresivní povahou karcinomu plic. Pětileté přežití časných stadií nepřesahuje 60 % resp. 50 % pro I. resp. II. stadium TNM. Ve stadiu IIIA přežívá 5 let pouze 15 %, ve stadiu III B 5 % nemocných, ve stadiu IV je pětileté přežití zcela výjimečné. Většina recidiv po operaci je systémových, v I. a II. stadiu je to asi 70 %, ve stadiu III 80 a více procent. To vede k logické úvaze kombinovat chirurgický výkon se systémovou léčbou, tedy chemoterapií.
Indukční chemoterapie má řadu teoretických předností. První a nejzřetelnější je cytoredukce v primárním tumoru, která může za určitých okolností umožnit resekci nádoru jinak neresekovatelného. Lokální účinky chemoterapie jsou umocněny intaktní vaskulaturou nádoru, systémová chemoterapie je předoperačně lépe tolerována. Chirurgický výkon pak umožňuje spolehlivé histopatologické vyhodnocení léčebné odpovědi, které může pomoci navigovat další adjuvantní léčbu. Lokální efekt však není hlavním cílem indukce, protože naprostá většina nemocných operovaných v pokročilých stadiích karcinomu plic zmírá na generalizaci. Jednoznačným hlavním cílem kombinovaných postupů je eradikace subklinického metastatického rozsevu [1, 2].
Předoperační diagnostika maligní lymfadenopatie je založena především na CT, při nálezu zvětšených uzlin je indikována invazivní explorace – mediastinoskopie event. torakoskopie. Tento postup lze považovat za standardní, nicméně nebyl v minulosti dodržován ani v naší republice, ani v zahraničí. V řadě souborů, a to i ve velkých mezinárodních studiích, bylo akceptováno zařazení do protokolu na podkladě vyšetření CT, kdy zvětšené mediastinální uzliny byly pokládány za maligně postižené. Rentgenologický popis zvětšených uzlin v mediastinu tedy postačoval k indikaci indukční léčby, ke kurativní operaci pak byli směřováni až nemocní, u kterých po aplikaci indukční léčby došlo ke zmenšení uzlin nebo k podstatnému zmenšení primárního nádoru. Takové výsledky musely být zcela zákonitě zatíženy již vstupní chybou, kterou lze odhadovat až na 20–30 %, a která zcela jistě musela ovlivnit celkové výstupy výzkumu. Teprve zavedení principů evidence based medicine (EBM) vneslo do indikačního protokolu nemocných s lokálně pokročilým karcinomem plic určitý řád. Nutným požadavkem se stala histologická konfirmace maligní lymfadenopatie nebo pozitivní nález na PET scanu.
Předmětem našeho výzkumu se stala spolehlivost předoperačního stagingu nemocných léčených v neoadjuvantním protokolu a posouzení regresivních změn v lymfatických metastázách u nemocných ve stadiu IIIA/N2 podle TNM klasifikace. Důvodem k vypracování této studie byl poznatek, že u řady nemocných indikovaných k resekci po indukční léčbě s prokázaným down-stagingem v parametru cN, tedy s rentgenologicky potvrzeným zmenšením mediastinálních uzlin pod hranicici 10 mm, byla při operaci (resekci a lymfadenektomii připadně mediastinoskopii) v lymfatických uzlinách prokázána reziduální nádorová tkáň.
Existuje řada prací, které se zabývají efektem cytostatické chemoterapie na primární nádor. U nemalobuněčného plicního karcinomu je však obtížné získat dostatečný vzorek primárního nádoru, který by bylo možné porovnat s tkání nádoru odstraněného po indukční chemoterapii, proto jsou ve většině publikovaných statí popisovány regresivní změny až v nádoru odstraněném po neoadjuvantní terapii a tyto změny jsou automaticky přičítány této léčbě [3]. Analýze změn v lymfatických uzlinách se věnuje ještě méně prací, zcela nepatrný počet sdělení je pak věnován porovnání těchto změn před a po chemoterapii u jednoho nemocného resp. v totožném nádoru či uzlině, přičemž právě reakce v uzlinách resp. jejich postižení event. likvidace metastáz v uzlinách je hlavním parametrem, podle kterého lze posuzovat efekt neoadjuvantního protokolu. Cílem prezentované studie bylo vyhodnocení spolehlivosti klinického (CT) stagingu a zejména restagingu v porovnání se skutečným histopatologickým nálezem v uzlinách odebraných při resekci případně při diagnostické operaci a posouzení regresivních změn po chemoterapii v identických (označených) postižených lymfatických uzlinách.
MATERIÁL
Do našeho souboru jsme zařadili nemocné operované na I. chirurgické klinice v Olomouci pro ověřený nemalobuněčný plicní karcinom s klinicky (CT) diagnostikovanou mediastinální lymfadenopatií v letech 2002–2006. Jednalo se o 76 mužů a 17 žen ve věku 34–79 let, průměrný věk sledovaného souboru byl 59,7 let (Tab. 1). V souboru převažoval spinocelulární karcinom (52 případů, 55,9 %) nad adenokarcinomem (34 případy, 36,6 %), minimálně byl zastoupen velkobuněčný karcinom (7 případy, 7,5 %) (Tab. 2). Klinický staging parametru T ukazuje tabulka 3.
Tab. 1. Distribuce podle pohlaví Tab. 1. Distribution according to gender 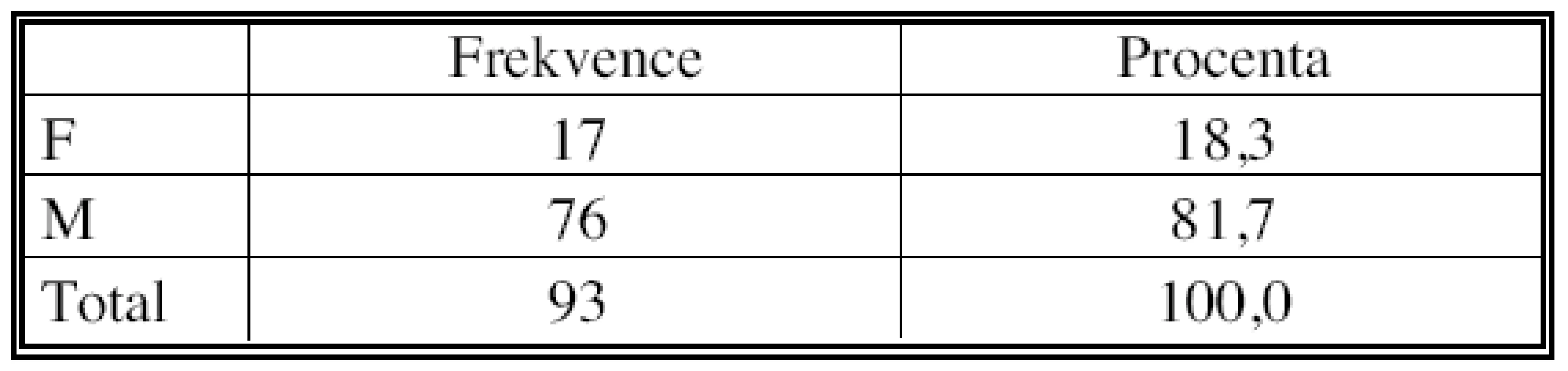
Tab. 2. Histologický typ primárního nádoru Tab. 2. Histological type of the primary tumour 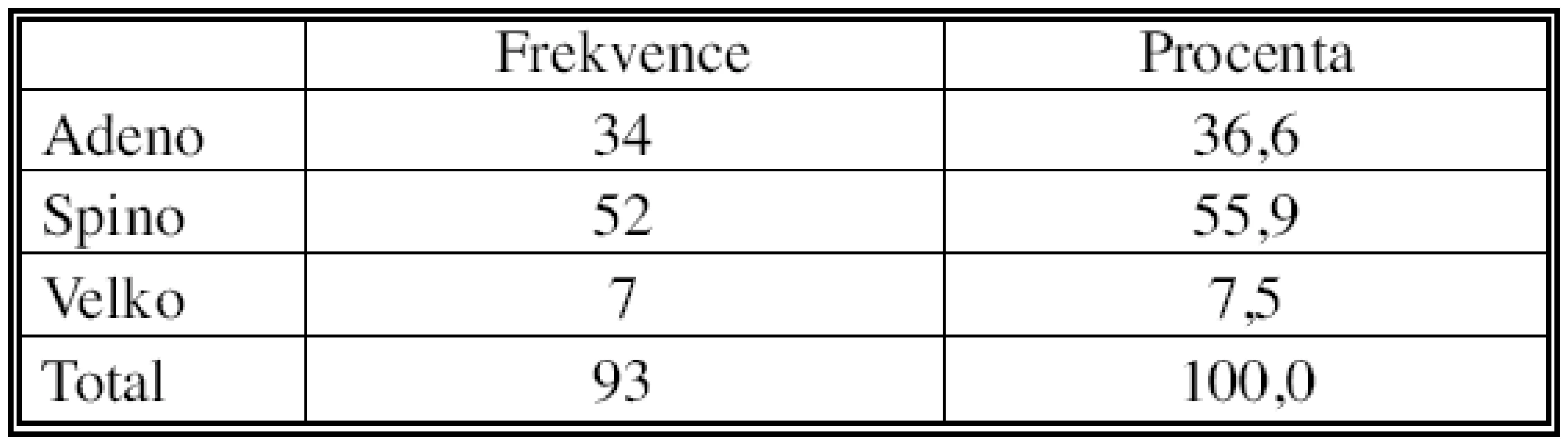
Tab. 3. Klinicky vyhodnocený parametr T Tab. 3. Clinically assessed T parameter 
V rámci prvotního předoperačního vyšetření absolvovali všichni pacienti bronchoskopii, scintigrafii skeletu, spirometrické vyšetření a CT vyšetření plic, mediastina a nadledvin nativní a s kontrastem podaným i.v. Uzliny větší než 10 mm v kratší ose byly popsány jako pozitivní. U těchto 93 nemocných jsme provedli 89 mediastinoskopií (videomediastinoskopií) a 4 jiné diagnostické procedury (2x parasternální mediastinotomii, 2x videotorakoskopii) k ověření klinicky (CT) diagnostikované maligní mediastinální lymfadenopatie. 4 nemocní, u kterých byla prokázána kontralaterální mediastinální lymfadenopatie (N3), byli z dalšího výzkumu vyřazeni. 19 (20,5 %) nemocných, u kterých nebyla v mediastinálních uzlinách nalezena nádorová tkáň, bylo následně indikováno ke kurativní resekci. Ve 14 případech byly uzliny plíce a mediastina nádoru prosty, v 5 případech byly nalezeny intrapulmonální lymfatické metastázy. 70 nemocných, u kterých byla při mediastinoskopii peroperačně ověřena a hemostatickým klipem označena pozitivní stejnostranná mediastinální uzlina, bylo dále léčeno indukční chemoterapií (3 cykly dvojkombinace chemoterapeutik – platinový derivát + taxan, etoposid, vinorelbin či gemcitabin). V rámci restagingu bylo provedeno opět CT vyšetření s kontrastem a kromě jiných parametrů byl vyhodnocen down-staging v parametru N. U 9 nemocných byla v průběhu indukční terapie zjištěna progrese (většinou vzdálená metastáza či kontralaterální či supraklavikulární maligní lymfadenopatie), u 2 nemocných nastaly komplikace vylučující chirurgickou intervenci. 59 nemocných bylo následně indikováno ke kurativní resekci, při které byla v rámci resekce provedena mediastinální lymfadenektomie a cíleně k definitivnímu vyšetření odebrána takto označená uzlina. U jednoho nemocného byla zjištěna generalizace na pleuře, u jednoho nemocného nebyla označená uzlina nalezena, takže k definitivnímu vyšetření na grading regresivních změn bylo odesláno 57 označených lymfatických uzlin.
METODIKA
Tkáň uzliny k analýze před indukční chemoterapií byla odebrána mediastinoskopicky. K analýze byla odebrána část uzliny v řádu několika mm3, dostatečná k ověření stadia i k pozdější analýze. Kapsula uzliny byla označena hemostatickým kovovým klipem, který se běžně používá k hemostáze v této indikaci. Takto bylo zaručeno, že bude posléze v rámci vlastní operace resp. lymfadenektomie odebrán a k vyšetření odevzdán zbytek totožné uzliny. V případě nálezu stejnostranné maligní mediastinální lymfadenopatie byla aplikována indukční (neoadjuvantní) chemoterapie (3 cykly dvojkombinace chemoterapeutik – platinový derivát + taxan, etoposid, vinorelbin či gemcitabin).
Po indukci byl proveden restaging včetně CT a v případech, kdy nebyla shledána kontraindikace resekce, byla provedena plicní resekce s mediastinální lymfadenektomií. Uzlina označená klipem byla vyhledána a separátně vyšetřena.
Pozitivita uzlin byla stanovována v definitivních sériových řezech po 1 mm barvených hematoxylinem-eosinem, v případě negativity následovalo ještě ověření anticytokeratiny. Byla porovnána shoda mezi klinických stagingem (c1N) a skutečným bioptickýcm nálezem v uzlinách (p1N) před zařazením do studie a po proběhlé chemoterapii (c2N, p2N).
Regresivní změny v uzlinách byly posuzovány takto:
Rozsah fibrózy byl stanoven z tkáňových řezů obarvených klasickými histochemickými metodami na průkaz kolagenu a to trichromem podle Massona a barvením podle Giesona. Takto zpracované preparáty byly nasnímány digitální kamerou a zpracovány systémem obrazové analýzy LUCIA. Rozsah fibrózy byl vyjádřen v plošných jednotkách a v procentech zkoumané plochy tkáně. Nádorové buňky byly spočteny v 10 zorných polích optického mikroskopu při zvětšení 100x manuálně. Rozsah fibrotických změn byl porovnán s přítomností (absencí) vitálních nádorových buněk a klasifikován podle Mandarda do 5 stupňů TRG (tumor regression grade) [4]:
Tab. 4. TRG (tumor regression grade) 
Ve tkáni odebrané k biopsii při primárním stagingu a také po proběhlé chemoterapii v označených uzlinách, které vykazovaly dostatečné množství reziduální nádorové tkáně (TRG 3-5), byly dále detekovány známky apoptózy, vyhodnocen proliferační index a stanovena exprese bcl 2. Výsledky této analýzy jsou předmětem jiného sdělení.
Pro statistickou analýzu uvedených dat byly použity tyto statistické testy: McNemarův test symetrie, chi-square test, Pearsonova korelační analýza, dvouvýběrový t-test a Studentův t-test.
VÝSLEDKY
U 93 nemocných s klinicky (CT) popsanou stejnostrannou mediastinální lymfadenopatií c1N=2 jsme tento nález potvrdili biopticky v 70 případech (75 %), ve 4 případech (4 %) byla lymfadenopatie vyššího stupně (pN = 3), 19x byl klinický staging nadhodnocen (pN = 0 nebo p1N = 1) (Tab. 5).
Tab. 5. Korelace klinického a histopatologického stagingu před indukční terapií Tab. 5. Correlation of the clinical and histopathological staging prior to induction therapy 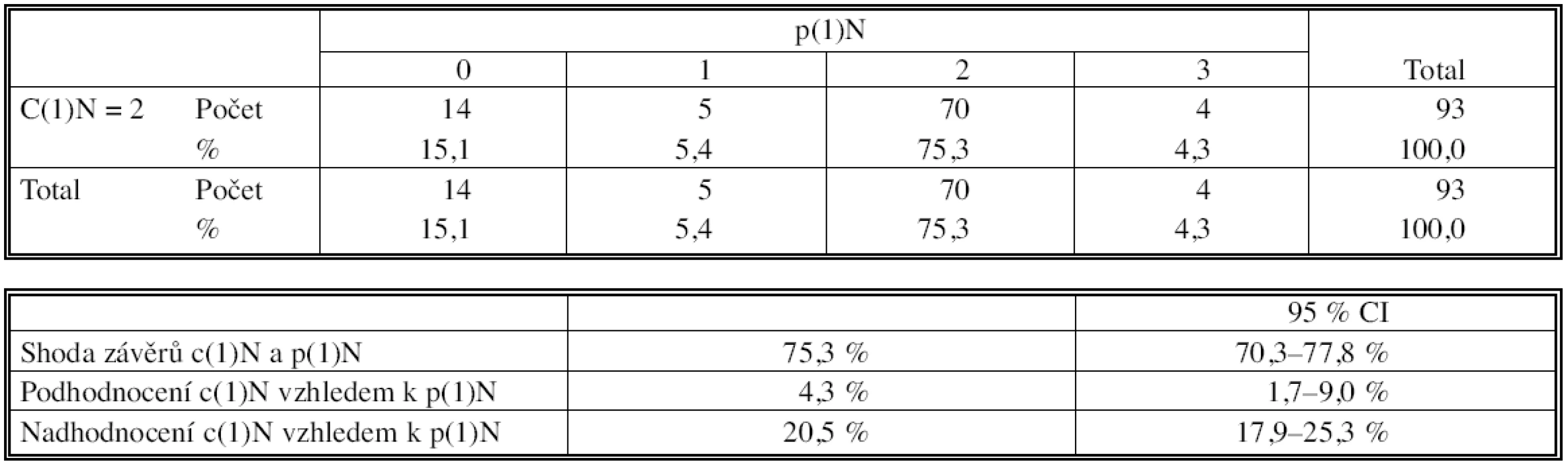
U 57 označených uzlin byl porovnán CT popis (c2N) a skutečný histopatologický nález (p2N). Shoda závěrů klinického restagingu a skutečného bioptického nálezu v uzlinách byla pouhých 61,4 %, V 18 případech (31,6 %) byla v uzlině popsané na CT jako negativní nalezena zbytková nádorová tkán, ve 4 případech byla uzlina popsaná na CT jako pozitivní nádoru prosta (Tab. 6).
Tab. 6. Korelace klinického a histopatologického stagingu po indukční terapií (test symetrie McNemar) Tab. 6. Correlation of the clinical and histopathological staging after the induction therapy (McNemar Symetry Test) 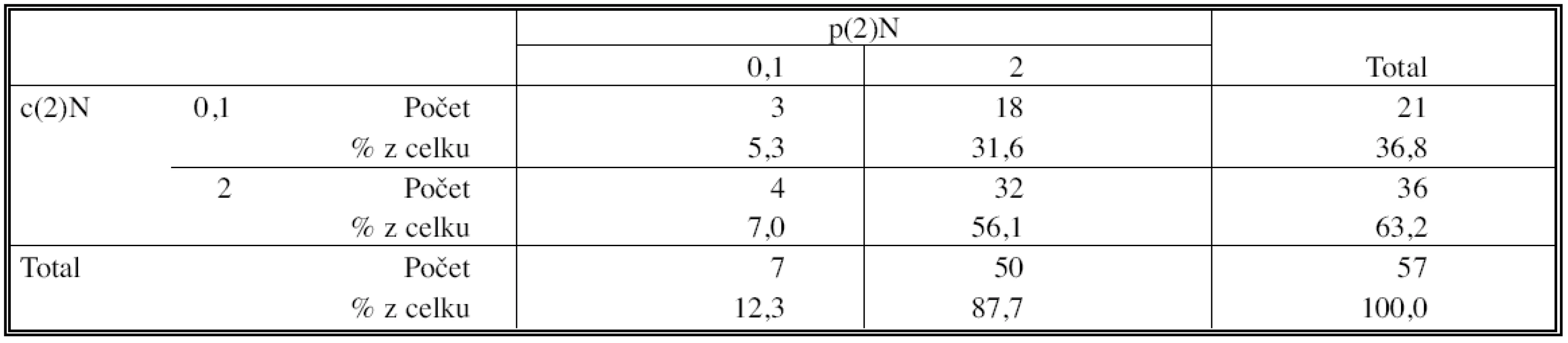
Tato neshoda byla shledána statisticky významnou jak testem chi-square, (Tab. 7), tak Cohenovou analýzou (Tab. 8).
Tab. 7. Chi-square tests 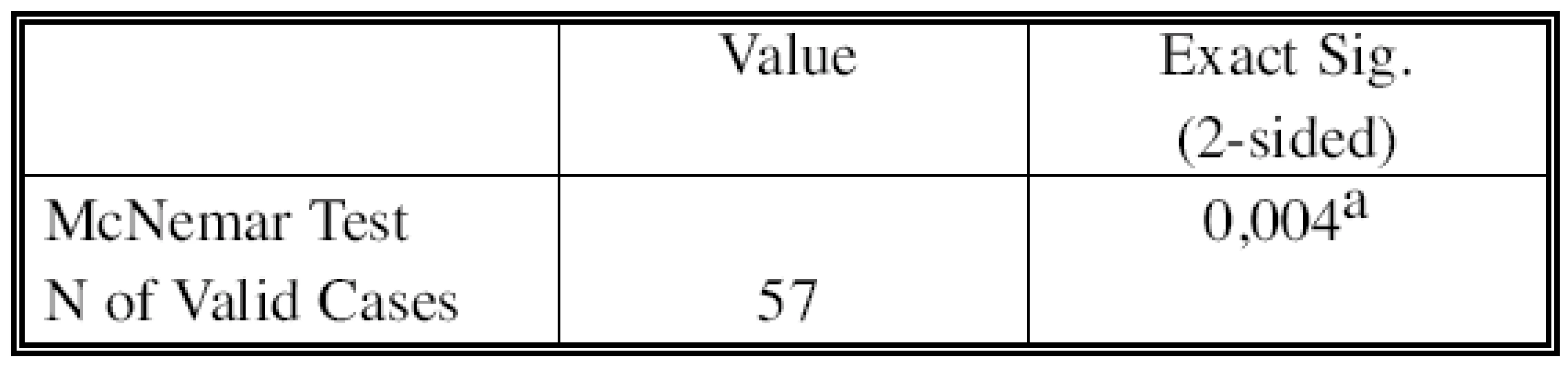
a – Binomal distribution used Tab. 8. Posouzení míry shody obou metod pomocí Cohenova kappa Tab. 8. Assessment of the both methods’ inter-rater agreement, using the Cohen’s Kappa value 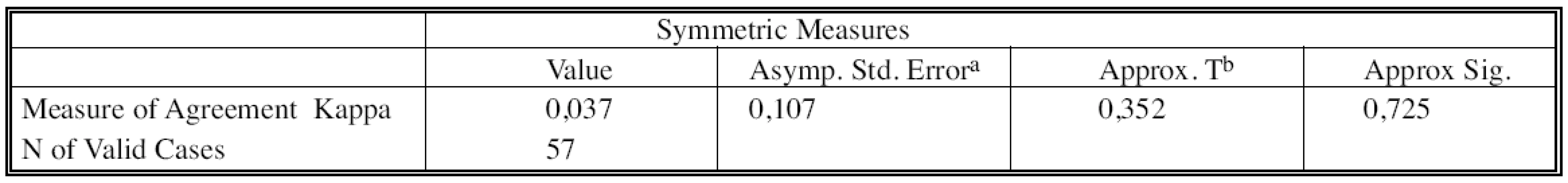
a – Not assuming the null hypothesis b – Using the asymptotic standard error assuming the null hypothesis Velmi nízká hodnota Cohenova kappa k = 0,037 vypovídá o tom, že shoda závěrů metod c(2)N a p(2)N je velmi špatná (p = 0,725).
Ve tkáni 57 označených mediastinálních uzlin byly vyhodnoceny regresivní změny v pětistupové škále. Kompletní remise (TRG 1) bylo dosaženo v 6 případech (10 %), velmi dobrá reakce na chemoterapii (TRG 2), pak byla konstatována v 31 případě (54,4 %), uspokojivá reakce (TRG 3) ve 12 případech (21 %), minimální reakce v 5 případech (8,8 %), žádné regresivní změny nebyly nalezeny pouze ve 3 označených uzlinách (5,3 %) (Tab. 9, Graf 1).
Tab. 9. Hodnocení regresivních změn Tab. 9. Assessment of the regressive changes 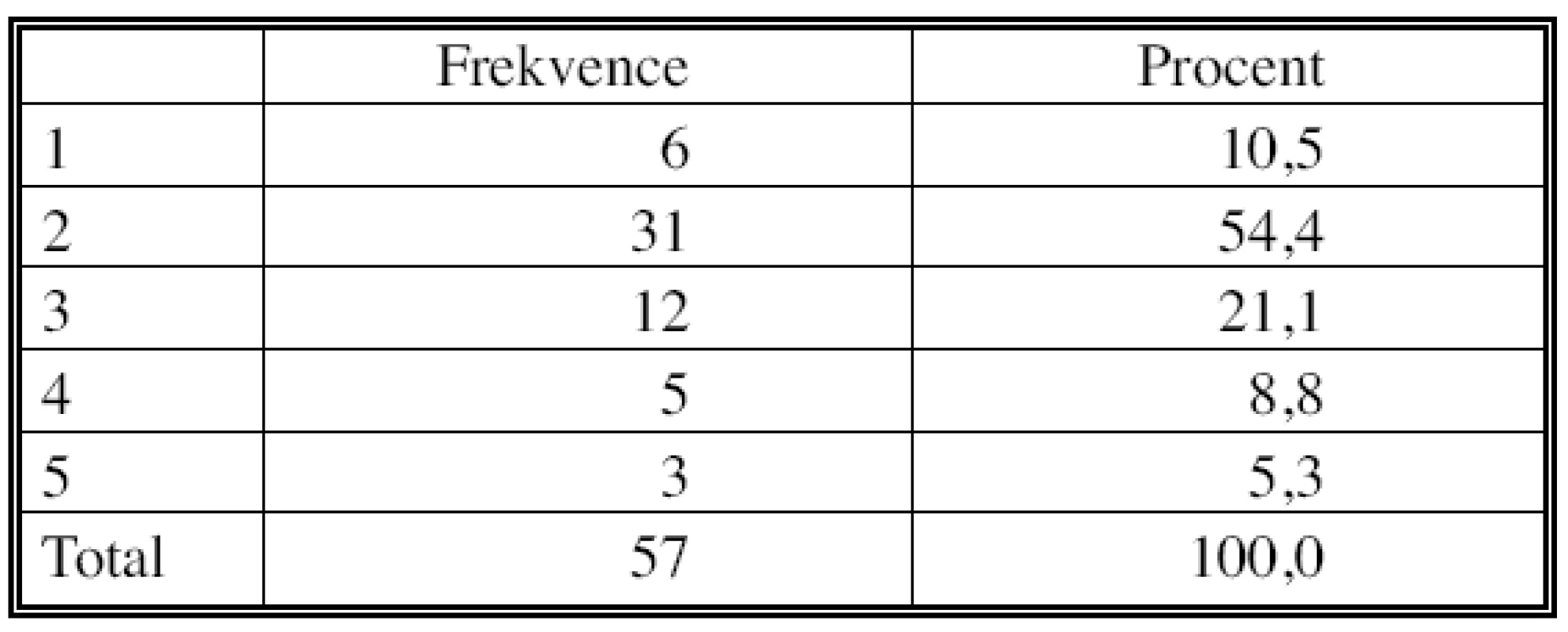
Graf 1. Percentuální zastoupení stupňů regresivních změn Graph 1. Percentual representation of the regressive changes degrees Nádorové ,,sterilizace” uzliny, tedy kompletní remise uzlinové metastázy, bylo dosaženo pouze u 6 uzlin (10,5 %) 
Úplná až uspokojivá reakce na chemoterapii (TRG 1–3) byla prokázána celkem ve 49 uzlinách (86 %), zatímco neuspokojivý výsledek – minimální nebo žádná reakce na chemoterapii ( TRG 4 nebo 5) byla nalezena jen ve zbylých 8 případech (Tab. 10).
Tab. 10. Vyhodnocení regresivních změn ve dvoustupňové škále Tab. 10. Assessment of the regressive changes on a twodegree scale 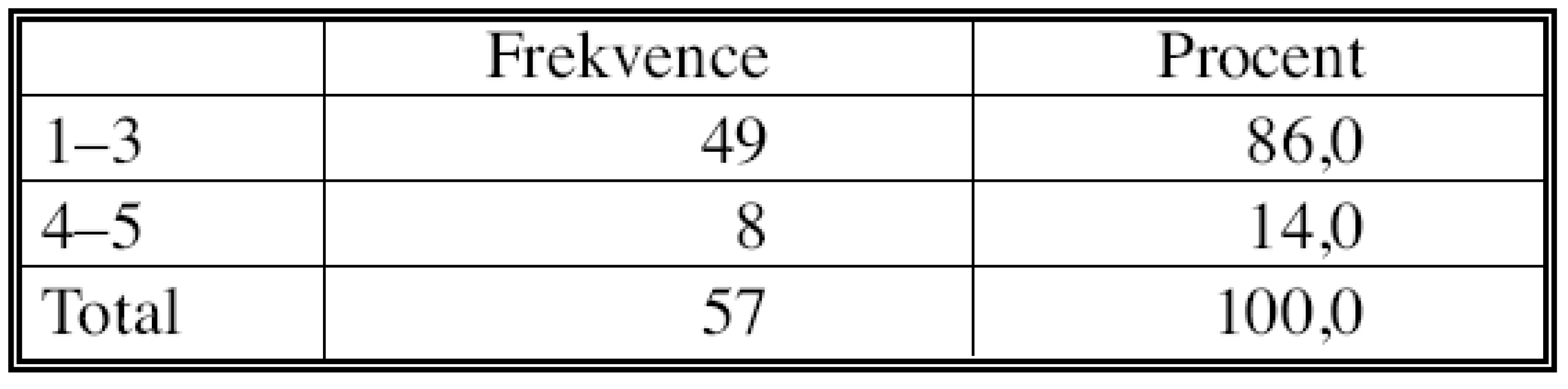
DISKUSE
Problematika indikace, způsobu provedení a vyhodnocení efektu neoadjuvantní chemoterapie je neobyčejně široká. Je nutno podotknout, že v německy mluvících zemích je obvyklejší neoadjuvantní radiochemoterapie, resp. chemoterapie následovaná souběžnou radiochemoterapií v dávkách blížících se plným terapeutickým (celkem 5 cyklů chemoterapie, radioterapie v dávce 45 Gy na mediastinum) [6]. V anglosaské literatuře je ve smyslu indukce referována častěji aplikace samotné chemoterapie v délce trvání od 2 do 6 cyklů, a to častěji jako kombinace chemoterapeutik, než monoterapie [7]. Ve valné většině studií byl prokázán signifikantní prognostický význam mediastinálního downstagingu případně závažnosti regresivních změn v tumoru nebo v uzlinách [8, 9]. Naproti tomu Langner prokazuje pouze prognostický význam stupně regresivních změn v primárním tumoru, mediastinální downstaging shledal bez statistické relevance [4].
V neoadjuvantních režimech založených na radiochemoterapii je obecně dosahováno vysokého procenta odpovědi na léčbu, remise maligní mediastinální lymfadenopatie je dosahováno až v 70 %, i když někdy bez prognostické relevance [4]. Očekávat podobný efekt od 3 cyklů chemoterapie by bylo jistě přehnaně optimistické. V našem souboru byl prokázán mediastinální downstaging v pouhých 10 % případů, nicméně zřetelně dobrá reakce na chemoterapii (TRG 1–3) byla popsána v 86 % případů. Tento rozdíl lze komentovat vcelku jednoduše: U krátkodobé chemoterapie se může uplatnit pouze primární chemorezistence. Při vhodné volbě chemoterapeutik (např. podle chemorezistence in vitro) lze tedy dosáhnout častého, ale vzhledem k limitu trvání neúplného efektu. Otázky polyklonality nádoru, zdvojovacího času, farmakokinetiky a otázky dávky a velikosti (masy) nádoru ponecháme stranou [10]. U radiochemoterapie lze sice předpokládat vzhledem k podstatně delšímu trvání vývoj indukované chemorezistence a repopulaci resp. selekci radio - a chemorezistentních buněk. Nicméně délka trvání a zejména vztah mezi dávkou radioterapie a velikostí postižených uzlin (obecně pod 30 mm) zaručuje do jisté míry dosažení vysokého procenta kompletní remise v mediastinálních uzlinách.
ZÁVĚRY
- Dvojkombinací chemoterapeutik na platinové bázi v neoadjuvantní indikaci lze dosáhnout významných regresivních změn v lymfatických metastázách plicních karcinomů a výjimečně i jejich kompletní nádorové ,,sterilizace”.
- Hodnocení efektu neoadjuvantní terapie pouze pomocí klinických metod (CT) je naprosto nevěrohodné.
- Otázkou zůstává, zda mediastinoskopie (remediastinoskopie) může mít vedoucí úlohu při rozhodování o způsobu definitivní lokální terapie (chirurgie versus radioterapie) za podmínek, kdy lze v původně pozitivních uzlinách oprávněně předpokládat reziduální nádorovou tkáň.
- Pokud budeme akceptovat tento fakt, potom je na zváženou, zda není pro rozhodování nad indikací dalšího postupu po indukční chemoterapii jiná metoda, která by lépe odpovídala předpokládaným prognostickým šancím (PET s vyhodnocením poklesu komsumpce 6-FDG v uzlinách či nádoru, porovnání minimální residuální nemoci před a po indukci, vyhodnocení tumor-regresivních změn v rebioptovaných uzlinách, vyhodnocení tumor-regresivních změn v rebioptovaném nádoru) [12].
Práce byla podpořena grantem MZ ČR NR/7772-3
Prof. MUDr. J. Klein, Ph.D.
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: kleinj@fnol.cz
Zdroje
1. Baas P. Inductive and adjuvant treatment strategies for localized non-small cell lung cancer in operable and inoperable patients. Curr. Opin. Oncol. 2002, 14, 180-4.
2. Klein J., Král V., Neoral Č., et al. Lung resection in a neoadjuvant protocol. Medic. Sci. Monit., 2000., 6, 937–941.
3. Junker, K., Langner, K., Klinke, F., et al. Grading of tumor regression in non-small cell lung cancer. Chest, 2001, 120, 1584–1591.
4. Langner, K., Thomas, M., Klinke, F., et al. Neoadjuvant therapy in non-small cell lung cancer. Prognostic impact of „mediastinal downstaging“. Der Chirurg, 2003, 74, 42–48.
5. Mandard, A. M., Dalibardm F., Mandardm J. C., at al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer, 1994; 73(11): 2680–2686.
6. Eberhardt, W. E., Albain, K. S., Pass, H., et. al. Induction treatment before surgery for non-small cell lung cancer. Lung Cancer, 2003; 42 Suppl. 1: S9-14. Review.
7. Atkins, B. Z., Amico, T. A. Controversial issues regarding the use of induction chemotherapy for lung cancer. Semin. Thorac. Cardiovasc. Surg., 2005 Fall; 17(3):191–194. Review.
8. Granetzny, A., Striehn, E., Bosse, U., et al. Remission rate of mediastinal lymph nodes after multimodal therapy of lung cancer – is it prognostic factor? Zentralbl. Chir., 2003, 128, 640–646.
9. Jaklish, M. T., Herndon, J. E., De Camp, M. M., et al. Nodal downstaging predicts survival following induction chemotherapy for stage IIIA (N2) non-small cell lung cancer in CALGB protocol #8935. J. Surg. Oncol., 2006; 94(7): 599–606.
10. Junker, K., Mueller, K. M., Bosse, F., et al. Apoptose und Tumorregression bei neoadjuvant behandelten lokal fortgeschrittenen nichtkleincelligen Lungenkarcinomen. Der Pathologe, 2003, 24, 214–219.
11. Král, V., Hajdúch, M., Neoral, Č., et al. Význam a možnosti současné cytostatické léčby maligních nádorů: testování účinnosti cytostatik. Rozhl. Chir., 2000, 79, 3, 134–138.
12. De Leyn, P., Stroobants, S., De Wever, W., et al. Prospective comparative study of integrated positron emission tomography-computed tomography scan compared with remediastinoscopy in the assessment of residual mediastinal lymph node disease after induction chemotherapy for mediastinoscopy-proven stage IIIA-N2 Non-small-cell lung cancer: a Leuven Lung Cancer Group Study. J. Clin. Oncol., 2006; 24(21): 3333–3339.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2007 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Ke stému výročí narození profesora MUDr. Bohuslava Niederle, DrSc.
- Chirurgické léčení krvácení z gastroduodenálního vředu
- Umělý svěrač u nemocných po kongenitálních malformacích anorekta
- Dlouhodobé výsledky po radikálních resekcích pro duktální adenokarcinom pankreatu – desetileté zkušenosti
- Naše zkušenosti s peroperační choledochoskopií
- Akútna intestinálna ischémia
- Ošetření střelných poranění a prevence vzniku komplikací v průběhu hojení
- Ošetření zlomenin proximálního humeru pomocí úhlově stabilního antegrádního zajištěného nitrodřeňového hřebu – prospektivní studie
- Bronchoplastické operace pro nemalobuněčný plicní karcinom
- Analýza regresivních změn v lymfatických metastázách plicního karcinomu po indukční chemoterapii
- Zpráva z kongresu
- Recenze
- Recenze
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ošetření střelných poranění a prevence vzniku komplikací v průběhu hojení
- Chirurgické léčení krvácení z gastroduodenálního vředu
- Akútna intestinálna ischémia
- Dlouhodobé výsledky po radikálních resekcích pro duktální adenokarcinom pankreatu – desetileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



