-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteochondrální kloubní spoj a osteoartróza
Osteochondral Articular Junction and Osteoarthrosis
The article brings an overview of information concerning current knowledge about events on the articular osteochondral junction during physiological and pathological conditions.
Keywords:
hyaline cartilage, subchondral bone, osteochondral junction, osteoarthritis
Autoři: J. Falta
Působiště autorů: Rehabilitační středisko FAUST, Náchod
Vyšlo v časopise: Rehabil. fyz. Lék., 20, 2013, No. 4, pp. 179-188.
Kategorie: Původní práce
Souhrn
Článek přináší přehled informací současného vědění o dění na osteochondrálním kloubním spoji za fyziologických i patologických stavů.
Klíčová slova:
hyalinní chrupavka, subchondrální kost, osteochondrální spoj, osteoartrózaÚvod
Degenerativní onemocnění kloubů, osteoartrózy, patří mezi vysoce frekventovaná poškození pohybového aparátu a jejich incidence významně narůstá s postupujícím stárnutím populace a, bohužel, má za důsledek i vysoké procento invalidizace postižených jedinců. Je proto žádoucí na genové a molekulární úrovni podrobně prostudovat patologické mechanismy podílející se na vzniku a průběhu osteoartrotických změn v kloubním chondrokostálním spojení a využít těchto poznatků pro účinnou prevenci a terapii chorob.
Přesto, že je v humánní medicíně věnována této skupině chorob s multifaktoriální etilogií velká pozornost, o čemž vypovídá vysoký počet publikovaných prací z jejich diagnostiky a léčby, zbývá ještě mnohé detaily mechanismu patologických dějů v postiženém kloubu objasnit. Nepostradatelnou úlohu pro získání komplexnějších poznatků o příčinách a průběhu osteoartrotických změn proto představuje studium příčinných podmínek chorobného procesu, které se dají studovat na experimentálních zvířecích modelech (3, 8, 30).
Je všeobecně známo, že toto chronické kloubní onemocnění je důsledkem náhlého nebo postupného poškození některé součásti komplexu kloubního spojení - komponentu kloubní chrupavky, subchondrální kosti, vazů, úponů, tkání kloubního pouzdra, synoviální membrány, případně periatrikulárních svalů. Dlouhodobě panovaly u osteoartrotického onemocnění představy, že klíčovou úlohu při vzniku a progresi patologického procesu zaujímají primárně degenerativní alterace v kloubní chrupavce. Poškození povrchové linie kloubní chrupavky, snížení počtu chondrocytů a úbytek proteoglykanů v matrix chrupavky následovaný jejím ztenčením a případně i trhlinkami v její stěně, představovalo dosti přesvědčivé argumenty pro tuto hypotézu. Možnosti podrobnějšího prostudování experimentálně navozeného patologického procesu u pokusných zvířecích modelů však přispěly k poznání, že nejméně stejně důležitou roli v realizaci patologických dějů v kloubním kompartmentu představují souběžně probíhající změny ve struktuře i funkčním chování komponent subchondrální kosti. Obě komponenty kloubu lze tak i považovat za rovnocenně důležité subjekty alteračního procesu. V poslední době se někteří autoři přiklánějí k názoru, že významnější roli v patologických dějích v rámci osteoartrotických změn sehrává spíše subchondrální kost než kloubní chrupavka (10, 32, 35, 40).
Při patologických procesech spojených s artrotickým procesem je prokazatelně narušen rovnovážný stav mezi procesy syntézy a degradace jednotlivých složek kloubní chrupavky a složek subchondrální kosti. Obvykle jsou za závažnější proces považovány degenerační změny, ale v současnosti se stále více autorů shoduje na poznatku, že podstatnou úlohu v etiopatogenezi změn kloubu představují defektní mechanismy v regeneračních procesech (31, 40).
MORFOLOGIE A FYZIOLOGIE KLOUBNÍ CHRUPAVKY
Hyalinní typ chrupavčité tkáně, která se nachází na artikulárních plochách kloubů, je u člověka a experimentálních zvířat nejlépe prostudovaným typem chrupavek. To nás uspokojivě informuje o složitosti biologických vztahů a regulací v této avaskulární, aneurální a alymfatické specifické pojivové tkáni s významnými biomechanickými vlastnostmi.
Dominantní skladební komponenty buněčného typu představuje v adultní artikulární chrupavce populace chondrocytů, které jsou zastoupeny přibližně pouze ve 2 - 5 % objemu tkáně chrupavek. Chondrocyty jsou lokalizovány v prostředí mezibuněčné hmoty, která vzniká jejich produkcí, v extracelulární matrix. Mají vysokou intenzitu aerobního i anaerobního metabolismu v neustále se měnících fyzikálně-chemických podmínkách relativně hypoxického a kyselého prostředí ve srovnání s jinými tkáněmi. Přísun nutričních substrátů a plynů je pro chondrocyty zprostředkován difuzí ze synoviální tekutiny a ze subchondrální kosti. V takto náročných podmínkách stabilita a funkčnost kloubní chrupavky je řízena složitou cestou signálních interakcí mezi tkáňovými komponentami a biologickými a biomechanickými vlivy prostředí (32, 35, 45).
Kloubní chrupavka má hierarchické uspořádání do několika zón, které se strukturálně a organizačně mění s hloubkou, uspořádáním a lokalizací v kloubním spoji (např. podle místa mechanického nebo hmotnostního zatížení). Rozlišují se čtyři odlišné histologické a biochemické zóny (I-IV):
(I) – tangenciální zóna (povrchová)
(II) –přechodová zóna
(III) – radiální zóna
(IV) – zóna mineralizované (zvápenatělé) chrupavky
Povrchní zóna je nejtenčí, probíhá podél kloubní plochy a spojuje se na kloubním okraji s perichondriem. Vlákna kolagenu typu II v povrchové zóně jsou orientována trajektoriálně na kloubní plochy a poskytují tak větší odolnost na tahové zatížení. Mezi nejhlubšími úseky nekalcifikované a kalcifikované zóny (mezi zónou III a IV) se nachází zřetelná hraniční linie, která se označuje jako tide-mark (11, 26, 36).
Matrix je spolutvořena fibrilárními jednotkami a amorfní základní hmotou. Takto komponovaný strukturální komplex vybavuje chrupavku pružností, která se podílí ve zdravém kloubu na zvládnutí mechanických stresů bez trvalé deformace a poškození během ontogeneze. Významný podíl extracelulárních komponent hyalinní chrupavky kloubu tvoří voda, která představuje u zdravé chrupavky 72 – 75% zastoupení. Čtyřicet procent suché hmotnosti hyalinní chrupavky tvoří majoritní složka kolagenu fibrilárního typu označovaného jako kolagen typu II a je doplněná nízkým podílem přítomnosti kolagenů asociovaných s fibrilami typu IX, XI a VI, které vykazují podpůrnou a stabilizační funkci pro trojrozměrnou strukturu kolagenu typu II. Snížená funkce kolagenu typu IX pravděpodobně může přispět k rozvoji degenerativních změn chrupavky.
Základním strukturálním prvkem kloubní chrupavky je podoba prostorové sítě z kolagenních vláken, tvořená především vlákny kolagenu typu II. Ten je chondrocyty produkován exocytózou v podobě prokolagenních propeptidů, které se po spojení v kolagenní vlákna vzájemně propojují stabilními příčnými kovalentními vazbami. Peptidový skelet takto vzniklé kolagenní molekuly je velmi stabilní a odolávající působení proteolytických enzymů.
Vedle kolagenů tvoří další složku chrupavky proteo-glykany, které vyplňují prostor mezi kolagenními vlákny a chondrocyty. Proteoglykany chrupavky zastoupené chondroitin-4-sulfátem, chondroitin-6-sulfátem a keratan-sulfátem tvoří propojením s dlouhými molekulami hyaluronové kyseliny glykosaminoglykan – proteinový komplex, který interaguje s kolagenem a vytváří specifické agregáty. Na tomto procesu má významný podíl agrekan a v nižším podílu i dekorin, fibromodulin, lumikan a biglykan. Přesnější úloha minoritně zastoupených bílkovin při tvorbě součástí matrix není však dosud objasněna. K proteinům mezibuněčné hmoty chrupavky patří také COMP (cartilage oligomeric matrix protein), který se nachází zejména v rostoucí chrupavce, kde je syntetizován chondrocyty. Exprese COMP je velmi nízká u nezralé chrupavky a zvyšuje se s jejím rozvojem. U dospělé chrupavky je COMP obsažen zejména v jejích povrchových vrstvách (26, 33).
Monomerní molekulární komplex agrekanu se skládá z centrálního proteinu, keratansulfátové domény, dvou chondroitinsulfátových domén, vazebné domény pro kyselinu hyaluronovou a dalších menších úseků. Agrekan se váže přes své globulinové domény pomocí linkoproteinu na hyaluronanové řetězce. Velké agregáty agrekanových komplexů, které se spojují v síť s kolagenovými fibrilami, tak představují důležitou strukturálně-funkční jednotku, jejíž klíčovou úlohou je akumulace negativního náboje a vytvoření vysokého osmotického tlaku ve tkáni, který vtahuje vodu a váže ji ve tkáni chrupavky. Vysoký obsah hydratační vody vázané na záporné náboje proteoglykanů tvoří gelovou strukturu, uplatňující se na viskoelastických vlastnostech kloubu a může tak na změny mechanického zatížení reagovat reverzibilní stlačitelností jako pružný tlumič absorbující nárazy. Funkční zdatnost hyalinní kloubní chrupavky je závislá na kvalitativním a kvantitativním zastoupení proteoglykanů a jejich glykosaminoglykanových řetězců a složení a uspořádání kolagenních fibril (11, 29, 33, 38).
Při látkovém obratu chrupavky za fyziologických i patologických podmínek je agrekan proteolyticky štěpen a jeho fragmenty jsou uvolňovány do dutiny synoviálního pouzdra. Za normálních okolností je však tento proces řízen, a tím je udržována tkáňová homeostáza. U osteoartrózy je však prostorová organizace, včetně náboje agrekanu, narušena a snižuje se tak schopnost tkáně vázat vodu.
Struktura a složení agrekanu se s přibývajícím věkem a stárnutím chrupavky poněkud mění. Zvyšuje se heterogenita velikosti molekul agrekanu a snižuje se koncentrace molekul pomocného vazebného proteinu, což pravděpodobně zhoršuje funkční vlastnosti molekul agrekanu.
Fyziologické změny agrekanu, ke kterým dochází v souvislosti s maturací a stárnutím chrupavky, nelze ztotožnit s artrotickými změnami, neboť fyziologické změny spojené s procesem stárnutí stále umožňují chrupavce plnit její funkci a odolávat biomechanickým a biochemickým vlivům, kterým je vystavena. Biosyntéza, složení a struktura agrekanu v lidské artrotické chrupavce se velmi odlišuje od normální, dospělé lidské chrupavky. Další významnou komponentou základní hmoty je glykoprotein chondronektin, který zajišťuje adhezi chondrocytu ke kolagenu v okrsku teritoriální matrix a podílí se i na metabolickém obratu chondrocytů, který probíhá především cestou anaerobní glykolýzy. Společně s probíhající syntézou součástí matrix je celý tento biologický proces striktně podřízen regulačnímu vlivu hormonů (37, 38, 45).
PATOFYZIOLOGICKÉ PROCESY VE CHRUPAVCE PŘI OSTEOARTROTICKÉM ONEMOCNĚNÍ
Artrotické změny v chrupavce se týkají prakticky všech zmíněných složek. Časnou změnou je zvýšení objemu chrupavky, způsobené jejím edémem; kolagenní síť je poškozena a nestačí účinně odolávat vysokému osmotickému tlaku agrekanových molekul.
U časné OA jsou fragmenty proteoglykanů uvolňovány z kloubní chrupavky do synoviální tekutiny. Jejich úbytek je kompenzován aktivitou chondrocytů, které se snaží udržet jejich celkové množství. Proces je však značně nerovnoměrný, a tak lze v chrupavce detekovat místa se sníženým i zvýšeným obsahem agrekanu. Tato heterogenita je podmíněna různým stupněm syntézy a degradace v určité části chrupavkové tkáně. Je také možné, že edém chrupavky je způsoben neschopností zvýšit hustotu agrekanu.
I přes svou vysokou stabilitu podléhá agrekan proteolytickému štěpení a jeho fragmenty jsou uvolňovány do synoviální tekutiny. Proteolytické enzymy se účastní fyziologické degradace jednotlivých složek kloubní matrix. Exprese mRNA těchto proteináz a jejich přirozených inhibitorů je řízená a za fyziologických podmínek je proces degradace v rovnováze s novotvorbou složek matrix. U osteoartrózy se tento mechanismus vymyká kontrole a aktivita chondrocytů, směřující k udržení normální struktury a složení matrix, posléze selhává.
Kolagenní síť je tvořena, jak bylo uvedeno výše, heterotypickou strukturou kolagenu typu II, IX a XI. Všechny proteolytické enzymy, které se účastní jejího odbourávání, nebyly dosud identifikovány. Jedná se především o superrodiny metaloproteináz. Agrekan obsahuje ve své molekule několik míst, jež podléhají proteolytickému štěpení. Na degradaci agrekanu se podílejí metaloproteinázy a agrekanáza.Působení těchto mechanismů bylo podrobně studováno v pokusech in vivo a in vitro a vytypovalo užší spektrum metaloproteináz s prokázaným vlivem na patologické působení v komponentách kloubní chrupavky a celého chondrokostálního spojení (18, 20, 21).
Při osteoartrotickém onemocnění dochází prvotně k biodegradaci složek mezibuněčné hmoty chrupavky, na niž reagují chondrocyty zvýšením své aktivity, směřující ke kompenzaci defektů v matrix, které biodegradací vznikají. Viabilita chondrocytů a jejich schopnost odolat apoptóze je podmínkou vyrovnávací biosyntézy proteinů extracelulární matrix. Uvedené změny neprobíhají v celé chrupavce homogenně; rozdíly jsou patrné v jednotlivých vrstvách a v oblastech různě vzdálených od chondrocytu. Přitom klesá množství kyseliny hyaluronové a snižuje se její molekulová hmotnost, což vede ve svém důsledku ke zhoršení kvality synoviální tekutiny. Synoviální tekutina je méně vazká, ztrácí svou vysokou viskozitu, a s tím spojenou schopnost lubrikace kloubních povrchů a ochrany receptorů pro bolest. Množství kloubní tekutiny tedy není snížené, jak bývá někdy mylně uváděno - je stejné, nebo i zvýšené, ale rozhodující změnou je právě nižší kvalita synoviální tekutiny. Jako hlavní iniciační faktory časné fáze progrese osteoartritického procesu se předpokládají enzymatické degradace chrupavky, které se projeví makroskopicky a mikroskopicky detekovatelnými změnami v povrchové zóně volné kloubní chrupavky. Charakterizují se zdrsněním junkční linie, včetně vytvořením mikroragád, které zřejmě naruší prostorové uspořádání a kontinuitu kolagenních vláken, a pokud pokračují do hlubších vrstev, vyvolají vážné poškození kloubního reliéfu a současně i aktivaci zánětlivého procesu. V zánětlivé odezvě se uplatní významně proteinázy uvolněné z neutrofilů, včetně zástupců rodiny matrixových metaloproteináz, desintegrinových typů metaloproteináz ADAMs a ADAMTs, elastáz, katepsinu G a katepsinu B, projevující silné proteolytické účinky. Jejich působením se může snížit v matrix podíl zastoupení agrekanu. Snížení titru, důležitého molekulárního organizátoru glykosaminoglykan – proteinového komplexu (porušením jeho integračního úkolu ve složkách matrix), akceleruje ve chrupavce destrukční pochody (22, 23). Současně s nimi probíhají i změny morfologie a fyziologie u chondrocytů. Jejich reakce na signály zánětlivých faktorů se projeví nefyziologickou formou hypertrofie a částečně i jejich lokálním zmnožením. Některé z nich podléhají následně apoptotické degeneraci nebo kalcifikačním transformacím. Tento stav vede postupně ke zdrsnění povrchové linie chrupavky a dalšími vlivy, zejména mechanickými inzulty, dochází k abrazi, denudaci, až k zániku chrupavčité tkáně. Odbourání proteoglykanů ze základní matrix se projeví desintegrací a chaotickým uspořádáním kolagenních vláken, a tím se zbortí i původní uspřádání prostorového modulu hyalinní chrupavky vytvořeném ve zdravém kloubu. Pozměněná morfologie kloubní chrupavky zapříčiní změnu funkčních vlastností kloubu a zároveň se stane signálem indukujícím reakce v dalších kompartmentech kloubního spoje. Na tyto podněty zareagují struktury subchondrální kosti, které se nacházejí v bezprostředním kontaktu s porušenou artikulární chrupavkou a zároveň zareagují i komponenty synoviální membrány a synoviální tekutiny. Subchondrální kost se postupně přestavuje kaskádou remodelačnch procesů, které se projeví ve svém důsledku změněnou denzitou a tuhosti kloubního spoje, což se projeví porušením viskoelasických a biomechanických funkcí, které za fyziologických poměrů tato struktura zajišťuje (19, 26, 33, 34, 38).
Na těchto komplexních dějích, spojitě probíhajících za fyziologických i patologických podmínek ve strukturách kloubní chrupavky a subchondrální kosti, se podílí množství biologicky aktivních působků, které regulují lokální tkáňové poměry při resorpčních i proliferačních procesech. Z těchto okruhů jsou dobře prostudovány děje spojené s poškozením kloubních tkání a stále přibývají nové informace z výsledků experimentů modelujících patologický proces a používajících k jeho sledování metody molekulární biologie. Jsme tak podrobněji informováni o mechanismech genových expresí a vlivu jejich produktů při patologickém procesu v kloubu probíhajícím.
Intenzivně studovaná úloha matrixových metaloproteináz (MMP), členů rodiny multidoménových zinek - dependentních endopeptidáz, související s jejich schopností ve tkáňových systémech modulovat řadu biologických procesů jak fyziologických (např. v průběhu embryogeneze, remodelace normálních tkání, angiogeneze, případně dějů při hojení ran), tak v patologických dějích spojených např. s patologickými procesy v cévním systému, nádorovou proliferací a samozřejmě i s degenerativním onemocněním kloubů. Jejich univerzální schopnosti degradovat všechny součásti extracelulární matrix předurčují metaloproteinázy jako subjekt, jehož ovlivnění antagonisticky působícími substancemi by bylo možné využít v terapii. Mnoho informací je recentně získáno především ze studia experimentálních modelů simulujících podmínky osteoartrotického onemocnění a onemocnění revmatoidní artritidou (2, 20, 21, 27).
Z početné palety dnes již šestadvacetičlenné rodiny těchto MMP se pozornost soustřeďuje na účinky MMP-13 (kolagenáza-3 ) a MMP-2 (gelatináza A). Tyto typy enzymů jsou produkty chondrocytů a buněk synoviální membrány a je prokázáno, že u lidských typů zánětlivého onemocnění kloubů sehrávají klíčovou úlohu při destrukci kloubní chrupavky. Jejich úloha v zánětlivém procesu je v posledních letech intenzivně studována na experimentálních modelech u myší a potkanů s výhledem jejich efektivního zablokování pomocí aplikací jejich přirozených antagonistů z rodiny tkáňových inhibitorů metaloproteináz (TIMP), případně připravením účinného specifického inhibitoru chemickou preparací.
Vzhledem k univerzálnosti biologického účinku MMP jsou samozřejmě studovány i další zástupci z dnes již šestadvacetičlenné rodiny těchto enzymů. Pozornost byla např. věnována typům MMP -2 (gelatináza –A), MMP-9 (gelatináza-B)a MMP-1 (kolagenáza -1), o nichž je známo, že realizují důležité remodelační tkáňové procesy například během hojení kožních lézí a spálenin (1, 4, 15, 20).
Imunohistochemickou lokalizací MMP-2 a MMP-9 v chondrokostálním spoji u experimentálního modelového poškození kloubních struktur potkanů a králíků jsme se zabývali i v naší laboratoři, s ohledem na sledování změn jejich distribuce a množství při ovlivnění reparačních procesů kloubního aparátu, jednorázovou aplikací vysoce viskózního roztoku kyseliny polyanhydroglukuronové (PAGA) (17).
Léze kloubních struktur jsme iniciovali jednorázovým intraartikulárním podáním 1 ml směsi 0,5% bupivikainu, u kterého byl in vivo i in vitro prokázán chrupavku poškozující účinek (12, 16). Současně nebo v následných intervalech bylo aplikováno pokusnému jedinci 0,5 ml nanotechnologickým procesem připraveného vysoce viskózního roztoku PAGA (kyseliny polyanhydroglukuronové), s jejímž příznivým účinkem na kvalitu a rychlost hojení tkáňových defektů jsme měli poznatky z jiného typu experimentů studujících reparativní procesy v průběhu hojení povrchových i hlubokých kožních lézí. Histopatologické vyšetření kloubů, takto ovlivněných ve srovnání s kontrolními klouby u téhož jedince po dvou až šestitýdenním období, vykázalo spíše drobnější morfologické odchylky ve tkáních exponovaného kloubu, včetně zhojení vpichem injekčí jehly poškozeného kloubního pouzdra. Některé dosud nepublikované nálezy z tohoto experimentu, ilustrující na světelně mikroskopické úrovni změny ve tkáních komplexu kloubní chrupavka - subchondrální kost - synoviální tkáně, uvádíme v obrazové dokumentaci sdělení (17) (obr. 1).
Obr. 1. Histologické vyšetření kloubů. A – přehledný obraz uspořádání struktur kloubní chrupavky a komponent subchondrální kosti (ploténka a trámce) v kontrolním intaktním kolenním kloubu distální končetiny králíka – šestý týden experimentu (barvení hematoxylin – eozinem (HE), zvětšení 40x). B – detailní pohled na stratifikaci a diferenciaci chondrocytů v kloubní chrupavce, včetně pravidelné linie průběhu kontaktní zóny se subchondrální kostí v intaktním kolenním kloubu, světle zvýrazněná linie (barvení HE, zv. 100x). C – řez kolenním kloubem distální končetiny králíka šestý týden po experimentálním ovlivnění bupivicainem a následnou aplikací PAGA.V kloubní chrupavce je patrná vystupňovaná diferenciace kolumnárního uspořádání chondroblastů a chondrocytů, linie kontaktu bazálních úseků chrupavky a komponent subchondrální kosti má pilovitý průběh (barvení HE, zv. 40x). D – detailní zobrazení z předchozího řezu – světlá linie vyznačuje nepravidelnosti kontaktní zóny kloubní chrupavka – subchondrální kost (barvení HE, zv. x200). 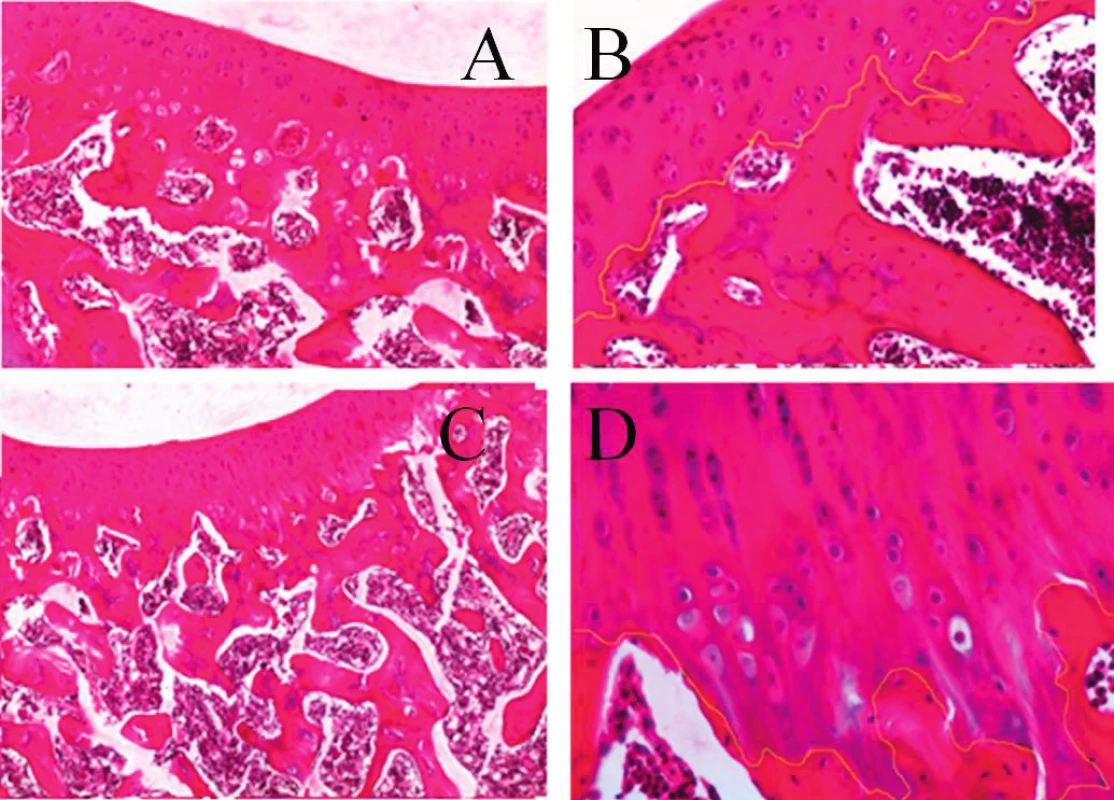
MORFOLOGIE SUBCHONDRÁLNÍ KOSTI
Podobně jako modelační a remodelační procesy u kloubní chrupavky jsou za fyziologických i patologických podmínek neustále dynamickým procesem remodelovány komponenty subchondrální kosti. Terminologie součástí tohoto osteochondrálního kontaktu nejsou v písemnictví zcela jednotné. Komplexním termínem subchondrální kost jsou obvykle označovány tyto struktury: kalcifikovaná tkáň ležící pod hraniční linií tidemarku artikulární chrupavky, denzní cementová linie, separující kalcifikovanou chrupavku od oblasti tenké kostní ploténky -kortikální lamely.Ke spodní části kortikální kostní lamely se připojují kostní trámce, které tvoří tzv. subarktikulární spongiózu. Souhrnně lze tedy pod pojmem subchondrální kost rozumět zónu zvápenatělé chrupavky, subchondrální kostní ploténku, včetně cementové linie, a subartikulární spongiózní kostní hmotu (24, 28, 39). Jinak definují subchondrální kost Duncan a spol.(13, 14), označují ji jako zónu oddělující kloubní chrupavku od dutin kostní dřeně, skládající se za fyziologických podmínek ze dvou vrstev - kalcifikované oblasti kloubní chrupavky a vrstvy lamelární kosti.
Subchondrální kost, oddělující kloubní chrupavku od kostní dřeně, se tak skládá ze dvou odlišně mineralizovaných vrstev. Linii kontaktu mezi hyalinní kloubní chrupavkou a cementovou linií kostního subchondrálního kompartmentu tvoří zóna mineralizované chrupavky o vyšší hustotě a podílu zastoupení anorganického materiálu. Tato kontaktní oblast má významné biomechanické funkce, neboť představuje rozdílná prostředí s velmi výraznou změnou tuhosti. Jak již bylo zmíněno výše, v hyalinní artikulární chrupavce je převážně zastoupen kolagen typu II, ve zvápenatělé zóně je však přítomen kolagen typu X. Kortikální ploténka obsahuje především kolagenní fibrily typu I, které pokračují do lamel trámčité kosti. Za důležitý je třeba označit fakt, že žádný typ kolagenních vláken neprobíhá kontinuálně mezi zónou zvápenatělé chrupavky a subchondrální kostní ploténkou. Osteochondrální spojení tedy představuje daleko fragilnější oblast než je tomu na hranici mezi hyalinní a kalcifikovanou chrupavkou, kterou procházejí kolagenní fibrily, a tím toto prostředí výrazně stabilizují (5, 6, 7).
Bezprostředně pod zónou kalcifikované chrupavky /oblast cementové linie a subchondrálního kostního plátu/ se nachází hustá, mřížovitě uspořádaná kostní tkáň s četnými interkomunikačními místy, které se v hlubších vrstvách zvětšují, prodlužují a jeví tendenci tvorby subartikulární kostní spongiózy. Tato oblast bývá výrazně kavitovaná a takovým uspořádáním se stane bohatě vaskularizovanou a inervovanou zvláště v oblastech, kde chrupavky i kosti jsou více namáhány.
Chrupavčitá tkáň (hyalinní i kalcifikovaná) je pevně ukotvena do velmi nepravidelného reliéfu podložní subchondrální ploténky.To umožňuje transformaci sil při namáhání během komprese,trakce i smyku . Mezi vrstvami hyalinní chrupavky, tidemarkem, zvápenatělé chrupavky, cementovou linií, subchondrálním kostním plátem a subartikulární kostní spongiózou je velmi prudký sklon tuhosti, který může být příčinou poškození chrupavky vinou prudkého tlaku. Subchondrální kost tlumí přibližně 30 % zátěže na kloub, pouze 1-3 % zátěže jsou tlumeny chrupavkou (9, 28, 29,40).
Síla subchondrálního plátu koreluje se stupněm zátěže daného regionu kloubu, tvarem kloubní plochy i funkcí kloubu. Například konvexní plochy subartikulárních kostních struktur bývají tenčí, v konkávních plochách je nejsilnější vrstva subartikulárních kostních struktur v centrální oblasti. Také je možné v subchondrálních kostních strukturách pozorovat rozdílné rozložení denzity (mineralizace). Obecně lze říci, že větší hustotu mají nejvíce zatěžované oblasti kloubní plochy. Díky srovnávacím studiím bylo prokázáno, že změny v denzitě subchondrální kosti jsou biomechanickou adaptací na mechanickou zátěž kloubního spoje. Dále bylo také prokázáno, že kloub s vysokým stupněm kongruence má slabší vrstvu hyalinní chrupavky, kdežto kloub s nízkou mírou kongruence je pokryt silnou vrstvou artikulární chrupavky. Silnější vrstva kloubní chrupavky může být snadněji deformována tlakovými silami, a tím rozšířit artikulační plochu nesoucí zátěž, a tím zmenšit tlak na jednotku plochy (9, 10,32, 34, 39).
PATOFYZIOLOGICKÉ PROCESY V SUBCHONDRÁLNÍ KOSTI PŘI OSTEOARTRÓZE
Osteoartrotické změny se projeví na strukturálních i funkčních vlastnostech subchondrální kosti zejména v oblasti tzv. subchondrální ploténky, uložené pod kloubní chrupavkou. Subchondrální ploténka reaguje velmi citlivě na degenerativní proces v chrupavce poruchou remodelace kostní tkáně. Osteoplastické procesy, zprostředkované signální drahou Wnt pro progenitorní buňky vstupující do chondrogenní a také do osteogenní diferenciace, mají za úkol účastnit se následně na procesech definitivního formování kostních struktur. Wnt signál zesiluje expresi osteoprogerinu a zároveň se projevuje jeho inhibiční vliv na diferenciaci a aktivaci osteoklastů. Tímto mechanismem tak může inhibovat destrukční děje v zánětem postižených kloubech (13, 18, 34).
V počátečních stadiích osteoartrotického poškození reaguje subchondrální kost zvýšenou remodelací. Remodelace je však vyšší pouze v místech uložených bezprostředně pod artrotickou lézí, zatímco pod neporušenou chrupavkou je remodelace normální. Vysoký stupeň remodelace vede k nedostatečné mineralizaci novotvořené kostní tkáně a ke snížení její pevnosti. V průběhu artrotického procesu dochází postupně ke snížení až útlumu kostní remodelace, což koresponduje s obrazem subchondrální sklerózy v pozdějších stadiích onemocnění. Nicméně s ohledem na skutečnost, že osteoartróza je fokální, heterogenní proces, mohou se v jednom postiženém kloubu střídat oblasti se zvýšenou i sníženou remodelací, cystoidní dutiny i osteofyty (2, 4, 5).
V průběhu choroby se mohou iniciovat zánětlivé reakce synoviální výstelky jako důsledek lokální aktivity makrofágů, odstraňujících detritus fragmentů chrupavkové tkáně a přítomnosti mediátorů zánětu, např. cytokinů typu IL-1, IL-6, TNFalfa, prostaglandinů a podobně.
Osteochondrální defekt je defektem jak kloubní chrupavky, tak pod ní ležící subchondrální kosti. Díky přístupu ke kostní spongióze je spontánní hojení osteochondrálních defektů mnohem efektivnější než hojení chondrálních defektů, které jsou jen vzácně obnovovány buňkami migrujícími ze synoviální membrány. Osteochondrální defekt je nejprve zaplněn krevní sraženinou, která se utvoří po kontaktu kostní dřeně s defektem. Pluripotentní nediferencované mezenchymální buňky přítomné v krvi se diferencují pod vlivem spuštění růstových faktorů na chondrocyty a osteoblasty, které později vytvářejí opravnou chrupavčitou tkáň a novou subchondrální kost. Jsou vedeny transkripčním faktorem genové rodiny SOX, migrují, proliferuijí, diferencují se a posléze syntetizují mimobuněčnou matrix. Asi po dvou týdnech se začínají objevovat vřetenovité buňky jako základ chrupavčité opravné tkáně. Proces chondrogeneze uvnitř defektu je dokončen až po několika měsících. Proces je charakterizován výskytem kulatých buněk a přítomností nové chrupavkové matrix, která obsahuje proteglykany a kolagen typů I a II (22, 23, 43).
Je celkem překvapivé, že nově vzniklá tkáň plně neintegruje s již existující okolní chrupavčitou matrix. Sousední chondrocyty nepoškozené kloubní chrupavky se neúčastní hojení defektu, dokonce postupně odumírají a chrupavka se zde stává bezbuněčnou. Po úplném zhojení nová tkáň uvnitř defektu vykazuje fenotyp vazivové chrupavky a také jsou zde přítomny známky rané degenerace. Bylo prokázáno, že některé osteoblasty při osteoartróze subchondrální kosti jsou fenotypicky diferencovány a produkují zvýšenou hladinu alkalické fosfatázy (AP), osteopontinu, osteokalcinu, interleukinů /IL-6,8/, transformačního růstového faktoru beta (TGF-beta), inzulinu podobného růstového faktoru-1 (IGF-1), urokinázy plazminogen aktivátoru (uPA) a prostgalndinu E2 (PGE2). Zatímco hladina IGF vázajících proteinů 3-5 je snížená, hladiny inhibitoru plazminogenového aktivátoru (PAI) a interleukinu-1(IL-1) beta zůstávají nezměněné (23, 31, 41, 42).
V kostní matrix osteoblasty vytvářejí nahromadění volného IGF-1, který hraje klíčovou roli při vzniku sklerózy kostního plátu při osteoartróze. Také osteoblasty při osteoartróze jsou rezistentní na stimulaci parathormonem /PTH/ a navíc produkují abnormální homotrimerický kolagen typu I s nízkou afinitou ke kalciu, což vede ke snížené mineralizaci osteoartrotické subchondrální kosti. IL-6, PGE2 a receptor, aktivující nukleární faktor kappa B ligandu (RANKL), mohou být odpovědné za zvýšenou aktivitu osteoklastů při osteoartróze subchondrální kosti a následné kostní resorpci, pozorované v časném období osteoartrózy (5, 6, 7, 31, 44).
Remodelace kostní hmoty je závislá na vybalancované a koordinované aktivitě osteoblastů a osteoklastů. Funkcí osteoblastů je mimo jiné produkce prostaglandinů, růstových faktorů a cytokinů, kterými působí na osteoklasty. Osteoblasty jsou vybaveny mechanoreceptory, reagujícími na působení mechanických tlaků na kloub. Přes aktivaci těchto mechanoreceptorů se spouští kaskáda inrtracelulárních signálů, ovlivňujících dění na iontových kanálech, semipermeabilní buněčné membráně i cytoskeletu.
Při remodelaci kostní hmoty se také mění hladiny zúčastněných enzymů. Je podstatně nízké zvýšení produkce metaloproteinázy 3 /MMP-3/, prostaglandinu E-2 /PGE 2/ a interleukinu-6 /IL-6/ , kdežto hladiny 15-hydroxyprostaglandin-dehydrogenázy a osteoprotegerinu /OPG/ signifikantně klesají. Pouze úroveň produkce /RANKL/ se nemění. Z toho lze vyvozovat fakt, že mechanické přetěžování kloubních struktur může vést ke skleróze subchondrálního skeletu (56, 24, 25, 42, 47).
ZÁVĚR
Citované studie prokazují velkou variabilitu subchondrálních kloubních struktur. Prokazují fakt, že změny rozložení tlaku jsou následovány změnami kloubní morfologie. Subchondrální struktury a hyalinní kloubní chrupavka tvoří jednu společnou funkční jednotku s velice rozdílnými mechanickými vlastnostmi. Subchondrální kostní plát plní jednak funkci mechanickou, ale také neméně důležitou funkci metabolickou, je také dějištěm aktivní remodelace. Vykazuje také významné topografické odchylky – tloušťky, denzity,vaskularity, biochemického složení i mechanických vlastností. Přesto však citované studie prokazují určitou systematiku v této variabilitě, která je chápána jako dynamická odpověď kloubních struktur na dlouhodobé zatížení kloubního povrchu.
Změny ve fyziologických poměrech při osteoartróze vedou ke změnám ve fenotypu osteoblastů takto postiženého regionu, a tím dochází k postupnému zvýšení kostního obratu (schéma 1). Z výše uvedeného vyplývá, že je přinejmenším diskutabilní často uváděný názor, že chrupavka je nadřazeným orgánem nad subchondrální kostí. Obě tyto složky kloubu jsou rovnocenné, jedna bez druhé nemohou existovat. Nelze tedy věnovat méně pozornosti výzkumu subchondrálních struktur než výzkumu hyalinní kloubní chrupavky.
Schéma 1 Časné změny u počínající osteoartrózy, vyvolané exogenními vlivy, indukují nerovnováhu mezi formováním a resorpcí tkání subchondrální kosti a kloubní chrupavky. Osteoblasty subchondrální kosti exprimují cytokiny a růstové faktory (IL-1,IL-6, TNFb, IGF-1), které zvyšují aktivitu osteoklastů. Tento stav vede ke zvýšení kostní resorpce a zároveň vyvolá u chondrocytů zvýšenou produkci proteáz (MMP, ADAMTS). Nepoměr mezi aktivitami osteoprogerinu a RANKLu se projeví zvýšením katabolických procesů v celé osteochondrální jednotce. 
Adresa pro korespondenci:
MUDr. Jan Falta
Zámecká 239
547 01 Náchod
Zdroje
1. BASSIL, J., SENNI K., CHANGOTADE, S., BAROUGH, B., KASSIS, C., NAAMAN, N., GODEAU, G.: Expression of MMP-2, 9 and 13 in newly formed bone after sinus augmentation using inorganic bovine bone in human. J. Periodontal. Res., 46, 2011, 6, s. 756-762.
2. BELLIDO, M., LUGO, L., ROMAN-BLAS, J. A. et al.: Improving subchondral boneintegrity reduces progression of cartilage damage in experimental osteoarthritis preceded by osteoporosis. Osteoarthritis Cartilage, 19, 2011, s. 1228-1236.
3. BENDELE, A.M.: Animal models of osteoarthritis in an era of molecular biology. J. Musculoskelet. Neuronal Interact., 2, 2002, 6, s. 501-513.
4. BLOM, A. B., van der KRAAN, P. M., van den BERG, W. B.: Cytokine targeting in osteoarthritis. Curr. Drug. Targets, 8, 2007, s. 283-292.
5. BOYCE, B. F., XING, L.: Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch. Biochem. Biophys., 473, 2008, 2, s. 139-146.
6. BOYCE, B. F., YAO, Z., XING, L.: Functions of nuclear factor kappaB in bone. Ann. N. Y. Acad. Sci., 1192, 2010, s. 367-375.
7. BOYCE, B. F., ROSENBERG, E., de PAPP, A. E., DUONG, T.: The osteoclast, bone remodelling and treatment of metabolic bone disease. Eur. J. Clin. Inves., 42, 2012, 12, s. 1332-1341.
8. BRANDT, K. D.: Animal models of osteoarthritis. Biorheology, 39, 2002, s. 221-235.
9. BROWN,T. D., VRAHAS, M. S.: The apparent elastic modulus of the juxtarticular subchondral bone of the femoral head. J. Orthop. Res., 2, 1984, 1, s. 32-38.
10. CASTANEDA, S., ROMAN-BLAS, J. A., LARGO, R. et al.: Subchondral bone as a key target for osteoarthritis treatment. Biochem. Pharmacol., 83, 2011, s. 315-332.
11. CLARK, J. M.: The organisation of collagen fibrils in the superficial zones of articular cartilage. J. Anat., 171, 1990, s. 117-130.
12. DOGAN, N., ERDEM, A. F., ERMAN, Z., KIZILKAYA, M.: The effects of bupivacaine and neostigmine on articular cartilage and synovium in the rabbit knee joint.Int. Med. Res., 32, 2004, 5, s. 513-519.
13. DUNCAN, H.: Cellular mechanisms of bone damage and repair in the arthritic joint. J. Rheumatol. Suppl., 11, 1983, s. 29-37.
14. DUNCAN, H, JUNDT, J., RIDDLE, J. M., PITCHFORD, W., CHRISTOPHERSON, T. The tibial subchondral plate. A scanning electron microscopic study. J. Bone Joint. Surg. Am., 69, 1987, 8, s. 1212-1220.
15. EBRAHIMIAN, T. G., SQUIBAN, C., ROQUE, T., LUGO-MARTINEZ, H., HNEINO, M., BUARD, V., GOURMELON, P., BENDERITTER, M., MILLIAT, F., TAMARAT, R.: Plasminogen activator inhibitor-1 controls bone marrow-derived cells therapeutic effect through MMP9 signaling: role in physiological and pathological wound healing. Stem Cells., 30, 2012, 7, s. 1436-1446.
16. ERDEN, I. A., ALTINEL, S., SARICAOGLU, F., ZEYBEK, N. D., AKINCI, S. B., ASAN, E., AYPAR, U.: Effect of intra-articular injection of levobupivacaine on articular cartilage and synovium in rats. Anaesthesist, 61, 2012, 5, s. 420-423.
17. FALTA, J.: nepublikované sdělení, 2013.
18. FERNANDES, J. C., MARTEL-PELLETIER, J., PELLETIER, J. P.: The role of cytokines in osteoarthritis pathophysiology. Biorheology, 39, 2002, 1-2, s. 237-246.
19. FUNCK-BRENTANO, T., COHEN-SOLAL, M.: Crosstalk between cartilage and bone: when bone cytokines matter. Cytokine Growth Factor Rev., 22, 2011, 2, s. 91-97.
20. GALASSO, O., FAMILIARI, F., De GORI, M., GASPARINI, G.: Recent findings on the role of gelatinases (matrix metalloproteinase-2 and -9) in osteoarthritis. Adv. Orthop., 2012, s. 83.
21. GOLDRING, M. B.: The role of cytokines as inflammatory mediators in osteoarthritis: lessons from animal models. Connect. Tissue Res., 40, 1999, 1, s. 1-11.
22. GOLDRING, M. B, GOLDRING, S. R.: Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis. Ann. N.Y. Acad. Sci., 1192, 2010, s. 230-237.
23. HEDBOM, E., HAUSELMANN, H. J.: Molecular aspects of pathogenesis in osteoarthritis: the role of inflammation. Cell Mol. Life Sci., 59, 2002, 1, s. 45-53.
24. HENROTIN, Y., PESESSE, L., SANCHEZ, C.: Subchondral bone in osteoarthritis physiopathology: state-of-the art and perspectives. Biomed. Mater. Eng., 19, 2009, 4-5, s. 311-326.
25. HENROTIN, Y., PESESSE, L., SANCHEZ, C.: Subchondral bone and osteoarthritis: biological and cellular aspects. Osteoporos. Int., Suppl., 8, 2012, s. 847-851.
26. HUBER, M., TRATTNING, S., LINTER, F.: Anatomy, biochemistry and physiology of articular cartilage. Investigations in Radiology, 35, 2000, 10, s. 573-580.
27. HUNTER, D. J., SPECTOR, T. D.: The role of bone metabolism in osteoarthritis. Curr. Rheumatol. Rep., 5, 2003, s. 15-19.
28. IMHOF, H., SULZBACHER, I., GRAMPP, S., CZERNY, C., YOUSSEFZADEH, S., KAINBERGER, F.: Subchondral bone and cartilage disease: a rediscovered functional unit. Invest. Radiol., 35, 2000, 10, s. 581-588.
29. KAAB, M. J., ITO, K., CLARK, J. M., NOTZI, H. P.: Deformation of articular cartilage collagen structure under static and cyclic loading. J. Orthopaed. Res., 16, 1998, 6, s. 743-751.
30. KAMEKURA, S., HOSHI, K., SHIMAOKA, T., CHUNG, U., CHIKUDA, H., YAMADA, T., UCHIDA, M., OGATA, N., SEICHI, A., NAKAMURA, K., KAWAGUCHI, H.: Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis Cartilage, 13, 2005, 7, s. 632-641.
31. KOSTENUIK, P. J.: Osteoprotegerin and RANKL regulate bone resorption, density, geometry and strength. Curr, Opin. Pharmacol., 5, 2005, 6, s. 618-625.
32. LAJEUNESSE, D.: Subchondral bone involvement in the pathophysiology of osteoarthritis. Understanding Osteoarthritis from Bench to Bedside, 2011, s. 69-83.
33. LEE, C. R., GRODZINSKY, A. J., SPECTOR, M.: Biosynthetic response of passaged chondrocytes in a type II collagen scaffold to mechanical compression. J. Biomed. Mater. Res., 64, 2003, 3, s. 560-569.
34. LODEWYCKX, L., LORIES, R. J.: WNT Signaling in osteoarthritis and osteoporosis: what is the biological significance for the clinician? Curr. Rheumatol. Rep., 11, 2009, 1, s. 23-30.
35. MADRY, H: The subchondral bone: a new frontier in articular cartilage repair. Knee Surg. Sports Traumatol. Arthrosc., 18, 2010, 4, s. 417-428.
36. MADRY, H., van DIJK, C. N., MUELLER-GERBL, M.: The basic science of the subchondral bone. Knee Surg. Sports Traumato. Arthrosc., 18, 2010, 4, s. 419-433.
37. MORRIS, N. P., KEENE, D. R., HORTON, W. A.: Morphology of connective tissue: Cartilage. In Connective Tissue and Its Heritable Disorders, ROYCE, P.M., STEINMAN, B., Wiley-Liss Inc., New York, 2002, s. 41-66.
38. MOW, V. C., HOLMES, M. H., LAI, W. M.: Fluid transport and mechanical properties of articular cartilage: a review. J. Biomechanics, 17, 1984, 5, s. 377-394.
39. MULLER-GERBL, M.: The subchondral bone plate. Adv. Ana. Embryol. Cell Biol., 141, 1998, s. 1-134.
40. RADIN, E. L., ROSE, R. M.: Role of subchondral bone in the initiation and progression of cartilage damage. Clin. Orthop. Relat. Res., 213, 1986, s. 34-40.
41. SANCHEZ, C., GABAY, O., HENROTIN, Y. E., BERENBAUM, F.: Osteoblast: a cell under compression. Biomed. Mate. Eng., 18, 2008, 4-5, s. 221-234.
42. SANCHEZ, C., GABAY, O., SALVAT, C., HENROTIN, Y. E., BERENBAUM, F.: Mechanical loading highly increases IL-6 production and decreases OPG expression by osteoblasts.Osteoarthritis Cartilage, 17, 2009, 4, s. 4734-4781.
43. VENKATESAN, J. K., EKICI, M., MADRY, H., SCHMITT, G., KOHN, D., CUCCHIARINI, M.: SOX9 gene transfer via safe, stable, replication-defective recombinant adeno-associated virus vectors as a novel, powerful tool to enhance the chondrogenic potential of human mesenchymal stem cells. Stem. Cell Res. Ther., 3, 2012, 3, s. 22.
44. WADA, T., NAKASHIMA, T., HIROSHI, N., PENNINGER, J. M.: RANKL-RANK signaling in osteoclastogenesis and bone disease. Trends Mol. Med., 12, 2006, 1, s.17-25.
45. WILUSZ, R. E., DEFRATE, L. E., GUILAK, F.: A biomechanical role for perlecan in the pericellular matrix of articular cartilage. Matrix Biol., 31, 2012, 6, s. 320-327.
46. WU, L., HUANG, X., LI, L., HUANG, H., XU, R., LUYTEN, W.: Insights on biology and pathology of HIF-1α/-2α, TGFβ/BMP, Wnt/β-catenin, and NF-κB pathways in osteoarthritis. Curr. Pharm. Des., 18, 2012, 22, s. 3293-3312.
47. XING, L., XIU, Y., BOYCE, B. F.: Osteoclast fusion and regulation by RANKL-dependent and independent factors. World J. Orthop., 3, 2012, 12, s. 212-222.
Štítky
Fyzioterapie Rehabilitační a fyzikální medicína Tělovýchovné lékařství
Článek Rejstříky
Článek vyšel v časopiseRehabilitation & Physical Medicine
Nejčtenější tento týden
2013 Číslo 4- Fyzioterapie u pacientů s Parkinsonovou nemocí
- STADA přináší do Česka inovativní lék pro léčbu pokročilé Parkinsonovy nemoci
- Parkinsonova nemoc – stanovení diagnózy neurologem
- Poruchy řeči a polykání u pacientů s Parkinsonovou nemocí
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všechny články tohoto čísla
- Osteochondrální kloubní spoj a osteoartróza
- Hodnocení svalové aktivace povrchovou elektromyografií u pacientů s Parkinsonovou nemocí při postavení na jednu dolní končetinu
- Sledovanie dynamiky klinického obrazu u chronického cervikobrachiálneho syndrómu pomocou princípov McKenzieho konceptu
- Hodnotenie kvality života pacientov s poranením miechy
- Sklon pánve a tvarová modulace cerviko-thorakálního přechodu páteře provokovaná zevní rotací paže
- Aktivita svalů trupu a krku při napřímení cerviko-thorakálního úseku páteře provokované zevní rotací paže
- Kombinovaný trénink uzavřených a otevřených kinematických řetězců v rehabilitaci na příkladu systému FLOWIN®
- Doc. MUDr. Dobroslava Jandová, Doctor honoris causa a nositelka medaile J. E. Purkyně, se v tomto roce dožila významného životního jubilea
- Rejstříky
- Rehabilitation & Physical Medicine
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kombinovaný trénink uzavřených a otevřených kinematických řetězců v rehabilitaci na příkladu systému FLOWIN®
- Doc. MUDr. Dobroslava Jandová, Doctor honoris causa a nositelka medaile J. E. Purkyně, se v tomto roce dožila významného životního jubilea
- Osteochondrální kloubní spoj a osteoartróza
- Sledovanie dynamiky klinického obrazu u chronického cervikobrachiálneho syndrómu pomocou princípov McKenzieho konceptu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



