-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biologická léčba chronické rinosinusitidy
Biological therapy of chronic rhinosinusitis
The aim of this paper is to present an up-to-date information about therapeutical options in chronic rhinosinusitis with nasal polyps. First choice therapy is a long term regular application of intranasal steroids in combination with salinic solution douches. If this treatment is not eff ective enough, then the pulses of systemic steroids are indicated. If the sufficient control of the disease is not achieved, then surgery is a therapeutic choice; it means functional endoscopic sinus surgery in the extent corresponding to the extension of the sinus disease. However, there remains a certain group of patients in whom the results with this treatment are not optimal. The type 2 immunopathological response affects relevantly the course of the disease. Nowadays, the research is done in this field. Specific agents, which are able to block circulating inflammatory mediators or bind receptors for these mediators are developed and studied. The results of the studies having been completed by now are promising.
Keywords:
biological therapy – chronic rhinosinusitis – nasal polyps – dupilumab – immunoglobulin E – interleukin
Autoři: Balatková Z. 1; Knížek Z. 2; J. Vodička 2
; Plzák J. 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole, Praha 1; Klinika otorinolaryngologie a chirurgie hlavy a krku FZS UP a Nemocnice Pardubického kraje, a. s., Pardubická nemocnice 2
Vyšlo v časopise: Otorinolaryngol Foniatr, 70, 2021, No. 2, pp. 109-114.
Kategorie: Přehledový článek
doi: https://doi.org/10.48095/ccorl2021109Souhrn
Cílem práce je podat informaci o současných trendech v léčbě chronické rinosinusitidy s nosní polypózou. Mezi obecně známé možnosti léčby patří pravidelné dlouhodobé podávání intranazálních kortikosteroidů v kombinaci s lavážemi nosní dutiny solnými roztoky. Při nedostatečném efektu léčby je u pacientů indikována pulzní léčba systémovými kortikoidy. Pokud ani tato léčba není dostatečně účinná, pak je metodou volby funkční endoskopická endonazální chirurgie v rozsahu odpovídajícím postižení nosní dutiny a vedlejších nosních dutin u každého jednotlivého pacienta. Z dlouholetých zkušeností s léčbou těchto pacientů bylo zjištěno, že u určité skupiny pacientů se tímto způsobem nedaří dosáhnout optimální kontroly onemocnění. V patogenezi onemocnění se významně uplatňuje imunopatologická odpověď II. typu. Výzkum se v současnosti zaměřuje na ovlivnění průběhu tohoto patofyziologického mechanizmu a snížení reaktivity organizmu ovlivněním koncentrace jednotlivých mediátorů zánětu. Toho se daří dosáhnout pomocí specifických léčiv, jež mohou blokovat volně cirkulující mediátory zánětu, nebo se váží na receptory pro tyto mediátory na efektorových buňkách. Výsledky dosud provedených studií jsou příslibem do budoucna.
Klíčová slova:
biologická léčba – chronická rinosinusitida – nosní polypy – dupilumab – imunoglobulin E – interleukin
Úvod
Biologická léčba bývá tradičně spojována s léčbou onkologických onemocnění. Z recentně provedených studií vyplývá, že biologickou léčbu lze použít i pro pacienty s chronickou rinosinusitidou s nosními polypy.
Chronická rinosinusitida je onemocnění postihující dutinu nosní a vedlejší dutiny nosní. Podle EPOS 2020 (European Position Paper on Rhinosinusitis and Nasal Polyps) je defi nována jako onemocnění, které se vyznačuje přítom inností určitých specifických subjektivních symptomů, především nosní sekrece a obstrukce, a dále objektivními známkami onemocnění (otokem, sekrecí či přítomností nosních polypů) při endoskopickém vyšetření, či nálezem opacifikace dutin na CT [1]. Toto onemocnění postihuje asi 5–12 % populace. Klasicky bývala chronická rinosinusitida členěna na chronickou rinosinusitidu s nosními polypy, nebo bez nich. V posledním vydání EPOS 2020 (vytvořené Evropskou rinologickou společností v únoru 2020) pak najdeme nové dělení chronických rinosinusitid s důrazem na endotypizaci onemocnění [1, 2]. Podle tohoto dokumentu je primární chronická rinosinusitida dělena na lokalizovanou a difuzní. Každá z těchto podskupin se dělí podle typu imunopatologické odpovědi na typ Th2 (pomocné T lymfocyty typu 2) odpověď a non-Th2 odpověď. U pacientů s typem Th2 odpovědi dochází po expozici určitým antigenům (často alergenům u alergiků) k vyšší koncentraci eozinofilů v tkáni nosní sliznice. Dále dochází k infiltraci tkání CD4+ lymfocyty, které se pod vlivem interleukinů (IL) produkovaných ve tkáni diferencují na Th2 lymfocyty a nezralé B lymfocyty se mění na zralé B lymfocyty, které produkují ve zvýšené míře IgE. IgE se následně váží na žírné buňky. Při styku antigenu s žírnou buňkou a bazofilem, která má již navázaný IgE, dochází k degranulaci buňky a další sekreci prozánětlivých cytokinů (mj. IL-4, IL-5 a IL-13) [3].
Imunopatologická odpověď II. typu je spojena s vysokou přítomností eozinofi lů ve sliznici nosu a vedlejších dutinách nosních. Na úrovni mediátorů zánětlivé odpovědi se zde ve zvýšené míře uplatňuje IL-4, IL-5, IL-13 a IgE. Tím dochází k aktivaci celé kaskády dějů, jež vyústí v hyperplazii nosní sliznice a v tvorbu nosních polypů (schéma 1) [4]. Výše popsaná kaskáda je popisována jako tzv. imunopatologická odpověď II. typu, není specifická pouze pro rozvoj chronické rinosinusitidy s nosní polypózou, ale i onemocnění jako atopická dermatitida, astma, chronická rinosinusitida s polypy a eozinofilní ezofagitida.
Schéma 1. Schéma průběhu imunopatologické odpovědi II. typu.
Scheme 1. Scheme of the course of the immunopathological response II. type.
Mezi chronické rinosinusitidy s II. typem imunopatologické odpovědi patří alergická fungální rinosinusitida, eozinof lní chronická rinosinusitida, atopická nemoc centrálního kompartmentu a chronická rinosinusitida s nosními polypy. Z toho chronická rinosinusitida s nosními polypy (CRSwNP) postihuje asi 2,1–4,3 % populace [1]. Jedná se o heterogenní skupinu pacientů, kteří se liší například přítomností či absencí různých komorbidit (astma, intolerance kyseliny acetylsalicylové [ASA], alergie). Přesná patogeneze tohoto onemocnění není známa, ale častěji je nosní polypóza pozorována u pacientů s bronchiálním astmatem, ASA intolerancí a alergiků, tedy pacientů, jejichž organizmus je predisponován k II. typu imunopatologické odpovědi. Až 30–70 % pacientů s CRSwNP má současně i bronchiální astma [5].
V léčbě tohoto onemocnění se uplatňují především kortikosteroidy ve formě nosního spreje, jejichž účinkem při pravidelné aplikaci dochází k omezení zánětlivé odpovědi v nosní sliznici a redukci objemu nosních polypů. Tento typ léčby je dlouho a dobře znám. Pokud není léčba dostatečně efektivní a nedochází k dostatečné kontrole onemocnění, lze použít kortikosteroidy podávané systémově ve formě perorálních tablet. Zpravidla jsou podávány v dávce 30–60 mg denně po dobu 7–14 dní [6]. Dlouhodobé systémové podávání kortikoidů je spojeno s vyšším rizikem projevů vedlejších a nežádoucích účinků. Chirurgická léčba je rezervována pro případy, u nichž selhává léčba konzervativní. Samotná chirurgická léčba není léčbou kauzální, spočívá v mechanickém odstranění nosních polypů, čímž je obnovena přirozená ventilace dutin a obnovena mukociliární clearance. I po úspěšné chirurgické léčbě musí pacient pokračovat farmakologickou léčbou topickými steroidy. Tyto pak mohou působit ve všech oblastech nosní sliznice. Jako podpůrná léčba CRSwNP jsou doporučovány laváže nosu salinickými roztoky.
V současné době se výzkum v oblasti CRSwNP zaobírá především možností ovlivnit zánětlivé mechanizmy uplatňující se v imunopatologické odpovědi druhého typu [7]. Jako první látka z řady bio logických léčiv byl použit anti-IgE u pacientů s těžkým alergickým astmatem [8]. Postupně se na trh dostávaly i další látky, které ovlivňují imunopatologický proces na úrovni IL-5, receptoru pro IL-5 a alfa podjednotky receptoru pro IL-4. Rovněž došlo k rozšíření indikace nejen pro alergické astma, ale také pro atopickou dermatitidu a kopřivku [9]. Vzhledem ke stejným imunopatologickým mechanizmům, jež se uplatňují u chronické rinosinusitidy, byla indikace dále rozšířena na léčbu tohoto onemocnění. Některé preparáty jsou již schváleny pro léčbu, jiné jsou ve 3. fázi klinického testování. Výzkum v této oblasti se posouvá dále směrem k dalším cílovým molekulám v kaskádě II. typu imunopatologické reakce, byly provedeny studie s transkripčním faktorem GATA-3, který je nezbytný pro diferenciaci a funkci Th2 lymfocytů. Dalšími studovanými preparáty jsou například anti IL-17 alfa, anti GM-CSF/ IL-3/ IL-5, anti IL-33. V současnosti není žádná z těchto látek zatím používána v léčbě CRSwNP [10–12].
V současnosti je biologická léčba rezervována pro pacienty s těžkým obtížně kontrolovatelným průběhem CRSwNP. Jedná se především o pacienty, kteří již podstoupili endoskopický endonazální výkon, jsou opakovaně indikováni k léčbě systémovými glukokortikoidy nebo mají-li současně i bronchiální astma. Vzhledem k vysokým ekonomickým nákladům spojeným s léčbou je třeba pečlivého výběru pacientů [7]. K biologické léčbě jsou indikováni dospělí pacienti s chronickou rinosinusitudou s nosními polypy, kteří splňují aspoň tři kritéria z kritérií indikace k biologické léčbě u chronické rinosinusitidy definovaných v EPOS 2020 (tab. 1) [1]. Úspěšnost biologické léčby je hodnocena podle kritérií definované v EPOS 2020 (tab. 2) [1].
Tab. 1. Indikace k biologické léčbě dle EPOS 2020 [1].
Tab. 1. Indications for biological treatment according to EPOS 2020 [1].![Indikace k biologické léčbě dle EPOS 2020 [1].<br>
Tab. 1. Indications for biological treatment according to EPOS 2020 [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/900bf4a4f9e2c30bf0ebb004f99e5491.png)
Tab. 2. Hodnocení odpovědi na biologickou léčbu podle EPOS 2020 [1].
Tab. 2. Evaluation of the response to biological treatment according to EPOS 2020 [1].![Hodnocení odpovědi na
biologickou léčbu podle EPOS
2020 [1].<br>
Tab. 2. Evaluation of the response
to biological treatment according
to EPOS 2020 [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1a87f0f0fca5ad770f4a1f5fb7ac0226.png)
Anti-IgE terapie
Prvním přípravkem, který byl použit v léčbě CRSwNP, byl omalizumab [8]. Ten selektivně váže volně cirkulující molekuly IgE. Úbytek volných IgE snižuje expresi receptorů pro IgE na žírných buňkách, bazofilech a dendritických buňkách, a tím snižuje jejich pohotovost k aktivaci. U tohoto typu zánětu byla prokázána polyklonální aktivace IgE a dále bylo zjištěno, že hladina tkáňového IgE koreluje s tíží CRSwNP. Léčba omalizumabem ve studii vedené Gaevertem et al. vedla po podání čtyř až osmi dávek ke snížení otoku nosních sliznic, zlepšení sekrece z nosu a zlepšení čichu [8]. Stejně tak došlo ke zlepšení Lund-Mackay skóre [13]. U jednoho pacienta došlo k rozvoji fatálního lymfoblastického lymfomu rok po skončení studie, souvislost s podáním omalizumabu nebyla prokázána. Naopak ve studii provedené Pintem et al. nedošlo k signifikantnímu zlepšení subjektivních symptomů (kvalita života, čich) ani objektivního nálezu (nasal polyps score, CT nález, hladina eoziofi lů ve výplachu z nosní dutiny) [14]. V literatuře jsou popsány případy arteriálních i venózních tromboembolických příhod vedoucích ke kardiovaskulárním a cerebrálním komplikacím [15]. Na základě dosud provedených studií a vzhledem k nejednoznačnosti výsledků provedených studií nelze v současnosti léčbu anti-IgE u pacientů s CRSwNP jednoznačně doporučit.
Anti-IL5 terapie
Interleukin 5 je důležitým tkáňovým mediátorem, který zprostředkovává konečnou diferenciaci eozinofi lů a umožňuje delší přežití eozinofilů v tkáních. Bývá častěji nacházen v tkáni nosních polypů, a proto byl zvolen jako možný cíl biologické léčby. Bylo provedeno několik randomizovaných kontrolovaných studií pro mepolizumab a reslizumab, které oba váží volný, cirkulující IL-5. Do multicentrické randomizované dvojitě zaslepené placebem kontrolované studie s mepolizumabem bylo zařazeno 107 účastníků s CRSwNP, kteří byli léčeni intranazálním kortikosteroidem. V terapii bylo použito placebo či 750 mg mepolizumabu formou intravenózní infuze jednou za čtyři týdny celkem v šesti dávkách. Bylo prokázáno signifi kantní zlepšení subjektivních symptomů (hodnoceno pomocí SNOT-22) [21], zlepšení nasal polyp score. Dále byla prokázána menší potřeba chirurgické terapie u pacientů léčených mepolizumabem [16]. V současnosti je ve fázi klinických studií další preparát, benralizumab, který blokuje alfa podjednotku receptoru pro IL-5. Podle literatury nebyly popsány vážnější nežádoucí účinky podávaných léků. Již v dříve provedených studiích s anti-IL5 z indikace bronchiálního astmatu byla prokázána vysoká bezpečnost podávaného léku. Pro chronickou rinosinusitidu s nosními polypy byl dosud dostatečně studován pouze mepolizumab a léčba tímto preparátem je doporučena v dokumentu EPOS 2020 u pacientů s CRSwNP, kteří splňují kritéria pro léčbu monoklonálními protilátkami (tab. 1) [1, 16, 17].
Anti-IL-4 terapie
Dupilumab je monoklonální protilátka, která blokuje receptor IL-4 alfa, a zamezuje tak signálním cestám cytokinů IL-4 a IL-13.
Receptor IL-4 alfa se vyskytuje mj. na epitelových buňkách dýchacích cest a popsány jsou dva typy tohoto receptoru. Typ 1 (složený z IL-4R alfa a gama řetězce) může být aktivován pouze IL-4, zatímco typ 2 (složený z IL-4R alfa a IL-13R alfa1) může být aktivován IL-4 i IL-13. IL-13 může aktivovat i receptor IL-13R alfa2, který ale naopak snižuje signalizaci IL-13 v buňce (obr. 1) [3, 18].
Obr. 1. Receptor IL-4 alfa.
Fig. 1. IL-4 alpha receptor.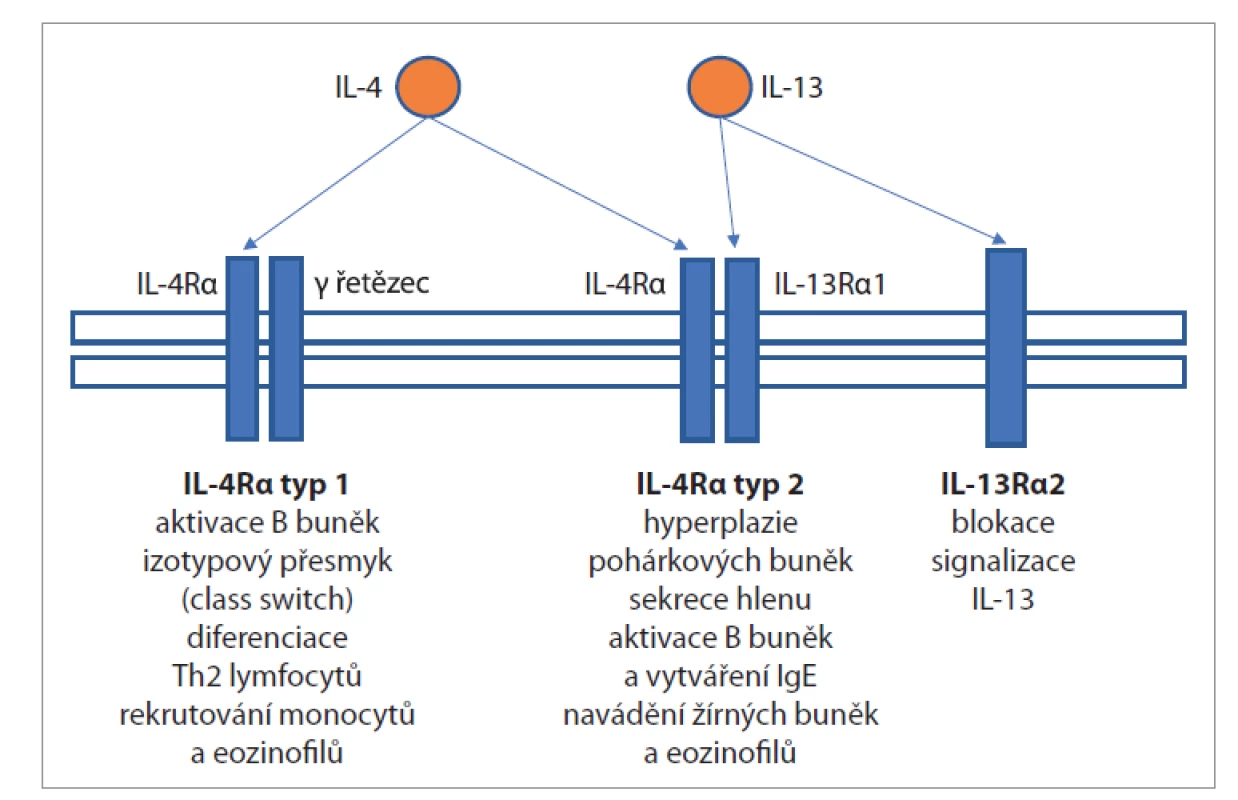
V případě aktivace receptoru typu 1 dochází k přeměně z nezralé B buňky na plazmatickou (efektorovou) B buňku, která produkuje imunoglobuliny, a k izotypovému přesmyku (class switch) imunoglobulinů na imunoglobuliny třídy E (IgE), dále k diferenciaci Th0 lymfocytů na Th2 lymfocyty (které dále produkují další IL-4, IL-5, IL-9 a IL-13) a k rekrutování monocytů a eozinofilů [3].
V případě aktivace receptoru typu 2 dochází k aktivaci epiteliálních buněk, hyperplazii pohárkových buněk a sekreci hlenu, dále k aktivaci B buněk a vytváření IgE a navádění žírných buněk a eozinofilů, které pak nacházíme v hojném množství v tkáni nosních polypů [3, 19].
K léčbě chronické rinosinusitidy s polypy byl dupilumab zkoušen jako čtvrté biologikum po anti-IgE (omalizumab) a anti-IL-5 (mepolizumab, reslizumab) [20].
V roce 2013 byla zahájena randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie s 60 účastníky. Pacientům s chronickou rinosinusitidou s polypy, kteří byli léčeni intranazálním kortikoidem, bylo do terapie přidáno placebo či subkutánně aplikovaný dupilumab – 600 mg iniciálně s následným podáváním 300 mg dupilumabu každý týden po dobu 16 týdnů. Ve skupině dupilumabu došlo v 16. týdnu k signifikantní redukci nasal polyp score (NPS) (obr. 2), Lund-Mackay skóre [13] a SNOT-22 skóre [21], současně k signifikantnímu zlepšení čichu podle testu UPSIT [22]. Vedlejšími účinky, které se častěji vyskytovaly ve skupině dupilumabu, byla nazofaryngitida, reakce v místě vpichu léku a bolesti hlavy [18].
Obr. 2. Klasifikace postižení nosní dutiny pomocí Nasal polyp score. SS – střední skořepa, DS – dolní skořepa, 1 – polyp po dolní hranu střední skořepy, 2 – polyp pod dolní hranu střední skořepy, 3 – polyp po dolní hranu dolní skořepy nebo polyp mediálně od střední skořepy, 4 – polyp po spodinu dutiny nosní
Fig. 2. Classification of nasal involvement using the Nasal polyp score. SS – middle turbinate, DS – lower turbinate, 1 – polyp to the lower edge of the middle turbinate, 2 – polyp below the lower edge of the middle turbinate, 3 – polyp to the lower edge of the lower turbinate or polyp medially from the middle turbinate, 4 – polyp to the base of the nasal cavity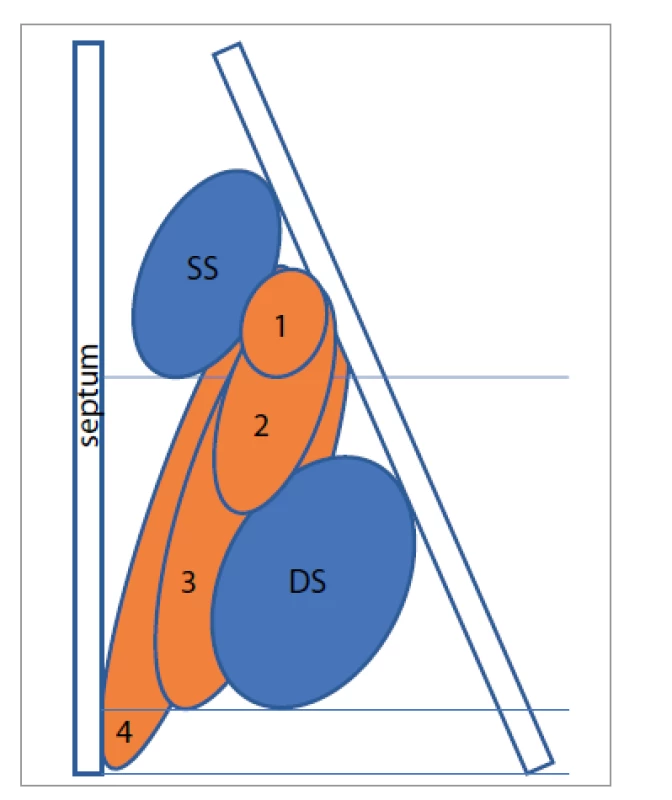
Na základě slibných výsledků byly následně v roce 2016 zahájeny studie SINUS-24 a SINUS-52, kterých se zúčastnilo 276, respektive 448 účastníků. Jednalo se o randomizované, dvojitě zaslepené a placebem kontrolované studie, u kterých bylo pacientům s chronickou rinosinusitidou s polypy na terapii intranazálním kortikoidem přidáno placebo či subkutánně aplikovaný dupilumab – 300 mg každé 2 týdny po dobu 24 týdnů (SINUS-24) či po dobu 52 týdnů nebo po dobu 24 týdnů a následně každé 4 týdny po dobu 28 týdnů (SINUS-52) [23].
Již ve 4.–8. týdnu bylo patrno zlepšení NPS ve skupině dupilumabu se signifikantním rozdílem v porovnání s placebem ve 24. týdnu. Poté bylo patrné další zlepšování NPS ve skupině dupilumabu, a to s větším rozdílem při podávání à 2 týdny oproti podávání dupilumabu à 4 týdny. Naopak při vysazení dupilumabu po 24 týdnech došlo opět ke zhoršení NPS, byť ve 48. týdnu nedošlo k dosažení NPS při podávání placeba [23].
Podobně již 4.–8. týden došlo ke zlepšování subjektivně vnímané nosní obstrukce se signifikantním rozdílem v porovnání s placebem ve 24. týdnu. Po vysazení dupilumabu došlo opět k postupnému zhoršení subjektivně vnímané nosní obstrukce. V případě subjektivního vnímání nicméně zde při dalším podávání nebyl patrný významný rozdíl ve vnímání nosní obstrukce u pacientů s aplikací dupilumabu à 2 týdny oproti podávání à 4 týdny [23].
Při podávání dupilumabu došlo rovněž ke zlepšení čichu (podle UPSIT testu z 74–79 % pacientů iniciálně s anosmií bylo ve 24. týdnu pouze 24–30 % pacientů s anosmií), snížení opacifikace vedlejších nosních dutin na CT a snížení skóre SNOT-22 (o více než klinicky významnou hodnotu 8,9 bodu) v porovnání s placebem. Podobně i potřeba nasazení orální kortikoterapie či provedení chirurgie byla signifikantně nižší ve skupině dupilumabu [23].
Ve studii se nejčastěji objevily nezávažné nežádoucí účinky (nazofaryngitida, zhoršení nosní polypózy a astmatu, bolesti hlavy, epistaxe a reakce v místě vpichu), které navíc byly častěji sledovány ve skupině placeba [23].
Na základě dobrého efektu dupilumabu při dobré bezpečnosti léčiva došlo ke schválení léčiva k jeho užití v indikaci chronická rinosinusitida s polypy v říjnu 2019. Léčivo tak získalo třetí indikaci, po schválení k užití při atopické dermatitidě v roce 2017 a astmatu v roce 2018. Recentně je schváleno i k užití při eozinofilní ezofagitidě od září 2020. Nově se lék zkouší i k léčbě eozinofilní mezotitidy, podle pilotních studií prozatím se slibnými výsledky [24, 25]. Vzhledem k vysoké ceně léčiva je zřejmé, že bude nutné v budoucnosti analyzovat zejména cost-efektivitu [26].
Závěr
Biologická léčba je relativně novou možností volby v léčbě chronické rinosinusitidy s nosními polypy. Je rezervována pro případy obtížně kontrolovatelného onemocnění, u nějž nedochází k dobré terapeutické odpovědi na léčbu kortikoidy (lokálními či systémovými) v kombinaci s chirurgickou léčbou. Jedná se o léčbu cílenou, jež ovlivňuje vlastní patofyziologický proces, a tedy i funkci a množství přítomných zánětlivých buněk ve tkáních. Vzhledem k vyšším ekonomickým nákladům léčba v České republice dosud podléhá schválení revizním lékařem. Z dosud provedených studií a vlastní zkušenosti jsou však výsledky slibné a dochází k významnému zlepšení subjektivního stavu pacientů i objektivního nálezu.
Prohlášení o střetu zájmu
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Přijato k recenzi: 20. 1. 2021
Přijato k tisku: 25. 2. 2021
MUDr. Zuzana Balatková, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Zdroje
1. Fokkens WJ, Lund VJ, Hopkins C et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology 2020; 58(Suppl S29): 1–464. Doi: 10.4193/ Rhin20. 600.
2. De Greve G, Hellings PW, Fokkens WJ et al. Endotype - driven treatment in chronic upper airway diseases. Clin Transl Allergy 2017; 7 : 22. Doi: 10.1186/ s13601-017-0157-8.
3. Gandhi NA, Bennett BL, Graham NM et al. Targeting key proximal drivers of type 2 infl ammation in disease. Nat Rev Drug Discov 2016; 15(1): 35–50. Doi: 10.1038/ nrd4624.
4. Hirose K, Iwata A, Tamachi T et al. Allergic air way infl ammation: key players beyond the Th2 cell pathway. Immunol Rev 2017; 278(1): 145–161. Doi: 10.1111/ imr.12540.
5. Khan A, Vandeplas G, Huynh TMT et al. The Global Allergy and Asthma European Network (GALEN rhinosinusitis cohort: a large European cross-sectional study of chronic rhinosinusitis patients with and without nasal polyps. Rhinology 2019; 57(1): 32–42. Doi: 10.4193/ Rhin17.255.
6. Pundir V, Pundir J, Lancaster G et al. Role of corticosteroids in Functional Endoscopic Sinus Surgery--a systematic review and meta - -analysis. Rhinology 2016; 54(1): 3–19. Doi: 10.4193/ Rhin15.079.
7. Fokkens WJ, Lund V, Bachert C et al. EUFOREA consensus on bio logics for CRSwNP with or without asthma. Allergy 2019; 74(12): 2312–2319. Doi: 10.1111/ all.13875.
8. Gevaert P, Calus L, Van Zele T et al. Omalizumab is eff ective in allergic and nonallergic patients with nasal polyps and asthma. J Allergy Clin Immunol 2013; 131(1): 110–116 e111. Doi: 10.1016/ j.jaci.2012.07.047.
9. Tsetsos N, Goudakos JK, Daskalakis D et al. Monoclonal antibodies for the treatment of chronic rhinosinusitis with nasal polyposis: a systematic review. Rhinology 2018; 56(1): 11 – 21. Doi: 10.4193/ Rhin17.156.
10. Krug N, Hohlfeld JM, Kirsten AM et al. Allergen - induced asthmatic responses modified by a GATA3-specifi c DNAzyme. N Engl J Med 2015; 372(21): 1987–1995. Doi: 10.1056/ NEJMoa 1411776.
11. Panousis C, Dhagat U, Edwards KM et al. CSL311, a novel, potent, therapeutic monoclonal antibody for the treatment of diseases mediated by the common beta chain of the IL-3, GM-CSF and IL-5 receptors. MAbs 2016; 8(3): 436–453. Doi: 10.1080/ 19420862.2015.1119352.
12. Lan F, Zhang N, Holtappels G et al. Staphylococcus aureus Induces a Mucosal Type 2 Immune Response via Epithelial Cell-derived Cytokines. Am J Respir Crit Care Med 2018; 198(4): 452–463. Doi: 10.1164/ rccm.201710-2112OC.
13. Lund VJ, Mackay IS. Staging in rhinosinusitis. Rhinology 1993; 31(4): 183–184.
14. Pinto JM, Mehta N, DiTineo M et al. A randomized, double-blind, placebo-controlled trial of anti-IgE for chronic rhinosinusitis. Rhinology 2010; 48(3): 318–324. Doi: 10.4193/ Rhin09.144.
15. Oblitas CM, Galeano-Valle F, Vela-De La Cruz L et al. Omalizumab as a provoking factor for venous thromboembolism. Drug Target Insights 2019; 13 : 1177392819861987. Doi: 10.1177/ 1177392819861987.
16. Bachert C, Sousa AR, Lund VJ et al. Reduced need for surgery in severe nasal polyposis with mepolizumab: Randomized trial. J Allergy Clin Immunol 2017; 140(4): 1024–1031 e1014. Doi: 10.1016/ j.jaci.2017.05.044.
17. Gevaert P, Van Bruaene N, Cattaert T et al. Mepolizumab, a humanized anti-IL-5 mAb, as a treatment option for severe nasal polyposis. J Allergy Clin Immunol 2011; 128(5): 989–995. Doi: 10.1016/ j.jaci.2011.07.056.
18. Bachert C, Mannent L, Naclerio RM et al. Effect of subcutaneous dupilumab on nasal polyp burden in patients with chronic sinusitis and nasal polyposis: a randomized clinical trial. JAMA 2016; 315(5): 469–479. Doi: 10.1001/ jama.2015.19330.
19. Jonstam K, Swanson BN, Mannent LP et al. Dupilumab reduces local type 2 pro-infl ammatory bio markers in chronic rhinosinusitis with nasal polyposis. Allergy 2019; 74(4): 743–752. Doi: 10.1111/ all.13685.
20. Bachert C, Zhang L, Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: Focus on nasal polyposis. J Allergy Clin Immunol 2015; 136(6): 1431–1440. Doi: 10.1016/ j.jaci.2015.10.010.
21. Toma S, Hopkins C. Stratifi cation of SNOT-22 scores into mild, moderate or severe and relationship with other subjective instruments. Rhinology 2016; 54(2): 129–133. Doi: 10.4193/ Rhin15.072.
22. Doty RL, Frye RE, Agrawal U. Internal consistency reliability of the fractionated and whole University of Pennsylvania Smell Identifi cation Test. Percept Psychophys 1989; 45(5): 381–384. Doi: 10.3758/ bf03210709.
23. Bachert C, Han JK, Desrosiers M et al. Effi - cacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS - 52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel - -group phase 3 trials. Lancet 2019; 394(10209): 1638–1650. Doi: 10.1016/ S0140-6736(19)31881-1.
24. Iino Y, Sekine Y, Yoshida S et al. Dupilumab therapy for patients with refractory eosinophilic otitis media associated with bronchial asthma. Auris Nasus Larynx 2020. Doi: 10.1016/ j. anl.2020.09.001.
25. Pierchalla G, Fluhr JW, Förster-Ruhrmann U et al. Pilot study: Clinical eff ects of dupilumab therapy on eosinophilic otitis media in patients with severe nasal polyposis. Laryngorhinootologie 2020; 99(S 02): S39. Doi: 10.1055/ s-0040 - 1710838.
26. Kim J, Naclerio R. Therapeutic potential of dupilumab in the treatment of chronic rhinosinusitis with nasal polyps: evidence to date. Ther Clin Risk Manag 2020; 16 : 31–37. Doi: 10.2147/ TCRM.S210648.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2021 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Isoprinosine nově bez indikačních a preskripčních omezení
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
- Suché sliznice a chrapot pod kontrolou: Co může lékař nabídnout pacientům?
-
Všechny články tohoto čísla
- Prvé skúsenosti s implantátom pre kostné vedenie zvuku Sophono
- Biologická léčba chronické rinosinusitidy
- Ušní chirurgie v České republice
- Rehabilitace jednostranné hluchoty pomocí implantabilního systému pro přímé kostní vedení – Bonebridge
- Význam screeningových dotazníků v detekci závažnosti obstrukční spánkové apnoe
- Chirurgická léčba benigních nádorů příušní žlázy na ORL oddělení Nemocnice České Budějovice, a.s., v letech 2014–2018
- Neuromonitoring zvratného nervu během operace štítné žlázy – výsledky a zkušenosti
- Griselův syndrom – kazuistika
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biologická léčba chronické rinosinusitidy
- Griselův syndrom – kazuistika
- Chirurgická léčba benigních nádorů příušní žlázy na ORL oddělení Nemocnice České Budějovice, a.s., v letech 2014–2018
- Neuromonitoring zvratného nervu během operace štítné žlázy – výsledky a zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



