-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNanočástice, nanotoxikologie, nanomedicína: definice pojmů, perspektivy v otorinolaryngologii
Nanoparticles, Nanotoxicology, Nanomedicine: Definition of Terms, Perspectives in Otorhinolaryngology
Nanoparticles are particles smaller than 100 nm in diameter. They are a subject of research interest of two related, closely collaborating scientific disciplines – nanotoxicology and nanotechnology. Nanoparticles are ubiquitous in environment and due to their very small sizes, they possess different properties than the microparticles of the same material (chemical and physical reactivity, interaction with living cells and organisms). Nanotoxicology studies their toxic effect in vitro and in vivo. Nanotechnology develops materials with new properties and functions based on the small size of nanoparticles. Nanomedicine combines new knowledge of nanotechnology and pharmacology to develop new medicaments and therapeutic procedures. The authors summarize current knowledge on nanoparticle properties, their effect on respiratory tract and possible use of nanotechnology in otorhinolaryngology in the article.
Keywords:
nanoparticles, nanotoxicology, nanotechnology, nanomedicine
Autoři: L. Čábalová 1,2
; Pavel Komínek 1,2
; Karol Zeleník 1,2
; J. Kukutschová 3; L. Čabanová 3
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku, Fakultní nemocnice Ostrava, přednosta prof. MUDr. P. Komínek, Ph. D., MBA 1; Katedra kraniofaciálních oborů, Lékařské fakulta, Ostravská univerzita v Ostravě, přednosta prof. MUDr. P. Komínek, Ph. D., MBA 2; Centrum nanotechnologií, Vysoká škola báňská – Technická univerzita Ostrava 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 65, 2016, No. 3, pp. 179-183.
Kategorie: Přehledový článek
Souhrn
Nanočástice jsou částice menší než 100 nm, jejichž studiem se zabývají dva příbuzné spolupracující obory – nanotoxikologie a nanotechnologie. Nanočástice jsou v prostředí všudypřítomné a vzhledem k jejich velmi malým rozměrům mají jiné vlastnosti než částice stejného materiálu velikosti v řádech mikrometrů (chemická a fyzikální reaktivita, interakce s buňkami a živými organismy). Jejich toxické působení in vitro a in vivo zkoumá nanotoxikologie. Nanotechnologie se zabývá vývojem materiálů s novými vlastnostmi a funkcemi, které vycházejí z jejich malé velikosti. Nanomedicína pak využívá poznatků nanotechnologie a farmakologie k vývoji nových léčiv a terapeutických postupů. Autoři v práci shrnují současné poznatky o vlastnostech nanočástic, jejich vlivu na dýchací cesty a možnosti využití nanotechnologií v otorinolaryngologii.
Klíčová slova:
nanočástice, nanotoxikologie, nanotechnologie, nanomedicínaÚVOD
Nanočástice jsou definovány jako částice v jednom či více rozměrech menší než 100 nm a větší než 1 nm (obr. 1). To, co je odlišuje od částic mikro - a větších rozměrů, jsou vlastnosti, jichž částice daného materiálu nabývají typicky pod kritickou velikostí 100 nm (3, 36). Nanočástice jsou předmětem rozsáhlého studia, zejména v posledních letech rychle se rozvíjejícího vědního oboru, který lze v angličtině nejlépe pojmenovat jako “nanoscience”. Tento pojem zastřešuje dvě hlavní nano-disciplíny – nanotechnologii a nanotoxikologii (28). V současné době se s pojmem „nano-“ často setkáváme v souvislosti s novými farmaky, technologiemi i aplikací nanotechnologie u řady onemocnění. Domníváme se však, že i odborné veřejnosti chybí základní informace o „nanosvětě“ – co jsou nanočástice, jaké mají vlastnosti a jaké je jejich působení na živý organismus či jejich potenciální terapeutické využití. Cílem článku je proto podat základní přehled pro orientaci v této problematice nejen pro otorinolaryngology.
Obr. 1. Srovnání rozměru nanočástice s jinými objekty – jak „velké“ je nano? 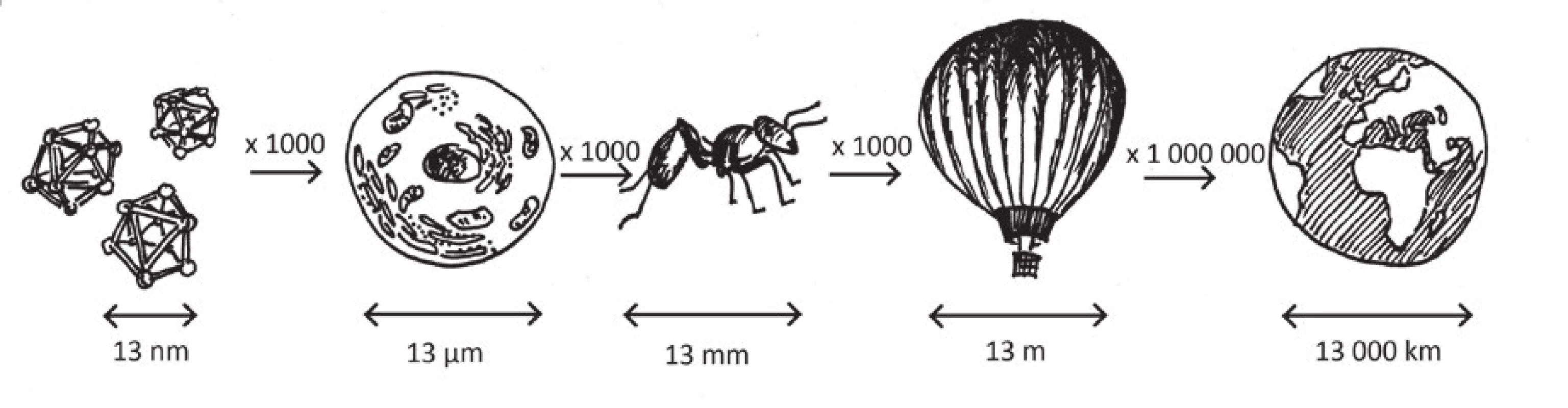
NANOTECHNOLOGIE, NANOMEDICÍNA A NANOTOXIKOLOGIE
Nanotechnologie se zabývá vývojem materiálů na úrovni atomů, molekul a makromolekul, zkoumá jejich vlastnosti a vytváří a využívá struktury, zařízení a systémy s novými vlastnostmi a funkcemi, které vycházejí z jejich malé velikosti (The Nanoscale Science, Engineering, and Technology Subcommitee, 2000). Nanotechnologie je multidisciplinární obor, v němž se spojují poznatky základního i aplikovaného výzkumu v biofyzice, molekulární biologii a bioinženýrství a lze předpokládat, že v budoucnu bude mít zásadní dopad na rozličná odvětví medicíny a farmakologie. Nanotechnologie poskytuje nové systémy, zařízení a materiály pro zlepšení možností aplikace nových farmak. V souvislosti s tím dochází k rozvoji oboru farmaceutická nanotechnologie, která se zabývá aplikací poznatků „nano-vědy“ ve farmakologii (nanomateriály, systémy cíleného transportu léčiv, diagnostické a zobrazovací systémy, biosenzory aj.) (18). Náplní oboru nanomedicíny, který spojuje a využívá poznatků nanotechnologie a farmakologie, je diagnostika, léčba a prevence chorob a zranění, léčba bolesti a snaha o uchování či zlepšení lidského zdraví s využitím znalostí struktury lidského těla a fyziologických pochodů na molekulární úrovni a terapeutických a diagnostických nástrojů vycházejících z nanotechnologie (11, 35).
Nanotoxikologie je odvětvím toxikologie, které studuje vlastnosti nanočástic a nanomateriálů a jejich toxické působení in vitro a in vivo (28). Z hlediska toxicity se částice rozdělují na primární (cíleně syntetizované) a sekundární (vznikající jako vedlejší produkt v nejrůznějších fyzikálních a chemických procesech). Posuzováním rizika expozice nanočásticím a zkoumáním možností prevence nežádoucích účinků terapeutických nano-produktů pak podporuje rozvoj nanotechnologie a nanomedicíny (40, 46).
NANOČÁSTICE – VÝSKYT A VLASTNOSTI
Výskyt nanočástic
Nanočástice jsou v prostředí všudypřítomné. Jedná se o částice na bázi uhlíku (např. saze), ale také anorganické částice, nejčastěji ve formě oxidů kovu (železo, chrom, nikl, hliník, měď, zinek, titan aj.). Kromě přírodních procesů (vulkanická činnost, lesní požáry) jsou jejich významným zdrojem antropogenní činnosti: metalurgický průmysl, doprava, kouření, smažení aj. S rychlým rozvojem nanotechnologií a pronikáním syntetizovaných nanomateriálů nejen do nejrůznějších výrobků denní potřeby (kosmetika, barviva, baterie, výroba aut aj.), ale také medicínských přípravků (např. koloidní stříbro), roste význam zkoumání potenciálního toxického vlivu také těchto záměrně produkovaných nanočástic (17).
Vlastnosti
Nanočástice mají vzhledem ke svým velmi malým rozměrům většinou jiné vlastnosti než částice stejného materiálu o velikosti v řádech mikrometrů. Pro jejich chování a ev. toxické působení je důležitá zejména velikost částic, jejich tvar a krystalická struktura. Se zmenšující se velikostí částic se mění jejich fyzikálně-chemické vlastnosti. Platí, že čím menší je částice, tím větší je její biologická aktivita a potenciální toxicita, a to i u materiálů, kdy mikročástice stejného složení toxické vlastnosti nevykazují (30). Nanočástice totiž mají na velmi malou hmotnost obrovský celkový povrch (tab. 1). Na povrchu molekul je odhaleno větší procento atomů a se zmenšujícím se rozměrem roste exponenciálně počet potenciálně reaktivních skupin. Nemusí proto platit přímý vztah toxického účinku na dávce (koncentraci) látky jako u částic mikro-rozměrů (7, 29, 32). Dále nanočástice se zmenšující se velikostí vykazují zvýšenou difuzivitu, a tím pádem i opožděnou sedimentaci. Tím se prodlužuje doba jejich setrvání v ovzduší (39).
TOXICKÉ PŮSOBENÍ NANOČÁSTIC NA ORGANISMUS
Hlavní branou vstupu nanočástic do organismu, kromě kůže a gastrointestinálního traktu, jsou dýchací cesty a plíce. Nanočástice jsou schopné penetrovat paracelulárně i skrz buňky do krve, redistribuovat se v organismu, akumulovat se v různých orgánech, např. v plicích, mozku, játrech, ledvinách či slezině, a vyvolávat v nich patologické změny (14, 28). Do buněk vstupují jednak endocytózou, jednak ne zcela jasným non-vezikulárním mechanismem (28). Možnost jejich degradace pomocí lyzosomálního systému je ale omezená. Nanočástice se tak mohou v buňkách hromadit a vyvolávat změny na úrovni buněčných organel i na úrovni genetické informace buňky (14, 42).
Přesný mechanismus jejich genotoxického účinku prozatím není znám. Většina prací poukazuje na jejich genotoxické působení spuštěním oxidativního stresu, a s tím spojenou indukci apoptózy, zánětu a zástavy buněčného cyklu (2, 13, 15, 17, 18, 31, 48). Prostřednictvím oxidativního stresu tedy mohou způsobovat zlomy v DNA, nestabilitu chromozomů a narušení mechanismů mitózy, což může vést k maligní transformaci buňky. Nové studie ale také ukazují, že nanočástice mohou pronikat do buněčného jádra a přímo interagovat s DNA (1, 5, 21).
Složení nanočástic přítomných v prostředí, které vstupují do organismu, je různé. Jako příklad uvádíme výsledek studie Zeleníka a kol. (2012), kteří zkoumali přítomnost a složení nanočástic v patrových tonzilách. Převládajícími nalezenými kovy byly železo, chrom, nikl, hliník a měď (50).
STUDIE ZABÝVAJÍCÍ se TOXICKÝM PŮSOBENÍM NANOČÁSTIC V DÝCHACÍCH CESTÁCH
Toxické působení nanočástic v dýchacích cestách je v současnosti intenzivně zkoumáno především in vitro, případně na hlodavcích či modelech.
V několika studiích na krysách a na lidských buňkách in vitro byl již prokázán toxický účinek uměle vpravených nanočástic na plicní tkáň ve smyslu vyvolání akutních i chronických zánětlivých změn (akutní alveolitida, bronchiální hyperreaktivita, poškození mukociliárního transportu, dysfunkce plicních makrofágů, formace mikrogranulomů) (16, 17, 33, 42). Byla také studována jejich přítomnost, distribuce a akumulace v různých etážích dýchacích cest, a to jak na hlodavcích, tak pomocí počítačových modelů. Pomocí počítačového modelování bylo zkoumáno chování nanočástic při distribuci v tkáních při jejich vdechování. Předpokládá se, že se řídí jinými zákonitostmi než částice větších rozměrů. Nejvíce nanočástic se stejně jako mikročástice zachycuje v nosní dutině na skořepách, ale na druhém místě je u nanočástic hltan; větší částice mají tendenci deponovat se spíše v hrtanu (12, 49). Zatím bylo provedeno jen velmi málo klinických studií zkoumajících přítomnost a působení nanočástic na sliznice dýchacích a polykacích cest, např. výše zmíněná studie Zeleníka a kol. (50).
Klinické studie zabývající se nanotoxicitou a nanopatologií prozatím narážejí na omezené možnosti stanovení koncentrace nanočástic ve vyšetřovaných tkáních, neboť jejich detekce v tkáni se provádí na zcela jiném principu než u větších částic; v nano-měřítku nelze tkáň jednoduše mapovat a přítomnost nanočástic statisticky hodnotit (50). Pokud se v budoucnu podaří tento problém vyřešit či obejít, lze na tomto poli předpokládat velmi rychlý rozvoj.
MEDICÍNSKÁ NANOTECHNOLOGIE
Medicínská nanotechnologie se ve smyslu praktického uplatnění v otorinolaryngologii prozatím proti nanotoxikologii jeví jako slibnější pole působnosti. Nanomateriály a nanokompozita jsou již v medicíně s úspěchem využívány, zejména v posledním desetiletí. Koloidní stříbro pro své antimikrobiální účinky v hojení chronických ran a k povrchové úpravě katetrů, kanyl či protéz k zamezení vzniku biofilmů; nanostruktury vzniklé oxidací titanu na povrchu kloubních náhrad či zubních implantátů ke zlepšení osteointegrace; oxid zinečnatý jako přísada do mastí pro svou fungicidní aktivitu; zlato ve spojení s biologickými ligandy v diagnostice, v zobrazovacích technikách či k cílené protinádorové terapii (8, 29, 37, 51). V otorinolaryngologii nicméně nanotechnologie prozatím běžně využívány nejsou.
Rinologie
V rinologii je perspektivní např. využití nanočásticových nosičů pro některé léky u chronických rinosinusitid. Nanočásticemi se specifickými vlastnostmi obalené léčivo lépe proniká i skrz hustý hlen k patogenům a déle setrvává ve sliznici (22), případně se může využít nano-nosiče pro některé toxické léky a přesně tak zacílit léčbu na infekční fokus bez nežádoucích systémových účinků (např. amfotericin B) (35). Ellis-Behnke pak v experimentech na zvířatech úspěšně použil k hemostáze uměle vyrobený biodegradabilní, netoxický a neimunogenní peptid (N-hydroxysulfosukcinimin) spontánně vytvářející síť nanovláken, s perspektivou využití při terapii epistaxe (10). Existují také studie na hlodavcích, které ukazují možnost obejití hematoencefalické bariéry pomocí transportu léčiv vázaných na nanočásticové nosiče (např. risperidonu) přes čichové nervy přímo do centrálního nervového systému (20, 34), případně vakcinace intranazálně podanými nanočásticemi exprimujícími povrchové antigeny pneumokoka (47).
Laryngologie
V laryngologii se jeví jako slibný vývoj syntetických analog extracelulární matrix s využitím např. k augmentaci hlasivek, ev. jako „náhradní díly“ pro rekonstrukční chirurgii (35). Nanočástic by také mohlo být využito jako nosičů léčiv, jež by umožnily delší setrvání účinné látky v tkáních hrtanu – např. Kolachala referoval o potenciálním využití lipidových nanočásticových nosičů, které umožní delší setrvání aktivních látek (např. růstových faktorů) v tkáních hlasivek (19).
Otologie
Velký potenciál má využití nanomateriálů jako nosičů léčiv v otologii při senzorineurálních poruchách sluchu a onemocněních vestibulárního ústrojí, kde jsou dosavadní léčebné možnosti velmi omezené. Léčiva navázaná na biodegradabilní polymerní nosič dle experimentálních výsledků lépe přecházejí k cílovým buňkám statoakustického ústrojí než léčivo bez nosiče. Např. Sakamoto na myších se ztrátou sluchu na podkladě akustického traumatu prokázal, že betametazon navázaný na obal z polylaktátu a polyethylenglykolu se oproti samotnému léčivu preferenčně akumuluje a dosahuje vyšších koncentrací v poškozených tkáních, tj. ve vnitřním uchu (38). Perspektivní je také využití nano-nosičů k cílené genové terapii při aplikaci léčiva přes foramen rotundum do scala tympani (8, 35, 44). Buckiová a kol. referovali o potenciálním využití liposomových a polymerosomových nanočásticových nosičů pro cílený transport léčiva při injekční aplikaci do foramen rotundum (4). Jinou možností cíleného transportu léčiva k vnitřnímu uchu může být využití feromagnetických nanočástic usměrňovaných zevním magnetickým navaděčem (41). Podobně jako u kloubních náhrad se jeví potenciál využití nanopolymerů (zejména sloučenin stříbra) u kochleárních implantátů za účelem jejich lepší integrace (43).
Protinádorová terapie
Významnou roli mohou v budoucnu nanočástice hrát v onkologii při protinádorové terapii zacílené specificky na maligní buňky, např. ve smyslu cíleného transportu chemoterapeutika vyžadujícího fotoaktivaci přímo do nádoru, nebo ve smyslu individualizované imunoterapie (6, 16, 35, 37), případně podobně jako u chorob vnitřního ucha využití nanočásticových nosičových systémů (9, 52). Liu a kol. také referovali o možném využití pH-senzitivních nanočásticových systémů v cílené protinádorové terapii (26).
ZÁVĚR
Nanotoxikologie i nanotechnologie jako vědní obory mají v budoucnu v medicíně velkou perspektivu. Zejména nanotoxikologie je prozatím hlavně v otorinolaryngologii opravdu „pole neorané“ a představuje velkou výzvu jak pro výzkumníky, tak klinické pracovníky. Nanotechnologie již dnes otevírají zcela nový svět netušených možností – v budoucnu lze očekávat jejich významné uplatnění v cílené léčbě nádorových onemocnění, léčbě onemocnění vnitřního ucha, včetně senzorineurální hluchoty, či další rozvoj jejich využití v diagnostice a biomedicínské technice. Nakolik optimističtí můžeme být a hledat odpovědi a řešení v „nanosvětě“, to ještě musí v budoucnu prověřit klinické studie.
Práce vznikla s podporou Institucionální podpory MZČR č. 2 RVO-FNOs/2013.
Adresa ke korespondenci:
MUDr. Lenka Čábalová
Klinika ORL a chirurgie hlavy a krku FN Ostrava
tř. 17. listopadu 1790
708 52 Ostrava
e-mail: lenka.cabalova@fno.cz
Zdroje
1. Ahlinder, L., Ekstrand-Hammarström, B., Gelandi, P., Österlund, L.: Large uptake of titania and iron oxide nanoparticles in the nucleus of lung epithelial cells as measured by raman imaging and multivariate classification. Biophysi J., 105, 2013, s. 310-319.
2. Al-Rawi, M., Diabaté, S., Weiss, C.: Uptake and intracellular localization of submicron and nanosized SiO2 particles in HeLa cells. Arch Toxicol, 85, 2011, s. 813-826.
3. British Standars Institution (BSI): Standards Publication: Nanoparticles – Vocabulary. BSI Group, London, 2011.
4. Buckiová, D., Ranjan, S., Newman, T. A., Johnston, A. H., Sood, R., Kinnunen, P. K., Popelář, J., Chumak, T., Syka, J.: Minimally invasive drug delivery to the cochlea through application of nanoparticles to the round window membrane. Nanomedicine (Lond), 2012, 9, s. 1339-1354.
5. Dam, D. H., Lee, J. H., Sisco, P. N., Co, D. T., Zhang, M., Wasielewski, M. R., Odom, T. W.: Direct observation of nanoparticle-cancer cell nucleus interactions. ACS Nano, 2012, 6: s. 3318-3326.
6. Damascelli, B., Patelli, G., Tichá, V., Di Tolla, G., Frigerio, L. F., Garbagnati, F., Lanocita, R., Marchiano, A., Spreafico, C., Mattavelli, F., Bruno, A., Zunino, F.: Feasibility and efficacy of percutaneous transcatheter intraarterial chemotherapy with paclitaxel in albumin nanoparticles for advanced squamous-cell carcinoma of the oral cavity, oropharynx and hypopharynx. J. Vasc. Interv. Radiol., 18, 2007, s. 1395-1403.
7. Demir, E., Turna F., Vales, G., Kaya, B., Creus, A., Marcos, R.:In vivo genotoxicity assessment of titanium, zirconium and aluminium nanoparticles, and their microparticulated forms in Drosophila. Chemosphere, 93, 2013, s. 2304-2310.
8. Dürr, S., Tietze, R., Lyer, S., Alexiou, C.: Nanomedizin in der HNO-Heilkunde – ein Ausblick. Laryngo-Rhino-Otol., 91, 2012, s. 6-12.
9. El-Dakdouki, M. H., Xia, J., Zhu, D. C., Kavunja, H., Grieshaber, J., O’Reilly, S., McCormick, J. J., Huang, X.: Assessing the in vivo efficacy of doxorubicin loaded hyaluronan nanoparticles. ACS Appl Mater Interfaces, 2014, 6: s. 697-705.
10. Ellis-Behnke, R., Liang,Y., You, S., Tay, D., Zhang, S., So, K. et al.: Nano neuro knitting: peptide nanofiber scaffold for brain repair and axon regeneration with functional return of vision. Proc. Natl. Acad. Sci., USA, 103, 2006, s. 5054-5059.
11. European Science Foundation. Nanomedicine – An ESF–European Medical Research Councils (EMRC): Forward Look Report. Strasbourgcedex, France ESF, 2004.
12. Farhadi Ghalati, P., Keshavarzian, E., Abouali, O., Faramarzi, A., Tu, J., Shakibafard, A.: Numerical analysis of micro - and nano-particle deposition in a realistic human upper airway. Computers in Biology and Medicine, 42, 2012, s.39-49.
13. Foldbjerg, R., Dang, D. A., Autrup, H.: Cytotoxicity and genotoxicity of silver nanoparticles in the human lungcancer cell line, A549. Arch. Toxicol,, 85, 2011, s.743-750.
14. Garnett, M. C., Kallinteri, P.: Nanomedicines and nanotoxicology: some physiological principles. Occupational Medicíně, 56, 2006, s. 307-311.
15. Gehrke, H., Pelka, J., Hartinger, G., Blank, H., Bleimund, F., Schneider, R., Gerthsen, D., Bräse, S., Crone, M., Türk, M., Marko, D.: Platinum nanoparticles and their cellular uptake and DNA platination at non-cytotoxic concentrations. Arch. Toxicol,, 85, 2011, s.799-812.
16. Genter, M. B., Newman, N. C., Shertzer, H. G., Ali, S. F., Bolon, B.: Distribution and systemic effects of intranasally administered 25 nm silver nanoparticles in adult mice. Toxicko. Pathol., 40, 2012, s. 1004-1013.
17. Hackenberg, S., Scherzed, A., Technau, A., Kessler, M., Froelich, K., Ginzkey, C., Koehler, C., Burghartz, M., Hagen, R., Kleinsasser, N.: Cytotoxic, genotoxic and pro-inflammatory effects of zinc oxide nanoparticles in human nasal mucosa cells in vitro. Toxicology in Vitro, 25, 2011, s. 657-663.
18. Jain, N. K.: Pharmaceutical nanotechnology. National Science Digital Library at NISCAIR, India, 2007. Dostupné z http://nsdl.niscair.res.in/bitstream/123456789/748/1/revised+Pharmaceuticall+Nanotech.pdf
19. Kolachala, V. L., Berg, E. E., Shams, S., Mukhatyar, S., Sueblinvong, V., Bellamkonda, R. V., Johns, M. M.: The use of lipid microtubes as a novel slow-release delivery system for laryngeal injection. Laryngoskope, 121, 2011, s. 1237-1243.
20. Kubek, M. J., Domb, A. J., Veronesi, M. C.: Attenuation of kindled seizures by intranasal delivery of neuropeptide-loaded nanoparticles. Neurotherapeutics, 2009, 6: s. 359-371.
21. Kumar, A., Dhawan, A.: Genotoxic and carcinogenic potential of engineered nanoparticles: an update. Arch. Toxicko., 87, 2013, s. 1883-1900.
22. Lai, K. S., Suk, J. S., Pace, A., Wang, Y.-Y., Yang, M., Mert, O., Chen, J., Kim, J., Hanes, J.: Drug carrier nanoparticles that penetrate human chronic rhinosinusitis mucus. Biomaterials, 32, 2001, s. 6285-6290.
23. Leppänen, M., Korpi, A., Miettinen, M., Leskinen, J., Torvela, T., Rossi, E. M., Vanhala, E., Wolff, H., Alenius, H., Kosma, V. M., Joutsensaari, J., Jokiniemi, J., Pasanen, P.: Nanosized TiO2 caused minor airflow limitation in the murine airways. Arch. Toxicko., 85, 2011, s. 827-839.
24. Li, X., Xu, L., Shao, A., Wu, G., Hanagata, N.: Cytotoxic and genotoxic effects of silver nanoparticles on primary Syrian hamster embryo (SHE) cells. J. Janošci. Nanotechnol., 12, 2013, s. 161-170.
25. Lim, E.-K., Jang, E., Lee, K., Haam, S., Huh, Y.-M.: Delivery of cancer therapeutics using nanotechnology. Pharmaceutics, 2013, 5, s. 294-317.
26. Liu, J., Huang, Y., Kumar, A., Tan, A., Jin, S., Mozhi, A., Liang, X. J.: pH-sensitive nano-systems for drug delivery in cancer therapy. Biotechnol., Adv., 2013, pii: S0734-9750(13)00214-0. doi: 10.1016/j.biotechadv.2013.11.009. [Epub ahead of print].
27. Marano, F., Hussain, S., Rodrigues-Lima, F., Baeza-Squiban, A., Boland, S.: Nanoparticles: molecular targets and cell signalling. Arch. Toxicol., 85, 2011, s. 733-741.
28. Monteiro-Riviere, N. A., Lang Tran, C.: Nanotoxicology: Characterization, Dosing and Health Effects. Informa Healthcare USA, Inc., 2007.
29. Murthy, S. K.: Nanoparticles in modern medicine: state of the art and future challenges. Int. J. Nanomedicine 2007, 2: s. 129-141. Nanoparticles. AIP Conf Proc 2010, 1311: s. 77-88. Nanotechnol., 12, 2013, s. 161-170.
30. Nanotoxicology, HSE (2004). Health effects of particles produced for nanotechnologies. EH75/6 HSE Books, 2004.
31. Ng, C. T., Li, J. J., Gurung, R. L., Hande, M. P., Ong, C. N., Bay, B. H., Yung, L. Y.: Toxicological profile of small airway epithelial cells exposed to gold nanoparticles. Exp. Biol. Med. (Maywood), 238, 2013, s. 1355-1361.
32. Oberdörster, G., Oberdörster, E., Oberdörster, J.: Concepts of nanoparticle dose metric and response metric. Environ Health Perspect, 115, 2007, s. A290.
33. Oberdörster, G., Sharp, Z., Atudorei, V., Elder, A., Gelein, R., Lunts, A., Kreyling, W., Cox, C.: Extrapulmonary translocation of ultrafine carbon particles following whole-body inhalation exposure of rats. J. Toxicol. Environ Health A., 20, 2002, s.1531-1543.
34. Patel, S., Chavhan, S., Soni, H., Babbar, A. K., Mathur, R., Mishra, A. K., Sawant, K.: Brain targeting of risperidone-loaded solid lipid nanoparticles by intranasal route. J. Drug Target, 19, 2011, s. 468-474.
35. Philpott, C. M., Gane, S., McKiernan, D.: Nanomedicine in otorhinolaryngology: what does the future hold? Eur Arch. Otorhinolaryngol., 268, 2011, s. 489-496.
36. Powers, K. W., Brown, S. C., Krishna, V. B., Wasdo, S. C., Moudgil, B. M., Roberts, S. M.: Research strategies for safety evaluation of nanomaterials. Part VI. Characterization of nanoscale particles for toxicological evaluation. Toxicological Sciences, 90, 2006, s. 296-303.
37. Prasad, S., Cody, V., Saucier-Sawyer, J. K., Saltzman, W. M., Sasaki, C. T., Edelson, R. L., Birchall, M. A., Hanlon, D. J.: Polymer nanoparticles containing tumor lysates as antigen delivery vehicles for dendritic cell-based antitumor immunotherapy. Nanomedicine, 2011, 7, s. 1-10. Epub 2010 Aug 6.
38. Sakamoto, T., Nakagawa, T., Horie, R. T., Hiraumi, H., Yamamoto, N., Kikkawa, Y. S., Ito, J.: Inner ear drug delivery system from the clinical point of view. Acta Oto-Laryngologica, 2010, s. 101-104.
39. Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR): Modified Opinion (after Public Consultation) on the Appropriateness of Existing Methodologies to Asses the Potential Risks Associated with Engineered and Adventitious Products of Nanotechnologies. Adopted by the SCENIHR during the 10th plenary meeting of 10 March 2006 after public consultation. Dostupné z: http://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_003b.pdf
40. Seaton, A.: Nanotoxicology: Hazard and risk. NanoBiotechnology, 2005, Humana Press Inc., s. 316.
41. Shapiro, B., Dormer, K., Rutel, I. B.: A Two-magnet system to push therapeutic nanoparticles. AIP Conf. Prof., 1311, 2010, s. 77-88.
42. Srinivasa, A., Jaganmohan Raoa, P., Selvama, G., Balakrishna Murthya, P., Neelakanta Reddyb, P.:Acute inhalation toxicity of cerium oxide nanoparticles in rats. Toxicology Letters, 205, 2011, s.105-115.
43. Stöver, T., Lenarz, T.: Biomaterialien bei Cochlea-implantaten. Laryngo-Rhino-Otol., 88, 2009, s. S12–S31.
44. Surovtseva, E. V., Johnston, A. H., Zhang, W., Zhang, Y., Kim, A., Murakoshi, M., Wada, H., Newman, T. A., Zou, J., Pyykkö, I.: Prestin binding peptides as ligands for targeted polymersome mediated drug delivery to outer hair cells in the inner ear. Int. J. Pharm., 424, 2012, s. 121-127.
45. Webster, T.: Nanomedicine: what’s in a definition? Int. J. Nanomedicine, 2006, 1, s. 115-116.
46. Weiss, C., Diabaté, S.: Editorial: A special issue on nanotoxicology. Arch. Toxicko., 85, 2011, s. 705-706.
47. Xu, J., Dai, W., Wang, Z., Chen, B., Li, Z., Fan, X.: Intranasal vaccination with chitosan-DNA nanoparticles expressing pneumococcal surface antigen a protects mice against nasopharyngeal colonization by streptococcus pneumoniae. Clin. Vaccine Imunol., 18, 2011, s. 75-81.
48. Xu, J., Li, Z., Xu, P., Xiao, L., Yang, Z.: Nanosized copper oxide induces apoptosis through oxidative stress in podocytes. Arch. Toxicko., 87, 2013, s. 1067-1073.
49. Zamankhan, P., Ahmadi, G., Wang, Z., Hopke, P. K., Cheng, Y. S., Su, W. C., Leonard, D.: Airflow and deposition of nano-particles in a human nasal cavity. Aerosol Science and Technology, 40, 2006, s. 463-476.
50. Zeleník, K., Kukutschová, J., Dvořáčková, J., Bielniková, J., Peikertová, P., Čábalová, L., Komínek, P.: Possible role of nano-sized particles in chronic tonsillitis and tonsillar carcinoma: a pilot study. Eur Arch. Otorhinolaryngol., 270, 2012, s. 705-709.
51. Zhang, W., Zhang, Y., Löbler, M., Schmitz, K. P., Ahmad, A., Pyykkö, I., Zou, J.: Nanoparticles in medicine: Therapeutic applications and developments. Clin. Pharmacol. Ther., 83, 2008, s. 761-769.
52. Zhang, W., Zhang, Y., Löbler, M., Schmitz, K. P., Ahmad, A., Pyykkö, I., Zou, J.: Nuclear entry of hyperbranched polylysine nanoparticles into cochlear ear cells. Int. . Nanomedicine, 2011, 6, s. 535-546.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2016 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Inosin pranobex v léčbě chřipky a dalších respiračních infekcí virové etiologie
-
Všechny články tohoto čísla
- Změny hladin vybraných cytokinů Th1, Th2 a Treg v séru u chronických infekcí (vč. H. pylori) v orofaryngu v závislosti na podání DHA a EPA a/nebo tonzilektomii – pilotní studie
- Endoskopická ušní chirurgie: první zkušenosti
- Role zobrazovacích metod v diagnostickém a terapeutickém postupu u cholesteatomu spánkové kosti
- Nanočástice, nanotoxikologie, nanomedicína: definice pojmů, perspektivy v otorinolaryngologii
- Endoskopická ušní chirurgie: shrnutí problematiky
- Sekreční karcinom slinných žláz
- Ganglioneurom, raritní příčina nádoru měkkých tkání krku v dospělosti
- Orbitální absces - možná komplikace akutní rinosinusitidy i při důsledné konzervativní terapii
-
78. kongres České společnosti otorinolaryngologie a chirurgie hlavy a krku ČLS JEP
(Karlovy Vary, 1. – 3. června 2016) -
KUTVIRTOVA CENA 2015
Cena České společnosti otorinolaryngologie a chirurgie hlavy a krku ČLS JEP za práce publikované v r. 2015 – výsledky soutěže.
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nanočástice, nanotoxikologie, nanomedicína: definice pojmů, perspektivy v otorinolaryngologii
- Orbitální absces - možná komplikace akutní rinosinusitidy i při důsledné konzervativní terapii
- Sekreční karcinom slinných žláz
- Ganglioneurom, raritní příčina nádoru měkkých tkání krku v dospělosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



