-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunohistochemická exprese C-kit onkoproteinu u karcinomů slinných žláz (Pilotní studie)
Immunohistochemical expression of C-kit oncoprotein in salivary gland carcinomas (A pilot study)
Background:
To investigate the expression of c-kit protein in salivary gland carcinomas and to correlate it to prognosis.Methods:
Immunohistochemistry for c-kit protein was performed in 33 carcinomas, using formalin-fixed paraffin-embedded sections. For the evaluation of reactivity of tumor cells, a combination of the cytoplasmic and/or membranous staining and the percentage of positive cells were applied. Only cases without any staining pattern were considered negative. For prognostic correlation, univariate disease-specific survival curves were calculated by the Kaplan-Meier method and distributions were compared using the log-rank test.Results:
Of all 33 cases, only 7 were c-kit negative, including 3 low-grade mucoepidermoid carcinomas, 2 carcinomas ex pleomorphic adenoma and 1 secretory carcinoma and 1 low-grade cribriform cystadenocarcinoma. The group of 26 (i.e. 79 %) positive tumors was dominated by 9 adenoid cystic carcinomas (all but one revealing strong reaction), followed by 5 acinic cell, 3 each mucoepidermoid and salivary duct carcinoma, 2 carcinomas ex pleomorphic adenoma and 4 other tumors, in which positive staining ranged from 50-100 %, with the immunoreaction varying from weak to strong. Disease specific survival in c-kit negative (n=7) carcinomas did not differ from that in positive (n=26) cases.Conclusions:
Of all salivary gland carcinomas, only adenoid cystic carcinoma was regularly associated with strong c-kit expression. Immunoreactivity in other subtypes, considering our as well as published data, greatly varies. C-kit expression harbors no significant prognostic information.Key words:
c-kit oncoprotein, salivary gland carcinoma, prognosis.
Autoři: I. Stárek 1; L. Kučerová 2; A. Skálová 3; M. Brož 1; T. Bakaj 1; K. Langová 4
Působiště autorů: Klinika ORL a chirurgie hlavy a krku LF UP a FN, Olomouc, přednosta prof. MUDr. I. Stárek, CSc. 1; Ústav patologie, FN Olomouc, přednosta doc. MUDr. M. Tichý, CSc. 2; Ústav patologie, FN Plzeň, přednosta prof. MUDr. M. Michal 3; Ústav lékařské biofyziky LF UP, Olomouc, přednostka doc. RNDr. H. Kolářová, Ph. D. 4
Vyšlo v časopise: Otorinolaryngol Foniatr, 59, 2010, No. 3, pp. 129-135.
Kategorie: Původní práce
Souhrn
Cíle:
Zhodnocení exprese c-kit onkoproteinu u karcinomů slinných žláz a její korelace s prognózou.Metody:
Imunohistochemická analýza c-kit proteinu byla provedena u 33 karcinomů za užití formalinem fixovaných parafinových bločků. Pro hodnocení reaktivity nádoru byla použita kombinace cytoplazmatického a/nebo membranózního barvení s procentem pozitivních buněk. Za negativní byly považovány jen případy bez jakékokoliv imunoreakce. Prognostické korelace byly provedeny univariátní analýzou nádorově specifických přežívacích křivek dle Kaplan-Meiera a porováním pomocí log-rank testu.Výsledky:
Ze 33 hodnocených bylo jen 7 nádorů c-kit negativních, a to 3 low-grade karcinomy mukoepidermoidní, 2 karcinomy z pleomorfního adenomu, jeden karcinom sekretorický a jeden low-grade kribriformní cystadenokarcinom. Ve skupině 26 (tj. 79 %) pozitivních tumorů převládalo 9 karcinomů adenoidně cystických (všechny až na jeden silně imunoreaktivní), následovaných 5 karcinomy acinocelulárními, 3 karcinomy mukoepidermoidními a 3 salivárními duktálními, 2 karcinomy z pleomorfního adenomu a 4 dalšími karcinomy, u kterých se pozitivita pohybovala od 50 do 100 % při slabé až silné imunoreakci. Chí-kvadrátem nebyl zjištěn rozdíl v nádorově specifickém přežívání u c-kit negativních (n=7) a pozitivních (n=26) karcinomů.Závěry:
Ze všech typů salivárních karcinomů jevil pravidelnou silnou reaktivitu jen karcinom adenoidně cystický. Imunoreaktivita ostatních typů v souladu s publikovanými daty silně kolísala. Stanovení c-kit exprese nemá prognostický význam.Klíčová slova:
c-kit onkoprotein, karcinomy slinných žláz, prognóza.ÚVOD
Karcinomy sliných žláz se na celkovém počtu humánních malignit podílejí jen asi 1 %. Všeobecnou charakteristikou této v oblasti hlavy a krku unikátní nádorové skupiny je značná morfologická i biologická rozmanitost mezi i v rámci jedné a téže histopatologické jednotky, jež způsobuje potíže v diferenciální diagnostice a prognóze. Klinickým problémem jsou pak neuspokojivé výsledky terapie salivárních karcinomů s vysokým stupněm malignity, kdy i přes komplexní léčbu, zahrnující jejich radikální chirurgické odstranění a následnou radioterapii, činí 5leté přežití pouze něco kolem 50 %, 10leté křivky pak klesají ke 20 % (5, 12, 22). Není tedy překvapující, že stále více pozornosti je věnováno molekulárně-biologickým markerům těchto tumorů v očekávání usnadnění jejich diferenciální diagnostiky, možnosti stanovení individuálně přesné prognózy, jakož i cílené biologické léčby. Zejména pro posledně uvedený aspekt byly zkoumány primárně ty onkogeny, resp. onkoproteiny, jejichž inhibice se osvědčila v terapii karcinomů jiných lokalit, tj. především EGFR a HER-2-Neu u karcinomu tlustého střeva, resp. prsu. Nejvíce poznatků v tomto směru máme u posledně uvedeného onkogenu, jenž je exprimován především u salivárního duktálního karcinomu (30). U pleomorfního adenomu se HER-2-Neu velmi pravděpodobně účastní na jeho zvratu v karcinom. Průkaz tohoto genu slouží k jeho časné detekci, jež může být jinak velmi obtížná (7). Daleko méně je v souvislosti se salivárními karcinomy známo o expresi a prognostickém významu protoonkogenů VEGF, NF-κB, EGFR a C-kit. V naší pilotní studii jsme se zaměřili na imunohistochemický průkaz exprese posledně uvedeného onkoproteinu. Náplní dalších prací pak bude jeho molekulárně-genetická analýza. Jejich očekávaným výstupem je vedle zpřesnění histopatologické diagnostiky i položení základů pro klinické studie, testující možnosti cílené léčby tyrosinkinásovým inhibitorem Imatinibem.
SOUBOR PACIENTŮ A METODY
Z registru karcinomů velkých žláz, vedeného na ORL klinice v Olomouci, bylo do retrospektivní studie vybráno 33 nemocných, u nichž byly dostupné archivované parafinové bloky a současně i relevantní klinická data. 17 nemocných bylo ženského, 16 mužského pohlaví. Věk všech nemocných se pohyboval v rozmezí 8 až 86 let, průměr pak činil 52, 45 let. Většina karcinomů vyrůstala z příušní žlázy, v gl. submandibularis byly lokalizovány pouze 2 karcinomy, v žádném případě se nevyskytl tumor ve žláze podjazykové. Šest nemocných bylo ve stadiu T1, 10 ve stadiu T2, 9 ve stadiu T3, a 5 ve stadiu T4, u tří nemocných nebylo možno tento údaj zjistit. U 31 nemocných s parotickými karcinomy byla provedena 8krát superficiální, 8krát totální konzervativní a 15krát totální radikální, event. rozšířená parotidektomie. Tumory gl. submandibularis byly exstirpovány in toto se žlázou. Kurativní nebo elektivní bloková krční disekce byla provedena ve 24 případech. 23 nemocných bylo následně ozářeno. Z celkové skupiny 33 pacientů jich 20 žije, z toho 2 se známkami onemocnění, 13 na nádor zemřelo. Rozsah sledovacího intervalu byl 8-270, průměrně 78,97 měsíců (medián 64 měsíců). Z jednotlivých histopatologických forem byl nejčastějším karcinom adenoidně cystický (9 nemocných), následovaný karcinomem mukoepidermoidním (6x), acinocelulárním (5x) a karcinomem z pleomorfního adenomu (4x), dále salivárním duktálním a nediferencovaným karcinomem (3, resp. 2 případy), po jednom případu pak adenokarcinomem jinak nespecifikovaným, kribriformním cystadenokarcinomem, adenokarcinomem papilárně-cystickým a sekretorickým karcinomem slinných žláz (nová jednotka (31), dosud neuvedena ve WHO klasifikaci).
Exprese c-kit onkoproteinu byla hodnocena semikvantitativně kombinací intenzity membranózní a/nebo cytoplazmatické reakce (škála 1+, 2+, 3+) a relativního počtu pozitivních buněk metodou dle Wenta (40) (tab. 1). Za negativní jsme považovali pouze tumory bez jakékoliv reakce.
Tab. 1. Semikvantitativní hodnocení exprese c-kit dle Wenta (40). 
Obr. 1. kit negativní low-grade kribriformní cystadenokarcinom (hematoxylin-eosin, zv. 200x). 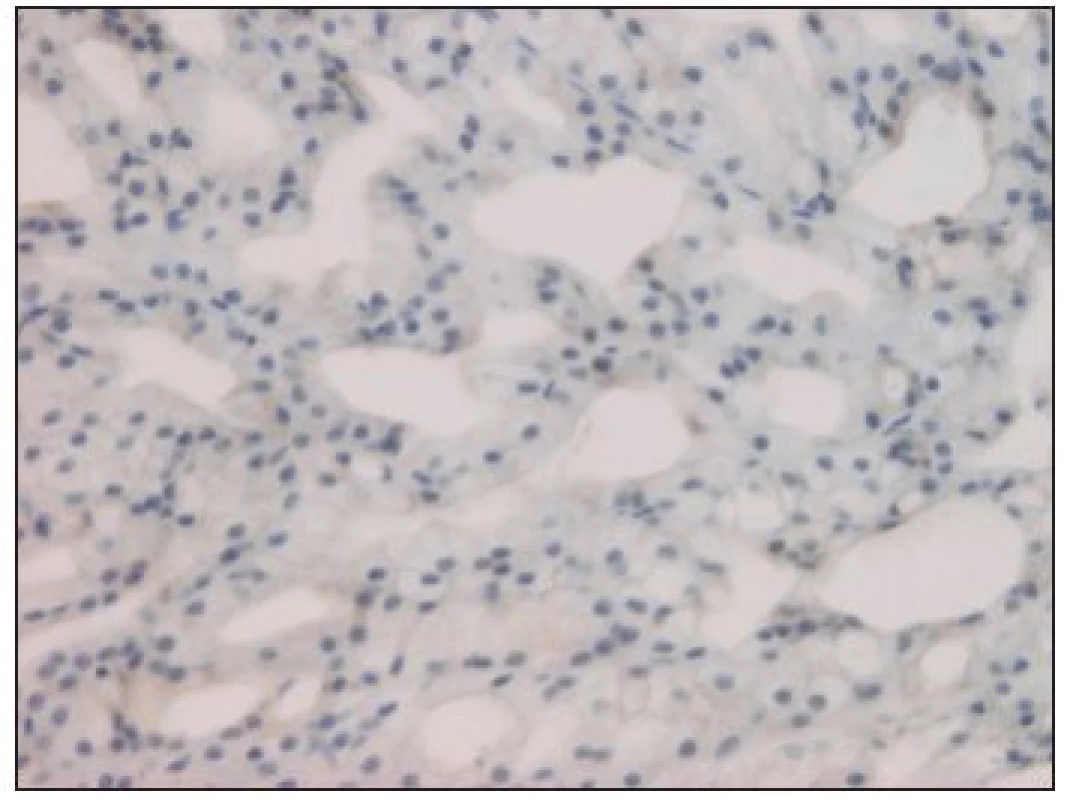
IMUNOHISTOCHEMICKÉ VYŠETŘENÍ
K detekci exprese c-kit jsme použili formalinem fixované, do parafinu zalité tkáňové řezy. Imunohistochemická reakce byla provedena standardním způsobem za použití polyklonální králičí protilátky firmy Dako (Glostrup, Denmark) proti transmembránovému tyrosinkinázovému receptoru CD117/c-kit v ředění 1 : 100 při 120 0C s použitím mikrovlnné trouby k odmaskování epitopu antigenu. K vizualizaci proběhlé reakce byl použit detekční systém Histofine (Nichirei Biosciences INC, Universal immunoperoxidase polymer anti-rabbit) a DAB (diaminobenzidine) jako chromogen. Jako pozitivní kontrola sloužily tkáňové řezy ze stromálního tumoru gastrointestinálního traktu (GIST).
STATISTICKÉ METODY ZHODNOCENÍ
Pravěpodobnost kumulativního přežití u pacientů s c-kit pozitivními a negativními karcinomy (Kaplan-Meier) byla porovnána log-rank testem.
VÝSLEDKY
Z celkového počtu 33 karcinomů bylo 26 (tj. 79 %) c-kit pozitivních. Na 7 negativních výsledcích se podílely 3 karcinomy mukoepidermoidní, 2 karcinomy z pleomorfního adenomu, jeden karcinom sekretorický a low-grade kribriformní cystadenokarcinom (obr. 1). Kompletní (až na jeden případ) silnou reakci jsme zjistili u 9 karcinomů adenoidně cystických (obr. 2) a dále u všech 3 salivárních duktálních karcinomů. U ostatních hodnocených histopatologických jednotek se c-kit pozitivita pohybovala od 50 do 100 % při variabilní, většinou však nižší intenzitě barvení (tab. 2).
Tab. 2. Exprese c-kit onkoproteinu v závislosti na histopatologickém typu karcinomu. Porovnání našich a publikovaných výsledků. 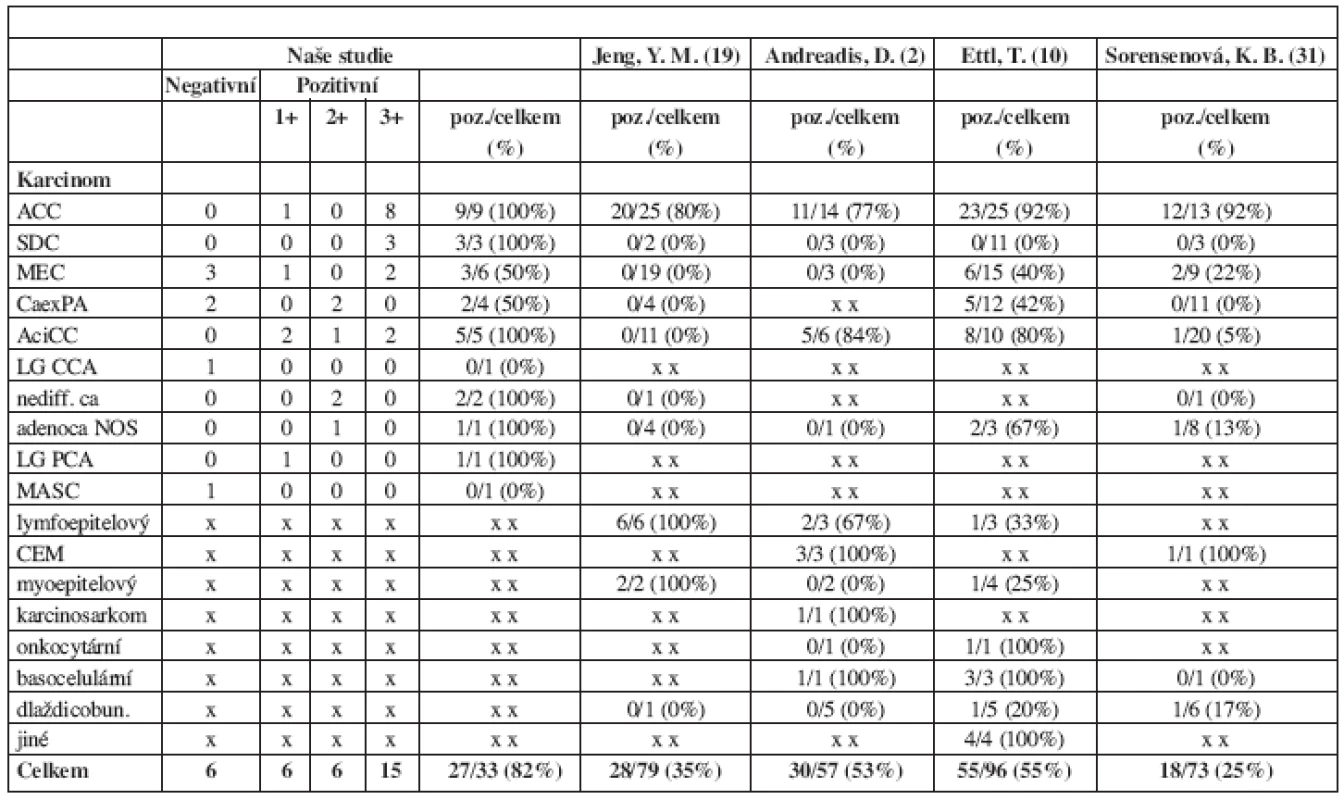
ACC = karcinom adenoidně cystický SDC = salivární duktální karcinom MEC = karcinom mukoepidermoidní CaexPA = karcinom z pleomorfního adenomu ACiCC = karcinom acinocelulární MASC = sekretorický karcinom slinných žláz adenoca NOS = adenokarcinom jinak nespecifikovaný LG CCA = low-grade kribriformní cystadenokarcinom LG PCA = low-grade papilárně cystický adenokarcinom CEM = karcinom epitelově - myoepitelový Obr. 2. C-kit 3+ pozitivní adenoidně cystický karcinom (hematoxylin-eosin, zv. 200x). 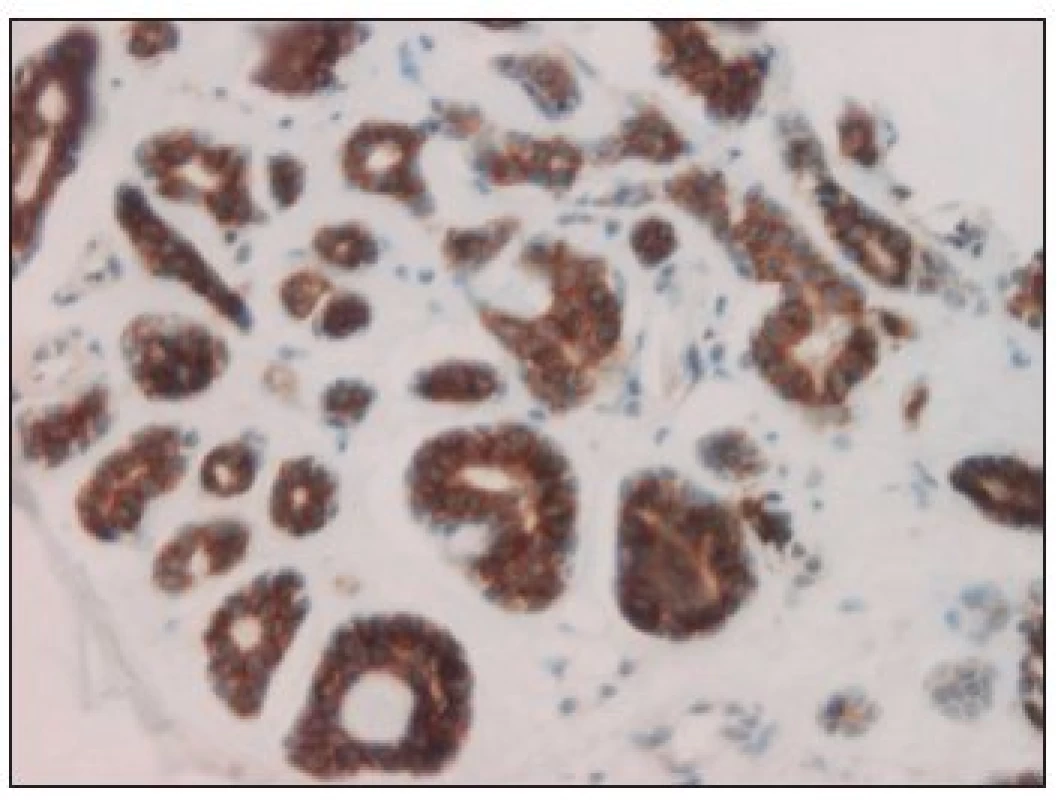
Pravděpodobnost kumulativního přežití (Kaplan-Meier) u pacientů s c-kit pozitivními (n = 27) a negativními (n = 6) karcinomy se při hodnocení log-rank testem statisticky nelišila.
DISKUSE
C-kit je transmembránový tyrosin kinázový glykoproteinový receptor, jehož gen, nacházející se v pozici 4 (q11-12), se účastní regulace buněčného růstu. Jeho vazba s ligandem aktivuje intracytoplazmatickou signální kaskádu hematopoetických, melano - a gametogenetických buněk (4, 16, 20, 41). Tento receptor byl prokázán v celé řadě nenádorových buněk, např. v mastocytech, intersticiálních buňkách Cajalových, bazocelulárních buňkách kůže, CNS, acinárních a duktálních buňkách slinných žláz (3, 21, 35, 36). C-kit je exprimován buňkami mnoha nádorů, především gastrointestinálního stromálního tumoru a akutní myeloblastické leukemie, dále pak karcinomu prostaty, ovaria, ledvin, papilárního a folikulárního karcinomu štítnice a malobuněčného karcinomu plic (23, 28, 29, 33, 39).
Imunoexpresi C-kit onkoproteinu u karcinomů slinných žláz se věnovalo dosud jen několik málo, ve výsledcích se často rozcházejících studií (tab. 2).
V Jengově souboru (19) 79 salivárních karcinomů vykazovalo c-kit imunopozitivitu jen 20 z 25 adenoidně cystických karcinomů, dále pak všechny karcinomy lymfo - a myoepitelové, zastoupené 6, resp. 2 případy. Ostatních 46 hodnocených tumorů (karcinom myoepitelový, mukoepidermoidní, acinocelulární, polymorfní low-grade adenokarcinom, adenokarcinom NOS, karcinom z pleomorfního adenomu, salivární duktální, nediferencovaný a dlaždicobuněčný karcinom) bylo negativních. Naproti tomu Andreadis (2) v testované skupině 57 tumorů zjistil c-kit imunoexpresi v 30 případech poněkud širšího histopatologického spektra. Vedle dominantního karcinomu adenoidně cystického (11 pozitivních ze 14 hodnocených), šlo o karcinom acinocelulární (5/6), epitelově-myoepitelový (3/3), lymfoepitelový (1/1), polymorfní low-grade adenokarcinom (7/14) a karcinosarkom (1/1). Negativita byla zjištěna u karcinomu mukoepidermoidního (0/3), dlaždicobuněčného (0/5), salivárního duktálního (0/2), myoepitelového (0/2), onkocytárního (0/1) a adenokarcinomu NOS (0/1).
V studii Soerensenové (32), zahrnující 73 parotických karcinomů, vykazovalo c-kit imunoreakci jen 18 (tj. 25 %) tumorů, mezi nimiž s 92% pozitivitou převládal karcinom adenoidně cystický. U ostatních 9 histopatologických subtypů byla (s výjimkou jediného epiteliálně-myoepiteliálního karcinomu) reakce nulová nebo nízká.
Početně dosud nejobsáhlejší je Ettlova sestava 96 případů salivárních karcinomů, z nichž 55 bylo c-kit pozitivních (10). V testované histopatologické škále byl zcela negativní toliko karcinom duktální (celkem 11 případů), všechny ostatní jednotky byly ve větším či menším procentu pozitivní. Stejně jako u 3 výše uvedených studií vykazoval c-kit expresi nejčastěji karcinom adenoidně cystický (23 z 25 hodnocených), následován karcinomem acinocelulárním (8/10), mukoepidermoidním (6/15), karcinomem z pleomorfního adenomu (5/12) a dalšími, vzácněji zastoupenými typy.
V našem souboru jsme prokázali c-kit expresi u 27 ze 33 (tj. 82 %) hodnocených karcinomů. Imunoreaktivita přitom procházela s různým podílem pozitivních případů napříč téměř celým spektrem 11 zde zahrnutých histopatologických jednotek, když jedinou výjimkou byl c-kit negativní mamární analogický sekreční karcinom slinných žláz. Při porovnání našich a publikovaných výsledků (tab. 2) je zřejmé, že shody v udávané c-kit expresi je dosahováno toliko u karcinomu adenoidně cystického, u všech ostatních, méně či více často se vyskytujících typů karcinomů jsou výsledky značně odlišné.
Osm z 9 námi hodnocených adenoidně cystických karcinomů vykazovalo silnou expresi. Analogické výsledky uvádějí i další autoři (9, 10, 13, 15, 38), intenzivní c-kit reakce u tohoto tumoru se tudíž nabízí jako potenciální diferenciálně-diagnostický znak mezi tímto tumorem a histologicky podobným, avšak biologicky příznivějším polymorfním low-grade adenokarcinomem, jenž podle Beltrana (6) vykazuje významně slabší imunohistochemickou c-kit expresi. Edwards (9) naproti tomu zjistil c-kit imunopozitivitu u 16 z jím hodnocených 17 polymorfních low-grade karcinomů, přičemž v 5 případech šlo o silnou expresi, takže z diferenciálně diagnostického hlediska považuje imunohistochemický průkaz tohoto onkoproteinu v obou uvedených biologicky odlišných afekcích za nepřínosný. V naší sestavě nebyl polymorfní low-grade adenokarcinom zastoupen, v tomto směru je studie nepřínosná.
Potenciální možností využití stanovení c-kit proteinu u adenoidně cystického karcinomu je včasná detekce jeho high-grade transformace, jež tento tumor s typicky dlouhodobým, avšak nelítostným průběhem mění v překotně progredující, lymfogenně se šířící lézi s rychlým letálním koncem. Odhalení tohoto zvratu na základě morfologických změn je velmi obtížné. Jak prokázal Seethala (27), stanovení c-kit overexprese v tomto ohledu nemá význam.
Dalším z úskalí histopatologické diagnostiky adenoidně cystického karcinomu může být i jeho odlišení od pleomorfního a monomorfního adenomu. Stanovení c-kit v těchto případech se jeví jako nepřínosné, neboť v Andreadisově sestavě (2) všech 20 testovaných pleomorfních adenomů vykazovalo c-kit pozitivitu, podobné výsledky udává i Chandan (18). Edwards (9) pak zjistil pozitivní reakci u 16 ze 17 monomorfních adenomů, přičemž v 10 případech šlo o silnou expresi.
Prognostickému významu c-kit overexprese věnovaly pozornost zatím jen 2 práce. Ettl (10) nalezl pozitivní korelaci mezi chyběním imunoreakce a starším věkem (70 a více let) nemocných, vysokým histologickým stupněm malignity a výskytem uzlinových metastáz. V univariátní analýze významu exprese c-kit receptoru pro přežití byla její negativita vedle některých dalších sledovaných klinických a imunohistochemických parametrů signifikantním faktorem. V multivariátním hodnocení však její vliv nebyl potvrzen. Vedle hodnocení prognostického významu pro celou skupinu salivárních karcinomů byla c-kit exprese analyzována i pro nejčastěji se vyskytující histopatologické jednotky. Negativita vyšetření korelovala nesigifikantně s přežitím u mukoepidermoidního karcinomu a karcinomu v pleomorfním adenomu, u karcinomu acinocelulárního byla korelace dokonce signifikantní. U salivárního duktálního a adenoidně cystického karcinomu nebyla zjištěna žádná závislost mezi c-kit expresí a prognózou. Naproti tomu Sorensenová (32) ve skupině 73 karcinomů, pozůstávající z 10 histopatologických subtypů, nepotvrdila žádnou prognostickou hodnotu exprese tohoto tyrosin-kinásového receptoru, nebyla prokázána ani její korelace se stupněm malignity, velikostí či klinickým stadiem tumoru a histopatologickým stavem regionálních uzlin. Takováto zásadní diskrepance výsledků obou zmíněných studií může snad být způsobena odlišnou metodikou určení negativity imunoreakce: Ettl (10) hodnotí jako c-kit negativní tumory s úplnou absencí imunoreakce a všechny ostatní (tj. l+, 2+, 3+) jako pozitivní. Vychází přitom ze zkušeností Rohra (25), Tsutsui (34) a Honga (16), získaných u některých extrasalivárních karcinomů, které ukazují, že při užití c-kit jako prognostického markeru i slabá reakce musí být hodnocena jako pozitivní. Naproti tomu Sorensenová (32) řadí mezi negativní i 1+ případy. V naší studii, používající Ettlovu metodiku (10), nebyl potvrzen rozdíl v celkovém nádorově specifickém přežívání (disease specific survival) u c-kit negativních vs. pozitivních karcinomů. Statistické hodnocení c-kit exprese, jakožto prognostického parametru stratifikované pro jednotlivé histopatologické typy, nebylo pro malý počet případů v dané skupině v naší pilotní studii možné.
Hlavním klinickým benefitem stanovení nádorové exprese c-kit receptoru je potenciální možnost jeho blokády tyrosin kinásu inhibujícím Imatinibem (STI571, Gleevec). Účinnost této terapie byla prokázána u gastrointestinálního stromálního tumoru (37) a chronické myeloidní leukemie (8). Vzhledem k dosavadním výsledkům relevantních studií, prokazujících asi 90% imunohistochemickou c-kit pozitivitu u relativně často se vyskytujícího adenoidně cystického karcinomu, byla léčba Imatinibem testována zatím jen u tohoto typu tumoru. Hotte (17) ve své předčasně ukončené studii, zahrnující 16 pacientů s progredujícím, metastatickým či recidivujícím tumorem, nezjistil žádný efekt této cílené biologické terapie. Ke stejným výsledkům dospěl u 10 pacientů i Pfeffer (24). Naproti tomu Faivrová (11) zaznamenala u 3 ze 6 takto léčených toliko stabilizaci nádoru, k částečné regresi došlo u jednoho pacienta s 3+ reakcí. Nelze tak vyloučit, že pozitivní léčebnou odpověď podmiňuje silná imunoreaktivita. Tuto domněnku podporuje fakt, že z celkem 16 Hotteho (17) pacientů byli pouze 4 hodnoceni jako 3+. Odlišnost výsledků uvedených prací můžeme dále spatřovat v malém počtu testovaných případů a v nejednotném léčebném režimu.
Bylo prokázáno, že efektivita léčby Imatinibem závisí na výskytu a typu c-kit aktivačních genových mutací (1, 26). Tak např. Heinrich (14) u 127 pacientů s gastrointestinálním stromálním tumorem prokázal, že v podskupině 85 nemocných s mutací exonu 11 činila parciální léčebná odpověď na Imatinib 83,5 %, zatímco u pacientů s mutacemi exonu 9 jen 47,8 %. Případy bez prokazatelných c-kit mutací pak zůstaly touto terapií zcela neovlivněny. Znalosti c-kit genetických změn u salivárních karcinomů jsou dosud omezeny. Holstová (15) u 30 adenoidně cystikých karcinomů, z nichž 90 % vykazovalo imunohistochemickou c-kit reaktivitu, nezjistila žádné c-kit relevantní genové mutace. Vila (38) v recentní studii zjišťoval na 14 případech téhož histologického typu karcinomu přítomnost c-kit mutací metodou PCR, klonální selekcí a DNA sekvenční analýzou. V 7 z 8 (tj. 88 %) nádorů, u nichž byla byla analýza uspěšná, zjistil mutace v převážně exonu 11, méně pak v exonu 9, exonu 13 a exonu 17. Některé bodové mutace se přitom nacházely v doménách, popsaných u gastrointestinálního stromálního tumoru.
ZÁVĚR
C-kit protonkogen hraje velmi pravděpodobně roli v onkogeneze adenoidně cystického karcinomu, jeho účast na vzniku a růstu dalších maligních, jakož i některých benigních sialomů je vágní. Výsledky dosavadních studií, zkoumajících imunohistochemickou expresi jeho proteinu u ostatních histopatologických typů této onkologické skupiny, jsou někdy až diametrálně rozporné. Příčinu tohoto stavu spatřujeme v nejednotné metodice hodnocení pozitivity reakce, v různých protilátkách a metodologii, jež byly použity k imunodetekci onkoproteinu, jakož i v malém počtu testovaných, zejména vzácněji se vyskytujících histopatologických jednotek. Vedle intrinsické biologické variability tumorů zde určitou roli může hrát i ztráta imunoreaktivity antigenu ve formalinem fixovaných archivovaných parafinových bločcích, i když vzhledem k prakticky 100% expresi adenoidně cystického karcinomu se posledně uvedená příčina jeví jako méně pravděpodobná. Imunohistochemická detekce c-kit onkoproteinu se pro prognózu a diferenciální diagnostiku karcinomů slinných žláz zatím tedy jeví jako nepřínosná. Více snad lze v tomto směru očekávat od molekulárně genetických analýz c-kit protoonkogenu, které zřejmě budou u této onkologické skupiny i klíčem k efektivitě cílené léčby Imatinibem.
Práce je podpořena grantem č. NS9725-4/2008, IGA, MZ České republiky
Prof. MUDr. Ivo Stárek, CSc.
ORL klinika LF UP a FNOL
I. P. Pavlova 5
775 20 Olomouc
e-mail: stareki@fnol.cz
Zdroje
1. Akin, C., Metcalfe, D. D.: The biology of Kit in disease and the application of pharmacogenetics. J. Allergy Clin. Immunol., roč. 114, 2004, s. 13-19.
2. Andreadis, D., Epivatianos, A., Poulopoulos, A. et al.: Detection of C-kit (CD117) molecule in benign and malignant salivary gland tumours. Oral. Oncol., roč. 42, 2006, č. 1, s. 57-65.
3. Arber, D. A., Tamaro, R., Weiss, L. M.: Paraffin section detection of the c-kit gene product (CD117) in human tissue: value in the diagnosis of mast cell disorders. Hum. Pathol., roč. 29, 1998, č. 5, s. 498-504.
4. Ashman, L. K.: The biology of stem cell factor and its receptor C-kit. Int. J. Biochem. Cell Biol., roč. 31, 1999, č. 10, s.1037-1051.
5. Bell, R., Dierks, E. J., Potter, B. E.: Management and outcome of patients with malignant salivary gland tumors. J. Oral Maxillofac. Surg., roč. 63, 2005, s. 917-928.
6. Beltran, D., Faquin, W. C., Gallagher, G. et al.: Selective immunohistochemical comparison of polymorphous low-grade adenocarcinoma and adenoid cystic carcinoma. J. Oral Maxillofac. Surg., roč. 64, 2006, č. 3, s. 415-423.
7. Di Palma, S., Skálová, A., Vaněček, T. et al.: Non-invasive (intracapsular) carcinoma ex pleomorphic adenoma: recognition of focal carcinoma by HER-2/neu and MIB1 immunohistochemistry. Histopathol., roč. 46, 2005, č. 2, s.144-152.
8. Druker, B., Talpaz, M., Resta, D. J. et al.: Efficacy and safety of a specific inhibitor of the CBR-ABL tyrosin kinase in chronic myeloid leukemia. N. Engl. J. Med., roč. 344, 2001, s. 1031-1037.
9. Edwards, P. C., Bhuiya, T., Kepech, R. D.: C-kit expression in the salivary gland neoplasms adenoid cystic carcinoma, polymorphous low-grade adenocarcinoma, and monomorphic adenoma. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endodontics., roč. 95, 2003, č. 5, s. 586-593.
10. Ettl, T., Schwarz, N., Hartmann, A. et al.: Overexpression of EGFR and absence of C-KIT expression correlate with poor prognosis in salivary gland carcinomas. Histopathol., roč. 53, 2008, č. 5, s. 567-577.
11. Faivre, S., Raymond, E., Casiraghi, O. et al.: Imatinib mesylate can induce objective response in progressing, highly expressing KIT adenoid cystic carcinoma of the salivary glands. J. Clin. Oncol., roč. 23, 2005, s. 6271-6273.
12. Frankenthaler, R. A., Luna, M. A., Lee, S. S.: Prognostic variables in parotid gland cancer. Arch. Otolaryngol. Head Neck Surg., roč. 117, 1991, s. 1251-1256.
13. Freier, K., Flechtenmacher, C., Walch, A. et al.: Differential KIT expression in histological subtypes of adenoid cystic carcinoma (ACC) of the salivary gland. Oral Oncol., roč. 41, 2005, č. 9, s. 934-939.
14. Heinrich, M. C., Corless, C. L., Demeteri, G. D. et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J. Clin. Oncol., roč. 21, 2003, s. 4342-4349.
15. Holst, V. A., Marshall, C. E., Moskaluk, C. A. et al.: KIT protein expression and analysis of c-kit gene mutation in adenoid cystic carcinoma. Mod. Pathol., roč. 12, 1999, č. 10, s. 956-960.
16. Hong, S. M., Hwang, I., Song, D. E. et al.: Clinical and prognostic significances of nuclear and cytoplasmic KIT expressions in extrahepatic bile duct carcinomas. Mod. Pathol., roč. 20, 2007, s. 562-569.
17. Hotte, S. J., Winquist, E. W., Lamont, E.: Imatinib mesylate in patients with adenoid cystic cancers of the salivary glands expressing c-kit: A Princess Margaret Hospital phase II consortium study. J. Clin. Oncol., roč. 23, 2008, č. 3, s. 585-590.
18. Chandan, V. S., Wilbur, D., Faquin, W. C. et al.: Is c-kit (CD117) immunolocalization in cell block preparations useful in the differentiation of adenoid cystic carcinoma from pleomorphic adenoma? Cancer (Cancer Cytopathol), roč. 102, 2004, s. 207-209.
19. Jeng, Y. M., Lin, Ch. Y., Hsu, H. Ch.: Expression of the c-kit protein is associated with certain subtypes of salivary gland carcinoma. Cancer Letters, roč. 154, 2000, s. 107-111.
20. Juany, E., Nocka, K., Beier, D. R. et al.: The hematopoetic growth factor KL is encoded by the Sl locus and is the ligand of the c-kit receptor, the gene product of the W locus. Cell, roč. 63, 1990, č. 1, s. 225-233.
21. Lammie, A., Drobnjak, M., Gerald, W. et al.: Expression of c-kit and kit ligand proteins in normal human tissues. J. Histochem. Cytochem., roč. 42, 1994, č. 11, s. 1417-1425.
22. Lima, R. A., Tavares, M. R., Dias, F. L. et al.: Clinical prognostic factors in malignant parotid gland tumors. Otolaryngol. Head Neck Surg., roč. 133, 2005, s. 702-708.
23. Miliaras, D., Karasavvidou, F., Papanikolaou, A. et al.: KIT expression in fetal, normal adult and neoplastic renal tissues. J. Clin. Pathol., roč. 57, 2004, s. 463-466.
24. Pfeffer, M. R., Talmi, Y., Catane, R. et al.: A phase II study of Imatinib for advanced adenoid cystic carcinoma of head and neck salivary glands. Oral Oncol., roč. 43, 2007, s. 33-36.
25. Rohr, U. P., Rehfeld, N., Pflugfelder, L. et al.: Expression of the tyrosine kinase c-kit is an independent prognostic factor in patients with small cell lung cancer. Int. J. Cancer, roč. 111, 2004, s. 259-263.
26. Sattler, M., Salgia, R.: Targeting c-Kit mutations: basic science to novel therapies. Leuk. Res., roč. 28 (Suppl. 1), 2004, s. 11-20.
27. Seethala, R. R., Hunt, J. L., Baloch, Z. W. et al.: Adenoid cystic carcinoma with high-grade transformation. A report of 11 cases and a review of the literature. Amer. J. Surg. Pathol., roč. 31, 2007, č. 11, s. 1683-1694.
28. Schmandt, R. E., Broaddus, R., Lu, K. H. K. et al.: Expression of c-ABL, c-KIT, and platelet derived growth factor receptor-beta in ovarian serous carcinoma and normal ovarian surface epithelium. Cancer, roč. 98, 2003, č. 4, s. 758-764.
29. Simak, R., Capodieci, P., Cohen, D. W. et al.: Expression of c-kit and kit-ligand in benign and malignant prostatic tissues. Histol. Histopathol., roč. 15, 2000, č. 2, s. 765-374.
30. Skálová, A., Stárek, I., Vaněček, T. et al.: Expression of HER2/neu gene and protein in salivary duct carcinomas of parotid gland as revealed by fluoresence in situ hybridisation immunohistochemisty. Histopathol., roč. 42, 2003, č. 4, s. 348-356.
31. Skálová, A., Vaněček, T., Šíma, R. et al.: Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Amer. J. Surg. Pathol., roč. 34, 2010, č. 5, s. 599-608.
32. Sorensen, K. B., Godballe, C., de Stricker, K. et al: Parotid carcinoma: expression of kit protein and epidermal growth factor receptor. J. Oral Pathol. Med., roč. 35, 2006, s. 286-291.
33. Stanula, M., Weite, K., Hadam, M. R. et al.: Coexpression of stem cell factor and its receptor c-Kit in human malignant glioma cell lines. Acta Neuropathol., roč. 89, 1995, č. 2, s. 158-165.
34. Tsutsui, S., Yasuda, K., Suzuji, K. et al.: A loss of c-kit expressions is associated with an advanced stage and poor prognosis in breast cancer. Br. J. Cancer, roč. 94, 2006, s. 1874-1878.
35. Tsuura, Y., Hiraki, H., Watanabe, K. et al.: Preferential localization of c-kit product in tissue mast cells, basal cells of skin, epithelial cells of breast, small cell lung carcinoma and seminoma/dysgerminoma in human: immunohistochemical study on formalin-fixed, paraffin embedded tissues. Virchows Arch., roč. 424, 1994, č. 2, s. 35-41.
36. Ulivi, P., Zoli, W., Medri, L. et al.: C-kit and SCF expression in normal and tumor breast tissue. Breast Cancer Res. Treat., roč. 83, 2004, č. 1, s. 33-42.
37. Van Oosterom, A. T., Judein, I., Verweij, J. et al.: Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet, roč. 358, 2001, s. 1421-1423.
38. Vila, L., Liu, H., Al-Quran, S. Z. et al.: Identification of c-kit gene mutations in primary adenoid cystic carcinoma of the salivary gland. Mod. Pathol., roč. 22, 2009, č. 10, s. 1296-1302.
39. Vitali, R., Cesi, V., Nicotra, M. R. et al.: C-Kit is preferentially expressed in MYCN-amplified neuroblastoma and its effect on cell proliferation is inhibited in vitro by STI-571. Int. J. Cancer, roč. 106, 2003, č. 2, s. 147-152.
40. Went, P. T., Dirnhofer, S., Bundi, M. et al.: Prevalence of KIT expression in human tumors. J. Clin. Oncol., roč. 22, 2004, s. 4514-4522.
41. Zsebo, K. M., Williams, D. A., Geissler, E. N. et al.: Stem cell factor is encoded at the Sl locus of the mouse and is the ligand for the c-kit tyrosine kinase receptor. Cell, roč. 63, 1990, č. 1, s. 213-224.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2010 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Isoprinosine nově bez indikačních a preskripčních omezení
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
- Suché sliznice a chrapot pod kontrolou: Co může lékař nabídnout pacientům?
-
Všechny články tohoto čísla
- Srovnání výsledků chirurgické a nechirurgické léčby nádorů hrtanu
- Záchovný protokol u nádorů orofaryngu
- Pepsin a slabě kyselý extraezofageální reflux
- Imunohistochemická exprese C-kit onkoproteinu u karcinomů slinných žláz (Pilotní studie)
- Šetrná dekongestiva a šetrné podání dekongestiv
- Vestibulárne evokované myogénne potenciály (VEMP) v diagnostike vestibulopatií
- Česká verze dotazníku kvality života pro pacienty s chronickou rinosinusitidou SNOT-22 (Sino-nasal outcome test)
- Psychologický pohled na plastiku boltců
- Základy radiofrekvenční elektrochirurgie
-
Půl života v Československu a půl ve Švýcarsku
K 80. narozeninám prof. MUDr. Karla Vrtičky, CSc. -
11. mezinárodní konference o kochleárních implantátech a ostatních implantabilních sluchových technologiích
(Švédsko, Stockholm, 30. června – 3. července 2010)
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Šetrná dekongestiva a šetrné podání dekongestiv
- Pepsin a slabě kyselý extraezofageální reflux
- Česká verze dotazníku kvality života pro pacienty s chronickou rinosinusitidou SNOT-22 (Sino-nasal outcome test)
- Vestibulárne evokované myogénne potenciály (VEMP) v diagnostike vestibulopatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



