-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití interim 18F-FDG PET/CT pro prognostickou stratifikaci pacientů s primárním mediastinálním velkobuněčným B-lymfomem
Application of 18F-FDG PET/CT in prognostic stratification of patients with primary mediastinal diffuse large B-cell lymphoma
Introduction:
Primary mediastinal diffuse large B-cell lymphoma (PMBCL) is characterized by rapid growth of a large tumor mass in anterior mediastinum. In this era of immunochemotherapy, the five-year survival rate is presently 80–90 %. Nevertheless, early relapse occurs in a selection of patients with an unfavorable prognosis. Positron emission tomography combined with computed tomography (PET/CT) using 18F-fluordeoxyglucose is widely used for staging and treatment monitoring. The Deauville score and percentage decrease in SUVmax is used as an addition to visual analysis.Subjects and methods:
Retrospective analysis was performed on 44 patients with PMBCL, who underwent staging PET/CT (26 patients) and PET/CT after 2–3 cycles of chemotherapy (36 patients). Visual analysis and the Deauville score were used. Maximum SUV value (SUVmax) was measured on the most intense uptake, and the percentage SUVmax changes over time between staging PET/CT and interim PET/CT were calculated.Results:
The Deauville score categorized to 2 groups (Deauville 1–3 and Deauville 4–5) was a statistically significant predictor of Progression Free Survival (PFS), with p = 0.028. An optimal ΔSUVmax cut-off value of 68 % was determined through ROC analysis. A significant decrease in metabolic activity of tumor tissue was associated with a significantly higher estimated PFS using both our cut-off value and the cut-off value reported in literature (66 %), with p = 0.014 in both cases.Conclusions:
The Deauville 5-point scale is a better prognostic factor compared to dichotomic visual analysis. ΔSUVmax is another strong prognostic factor for PFS prediction.Key Words:
primary mediastinal diffuse large B-cell lymphoma, FDG, Deauville score, prognosis
Autoři: Lenka Henzlová 1; Pavel Koranda 1; Vít Procházka 2; Tomáš Papajík 2; Jana Zapletalová 3
Působiště autorů: Klinika nukleární medicíny 1; Hemato-onkologická klinika 2; Ústav lékařské biofyziky, LF Univerzity Palackého v Olomouci a FN Olomouc, ČR 3
Vyšlo v časopise: NuklMed 2017;6:22-27
Kategorie: Původní práce
Souhrn
Úvod:
Pro primární mediastinální velkobuněčný B-lymfom (PMBCL) je typický rychlý nárůst velké nádorové masy v předním mediastinu. V době imunochemoterapie je 5leté celkové přežití 80–90 %, přesto u části pacientů dochází již v prvním roce po ukončení terapie k relapsu, jehož prognóza je špatná. Pro stážování a monitorování léčby je široce využívána pozitronová emisní tomografie kombinovaná s výpočetní tomografií (PET/CT) s využitím 18F-fluorodeoxyglukózy. Při hodnocení vyšetření se vedle vizuálního posouzení používá také Deauvilleské skórování a hodnocení procentuálního poklesu SUVmax.Soubor a metodika:
Retrospektivně bylo hodnoceno 44 pacientů s diagnózou PMBCL, u kterých bylo provedeno PET/CT před léčbou (26 pacientů) a PET/CT po 2–3 cyklech chemoterapie (36 pacientů). Nálezy byly hodnoceny vizuálně a pomocí Deauvilleské škály. Změřeny byly hodnoty SUVmax na vstupním a interim vyšetření a vypočten jejich procentuální rozdíl – ΔSUVmax.Výsledky:
Signifikantním prediktorem doby přežívání bez progrese (progression free survival – PFS) bylo Deauvilleské skóre (p = 0,028). Pomocí ROC analýzy byla zjištěna optimální hodnota cut-off ΔSUVmax 68 %. Významný pokles metabolické aktivity nádorové tkáně s použitím této hodnoty i hodnoty uváděné v literatuře (ΔSUVmax 66 %) byl spojen se signifikantně vyšší předpokládanou dobou PFS ve srovnání se skupinou s ΔSUVmax ≤ 68 %, resp. ΔSUVmax ≤ 66 % (9 let vs. 3,5 roku pro cut-off 66 % a 8,96 let vs. 3,49 let pro cut-off 68 %, v obou případech p = 0,014).Závěr:
Hodnocení pomocí Deauvilleské škály má lepší prognostickou hodnotu k určení PFS než vizuální dichotomické hodnocení. Podobně silným prediktorem PFS je i hodnocení interim PET/CT pomocí ΔSUVmax.Klíčová slova:
primární mediastinální velkobuněčný B-lymfom, FDG, Deauvilleské skórování, prognózaÚvod
Primární mediastinální velkobuněčný B-lymfom (PMBCL) je samostatnou klinicko-patologickou jednotkou ve WHO klasifikaci nádorů lymfatické tkáně. 1 Jeho výskyt je častější v mladším věku než je tomu u difuzního velkobuněčného B-lymfomu (DLBCL), maximum výskytu je ve 3. až 4. dekádě a častěji jsou postiženy ženy (poměr žen k mužům je cca 2 : 1). Nádor vychází z populace B-lymfocytů v thymu a je tvořen velkými centrocyty a středně velkými centroblasty s širokou světlou cytoplasmou, některé buňky jsou vícejaderné a podobají se diagnostickým buňkám Hodgkinova lymfomu (HL).
Pro PMBCL je typický rychlý nárůst velké nádorové masy v předním mediastinu, která se často manifestuje lokální invazí nebo útlakovými symptomy. Díky tomu je většina nemocných diagnostikována ve stádiu I a II dle Ann Arborského systému, generalizace onemocnění je spíše výjimečná. Pro stanovení diagnózy je klíčové histologické vyšetření včetně vyšetření imunohistochemického, kdy vzorek tkáně je zpravidla získáván pomocí mediastinoskopie či torakoskopie.
V terapii PMBCL se v dnešní době standardně používá kombinace rituximabu a chemoterapie založené na antracyklinu (R-CHOP a podobné režimy). U vysoce rizikových pacientů lze zvýšit úspěšnost léčby intenzifikovanými režimy či konsolidací pomocí zevního ozáření nebo vysoce dávkované léčby s autologní transplantací kmenových buněk. Díky vysoké chemosenzitivitě onemocnění i mladšímu věku pacientů při prezentaci choroby je podle dostupných prací 5leté celkové přežívání až 80–90 %. 2,3 U části nemocných však dochází k časným relapsům onemocnění, které se manifestují někdy i v neobvyklých lokalizacích, jako jsou játra, ledviny či CNS 4 a objevují se již v prvním roce po ukončení terapie. Tito nemocní mají špatnou prognózu. 5 Z tohoto důvodu je důležitá jejich časná identifikace s možností intenzifikace jejich léčby.
Klasické prognostické parametry ve vztahu k dosažení kompletní remise a dlouhodobému přežití bez návratu choroby u PMBCL selhávají. Díky manifestaci v mladším věku a omezení choroby na mediastinum má totiž většina pacientů nízké skóre Mezinárodního prognostického indexu (IPI). 2,6 Silný prognostický význam má využití pozitronové emisní tomografie kombinované s výpočetní tomografií (PET/CT) s využitím 18F-fluorodeoxyglukózy (18F-FDG) a to jak před započetím léčby 7, tak v době léčby (interim PET) a po jejím ukončení. 2,8,9
Vizuální dichotomické hodnocení (pozitivní/negativní nález) nepostihuje svou jednoduchostí léčebnou odpověď jako víceméně kontinuální proces. 10,11 Deauvilleská 5bodová škála, která byla původně navržena pro hodnocení interim PET u Hodgkinova lymfomu (HL) 12, našla své široké uplatnění v hodnocení léčebné odpovědi v průběhu léčby i po jejím ukončení u dalších typů lymfomů včetně PMBCL.
Zvláště u agresivních typů lymfomů, které vykazují vysokou 18F-FDG aviditu, je silným prediktivním faktorem také hodnocení léčebné odpovědi pomocí procentuálního poklesu maximální hodnoty „standardized uptake value“ (SUVmax) – ΔSUVmax. 13 Tento způsob hodnocení vykazuje vysokou reprodukovatelnost mezi různými hodnotiteli a může snižovat podíl falešně pozitivních výsledků. 14 Nevýhodou hodnocení pomocí ΔSUVmax je nutnost přesně dodržet standardní akviziční protokol u všech prováděných vyšetření a správná kalibrace přístroje.
Cílem této práce bylo zhodnotit prognostický význam interim PET/CT hodnocení pomocí Deauvilleské škály a ΔSUVmax a stanovit optimální hodnotu cut-off ΔSUVmax pro náš soubor.
Soubor a metodika
Retrospektivně bylo hodnoceno 44 pacientů (28 žen, 16 mužů, průměrný věk 33,7 (19–73) let, medián věku 34,0 let), kterým byl PMBCL diagnostikován v letech 2006–2016. Podle Ann Arbor klasifikace byli 2 pacienti stadia I, 27 pacientů stadia II, 3 pacienti stadia III a 12 pacientů stadia IV. Nemocní byli léčeni antracyklinovými režimy s obsahem rituximabu: nejčastěji sekvenční imunochemoterapií (n = 38), menšina pacientů režimem R-CHOP (3 pacienti), intenzifikovaným R-Mega-CHOP/ESHAP (1 pacient) či režimem R-PACEBO (2 pacienti) dle rozhodnutí hematoonkologického pracoviště. 14 U 27 (61,4 %) nemocných byla remise konsolidována pomocí autologní transplantace krvetvorných buněk (ASCT) po přípravném režimu BEAM. Deset nemocných (22,7 %) bylo z důvodu suboptimální odpovědi na chemoterapii ozářeno technikou „involved field“.
U pacientů bylo provedeno vstupní PET/CT vyšetření před zahájením terapie (26 pacientů) a interim PET/CT po 2–3 cyklech léčby (36 pacientů). U části pacientů nebylo možné vstupní PET/CT provést vzhledem k nutnosti rychle zahájit protinádorovou terapii. Vyšetření indikovaná do září 2015 byla provedena na přístroji Siemens Biograph 16 HI-REZ, od října 2015 na přístroji Siemens Biograph mCT-40. Oba přístroje splňují akreditaci EARL. 15 Před vyšetřením byla stanovena hladina krevní glukózy, která u žádného nemocného nepřekračovala 13 mmol/l. Aplikováno bylo 400 MBq 18F-FDG/70 kg hmotnosti pacienta na starším přístroji a 190 MBq 18F-FDG/70 kg hmotnosti pacienta na novějším přístroji, v obou případech s přepočtem na aktuální hmotnost. Akvizice vyšetření byla zahájena 60 min. po aplikaci 18F-FDG, obvykle s aplikací i.v. a p.o. kontrastní látky, standardně v rozsahu od baze lební do poloviny stehen. Délka jedné vyšetřovací postele byla nejméně 3 minuty. Data byla korigována na rozptýlené a náhodné koincidence a korekce na zeslabení byla prováděna pomocí CT obrazů.
Vizuální hodnocení studií proběhlo standardně na dedikovaných vyhodnocovacích stanicích Siemens. Zařazení do Deauvilleské škály bylo provedeno částečně vizuálně a částečně srovnáním SUVmax posuzované léze s SUVmax krevního poolu mediastina a SUVmax široké oblasti zájmu (region of interest – ROI) v játrech. Jako skóre 5 byly hodnoceny léze s akumulací vyšší než dvoj - až trojnásobek SUVmax ve zdravém jaterním parenchymu. 16
Hodnota SUVmax byla hodnocena na vstupním PET/CT a interim PET/CT, v obou případech volumetricky v lézi s nejintenzivnější akumulací FDG, a to i v případě, že se lokalita s nejintenzivnější akumulací na vstupním a interim PET/CT lišila. Pokud došlo ke kompletní metabolické odpovědi na léčbu, bylo na interim PET změřeno SUVmax v lokalizaci, kde bylo vstupně přítomno postižení. Z hodnot SUVmax na vstupním a interim PET/CT byla vypočtena procentuální změna hodnoty – ΔSUVmax.
Ke statistické analýze dat byl použit statistický software IBM SPSS Statistics verze 22. ROC analýza byla použita k hledání optimální cut-off hodnoty ΔSUVmax pro predikci relapsu/progrese. Zároveň byla jako cut-off hodnota ΔSUVmax použita i v literatuře uváděná hodnota 66 %. 17 Kaplan-Meierova analýza s Log-rank testem byla použita k hledání významných prediktorů doby přežívání bez progrese (progression free survival – PFS). Testy byly dělány na hladině signifikance 0,05.
Výsledky
V průběhu sledování souboru (medián 4,6 roku, rozsah 0,4–11,4 roku) došlo k relapsu a/nebo progresi lymfomu u 9 nemocných (20,5 %) a 9 (20,5 %) nemocných zemřelo (1 v remisi lymfomu). Interval do progrese v 5 letech (5-y progression free survival, PFS) dosáhl 75,7 % (95% CI 0,63–0,89), celkové přežití v 5 letech (5-y overall survival, OS) pak 79,8 % (95% CI 0,67–0,92). Počty pacientů podle typu odpovědi na interim PET/CT a PET/CT po ukončení léčby hodnocených vizuálně a Deauvilleskou škálou jsou zpracovány v tabulce 1.
Tab. 1. <i>Typ odpovědi na léčbu na interim PET/CT a finálním PET/CT hodnocených vizuálně a podle Deauvilleské škály.</i> 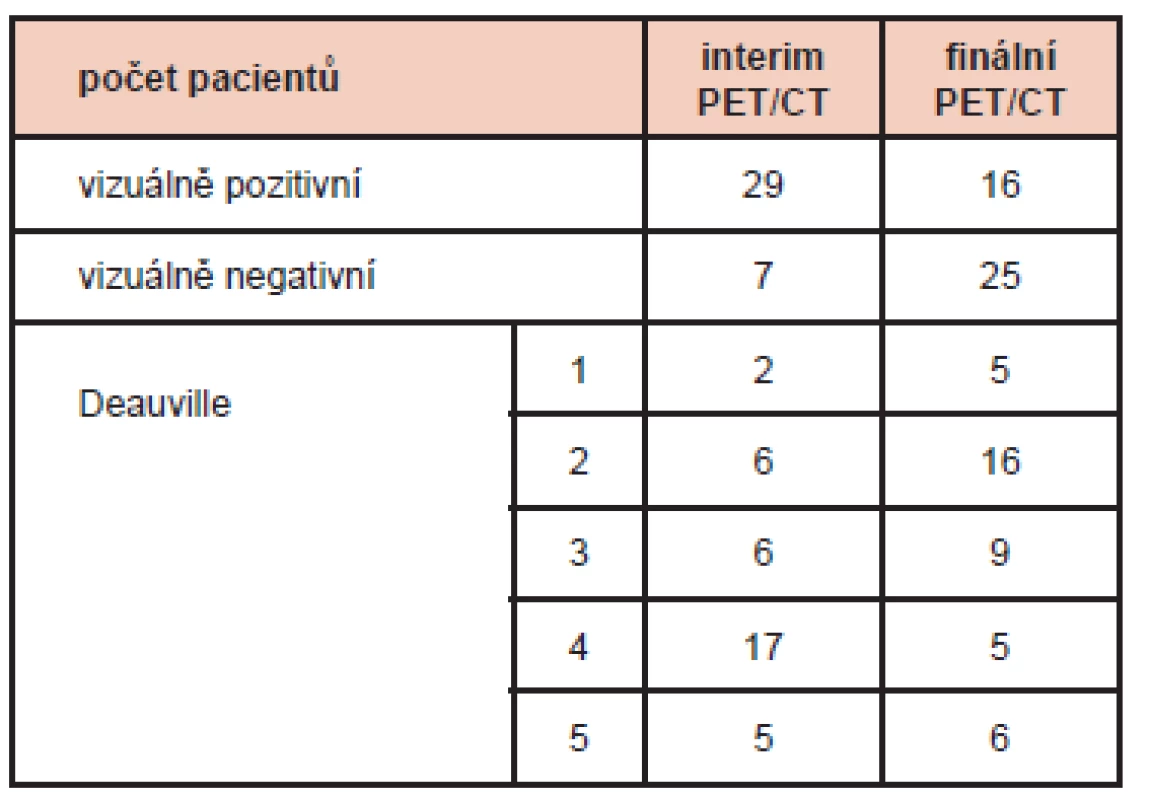
Dichotomické vizuální hodnocení interim PET (jako nález pozitivní/negativní) má jistou výpovědní hodnotu ve vztahu k predikci relapsu/progrese, ne však na hladině statistické významnosti (p = 0,191). Hodnocení pomocí Deauvilleské škály bylo za účelem stratifikace rizika rozděleno do dvou kategorií – Deauville skóre 1–3 a Deauville skóre 4–5. Do první skupiny spadalo 14 pacientů a u žádného z nich nedošlo za dobu sledování k relapsu onemocnění. Do druhé skupiny spadalo 22 pacientů, z nichž u 6 došlo k progresi/relapsu. Rozdíl v PFS mezi těmito dvěma skupinami je statisticky signifikantní s p = 0,028. (Graf 1)
Graf 1. <i>Kaplan-Meierova analýza predikce PFS pomocí Deauvilleské škály.</i> 
Při hodnocení významu ΔSUVmax jsme jako cut-off nejprve použili hodnotu získanou z literatury – 66 %. 17 Významný pokles metabolické aktivity nádorové tkáně (ΔSUVmax > 66 %) byl spojen se signifikantně vyšší předpokládanou dobou do progrese (9 let) ve srovnání se skupinou s ΔSUV max ≤ 66 % (předpokládaná doba do progrese 3,5 roku) (p = 0,014). (Graf 2)
Graf 2. <i>Kaplan-Meierova analýza predikce PFS pomocí ΔSUVmax s cut-off 66 %.</i> 
Následně jsme pomocí ROC analýzy určili hodnotu 68 % jako optimální cut-off pro náš soubor. I s touto hranicí vychází ΔSUVmax jako statisticky významný prediktor relapsu onemocnění s p = 0,014. Skupina nemocných s ΔSUVmax 68 % má střední předpokládanou dobu do progrese 8,96 let a skupina s ΔSUVmax ≤ 68 % 3,49 let. (Graf 3)
Graf 3. <i>Kaplan-Meierova analýza predikce PFS pomocí ΔSUVmax s cut-off 68 %.</i> 
Diskuze
Úloha PET/CT v diagnostice a sledování léčebné odpovědi u FDG avidních lymfomů je v současné době nezpochybnitelná 18, problémem však může být standardizace hodnotících kritérií a reprodukovatelnost výsledků mezi jednotlivými hodnotiteli či centry. 16 IHP kritéria (International Harmonization Project), navržená pro hodnocení PET/CT u lymfomů po ukončení léčby 20, srovnávala akumulaci patologických lézí s krevním poolem mediastina u lézí větších než 2 cm a s jejich okolím u lézí menších než 2 cm. Jemnějším zhodnocením stupňů léčebné odpovědi pomocí Deauvilleských kritérií a srovnáním akumulace patologických lézí nejen s krevním poolem mediastina, ale také s akumulací v játrech se ukázalo, že u většiny typů lymfomů je lepší hranicí pro stratifikaci rizikovosti pacientů akumulace v játrech. Pacienti s Deauville skóre 3, definovaným jako akumulace patologické léze na úrovni mezi krevním poolem mediastina a játry, vykazují podobně dobrou prognózu jako pacienti s Deauville skóre 1 a 2. 19,21 Podobně i v našem souboru pacientů s PMBCL vykazují nemocní se skóre 1–3 dobrou prognózu (viz kazuistiky na Obr. 1 a Obr. 2).
Obr. 1. Kazuistika – 26letá žena s PMBCL. 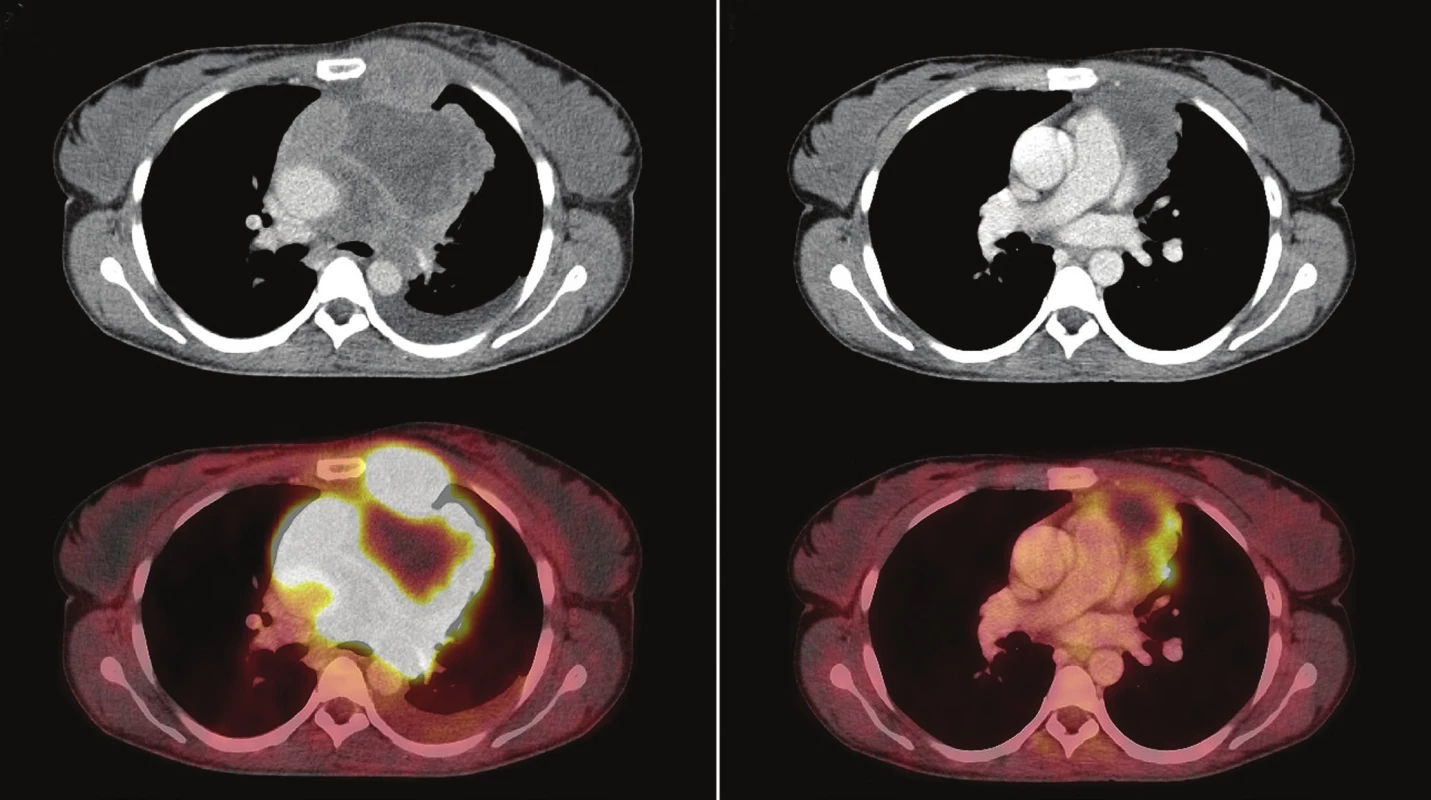
A – vstupní 18 F-FDG PET/CT – rozsáhlá tumorózní masa předního a středního mediastina s infiltrací hrudní stěny a centrálním rozpadem (vel. 103 x 113 x 100 mm, SUVmax 18,1). B – interim 18 F-FDG PET/CT – prognosticky nepříznivý nález, přetrvává akumulace 18 F-FDG v lemu měkkotkáňové masy (vel. 76 x 69 x 112 mm, SUVmax. 6,3), Deauville 4, ΔSUVmax 65 %. Po dokončení imonuchemoterapie parciální remise, následně byla provedena ASCT. Již měsíc po transplantaci (7 měsíců od stanovení diagnózy) časný relaps, chemorezistentní choroba, imunoterapie anti-CD30 i radioterapie na mediastinum vždy jen s přechodným efektem, postupné zhoršování stavu, exitus. Obr. 2. Kazuistika – 28letá žena s PMBCL. 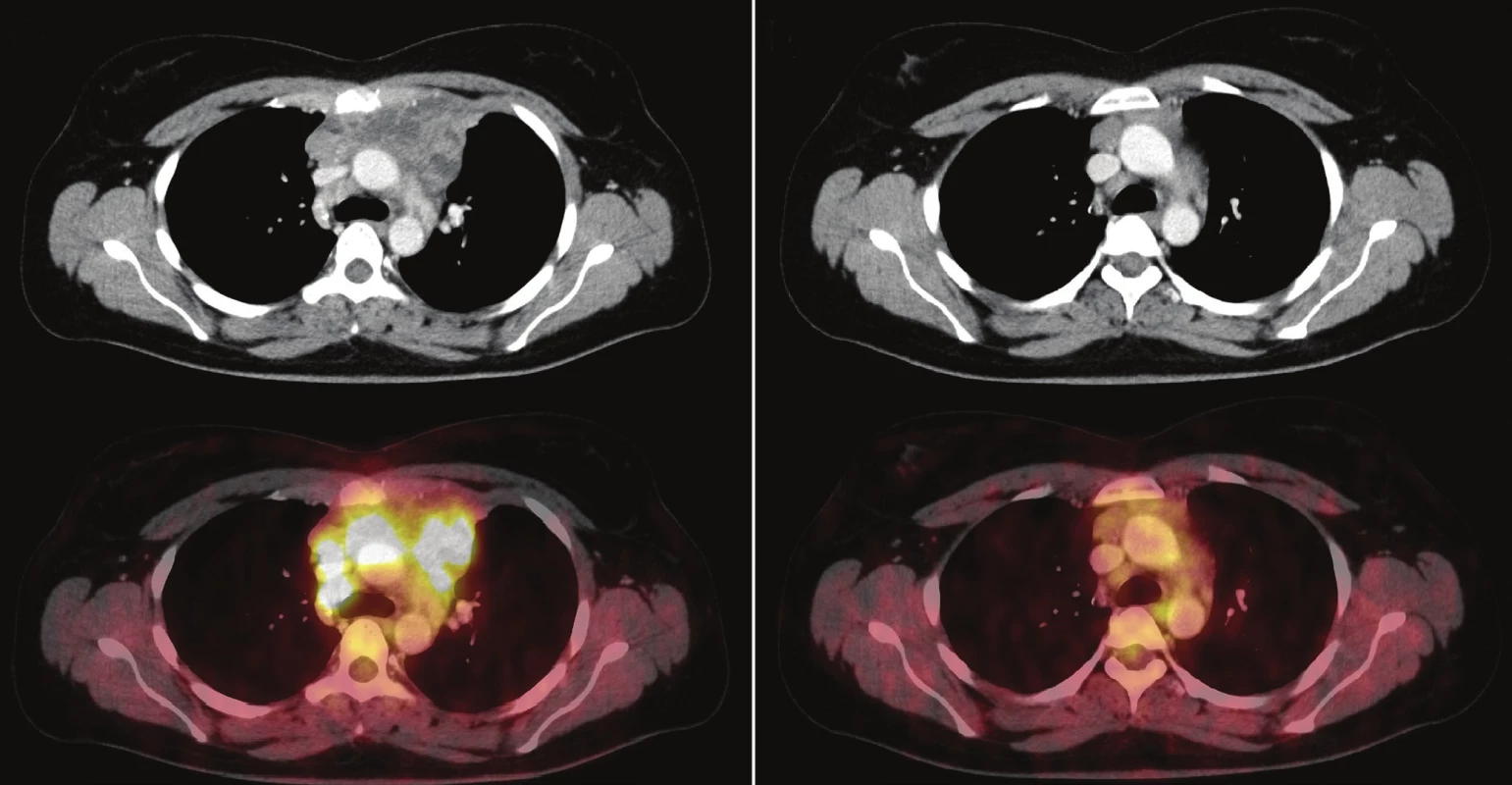
A – vstupní 18F-FDG PET/CT – měkkotkáňová tumorózní masa předního mediastina (vel. 92 x 38 x 38 mm, SUVmax 15,7). B – interim 18F-FDG PET/CT – na CT přetrvává v předním mediastinu měkkotkáňová formace, bez jednoznačně zvýšené akumulace 18F-FDG (vel. 54 x 19 x 18 mm, SUVmax 2,8), Deauville 2, ΔSUVmax 82 %. Po dokončení imunochemoterapie dosaženo kompletní remise. V současnosti (9 let od stanovení diagnózy) remise trvá. Hodnocení stupně Deauville skóre 3 jako kompletní metabolická odpověď (complete metabolic response – CMR) je přístup zvláště důležitý u pacientů léčených chemoterapií s rituximabem. Ten může způsobit zánětlivé změny v nádorových lézích a tím generovat falešně pozitivní výsledky. Jako Deauville skóre 1–3 je CMR definována také v nejnovějších kritériích léčebné odpovědi – Luganské klasifikaci. 18 Autoři připouštějí posun hranice CMR mezi Deauville skóre 2 a 3 ve studiích, zaměřených na deeskalaci léčby na základě PET/CT, kde je potřebná vysoká negativní prediktivní hodnota vyšetření. Pro hodnocení léčebné odpovědi u pacientů léčených imunomodulačními léky zohledňující možnost vzniku tzv. tumor flare nebo pseudoprogrese je nejnověji navržena modifikace Lugano klasifikace – LyRIC klasifikace (The Lymphoma Response to Immunomodulatory Therapy Criteria). 22 PET/CT je ve své podstatě kvantitativní metoda a kvantitativní hodnocení pomocí SUV se tedy nabízí. Nevýhodou je množství faktorů, které měření SUV ovlivňují (hmotnost pacienta, glykemie, časový odstup aplikace radiofarmaka a nahrávání, použití intravenózní kontrastní látky, akviziční parametry, rekonstrukční parametry) a nutnost provedení vstupního PET/CT pokud chceme hodnotit jeho změnu v průběhu léčby nebo po jejím ukončení. Přesto při zachování technických parametrů je procentuální změna SUVmax u konkrétního pacienta v průběhu léčby podle dostupných dat silným prognostickým faktorem přežívání. 17
Optimální hodnoty cut-off ΔSUVmax se z povahy procesu liší pro různé časové intervaly provedení interim PET/CT (po 2 či po 4 cyklech léčby). 23,24 Liší se také pro různé typy lymfomů; zatímco u DLBCL je pro PET/CT po dvou cyklech léčby podle uvedených prací 66 %, u HL je to 71 %. 25 Dá se předpokládat, že odlišnosti budou také u různých léčebných režimů. Vzhledem ke klinicko-patologické příbuznosti PMBCL s DLBCL jsme při statistickém zpracování našeho souboru použili hodnotu získanou z literatury – 66 % 17 a zároveň určili vlastní optimální cut-off jako 68 %. Je zřejmé, že hodnoty se příliš neliší, a proto i statistická významnost obou způsobů hodnocení je podobná (p = 0,014).
Závěr
Při hodnocení interim PET/CT u pacientů s PMBCL má hodnocení pomocí Deauvilleské 5bodové škály lepší prognostickou hodnotu k určení PFS než prosté vizuální dichotomické hodnocení. Podobně silným prediktorem PFS je i hodnocení interim PET/CT pomocí ΔSUVmax, a to jak s cut-off hodnotou 66 %, uváděnou v literatuře pro pacienty s DLBCL, tak s cut-off hodnotou 68 %, vypočtenou pro náš soubor pacientů. Časné zhodnocení chemosenzitivity lymfomu pomocí interim PET/CT již po 2. cyklu chemoterapie představuje šanci na identifikaci nemocných s krajně nepříznivou prognózou. Přesné vyhodnocení výsledku zobrazovacího vyšetření je pro nemocného i ošetřujícího lékaře důležité pro volbu další strategie léčby.
Poděkování:
Tato práce byla podpořena vnitřním grantem IGA_LF_2017_007 Univerzity Palackého v Olomouci.
1Lenka Henzlová
1Pavel Koranda
2Vít Procházka
2Tomáš Papajík
3Jana Zapletalová
1Klinika nukleární medicíny,
2Hemato-onkologická klinika,
3Ústav lékařské biofyziky LF Univerzity Palackého v Olomouci a FN Olomouc,
henzlova.lenka@centrum.cz
Zdroje
1. Gaulard P, Harris NL, Pileri SA et al. Primary mediastinal (thymic) large B-cell lymphoma, in Swerdlow S, Campo E, Harris NL et al (eds):WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC, 2008, 250-253 p
2. Martelli M, Ceriani L, Zucca E et al. (18F)fluorodeoxyglucose positron emission tomography predicts survival after chemoimmunotherapy for primary mediastinal large B-cell lymphoma: results of the International Extranodal Lymphoma Study Group IELSG-26 Study. J Clin Oncol 2014;32 : 1769-1775
3. Jackson MW, Rusthoven CG, Jones BL et al. Improved survival with combined modality therapy in the modern era for primary mediastinal B-cell lymphoma. Am J Hematol 2016;91 : 476-480
4. Johnson PW, Davies AJ. Primary mediastinal B-cell lymphoma. Hematology Am Soc Hematol Educ Program 2008;349-358
5. Kuruvilla J, Pintilie M, Tsang R et al. Salvage chemotherapy and autologous stem cell transplantation are inferior for relapsed or refractory primary mediastinal large B-cell lymphoma compared with diffuse large B-cell lymphoma. Leuk Lymphoma 2008;49 : 1329-1336
6. Abou-Elella AA, Weisenburger DD, Vose JM et al. Primary mediastinal large B-cell lymphoma:a clinicopathologic study of 43 patients from the Nebraska Lymphoma Study Group. J Clin Oncol 1999;17 : 784-790
7. Ceriani L, Martelli M, Zinzani PL et al. Utility of baseline 18FDG-PET/CT functional parameters in defining prognosis of primary mediastinal (thymic) large B-cell lymphoma. Blood 2015;126 : 950-956
8. Nagle SJ, Chong EA, Chekol S et al. The role of FDG-PET imaging as a prognostic marker of outcome in primary mediastinal B-cell lymphoma. Cancer Med 2015;4 : 7-15
9. Procházka V, Henzlová L, Buriánková E et al. Prognostic Impact of Interim and Final PET in Primary Mediastinal Large B-Cell Lymphoma Treated with Intensive Etoposide-Based Therapy. Blood 2014;124 : 1729
10. Cashen AF, Dehdashti F, Luo J et al. (18)FDG PET/CT for early response assessment in diffuse large B-cell lymphoma: Poor predictive value of International Harmonization Project interpretation. J Nucl Med 2011;52 : 386-392
11. Juweid ME, Stroobants S, Hoekstra OS et al. Use of positron emission tomography for response assessment of lymphoma: Consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol 2007;25 : 571-578
12. Barrington SF, Qian W, Somer EJ et al. Concordance between four European centres of PET reporting criteria designed for use in multicentre trials in Hodgkin lymphoma. Eur J Nucl Med Mol Imaging 2010;37 : 1824-1833
13. Itti E, Meignan M, Berriolo-Riedinger A et al. An international confirmatory study of the prognostic value of early PET/CT in diffuse large B-cell lymphoma: comparison between Deauville criteria and ΔSUVmax. Eur J Nucl Med Mol Imaging 2013;40 : 1312–1320
14. Belada D, Trněný M et al. Kooperativní lymfomové skupiny. Diagnostické a léčebné postupy u nemocných s maligními lymfomy - IX. vydání. Hradec Králové: HK Kredit, 2016, 240 p
15. EANM Research Ltd (EARL). New EANM FDG PET/CT accreditation specifications for SUV recovery coefficients. medicíny [online]. 2014. [cit. 2017-02-28]. Dostupné na: http://earl.eanm.org/cms/website.php?id=/en/projects/fdg_pet_ct_accreditation/accreditation_specificaspeci.htm.
16. Barrington SF, Mikhaeel NG, Kostakoglu L et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32 : 3048-3058
17. Lin C, Itti E, Haioun C et al. Early 18F-FDG PET for Prediction of Prognosis in Patients with Diffuse Large B-Cell Lymphoma:SUV-Based Assessment Versus Visual Analysis. J Nucl Med 2007;48 : 1626-1632
18. Cheson BD, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32 : 3059-3068
19. Biggi A, Gallamini A, Chauvie S et al. International validation study for interim PET in ABVD-treated, advanced-stage Hodgkin lymphoma: Interpretation kriteria and concordance rate among reviewers. J Nucl Med 2013;54 : 683-690
20. Juweid ME, Stroobants S, Hoekstra OS et al. Use of positron emission tomography for response assessment of lymphoma: Consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol 2007;25 : 571-578
21. Pregno P, Chiapella A, Bello M et al. Interim 18-FDG-PET/CT failed to predict the outcome in diffuse large B-cell lymphoma patients treated at the diagnosis with rituximab-CHOP. Blood 2012;119 : 2066-2073
22. Cheson BD, Ansell S, Schwartz L et al. Refinement of the Lugano Classification lymphoma response criteria in the era of immunomodulatory therapy. Blood. 2016;128 : 2489-2496
23. Casasnovas RO,MeignanM, Berriolo-Riedinger A et al. SUVmax reduction improves early prognosis value of interim positron emission tomography scans in diffuse large B-cell lymphoma. Blood 2011;118 : 37–43
24. Itti E, Lin C, Dupuis J et al. Prognostic value of interim 18F-FDG PET in patients with diffuse large B-cell lymphoma: SUV-based assessment at 4 cycles of chemotherapy. J Nucl Med 2009;50 : 527–533
25. Rossi C, Kanoun S, Berriolo-Riedinger A et al. Interim 18F-FDG PET SUVmax reduction is superior to visual analysis in predicting outcome early in Hodgkin lymphoma patients. J Nucl Med 2014;55 : 569-573
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2017 Číslo 2- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Intersticiální plicní procesy a jejich fibrotická progrese
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
Nejčtenější v tomto čísle- Jak šel čas – vznik oboru nukleární medicína
- Obraz chordomu sakrální oblasti na třífázové scintigrafii skeletu a při scintigrafickém vyšetření značenými leukocyty
- Využití interim 18F-FDG PET/CT pro prognostickou stratifikaci pacientů s primárním mediastinálním velkobuněčným B-lymfomem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



