-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Polydentátne ligandy pre moderné rádiofarmaka obsahujúce 64Cu - review
Polydentate ligands for modern radiopharmaceuticals containing 64Cu – review
Molecular imaging techniques (PET, SPECT) play a major role in nuclear medicine. 64Cu appears to be the important radionuclide having the potential to find the application in the diagnostic as well as in the therapy. However, 64Cu must be delivered to the living system in the form of radiopharmaceutical with targeted biodistribution and sufficient in vivo stability. Therefore, polydentate ligand forming the complex compound with the copper radionuclide is often the essential part of the whole radiopharmaceutical. This review is devoted to the classification of ligands which can produce chelate with 64Cu.
Key words:
polydentate ligands, 64Cu, modern radiopharmaceuticals, review
Autoři: Roman Staník; Jan Světlík
Působiště autorů: Katedra farmaceutickej analýzy a nukleárnej farmácie, FaF UK v Bratislave, Slovensko
Vyšlo v časopise: NuklMed 2013;2:2-6
Kategorie: Přehledová práce
Souhrn
Molekulárne zobrazovacie techniky (PET, SPECT) zohrávajú dôležitú úlohu v nukleárnej medicíne. 64Cu sa javí ako významný rádionuklid, ktorý má potenciál si nájsť svoje uplatnenie v diagnostike ako aj v terapii. Avšak 64Cu musí byť do živého organizmu dopravená vo forme rádiofarmaka s cielenou biodistribúciou a dostatočnou in vivo stabilitou. Preto je často rozhodujúcou súčasťou celého rádiofarmaka polydentátny ligand, ktorý tvorí komplex s rádionuklidom medi. Tento prehľadový článok je venovaný najmä klasifikácii ligandov, ktoré dokážu tvoriť stabilné cheláty s 64Cu.
Kľúčové slová:
bifunkčné chelátory, polydentátne ligandy, 64Cu, moderné rádiofarmaká, reviewÚvod
Zobrazovacie techniky nukleárnej medicíny (SPECT, PET) spolu s rádiofarmakami umožňujú vizualizáciu, charakterizáciu a meranie biologických procesov v živých organizmoch na molekulárnej a bunkovej úrovni. Tradične používané izotopy ako 18F, 15O, 13N a 11C sa zabudovávajú iba do malých molekúl, ktorých často zdĺhavá rádiosyntéza a krátky efektívny polčas výrazne obmedzujú možnosti ich použitia.
S neustálym rozvojom látok s cielenou biodistribúciou ako sú proteíny, peptidy, špecifické protilátky a nanočastice narastá aj potreba nových rádionuklidov s vhodnými vlastnosťami. Medzi takéto rádionuklidy patrí v súčasnosti 64Cu s nasledujúcou jadrovou charakteristikou: t1/2 = 12,7 h; β+ 18 %, Eβ+ = 653 keV; β- 39 %, E β- = 579 keV; EC 44 %, EEC = 1675 keV 1. Jej produkcia je možná vo vyhovujúcom množstve a kvalite v cyklotrónoch pomocou jadrovej reakcie 64Ni(p,n)64Cu 2.
Rádiofarmaka obsahujúce 64Cu môžeme rozdeliť do dvoch hlavných skupín:
- špecificky navrhnuté priamo značené malé molekuly
- biologické nosiče s cielenou biodistribúciou (peptidy, protilátky) značené cez polydentátne ligandy.
Do prvej skupiny patria napr. 64Cu-PTSM (pyruvalde-hyd-bis-(N4-metyltiosemikarbazón)) (L1) 3 používaný pri meraní krvného prietoku v srdci 4 alebo mozgu 5, 64Cu-ATSM (diacetyl-bis-(N4-metyltiosemikarbazón)) (L2) 6 používaný na zobrazenie hypoxického tkaniva v tumoroch a srdci, a napokon 64Cu-DO2P (1,4,7,10-tetraazacyklododekán-1,7-di(metylfosforečná) kyselina) (L3) ako vhodné diagnostikum pre Dubin-Johnsonov syndróm 7 (Obr. 1).
Obr. 1. PTSM (L1), ATSM (L2) a DO2P (L3) . 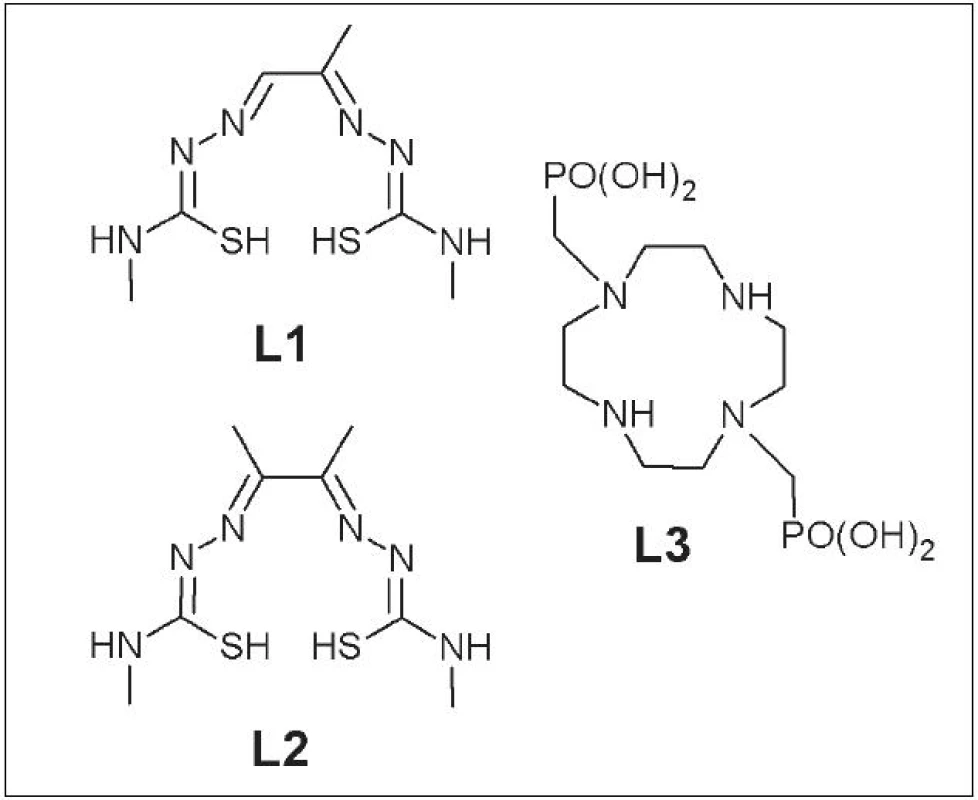
Druhá skupina zahŕňa predovšetkým látky peptidového charakteru, ktoré sa selektívne viažu na dané receptory. Pozornosť sa sústreďuje predovšetkým na receptor pre peptid uvoľňujúci gastrín (GRPR). Pripravených a testovaných už bolo veľké množstvo derivátov bombezínu značených 64Cu. Medzi ďalšie cieľové receptory patrí napríklad integrínový αvβ3 receptor, na ktorý sa viažu proteíny obsahujúce takzvanú RGD sekvenciu, alebo somatostatínový receptor, ktorý obsahuje väzbové miesto pre oktreotidové analógy. Biomolekuly ako bombezín, RGD peptidová sekvencia a oktreotidové analógy sa po naznačení 64Cu stávajú účinnými PET diagnostikami pri rakovine prostaty, neuroendokrinných tumoroch alebo pri sledovaní účinnosti terapie na spomalenie/zastavenie angiogenézy v nádoroch 8.
Cieľom tejto práce je poskytnúť logický prehľad polydentátnych ligandov pre 64Cu (nazývaných aj bifunkčné chelátory), ktoré sú súčasťou moderných rádiofarmák s cielenou biodistribúciou z druhej vyššie menovanej kategórie.
Prehl‘ad polydentátnych ligandov
Meď sa vo všetkých používaných alebo vyvíjaných rádiofarmakách vyskytuje v oxidačnom stupni II. Oproti Tc, Re alebo Y je vhodnejšia na značenie látok peptidového charakteru, pretože nízkou hodnotou reakčného pH sa dá minimalizovať jej nešpecifická väzba na proteín 9. In vivo stabilita komplexu 64Cu–(polydentátny ligand)–biomolekula je kľúčovou vlastnosťou pri vývoji, príprave a klinickom použití takýchto rádiofarmák. Preto je kinetická inertnosť a odolnosť voči transchelatácii a redukcii 64Cu často dôležitejšia ako termodynamická stabilita daného komplexu 10, 11.
Na základe chemickej štruktúry sa dajú polydentátne ligandy používané v nukleárnej medicíne pri príprave rádiofarmák obsahujúcich 64Cu rozdeliť do nasledujúcich skupín:
- acyklické polyaminokarboxylové zlúčeniny
- cyklické polyamíny
- cyklické polyaminokarboxylové zlúčeniny
- premostené cyklické polyaminokarboxylové zlúčeniny
- hexaazamakrobicyklické zlúčeniny
- deriváty triaminocyklohexánu
Acyklické polyaminokarboxylové zlúčeniny
Do tejto skupiny ligandov patria DTPA (L4), EDTA (L5) a ich deriváty (Obr. 2).
Obr. 2. DTPA (L4) a EDTA (L5). 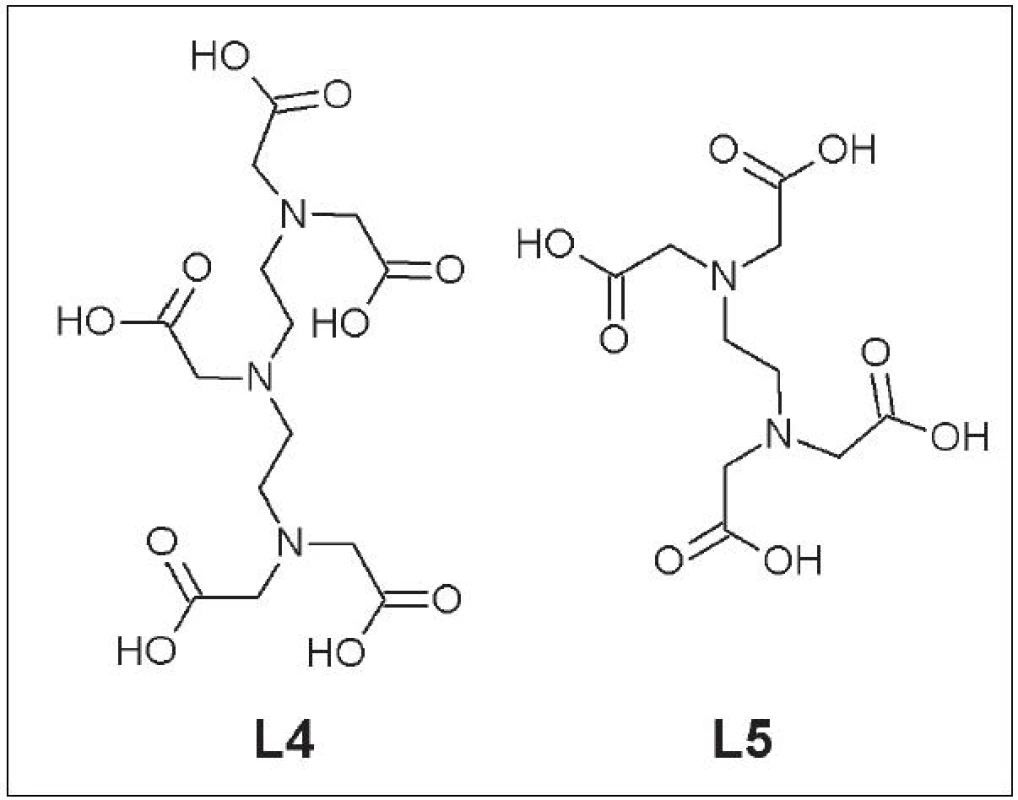
Aj napriek tomu, že DTPA a EDTA tvoria s Cu termodynamicky stabilné komplexy s hodnotami logKcu-DTPA = 21,4 a logKcu-EDTA = 18,7, v ľudskom sére dochádza k rýchlej transchelatácii medi a vzniku Cu-albumín komplexu 12. Snaha o zvýšenie stability komplexov zavedením rigídnych chemických skupín do štruktúry ligandu alebo jeho konjugácia s protilátkou neboli úspešné 13. Preto sa v súčasnosti už dané ligandy pri vývoji nových rádiofarmák nepoužívajú.
Cyklické polyamíny
Cyklén (1,4,7,10-tetraazacyklododekán) (L6) a cyklám (1,4,8,11-tetraazacyklotetradekán) (L7) (Obr. 3) tvoria s Cu za biologických podmienok kineticky veľmi stále komplexy. Pri inkubácii v sére sa po 48 h uvoľní z komplexu iba 0,5 % Cu. Tieto komplexy majú vyššiu akumuláciu v obličkách, ktorá je spôsobená ich kladným nábojom, a v pečeni dochádza k ich zvýšenej disociácii 14
Obr. 3. Cyklén (L6) a cyklám (L7). 
Nevýhodou týchto ligandov je nízka efektivita značenia pri príprave rádiofarmák, ktorá dosahuje iba 33 %. Alternatívny a náročnejší postup značenia, pri ktorom sa najskôr pripravil chelát s meďou a až na záver sa chemicky naviazal na protilátku, viedol k celkovej efektivite značenia iba 52 % 15. Dané nevýhody sa pokúšajú prekonať zástupcovia nasledujúcich skupín ligandov.
Cyklické polyaminokarboxylové zlúčeniny
Táto skupina je odvodená od cyklických polyamínov. Zavedenie karboxymetylovej skupiny umožňuje tvorbu komplexov s vyšším koordinačným číslom. Do danej kategórie ligandov patria DOTA (1,4,7,10-tetraazacyklododekán-1,4,7,10-tetrakarboxylová kyselina) (L8), TETA (1,4,8,11-tetraazacyklotetradekán-1,4,8,11-tetrakarboxylová kyselina) (L9) a NOTA (1,4,7-triazacyklononán-1,4,7-trikarboxylová kyselina) (L10) (Obr. 4).
Obr. 4. DOTA (L8), TETA (L9) a NOTA (L10). 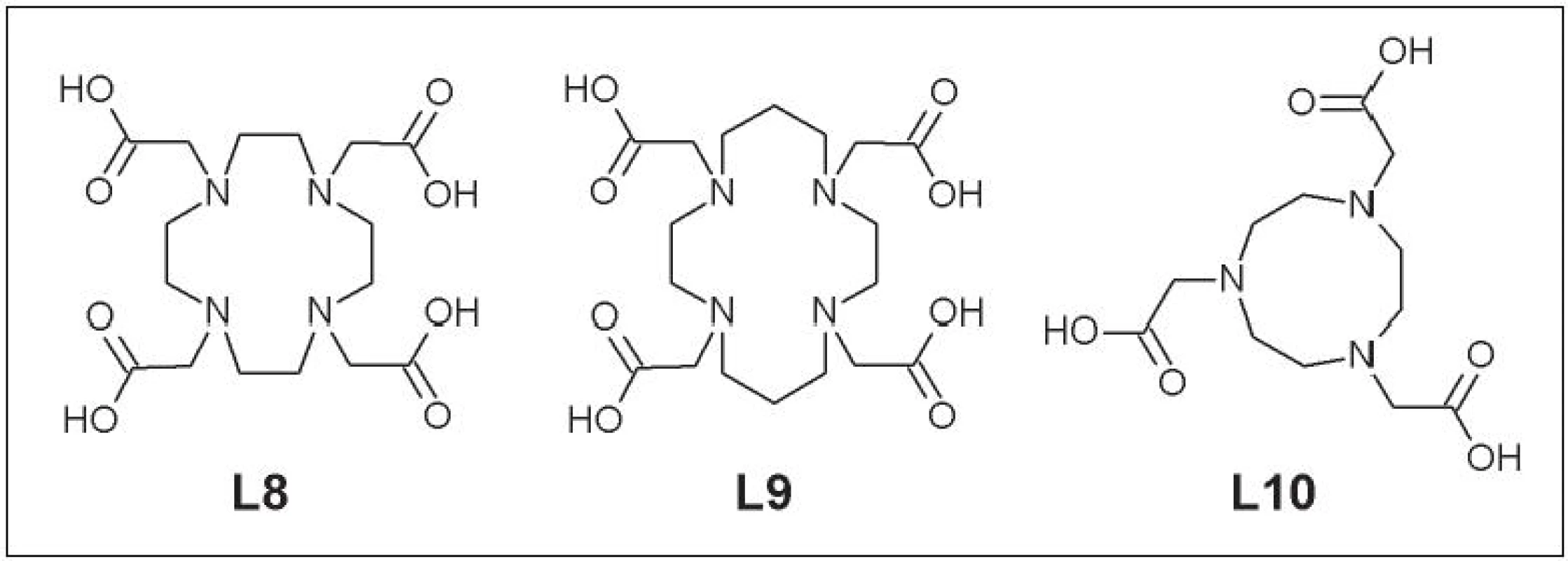
Cyklické polyaminokarboxylové kyseliny majú dobrú efektivitu značenia rádionuklidmi medi a vyššiu in vivo stabilitu v porovnaní s cyklickými polyamínmi. DOTA bola použitá pri značení viacerých monoklonálnych protilátok a biologicky aktívnych molekúl (Cetuximab, Abegrin, RGD peptid – sekvencia Arg-Gly-Asp a ďalšie). Tieto štúdie však preukázali zároveň aj nešpecifickú akumuláciu 64Cu-DOTA-biomolekula v retikuloendotelovom systéme a nižšiu in vivo stabilitu v porovnaní s TETA alebo NOTA 16,-18. Naviac, neselektivita väzby Cu-DOTA zapríčinila, že sa v súčasnosti používa pri príprave rádiofarmák značených meďou už len ojedinele. Hoci 64Cu-TETA komplexy sú stabilnejšie než 64Cu-DOTA komplexy, taktiež bola pozorovaná ich in vivo nestabilita. Po intravenóznej aplikácii 64Cu-TETA-oktreotid dochádza po 20 h až k 70% transchelatácii 64Cu na superoxiddismutázu v pečeni a časť uvoľnej medi sa viaže aj na ceruloplazmín 19. Bifunkčný chelátor NOTA použil Prasanphanich a kolektív pri značení bombezínového analógu. Dané rádiofarmakum malo najnižšiu akumuláciu v pečeni v porovnaní s DOTA a TETA analógmi 20. Aj keď sa NOTA pôvodne používala pri príprave rádiofarmák obsahujúcich 68Ga, dobrá in vivo stabilita 64Cu-NOTA komplexu ju predurčujú na širšie uplatnenie pri značení moderných rádiofarmák.
Premostené cyklické polyaminokarboxylové zlúčeniny
Nedávno sa upriamila pozornosť na skupinu takzvaných premostených cyklických polyaminokarboxylových zlúčenín. Hoci meďnaté komplexy týchto zlúčenín majú konštantu stability (logK) podobnú ako ich nepremostené analógy, miera ich in vivo stability je často o niekoľko poriadkov vyššia 21. Zástupcovia danej skupiny sú CB-DO2A (4,10-bis(karboxymetyl)-1,4,7,10-tetraazabicyklo[5.5.2]tetradekán) (L11) a CB-TE2A (4,11-bis(karboxymetyl)-1,4,8,11-tetraazabicyklo[6.6.2]hexadekán) (L12).(Obr. 5).
Obr. 5. CB-DO2A (L11), CB-TE2A (L12). 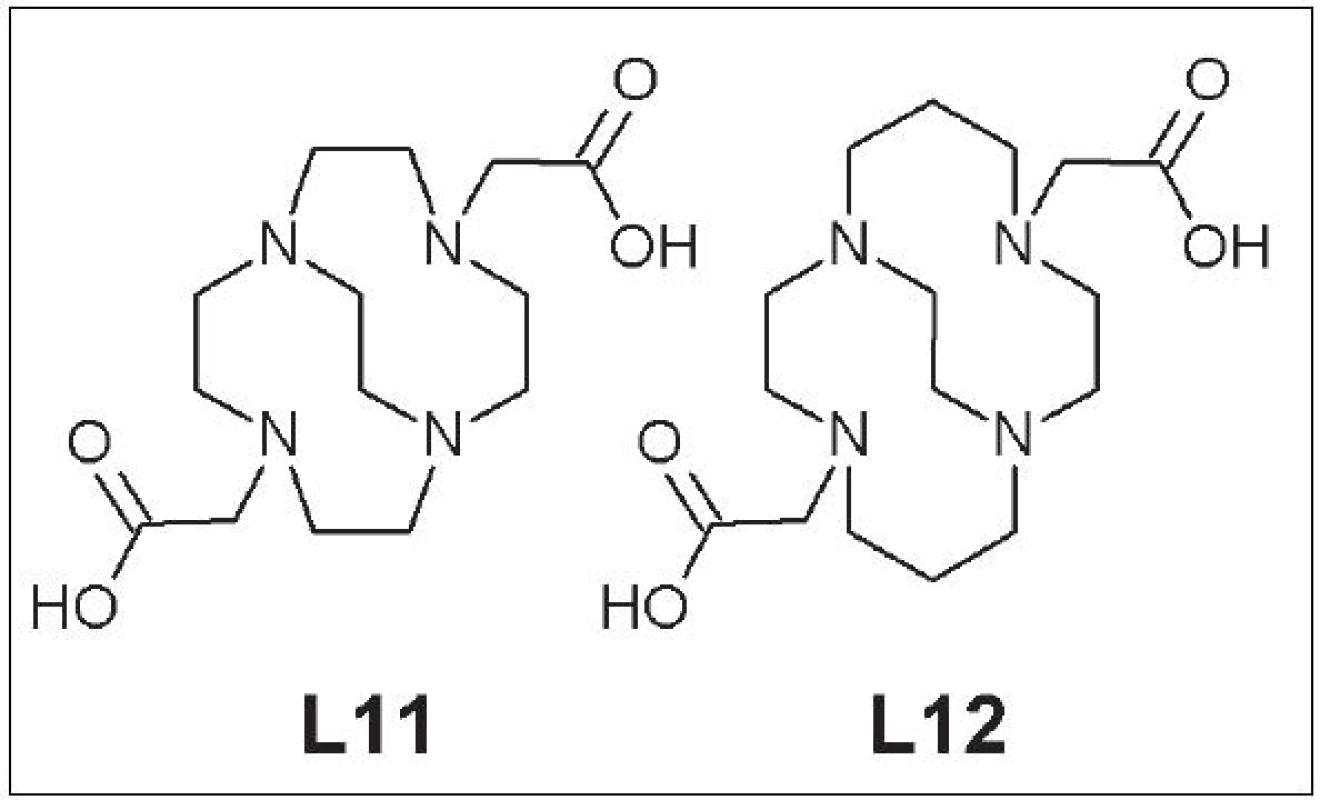
Boswell a kolektív priamo porovnávali biodistribúciu a in vivo stabilitu 64Cu-CB-DO2A a 64Cu-CB-TE2A s ich nepremostenými analógmi. Premostené komplexy mali lepšiu klírens a vyššiu odolnosť voči transchelatácii medi, ktorú sledovali 4 h po aplikácii: CB-DO2A vs. DOTA = 61 % vs. 90 %; CB-TE2A vs. TETA = 13 % vs. 75 %. Po 20 h od aplikácie bola miera transchelatácie 64Cu z 64Cu-CB-TE2A komplexu na proteíny v krvi iba 24 % (v prípade 64Cu-TETA je to 92 %) 22 - 24. Somatostatínový analóg značený 64Cu pomocou CB-TE2A mal vysokú rádiochemickú čistotu, vyššiu afinitu k cieľovému tkanivu a nižšiu akumuláciu v obličkách, pečeni a krvi pri porovnaní s rovnakým somatostatínovým analógom značeným 64Cu pomocou TETA 25, 26.
Nevýhodou CB-TE2A je však zložitý postup značenia a citlivosť na reakčné podmienky 27. Problémy súvisiace so značením vyriešila zámena karboxymetylovej za fosfonylmetylovú skupinu a príprava CB-TE2P (1,8-bis(fosfonylmetyl)-1,4,8,11-tetraazabicyklo[6.6.2]hexa-dekán) (L13), ktorý má 90% výťažnosť značenia s 64Cu, a CB-TE1A1P (1-fosfonylmetyl-8-karboxymetyl-1,4,8,11-tetraazabicyklo[6.6.2]hexa-dekán) (L14), ktorý dosahuje až 100% výťažnosť pri značení 28, 29 (Obr. 6).
Obr. 6. CB-TE2P (L13), CB-TE1A1P (L14). 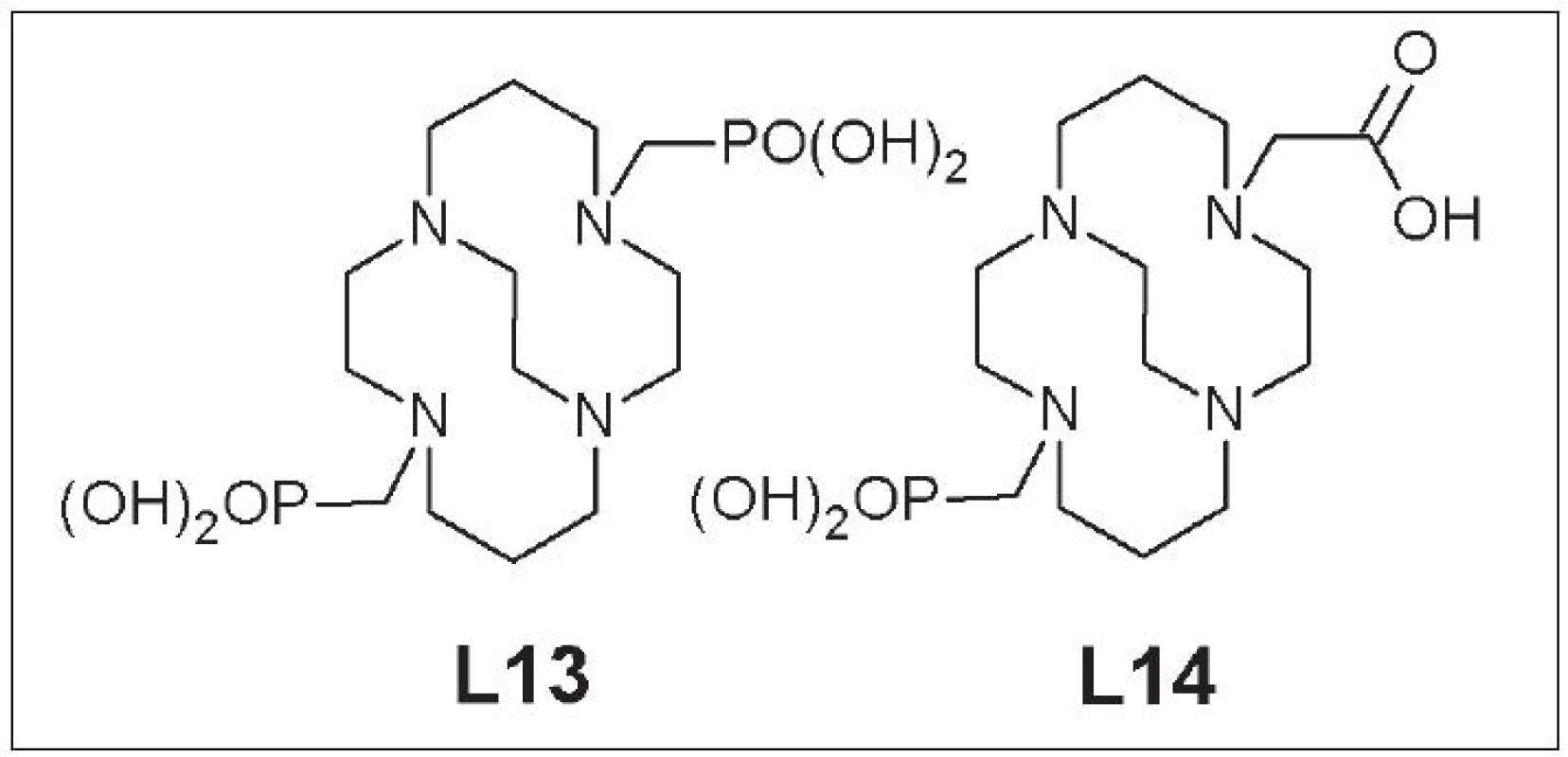
Hexaazamakrobicyklické zlúčeniny
Ďalšou skupinou polydentátnych ligandov sú hexaazamakrobicyklické ligandy typu sarcophogine: Sar (L15), DiamSar (L16), SarAr (L17) (Obr. 7).
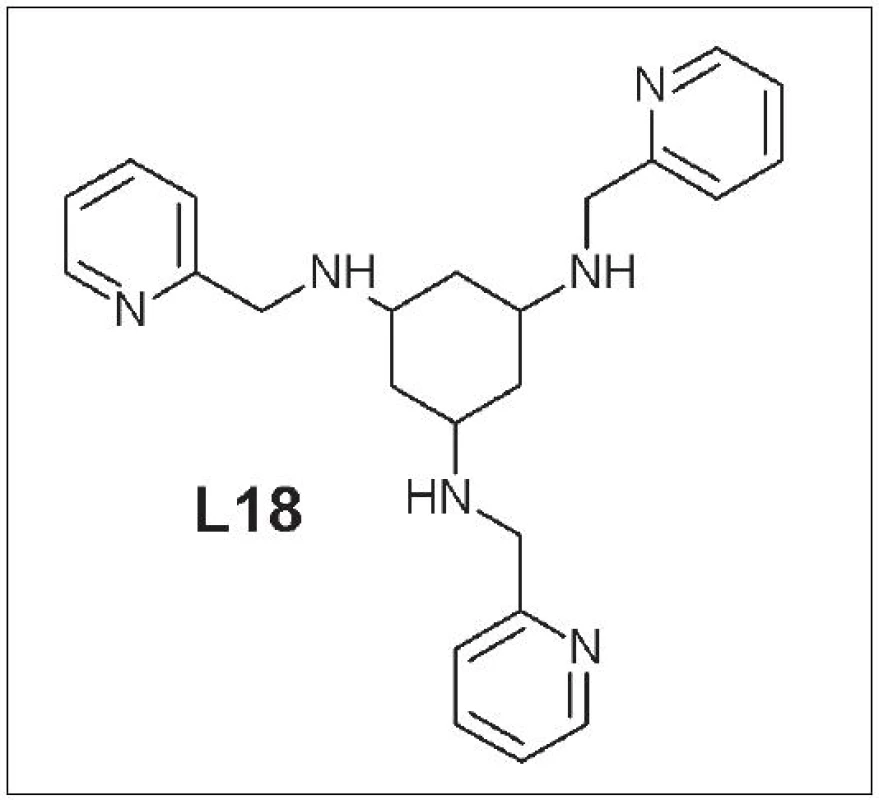
Obr. 7. Sar (L15), DiamSar )(L16), SarAr (L17). 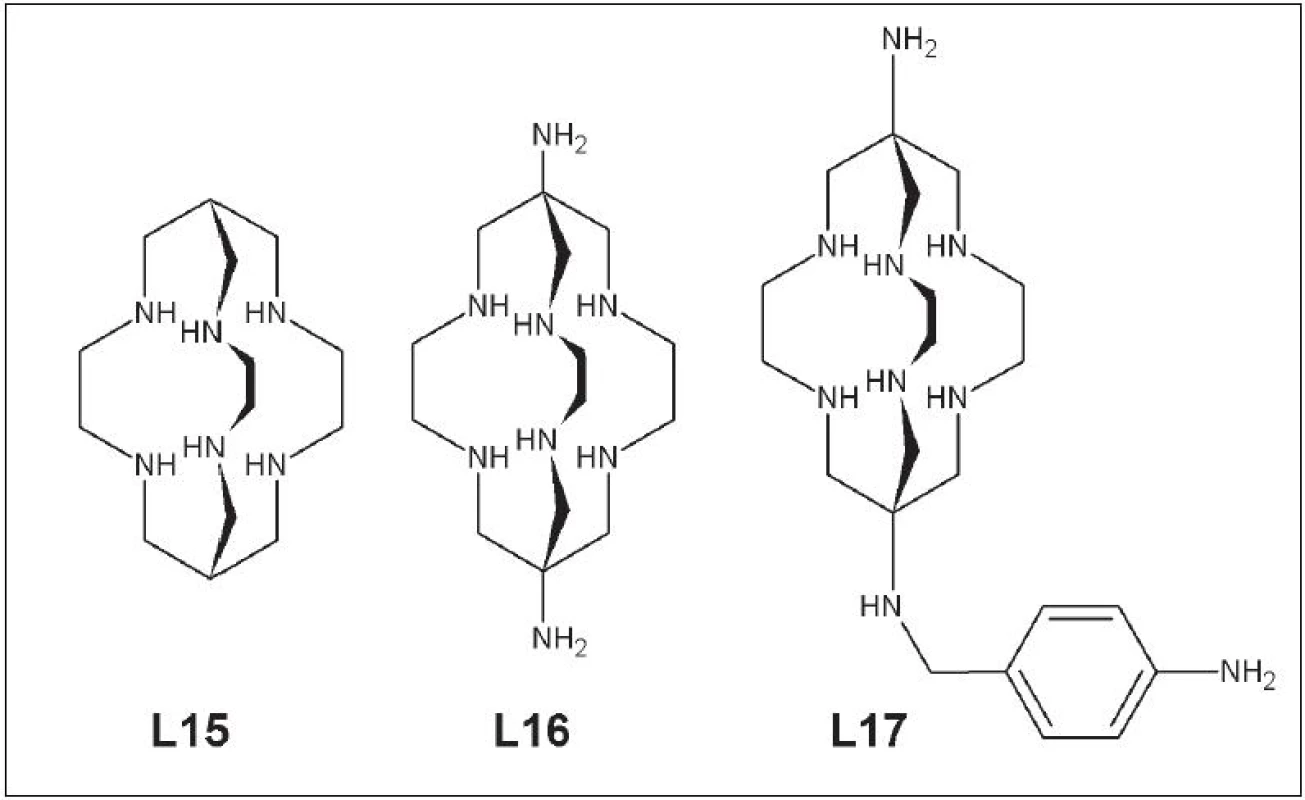
Pri značení dochádza v priebehu niekoľkých minút k 100% naviazaniu medi (64Cu) z roztoku pri 25 °C a v rozsahu pH 4-10. Viaceré práce zaoberajúce sa stabilitou a biodistribúciou komplexov medi so sarcophaginom a jeho derivátmi potvrdili ich stabilitu v ľudskom sére po dobu 7 dní. Dané komplexy mali rýchly klírens z krvi a nízku akumuláciu v orgánoch citlivých na radiačnú záťaž 30 - 32. Hexaazamakrobicyklické ligandy boli použité pri značení protilátok proti karcinómu hrubého čreva a viaceré experimenty na laboratórnych zvieratách potvrdili prednosti týchto ligandov pri vývoji rádiofarmák obsahujúcich meď 33. Širšie uplatnenie sarcophaginu a jeho derivátov pri príprave rádiofarmák s cielenou biodistribúciou si vyžaduje ešte viacero štúdii zameraných na dlhodobé sledovanie in vivo stability, biodistribúcie a vylučovania.
Deriváty triaminocyklohexánu
Štruktúra týchto ligandov je založená na 1,3,5-triaminocyklohexáne s naviazanými pyridylovými alebo imidazolovými zvyškami na troch aminoskupinách. Park a kolektív študovali vznik a stabilitu komplexu 64Cu-tachpyr (N,N’,N’’-tris-(2-pyridylmetyl)-1,3,5-cis,cis-triaminocyklohexán) (L18) (Obr. 8). Skúmaný komplex vykazoval stabilitu v ľudskom sére počas 7 dní 34. Ma a kolektív pripravili niekoľko derivátov základnej štruktúry ligandu. V mnohých prípadoch bola 100% výťažnosť reakcie pri ich značení meďou a mali vysokú odolnosť voči transchelatácii s EDTA alebo TETA 35. Stále však chýbajú údaje o ich biodistribúcii a in vivo stabilite. Snahy použiť deriváty triaminocyklohexánov ako bifunkčné chelátory pri značení peptidov boli zatiaľ neúspešné a sprevádzané viacerými komplikáciami pri samotnej syntéze a následnom značení 36.
Záver
Vývoj rádiofarmák obsahujúcich 64Cu zaznamenal v poslednom desaťročí výrazný pokrok. Kľúčovým faktorom v celom procese sa stáva polydentátny ligand, ktorý musí s 64Cu pri miernych reakčných podmienkach dostatočne rýchlo a dobre reagovať. Naviac vzniknutý komplex musí byť in vivo stabilný a odolný voči transchelatácii a redukcii. Takéto rádiofarmakum musí mať dobrý krvný klírens a vysokú špecifickú akumuláciu v cieľovom tkanive. Zatiaľ sa javia ako najperspektívnejšie ligandy premostené polyaminokarboxylové zlúčeniny ako CB-TE2A poprípade ich fosfonylmetylové analógy: CB-TE2P, CB-TE1A1P. Ďalšími sľubnými kandidátmi sú aj sarcophagin a jeho deriváty, aj keď si ich širšie uplatnenie bude ešte vyžadovať viacero štúdií biodistribúcie a in vivo stability.
Poďakovanie
Táto práca bola podporovaná Agentúrou na podporu výskumu a vývoja na základe zmluvy č. APVV-0204-10 a grantom VEGA MŠVVaŠ č. 1/0664/12.
Roman Staník
Katedra farmaceutickej analýzy a nukleárnej farmácie, FaF UK v Bratislave, Slovensko
stanik@fpharm.uniba.sk
Zdroje
1. Bé MM, Chisté V, Dulieu C et al. Table of Radionuclides (Vol. 1 – A = 1 to 150). France, Bureau International des Poinds et Mesures, 2004, 311 p
2. Qaim SM. Decay data and production yields of some non-standard positron emitters used in PET. Q J Nucl Med Mol Imaging 2008; 52 : 111-120
3. Mathias CJ, Green MA, Morrison WB et al. Evaluation of Cu-PTSM as a tracer of tumor perfusion: comparison with labeled microspheres in spontaneous canine neoplasms. Nucl Med Biol 1994;21 : 83-87
4. Shelton ME, Green MA, Mathias CJ et al. Kinetics of Copper-PTSM in Isolated Hearts: A Novel Tracer for Measuring Blood Flow with Positron Emission Tomography. J Nucl Med 1989;30 : 1843-1847
5. Mathias CJ, Welch MJ, Raichle ME et al. Evaluation of a Potential Generator-Produced PET Tracer for Cerebral Perfusion Imaging: Single-Pass Cerebral Extraction Measurements and Imaging with Radiolabeled Cu-PTSM. J Nucl Med 1990;31 : 351-359
6. Lewis JS, Sharp TL, Laforest R et al. Tumor Uptake of Copper-Diacetyl-Bis(N4-Methylthiosemicarbazone): Effect of Changes in Tissue Oxygenation. J Nucl Med 2001;42 : 655
7. Sun X, Wuest M, Kovacs Z et al. In vivo behavior of copper-64-labeled methanephosphonate tetraaza macrocyclic ligands. J Biol Inorg Chem 2003;8 : 217-225
8. Michelle TM, Donnelly PS. Peptide Targeted Copper-64 Radiopharmaceuticals. Curr Top Med Chem 2011;11 : 500-520
9. Pettit LD, Steel L, Kowalik T et al. Specific binding of tyrosine residue in copper(II) complexes of Tyr-Pro-Gly-Tyr and Tyr-Gly-Pro-Tyr. J Chem Soc Dalton Trans 1985;6 : 1201-1205
10.Meares CF. Chelating agents for the binding of metal ions to antibodies. Nucl Med Biol 1986;13 : 311-318
11.Sun X, Anderson CJ. Production and applications of copper-64 radiopharmaceuticals. Methods Enzymol 2004;386 : 237-261
12.Cole WC, DeNardo SJ, Meares CF et al. Serum stability of 67Cu chelates: comparison with 111In and 57Co. Int J Rad Appl Instrum B 1986;13 : 363–368
13.Cole WC, DeNardo SJ, Meares CF et al. Comparative serum stability of radiochelates for antibody radiopharmaceuticals. J Nucl Med 1987;28 : 83-90
14.Franz J, Freeman GM, Barefield EK et al. Labeling of antibodies with 64Cu using a conjugate containing a macrocyclic amine chelating agent. Int J Rad Appl Instrum B 1987;14 : 479-484
15.Morphy JR, Parker D, Kataky R et al. Towards Tumour Targeting with Cu-Radiolabelled Macrocyc1e-Antibody Conjugates. JCS Chem Commun 1989;5 : 792-794
16.Ping LW, Meyer LA, Capretto DA et al. Receptor-binding, biodistribution, and metabolism studies of (64)Cu-DOTA-Cetuximab, a PET-imaging agent for epidermal growth-factor receptor-positive tumors. Cancer Biother Radiopharm 2008;23 : 158–171
17.Cai W, Wu Y, Chen K et al. In vitro and in vivo characterization of 64Cu-labeled Abegrin, a humanized monoclonal antibody against integrin alpha v beta 3. Cancer Res 2005; 66 : 9673–9681
18.Wu Y, Zhang X, Xiong Z et al. MicroPET imaging of glioma integrin αvβ3 expression using 64Cu-labeled tetrameric RGD peptide. J Nucl Med 2005;46 : 1707–1718
19.Bass LA, Wang M, Welch MJ et al. In vivo transchelation of copper-64 from TETA octreotide to superoxide dismutase in rat liver. Bioconjugate Chem 2000;11 : 527–532
20.Prasanphanich AF, Prasant KN, Tammy LR et al. Cu-NOTA-8-Aoc-BBN(7-14)NH2] targeting vector for positron-emission tomography imaging of gastrin-releasing peptide receptor-expressing tissues. Proc Natl Acad Sci USA 2007;104 : 12462-12467
21.Woodin KS, Heroux KJ, Boswell CA et al. Kinetic inertness and electrochemical behavior of copper(II) tetraazamacrocyclic complexes: possible implications for in vivo stability. Eur J Inorg Chem 2005;2005 : 4829-4833
22.Boswell CA, Sun X, Niu W et al. Comparative in vivo stability of copper-64-labeled cross-bridged and conventional tetraazamacrocyclic complexes. J Med Chem 2004;47 : 1465-1474
23.Sun X, Wuest M, Weisman GR et al. Radiolabeling and in vivo behavior of copper-64-labeled cross-bridged cyclam ligands.J Med Chem 2002;45 : 469-477
24.Jones-Wilson TM, Deal KA, Anderson CJ et al. The in vivo behavior of copper-64-labeled azamacrocyclic compounds. Nucl Med Biol 1998;25 : 523-530
25.Lewis EA, Boyle RW, Archibald SJ. Ultrastable complexes for in vivo use: a bifunctional chelator incorporating a cross-bridged macrocycle. Chemical Commun 2004;19 : 2212-2213
26.Sprague JE, Peng Y, Sun X et al. Preparation and biological evaluation of copper-64-labeled Tyr3-octreotate using a cross-bridged macrocyclic chelator. Clin Cancer Res 2004;10 : 8674-8682
27.Wadas TJ, Anderson CJ. Radiolabeling of TETA - and CB-TE2A-conjugated peptides with copper-64. Nat Prot 2006;1 : 3062-3068
28.Stigers DJ, Ferdani R, Weisman GR et al. A new phosphonate pendant-armed cross-bridged tetraamine chelator accelerates copper(II) binding for radiopharmaceutical applications. Dalton Trans 2011;39 : 1699-1701
29.Ferdani R, Stigers DJ, Fiamengo AL et al. Synthesis, Cu(II) complexation, 64Cu-labeling and biological evaluation of cross-bridged cyclam chelators with phosphonate pendant arms. Dalton Trans 2012;41 : 1938-1950
30.DiBartolo NM, Sargeson AM, Donlevy TM et al. Synthesis of a new cage ligand, SarAr, and its complexation with selected transition metal ions for potential use in radioimaging. J Chem Soc Dalton Trans 2001;15 : 2303-2309
31.Lears KA, Ferdani R, Liang K et al. In vitro and in vivo evaluation of 64Cu-labeled SarAr-bombesin analogs in gastrin-releasing peptide receptor-expressing prostate cancer. J Nucl Med 2011; 52 : 470-477
32.Voss SD, Smith SV, DiBartolo N et al. Positron emission tomography (PET) imaging of neuroblastoma and melanoma with 64Cu-SarAr immunoconjugates. Proc Natl Acad Sci USA 2007; 104 : 1-5
33.Smith SV. Molecular imaging with copper-64. J Inorg Biochem 2004;98 : 1874-1901
34.Park G, Dadachova E, Przyborowska A et al. Synthesis of novel 1,3,5-cis,cis-triaminocyclohexane ligand based Cu(II) complexes as potential radiopharmaceuticals and correlation of structure and serum stability. Polyhedron 2001;20 : 3155-3163
35.Ma D, Lu F, Overstreet T et al. Novel chelating agents for potential clinical applications of copper. Nucl Med Biol 2002;29 : 91-105
36.Brady ED, Chong H-S, Milenic DE et al. Development of a spectroscopic assay for bifunctional ligand-protein conjugates based on copper. Nucl Med Biol 2004;31 : 795-802
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2013 Číslo 1- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Intersticiální plicní procesy a jejich fibrotická progrese
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
Nejčtenější v tomto čísle- Srovnání parametrů kitů pro přípravu 99mTc-radiofarmak pro diagnostiku mozkové perfuze
- Polydentátne ligandy pre moderné rádiofarmaka obsahujúce 64Cu - review
- Dlouhodobá kontrola efektivity biopsie sentinelové uzliny sledováním výsledků komplexní terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání