-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinický přístup k pacientovi s aortální stenózou
Clinical approach to patients with aortic stenosis
Aortic stenosis is the most frequently corrected valve disease affecting 2.5% of persons over 65 years. Aortic stenosis is always progressive, while the rate of progression varies. Aortic valve replacement is indicated in patients with severe symptomatic aortic stenosis or ejection fraction (< 50%). Patients with asymptomatic aortic stenosis who can profit from early surgery are selected by risk stratification. Surgical aortic valve replacement is standard in patients with low and medium risk. TAVI 5-year results are similar to surgery in high risk patients and better than conservative treatment in inoperable patients. The choice of TAVI vs. surgery is a team decision based on the overall risk and anatomical factors of aortic stenosis.
Keywords:
aortic stenosis – calcification – aortic valve replacement – TAVI – exercise test
Autoři: K. Linhartová
Působiště autorů: Kardiochirurgické oddělení, FN Plzeň Kardiologie v sadech, s. r. o., Plzeň
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(4): 322-324
Kategorie: Kardiologická revue
Souhrn
Aortální stenóza je nejčastěji korigovaná chlopenní vada, která postihuje 2,5 % osob nad 65 let. Vada má vždy progresivní charakter, přičemž rychlost progrese je velmi variabilní. Ke korekci je indikována významná symptomatická vada nebo těžká vada s ejekční frakcí levé komory < 50 %, také rizikovou stratifikací asymptomatických pacientů však identifikujeme ty, kteří profitují z korekce vady. Chirurgická náhrada aortální chlopně je standardem u pacientů s nízkým a středním rizikem. Katetrizační implantace aortální chlopně má v současné době pětileté výsledky podobné jako operace u vysoce rizikových pacientů a lepší než konzervativní postup u inoperabilních pacientů. Volba korekce vady je týmovým rozhodnutím na základě zhodnocení operačního rizika i anatomických faktorů vady.
Klíčová slova:
aortální stenóza – kalcifikace – náhrada aortální chlopně – TAVI – zátěžový testÚvod
Aortální stenóza je třetí nejčastější kardiovaskulární (KV) onemocnění a nejčastěji operovaná vada. Postihuje asi 2,5 % populace ve věku nad 65 let, ale až 10 % osob ve věku nad 80 let [1]. Její průběh zatím nedokážeme ovlivnit a základem léčby zůstává korekce v pokročilém stadiu vady [2].
Hlavním diagnostickým nástrojem je echokardiografie, součástí hodnocení aortální stenózy je i posouzení morfologie aorty a posouzení odpovědi levé komory (LK). K upřesnění diagnostiky a zejména při plánování katetrizační implantace aortální chlopně (TAVI) je nezbytná výpočetní tomografie (CT) a nově se uvažuje o prognostickém významu hodnocení stupně fibrózy myokardu LK pomocí magnetické rezonance (MR) [3].
Evropská doporučení pro diagnostiku a léčbu chlopenních vad byla publikována v roce 2012 [4]. Pro klinickou praxi je však velmi názorné rozdělení aortální stenózy podle Doporučení Americké kardiologické společnosti (ACC) z roku 2014 [5]. Chlopenní vady jsou zde rozděleny do čtyř stadií podle predisponujících faktorů, hemodynamické významnosti a symptomů (tab. 1).
Tab. 1. Stadia aortální stenózy. 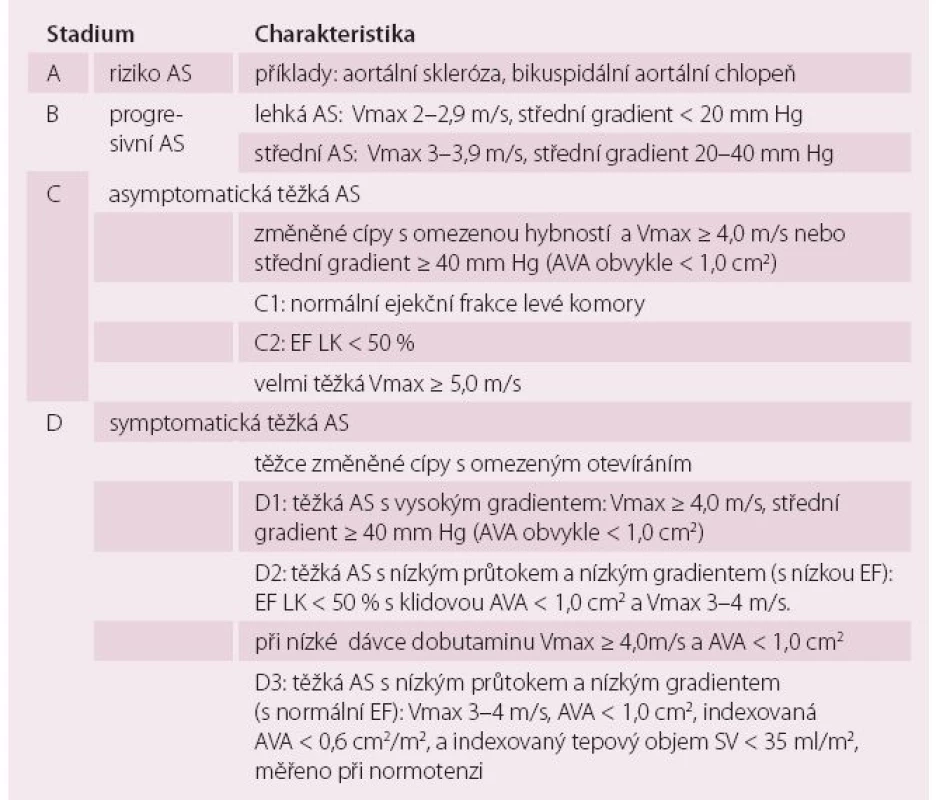
AS – aortální stenóza, EF LK – ejekční frakce LK, AVA – plocha aortálního ústí, SV – srdeční výdej Dle Guidelines ACC 2014 [5]. „Staging“ a léčba aortální stenózy
Stadium A – riziko aortální stenózy. Znamená přítomnost faktorů predisponujících k vzniku aortální stenózy. Je to především dysplastická, bikuspidní aortální chlopeň, která postihuje 0,5–2 % populace. Jen zcela ojediněle zůstane dvojcípá chlopeň celý život intaktní. Prakticky vždy progreduje během života k významné vadě, v 80 % ke stenóze. Při nálezu dysplastické aortální chlopně je indikováno CT nebo MR hrudní aorty, která bývá dilatovaná asi ve 40 %. Koarktace aorty je vzácná, ale pokud se vyskytne, v 90 % bývá spojena právě s bikuspidní chlopní. Je namístě i echokardiografické vyšetření pokrevních příbuzných první linie, kde lze výskyt bikuspidní chlopně očekávat asi ve 20 % [6].
Druhým rizikovým faktorem je skleróza trojcípé aortální chlopně, která je velmi častým nálezem (až ve 25 %) u osob nad 65 let [1]. Není indikací k léčbě ani sledování, skleróza je spíše markerem koronární nemoci a bývá spojena s KV rizikovými faktory. Ke stenóze progreduje jen asi v 10–15 % během pěti let [7].
Stadium B znamená lehkou až střední stenózu. Jakmile postižení chlopně přejde do tohoto stadia, má již vždy progresivní charakter. Průměrná progrese středního gradientu je 7 mm Hg/ rok, individuálně se však výrazně liší a mění se i u jednoho člověka během života. Vada se také může zpočátku vyvíjet jako regurgitace, zatímco později převládne kalcifikace a vývoj ke stenóze. Proto jsou indikovány pravidelné echokardiografické kontroly v přibližně ročních intervalech, blíže ke stadiu těžké vady pak častěji. V tomto stadiu obvykle aortální stenóza nezpůsobuje obtíže. Více než dvě třetiny pacientů mají arteriální hypertenzi [8] a v medikamentózní léčbě je možné využít celé spektrum antihypertenziv, nezbytná je pouze pečlivá titrace dávky. Téměř všichni pacienti mají dyslipidemii, kterou je třeba léčit hypolipidemiky, ačkoli nebylo prokázáno, že by statiny dokázaly zpomalit progresi vady [9].
Stadium C označuje hemodynamicky těžkou, avšak asymptomatickou vadu. Základní charakteristikou je vysoký transaortální gradient. Aortální stenóza je hodnocena jako těžká, i když spočtená plocha ústí může být více než 1 cm2, jak je tomu u kombinované vady. Správné zhodnocení asymptomatičnosti může být problematické: pacient nemusí zaznamenat postupný pokles tolerance a reagovat na něj. Prospektivní i retrospektivní analýzy registrů [10,11] navíc ukázaly, že i v rámci asymptomatické vady je vhodná další riziková stratifikace k identifikaci pacientů, kteří mohou profitovat z operace, zejména při nízkém operačním riziku. Indikace k operaci asymptomatické aortální stenózy shrnuje tab. 2.
Tab. 2. Indikace k operaci těžké asymptomatické aortální stenózy. 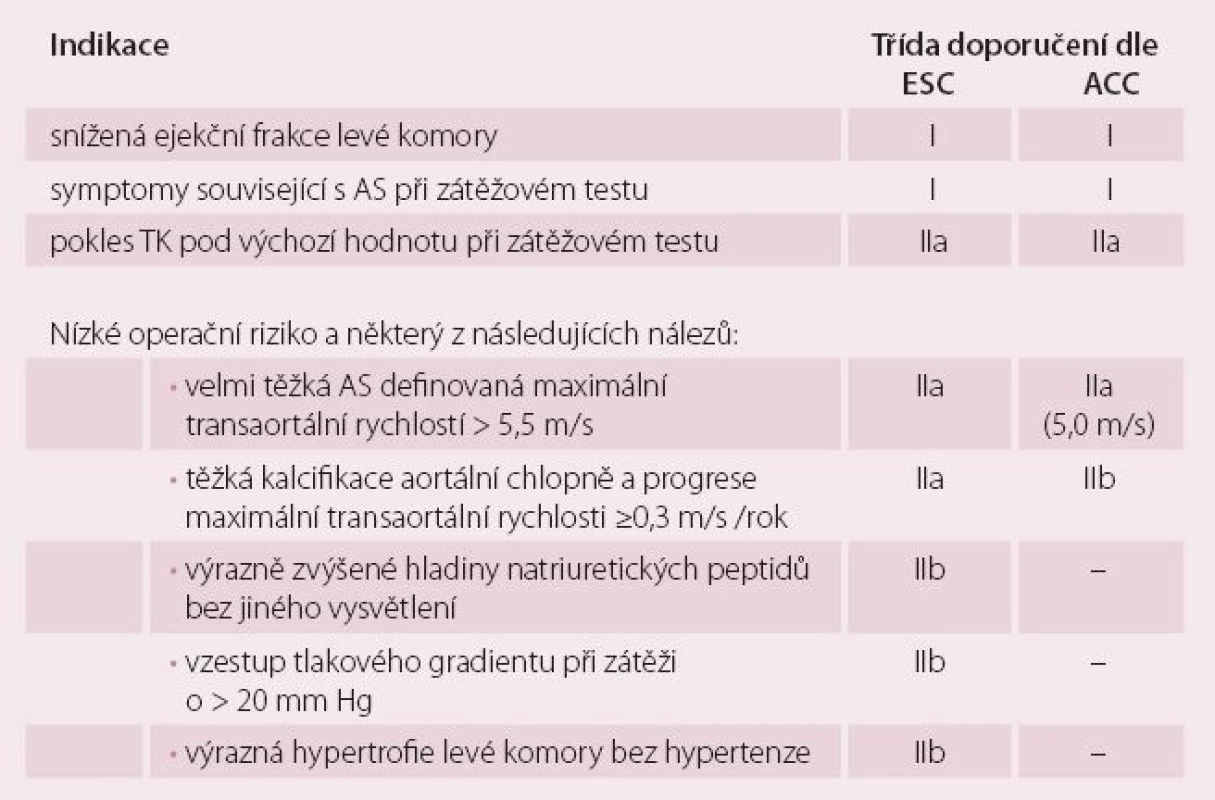
ESC – Evropská kardiologická společnost, ACC – Americká kardiologická společnost, Třída doporučení I = je indikována, IIa = měla by být zvažována, IIb = lze zvažovat [4,5], AS – aortální stenóza Dle Gudelines ESC 2012 a ACC 2014 [4,5]. Stadium D označuje těžkou symptomatickou vadu, kterou dále rozdělujeme na tři skupiny.
Těžká vada s vysokým gradientem (D1) je diagnosticky nejsnadnější a je jasnou indikací ke korekci vady. Snížená ejekční frakce LK není kontraindikací výkonu, neboť vysoký gradient je sám o sobě známkou funkční rezervy a snížená ejekční frakce je obvykle alespoň částečně reverzibilní.
Těžká vada s nízkým gradientem a nízkou ejekční frakcí levé komory (D2) je charakterizována plochou ústí < 1 cm2 . Diagnostickým probémem je odlišení od situace, kdy příčinou omezeného otevírání chlopně nejsou změny na chlopni, ale nízký tepový objem. Přínosná může být echokardiografie nízkou dávkou dobutaminu (do 15 µg/ kg/ min). Vzestup ejekční frakce ukazuje na zachovanou kontraktilní rezervu, vzestup gradientu svědčí pro významnost vady, a posouvá tedy k indikaci korekce vady. Není-li přítomna kontraktilní rezerva, nelze závažnost vady spolehlivě posoudit. Pomoci může posouzení kalcifikací pomocí CT. Tato skupina pacientů je vysoce riziková obvykle polymorbidní s koronární nemocí či nemocí periferních tepen a rozhodování o intervenci je individuální na základě posouzení celkového rizika.
Diagnosticky nejobtížnější je symptomatická těžká aortální stenóza s nízkým gradientem a zachovanou ejekční frakcí nebo s paradoxně nízkým tepovým objemem (D3). Základním hemodynamickým parametrem je nález plochy ústí < 1 cm2, zatímco transaortální gradient by odpovídal střední vadě. Diagnózu významné vady zde činíme per exclusionem, je-li pacient normotenzní a je-li správně změřený gradient. Častým zdrojem omylů může být chybné změření výtokového traktu levé komory (LVOT). Nesprávně nízký rozměr LVOT dosazený do rovnce kontinuity nadhodnocuje tíži vady. LVOT je navíc trojrozměrná struktura, takže lineární měření může být různě nepřesné. K diagnostice může přispět CT k zhodnocení kalcifikace chlopně, která koreluje s tíží vady, a vyšetření hladiny biomarkerů např. NT-pro BNP [12]. Pacienti v tomto stadiu budou rovněž velmi pravděpodobně profitovat z operace.
Volba způsobu korekce vady
O volbě způsobu intervence rozhoduje tzv. Heart Team [4] tvořený klinickým a intervenčním kardiologem, kardiochirurgem a autory zobrazení v echokardiografickém i CT obraze na základě odhadu operačního rizika, přidružených onemocnění, stavu pacienta i integrace faktorů anatomie aortální chlopně, aorty i přístupových tepen.
Klasickým řešením je náhrada aortální chlopně protézou – u osob nad 60 let obvykle biologickou. Přístupem je střední sternotomie, při vhodné anatomii i ministernotomie. Operace je standardem u osob s nízkým a středním operačním rizikem.
TAVI je podle současných platných doporučení Evropské kardiologické společnosti (ESC) indikována pacientům s vysokým operačním rizikem či s kontraindikací operačního řešení vady. Podmínkou je nepřítomnost známých závažných onemocní, které by zkracovaly předpoklad dožití pod jeden rok i při úspěšné TAVI.
Poprvé u člověka byla TAVI provedena v roce 2002 a do roku 2014 bylo na celém světě provedeno kolem 100 000 výkonů. Studie PARTNER B prokázala nejprve významné snížení dvouleté mortality pacientů hodnocených jako inoperabilní léčených TAVI oproti standardní, medikamentozní léčbě (43,3 vs. 68 %) a významný příznivý klinický efekt přetrvává i po pěti letech [13]. Studie PARTNER A nezjistila u osob s vysokým operačním rizikem významné rozdíly v celkové mortalitě při léčbě TAVI oproti operační náhradě aortální chlopně, a to až do pěti let od výkonu (67,8 vs. 62,4 %) [14]. V současné době probíhají srovnání TAVI a náhrady aortální chlopně u osob se středním rizikem. Posun indikace TAVI do méně rizikové a mladší skupiny pacientů by kladl větší důraz na dlouhodobou trvanlivost protézy. Značné rozdíly v počtu implantací i v rámci Evropy ukazují, že významnou roli hrají i ekonomické faktory.
Závěr
V korekci aortání stenózy lze dál předpokládat vývoj celkově k menší invazivitě jak chirurgických, tak katetrizačních výkonů (bez jícnové echokardiografie, bez celkové anestezie, zkracování doby hospitalizace až k úrovni ostatních invazivních výkonů), nárůst podílu TAVI a další vývoj k vyšší bezpečnosti a spolehlivosti biologických protéz obecně. Odhaduje se, že počet provedených TAVI na celém světě se do roku 2025 zčtyřnásobí. Cílem na horizontu nadále zůstává medikamentózní prevence nebo zpomalení progrese aortální stenózy. Určitou nadějí v tomto smyslu je probíhající randomizovaná studie SALTIRE II [15], která testuje vliv bisfosfonátů na progresi kalcifikací v aortální chlopni a jejíž výsledky lze očekávat v roce 2017.
Doručeno do redakce: 23. 9. 2015
Přijato po recenzi: 30. 10. 2015
doc. MU Dr. Kateřina Linhartová, Ph.D., FESC
www.fnplzen.cz
linhartkaterina@seznam.cz
Zdroje
1. Stewart BF, Siscovick D, Lind BK et al. Clinical factors associated with calcific aortic valve disease. Cardiovascular Health Study. J Am Coll Cardiol 1997; 29 : 630–634.
2. Linhartová K. Diagnostika aortální stenózy. Kardiol Rev Int Med 2013; 15 : 141–143.
3. Lee SP, Lee W, Lee JM et al. Assessment of diffuse myocardial fibrosis by using MR imaging in asymptomatic patients with aortic stenosis. Radiology 2015; 274 : 359–369. doi: 10.1148/ radiol.14141120.
4. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33 : 2451–2496. doi: 10.1093/ eurheartj/ ehs109.
5. Nishimura RA, Otto CM, Bonow RO et al. 2014 AHA/ ACC Guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129 : 2440–2492. doi: 10.1161/ CIR.0000000000000029.
6. Michelena HI, Desjardins VA, Avierinos JF et al. Natural history of asymptomatic patients with normally functioning or minimally dysfunctional bicuspid aortic valve in the community. Circulation 2008; 117 : 2776–2784. doi: 10.1161/ CIRCULATIONAHA.107.740878.
7. Rashedi N, Otto CM. Aortic stenosis: Changing disease concepts. J Cardiovasc Ultrasound 2015; 23 : 59–69. doi: 10.4250/ jcu.2015.23.2.59.
8. Linhartová K, Filipovský J, Cerbák R et al. Severe aortic stenosis and its association with hypertension: analysis of clinical and echocardiographic parameters. Blood Press 2007; 16 : 122–128.
9. Rossebø AB, Pedersen TR, Boman K. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med 2008; 359 : 1343–1356. doi: 10.1056/ NEJMoa0804602.
10. Kang DH, Park SJ, Rim JH. Early surgery versus conventional treatment in asymptomatic very severe aortic stenosis. Circulation 2010; 121 : 1502–1509. doi: 10.1161/ CIRCULATIONAHA.109.909903.
11. Rosenhek R, Zilberszac R, Schemper M. Natural history of very severe aortic stenosis. Circulation 2010; 121 : 151–156. doi: 10.1161/ CIRCULATIONAHA.109.894170.
12. Clavel MA, Malouf J, Michelena HI et al. B-type natriuretic peptide clinical activation in aortic stenosis: impact on long-term survival. J Am Coll Cardiol 2014; 63 : 2016–2025. doi: 10.1016/ j.jacc.2014.02.581.
13. Mack MJ, Leon MB, Smith CR et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet 2015; 385 : 2477–2484. doi: 10.1016/ S0140-6736(15)60308-7.
14. Kapadia SR, Leon MB, Makkar Rr et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet 2015; 385 : 2485–2491. doi: 10.1016/ S0140-6736(15)60290-2.
15. Pawade TA, Newby D, Dweck M. Study investigating the effect of drugs used to treat osteoporosis on the progression of calcific aortic stenosis. (SALTIRE II). NCT02132026. Available from: https:/ / clinicaltrials.gov/ ct2/ show/ NCT02132026.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2015 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Myokarditidy a zánětlivé kardiomyopatie
- Obrovskobuněčná myokarditida a sarkoidóza srdce – update 2015
- Perikarditidy
- Infekční endokarditida – diagnostika a doporučené postupy
- Srdeční vrozené vady v dospělosti
- Klinický přístup k pacientovi s aortální stenózou
- Indikace k intervenci a volba nejvhodnějšího postupu u mitrálních regurgitací
-
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus -
Jak léčit dyslipidemii u pacientů s renální insuficiencí
Výběr z doporučení KDIGO s klinickým komentářem - Dávkování antibiotik u pacientů léčených hemoeliminačními metodami
- Vénové vaskulárne choroby – aktuálny naliehavý problém klinickej medicíny
- Diagnóza, klasifikácia a princípy manažmentu cerebrovaskulárnej aterosklerotickej choroby z hľadiska angiológie
- Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
- Co zaznělo na kongresu AHA 2015 v Orlandu
-
European Society of Cardiology Congress
Co může být lepší než NOAC?
Snad jedině NOAC s antidotem... -
European Society of Cardiology Congress
Mají pacienti se srdečním selháním opět naději?
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perikarditidy
- Myokarditidy a zánětlivé kardiomyopatie
- Srdeční vrozené vady v dospělosti
- Infekční endokarditida – diagnostika a doporučené postupy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



