-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
Antithrombotic treatment from the point of view of new guidelines for the management of atrial fibrillation
Atrial fibrillation is associated with significantly greater rates of morbidity and mortality, caused primarily by thromboembolic complications. The prevention of thromboembolic strokes is therefore one of the most important elements of the complex treatment of atrial fibrillation. Different strategies for anticoagulant or antiplatelet therapy in patients with atrial fibrillation are recommended for the prevention of thromboembolic complications according to the presentation of a different number of risk factors. New guidelines optimize antithrombotic treatment according to new risk stratification (CHA2DS2Vasc score) and mentioned the future of alternative antithrombotic treatment using direct thrombin antagonists or factor Xa inhibitors.
Keywords:
antithrombotic treatment – atrial fibrillation – CHA2DS2Vasc score – direct thrombin antagonists – factor Xa inhibitors
Autoři: P. Heinc; O. Moravec; J. Přeček; J. Ondrušková; M. Táborský
Působiště autorů: I. interní klinika FN Olomouc
Vyšlo v časopise: Kardiol Rev Int Med 2011, 13(3): 153-159
Souhrn
Fibrilace síní je spojena se signifikantně vyšší morbiditou i mortalitou, což je především způsobeno tromboembolickými komplikacemi. Proto je prevence tromboembolických cévních mozkových příhod jednou z nejdůležitějších složek komplexní léčby FS. Dle přítomnosti různých rizikových faktorů je u fibrilace síní doporučována v prevenci tromboembolických komplikací rozdílná strategie antikoagulační nebo protidestičkové léčby. Nová doporučení optimalizují tuto léčbu na základě nové stratifikace rizika tromboembolizace dle tzv. CHA2DS2Vasc skóre a zmiňují budoucnost alternativní antikoagulační léčby pomocí přímých inhibitorů trombinu nebo inhibitorů faktoru Xa.
Klíčová slova:
antitrombotická léčba – fibrilace síní – CHA2DS2Vasc skóre – přímý inhibitor trombinu – inhibitory faktoru XaÚvod
Výsledky studií z posledních pěti let přinesly v problematice fibrilace síní (FS) nejvíce zásadnějších poznatků především v oblasti antitrombotické léčby, což vytvořilo největší tlak na tvorbu nových doporučení pro léčbu nemocných s FS. Ve studiích se ukázalo, že nehomogennost rizikových faktorů (RF) pro vznik cévní mozkové příhody (CMP) či tromboembolizmu (TE) je větší, než se předpokládalo, a v důsledku toho došlo ke ztrátě dostatečné prediktivní hodnoty doposud užívané stratifikace rizika CMP a TE, tzv. CHADS2 skóre (tab. 1) [1,2]. Současně s tím studie prokázaly účinnost nových antitrombotik i kombinací více antitrombotik při sníženém riziku krvácení a to vše vedlo k potřebě nových doporučení pro antitrombotickou léčbu nemocných s FS.
Tab. 1. Riziko mozkové příhody u nemocných s FS bez přítomné chlopňové vady a bez antikoagulační léčby dle CHADS indexu. 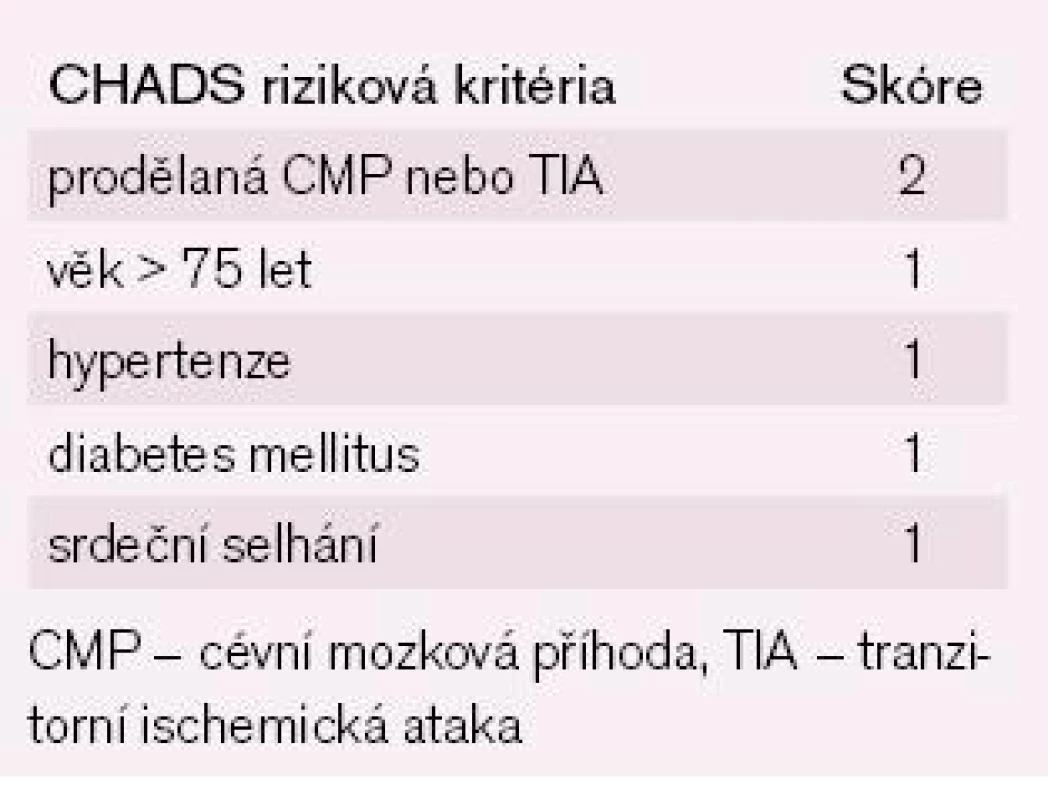
Antikoagulační vs antiagregační léčba
Všechna schémata rizikové stratifikace CMP/TE rozdělují nemocné do tří rizikových skupin – nízce riziková, středně riziková a vysoce riziková skupina. Dle míry rizika byla vesměs doporučována warfarinizace pro vysoce rizikovou skupinu a kyselina acetylosalicylová (ASA) pro nízce rizikovou skupinu [3]. U středně rizikové skupiny se doporučoval warfarin nebo ASA dle poměru rizika krvácení a rizika tromboembolizace. Léčebné přehledy dostupných registrů ukázaly, že relativně velká část nemocných zařazená do skupiny s nízkým rizikem TE medikovala warfarin [4,5]. Sledováním antikoagulační léčby se také ukázalo, že u starších nemocných je tato léčba statisticky významně efektnější v prevenci CMP než ASA, navíc není rozdíl v počtu velkých krvácivých příhod a stejně tomu je i u nemocných s jedním rizikovým faktorem dle CHADS2 skórovacího systému [6–8]. Na druhou stranu studie, která sledovala skupinu léčenou ASA proti skupině bez antitrombotické léčby u nemocných v nízkém riziku TE, ukázala, že ASA nebyla efektnější v prevenci CMP proti kontrolní skupině bez léčby a navíc zde byl trend k vyššímu výskytu krvácivých komplikací [9].
Kombinovaná antitrombotická léčba
Studie ACTIVE A ukázala, že duální antiagregační léčba (ASA + clopidogrel) významně redukuje riziko TE proti ASA samotné (relativní redukce CMP – 28 %), ale tato duální antiagregační léčba vede také k signifikantnímu zvýšení velkých krvácivých komplikací proti ASA samotné (2 % vs 1,3 %) [10].
Studie ACTIVE W ukázala, že u nemocných se středním a vyšším rizikem (CHADS2 skóre ≥ 1) je statisticky významně větší přínos antikoagulační léčby proti duální antiagregaci (ASA + clopidogrel) [11]. Výskyt krvácivých komplikací při této duální antiagregaci byl podobný jako u léčby antikoagulační, nicméně v současné době, kdy jsou k dispozici přímé inhibitory trombinu nebo inhibitory faktoru Xa, nelze tuto duální antiagregaci doporučit ani u nemocných, kteří nejsou vhodní k antikoagulační léčbě warfarinem z jakéhokoli důvodu.
Kombinace antikoagulační léčby s antiagregační léčbou nepřináší další snížení výskytu TE, ale naopak zvyšuje výskyt krvácivých komplikací. Proto v případě, že dojde k TE při účinné antikoagulační léčbě (INR 2,0–3,0), nedoporučuje se přidat antiagregační léčbu, nýbrž zvýšit účinnost antikoagulace (INR 3,0–3,5), jelikož riziko závažného krvácení se zvyšuje až od hodnoty INR > 3,5.
Potenciální význam a relativita sledovaných rizikových faktorů ovlivňujících TE u nemocných s FS – CHA2DS2Vasc skóre
Řada studií sledovala nové rizikové faktory nebo podrobně hodnotila závažnost stávajících klinických a echokardiografických rizikových faktorů pro vznik CMP především z důvodu, aby došlo ke zvýšení oslabené prediktivní hodnoty rizikové stratifikace CMP či TE (CHADS2 skóre – tab. 1) [1,2]. Prodělaná CMP/TIA/TE (TIA – tranzitorní ischemická ataka), věk, hypertenze, diabetes mellitus a známky srdečního selhání se potvrdily jako důležité rizikové faktory. Nově byl zjištěn vyšší stupeň závažnosti u věku ≥ 75 let, na významu získala přítomnost aterosklerotického cévního onemocnění a ženské pohlaví. Tato nová zjištění vedla k vytvoření nového schématu pro stratifikaci rizika TE u nemocných s FS a toto schéma dostalo pojmenování CHA2DS2Vasc skóre (tab. 2).
Tab. 2. Riziko embolizační mozkové příhody u nemocných s fibrilací síní bez přítomné chlopňové vady pro stanovení antitrombotické léčby dle CHA2DS2Vasc skórovací stratifikace. 
Závažnost rizikového faktoru věku začíná od věku 65 let a signifikantní navýšení závažnosti tohoto rizikového faktoru je od věku ≥ 75 let. Dobře kontrolovaná hypertenze představuje nízké riziko CMP/TE, nicméně na závažnosti nabývá s věkem, přičemž za rizikový faktor se pokládá neléčená hypertenze > 160/95 mmHg nebo korigovaná hypertenze hypotenzivní léčbou.
Přítomnost závažnější systolické dysfunkce levé komory při echokardiografickém vyšetření (ejekční frakce levé komory – EF LK ≤ 40 %) se ukázala jako jediný nezávislý rizikový faktor CMP. Zatímco riziko TE při snížené systolické funkci levé komory je jasné, riziko TE u srdečního selhání při zachované dobré systolické funkci levé komory není zatím dostatečně přesně definované.
Nově bylo stanoveno, že přítomnost aterosklerotického cévního onemocnění představuje zvýšené riziko CMP. Nicméně závažnost jednotlivých aterosklerotických cévních onemocnění není stejná. Prodělaný infarkt myokardu zyšuje riziko CMP/TE [12], ale diagnóza anginy pectoris samotné je nespolehlivá, jelikož část těchto nemocných nemusí mít sklerotické postižení koronárních tepen. FS přispívá ke špatné prognóze nemocných s postižením periferních tepen, ale postižení periferních tepen není nezávislým prediktorem CMP/TE, jako je tomu u komplexních aortálních plátů.
Analýza četných studií a registrů nově stanovila, že ženské pohlaví představuje podobně zvýšené riziko TE, jako je tomu u rizikových faktorů věku a hypertenze.
Echokardiografické parametry, které zvyšují riziko vzniku CMP a TE u nemocných s FS, jsou přítomnost trombu v levé síni, přítomnost komplexních aortálních plátů, přítomnost spontánního echokontrastu a nízká výdejová rychlost v oušku levé síně (≤ 20 cm/s). Tyto echokardiografické parametry jsou nezávislé prediktory CMP a TE při transezofageální echokardiografii a tato rizika jsou podobná u paroxyzmální, perzistentní i permanentní formy FS.
CHA2DS2Vasc skóre vs CHADS2 skóre
Studie, která porovnávala predikci stratifikačních schémat, ukázala, že toto nové stratifikační schéma (CHA2DS2Vasc skóre) má lepší prediktivní hodnotu pro CMP a TE proti všem doposud známým stratifikačním schématům stanovujícím tato rizika [4]. Toto schéma velmi dobře identifikuje nemocné s FS, kteří jsou skutečně v nízkém riziku (CHA2DS2Vasc skóre = 0, žádná CMP nebo embolizační příhoda během jednoho roku). Současně toto schéma velmi dobře kategorizuje skupinu nemocných se středním rizikem tromboembolizace (CHA2DS2Vasc skóre = 1), která je podstatně méně početná (15,1 % dle stratifikace CHA2DS2Vasc vs 61,9 % dle stratifikace CHADS2) a lze u ní nadále volit mezi antikoagulační a antiagregační léčbou. U skupiny nemocných, která měla dle CHADS2 skóre = 0 a byla v mírném ohrožení, byl roční výskyt CMP či embolizace 1,4 %. Při zvolené nové stratifikaci nedošlo u nemocných ve skutečně nízkém riziku tromboembolizace (CHA2DS2Vasc skóre = 0) k žádné tromboembolizační příhodě, proto je u těchto nemocných možné nepodávat jakoukoli antitrombotickou léčbu. Doposud se u nemocných v nízkém riziku (CHADS2 skóre = 0) doporučovala ASA, což vedlo k určitému množství krvácivých komplikací, navíc velká část nemocných ve středním riziku (CHADS2 skóre = 1) dostávala ASA, což vedlo při podhodnocení rizika k tromboembolickým komplikacím a při nadhodnocení rizika k určitému počtu krvácivých komplikací. U všech ostatních nemocných, kteří jsou zařazení do vyššího rizika tromboembolizace (CHA2DS2Vasc > 1), by měla být podávána antikoagulační léčba (tab. 3) [13–15].
Tab. 3. Doporučení pro prevenci tromboembolie dle rizikových faktorů CHA2DS2Vasc stratifikace. 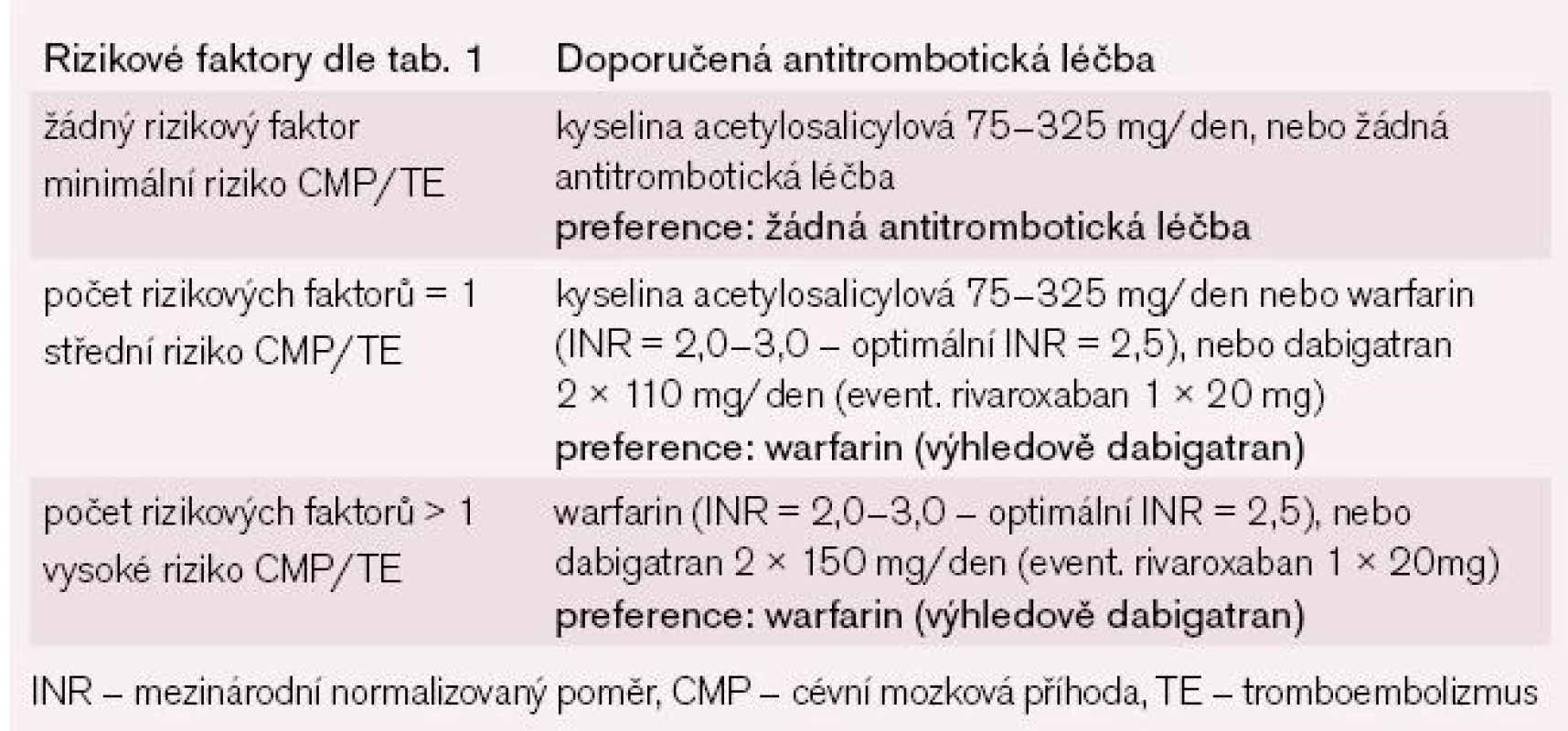
Při sledování dalších koincidujících onemocnění u nemocných s FS byly zjištěny i další faktory, které představují zvýšené riziko TE (chronické onemocnění ledvin, hypertyreóza, hypertrofická kardiomyopatie, amyloidóza a řada dalších), nicméně tyto faktory zvyšují současně mortalitu a krvácivé komplikace a nebyly prospektivně sledovány, proto jejich závažnost ve vztahu k TE není stanovena, ale dá se předpokládat, že závažnost těchto dalších faktorů nebude srovnatelná s výše uvedenými rizikovými faktory. Evropská doporučení navrhují, aby se periferní lékaři nadále v počátku řídili při stratifikaci rizika CMP/TE dle CHADS2 skóre a tento návrh odůvodňují jednoduchostí a dobrou zapamatovatelností tohoto skórovacího systému. Nová stratifikace rizika CHA2DS2Vasc skóre není proti původní stratifikaci rizika dle CHADS2 skóre výrazně složitější, CHA2DS2Vasc skóre má podstatně větší prediktivní hodnotu pro stanovení rizika CMP/TE a v nejbližší době nelze předpokládat, že by se objevily nové, signifikantně závažné rizikové faktory. Z těchto důvodů by bylo účelné, aby se všichni lékaři od počátku již řídili při stanovení rizika CMP/TE touto novou stratifikací (CHA2DS2Vasc skóre).
Alternativy antikoagulační léčby
Do III. fáze klinického zkoušení antikoagulační léčby se dostal dabigatran (přímý inhibitor trombinu), rivaroxaban, apixaban a edoxaban (inhibitory faktoru Xa). Studie s apixabanem a edoxabanem v prevenci CMP/TE u nemocných s FS zatím nemají zveřejněny výsledky, které by vykazovaly preferenční výsledky proti warfarinu.
Studie AVERROES prokázala, že dávka 2 × 5 mg apixabanu denně u nemocných, u nichž není možno podat warfarin, vede k signifikantnímu snížení rizika CMP či TE bez zvýšení rizika krvácení ve srovnání s ASA.
Studie ROCKET-AF ukázala, že rivaroxaban je přinejmenším srovnatelně efektivní v prevenci CMP nebo TE ve srovnání s warfarinem při sníženém riziku intrakraniálního či fatálního krvácení u nemocných se zvýšeným rizikem CMP a TE.
Studie RE-LY ukázala, že dabigatran vede k významnému snížení život ohrožujících krvácení proti warfarinu, je přinejmenším stejně účinný v prevenci CMP a TE jako warfarin a jeho medikace není provázena hepatotoxicitou ve srovnání se správně nastavenou dávkou warfarinu [16]. Dabigatran se jeví jako účinná a bezpečná antikoagulační léčba, která zajišťuje prevenci CMP s nižším rizikem krvácení, než je tomu u warfarinu, bez potřeby rutinního monitorování, bez interakcí s potravinami a s nízkým potenciálem pro interakce s léky (není metabolizován v systému cytochromu P 450).
Dabigatran a rivaroxaban se po mnoha letech ukazují jako možná alternativa antitrombotické léčby v prevenci CMP/TE u středně rizikových a vysoce rizikových nemocných s FS. Obě nová antitrombotika nelze porovnávat, jelikož mají rozdílnou farmakokinetiku, rozdílné dávkování a studie, které prokázaly jejich příznivý efekt, neměly stejnou strukturu rizika nemocných.
Studie REDEEM ukázala, že dabigatran v dávce až 2 × 150 mg společně s duální antiagregací vedl proti placebu k absolutnímu zvýšení velkých krvácivých komplikací pouze do 1 % při zachovaném klinickém efektu v prevenci TE, což dokládá vysokou bezpečnost této trojkombinační antitrombotické léčby nemocných po akutním infarktu myokardu. Významná výhoda vysoké bezpečnosti této trojkombinační antitrombotické léčby bude jistě v nejbližší budoucnosti uplatněna u velké populace nemocných se zvýšeným rizikem tromboembolizmu podstupujících koronární intervenci s implantací stentu, i když kombinace dabigatranu s clopidogrelem nebo ticlopidinem není zatím oficiálním souhrnem údajů o léku (SPC) u dabigatranu (Pradaxy) doporučována.
Praktické uplatnění nové stratifikace rizika a nových antitrombotik
U nemocných se středním rizikem tromboembolizace (CHA2DS2Vasc skóre = 1) se doporučuje dávkování dabigatranu 2× 110 mg denně, u ostatních nemocných s vyšším rizikem TE se dávkování řídí mírou rizika krvácení dle kritérií HAS-BLED (tab. 4). Při nízkém riziku krvácení (HAS-BLED skóre 0–2) se doporučuje dávka dabigatranu 2× 150 mg a při vyšším riziku krvácení (HAS-BLED skóre ≥ 3) dávka 2× 110 mg denně. Praktické uplatnění těchto doporučení u nás bude ještě vyžadovat schválení této léčby v dané indikaci (FS) a do určité míry pak budou tato doporučení ovlivněna výšemi úhrad léků pojišťovnami, preferencemi indikujících lékařů i preferencemi nemocných. Vymezení indikací pro medikaci rivaroxabanu zatím není k dispozici, nicméně jistě přistoupí jako alternativní antikoagulační léčba u nemocných s vyšším rizikem CMP či TE.
Podání dabigatranu by mělo být doporučeno i u nemocných, kteří jsou indikovaní k léčbě warfarinem, ale nejsou vhodní k antikoagulační léčbě warfarinem z jakéhokoli důvodu. Doposud se jako alternativní léčba u těchto nemocných doporučuje duální antiagregace (ASA + clopidogrel), nicméně toto by mělo být změněno v okamžiku uvolnění dabigatranu (event. rivaroxabanu) v indikaci antitrombotické léčby FS.
Rizika krvácení
Hodnocení rizika krvácení by mělo být součástí celkového hodnocení nemocného s FS před nasazením jakékoli antitrombotické léčby. Přestože antikoagulační léčbu užívají starší nemocní s FS častěji než v dřívějších studiích, počet intrakraniálních krvácení je srovnatelný a pohybuje se v rozmezí 0,1–0,6 %. Toto může být způsobeno méně intenzivní antikoagulační léčbou, pečlivějšími kontrolami INR nebo lepší kontrolou hypertenze. Intrakraniální krvácení vzrůstá při hodnotách INR ≥ 3,5 a naopak nedochází ke zvýšenému krvácení při hodnotách INR 2,0–3,0 ve srovnání s nižšími hodnotami INR. Vzhledem k tomu, že způsob hodnocení závažnosti krvácivých komplikací byl ve studiích značně rozdílný, je rozumné předpokládat, že především u starších nemocných je riziko závažného krvácení při medikaci ASA a při antikoagulační léčbě s hladinou INR < 3,0 přibližně stejné [17]. Podobně je třeba si uvědomit, že prospěšnost antikoagulační léčby v prevenci CMP mnohonásobně převažuje nad rizikem intrakraniálního krvácení. I přes tato známá fakta je potřeba s rizikem krvácení počítat, proto na základě rozboru evropského přehledu dat nemocných s FS (EuroHeart Survey) byla vytvořena relativně jednoduchá stratifikace rizika krvácení HAS-BLED [18]. Tato stratifikace je postavena na podobném principu skórování jednotlivých rizikových faktorů, jako je tomu u stratifikace rizika tromboembolizace dle CHA2DS2Vasc skóre (tab. 4). Dle této stratifikace je relativně vysoké riziko krvácení při HAS-BLED skóre ≥ 3 a u těchto nemocných by zatím měly být přísnější a častější kontroly antikoagulační léčby warfarinem nebo volba antikoagulační léčby dabigatranem či rivaroxabanem po uvolnění této alternativní antitrombotické léčby pro indikaci nemocných s FS.
Tab. 4. Stanovení rizika krvácení dle rizikové stratifikace HAS-BLED. 
Riziko in-stent trombózy je nejvyšší během prvního měsíce po implantaci stentu, proto je všeobecný souhlas, aby všichni nemocní dostávali duální antiagregační léčbu po dobu nejméně čtyř týdnů po implantaci stentu. Není mnoho studií, které sledovaly riziko krvácivých příhod u trojkombinační antitrombotické léčby (warfarin, ASA, clopidogrel). Tyto studie vesměs prokazovaly zvýšený výskyt krvácivých příhod při této trojkombinační antitrombotické léčbě, nicméně minimum závažných krvácivých komplikací (< 2 %) vznikalo, pokud se tato medikace podávala v kratší periodě – tj. do 30 dnů po implantaci stentu [19,20].
Optimální antikoagulační léčba warfarinem
Za účinnou a optimální antikoagulační léčbu v prevenci CMP a TE lze dnes pokládat jednoznačné udržení hodnot INR v rozmezí 2,0–3,0. Vzhledem k tomu, že hodnota INR je variabilně ovlivňována lékovými interakcemi, potravou a požíváním alkoholu, pohybují se hodnoty INR v tomto rozmezí ve studiích jen asi po dobu 60 % a v reálném životě jen přibližně po dobu 50 %. Při hodnotách INR 1,5–2,0 se riziko CMP zvyšuje dvojnásobně a to platí i pro starší nemocné, kde se v minulosti připouštěly nižší hodnoty rozmezí INR. Pokud se nemocný nepohybuje v rozmezí INR 2,0–3,0 více než 60 % času, pak zcela mizí prospěšnost antikoagulační léčby. Vzhledem k tomu, že riziko závažného krvácení se signifikantně zvyšuje od hodnoty INR ≥ 3,5, neměla by být tato hodnota překročena.
U nemocných s umělou chlopenní náhradou by se hodnota INR měla udržovat minimálně na hodnotě INR ≥ 2,5, pokud je náhrada v mitrální pozici, a minimálně na hodnotě INR ≥ 2,0, pokud je náhrada v aortální pozici.
V případě, že dojde k TE při prokazatelně účinné antikoagulační léčbě (INR 2,0–3,0), je možno zvýšit účinnost antikoagulace na hodnoty INR 3,0–3,5. Jak již bylo zmíněno, neměla by se k této antikoagulační léčbě přidávat antiagregační léčba.
K optimalizaci antikoagulační léčby lze využít také monitorace INR pacientem (self-monitoring např. přístrojem CoaguCheck), kde je předpoklad určité inteligence a spolupráce.
Zvláštní klinické situace
Perioperační antikoagulační léčba – dočasné přerušení antikoagulace
Nemocní s FS na antikoagulační léčbě vyžadují, aby před operačním krvácivým zákrokem byla vysazena antikoagulační léčba a většina chirurgů požaduje, aby hodnota INR byla před zákrokem < 1,5 nebo aby byla zcela v normě. Riziko závažného krvácení by mělo být vždy porovnáváno s rizikem TE v průběhu změny antikoagulační léčby. Pokud nemocný medikuje warfarin, jehož biologický poločas je 36–42 hod, antikoagulační efekt po vysazení přetrvává 4–5 dní, a naopak při opětovném nasazení je nutno počítat s 2–3denní latencí nástupu účinku. Warfarin by měl být tedy vysazen pět dnů před plánovanou operací a invazivní zákrok by měl být proveden v době poklesu INR do subterapeutických hodnot. Tato subterapeutická hodnota, během níž by měla být provedena operace, by měla optimálně trvat maximálně 48 hod, kdy je nejnižší riziko vzniku tromboembolické komplikace. Pokud se přerušuje antikoagulační léčba u nemocných v jakémkoli zvýšeném riziku TE, je oprávněné nasazení nízkomolekulárního heparinu v preventivní dávce den po vysazení antikoagulace. Po provedeném krvácivém zákroku, pokud je stabilní hemostáza, je vhodné večer v den zákroku nebo následující den ráno nasadit udržovací dávku antikoagulancia (ne nasycovací dávku) a u nemocných se zvýšeným rizikem TE ještě překrýt periodu subterapeutické hodnoty INR nízkomolekulárním heparinem.
Perioperační antitrombotická léčba u nemocných vyžadujících duální či trojkombinační antitrombotickou léčbu
U nemocných, u nichž je plánován chirurgický zákrok, je po vysazení duální či trojkombinační antitrombotické léčby vysoké riziko in-stent trombózy s potenciálně fatálními důsledky (mortalita se pohybuje v rozmezí 2,5–21,4 %) [21]. Proto se u těchto vysoce rizikových nemocných s implantovaným stentem snažíme chirurgickému zákroku vyhnout (minimálně jeden měsíc u metalického stentu a jeden rok u potahovaných stentů – DES). Podobně u nemocných, kde je plánovaná operace v průběhu nejbližších 12 měsíců, by neměl být implantován DES [22].
U nemocných, kteří vyžadují provedení urgentního chirurgického zákroku, je třeba individualizovat antitrombotickou léčbu na základě odhadu rizika krvácení chirurgem a rizika in-stent trombózy. Při nízkém a středním riziku krvácení se u duální antitrombotické medikace doporučuje ponechat pouze ASA a při vysokém riziku krvácení se doporučuje provedení zákroku při zcela vysazené duální antiagregační léčbě. Při vysokém riziku krvácení a při subakutní urgenci operace, kdy je třeba duální protidestičkovou léčbu zcela vysadit, se ASA vysadí sedm dnů před operací, clopidogrel pět dnů před operací a tři dny před operací se slábnoucí protidestičkový efekt nahradí inhibitorem glykoproteinu IIb/IIIa – integrilinem nitrožilně v dávce 2 µg/ kg/min. Tato infuze se 6–8 hod před plánovanou subakutní operací zastaví [23]. Pooperačně se co nejdříve vrátí původní protidestičková léčba, případně se toto období do nástupu plného protidestičkového efektu překryje ještě několikahodinovou infuzí integrilinu. Tento způsob léčby je sice nákladný, ale pro nemocné s vysokým rizikem in-stent trombózy vyžadující neodkladný chirurgický zákrok není zatím jiné levnější/efektivnější řešení.
Pokud je nemocný na trojkombinační antitrombotické léčbě, pak je třeba zvážit poměr rizika tromboembolizace a in-stent trombózy. Pokud se zdá riziko in-stent trombózy vyšší, pak se přejde na stejnou strategii jako u duální protidestičkové léčby. Pokud se zdá vyšší tromboembolizační riziko, pak se doporučuje úplné vysazení antitrombotické léčby týden před operací a po celou dobu tuto léčbu nahradit nízkomolekulárním heparinem v léčebných dávkách s posledním podáním den před operací ráno. Po operaci se při nekrvácivém průběhu nasazuje co nejdříve nízkomolekulární heparin se znovuzavedením trojkombinační antitrombotické léčby.
Pokud je operace urgentní a riziko krvácení převyšuje riziko in-stent trombózy (život ohrožující traumata či vitální indikace), není jiné řešení než podání destičkového koncentrátu.
Akutní koronární syndrom a/nebo provedená perkutánní koronární intervence s implantací koronárního stentu
Současná doporučení pro léčbu akutního koronárního syndromu a/nebo po provedené perkutánní koronární intervenci s implantací stentu pokládají za optimální duální antiagregační léčbu ASA s clopidogrelem (čtyři týdny po implantaci kovového stentu a 6–12 měsíců po implantaci potahovaných stentů). Pokud je nemocný současně ve zvýšeném riziku TE, je třeba, aby za těchto okolností měl trojkombinační antitrombotickou léčbu (warfarin + ASA + clopidogrel). Prevalence závažného krvácení při této trojkombinační léčbě je 2,6–4,6 % během prvních 30 dnů a tato prevalence se zvyšuje na 7,4–10,3 % při medikaci po dobu 12 měsíců. Z těchto zjištění vyplývá, že nejlepší poměr prospěšnosti trojkombinační léčby a rizika krvácení je při krátkém trvání této léčby, nejlépe po dobu jednoho měsíce. Potahovaným stentům bychom se měli u nemocných indikovaných k antikoagulační léčbě vyhnout a trojkombinační léčba by se měla podávat jen po krátkou dobu s následnou protrahovanou kombinovanou léčbou warfarinem a jedním antiagregačním preparátem ve formě ASA nebo clopidogrelu (tab. 5 a 6) [24].
Tab. 5. Strategie antitrombotické léčby po zavedení koronárního stentu u nemocných s FS s > 1 rizikovým faktorem dle CHA2DS2Vasc stratifikace (doporučená antikoagulační léčba) a současně s nízkým až středním rizikem krvácení dle HAS-BLED stratifikace – skóre 0–2. 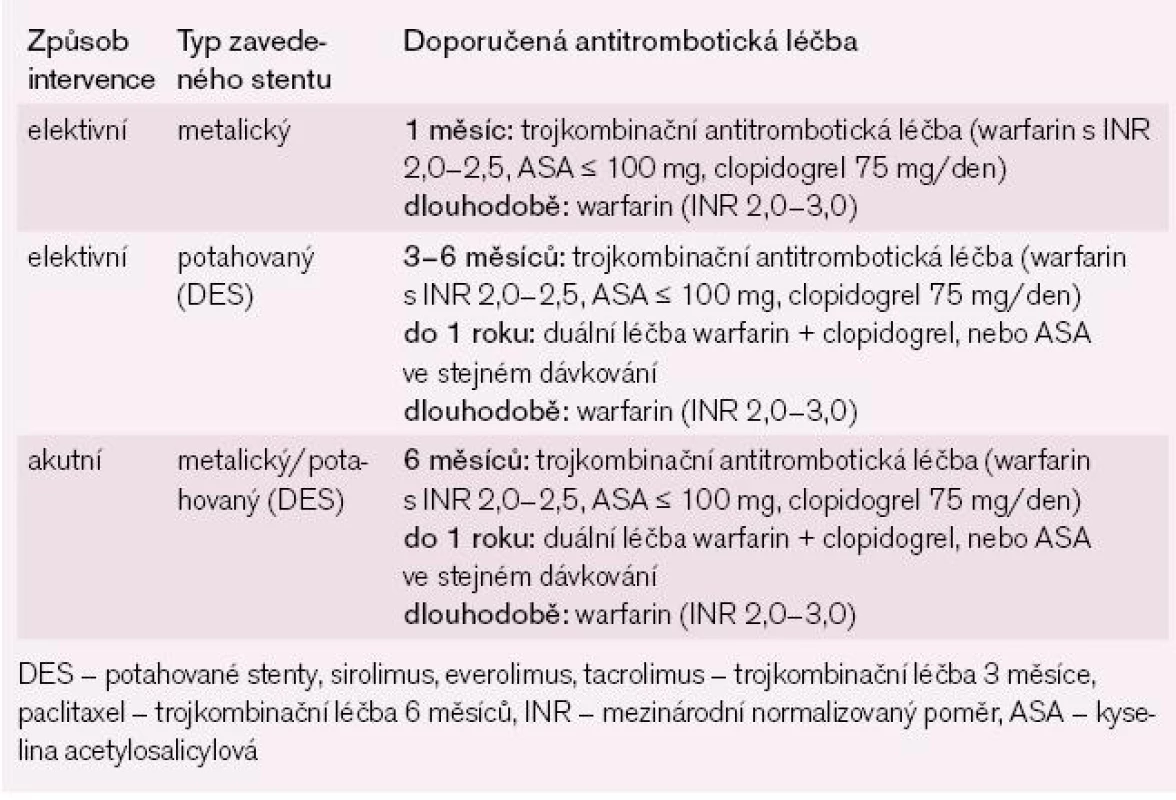
Tab. 6. Strategie antitrombotické léčby po zavedení koronárního stentu u nemocných s FS s > 1 rizikovým faktorem dle CHA2DS2Vasc stratifikace (doporučená antikoagulační léčba) a současně s vysokým rizikem krvácení dle HAS-BLED stratifikace – skóre ≥ 3. 
Plánovaná perkutánní koronární intervence
U většiny nemocných s FS je při plánované intervenci, v případě stabilního stavu na aterosklerotických koronárních tepnách, implantován metalický stent. Po provedené implantaci stentu by měla být podávána trojkombinační antitrombotická léčba (warfarin + ASA + clopidogrel) s inhibitory protonové pumpy nebo s antagonisty H2 receptorů po dobu jednoho měsíce. Na tuto léčbu by měla navazovat dlouhodobější (do 12 měsíců od implantace stentu) duální léčba warfarinem s clopidogrelem 75 mg denně nebo s ASA v dávce 75–100 mg denně, společně s inhibitory protonové pumpy nebo s antagonisty H2 receptorů k ochraně žaludeční sliznice. Veškerá tato léčba by měla být individuální a měla by se řídit rizikem TE i rizikem krvácivých komplikací.
Používání potahovaných stentů by mělo být omezeno na klinické a/nebo anatomické situace, kde riziko in-stent trombózy je výrazně zvýšeno a kde je tedy přínos potahovaného stentu signifikantně vyšší, než je tomu u stentu metalického. Tato strategie je dána tím, že trojkombinační antitrombotická léčba by se měla v případě implantace potahovaného stentu podávat jen kratší dobu (čtyři týdny) v důsledku současně zvýšeného rizika krvácivých komplikací. Obecně platí, že trojkombinační léčba by se měla u pacientů se stabilním stavem na aterosklerotických koronárních tepnách podávat minimálně jeden měsíc po implantaci metalického stentu, zatímco po implantaci potahovaného stentu by měla trojkombinační léčba trvat podstatně déle (nejméně tři měsíce u sirolimových, everolimových a tacrolimových stentů a nejméně šest měsíců u paclitaxelem potažených stentů). Tato trojkombinační léčba by měla být následně (do 12 měsíců od implantace stentu) vystřídána dvojkombinační léčbou warfarinem a ASA nebo clopidogrelem za současné medikace inhibitory protonové pumpy nebo antagonisty H2 receptorů k ochraně žaludeční sliznice. U nemocných se zvýšeným rizikem TE by antikoagulační léčba pro plánovanou intervenci neměla být přerušena a intervence by měla být provedena radiálním přístupem při účinnosti antikoagulace na hodnotách INR 2,0–3,0.
U infarktu myokardu bez elevací ST úseků by implantace potahovaných stentů měla být limitována stejným způsobem, jako je tomu při plánované intervenci, a podobně je tomu u těchto nemocných i v preferenci radiálního přístupu při provádění koronární intervence.
Akutní cévní mozková příhoda
Nemocní s akutní cévní mozkovou příhodou jsou v největším riziku tromboembolizace v prvních dvou týdnech, ale antikoagulační léčba podaná v této době může vést k intrakraniálnímu krvácení. Nemocní s akutní cévní mozkovou příhodou a s FS by měli mít před nasazením antikoagulační terapie řádně korigovanou hypertenzi a CT vyšetření nebo by měla magnetická rezonance vyloučit krvácivou etiologii mozkové příhody. Po vyloučení mozkového krvácení může být antikoagulační léčba zahájena po dvou týdnech od vzniku akutní příhody. Naopak u nemocných s FS a s přechodnou mozkovou ischemií by měla být antikoagulační léčba zahájena co nejdříve po vyloučení mozkového krvácení.
Kardioverze
Zvýšené riziko tromboembolie po kardioverzi je obecně uznávaným faktem. Před elektivní kardioverzí prováděné kvůli FS trvající déle než 48 hod nebo FS neznámého trvání se proto povinně nasazuje antikoagulační léčba. Na základě výsledků observačních kohortových studií by se léčba warfarinem (INR 2,0–3,0) měla podávat nejméně tři týdny před kardioverzí. Tromboprofylaxe se doporučuje u elektrické i farmakologické kardioverze FS trvající déle než 48 hod. Warfarin by měl být podáván ještě nejméně čtyři týdny po kardioverzi kvůli riziku tromboembolie, které je spojeno s dysfunkcí levé síně/ouška levé síně po kardioverzi (tzv. „omráčením“ levé síně). U pacientů s rizikovými faktory pro mozkovou příhodu a s recidivami FS je třeba pokračovat v léčbě warfarinem doživotně bez ohledu na to, zda se po kardioverzi zdá být sinusový rytmus obnoven.
U pacientů, u nichž dochází k jasnému nástupu FS a její trvání nepřekračuje 48 hod, lze kardioverzi provést při nitrožilním podávání nefrakcionovaného heparinu, po němž následuje podávání nízkomolekulárního heparinu. U pacientů s rizikovými faktory pro CMP je třeba po kardioverzi pokračovat v antikoagulační terapii doživotně. Podávání nefrakcionovaného nebo nízkomolekulárního heparinu by mělo pokračovat, dokud se INR nedostane na terapeutickou úroveň (2,0–3,0). U pacientů bez rizikových faktorů tromboembolie není po kardioverzi FS trvající do 48 hod perorální antikoagulace zapotřebí.
U pacientů s FS trvající déle než 48 hod a hemodynamickou nestabilitou (angina, infarkt myokardu, šok nebo plicní otok) je třeba provést okamžitou kardioverzi a před ní podat nefrakcionovaný nebo nízkomolekulární heparin. Po kardioverzi by se mělo začít s perorální antikoagulací a heparin by měl být podáván, dokud se INR nedostane na terapeutickou úroveň (2,0–3,0). Trvání perorální antikoagulační léčby (čtyři týdny nebo celoživotně) bude záviset na přítomnosti nebo absenci rizikových faktorů mozkové příhody.
Závěr
Fibrilace síní je spojena se signifikantně vyšší morbiditou i mortalitou, což je především způsobeno tromboembolickými komplikacemi. Cévní mozkové příhody způsobené fibrilací síní mají vyšší mortalitu a způsobují větší invalidizaci než příhody jiného původu. Proto prevence tromboembolických cévních mozkových příhod je jednou z nejdůležitějších složek komplexní léčby FS. Dle přítomnosti různých rizikových faktorů je u fibrilace síní doporučována v prevenci tromboembolických komplikací rozdílná strategie antikoagulační nebo protidestičkové léčby. Optimální antitrombotickou léčbu se snaží najít nová evropská i naše národní doporučení pro léčbu fibrilace síní na základě nové stratifikace rizika tromboembolizace dle tzv. CHA2DS2Vasc skóre a současně také s příchodem nových antitrombotik ve formě přímých inhibitorů trombinu nebo inhibitorů faktoru Xa.
Doručeno do redakce 27. 6. 2011
Přijato po recenzi 15. 7. 2011
doc. MUDr. Petr Heinc, Ph.D.
MUDr. Ondřej Moravec
MUDr. Jan Přeček
MUDr. Jana Ondrušková
doc. MUDr. Miloš Táborský, CSc., FESC, MBA
I. interní klinika FN Olomouc
petr.heinc@fnol.cz
Zdroje
1. Hughes M, Lip GY. Guideline Development Group. National Clinical Guideline for Management of Atrial Fibrillation in Primary and Secondary Care, National Institute for Health and Clinical Excellence. Stroke and thromboembolism in atrial fibrillation: a systematic review of stroke risk factors, risk stratification schema and cost effectiveness data. Thromb Haemost 2008; 99 : 295–304.
2. Stroke in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69 : 546–554.
3. Lip GY, Lim HS. Atrial fibrillation and stroke prevention. Lancet Neurol 2007; 6 : 981–993.
4. Lip GY, Nieuwlaat R, Pisters R et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010; 137 : 263–272.
5. Nieuwlaat R, Capucci A, Lip GY et al. Euro Heart Survey Investigators. Antithrombotic treatment in real-life atrial fibrillation patients: a report from the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2006; 27 : 3018–3026.
6. Mant J, Hobbs FD, Fletcher K et al. BAFTA investigators; Midland Research Practices Network (MidReC). Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged study, BAFTA): a randomized controlled trial. Lancet 2007; 370 : 493–503.
7. Lee BH, Park JS, Park JH, et al. The effect and safety of the anti-thrombotic therapies in patients with atrial fibrillation and CHADS2 score 1. J Cardiovasc Electrophysiol 2010; 21 : 501–507.
8. Gorin L, Fauchier L, Nonin et al. Antithrombotic treatment and the risk of death and stroke in patients with atrial fibrillation and a CHADS2 score=1. Thromb Haemost 2010; 103 : 833–840.
9. Sato H, Ishikawa K, Kitabatake A, et al. Japan Atrial Fibrillation Stroke Trial Group. Low-dose aspirin for prevention of stroke in low-risk patients with atrial fibrillation: Japan Atrial Fibrillation Stroke Trial. Stroke 2006; 37 : 447–451.
10. Connolly SJ, Pogue J, Hart RG et al. ACTIVE Investigators. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med 2009; 360 : 2066–2078.
11. Connolly S, Pogue J, Hart RG et al. ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367 : 1903–1912.
12. Schmitt J, Duray G, Gersh BJ et al. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J 2009; 30 : 1038–1045.
13. Lip GY, Halperin JL. Improving stroke risk stratification in atrial fibrillation. Am J Med 2010;123 : 484–488.
14. Rietbrock S, Plumb JM, Gallagher AM et al. How effective are dose-adjusted warfarin and aspirin for the prevention of stroke in patients with chronic atrial fibrillation? An analysis of the UK General Practice Research Database. Thromb Haemost 2009; 101 : 527–534.
15. Tay KH, Lip GY, Lane DA. Atrial fibrillation and stroke risk prevention in real-life clinical practice. Thromb Haemost 2009; 101 : 415–416.
16. Connoly SJ, Ezekowitz MD, Yusuf S, et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 : 1139–1151.
17. Mant J, Hobbs FD, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007; 370 : 493–503.
18. Pisters R, Lane DA, Nieuwlaat R et al. A novel userfriendly score (HAS-BLED) to assess one-year risk of major bleeding in patients with atrial fibrillation: The Euro Heart Survey. Chest 2010; 138 : 1093–1100.
19. Buresly K, Eisenberg MJ, Zhang X et al. Bleeding complications associated with combinations of aspirin, thienopyridine derivatives, and warfarin in elderly patients following acute myocardial infarction. Arch Intern Med 2005; 165 : 784–789.
20. Porter A, Konstantino Y, Iakobishvili Z et al. Short-term triple therapy with aspirin, warfarin, and a thienopyridine among patients undergoing percutaneous coronary intervention. Catheter Cardiovasc Interv 2006; 68 : 56–61.
21. Vicenzi MN, Meislitzer T, Heitzinger B, et al. Coronary artery stenting and non-cardiac surgery: a prospective outcome study. Br J Anaesth 2006; 96 : 686–693.
22. Grines CL, Bonow RO, Casey DE Jr et al. American Heart Association; American College of Cardiology; Society for Cardiovascular Angiography and Interventions; American College of Surgeons; American Dental Association; American College of Physicians. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Coll Cardiol 2007; 49 : 734–739.
23. Brilakis ES, Banerjee S, Berger PB. Perioperative management of patients with coronary stents. J Am Coll Cardiol 2007; 49 : 2145–2150.
24. Lip GY, Huber K, Andreotti F et al. European Society of Cardiology Working Group on Thrombosis. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous coronary intervention/stenting. Thromb Haemost 2010; 103 : 13–28.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2011 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Fibrilace síní z pohledu nových doporučení a dálková monitorace v kardiologii
- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Nefarmakologická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Upstream terapie u fibrilace síní
- Home monitoring nemocných s fibrilacemi síní
- Home monitoring a implantáty
- Telemonitoring krevního tlaku u nemocných s arteriální hypertenzí
- Twin cities
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Home monitoring a implantáty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



