-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační implantace aortální chlopně
Transcatheter aortic valve implantation
Surgical replacement of aortic valve is the treatment of choice in patients with symptomatic aortic stenosis or stenosis causing impairment of left ventricular function. The procedure is in indicated cases performed with low mortality and good long‑term outcome, even in older patients. Aortic valve replacement increases survival in a number of operated subgroups. Transcatheter Aortic Valve Implantation (TAVI) has been developing fast over the recent years as an option in patients in whom the traditional surgical aortic valve replacement would represent a too high risk. This technique is indicated in patients with high EuroSCORE (above 10–20), most often as a result of co-morbidities or of other reasons, for example as a consequence of previous cardiac surgery (most frequently previous coronary revascularization with functional bypass). Success of the procedure depends on operator‘s experience and exceeds 90%. Aortic valve gradient falls to near zero values immediately after the implantation and aortic valve area of 1.5–1.8 sqcm is being achieved; mild to moderate, mostly paravalvular, aortic regurgitation is observed in about half of the patients. The incidence of severe aortic regurgitation has fallen below 5% following improved implant selection. 30-day mortality is 5–18%, the incidence of acute myocardial infarction 2–11%. The incidence of vascular complications (between 10–15%) and conduction disorders with the need for pacemaker implantation in patients treated with self-expanding valve remain an issue.
Keywords:
aortic stenosis – transcatheter treatment – transcatheter aortic valve implantation
Autoři: J. Vojáček 1; J. Šťásek 1; J. Bis 1; M. Brtko 2; J. Vojáček 2; J. Harrer 2
Působiště autorů: 1. interní klinika LF UK a FN Hradec Králové 1; Kardiochirurgická klinika LF UK a FN Hradec Králové 2
Vyšlo v časopise: Kardiol Rev Int Med 2009, 11(3): 143-147
Souhrn
Pokud je aortální stenóza symptomatická nebo způsobuje poruchu funkce levé srdeční komory, je dnes metodou volby chirurgická náhrada aortální chlopně. Ta je v indikovaných případech prováděna s nízkou mortalitou a s dobrými dlouhodobými výsledky i u starších nemocných. Náhrada aortální chlopně zlepšuje přežívání u řady operovaných podskupin. Pro nemocné, u nichž je klasická chirurgická náhrada aortální chlopně spojena s neúnosným rizikem, se v poslední době rychle rozvíjí možnost katetrizační implantace aortální chlopně (Transcatheter Aortic Valve Implantation – TAVI). Ta je indikována u nemocných s vysokým EuroSCORE (nad 10–20), nejčastěji v důsledku dalších komplikujících onemocnění či z jiných důvodů, např. v důsledku předchozího kardiochirurgického výkonu (nejčastěji předchozí koronární revaskularizace s funkčními bypassy). Úspěšnost výkonu je závislá na zkušenosti operátora a přesahuje 90 %. Bezprostředně po výkonu klesá gradient na aortální chlopni na nulové hodnoty a je dosahována plocha ústí 1,5–1,8 cm2, asi u poloviny nemocných je pozorována lehká až střední, většinou paravalvulární aortální regurgitace. Se zlepšeným výběrem implantátů poklesl výskyt významné aortální regurgitace pod 5 %. Třicetidenní mortalita je 5–18 %, výskyt akutního infarktu myokardu 2–11 %. Problémem zůstává výskyt cévních komplikací (mezi 10–15 %) a převodní poruchy s nutností implantace kardiostimulátoru u nemocných léčených samoexpandabilními chlopněmi.
Klíčová slova:
aortální stenóza – katetrizační léčba – katetrizační implantace aortální chlopněÚvod
Aortální stenóza je dnes nejčastější vadou nativní chlopně v Evropě a v USA, stejně je tomu i v České republice [1]. Její prevalence v populaci nad 75 let je udávána na 4,6% [2]. Pokud je aortální stenóza symptomatická nebo způsobuje poruchu funkce levé srdeční komory, je dnes metodou volby chirurgická náhrada aortální chlopně. Ta je v indikovaných případech prováděna s nízkou mortalitou a s dobrými dlouhodobými výsledky i u starších nemocných. Náhrada aortální chlopně zlepšuje přežívání u řady operovaných podskupin [3–4]. V USA došlo například během let 1995–2004 ke zdvojnásobení počtu chirurgických náhrad aortální chlopně [2].
Operační mortalita se pohybuje mezi 3–8%, výrazně však může kolísat mezi jednotlivými pracovišti a u různých podskupin nemocných v závislosti na stupni nezvratného postižení funkce levé komory a především na přítomnosti přidružených onemocnění. Přesto není část nemocných (podle některých odhadů až 30%) z nejrůznějších důvodů indikována k chirurgické léčbě. Je to buď pro vysoké riziko operace (to lze s určitými výhradami vyjádřit pomocí EuroSCORE), nejčastěji v důsledku dalších komplikujících onemocnění, či z jiných důvodů, např. v důsledku předchozího kardiochirurgického výkonu (nejčastěji předchozí koronární revaskularizace).
Pro odhad perioperační mortality je používáno aditivní nebo lépe a častěji logistické EuroSCORE [5–6]. Logistické EuroSCORE (European System for Cardiac Operative Risk Evaluation) je používáno pro sjednocení indikačních kritérií ke katetrizační implantaci aortální chlopně, přestože opakovaná porovnání skutečné operační mortality oproti predikované mortalitě na základě logistického EuroSCORE prokazovala systematické nadhodnocení rizika. Nověji je za lepší považováno STS (Society of Thoracic Surgeons) skóre [7].
Pro nemocné, u nichž je klasická chirurgická náhrada aortální chlopně spojena s neúnosným rizikem, se v poslední době rychle rozvíjí možnost katetrizační implantace aortální chlopně (Transcatheter Aortic Valve Implantation – TAVI) [8–9].
První katetrizační implantaci aortální chlopněprovedl v roce 2002 Alain Cribier [10–11]. Ten po několika letech pokusů na zvířatech implantoval transseptálně antegrádně na balonku upevněnou („nakrimpovanou“) trojcípou chlopeň z hovězího perikardu 57letému muži s těžkou kalcifikovanou aortální stenózou v kardiogenním šoku. Nemocný se okamžitě po implantaci hemodynamicky zlepšil a během následujících čtyř měsíců byla funkce implantátu normální, nemocný však po 17 týdnech zemřel z nekardiálních příčin. Chlopeň byla poté implantována několika dalším nemocným v terminálním stadiu kritické aortální stenózy. Přesto se zprvu nezdálo, že katetrizační implantace aortální chlopně najde širší klinické využití – výkon byl komplikovaný, špatně technicky proveditelný s nejistým dlouhodobějším efektem. Následující roky však byly ve znamení poměrně rychlého paralelního vývoje zkušeností se dvěma systémy, které dnes již mají CE značku a jsou komerčně dostupné: Edwards-Sapien (Edwards Lifesciences Inc, Kalifornie, USA) a CoreValve Revalving System (CRS TM, CoreValve Inc, Irvine, Kalifornie, USA). Systém Edwards-Sapien (obr. 1) je balonkem roztažitelná třícípá chlopeň z hovězího perikardu (původně byla z koňského perikardu). Zatím je dostupná ve velikostech 23mm (zaváděcí systém 22 Fr) a 26mm (zaváděcí systém 24 Fr). Brzo bude dostupná ještě chlopeň o velikosti 20mm (vhodná mimo jiné pro restenózu v bioprotéze) a 29mm a zaváděcí systém 18 Fr. CoreValve Revalving System (obr. 2) má samoroztažitelnou (po stažení zaváděcího pouzdra) trojcípou chlopeň z vepřového (původně hovězího) perikardu ve velikostech 26 a 29mm, kterou lze zavést přes 18 Fr zavaděč.
Obr. 1. Systém Edwards-Sapien je balónkem roztažitelná třícípá chlopeň z hovězího perikardu. 
Obr. 2. CoreValve Revalving System má samoroztažitelnou trojcípou chlopeň z vepřového perikardu. 
V současné době jsou velmi precizně definována kritéria výběru nemocných pro katetrizační implantace aortální chlopně a výběr pracovišť a zahájení programu implantací na vybraných pracovištích jsou podmíněny absolvováním příslušného školení a přítomností proktorů během prvních výkonů.
Před výkonem je vyžadováno transtorakální a transezofageální echokardiografické vyšetření, koronarografie, aortografie, angiografie pánevních tepen a CT zobrazení pánevního tepenného řečiště. Ke katetrizační implantaci aortální chlopně jsou indikováni nemocní se symptomatickou hemodynamicky významnou aortální stenózou (index plochy aortálního ústí ≤ 0,6 cm2/m2) ve věku nad 75 let s logistickým EuroSCORE nad 20 (tab. 1, 2) či s přítomností dalších komplikujících onemocnění, jako jsou těžká chronická obstrukční choroba plicní, stavy po radiaci hrudníku a sterna, předchozí kardiochirurgický výkon u pacientů s funkčními arteriálními či žilními štěpy.
Tab. 1. Standardní aditivní model EuroSCORE (European System for Cardiac Operative Risk Evaluation) [5-6,16]. ![Standardní aditivní model EuroSCORE (European System for Cardiac Operative Risk Evaluation) [5-6,16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3354104ab354333d363de984b0fc294a.png)
Tab. 2. Beta koeficienty pro výpočet Logistického regresního modelu EuroSCORE (European System for Cardiac Operative Risk Evaluation) [5-6,16]. ![Beta koeficienty pro výpočet Logistického regresního modelu EuroSCORE (European System for Cardiac Operative Risk Evaluation) [5-6,16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9a4fe96b37050ce2ce9c4cdab3acdce6.png)
Z technického hlediska je zásadní změření velikosti aortálního anulu a velikosti a stavu přístupových tepen (chlopeň Edwards lze v současné době implantovat do anulu o průměru 18–25mm, Corevalve 20–27mm, Edwards-Sapien vyžaduje průměr femorální tepny nejméně 7mm pro chlopeň 23mm s použitím 22 Fr instrumentaria a 8mm pro chlopeň 26mm s použitím 24 Fr instrumentaria, Corevalve Revalving System třetí generace vyžaduje průměr femorální tepny nejméně 6mm pro 18 Fr instrumentarium). V případě potřeby je možné chlopeň Edwards-Sapien implantovat i transapikálně. Transapikální přístup je v současné době indikován při těžkém aterosklerotickém postižení pánevního řečiště nebo aorty (včetně „porcelánové“ aorty) a při horizontální poloze kořene aorty. Vyloučeni z katetrizační implantace jsou nemocní s hrudkovými kalcifikacemi v oblasti ústí věnčitých tepen, které by mohly vést ke koronární obstrukci. Pokud je indikována koronární angioplastika s implantací stentu, je nutné ji provést před výkonem na aortální chlopni.
Samotný výkon je zahájen zavedením angiografického „pig-tail“ katétru do aorty, stimulačního katétru do pravé komory srdeční a sondáží levé komory srdeční retrográdní cestou přes stenotickou aortální chlopeň. Před implantací chlopně je prováděna balónková valvuloplastika za praktické krátkodobé zástavy oběhu dosažené rychlou stimulací komor (obr. 3). Potom je do levé komory umístěn vodič s vysokou oporou a po tomto vodiči je speciálním zaváděcím katétrem zavedena chlopeň do aorty. Kruciální částí výkonu je umístění chlopně do aortální pozice (obr. 4). Následuje roztažení chlopně balónkem nebo implantace samoroztažitelné chlopně stažením pouzdra (u balónkem roztahované chlopně za oběhové krátkodobé zástavy, u samoroztažitelné chlopně bez zástavy (obr. 5)). Kontrola implantace chlopně je prováděna angiograficky a echokardiografií (obr. 6).
Obr. 3. Před implantací chlopně je prováděna balónková valvuloplastika za praktické krátkodobé zástavy oběhu dosažené rychlo u stimulací komor. 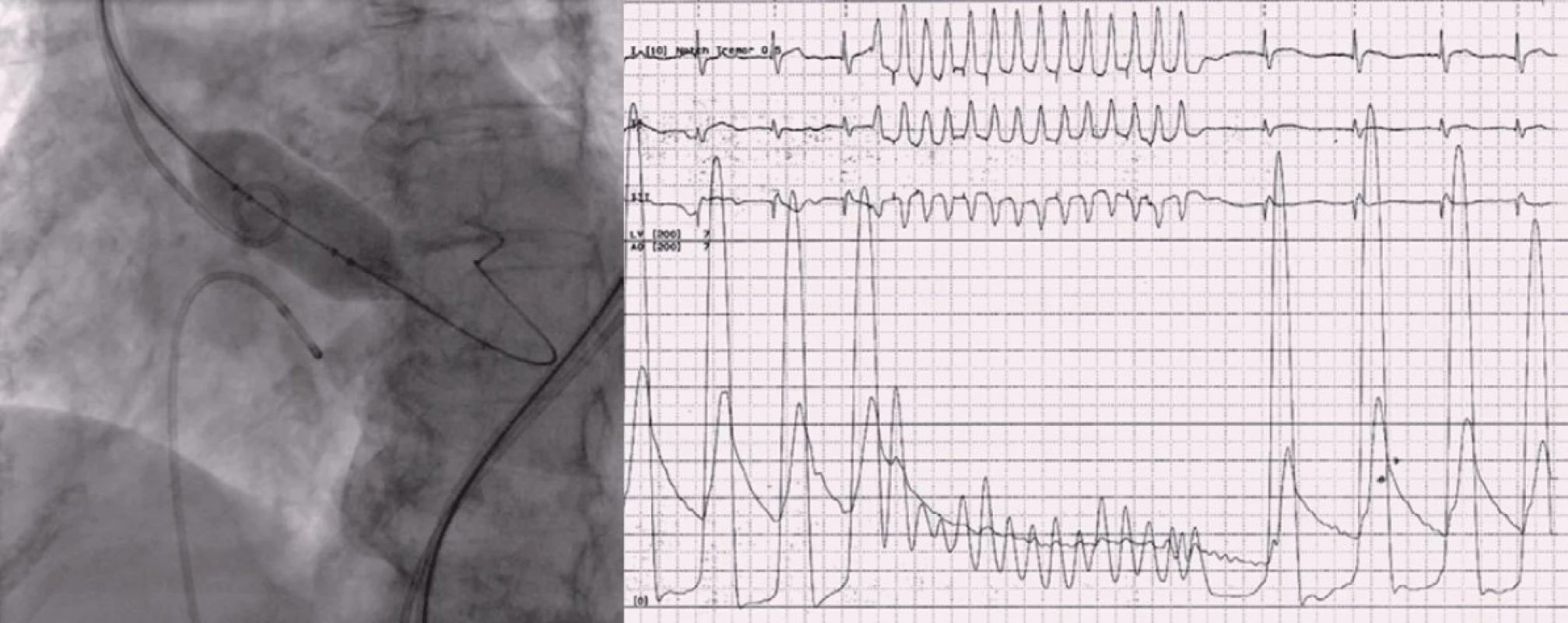
Obr. 4. Umístění chlopně do aortální pozice. 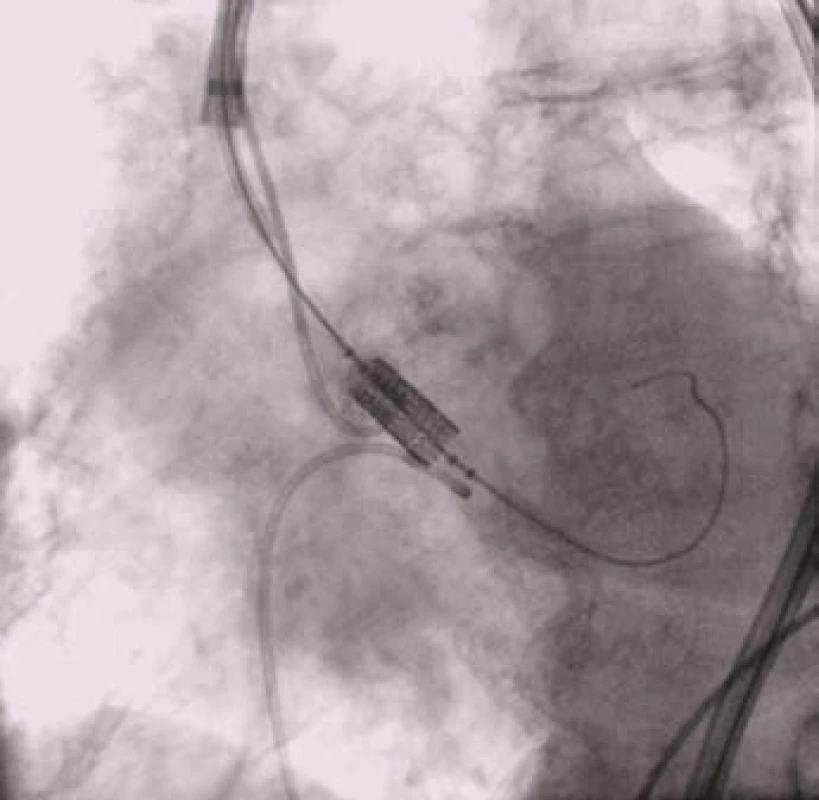
Obr. 5. Roztažení chlopně balónkem. 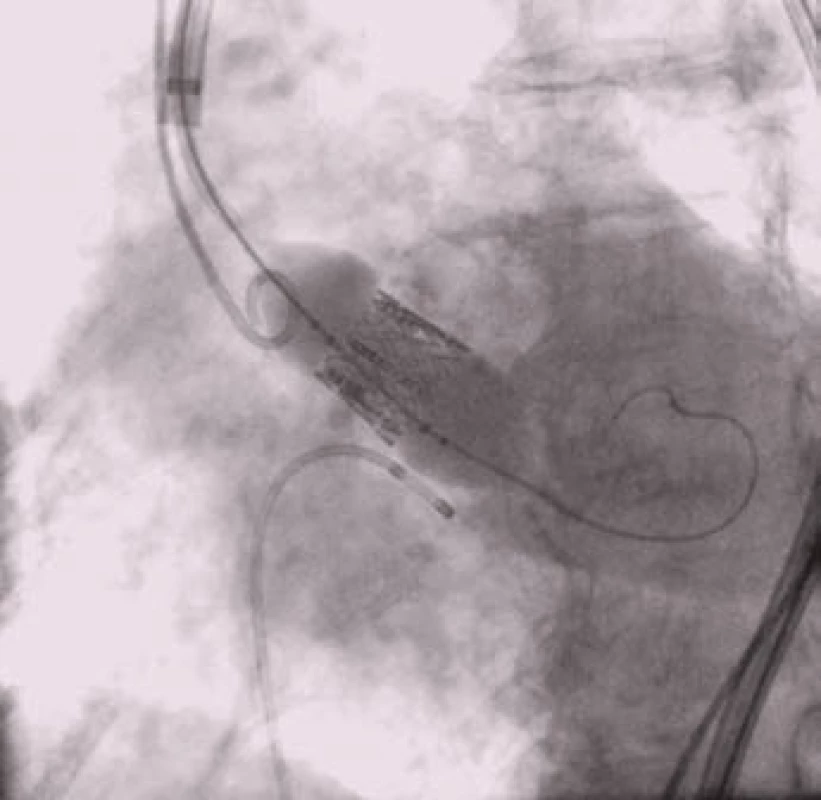
Obr. 6. Implantovaná chlopeň Edwards-Sapien v aortální pozici. 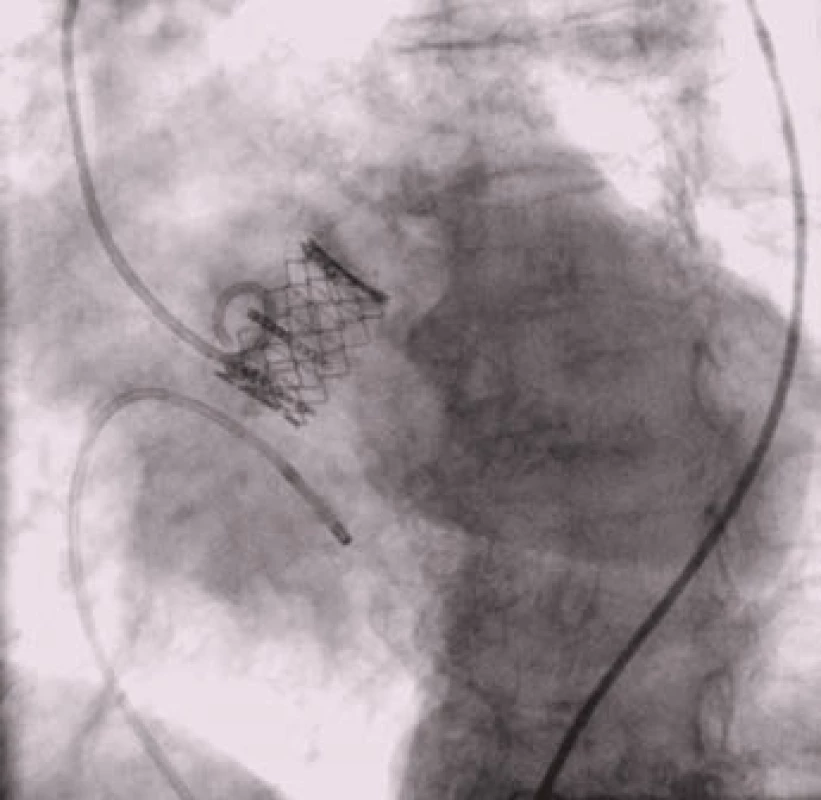
Úspěšnost výkonu je výrazně závislá na zkušenosti operátora a v centrech s dostatečnými počty výkonů přesahuje 90% [9], bezprostředně po výkonu klesá gradient na aortální chlopni na nulové hodnoty a je dosahována plocha ústí 1,5–1,8 cm2, asi u poloviny nemocných je pozorována lehká až střední, většinou paravalvulární aortální regurgitace. Se zlepšeným výběrem implantátů poklesl výskyt významné aortální regurgitace pod 5% [9]. Třicetidenní mortalita je 5–18%, výskyt akutního infarktu myokardu 2–11% [9]. Největším problémem vzhledem k zatím velkému průsvitu zaváděcích systémů (18–24 F) zůstává výskyt cévních komplikací (mezi 10–15%) se závažnými konsekvencemi, pokud jde o morbiditu i mortalitu [9]. Převodní poruchy jsou důvodem k implantaci kardiostimulátoru až u 24% nemocných léčených samoexpandabilními chlopněni [9]. Ve srovnání s klasickými kovovými kardiochirurgickými chlopněmi, kde jsou rozsáhlé zkušenosti a délka sledování v řádu desetiletí, je u perkutánně implantovaných chlopní doba sledování u většiny poměrně malých souborů jedno - až dvouletá s přežíváním 70–80%, přičemž pozdní úmrtí jsou v důsledku přidružených onemocnění [9]. Funkce implantované chlopně zůstává dlouhodobě dobrá.
V České republice byly první chlopně implantovány na pracovištích IKEM (CoreValve) a v Hradci Králové (Edwards-Sapien transfemorálně a transapikálně) [12–15].
Katetrizační implantace aortální chlopně (Transcatheter Aortic Valve Implantation – TAVI) předpokládá výbornou spolupráci mezi intervenčními kardiology, klinickými kardiology, echokardiografisty, kardiochirurgy a kardiovaskulárními anesteziology, příp. dalšími specialisty. Indikace by měla být schválena konziliem intervenčních kardiologů zkušených v nekoronárních intervencích a kardiochirurgů zkušených ve vysoce rizikových chlopenních výkonech. Podle doporučení pracovní skupiny složené ze zástupců European Association of Cardio-Thoracic Surgery (EACTS), European Society of Cardiology (ESC) a European Association of Percutaneous Cardiovascular Interventions (EAPCI) by měly být katetrizační implantace aortální chlopně prováděny v omezeném počtu center s vysokými objemy, které mají katetrizační laboratoř se zkušeností v léčbě nekoronárních intervencí a srdeční chirurgii se zkušenostmi s vysoce rizikovou chlopenní chirurgií [9].
Práce je podpořena grantem IGA MZ ČR NS/9741-3 a VZ MZO 00179906.
Doručeno do redakce 7. 7. 2009
Přijato po recenzi 10. 7. 2009
prof. MUDr. Jan Vojáček, DrSc., FESC, FACC1
doc. MUDr. Josef Šťásek, Ph.D.1
MUDr. Josef Bis1
MUDr. Miroslav Brtko, Ph.D.2
doc. MUDr. Jan Vojáček, Ph.D.2
doc. MUDr. Jan Harrer, CSc.2
11. interní klinika LF UK a FN Hradec Králové
2Kardiochirurgická klinika LF UK a FN Hradec Králové
vojacek@fnhk.cz
Zdroje
1. Čerbák R. Aortální stenóza – nejčastější chlopenní vada současnosti. Cor Vasa 2005; 47 : 409–411.
2. Chiam PT, Ruiz CE. Percutaneous transcatheter aortic valve implantation: Evolution of the technology. Am Heart J 2009; 157 : 229–242.
3. Popelová J, Benešová M, Brtko M et al. Doporučené postupy pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti. Cor Vasa 2007; 49 (Suppl 11): 6–46.
4. Vahanian A, Baumgartner H, Bax J et al. Task Force on the Management of Valvular Hearth Disease of the European Society of Cardiology; ESC Committee for Practice Guidelines. Guidelines on the Management of Valvular Heart Disease. The task force on the management of valvular heart disease of the European Society of Cardiology. Eur Heart J 2007; 28 : 230–268.
5. Nashef SA, Roques F, Michel P et al. The EuroSCORE study group. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 1999; 16 : 9–13.
6. Roques F, Michel P, Goldstone AR et al. The logistic EuroSCORE. Eur Heart J 2003; 24 : 881–882.
7. Edwards FH, Grover FL, Shroyer AL et al. The Society of Thoracic Surgeons National Cardiac Surgery Database: current risk assessment. Ann Thorac Surg 1997; 63 : 903–908.
8. Ghanbari H, Kidane AG, Burriesci G et al. Percutaneous Heart Valve Replacement: An Update. Trends in Cardiovasc Med 2008; 18 : 117–125.
9. Vahanian A, Alfieri O, Al-Attar N et al. Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio-Thoracic Surgery (EACTS) and the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI). EuroIntervention 2008; 4 : 193–199.
10. Cribier A, Eltchaninoff H, Bash A et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002; 106 : 3006–3008.
11. Cribier A, Eltchaninoff H, Tron C. First human transcatheter implantation of an aortic valve prosthesis in a case of severe calcific aortic stenosis. Ann Cardiol Angeiol (Paris) 2003; 52 : 173–175.
12. Vojáček J. První katetrizační implantace aortálních chlopní v České republice. Interv Akut Kardiol 2009; 8 : 6–8.
13. Želízko M, Janek B, Netuka I et al. Perkutánní implantace aortální chlopně u nemocné s těsnou aortální stenózou. Interv Akut Kardiol 2009; 8 : 43–46.
14. Šťásek J, Vojáček J, Bis J et al. První zkušenost s perkutánní transfemorální implantací chlopně Edwards SAPIEN™ u nemocných s aortální stenózou. Interv Akut Kardiol 2009;8 : 47–51.
15. Harrer J, Vojáček J, Šťásek J et al. První zkušenost s transapikální implantací chlopně u nemocných s aortální stenózou. Interv Akut Kardiol 2009; 8 : 100–104.
16. EuroSCORE. European System for Cardiac Operative Risk Evaluation. EuroScore Interactive Calculator. [http://www.euroscore.org/calc.html].
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2009 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Změny počasí a naše srdce
- Vývoj prognostického skóre u pacientů s chronickým kardiorenálním syndromem
- Kardiovaskulární rizikové faktory u chronického selhání ledvin
- Jak ovlivňují diabetes mellitus 2. typu a zvýšená glykemie kardiovaskulární riziko?
- Kyselina močová a kardiorenální riziko
- Současné názory na roli mírné hyperhomocysteinemie jako rizikového faktoru kardiovaskulárních chorob
- HRT a kardiovaskulární riziko
- Koronární příhody a zánět
- Katetrizační implantace aortální chlopně
- Holterova monitorace EKG
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Změny počasí a naše srdce
- Holterova monitorace EKG
- Současné názory na roli mírné hyperhomocysteinemie jako rizikového faktoru kardiovaskulárních chorob
- Kyselina močová a kardiorenální riziko
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



