-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metabolický syndróm po transplantácii obličky
Metabolic syndrome in kidney transplant recipients
Metabolic syndrome in kidney transplant recipients shares many common characteristics with the general population, but the presence of transplant-specific aspects (particularly the use of chronic immunosuppressive therapy) ranks this group of patients at high risk for its development. According to a previous analysis of the Transplant Center in Martin in 2016, its prevalence was found to be 44.4 %. The onset of metabolic syndrome in the post-transplant period is associated with impaired graft function and graft loss. Number of these patients suffer from metabolic syndrome, or its components, before transplantation, and even then it represents a significant risk factor for post-transplant diabetes mellitus, which is a serious metabolic complication with an impact on overall and cardiovascular morbidity and mortality. The most important step is prevention be selecting high-risk patients before transplantation and, in case of metabolic syndrome detection, active modification of lifestyle and treatment of its components in order to eliminate negative effects on the patient and the transplanted kidney.
Keywords:
kidney transplantation – metabolic syndrome – immunosuppression
Autoři: Karol Graňák 1; Matej Vnučák 1; Monika Beliančinová 1; Margaréta Pytliaková 2; Ivana Dedinská 1
Působiště autorů: Chirurgická klinika a transplantačné centrum JLF UK a UNM, Martin 1; Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s. 2
Vyšlo v časopise: Forum Diab 2021; 10(3): 187-192
Kategorie: Prehľadové práce
Souhrn
Metabolický syndróm u pacientov po transplantácii obličky zdieľa mnohé spoločné charakteristiky so všeobecnou populáciou, avšak prítomnosť pre transplantáciu špecifických aspektov (najmä užívanie chronickej imunosupresívnej liečby) radí túto skupinu pacientov medzi vysoko rizikovú pre jeho vývoj. Podľa predchádzajúcej analýzy Transplantačného centra v Martine z roku 2016 bola jeho zistená prevalencia 44,4 %. Vznik metabolického syndrómu v potransplantačnom období je asociovaný so zhoršením funkcie, až stratou štepu. Určité percento pacientov trpí týmto syndrómom, alebo jeho komponentami ešte pred samotnou transplantáciou a už vtedy predstavuje významný rizikový faktor pre potransplantačný diabetes mellitus, ktorý je závažnou metabolickou komplikáciou s dopadom na celkovú a kardiovaskulárnu morbiditu a mortalitu. Základným krokom je prevencia s vyhľadávaním vysoko rizikových pacientov ešte pred samotnou transplantáciou a v prípade detekcie metabolického syndrómu aktívna modifikácia životného štýlu a liečba jeho zložiek s cieľom eliminovať negatívne dopady na pacienta a transplantovanú obličku.
Klíčová slova:
metabolický syndrom – Transplantácia obličky – imunosupresia
Úvod
Metabolický syndróm (MS) je nenáhodná akumulácia viacerých porúch, ktoré spoločne zvyšujú riziko vývoja aterosklerotických kardiovaskulárnych chorôb (KVO), inzulínovej rezistencie a diabetes mellitus (DM), či cerebrovaskulárnych príhod. Syndrómom sa stáva v prípade, že u pacienta je prítomná centrálna obezita charakterizovaná obvodom pása a aspoň 2 z nasledovných: zvýšená hladina triacylglycerolov (TAG), zníženie hladiny lipoproteínov s vyššou denzitou (HDL), artériová hypertenzia, hraničná glykémia nalačno a porucha glukózovej tolerancie [1]. Súčasná definícia MS vychádza z konsenzu IDF (International Diabetic Federation) z roku 2005 (tab. 1). Incidencia MS vo všeobecnej populácii zvyčajne odráža výskyt obezity a diabetes mellitus 2. typu (DM2T). Globálne môže postihovať približne štvrtinu populácie, nakoľko prevalencia MS je približne 3-krát vyššia v porovnaní s DM, ktorá bola podľa diabetologického atlasu IDF v roku 2015 až 8,8 % s predpokladom rastu na 10,4 % do roku 2040 [2].
Tab. 1. Diagnostické kritéria pre metabolický syndróm (IDF, 2005) 
DM– diabetes mellitus dTK – diastolický tlak krvi HDL – cholesterol s vysokou denzitou sTK – systolický tlak krvi TAG – triacylglycerol Transplantácia obličky (TO) predstavuje jednu z možností náhrady funkcie obličiek, spoločne s hemodialýzou (HD) a peritoneálnou dialýzou. Pre pacientov v konečnom štádiu choroby obličiek je práve TO najideálnejšou z týchto metód. Jej pozitívny efekt vyplýva z lepšej kvality života, celkového prežívania pacientov s nižším výskytom sprievodných komplikácií v porovnaní s dialyzačnou liečbou [3]. Prevalenciou a dopadmi MS u pacientov po TO sa doteraz zaoberalo pomerne veľké množstvo štúdii. Courivard et al. zistili na vzorke 337 pacientov prevalenciu MS 32 % 1 rok po TO [4]. Porrini et al. taktiež vyšetrovali jeho prevalenciu na európskej populácii, konkrétne medzi 230 pacientmi 1 rok po TO identifikovali vývoj MS v 22,6 % prípadov s nárastom na 37,7 % po 18 mesiacoch od začiatku vyšetrovania. Tieto zistenia môžu naznačovať, že prevalencia MS sa môže zvyšovať časom [5]. Samotný MS je u príjemcov po TO spojený so zvýšeným rizikom straty štepu a predčasného úmrtia z kardiovaskulárnej (KV) príčiny [6]. V štúdii z roku 2019 na vzorke viac ako 600 pacientov po primárnej TO bolo potvrdené, že MS už pred TO je nezávislým rizikovým faktorom pre neskorší vývoj potransplantačného diabetes mellitus (PTDM), čo sa zhoduje so závermi predošlých analýz [7].
Napriek tomu, že mnoho rokov sa diskutuje o tom, či sú metabolické poruchy u pacientov po TO samostatnou entitou, je evidentné, že zdieľajú so všeobecnou populáciou viacero spoločných charakteristík. Ide predovšetkým o inzulínovú rezistenciu či poruchu v uvoľňovaní inzulínu na úrovni B-buniek pankreasu, ale aj obezitu, hypertriacylglycerolémiu, hypertenziu a chronický subklinický zápal [8]. Špecifickými aspektami v potransplantačnom období sú užívanie imunosupresívnej liečby, chronická hypomagnezémia a vírusové infekcie, obzvlášť cytomegalovírusová. Dnes štandardne používaný imunosupresívny protokol zahŕňa kalcineurínový inhibítor (CNI – CalciNeurin Inhibitor), kyselinu mykofenolovú a kortikosteroidy. Španielska štúdia porovnávala jednotlivé imunosupresívne režimy v kontexte vzniku metabolických porúch a rizika akútnej rejekcie a potvrdili, že spomínaný režim vytvára medzi nimi najlepší balans [9]. Pacienti po TO sú vystavení perioperačne vysokým intravenóznym dávkam metylprednisolonu, ktoré sú nasledované perorálnym prednisonom v postupne sa znižujúcej dávke. Ich nežiaduci efekt v podobe hyperglykémie je dobre známy. Deje sa tomu tak prostredníctvom indukcie či zhoršenia preexistujúcej inzulínovej rezistencie, zvýšením hepatálnej glukoneogenézy a z dlhodobého hľadiska aj stimuláciou apetítu s prírastkom na hmotnosti [10]. Výskyt nežiaducich účinkov je závislý od dávky. Ako vychádza z výsledkov vyššie uvedenej španielskej štúdie, včasné vysadenie steroidov neviedlo k redukcii incidencie nežiaducich metabolických účinkov, na druhej strane bolo zaznamenané mierne zvýšenie biopsiou identifikovanej akútnej rejekcie. Z CNI je už takmer výhradne používaný takrolimus, nakoľko bola opakovane potvrdená jeho nadradenosť nad cyklosporínom A v prevencii akútnej rejekcie. Takrolimus však viedol k zvýšeniu metabolických komplikácií, bol zaznamenaný signifikantne vyšší výskyt PTDM [9]. Štúdia z roku 2015 s takrolimom u myší poukázala na indukovanú redukciu proliferácie B-buniek, nie však ich apoptózu, ako sa dovtedy predpokladalo, a preto možno jeho efekt považovať za reverzibilný [11]. Podľa niektorých štúdii a metaanalýz je predpokladom týchto účinkov peexistujúca hypertriacylglycerolémia alebo inzulínová rezistencia [12]. Z ostatných imunosupresív možno ešte spomenúť mTOR (mammalian Target Of Rapamycin) inhibítory, ktoré sa dnes používajú po konverzii z CNI pri malígnych ochoreniach. Častým nežiadúcim účinkom je vznik hypertriacylglycerolémie a tiež môžu byť asociované s poruchou metabolizmu glukózy [13].
Metabolický syndróm pred transplantáciou obličky
Výskyt MS v skupine pacientov v terminálnom štádiu chronickej choroby obličiek je častý, obzvlášť u pacientov podstupujúcich hemodialýzu. Podľa štúdie z roku 2018 bola jeho prevalencia 55,7 %, v novšej štúdii na vzorke 753 pacientov bola dokonca 68,5 % [14,15]. Obzvlášť častými komponentami v porovnaní s transplantovanými pacientmi sú artériová hypertenzia a nízka hladina HDL-cholesterolu [16]. MS zistený pred TO je spojený s negatívnymi dopadmi na potransplantačné obdobie. Ako uvádzajú predchádzajúce práce, MS je nezávislým rizikovým faktorom pre vznik PTDM [3,7]. V americkej multicentrickej analýze zo 640 príjemcami bez DM bol predtransplantačne identifikovaný MS u 57,2 %, pričom z nich PTDM vyvinulo 31,4 % prípadov. Práve MS bol zistený ako rizikový faktor pre PTDM nezávisle od veku, etnika a kumulatívnej dávky steroidov [17]. Svoju pozornosť si v predtransplantačnom období vyžaduje obezita definovaná hodnotou indexu telesnej hmotnosti (BMI – Body Mass Index) > 30 kg/m2, ktorá je nezávislým rizikovým faktorom straty štepu a KV-morbidity po TO. Je zároveň viazaná na vyšší výskyt ranových infekcií a signifikantne asociovaná s ďalším nárastom na váhe v potransplantačnom období v porovnaní s neobéznymi pacientmi [18]. Hodnota BMI > 35 kg/m2 predstavuje relatívnu kontraindikáciu k TO s potrebou redukcie telesnej hmotnosti ešte pred zaradením na čakaciu listinu. Každý potenciálny príjemca s obezitou musí absolvovať predtransplantačne chirurgické vyšetrenie. V štúdii z nášho transplantačného centra autori na vzorke 268 pacientov po TO identifikovali MS podľa kritérií IDF u 44,4 % pacientov [19]. V novšej multicentrieckej analýze slovenských transplatovaných pacientov Dedinská et al. zaznamenali vysokú incidenciu PTDM na úrovni 38,3 % [20]. Možno sa domnievať, že značný podiel na týchto vysokých číslach mali práve pacienti s nepoznaným MS alebo DM ešte pred samotnou TO. Vzhľadom k tomu sa pred zaradením na čakaciu listinu dnes rutinne zameriavame aj na dôkladné vyšetrenie metabolizmu glukózy, tukov a ostatných zložiek MS. Každý pacient taktiež absolvuje orálny glukózo-tolerančný test (OGTT). Na základe zistených informácii je dôležitý individuálny preventabilný a v prípade zisteného MS terapeutický manažment s cieľom minimalizovať jeho negatívne dopady na pacienta a transplantovanú obličku.
Metabolický syndróm vzniknutý po transplantácii obličky
V tesnom potransplantačnom období sa vyskytuje hyperglykémia u 80 % príjemcov v závislosti od ich predispozície a často pretrváva aj po 3 mesiacoch od TO. Už táto tranzientná perioperačná hyperglykémia je asociovaná so zvýšeným rizikom rozvoja PTDM [21]. Chakkera et al uvádzajú výskyt hyperglykémie spĺňajúcej kritéria PTDM v prvom týždni až u 87 % pacientov, ktorí DM v predoperačnom období netrpeli [22]. Hecking et al sledovali dokonca vyššiu incidenciu, a to 92 %, za hlavnú príčinu možno považovať vysokú nálož kortikosteroidov a CNI s ich silným synergickým prodiabetogénnym efektom v teréne perioperačného stresu [23]. Z jednotlivých zložiek MS je po TO častý práve vývoj prediabetických stavov a takmer pravidlom je váhový prírastok – polovica pacientov trpí centrálnou obezitou. Zvýšený apetít, zlepšené vnímanie chutí ústupom urémie, liberalizácia diétnych reštrikcií, ako aj sedavý spôsob života so zlou celkovou fyzickou kondíciou sú faktormi, ktoré sa na ňom najväčšmi podieľajú [24]. Centrálna obezita je asociovaná s hypertriacylglycerolémiou, adipocytmi riadeným uvoľňovaním cytokínov a subklinickým zápalom, z ktorých všetky indukujú inzulínovú rezistenciu s vysokým rizikom vzniku PTDM [25]. Nízke hladiny adiponektínu sú úzko späté s inzulínovou rezistenciou a signifikantne zvyšujú riziko vzniku PTDM nezávisle od pohlavia, veku a typu imunosupresie. Naopak u obéznych pacientov stúpa produkcia leptínu, ktorého hladina signifikantne rastie v potransplantačnom období a je významne asociovaná s vývojom PTDM [26]. Vážnym dôsledkom MS po TO je negatívny dopad na prežívanie štepu [5]. Rovnako de Vries et al vo svojej štúdii poukázali na významnú asociáciu medzi MS a redukciou funkcie štepu z dlhodobého hľadiska. Pacienti, ktorí trpeli MS, mali klírens kreatinínu približne o 5 ml/min nižší v porovnaní s kontrolnou skupinou v 7-ročnom sledovaní [27].
Výskyt MS a jeho jednotlivých zložiek sme vyšetrovali aj v transplantačnom centre v Martine. Analyzovali sme vzorku 268 pacientov po primárnej TO od mŕtveho darcu, ktorí v čase TO nemali známy DM ani žiadny prediabetický stav. 12 mesiacov po TO bol podľa platných IDF kritérií diagnostikovaný MS u 44,4 % zúčastnených. Ich porovnaním s kontrolnou skupinou, čo sa komponentov MS týka, mali títo pacienti signifikantne vyšší obvod pása (muži aj ženy), vyšší výskyt hyperglykémie nalačno, u žien bola významne nižšia hladina HDL-cholesterolu. Signifikantný rozdiel vo výskyte artériovej hypertenzie a hypertriacylglycerolémie prítomný nebol. Pacienti, ktorí vyvinuli MS, boli štatisticky významne starší (tab. 2). Z hľadiska imunosupresívneho protokolu nevykazovali skupiny rozdiel v priemernej hladine CNI a dennej dávke prednisonu, avšak u pacientov s MS nastavených na mTOR inhibítor sirolimus bola zistená jeho významne vyššia hladina v sére. Dôležitým záverom tejto analýzy bolo štatisticky významne zhoršenie funkcie štepu v 12. mesiaci po TO, definovanej pomocou hodnoty glomerulovej filtrácie (eGFR – estimated Glomerular Filtration Rate), v skupine, ktorá vyvinula MS v porovnaní s kontrolnou skupinou (tab. 3) [19].
Tab. 2. Porovnanie sledovaných parametrov v kontrolnej skupine a skupine s MS 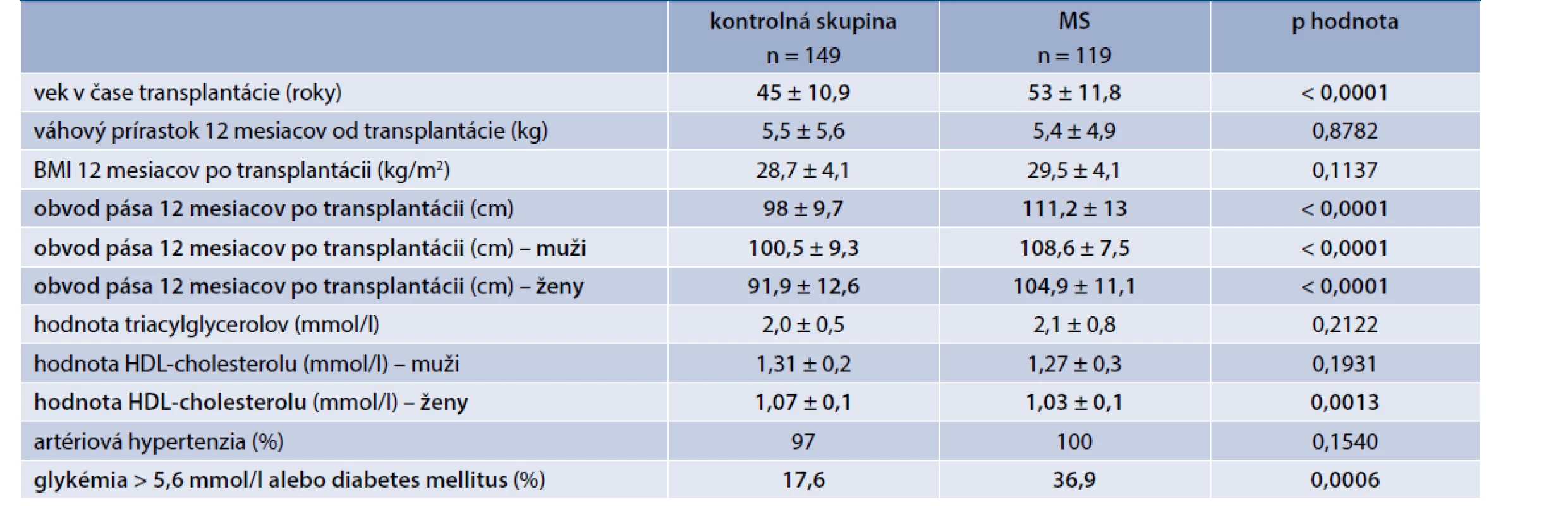
BMI – index telesnej hmotnosti HDL – cholesterol s vysokou denzitou MS – metabolický syndróm Tab. 3. Porovnanie funkcie štepu medzi skupinami 12 mesiacov po transplantácii 
eGFR – glomerulová filtrácia MS – metabolický syndróm Prevencia a ciele liečby
Poruchy metabolizmu glukózy
V ideálnom prípade by mala fungovať prevencia vývoja prediabetických stavov a PTDM, a preto je odôvodneným prvým krokom určenie ich rizika pred transplantáciou. Vzhľadom k faktu, že 2-hodinová glykémia je významným prediktorom potransplantančnej hyperglykémie u pacientov po TO, mnohé centrá štandardne realizujú OGTT pred zaradením pacienta na čakaciu listinu pre TO. Ďalším dôležitým krokom je identifikovať ostatné rizikové faktory, ku ktorým patrí pozitívna rodinná anamnéza pre DM, vek > 40 rokov, obezita, ale aj infekcia vírusom hepatitídy C (HCV). „Ušitie imunosupresie na mieru“ pre pacienta v čase transplantácie je pravdepodobne primárnym nástrojom prevencie alebo posunutia vývoja PTDM u tých, ktorí sú vo vysokom riziku. Samozrejme, klinické rozhodnutia musia byť ovplyvnené dvoma dôležitými faktami. Po prvé, voľba imunosupresívneho liečebného režimu nikdy nemôže vystaviť pacienta riziku rejekcie transplantovaného orgánu. Po druhé, glykémia je zvyčajne potencovaná u náchylných pacientov v priebehu 1.–2. mesiaca po transplantácii a nemusí bezpodmienečne znamenať dlhodobo manifestovaný PTDM [28]. Jenssen et al. odporúčajú v skorom potransplantačnom období udržiavať hladinu plazmatickej glukózy nalačno < 7 mmol/l a postprandiálnej < 10 mmol/l [29]. Hladina glykovaného hemoglobínu (HbA1c) môže byť nápomocná pri monitoringu glykémií u príjemcov 6 až 12 mesiacov po chirurgickom výkone. Vo včasnom potransplantačnom období sú hladiny HbA1c zlým monitorovacím nástrojom, z časti z dôvodu krvných strát a zvýšeného obratu erytrocytov alebo použitia erytropoetínu v stave renálneho zlyhávania [30]. Je dôležité vyhnúť sa ťažkým hypoglykemickým udalostiam z dôvodu vysokého KV-rizika [28]. Vo všeobecnosti majú cieľové hladiny HbA1c dosahovať 7,0–7,5 % (53–58 mmol/mol). V priebehu prvých 1–2 mesiacov po transplantácii je k ovplyvneniu hyperglykémie vždy preferovaná terapia inzulínom. Vzhľadom k častým zmenám dávok imunosupresív, renálnej funkcie a nutričného príjmu v tesnom potransplantačnom období je jeho intravenózna aplikácia preferovanou cestou. Dovoľuje pomerne frekvenčne titrovať dávky aplikovaného inzulínu s lepšou prevenciou signifikantných odchýlok glykémie [8]. Diagnostikovať prediabetický stav alebo PTDM sa odporúča po uplynutí minimálne 2 mesiacov od TO a až v prípade, že je to potrebné, sú uprednostňované perorálne preparáty, u ktorých bola, na tejto špecifickej časti populácie, potvrdená efektivita a bezpečnosť s ohľadom na liekové interakcie, užívanú imunosupresiu a renálnu funkciu. Liekom prvej voľby zostáva, rovnako ako u diabetikov 2. typu, metformín. Dnes je už však známych, eventuálne stále prebiehajúcich niekoľko štúdií s tendenciou potvrdiť dobrú účinnosť a bezpečné použitie novších skupín antidiabetík, obzvlášť inhibítorov sodíkovo - glukózového kontransportéra 2 (SGLT2i) alebo agonistov receptora pre glukagónu podobný peptid 1 (GLP1-RA). Pacienti s potvrdeným prediabetickým stavom alebo PTDM by mali byť odoslaní do starostlivosti diabetológa.
Centrálna obezita
Intenzívna zmena životného štýlu, znížený kalorický príjem, redukcia telesnej hmotnosti a cvičenie sú dobre overené kroky k prevencii DM2T u netransplantovanej populácie s dlhotrvajúcim dopadom. Pozornosť na prevenciu váhového prírastku môže byť ďalšou stratégiou k prevencii MS, hoci redukcia hmotnosti by nemala byť odporúčaná v tesnom potransplantačnom období z dôvodu správneho zhojenia rany. Napriek tomu, že aktivita môže byť včasne limitovaná pre bolesť a stratu svalovej hmoty, modifikácia životného štýlu zahŕňajúca referenciu pacienta dietológovi, cvičebný program, poradenstvo k redukcii telesnej hmotnosti, je benefitom pre príjemcov po TO a mala by byť inkorporovaná do preventabilných opatrení [31]. Práve fyzická aktivita je najdôležitejším nefarmakologickým prostriedkom k zníženiu KV-rizika a pozitívnemu ovplyvneniu renálnej funkcie. Viacero faktorov, ktoré u pacientov v hemodialyzačnom (HD) programe podmieňujú tendenciu k sedavému spôsobu života (anémia, urémia, 12 hodín týždenne na HD, redukovaná sekrécia pohlavných hormónov, malnutrícia), môže byť odstránených práve TO. Napriek tomu možné nežiaduce účinky imunosupresie, rekurentné infekcie, kostné a svalové zmeny môžu napomáhať k inaktivite aj po TO [32]. Odporúčania KDIGO (Kidney Disease – Improving Global Outcomes) z roku 2012 pre vyšetrovanie a manažment chronickej choroby obličiek (CKD – Chronic Kidney Disease) navrhujú pacientom s CKD vykonávať aeróbnu fyzickú aktivitu minimálne 30 minút stredného stupňa 5-krát týždenne (rozsah korešponduje s 450 až 750 MET minút za týždeň) [33].
Artériová hypertenzia
U všetkých pacientov po TO je nevyhnutná pravidelná kontrola krvného tlaku pri ambulantnom vyšetrení, ale aj v domácom prostredí. Práve vedenie si domáceho záznamníku krvného tlaku môže viesť k lepším terapeutickým rozhodnutiam s jeho lepšou kontrolou. Podľa najnovších odporúčaní KDIGO z roku 2021 by mali byť pacienti s potvrdenou hypertenziou liečení antihypertenzívnymi preparátmi s cieľovými hodnotami tlaku < 130/80 mm Hg. Liekmi prvej voľby sú dihydropyridínové blokátory kalciových kanálov (predovšetkým amlodipín) a blokátory receptorov angiotenzínu II, u ktorých bola potvrdená signifikantná redukcia straty štepu [34]. Z doplnkových preparátov, bežne používaných v praxi, možno použiť betablokátory (preferovaný je karvedilol), alfablokátory, centrálne pôsobiace hypotenzíva, či v indikovaných prípadoch diuretiká.
Dyslipidémia
Pacienti po TO patria do skupiny s vysokým rizikom KVO, a preto by im mal byť kontrolovaný lipidový profil v pravidelných intervaloch. Základným preventívnym opatrením je diéta s nízkym obsahom živočíšnych tukov s cieľom redukovať príjem nasýtených mastných kyselín a cholesterolu, nízky príjem jednoduchých cukrov, alkoholu, naopak preferovať príjem polynenasýtených mastných kyselín z rastlinných zdrojov či rybieho tuku a zakomponovať do stravy dostatok zeleniny a ovocia [35]. V prípade, že nie sú efektívne režimové a diétne opatrenia, je indikovaná hypolipidemická liečba. Preparátmi prvej voľby sú statíny. Veľká randomizovaná placebom kontrolovaná štúdia ALERT (The Assessment of Lescol in Renal Transplantation) na vzorke 2 102 pacientov po TO potvrdila signifikantný vplyv fluvastatínu na primárny cieľ (smrť z kardiálnej príčiny, nefatálny infarkt myokardu) v porovnaní s placebom. Aj napriek tomu, že dnes je preferovaným CNI takrolimus, menšie percento pacientov je nastavených na cyklosporín, ktorý môže interagovať so statínmi a viesť k myopatii, či rabdomyolýze. V takomto prípade je potrebné preferovať nižšiu dávku statínu so starostlivým monitorovaním týchto pacientov. V prípade, že nie je dosiahnutý adekvátny efekt monoterapie, možno pristúpiť ku kombinovanej liečbe. Ezetimib bol viacerými štúdiami vyhodnotený ako bezpečný a účinný v rámci kombinovanej hypolipidemickej liečby po TO. Zároveň sa nedostáva do interakcie s CNI a neovplyvňuje ich hladinu v sére [36].
Záver
Pacienti po TO sú vystavení vysokému riziku vývoja MS, čo odzrkadľuje aj jeho vysoká prevalencia v danej populácii. MS u príjemcov obličky významne ovplyvňuje potransplantačný priebeh, nakoľko je asociovaný s KV-morbiditou, PTDM, deterioráciou funkcie štepu a stratou štepu. U každého transplantovaného pacienta je preto nevyhnutnosťou vyšetrovanie parametrov metabolizmu glukózy vrátane OGTT, tukov, kontrola telesnej hmotnosti, obvodu pása a krvného tlaku s iniciáciou agresívnej modifikácie životného štýlu u pacientov s detekovanými komponentami MS, či PTDM. Je však nesmierne dôležité, aby práve pacienti s normálnou glukózovou toleranciou neunikali dostatočnej pozornosti a aby dôraz na životný štýl bol základným kameňom prevencie rovnako ako v bežnej populácii.
Práca bola podporená projektom v rámci operačného programu „Výskum a inovácie Európskeho fondu regionálneho rozvoja“ ITMS2014+:313011V344 „Dlhodobý strategický výskum prevencie, intervencie a mechanizmov obezity a jej komorbidít“.
MUDr. Matej Vnučák, PhD.
www.unm.sk
Doručené do redakcie 26. 8. 2021
Prijaté po recenzii 13. 9. 2021
Zdroje
1. Swarup S, Zelster R. Metabolic Syndrome. [Updated 2021 Aug 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing: 2021.
2. Saklayen MG. The Global Epidemic of the Metabolic Syndrome. Curr Hypertens Rep 2018;20(2): 12. Dostupné z DOI: <http://dx.doi.org/10.1007/s11906–018–0812-z>.
3. Chen G, Gao L, Li X et al. Effects of exercise training on cardiovascular risk factors in kidney transplant recipients: a systematic review and meta-analysis. Ren Fail 2019; 41(1): 408–418. Dostupné z DOI: <http://dx.doi.org/10.1080/0886022X.2019.1611602>.
4. Courivaud C, Kazory A, Simula-Faivre D et al. Metabolic syndrome and atherosclerotic events in renal transplant recipients. Transplantation 2007; 83(12): 1577–1581. Dostupné z DOI: <http://dx.doi.org/10.1097/01.tp.0000266898.93894.3d>.
5. Porrini E, Delgado P, Bigo C et al. Impact of metabolic syndrome on graft function and survival after cadaveric renal transplantation. Am J Kidney Dis 2006; 48(1): 134–142. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2006.04.078>.
6. Perdrollo E, Correa C, Nicoletto BB et al. Effects of metabolic syndrome on kidney transplantation outcomes : a systematic review and meta-analysis. Transpl Int 2016; 29(10): 1059–1066. Dostupné z DOI:<http://dx.doi.org/10.1111/tri.12805>.
7. Cai R, Wu M, Wing Y et al. Pretransplant metabolic syndrome and its components predict post-transplantation diabetes mellitus in Chinese patients receiving a first renal transplant. Ther Clin Risk Manag 2019; 15 : 497–503. Dostupné z DOI: <http://dx.doi.org/10.2147/TCRM.S190185>.
8. Sharif A, Hecking M, de Vries J et al. Proceedings from an international consensus meeting on posttransplantation diabetes mellitus: recommendations and future directions. Am J Transplant 2014; 14(9): 1992–2000. Dostupné z DOI: <http://dx.doi,org/10.1111/ajt.12850>.
9. Torres A, Hernández D, Moreso F et al. Randomized controlled trial assessing the impact of tacrolimus versus cyclosporine on the incidence of posttransplant diabetes mellitus. Kidney Int Rep 2018; 3(6): 1304–1315. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ekir.2018.07.009>.
10. Van Laecke S, Caluwe R, Huybrechts I et al. Effect of Magnesium Supplements on Insulin Secretion After Kidney Transplantation: A Randomized Controlled Trial. Ann Transplant 2017; 22 : 524–531. Dostupné z DOI: <http://dx.doi.org/10.12659/aot.903439>.
11. Rodriguez-Rodriguez A, Trinanes J, Porrini E et al. Glucose homeostasis changes and pancreatic β‐cell proliferation after switching to cyclosporin in tacrolimus‐induced diabetes mellitus. Nefrologia 2015 ; 35(3): 264–272. Dostupné z DOI: <http://dx.doi.org/10.1016/j.nefro.2015.05.007>.
12. Trinanes J, Rodriguez-Rodriguez A, Brito-Casillas Y et al. Deciphering Tacrolimus-Induced Toxicity in Panreatic b Cells. Am J Transplant 2017; 17(11): 2829–2840. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.14323>
13. Johnston O, Rose C, Webster AC et al. Sirolimus is associated with new-onset diabetes in kidney transplant recipients.J Am Soc Nephrol 2008; 19(7): 1411–1418. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2007111202>.
14. Sgambat K, Clauss S, Moudgil A et al. Cardiovascular effects of metabolic syndrome after transplantation: convergence of obesity and transplant-related factors. Clin Kidney J 2018; 11(1): 136–146. Dostupnéz DOI: <http://dx.doi.org/10.1093/ckj/sfx056>.
15. Delautre, A, Chantrel, F, Dimitrov Y et al. Metabolic syndrome in haemodialysis patients: prevalence, determinants and association to cardiovascular outcomes. BMC Nephrol 2020; 21(1):343. Dostupné z DOI: <http://dx.doi.org/10.1186/s12882–020–02004–3>.
16. Young DO, Lund RJ, Haynatzki G et al. Prevalence of the metabolic syndrome in an incident dialysis population. Hemodial Int 2007; 11(1): 86–95. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1542–4758.2007.00158.x>.
17. Bayer ND, Cochetti PT, Kumar MS et al. Association of metabolic syndrome with development of new-onset diabetes after transplantation. Transplantation 2010; 90(8): 861–866. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181f1543c>.
18. Hricik DE. Metabolic syndrome in kidney transplantation: management of risk factors. Clin J Am Soc Nephrol 2011; 6(7): 1781–1785. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.01200211>.
19. Dedinská I, Miklušica J, Laca L et al. Transplantácia obličky a metabolická syndróm. Forum Diab 2016; 5(2): 94–98.
20. Dedinská I, Baltesová T, Beňa L et al. Incidence of Diabetes Mellitus After Kidney Transplantation in Slovakia: Multicentric, Prospective Analysis. Transplant Proc 2016; 48(10): 3292–3298. Dostupné z DOI:<http://dx.doi.org/10.1016/j.transproceed.2016.09.041>.
21. Piotti G, Gandolfini I, Paqlmisano A et al. Metabolic risk profile in kidney transplant candidates and recipients. Nephrol Dial Transplant 2019; 34(3): 388–400. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfy151>.
22. Chakkera HA, Weil EJ, Swanson CM et al. Pretransplant risk score for new-onset diabetes after kidney transplantation. Diabetes Care 2011; 34(10): 2141–2145. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–0752>.
23. Hecking M, Werzowa J, Haidinger M et al. Novel views on new-onset diabetes after transplantation: development, prevention and treatment. Nephrol Dial Transplant 2013; 28(3): 550–566. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfs583>.
24. AlShelleh S, AlAwwa I, Oweis A et al. Prevalence of metabolic syndrome in dialysis and transplant patients. Diabetes Metab Syndr Obes 2019; 12 : 575–579. Dostupné z DOI: <http://dx.doi.org/10.2147/DMSO.S200362>.
25. Despres J, Lemieux I. Abdominal obesity and metabolic syndrome. Nature 2006; 444(7121): 881–887. Dostupné z DOI: <http://dx.doi.org/10.1038/nature05488>.
26. Dedinská I, Mäčková N, Kantárová D et al. Leptin – A new marker for development of post-transplant diabetes mellitus? J Diabetes Complications 2018; 32(9): 863–869. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdiacomp.2018.07.002>.
27. de Vries AP, Bakker SJ, Bakker SJ et al. Metabolic syndrome is associated with impaired long-term renal allograft function; not all components contribute equally. Am J Transplant 2004; 4(10): 1675–1683. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2004.00558.x>.
28. Jenssen T, Hartmann A. Post-transplant diabetes mellitus in patients with solid organ transplants. Nat Rev Endocrinol 2019; 15(3): 172–188. Dostupné z DOI: <http://dx.doi.org/10.1038/s41574–018–0137–7>.
29. Jenssen T, Hartmann A. Emerging treatments for post-transplantation diabetes mellitus. Nat Rev Nephrol 2015; 11(8): 465–477. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneph.2015.59>.
30. Eide IA, Halden TA, Hartmann A et al. Mortality risk in post-transplantation diabetes mellitus based on glucose and HbA1c diagnostic criteria. Transpl Int 2016; 29(5): 568–578. Dostupné z DOI: <http://dx.doi.org/10.1111/tri.12757>.
31. Sharif A, Moore R, Baboolal K et al. Influence of lifestyle modification in renal transplant recipients with postprandial hyperglycemia. Transplantation 2008; 85(3): 353–358. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181605ebf>.
32. Carvalho EV, Reboredo MM, Gomes EP et al. Physical activity in daily life assessed by an accelerometer in kidney transplant recipients and hemodialysis patients. Transplant Proc 2014; 46(6): 1713–1717. Dostupné z DOI: <http://dx.doi.org/10.1016/j.transproceed.2014.05.019>.
33. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Chapter 3: Management of progression and complications of CKD. Kidney Int Suppl 2013; 3(1): 73–90. Dostupné z DOI: <http://dx.doi.org/10.1038/kisup.2012.66>.
34. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney International 2021; 99(3 Suppl): S1-S87. Dostupné z DOI: <http://dx.doi.org/10.1016/j.kint.2020.11.003>.
35. Agarwal A, Prasad GV. Post-transplant dyslipidemia: Mechanisms, diagnosis and management. World J Transplant 2016; 6(1):125–134. Dostupné z DOI: <http://dx.doi.org/10.5500/wjt.v6.i1.125>.
36. Mikolasevic I, Žutelija M, Mavrinac V et al. Dyslipidemia in patients with chronic kidney disease: etiology and management. Int J Nephrol Renovasc Dis 2017; 10 : 35–45. Dostupné z DOI: <http://dx.doi.org/10.2147/IJNRD.S101808>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
2021 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Komponenty metabolického syndrómu ako rizikový faktor diabetes mellitus 2. typu
- Imunometabolický pohľad na komponenty metabolického syndrómu
- Diabetes mellitus a chronické srdcové zlyhávanie
- Obezita ako rizikový faktor fibrilácie predsiení a srdcového zlyhávania
- Metabolický syndróm po transplantácii obličky
- Metabolický syndróm a črevný mikrobióm
- Obezita a psoriáza: súčasný pohľad na problematiku
- IGlarLixi predstavuje v porovnaní s bifázickým inzulínom lepšiu voľbu pri intenzifikácii liečby bazálnym inzulínom
- Priaznivý vplyv gliflozínov aj na aterosklerózu?
- Perorálny semaglutid: budúcnosť agonizmu GLP1-receptorov?
- Výsledky štúdie DAPA-CKD v kontexte predchádzajúcich štúdií s gliflozínmi vo vzťahu k chronickému ochoreniu obličiek
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perorálny semaglutid: budúcnosť agonizmu GLP1-receptorov?
- Metabolický syndróm po transplantácii obličky
- Obezita ako rizikový faktor fibrilácie predsiení a srdcového zlyhávania
- Diabetes mellitus a chronické srdcové zlyhávanie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



