-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteoporóza a diabetes mellitus
Osteoporosis and diabetes mellitus
Osteoporosis is now recognized, along with cardiovascular and oncologic diseases for civilization disease. It is a globally significant growing health problem due to the high incidence of fractures contributes significantly to morbidity, mortality and increased healthcare costs. Its growth is exponential and is related, as with other lifestyle-related diseases, with increases in life expectancy of the population and lifestyle changes. There is a wealth of data confirming the high incidence of osteoporosis in patients with diabetes mellitus type 1 and also type 2. While in type 1 diabetes the major reason is low bone mass, patients with type 2 diabetes are at an increased risk despite increased bone mineral density (BMD) and this is caused by inferior quality of bone. The main problem in daily practice is how to evaluate the bone quality. We present the ability of Trabecular Bone score to assess the bone quality in T2DM. Although the relationship “osteoporosis – diabetes mellitus” are already subject to certain clearly defined will require even more monitoring, more-year prospective study to a large number of patients to clarify many still have unanswered questions. Nevertheless, from a clinical perspective while complex care for diabetic patients should be remembered that there is also a high risk of osteoporosis.
Key words:
bone quality – diabetes mellitus fractures – osteoporosis
Autoři: Peter Jackuliak; Juraj Payer
Působiště autorů: V. interná klinika LF UK a UN Bratislava, prednosta prof. MUDr. Juraj Payer, PhD., FRCP
Vyšlo v časopise: Forum Diab 2014; 3(3): 129-134
Kategorie: Hlavná téma
Souhrn
Osteoporóza sa dnes považuje spolu s kardiovaskulárnymi a onkologickými ochoreniami za civilizačnú chorobu. Predstavuje celosvetovo významne narastajúci zdravotný problém, ktorý vzhľadom na vysoký výskyt fraktúr výrazne prispieva k chorobnosti, úmrtnosti a zvyšuje náklady na zdravotnú starostlivosť. Jej nárast má exponenciálny charakter a súvisí, rovnako ako u iných civilizačných ochorení, s predlžovaním priemerného veku populácie a so zmenou životného štýlu. Existuje množstvo údajov potvrdzujúcich vysoký výskyt osteoporózy u pacientov s diabetes mellitus 1. aj 2. typu. Aj keď sa donedávna osteoporotická fraktúra nezaraďovala medzi tradičné komplikácie diabetes mellitus, už dávno sa vedelo, že diabetici tak 1. ako aj 2. typu majú zvýšené riziko osteoporózy. U diabetikov 1. typu je dôvodom znížená kostná denzita, u diabetikov 2. typu sa vzhľadom na normálnu až vyššiu kostnú denzitu predpokladá porušená mikroarchitektonika kosti. Problémom ale ostáva zhodnotiť kvalitu kosti v reálnej praxi, jednou z modalít je zhodnotiť kvalitu kosti pomocou TBS (Trabecular Bone Score) najmä u pacientov s diabetom 2. typu. Aj keď vo vzťahu osteoporóza – diabetes mellitus sú už dnes jasne definované vzťahy, určite budú potrebné ešte ďalšie sledovania, prospektívne viac-ročné štúdie na veľkom počte pacientov na objasnenie mnohých ešte dodnes nezodpovedaných otázok. Napriek tomu z klinického hľadiska pri komplexnej starostlivosti o diabetikov netreba zabúdať aj na riziko osteoporózy.
Kľúčové slová:
diabetes mellitus – fraktúry – kvalita kosti – osteoporózaOsteoporóza
Podľa definície Svetovej zdravotníckej organizácie (SZO/WHO) z roku 1994 je osteoporóza metabolické ochorenie kostí, ktoré spôsobuje úbytok množstva kostnej hmoty, poruchu mikroštruktúry s následným zvýšením fragility kosti a rizika zlomenín už po minimálnej traume [1]. Ide o zlomeniny vznikajúce na podklade neadekvátne nízkej energie úrazu. Typické lokality sú stavce a dlhé kosti, najmä horná tretina stehennej kosti a dolná tretina vretennej kosti.
Osteoporóza sa dnes považuje spolu s kardiovaskulárnymi a onkologickými ochoreniami za civilizačnú chorobu. Predstavuje celosvetovo významne narastajúci zdravotný problém, ktorý vzhľadom na vysoký výskyt fraktúr, výrazne prispieva k chorobnosti, úmrtnosti a zvyšuje náklady na zdravotnú starostlivosť. Jej nárast má exponenciálny charakter a súvisí, rovnako ako u iných civilizačných ochorení, s predlžovaním priemerného veku populácie a zmenou životného štýlu [2]. Takmer každá druhá žena kaukazoidnej rasy po menopauze utrpí niektorú z typických osteoporotických zlomenín (predlaktie, chrbtica, proximálny femur). Zlomeniny u starších pacientov majú často závažné dôsledky, a výrazne tak ovplyvňujú kvalitu ich života. Podľa najaktuálnejšieho reportu IOF z roku 2013 malo v roku 2010 v celej Európskej únii 22 miliónov žien a 5,5 miliónov mužov osteoporózu. Do roku 2025 má tento počet narásť až na 33,9 miliónov mužov a žien trpiacich na osteoporózu, čo predstavuje nárast o 23 %. Podľa analýz údajov jednotlivých krajín vzniklo v Európskej únii za rok 2010 asi 3,5 miliónov fraktúr (čiže 9 556 fraktúr za deň a 390 fraktúr za hodinu), pričom asi 610 000 predstavovali zlomeniny bedra, 520 000 vertebrálne zlomeniny, 560 000 zlomeniny zápästia a asi 1 800 000 iné fraktúry (panva, rebrá, humerus, predkolenie, klavikula, skapula, sternum a iné zlomeniny stehnovej kosti) [3].
Osteoporóza a diabetes mellitus
Na základe klinickej praxe a mnohých literárnych údajov je známe, diabetes mellitus 1., ale aj 2. typu (DM1T, DM2T) je asociovaný so zvýšeným rizikom osteoporotických fraktúr ako komplikácie zle kompenzovaného, dlho trvajúceho DM. Mechanizmus úbytku kostnej hmoty u diabetikov je multifaktoriálny, závisí od typu DM (1. typ vs 2. typ) a prítomnosti diabetických komplikácií. Je známe, že DM1T závažnejšie postihuje skelet než DM2T, najmä v dôsledku nedostatku inzulínu a jeho anabolického vplyvu na kosť [4]. Kostná denzita u DM2T zostáva zachovaná, napriek tomu ale „nechráni“ pred osteoporotickými fraktúrami, pretože je zmenená kvalita kosti. Viaceré prospektívne observačné štúdie preukázali, že riziko fraktúry pre daný vek (> 73 rokov) a hodnotu BMD podľa T-skóre je u diabetikov vyššie než u osôb bez DM [5].
U diabetikov je možné nájsť rôzne typy metabolického postihnutia kostí, okrem osteoporózy aj osteomaláciu, osteopetrózu či osteodystrofiu. Typické komplikácie nedostatočne kontrolovaného DM postihujúce skelet sú syndróm diabetickej nohy a Charcotova neuroartropatia, ktoré vedú k vysokému počtu chirurgických intervencií u diabetikov a častokrát aj amputáciám [6–8]. Avšak fraktúry v dôsledku nízkej kostnej denzity (fragility fractures) sa stali tiež často pozorovanou komplikáciou DM [9].
Rizikové faktory pre vznik osteoporózy a pádov u diabetikov ukazuje tab. 1.
Tab. 1. Rizikové faktory vzniku osteoporotických fraktúr a pádov u diabetikov. Upravené podľa [10]. ![Rizikové faktory vzniku osteoporotických fraktúr a pádov u diabetikov. Upravené podľa [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/658ff89e06a848d6fa9d60887676102f.png)
Ďalšou závažnou komplikáciou je horšia rekonvalescencia pacientov s DM po fraktúre. U pacientov s DM2T po fraktúre bedra bol 2-násobne vyšší výskyt kardiovaskulárnych komplikácií než u nediabetickej populácie, čo viedlo k predĺženiu hospitalizácie (v priemere o 4 dni) [11]. Pacienti s DM majú taktiež vyššie riziko infekcií operačnej rany, horšieho hojenia rany či vzniku pseudoartrózy [12].
Ako vieme, z etiopatogenetického hľadiska rozlišujeme dva základné typy osteoporózy. Primárnu osteoporózu, ktorá zahŕňa dva typy (postmenopauzálnu a senilnú osteoporózu), a sekundárnu osteoporózu, ktorá vzniká ako následok iného ochorenia, resp. liečby [13]. Medzi časté príčiny sekundárnej osteoporózy patria ochorenia gastrointestinálneho traktu, pankreasu, pečene a obličiek, endokrinné a reumatické ochorenia a liekmi indukovaná osteoporóza. Práve tieto ochorenia sa tiež často vyskytujú u pacientov s DM, čo tiež vysvetľuje riziko osteoporózy u diabetikov. Rozsah liekov, ktoré sú asociované so zvýšeným rizikom vzniku osteoporotickej fraktúry, sa postupne rozširuje (tab. 2). Rozličné epidemiologické štúdie, rozsiahle randomizované štúdie, menšie observačné štúdie a metaanalýzy preukázali zvýšenú fragilitu kostí a vyššiu incidenciu fraktúr u diabetikov 2. typu dlhodobo užívajúcich tiazolidíndióny – glitazóny.
Tab. 2. Sekundárna osteoporóza vyvolaná farmakoterapiou [14] ![Sekundárna osteoporóza vyvolaná farmakoterapiou [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5ec8dc3698a6dc894167aa932ea91e8a.png)
Exituje veľa patomechanizmov, ktoré sa pokúšajú vysvetliť zvýšené riziko osteoporotických fraktúr u pacientov s DM2T. Mnohé štúdie hovoria o zmenách v markeroch kostného obratu ako aj v humorálnom pôsobení faktorov a látok produkovaných tukovým tkanivom. Osteokalcín je dôležitý faktor, ktorý sa považuje za spojku medzi metabolizmom glukózy a osteoblastogenézou [15]. Aktivácia inzulínového receptoru na osteoblaste zvyšuje produkciu a aktivitu osteokalcínu (post-translačná gama-karboxylácia za vzniku aktívnej formy osteokalcínu) [16]. Osteokalcín taktiež sprostredkuje dôležité signály z kostí k B-bunkám, aj keď jeho úloha u ľudí ešte nie je presne objasnená. Osteokalcín (OC) je proteín produkovaný osteoblastmi, ktoré majú rozličné hormonálne (endokrinné) účinky [17]. Početné štúdie na animálnych modeloch preukázali, že osteokalcín zasahuje jednak do kostného ako aj do glukózového metabolizmu. Štúdie na OC-deficitných myšiach preukázali, že osteokalcín ako hormón zlepšuje metabolizmus glukózy a redukuje tukovú hmotu [18]. Podávanie rekombinantného dekarboxylovaného osteokalcínu ovplyvňuje génovú expresiu B-buniek a adipocytov (vrátane expresie adiponektínu) a vedie k prevencii vzniku metabolických porúch, obezity a hyperglykémie [19]. Vysoké koncentrácie glukózy vedú k zmenám expresie osteokalcínu a jeho sekréciu z osteoblastov a liečba hyperglykémie u DM2T viedla k zvýšeniu koncentrácie osteokalcínu u týchto pacientov [20]. Súčasné štúdie ukazujú, že negatívna korelácia existuje medzi hladinami osteokalcínu a glykemickou kompenzáciou [21]. Nie je jasné, či hyperglykémia sama o sebe je za to zodpovedná, alebo len ak je spojená s absolútnym alebo relatívnym nedostatkom inzulínu. Kostné bunky majú receptory pre inzulín a IGF1. In vitro štúdie preukázali, že inzulín zvyšuje proliferáciu a funkciu osteoblastov. U zvierat nedostatok inzulínu potláča aktivitu osteoblastov. Hladiny IGF1 majú tendenciu byť nízke u pacientov so zle kontrolovaným DM a zlepšujú sa s lepšou kontrolou glykémie. Korelácia medzi IGF1 a hladinami osteokalcínu bola preukázaná aj u DM1T aj u DM2T.
Na základe rozličných klinických štúdií sú výsledky zmien hladín markerov kostného obratu u diabetikov s DM2T kontroverzné a nejednoznačné [21]. Veľká väčšina štúdií preukázala nízke hladiny osteokalcínu v porovnaní s nediabetickou populáciou [22,23]. Autori Oz et al našli aj nižšie hodnoty kostnej alkalickej fosfatázy u pacientiek s DM2T, pričom ale u mužov tento vzťah nebol potvrdený [24]. Iní autori zase zistili vyššie hladiny alkalickej fosfatázy u diabetickej populácie [25]. Čo sa týka markerov osteoresorpcie, najmä CTx, výsledky sú taktiež nejednoznačné [26].
Hoci vitamín D je známy približne 80 rokov, jeho aktívny metabolit 1,25(OH)2D3 bol objavený pred menej ako 25 rokmi. Nedostatok vitamínu D je veľmi častým a závažným rizikovým faktorom osteoporózy. Vitamín D je syntetizovaný v koži účinkom ultrafialového žiarenia na 7-dehydrocholesterol. Vitamín D (cholekalciferol) sa viaže na plazmatické bielkoviny a je transportovaný do pečene, kde podlieha hydroxylácii na 25-hydroxycholekalciferol. Takto naviazaný na plazmatické nosiče je transportovaný do obličky, v ktorej prebieha jeho ďalšia hydroxylácia. Hladina hlavného aktívneho metabolitu vitamínu 1,25(OH)2D3 je závislá od koncentrácie kalcia, fosforu a PTH. Nízka hladina kalcia, fosforu a vysoká hladina PTH stimulujú produkciu 1,25(OH)2D3 naopak vysoké hladiny kalcia, fosforu a nízka hladina PTH redukujú jeho syntézu. Tab. 3 uvádza vplyv sérovej hladiny vitamínu D na kostný metabolizmus [27].
Tab. 3. Hladiny vitamínu D a ich vplyv na kosť 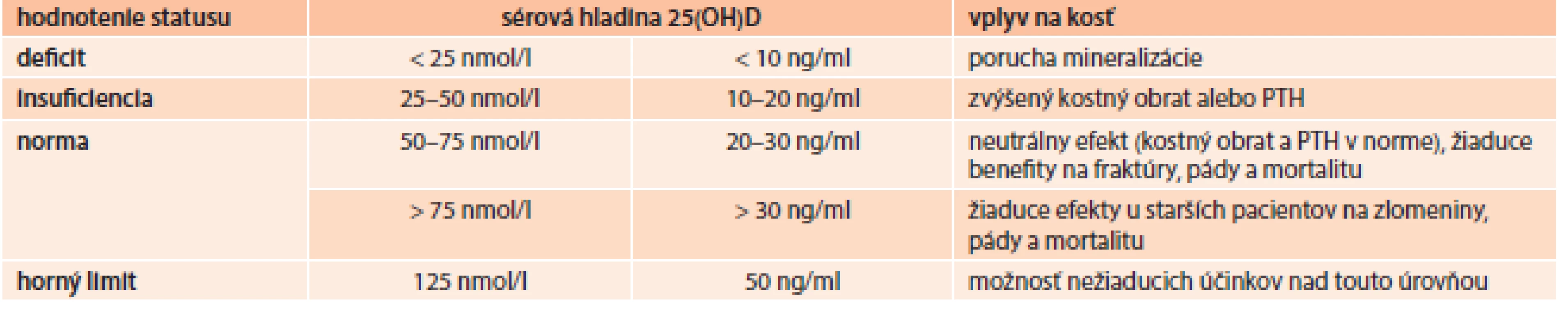
Osobitne treba spomenúť zvýšené riziko pádov u diabetikov. Pády sú vo všeobecnosti považované za pomerne častý rizikový faktor a mechanizmus vzniku osteoporotickej fraktúry. Zvýšené riziko pádov je tak u DM1T aj DM2T. Príčiny vzniku pádov uvádza tab. 4.
Tab. 4. Rizikové faktory pádov u pacientov s diabetes mellitus. Upravené podľa [28] ![Rizikové faktory pádov u pacientov s diabetes mellitus. Upravené podľa [28]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/60b0c83c960b7bddde5b6de3091a030a.png)
Je známe, že viac ako 30 % ľudí nad 65 rokov a starších spadne minimálne 1-krát ročne a so stúpajúcim vekom toto riziko narastá. Pády sú najčastejšou príčinou smrteľných úrazov u ľudí nad 65 rokov, pričom viac než 85 % všetkých fraktúr vzniká pri páde. Pády súvisiace s vekom tesne korelujú s predčasnou a nadmernou stratou mobility, invaliditou, fraktúrami, umiestnením v domoch opatrovateľskej služby a veľmi často aj úmrtím [29].
Diagnostika osteoporózy u diabetikov
V diagnostike osteoporózy okrem anamnézy a fyzikálneho vyšetrenia využívame niektoré laboratórne a zobrazovacie vyšetrovacie metódy (tab. 5) [30,31]. Hlavný význam anamnézy je v stanovení rizikových faktorov fraktúry. Podľa aktuálnych odporúčaní National Osteoporosis Foundation (NOF) je definovaných 79 stavov, chorôb a liekov, ktoré spôsobujú alebo potencujú vznik osteoporózy a 25 rizikových faktorov pádov [32]. Základným a najrozšírenejším diagnostickým nástrojom sú ale zobrazovacie vyšetrovacie metódy – röntgenologické vyšetrenie (na vylúčenie prítomnosti fraktúr) a kostná denzitometria na stanovenie kostnej hustoty (lumbálna chrbtica, proximálny femur, predlaktie, päta) [33].
Tab. 5. Diagnostika a diferenciálna diagnostika osteoporózy 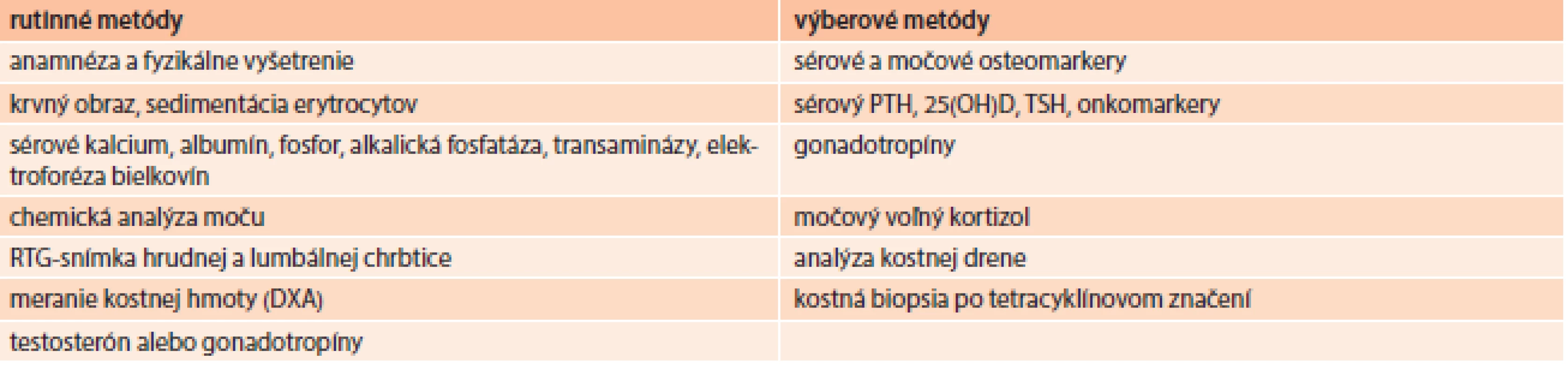
DXA – dual energy X-ray absorptiometry (denzitometria) PTH – parathormón 25(OH)D – 25-hydroxy-vitamín D TSH – tyreostimulačný hormón Zlatým štandardom v diagnostike osteoporózy je ale denzitometrické stanovenie hodnoty kostnej hustoty vyjadrenej ako T-skóre. Vyjadruje počet smerodajných odchýlok (SD) od denzity mladých zdravých jedincov rovnakého pohlavia. Pri hodnotení kostnej denzity využívame klasifikáciu WHO (tab. 6), podľa ktorej T-skóre menej ako -2,5 SD zodpovedá už osteoporóze. Toto hodnotenie však platí pre ženy po menopauze a mužov nad 65 rokov [34].
Tab. 6. WHO klasifikácia hodnotenia T-skóre 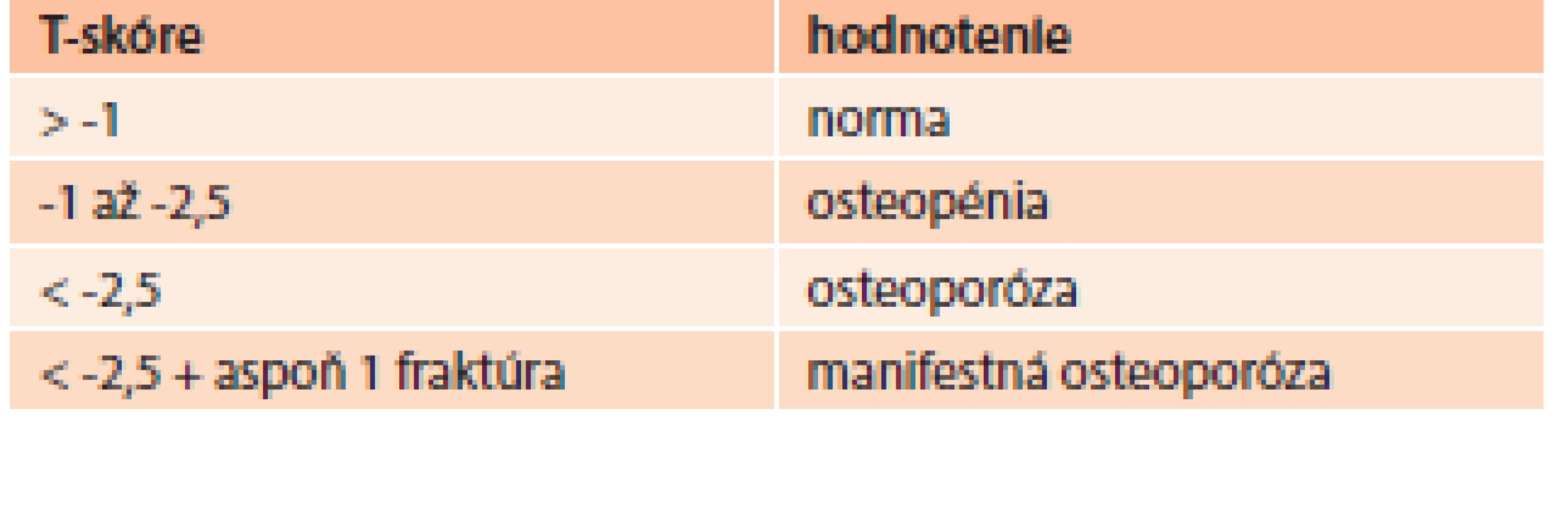
Kvalita kosti u diabetikov
Z pohľadu rizika osteoporotickej fraktúry u pacienta s DM nemožno hodnotiť len jednu kvalitu – BMD, a podľa nej posudzovať úroveň rizika vzniku fraktúry. Kosť má aj charakteristickú štruktúru (architektúru), a tá je tvorená z komplikovaných organických a anorganických zlúčenín, ktoré podmieňujú biomechanické vlastnosti kosti [35].
Pod kvalitou kosti sa v súčasnosti rozumie [36]:
- architektonika kosti
- mineralizácia kosti podmieňujúca kostnú denzitu
- organická matrix s kolagénom
- stav poškodenia kortikálnej a trabekulárnej kosti
Denzitometria je štandardná diagnostická metóda, ktorá dokáže stanoviť kostnú hustotu (bone mineral density) a identifikovať pacientov s osteoporózou [37]. Neposkytuje ale informáciu o kvalite kosti, ďalšom dôležitom parametre pevnosti kosti. Pri posudzovaní kvality kosti je dôležité poznať jej mikroarchitektoniku, ktorá prispieva k mechanickej pevnosti kosti, a teda schopnosti kosti „odolať“ tlaku a vzniku fraktúry. Strata kostnej hmoty pri osteoporóze vedie aj k poškodeniu kostnej architektoniky – zníženie počtu trabekúl špongióznej časti kosti, zväčšenie vzdialenosti medzi trabekulami, strata konektivity trabekúl. Stenčenie kortikálnej kosti a zvýšenie porozity trabekulárnej kosti, vedú v konečnom dôsledku k fragilite (krehkosti) kosti. Preto sa osteoporotická kosť nazýva aj „porózna“ [38]. Podľa najnovších štúdií vyplýva, že pevnosť kosti závisí nielen od BMD, ale aj od kvality kosti. Kvalita kosti je založená na vlastnostiach, ktoré bránia zlomenine kosti – jej mikroarchitektúra, kvalita kolagénu, veľkosť minerálnych kryštálov a rýchlosť kostného obratu. Kvalita kosti je zatiaľ v bežnej klinickej praxi ťažko merateľný parameter. MRI a HRCT síce dávajú informáciu o niektorých parametroch kvality kosti, no vzhľadom na ich cenu a radiačnú záťaž nie je možné očakávať ich širšie uplatnenie. Použitie software hodnotiaceho trabekulárne kostné skóre – TBS (Trabecular Bone Score) pri použití DXA-metódy je prínosom v oblasti neinvazívneho klinického hodnotenia mikroarchitektúry kosti. Jedná sa o hodnotenie priemerného výskytu lokálnych variácií stupňov sivej v 2D-projekcii snímok. Môže byť porovnateľné s BMD, pretože môže hodnotiť rovnakú oblasť. Základným princípom TBS je prevedenie získaného údaja o obsahu minerálu v malom úseku (ako keby išlo o meranie v jednom bode), do rôznych stupňov sivej farby, a to potom umožňuje rozlíšenie štrukturálnych zmien. Toto dokážeme získať z existujúcich denzitometrických snímok u jedného pacienta. A práve TBS má dokázaný vzťah ku kostnej mikroarchitektonike. TBS má pozitívnu koreláciu s počtom trabekúl, ich konektivitou a naopak negatívne koreluje s priemerným počtom otvorov medzi kostnými trámcami. Čiže vyššia hodnota TBS znamená „hustejšiu“ mikroarchitektúru, lepšiu konektivitu trámcov s malými priestormi medzi trámcami. Naopak, nízka hodnota TBS znamená, že mikroarchitektonika je porušená, priestory medzi trámcami sú väčšie [39,40].
Prevencia a liečba osteoporózy u pacientov s DM
Prevenciou osteoporózy a následne aj osteoporotických fraktúr je vhodné sa začať zaoberať nielen u pacientov s prítomnými rizikovými faktormi osteoporózy, ale aj u rizikových pacientov – diabetikov bez osteoporotickej zlomeniny. V rámci preventívnych opatrení je na začiatku najdôležitejšia prevencia samotných rizikových faktorov (fyzická inaktivita, nedostatočný prívod kalcia v potrave, porucha jeho resorpcie v gastrointestinálnom trakte, zvýšená exkrécia v obličkách, fajčenie, alkohol, užívanie niektorých liekov, ochorenia vedúce k sekundárnej osteoporóze). Ďalej je to fyzicky aktívny životný štýl, primeraná expozícia slnečnému žiareniu, suplementácia vitamínu D (najmä vo vyšších vekových skupinách), adekvátny príjem kalcia v diéte a u žien po menopauze s rizikovými faktormi vzniku osteoporózy, respektíve denzitometricky verifikovanou zníženou kostnou denzitou (osteopénia) a klimakterickým syndrómom, je vhodné zvážiť možnosť hormonálnej substitučnej liečby (pokiaľ nie je kontraindikovaná) [41].
Cieľom terapie osteoporózy je predovšetkým redukcia rizika fraktúr. Pred zahájením liečby je potrebné vylúčiť sekundárnu osteoporózu a iné metabolické ochorenia kosti prejavujúce sa nízkou denzitou, tab. 7 [42].
Tab. 7. Účinok používaných prípravkov v liečbe osteoporózy 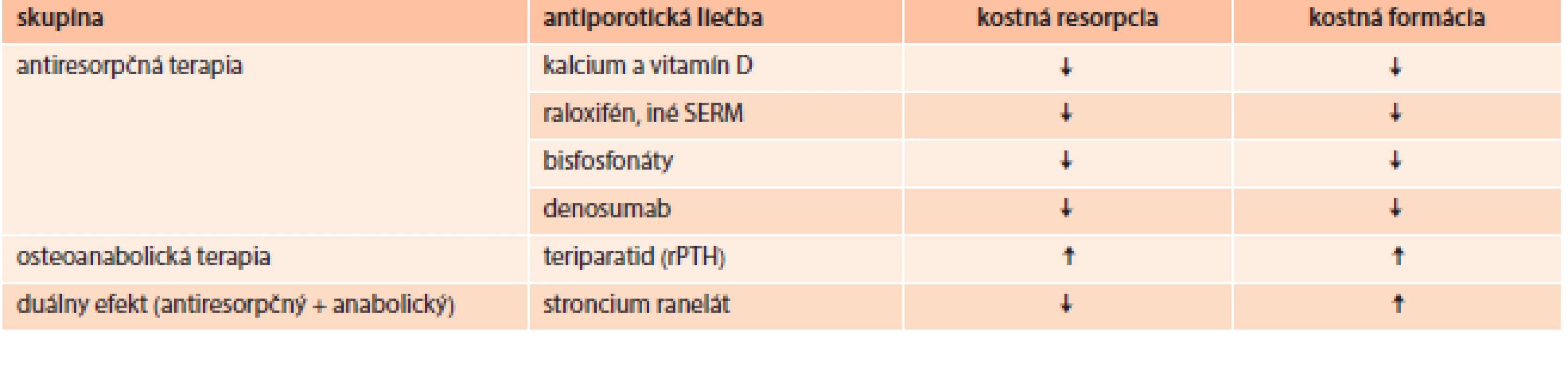
Pri záchyte osteopénie u diabetika indikujeme suplementáciu vápnikom (1 000–1 200 mg/deň) a vitamínom D (800–1 000 IU/deň), pri preukázanej osteoporóze pridávame antiporotickú terapiu podľa platných indikačných obmedzení [43,44].
Záver
DM1T, ale aj DM2T je asociovaný so zvýšeným rizikom osteoporotických fraktúr ako komplikáciou zle kompenzovaného, dlho trvajúceho DM. Pri komplexnej starostlivosti o diabetikov treba myslieť aj na riziko osteoporózy. Aj keď kostná denzita určená denzitometricky je v súčasnosti považovaná za dominantný prediktor a nástroj diagnostiky osteoporózy, treba si uvedomiť, že u DM2T nie je práve najvhodnejšou diagnostickou modalitou. Pri denzitometrickom vyšetrení mikroarchitektúra a geometria kosti unikajú detekcii. Problémom sa stáva, ako identifikovať rizikové skupiny pacientov s DM2T, keď u nich denzitometricky zistíme vyhovujúce hodnoty BMD. Existuje pomerne nová neinvazívna metodika hodnotenia kvality kosti diabetikov DM2T – tzv. TBS.
Prevenciou osteoporózy a následne aj osteoporotických fraktúr je vhodné totiž sa začať zaoberať nielen u pacientov s prítomnými rizikovými faktormi osteoporózy, ale aj u rizikových pacientov – diabetikov bez osteoporotickej zlomeniny. V rámci preventívnych opatrení je na začiatku najdôležitejšia prevencia samotných rizikových faktorov (fyzická inaktivita, nedostatočný prívod kalcia v potrave, porucha jeho resorpcie v gastrointestinálnom trakte, zvýšená exkrécia v obličkách, fajčenie, alkohol, užívanie niektorých liekov, ochorenia vedúce k sekundárnej osteoporóze). Ďalej je to fyzicky aktívny životný štýl, primeraná expozícia slnečnému žiareniu, suplementácia vitamínu D (najmä vo vyšších vekových skupinách), adekvátny príjem kalcia v diéte a u žien po menopauze s rizikovými faktormi vzniku osteoporózy, respektíve denzitometricky verifikovanou zníženou kostnou denzitou (osteopénia) a klimakterickým syndrómom je vhodné zvážiť možnosť hormonálnej substitučnej liečby (pokiaľ nie je kontraindikovaná). Je potrebné si uvedomiť, že kostná denzita priamo úmerne koreluje s úrovňou kompenzácie DM a s prítomnosťou jeho komplikácií. Jedným z prvých terapeutických krokov by mala byť adekvátna korekcia glykemickej kompenzácie, snaha zabrániť rozvinutiu diabetických komplikácií, resp. ich správna liečba ako ju ukazuje nasledujúci manažment osteoporózy u pacientov s DM:
- dobrá glykemická kompenzácia
- minimalizovať epizódy hypoglykémií
- pri liečbe nepoužívať glitazóny
- prevencia a manažment diabetických komplikácií (hlavne nefropatia)
- prevencia pádov
- adekvátna suplementácia vitamínu D a kalcia
- špecifická antiporotická terapia (antiresorpčná či osteoanabolická)
MUDr. Peter Jackuliak, PhD.
peter.jackuliak@gmail.com
prof. MUDr. Juraj Payer, PhD., FRCP
V. interná klinika Lekárskej fakulty UK a UN Bratislava
www.unb.sk
Doručené do redakcie 2. 9. 2014
Prijaté do tlače po recenzii 29. 9. 2014
Zdroje
1. National Osteoporosis Foundation. Clinician´s Guide to Prevention and Treatment of Osteoporosis. National Osteoporosis Foundation: Washington (DC) 2010. ISBN 978–0-9798989–9-0.
2. Jackuliak P. Základné princípy osteoporózy. In: Payer J, Borovský M et al. Osteoporóza u vybranných ochorení. Herba: Bratislava 2014 : 11–42. ISBN 978–80–89631–19–3.
3. Ivergård M, Svedbom A, Hernlund E et al. Epidemiology and Economic Burden of Osteoporosis in Slovakia. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporos 2013; 8(1–2): 178–186.
4. Hamann C, Kirschner S, Guenther KP et al. Bone, sweet bone – osteoporotic fractures in diabetes mellitus. Nat Rev Endocrinol 2012; 8(5): 297–305.
5. Schwartz AV, Vittinghoff E, Bauer DC et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA 2011; 305(21): 2184–2192.
6. O’Loughlin A, McIntosh C, Dinneen SF et al. Review paper: basic concepts to novel therapies: a review of the diabetic foot. Int J Low Extrem Wounds 2010; 9(2): 90–102.
7. Carnevale V, Romagnoli E, D’Erasmo E. Skeletal involvement in patients with diabetes mellitus. Diabetes Metab Res Rev 2004; 20(3): 196–204.
8. Sumpio BE. Foot ulcers. N Engl J Med 2000; 343(11): 787–793.
9. Vestergaard P, Rejnmark L, Mosekilde L. Diabetes and its complications and their relationship with risk of fractures in type 1 and 2 diabetes. Calcif Tissue Int 2009; 84(1): 45–55.
10. Brown SA, Sharpless JL. Osteoporosis: An Under-appreciated Complication of Diabetes. Clinical Diabetes 2004; 22(1): 10–19.
11. Norris R, Parker M. Diabetes mellitus and hip fracture: A study of 5966 cases. Injury 2011; 42(11): 1313–1316.
12. Retzepi M, Donos N. The effect of diabetes on osseous healing. Clin Oral Implants Res 2010; 21(7): 673–681.
13. Payer J, Baňárová A, Jackuliak P et al. Sekundárna osteoporóza. In: Payer J, Killinger Z et al. Osteoporóza. Herba: Bratislava 2012 : 131–156. ISBN 978–80–89171–94–1.
14. Ochodnický M. Vybrané metabolické ochorenia. In: Mokáň M, Martinka E, Galajda P et al. Diabetes mellitus a vybranné metabolické ochorenia. Vydavatelstvo P + M, Martin 2008. ISBN 9788096971398.
15. Clemens TL, Karsenty G. The osteoblast: an insulin target cell controlling glucose homeostasis. J Bone Miner Res 2011; 26(4): 677–668.
16. Ferron M, Wei J, Yoshizawa T. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism. Cell 2010; 142(2): 296–308.
17. Hauschka PV, Lian JB, Cole DE et al. Osteocalcin and matrix protein: vitamin K-dependent proteins in bone. Physiol Rev 1989; 69(3): 990–1047.
18. Lee NK, Sowa H, Hinoi E et al. Endocrine regulation of energy metabolism by the skeleton. Cell 2007; 130(3): 456–469.
19. Ferron M, Hinoi E, Karsenty G et al. Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice. Proc Natl Acad Sci USA 2008; 105(13): 5266–5270.
20. Inaba M, Terada M, Koyama H et al. Influence of high glucose on 1,25-dihydroxyvitamin D3-induced effect on human osteoblast-like MG-63 cells. J Bone Miner Res 1995; 10(7): 1050–1056.
21. Ducy P. The role of osteocalcin in the endocrine cross-talk between bone remodelling and energy metabolism. Diabetologia 2011; 54(6): 1291–1297.
22. Reyes-García R, Rozas-Moreno P, López-Gallardo G et al. Serum levels of bone resorption markers are decreased in patients with type 2 diabetes. Acta Diabetologica 2013; 50(1): 47–52.
23. Gerdhem P, Isaksson A, Akesson K et al. Increased bone density and decreased bone turnover, but no evident alteration of fracture susceptibility in elderly women with diabetes mellitus. Osteoporos Int 2005; 16(12): 1506–1512.
24. Oz G, Guven GS, Kilicarslan A et al. Evaluation of bone metabolism and bone mass in patients with type-2 diabetes mellitus. J Natl Med Assoc 2006; 98(10): 1598–1604.
25. Suzuki K, Kurose T, Takizawa M et al. Osteoclastic function is accelerated in male patients with type 2 diabetes mellitus: the preventive role of osteoclastogenesis inhibitory factor/osteoprotegerin (OCIF/OPG) on the decrease of bone mineral density. Diabetes Res Clin Pract, 2005; 68(2): 117–125.
26. Achemlal L, Tellal S, Rkiouak F et al. Bone metabolism in male patients with type 2 diabetes. Clin Rheumatol 2005; 24(5): 493–496.
27. Feldman D, Malloy PJ, Krishnan AV et al. Vitamin D: biology, action and clinical implications. In: Marcus R, Feldman D, Nelson DA et al (eds). Osteoporosis. 4th ed. Elsevier: Amsterdam 2013. ISBN 978–0-12–415853–5.
28. Chau DL, Edelman SV, Chandran M. Osteoporosis and Diabetes. Cur Diab Rep 2003; 3(1): 37–42.
29. American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults. Recommendations abstracted from the American Geriatrics Society Consensus Statement on vitamin D for Prevention of Falls and Their Consequences. J Am Geriatr Soc 2014; 62(1): 147–152.
30. Black DM, Steinbuch M, Palermo L et al. An assessment tool for predicting fracture risk in post-menopausal women. Osteoporos Int 2001; 12(7): 519–528.
31. Kanis JA, McCloskey EV, Johansson H et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2013; 24(1): 23–57.
32. National Osteoporosis Foundation. Clinician´s Guide to Prevention and Treatment of Osteoporosis. National Osteoporosis Foundation: Washington (DC) 2010. ISBN: 978–0-9798989–9-0.
33. Grados F, Fechtenbaum J, Flipon E et al. Radiographic methods for evaluating osteoporotic vertebral fractures. Joint Bone Spine 2009; 76(3): 241–247.
34. The International Society for Clinical Densitometry 2007 Official Positions and Pediatric Official Positions. Bone 2008; 43(6): 1115–1121.
35. Frost HM. Osteoporosis: A rationale for further definitions? Calcif Tissue Int 1998; 62(2): 89–94.
36. Seeman E, Delmas PD. Bone quality—the material and structural basis of bone strength and fragility. N Engl J Med 2006; 354(21): 2250–2261.
37. Raisz LG. Clinical Practice. Screening for osteoporosis. N Engl J Med 2005; 353(2): 164–171.
38. Seeman E, Delmas PD. Bone quality – the material and structural basis of bone strength and fragility. N Engl J Med 2006; 354(21): 2250–2261.
39. Roux JP, Wegrzyn J, Boutroy D et al. Relationship between trabecular bone score (TBS), bone mass and microarchitecture in human vertebrae: an ex vivo study. Osteoporos Int 2012; 23(Suppl 2): S327 (P597).
40. Hans D, Goertzen AL, Krieg MA et al. Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study. J Bone Miner Res 2011; 26(11): 2762–2769.
41. Payer J, Jackuliak P, Kollerová J et al. Prevencia a liečba osteoporózy. In: Payer J, Killinger Z et al. Osteoporóza. Herba: Bratislava 2012. 183–226. ISBN 978–80–89171–94–1.
42. Payer J, Jackuliak P, Killinger Z. Farmakoterapia osteoporózy. Klimakterická Medicína, 2011; 16(2): 7–13.
43. Keegan TH, Schwartz AV, Bauer DC et al. Effect of alendronate on bone mineral density and biochemical markers of bone turnover in type 2 diabetic women: the fracture intervention trial. Diabetes Care 2004; 27(7): 1547–1553.
44. Jackuliak P, Payer J. Osteoporóza a diabetes mellitus. Via Pract 2013; 10(3–4): 95–98.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek EditorialČlánek Metabolický syndróm a pečeň
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
2014 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Editorial
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
- Diabetes mellitus a ochorenia štítnej žľazy
- Vitamín D a metabolický syndróm u žien so syndrómom polycystických ovárií
- Metabolický syndróm a pečeň
-
Účinnosť a znášanlivosť vildagliptínu ako lieku druhej voľby v porovnaní s inými perorálnymi antidiabetikami pri diabetes mellitus 2. typu
Celosvetová observačná štúdia v podmienkach reálnej klinickej praxe (EDGE – výsledky subanalýzy pacientov zaradených na Slovensku) - Asociácia srdcového zlyhávania Európskej kardiologickej spoločnosti
- Montpellierska lekárska škola
- Autodidaktický test hodnotený kreditmi SACCME
- Register kľúčových slov, autorov a lektorov
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diabetes mellitus a ochorenia štítnej žľazy
- Metabolický syndróm a pečeň
- Poruchy metabolizmu cukrů u Cushingova syndromu
- Osteoporóza a diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



