-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Slovo o mikrobiomu: úvaha nad historií, současným stavem a pojmoslovím vzkvétajícího oboru
A word on the microbiome: considerations about the history, current state, and terminology of an emerging discipline
Since the beginning of the 21st century, a new discipline, microbiome science, has emerged as a key part of microbiology and related biomedical and ecological sciences. Microbiome science uses highly advanced molecular genetic and bioinformatic methods to study complex microbial communities. Unlike isolated microbes, microbial communities shaped by the environment, referred to as microbial consortia or microbiomes, follow their own laws that allow for significant functional specialization. The synthesis of multimethodology and multidisciplinary data enables microbiome science to move towards a holistic picture of the microbiome in an exceptionally effective way, but on the other hand, it burdens the field with terminological ambiguity of the key terms, which consequently need to be clearly codified in accordance with the international trends in the use of technical nomenclature. To this end, we present in our article the official position of the Czech Microbiome Society of the J. E. Purkyně Czech Medical Society on the use of appropriate Czech terms in both professional and general communication.
Autoři: V. Černý 1; J. Hrdý 1; J. Beneš 2; H. Tláskalová 1,3
Působiště autorů: Ústav imunologie a mikrobiologie, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, Praha 1; Klinika infekčních nemocí, Fakultní nemocnice Bulovka a 3. lékařská fakulta Univerzity Karlovy, Praha 2; Mikrobiologický ústav AV ČR, v. v. i., Praha 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 2, s. 112-118
Kategorie: Souhrnné sdělení
Souhrn
Od začátku 21. století se v mikrobiologii a souvisejících biomedicínských a ekologických oborech jako klíčový etabluje nový dílčí obor – mikrobiomová věda. Ta za použití vysoce pokročilých molekulárně genetických a bioinformatických metod zkoumá komplexní mikrobiální komunity. Tato určitým prostředím formovaná společenstva, označovaná jako mikrobiální konsorcia či mikrobiomy, mají svébytné zákonitosti, lišící se od těch platných pro izolované mikroby a umožňující funkčně významnou specializaci. Syntéza metodicky i oborově multidisciplinárních dat mikrobiomové vědě umožňuje výjimečně efektivně směřovat k holistickému obrazu mikrobiomové tematiky, na druhé straně však obor zatěžuje terminologickou nejednoznačností klíčových pojmů, jež je tak zapotřebí jasně kodifikovat v souladu s mezinárodními trendy v používání odborného názvosloví. Za tímto účelem předkládáme v našem článku oficiální stanovisko České mikrobiomové společnosti ČLS JEP o používání vhodných českých pojmů v odborné i popularizační komunikaci.
Klíčová slova:
Genomics – Microbiome – Organoids – microbiota – bioinformatic methods
Jednou z nejdynamičtěji se vyvíjejících oblastí mikrobiologie je v současnosti mikrobiomová věda. Toto odvětví z různých úhlů pohledu a za použití kombinace moderních vědeckých metod studuje složitá mikrobiální společenství, jejich kompozici i funkční aspekty. Výzkum takovýchto mikrobiálních konsorcií nachází odezvu především v medicíně a v experimentální biologii, ale i mimo ně. Mikrobiální vlivy jsou totiž v čím dál větším detailu a s čím dál vyšší komplexitou zkoumány také v oborech, jako jsou nauka o půdě, lesnictví, potravinářství či oceánografie. Díky potenciálu aplikovaného využití nově odhalovaných fenotypických, funkčních a metabolických vlastností mikrobiálních komunit je pak mikrobiomová věda přitažlivá také pro průmysl a zemědělství.
Mikroorganismy v rámci mikrobiomu vytvářejí vysoce propojený a organizovaný ekosystém, kde dochází k prolínání a navazování metabolických drah i prostorovému a funkčnímu vyhranění jednotlivých členů komunity. Ta jako celek získává nové metabolické možnosti, lepší schopnost adherence a perzistence v prostředí a obecně vyšší odolnost vůči různým stresorům; tyto vlastnosti jsou popisovány například u vysoce adhezivních mikrobiálních společenství obklopených komplexní matricí biopolymerů, tzv. biofilmů [1, 2]. Z medicínského hlediska se proto takováto společenství dostala do ohniska zájmu nejprve v rámci infekčního lékařství a terapie, a to především v kontextu bakteriálních infekcí (např. hojení chronických ran či šíření rezistentního fenotypu v rámci mikrobiálních společenství). Významné pokroky v prevenci a terapii nozokomiálních nákaz přinesl výzkum schopnosti mikrobů kontaminovat a kolonizovat různé druhy implantátů a zdravotnického materiálu i prostředí ve zdravotnických zařízeních (např. ve formě výše zmíněných biofilmů) [3]. Zvyšující se zájem o mikrobiální konstituenty kolonizující „zdravý“ makroorganismus a zdokonalování výzkumných metod pak v posledních dvou desetiletích otevřely dveře pro extenzivní výzkum mikrobiální komunity, především gastrointestinálního traktu, a jejího vlivu na lidské zdraví [4]. Složité experimentální postupy umožnily odhalit a modelovat nenápadný, ale o to významnější vliv kolonizujících mikrobů na celou řadu chorobných procesů včetně tzv. civilizačních chorob – zánětlivých (např. alergie, idiopatické střevní záněty), metabolických a kardiovaskulárních (např. diabetes mellitus 2. typu, ateroskleróza), nádorových, ale vlivem tzv. osy střevo-mozek také psychiatrických (např. poruchy nálady, choroby autistického spektra, psychotická onemocnění) [5].
Komplexní fenotypizace a tím i výzkum mikrobiálních společností byly v plné míře umožněny teprve v posledních desetiletích s rozvojem moderních metod, především molekulárně biologických a bioinformatických. Sekvenační techniky včetně sekvenování nové generace umožňují efektivní rozbor genetické informace, nacházející se v mikrobiomu (genomika); analýza genové exprese stanoví aktuálně přepisované geny (transkriptomika); pokroky v metodách analýzy proteinů a metabolitů (hmotnostní spektrometrie, chromatografie, elektroforetické metody) pak otevírají možnosti mikrobiální proteomice a metabolomice. Všechny tyto metody produkují velké objemy vysoce komplexních biologických dat, jejichž rozklíčování vyžaduje pokročilou výpočetní techniku a bioinformatické know-how. Současná věda tak může díky vysoce výkonným počítačům poprvé efektivně integrovat izolované poznatky o jednotlivých „etážích“ klasického základního dogmatu molekulární biologie do komplexního popisu složení a fungování mikrobiální komunity. Použití výše zmíněných, tzv. „omics“ metod tak mikrobiomové vědě umožnilo obejít některé limitace klasické, na kultivaci závislé mikrobiologie.
Současně s těmito metodami se jako nezbytná součást výzkumu mikrobiomu v průběhu času rozvíjely stále pokročilejší metody pro studium funkce mikrobiomu a jeho vlivu na organismus hostitele, a také vzájemných interakcí mezi jednotlivými složkami mikrobioty. Široce se využívají tkáňové a buněčné kultury lidského nebo zvířecího původu. Velké možnosti pro studium interakce mikro - a makroorganismu v těchto in vitro systémech se dnes nabízí využitím tzv. organoidů (tj. laboratorně udržovaných modelových systémů, zahrnujících více tkání a simulujících prostředí v orgánech in vivo), a to především střevních. Rozvoj technologie organoidů experimentátorům umožňuje kontrolovaně a zároveň dostupně studovat vysoce komplexní funkční vlastnosti střevní sliznice včetně její integrace s imunitním systémem hostitele i mikrobiomem [6, 7]. Představují také vhodný systém pro studium obtížně kultivovatelných mikroorganismů včetně striktních anaerobů [8]. Běžně se používají organoidy připravené z tkání různých zvířecích modelů, velikou výhodou pak je možnost pracovat s lidskými organoidy. Ty navíc mohou být vytvořeny z tkání nemocných jedinců a dávají tak unikátní vhled do fungování střevní tkáně nejen ve zdraví, ale i v nemoci (příkladem je studium organoidů izolovaných od pacientů s celiakií [9]). Reprodukovatelnost a relativně snadná obsluha dále dovolují jejich využití pro vysoce efektivní testování vlivu různých látek či terapeutických postupů na aktivitu hostitelské tkáně i střevní mikrobioty. Díky zavádění rozličných variant kultivace s použitím dynamických modelů (např. tzv. „gut-on-chip“ systémů) je možné modelovat funkční i histologické změny střevní tkáně v průběhu času i její reaktivitu na funkční stimuly [6, 10]. Intenzivní výzkum v oblasti mikrofluidiky pak směřuje k funkčnímu propojení organoidů, izolovaných z různých orgánů, které by umožnilo detailní analýzu vzdálených interakcí mezi různými tkáněmi nebo mezi tkáněmi a mikrobiomem [11]. I přes extrémní sofistikovanost a slibnou pozici do budoucna nicméně organoidy stále představují ex vivo modelový systém a nemohou zcela nahradit výzkum prováděný in vivo na zvířecích modelech.
Při studiu biologického významu mikrobioty a důsledků bakteriální kolonizace makroorganismu jsou nepostradatelným metodickým nástrojem především gnotobiotické modely experimentálních zvířat. Myši nebo jiné druhy zvířat odchovávané náročnou technologií ve sterilním prostředí, tj. v izolátorech pro bezmikrobní chov, mohou být kontrolovaně osídlovány jednotlivými kmeny komensálních bakterií či jejich definovanou směsí. Pak je možné detailně studovat vývoj mikrobiomu a jeho vlivu na hostitele na genové i proteinové úrovni [12]. Z historického hlediska stojí za zmínku, že jedna z mála takto specializovaných laboratoří ve světě je před více než 60 lety profesorem MUDr. Jaroslavem Šterzlem, DrSc., v rámci Mikrobiologického ústavu Československé akademie věd založená Gnotobiologická laboratoř v Novém Hrádku u Náchoda. Na tomto pracovišti prováděné pokusy, které využívaly bakteriální kolonizaci bezmikrobních zvířat a detailní analýzu imunitních reakcí, jasně prokázaly významnou roli střevní mikrobioty ve vývoji imunitního systému [13]. Z počátku se zde intenzivně využíval především model bezmikrobních bezkolostrálních selat, která díky neprostupnosti prasečí šestivrstevné placenty nemají přenesené mateřské protilátky a umožňují tak odlišit imunologické mechanismy vrozené od těch, které se vyvíjejí pod vlivem mikrobioty [13]. Teprve později byly v této laboratoři do bezmikrobních podmínek převedeny další druhy zvířat (potkani, myši a králíci). Od devadesátých let minulého století dochází k postupnému zavádění a využívání experimentálních zvířecích (hlavně myších) modelů lidských chorob získaných buď indukcí choroby, nebo využitím geneticky modifikovaných kmenů myší (spontánně vznikající choroby). Tyto experimentální zvířecí modely jsou pomocí gnotobiotické technologie převáděny do bezmikrobního prostředí, kolonizovány definovanými mikroby nebo jejich komunitami a široce využívány pro studium úlohy mikrobioty v patogenezi lidských chorob zánětlivých [14], metabolických [15], autoimunitních [16], nádorových [17] i infekčních [18]. Gnotobiologie se tak výrazně uplatňuje při vývoji medicínsky zcela nových terapeutických přístupů, spočívajících v modulaci mikrobioty za účelem obnovy rovnovážných interakcí mezi systémy regulujícími základní funkce a mikrobiotou hostitele [4, 19].
Z výše řečeného vyplývá, že zodpovědně vedený výzkum mikrobiomu a jeho vztahu k člověku – jako jednotlivci, jako druhu i jako společnosti – vyžaduje integraci poznatků získaných velice rozdílnými metodami v rámci různých oborů. Za účelem koordinace této integrace, zprostředkování diskuse mezi specialisty z různých oborů a obecné podpory i popularizace mikrobiomové vědy ve světě již vznikla řada odborných skupin; v České republice tento směr zastupuje Česká mikrobiomová společnost ČLS JEP, která vznikla v roce 2019.
Jako každý mladý, překotně se rozvíjející vědní obor, i mikrobiomová věda má své dětské choroby. Tou nejvýraznější a snad nejzáludnější bývá nejednotnost terminologie, která znesnadňuje odbornou komunikaci a orientaci v živelně bující mase poznání. Vzhledem k esenciálně multidisciplinární povaze mikrobiomového výzkumu je tento aspekt ještě zvýrazněn tím, že je nezbytné překlenout různé již zažité vnímání termínů, které mohou mít v rozdílných oborech i diametrálně odlišný obsah či konotace. Každý metodologický či odborný „úhel pohledu“ představuje nezastupitelný přínos, ale také jistou zátěž axiomy a celkovým prismatem daného oboru. Pro vytvoření platného a celistvého obrazu je nutné mít jistotu, že chápání a používání terminologie je napříč obory univerzální, unifikované v souladu s holistickým paradigmatem. Jen tak se můžeme vyhnout babylonskému zmatení jazyků.
Že nejde o plané varování, je zřejmé z toho, že terminologickou nejednoznačností již v současné době trpí centrální pojmy oboru – především samotný pojem „mikrobiom“ (angl. microbiome). V současnosti je termínu mikrobiom používáno převážně ve dvou významech: 1. ve smyslu ekologickém bývá mikrobiom autory definován jako „charakteristické společenství mikroorganismů, včetně racionálně definovaného prostředí s určitými fyzikálními a chemickými vlastnostmi“; 2. ve smyslu genomovém je termín mikrobiom často užíván pro „kolektivní genom“, čili soubor genů a genomů všech mikroorganismů, obývajících určité prostředí.
Každá z těchto definic má své výhody a své nevýhody. Rozpor mezi nimi vznikl historicky a posléze byl zafixován v důsledku rozdílného těžiště metodického zájmu různých vědeckých skupin. Ekologická definice je historicky původnější, poprvé byla navržena a použita v roce 1988 v kontextu parazitismu mikroskopických hub na rostlinách [20]. Mezi její výhody kromě toho patří větší šíře a holističnost (zahrnuje kromě genetiky mikrobů i jejich strukturní a funkční aspekty a zohledňuje i komplexní faktory prostředí), v neposlední řadě pak je lépe etymologicky ukotvena (pro zájemce stručně shrnuje tabulka 1 – etymologický přehled). Naproti tomu genomový význam termínu „mikrobiom“ byl poprvé zaznamenán roku 2001 [21] a jeho autorství je připisováno Joshuovi Lederbergovi, nositeli Nobelovy ceny za medicínu roku 1958 za objev konjugace bakterií. Ten nově vytvořil termín „mikrobiom“ zkrácením slovního spojení „mikrobiální genom“. V jeho pojetí tedy jde o kompletní soubor mikrobiálních genů. Tato jednoduchá a úzce genomicky zaměřená definice ve věku různých „-omů“ našla značný ohlas u množství odborníků, zkoumajících mikroorganismy metodami molekulární biologie, a v současnosti je v odborném tisku široce citovaná a používaná.
Tab. 1. Etymologický přehled nejvýznamnějších pojmů
Table 1. Etymological overview of the most relevant terms
Od roku 2015 probíhá v anglofonním odborném světě snaha o jakousi renesanci ekologické definice mikrobiomu, která vyvrcholila vydáním článku [22], zveřejňujícího stanovisko vypracované skupinou mikrobiomových specialistů z různých oborů v rámci sympozia konaného konsorciem Microbiome Support dne 6. 3. 2019. Publikovaný text zahrnuje mimo historický a metodický přehled také seznam termínů, které konsorcium autorů dále doporučuje k jednotnému používání. Jejich originální znění a v tomto článku uvedený překlad doporučuje Česká mikrobiomová společnost pro používání v rámci odborné komunikace, edukační či publikační činnosti i popularizace (přehledně viz tabulka 2 – Stanovisko ČMS).
Tab. 2. Oficiální stanovisko České mikrobiomové společnosti k používání správných pojmů
Table 2. Official position of the Czech Microbiome Society on the use of correct terms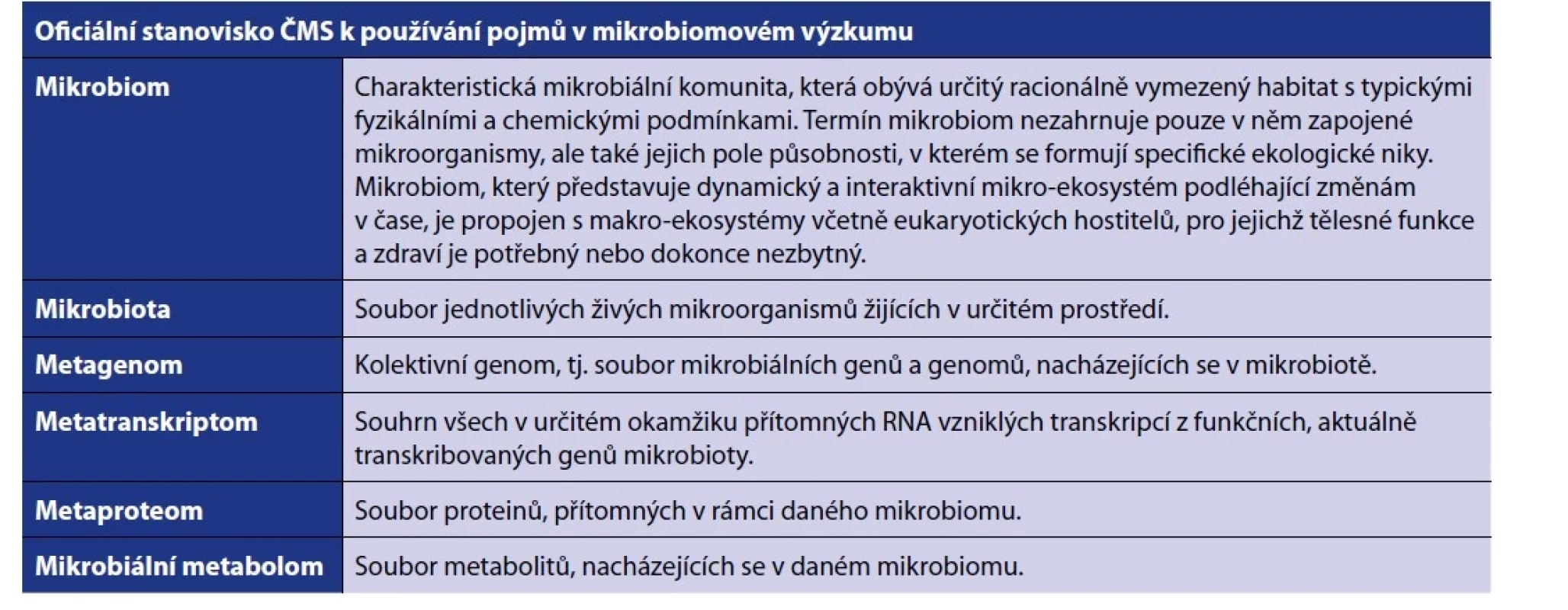
Námi doporučená definice mikrobiomu v českém jazyce tedy zní: „Mikrobiom představuje charakteristickou mikrobiální komunitu, která obývá určitý racionálně vymezený habitat s typickými fyzikálními a chemickými podmínkami. Termín mikrobiom nezahrnuje pouze v něm zapojené mikroorganismy, ale také jejich pole působnosti, v kterém se formují specifické ekologické niky. Mikrobiom, který představuje dynamický a interaktivní mikro - ekosystém podléhající změnám v čase, je propojen s makro-ekosystémy včetně eukaryotických hostitelů, pro jejichž tělesné funkce a zdraví je potřebný nebo dokonce nezbytný.“ Pozornost si zasluhuje také fakt, že definice kromě vlastních mikroorganismů obsahuje i jejich „pole působnosti“, tj. zevní podmínky nabízené prostředím, ale také veškeré látky, které mikroorganismy produkují či uvolňují – metabolity, signalizační molekuly, strukturní komponenty. Sem patří i volně se vyskytující nukleové kyseliny včetně těch virových (resp. bakteriofágových). Cílem takto široce pojímané definice je zohlednit komplexitu a vzájemnou provázanost komponent mikrobiálního ekosystému, ve kterém lze jen s velkými obtížemi zkoumat jeho jednotlivé složky izolovaně a kde určujícím faktorem emergentních vlastností systému jsou často právě vztahy mezi jeho složkami. V případě mikrobiomu tak doslova platí, že celek je více než součet jeho částí.
Dalším významným a užitečným termínem je pojem „mikrobiota“ (angl. microbiota), definovaný jako „soubor jednotlivých živých mikroorganismů žijících v určitém prostředí“ (viz tabulka 2). Jedná se tedy o zastřešující termín pro sumu všech jednotlivců/druhů mikrobů v mikrobiomu, bez ohledu na jejich vztahy a faktory prostředí. Mikrobiota zde explicitně nahrazuje zastaralý, nicméně stále rozsáhle zažitý a často používaný termín „mikroflóra“. Ten vznikl historicky jako přirozený protipól „makrofauny“ v době, kdy bylo třeba symbolicky vymezit živočichy včetně člověka vůči mikrobům „kvetoucím“ kolem něj a v něm. Pro velice silné a vzhledem k rostoucímu zastoupení ekologicky orientovaného výzkumu v rámci mikrobiomové vědy potenciálně zavádějící konotace slova „flóra“ s rostlinnou říší považujeme kontinuální používání výrazu „mikroflóra“ za neodborné a nežádoucí [23]. Důrazně tedy apelujeme na odbornou veřejnost, aby jej nadále nepoužívala, a to ani v popularizačně či komerčně motivovaném kontaktu s laickou veřejností. Pro nahrazení doporučujeme užívat správný pojem „mikrobiota“, případně obsahově širší ale vhodné „mikrobiální společenství“.
Kromě toho je ještě vhodné dodat, že viry, které stojí na pomezí živého a neživého světa jakožto neautonomní infekční nosiče informace, se koncepčně značně vymykají definovanému obsahu termínu mikrobiota. Vzhledem k jejich obrovskému počtu a velkému významu jako ekologicky aktivních činitelů v mikro - i makrosvětě jsou nicméně jak eukaryotické viry, tak především bakteriofágy výraznou součástí holisticky chápaného mikrobiomu. Vzhledem k rozšířenému konsenzu, který viry v rámci systematiky řadí po bok ostatních, nezpochybnitelně živých organismů [24], se rovněž kloníme k jejich uvažování coby jedné ze subkategorií mikrobioty. Měli bychom však vést v patrnosti, že viry striktně vzato nesplňují podmínku životnosti, zahrnutou v navrhované definici. Komplexní diskuse na téma přesného zařazení virů v rámci živé přírody značně přesahuje možnosti této práce, tabulka 3 nicméně pro orientaci čtenáře uvádí alespoň stručný přehled námi uvažovaných klíčových vlastností živých entit a jejich přítomnost, resp. nepřítomnost u virů.
Tab. 3. Postavení virů vzhledem k živým organismům
Table 3. The position of viruses in relation to living organisms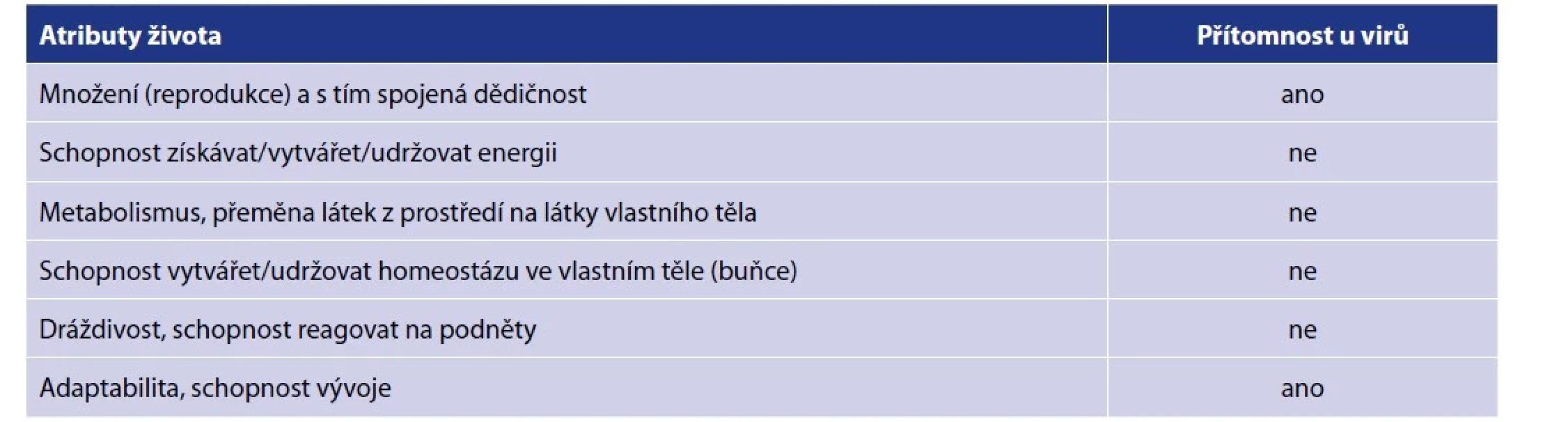
Vzhledem k tomu, že nově navrhovaná koncepce usiluje o odklon od používání „genomické“ definice mikrobiomu, je potřeba tento význam nahradit. Jako nejvhodnější alternativa se jeví termín „metagenom“ (angl. metagenome), definovaný jako „kolektivní genom mikrobioty, tj. soubor mikrobiálních genů a genomů, nacházejících se v mikrobiotě“ (viz tabulka 2). Metagenom byl historicky definován metodicky, skrze metagenomickou analýzu celého souboru genů přítomných v mikrobiálním společenství pomocí „shotgun sequencing“. Metagenomika jako obor provádí bioinformatickou analýzu takto získaných dat a usiluje o vytvoření sestavy genomů všech členů daného společenství, včetně těch obtížně kultivovatelných. Výše navrhovaná definice metagenomu, která v podstatě odpovídá původnímu „genomovému“ užívání pojmu mikrobiom, je konceptuální a neobsahuje již metodický aspekt, tj. nezávisí na tom, jakými metodami byly informace o metagenomu získány.
Hlavní nevýhodu tohoto použití termínu představuje právě tato metodická diskrepance, která může být matoucí zejména pro odborníky zvyklé běžně používat termín „metagenomika“ v původním kontextu, tj. pro označení celogenomové sekvenační analýzy kompletního genetického materiálu v daném mikrobiomu. Odhlédneme-li však od tohoto praktického aspektu, již první formulace pojmu „metagenom“ jej definovala jako kolektivní genom mikrobů v určitém prostředí [25]. Naše definice usiluje zavést terminologii, která překlene metodické rozdíly v rámci různých proudů mikrobiomové vědy. Rozhodující je pak skutečnost, že pojem takto bude užíván konzistentně s mezinárodní terminologií tak, jak byla navržena výše zmiňovaným konsorciem [22].
Další výhodou je, že se tím metagenom a metagenomika zařadí do logické souvztažnosti dalších již zavedených „-omics věd“, reflektujících jednotlivé etáže fenotypické analýzy mikrobiálního společenství. Postupujeme - li podle centrálního dogmatu molekulární biologie (DNA → RNA → proteiny), na metagenom a metagenomiku navazuje metatranskriptomika, zkoumající pokročilými metodami skutečně probíhající genovou expresi ve vzorku; jejím výstupem je metatranskriptom jakožto „souhrn všech v určitém okamžiku přítomných RNA vzniklých transkripcí z funkčních, aktuálně transkribovaných genů mikrobioty“. Proteomické metody použité v kontextu mikrobiomového výzkumu spadají pod metaproteomiku, která zkoumá metaproteom – „soubor proteinů, přítomných v rámci daného mikrobiomu“. Na konec této řady připadá mikrobiálními metabolity se zabývající metabolomika. Ta jediná se vymyká schématu rozlišení „mikrobiomové varianty“ těchto vědních oborů pomocí předpony meta-, a to jak z onomatopoetických příčin, tak proto, že v prostředí sdíleném celou řadou mikroorganismů a ovlivňovaném metabolickou činností makroskopického hostitele je – na rozdíl od analýzy proteinů a nukleových kyselin – neúčelné či přímo nemožné stanovit konkrétního původce metabolitů o nízké molekulové hmotnosti a komplexitě, kterými se metabolomika zabývá. Navrhované definice přehledně shrnuje tabulka 2.
Všechny zmíněné obory produkují související systémy dat, které za pomoci adekvátní bioinformatické syntézy a analýzy umožňují mikrobiom popsat v jeho celkovém obraze. Odpovídají tak na tři základní otázky, od „Kdo je v daném mikrobiomu přítomen?“ (tj. mikrobiota, analyzována metataxonomickými metodami), přes „Co umí dělat?“ (tj. jakou má genovou výbavu – metagenom) až po „Co dělá právě teď?“ (tj. aktuálně probíhající procesy, které popisují metatranskriptom, metaproteom a mikrobiální metabolom). Vztahy mezi jednotlivými entitami a pojmy, které dle naší definice do mikrobiomu patří, přehledně vyjadřuje diagram na obrázku 1.
Obr. 1. Schéma znázorňující praktickou souvztažnost jednotlivých pojmů
(Upraveno dle Berg et al. [22]).
Figure 1. Schematic representation of the interrelatedness of terms
(Adapted from Berg et al. [22]).![Schéma znázorňující praktickou souvztažnost jednotlivých pojmů<br>
(Upraveno dle Berg et al. [22]).<br>
Figure 1. Schematic representation of the interrelatedness of terms<br>
(Adapted from Berg et al. [22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/313d9a0445b18b1fe325f28487594b76.jpg)
Pro jednotlivé podskupiny mikroorganismů či jejich metagenom se v současnosti někdy zavádějí skupinové pojmy nižší etáže, jako „bakteriom“ pro bakterie, „archaeom“ pro mikroorganismy řazené do domény Archaea, „mykobiom“ pro mikroskopické houby, případně častěji používaný „virom“ pro metagenom virů. I vzhledem k nejednoznačnosti užívání těchto pojmů nižší úrovně (někdy se vztahují k jednotlivým skupinám členů, jindy pouze k jejich genetické výbavě) a vzhledem k tomu, že při izolovaném zvažování pouze vybrané podskupiny mikrobů odpadá ekologický aspekt neoddělitelný od navrhované definice mikrobiomu, doporučujeme se těmto termínům vyhnout a používat korektnější „bakteriální/ archeální/… společenství“, případně „bakteriální/ archeální/… metagenom“.
Mikrobiomová věda se v současnosti nalézá v bodě, který do budoucna přináší naději na významný pokrok v našem poznání a jeho využití v různých oblastech, od průmyslu a ekologie po lékařství. Rozvoj moderních molekulárně biologických metod (zejména sekvenačních technik) i vývoj přístrojů a softwarů umožňujících analýzu velkého množství dat usnadňuje rozkvět tohoto moderního odvětví mikrobiologie a jeho značný přesah i do dalších vědních oblastí, což dále zlepšuje pochopení vzájemných interakcí mezi mikrobiomem a hostitelem ve zdraví a nemoci. Zároveň však relativně mladý obor nepochybně čeká řada úskalí, pro jejichž překonání bude nezbytná kromě píle a ochoty k interdisciplinární spolupráci také značná dávka obezřetnosti. Extrémní komplexita mikrobiomů a jejich konstituujících činitelů dosud naše poznání brzdila, takže účinného, dostatečně kontrolovatelného ovlivňování těchto systémů se podařilo docílit pouze v omezené míře (v lékařství asi nejvýznamnějším příkladem je fekální mikrobiální transplantace, schválená pro léčbu pacientů s kolitidou vyvolanou Clostridioides difficile). S rostoucím zájmem vědecké komunity a s prudce se vyvíjejícími možnostmi molekulární biologie a bioinformatiky, především metod analýzy velkých objemů dat, lze očekávat, že v budoucnosti se řízená modifikace mikrobioty stane podstatně častějším nástrojem klinického využití v rámci cílené či podpůrné terapie. Zároveň tento zvýšený zájem odborné a laické veřejnosti i komerčního sektoru ovšem přinese nové, závažné otázky charakteru etického a nepochybně též legálního. Stejně jako u každého oboru, který se náhle stal módním, i živelně se vyvíjející pole mikrobiomů a jejich modifikace přitáhne kromě seriózního výzkumu a inovací také zájem potenciálních podvodníků či šarlatánů, kteří se v dobré víře či ve vidině zisku budou snažit komercionalizovat i nedostatečně prozkoumané či dokonce nebezpečné postupy a přípravky. Pro zajištění odborného dohledu nad etikou a bezpečností aplikací získaných poznatků bude zapotřebí hodnověrného konsenzu odborníků z různých oblastí širokého pole mikrobiomového výzkumu a souvisejících oborů, jak lékařských, tak ekologicky a environmentálně zaměřených.
Aby takovýto konsenzus vůbec mohl vzniknout, je nezbytné správné stanovení pojmů, které mají nadále být používané v odborné komunikaci, publikační a edukační činnosti včetně psaní závěrečných prací na vysokých školách, i v komunikaci mezioborové a popularizační. Čím dříve se takováto terminologická platforma prosadí a čím lépe bude zakotvena v mezinárodní vědecké komunitě, tím efektivnější bude produktivní výměna vědeckých informací v rámci jednotlivých oborů mikrobiomové vědy i mezi nimi. Věříme, že definice, které zde s podporou České mikrobiomové společnosti navrhujeme, jsou dostatečně jazykově i obsahově korektní, zohledňují historický precedens, poskytují adekvátní termíny postihující jak holistický a ekologický charakter mikrobiomu, tak jednotlivé aspekty jeho složení a fungování a v neposlední řadě se opírají o oficiálně publikované stanovisko mezinárodní mikrobiomové komunity. Apelujeme proto na českou akademickou obec, aby tyto termíny přijala za své a uvolila se v budoucnu je používat – alespoň do té doby, než vývoj poznání opět přinese změny tak revoluční, že bude nezbytné zcela revidovat naše chápání mikrobů a našeho věčně se vyvíjejícího vztahu k nim.
Vydání článku bylo podpořeno Výzkumným programem Univerzity Karlovy Cooperatio (výzkumná oblast Imunologie a infekce) číslo IMMU207032. Dále byla práce podpořena z programových projektů Ministerstva zdravotnictví ČR s registračními čísly NU20-05-00038 a NU20-04-00077, projektem Technologické agentury České republiky číslo NV19-03-00179 a projektem Grantové agentury České republiky číslo 20-03997S.
Do redakce došlo dne 9. 11. 2022.
Adresa pro korespondenci:
RNDr. MUDr. Viktor Černý, Ph.D.
Ústav imunologie a mikrobiologie
Studničkova 7
128 00 Praha 2-Albertov
e-mail: viktor.cerny@lf1.cuni.cz
Zdroje
1. Charlton SGV, White MA, Jana S, et al. Regulating, Measuring, and Modeling the Viscoelasticity of Bacterial Biofilms. J. Bacteriol,, 2019;201(18):e00101–19.
2. Motta JP, Wallace JL, Buret AG, et al. Gastrointestinal biofilms in health and disease. Nat. Rev. Gastroenterol. Hepatol., 2021;18(5):314–334.
3. Høiby N. A personal history of research on microbial biofilms and biofilm infections. Pathog. Dis., 2014;70(3):205–211.
4. Tlaskalová-Hogenová H, Štěpánková R, Kozáková H, et al. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: contribution of germ-free and gnotobiotic animal models of human diseases. Cell Mol. Immunol., 2011;8(2):110–120.
5. Manos J. The human microbiome in disease and pathology. APMIS Acta Pathol. Microbiol. Immunol. Scand, 2022.
6. Bozzetti V, Senger S. Organoid technologies for the study of intestinal microbiota–host interactions. Trends Mol. Med., 2022;28(4):290–303.
7. Janečková L, Kostovčíková K, Švec J, et al. Unique Gene Expression Signatures in the Intestinal Mucosa and Organoids Derived from Germ-Free and Monoassociated Mice. Int. J. Mol. Sci., 2019;20(7):1581.
8. Zhang J, Huang YJ, Yoon JY, et al. Primary Human Colonic Mucosal Barrier Crosstalk with Super Oxygen-Sensitive Faecalibacterium prausnitzii in Continuous Culture. Med., 2021;2(1):74–98.e9.
9. Freire R, Ingano L, Serena G, et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci. Rep., 2019;9(1):7029.
10. Kim HJ, Huh D, Hamilton G, et al. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab. Chip., 2012;12(12):2165–2174.
11. Wu Q, Liu J, Wang X, et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomed. Eng. Online, 2020;19(1):9.
12. Falk PG, Hooper LV, Midtvedt T, et al. Creating and maintaining the gastrointestinal ecosystem: What we know and need to know from gnotobiology. Microbiol. Mol. Biol. Rev., 1998;62(4):1157–1170.
13. Šterzl J, Říha I. Developmental aspects of antibody formation and structure. Praha: Academia;1970. 474 s.
14. Schwarzer M, Repa A, Daniel C, et al. Neonatal colonization of mice with Lactobacillus plantarum producing the aeroallergen Bet v 1 biases towards Th1 and T-regulatory responses upon systemic sensitization. Allergy, 2011;66(3):368–375.
15. Schwarzer M, Makki K, Storelli G, et al. Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition. Science, 2016;351(6275):854–857.
16. Štěpánková R, Powrie F, Kofroňová O, et al. Segmented filamentous bacteria in a defined bacterial cocktail induce intestinal inflammation in SCID mice reconstituted with CD45RBhigh CD4+T cells. Inflamm. Bowel Dis., 2007;13(10):1202–1211.
17. Tlaskalová-Hogenová H, Vannucci L, Klimešová K, et al. Microbiome and colorectal carcinoma: insights from germ-free and conventional animal models. Cancer J. Sudbury Mass, 2014;20(3):217–224.
18. Šplíchal I, Rychlík I, Gregorová D, et al. Susceptibility of germ-free pigs to challenge with protease mutants of Salmonella enterica serovar Typhimurium. Immunobiology, 2007;212(7):577–582.
19. Kverka M, Tlaskalová-Hogenová H. Two faces of microbiota in inflammatory and autoimmune diseases: triggers and drugs. APMIS, 2013;121(5):403–421.
20. Whipps JM, Lewis K, Cooke RC. Mycoparasitism and plant disease control. In: Burge MN. Fungi in biological control systems. Manchester: Manchester University Press;1988. p. 161–187.
21. Hooper LV, Gordon JI. Commensal Host-Bacterial Relationships in the Gut. Science, 2001;292(5519):1115–1118.
22. Berg G, Rybakova D, Fischer D, et al. Microbiome definition re-visited: old concepts and new challenges. Microbiome, 2020;8(1):103.
23. Marchesi JR, Ravel, J. The vocabulary of microbiome research: a proposal. Microbiome, 2018;3(1):31, s40168-015-0094–0095.
24. Virgin HW. The Virome in Mammalian Physiology and Disease. Cell, 2014;157(1):142–150.
25. Handelsman J, Rondon MR, Brady SF, et al. Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products. Chem. Biol., 1998;5(10):R245–R249.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2023 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Slovo o mikrobiomu: úvaha nad historií, současným stavem a pojmoslovím vzkvétajícího oboru
- Sekundární prevence karcinomu plic v České republice – úskalí, rizika, benefit
- Vliv meteorologických faktorů na riziko infekce klíšťovou encefalitidou
- Dopad klimatických podmienok na dynamiku kliešťovej encefalitídy na Slovensku v rokoch 2012–2016
- Porovnání invazivních a neinvazivních izolátů Neisseria meningitidis metodou sekvenace celého genomu, Česká republika, 2005–2021
- Vysoký výskyt pneumónie spôsobenej Pneumocystis jirovecii u onkologických pacientov: 19-ročná štúdia
- Vybrané aspekty úmrtnosti v Česku a na Slovensku v pandemickém roce 2020
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vybrané aspekty úmrtnosti v Česku a na Slovensku v pandemickém roce 2020
- Slovo o mikrobiomu: úvaha nad historií, současným stavem a pojmoslovím vzkvétajícího oboru
- Vliv meteorologických faktorů na riziko infekce klíšťovou encefalitidou
- Sekundární prevence karcinomu plic v České republice – úskalí, rizika, benefit
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



