-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oportúnne patogénna kvasinka Candida glabrata a jej mechanizmy rezistencie voči antimykotikám (súborný referát)
Opportunistic Pathogen Candida glabrata and the Mechanisms of its Resistance to Antifungal Drugs
Treatment of not only bacterial but also fungal infections is currently a growing concern. A major reason is the acquisition of multidrug resistance in both prokaryotic and human cells. The multidrug resistance phenotype is a cellular response to the presence of cytotoxic substances in the environment. The basic mechanism of multidrug resistance is overexpression of the membrane proteins involved in the extrusion of toxic substances outside the cell. The resistance mechanism based on the efflux of inhibitors as a result of the overproduction of transport proteins was also observed in some plant and animal pathogens and human tumour cells. The phenomenon of multidrug resistance associated with an excessive and long-term use of antifungals, in particular of azole derivatives, was also confirmed in the yeast Candida glabrata which is becoming a growing concern for health care professionals. Reduced susceptibility to azole derivatives in particular, a high potential for adapting to stressors, and multiple mechanisms of resistance to structurally and functionally unrelated antifungal drugs make the species C. glabrata a potential threat to hospital patients.
Key words:
Candida glabrata – virulence factors – resistance mechanisms – biofilm – antifungal drugs.
Autoři: N. Berila; J. Šubík
Působiště autorů: Katedra mikrobiológie a virológie, Prírodovedecká fakulta Univerzity Komenského, Bratislava, Slovenská republika
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 2, s. 67-79
Souhrn
V súčasnosti sa stáva čoraz viac problematickou terapia nielen bakteriálnych ale aj fungálnych infekcií. Väčšinou je to z dôvodu nadobudnutia mnohonásobnej rezistencie, ktorá sa vyskytuje od prokaryotických buniek až po bunky človeka. Fenotyp mnohonásobnej rezistencie predstavuje odpoveď buniek na prítomnosť cytotoxických látok v prostredí. Základným mechanizmom mnohonásobnej rezistencie je nadexpresia membránových proteínov vylučujúcich toxické látky von z bunky. Mechanizmus rezistencie založený na efluxe inhibítorov z bunky v dôsledku nadprodukcie transportných proteínov bol pozorovaný aj u niektorých patogénov rastlín, živočíchov a nádorových buniek človeka. Fenomén mnohonásobnej rezistencie, spojený s nadmerným a dlhodobým používaním antifungálnych látok, najmä azolových derivátov, sa potvrdil aj u kvasinky Candida glabrata, ktorá sa čoraz viac dostáva do pozornosti odbornej verejnosti. Znížená citlivosť predovšetkým na azolové deriváty, schopnosť rýchlej adaptácie na stresové podmienky a kombinácia viacerých mechanizmov rezistencie voči štrukturálne a funkčne nepríbuzným antifungálnym látkam predstavujú druh C. glabrata ako potenciálnu hrozbu najmä v nemocničných zariadeniach.
Kľúčové slová:
Candida glabrata – faktory virulencie – mechanizmy rezistencie – biofilm – antimykotiká.Taxonómia a evolúcia
Druhy rodu Candida predstavujú súčasť fyziologickej mikroflóry slizníc človeka. U imunokompetentných jedincov môžu byť pôvodcami vaginitídy, ezofagitídy či infekcie močových ciest. Nebezpečnými sa stávajú hlavne pre ľudí s oslabeným imunitným systémom, u ktorých vyvolávajú nebezpečné systémové ochorenia, kandidémie a kandidúrie [1, 2]. Väčšina predstavuje riziko najmä v nemocničnom prostredí, kde figurujú ako nozokomiálne patogény s vysokou morbiditou a mortalitou [3]. Zástupcovia rodu Candida tvoria heterogénnu skupinu kvasiniek vyskytujúcu sa v dvoch morfologických formách: v podobe hýf (mycélium, pseudomycélium) alebo ako samostatne existujúce bunky (kvasinky). Vzhľadom na fakt, že environmentálne nároky C. glabrata a C. albicans sú veľmi podobné, predpokladala sa podobná biologická charakteristika oboch druhov. Na rozdiel od dimorfnej C. albicans sa C. glabrata vyskytujevýlučne v podobe blastokonídií [4]. Na základe neprítomnosti vláknitých štruktúr bola klasifikovaná ako Torulopsis glabrata. Rod Torulopsis bol prvýkrát popísaný v roku 1894, ale neskôr sa zistilo, že prítomnosť resp. absencia hýf nie je dostatočným diskriminačným znakom pri klasifikácii zástupcov rodu Candida [5]. Preto bola kvasinka T. glabrata premenovaná na C. glabrata. Moderné molekulárno-biologické prístupy v taxonómii organizmov založené na komparácii konzervatívnych sekvencií 18S rRNA potvrdili, že C. glabrata ako druh má evolučne bližšie k Saccharomyces cerevisiae ako ku C. albicans. Petite-pozitívny charakter kvasinky C. glabrata bol ďalším faktom potvrdzujúcim túto príbuznosť. Rovnako aj podobné percentuálne zastúpenie G+C svedčí o príbuznosti týchto dvoch druhov. Zastúpenie G+C u C. glabrata je 38,8 %, u S. cerevisiae 38,3% [6-8]. Výsledkom rozsiahlejšej straty génov je ich nižší počet u C. glabrata v porovnaní s ostatnými druhmi hemiaskomycét, pričom počet chromozómov ani veľkosť genómu táto redukcia neovplyvňuje. Redukčná evolúcia je pravdepodobne dôsledkom adaptability tohto druhu zo saprofytického na parazitický spôsob života [9]. Podľa dostupnej internetovej databázy http://cbi.labri.fr/Genolevures/ nie sú v genóme C. glabrata zastúpené také homológy génov S. cerevisiae ako napr. GAL1, GAL3, GAL7, GAL10, SUC2 či HEX2 a MEL1.
Taxonomické zaradenie C. glabrata je nasledovné:
Ríša: Fungi
Oddelenie: Ascomycota
Pododdelenie: Ascomycotina
Trieda: Ascomycetes
Rad: Saccharomycetales
Čeľaď: Saccharomycetaceae
Rod: Candida
Druh: Candida glabrataMorfológia a fyziológia
C. glabrata sa obligátne vyskytuje fo forme ovoidných blastokonídií s priemerom 1–4 μm. Vzhľadom na absenciu dimorfizmu sú komenzálna i patogénna forma tejto kvasinky morgologicky totožné. Na Sabouraudovom dextrózovom agare rastie v podobe lesklých, hladkých kolónií krémovej farby. Na diagnostickom médiu CHROMagar tvorí kolónie ružovej až fialovej farby na rozdiel od kolónií C. albicans, ktoré sú modro-zelené až zelené [10]. Klinické izoláty získané zo sterov vagíny sa vyznačujú prítomnosťou puzdra, v strede ktorého je uložená oválna bunka (tzv. „halo“ efekt) [11]. Tvorba vláknitých štruktúr sa pozorovala iba raz, a to na okrajoch kolónií, ktoré sa kultivovali na médiu bez zdroja dusíka [12]. Niektoré druhy rodu Candida sú okrem asexuálnej formy schopné tvoriť aj teleomorfné štádium, ktoré bolo popísané u ôsmych druhov, nie však u haploidnej asexuálnej kvasinky C. glabrata [13]. Rozmnožuje sa nepohlavnou cestou pučaním a tvorbou dcérskych buniek. C. glabrata zmenila svoje metabolické nároky v porovnaní so svojim príbuzným druhom S. cerevisiae. Je to prirodzený proces adaptácie na komenzálny, resp. parazitický spôsob života. V genóme C. glabrata došlo ku strate viacerých génov zapojených do syntézy galaktózy, sacharózy ale aj metabolizmu fosfátu, síry a dusíka. C. glabrata asimiluje iba glukózu a trehalózu (intracelulárny zásobný disacharid glukózy), čo predstavuje relatívne úzke spektrum v porovnaní s inými zástupcami rodu Candida [14, 15]. Je auxotrofom pre tiamín, pyridoxín a kyselinu nikotínovú. Zároveň je schopná rásť na glycerole ako jedinom nefermentovateľnom zdroji uhlíka. Pri čiastočnom poškodení (rho–) alebo úplnej strate mitochondriálneho genómu (rho) nestráca C. glabrata životaschopnosť, čím sa zaraďuje medzi petite--pozitívne kvasinky. Je naopak schopná využiť tieto mutácie vo svoj prospech, nakoľko sa takéto mutantné kmene vyznačujú vyššou hladinou rezistencie voči antifungálnym látkam v porovnaní s prislúchajúcimi štandardnými kmeňmi [16, 17]. Čiastočná, príp. úplná strata mitochondriálneho genómu zvyšuje expresiu vybraných jadrových génov. Ukazuje sa, že za rezistenciu voči azolovým antimykotikám u petite mutantov C. glabrata zodpovedá nadexpresia jadrových génov kódujúcich efluxné pumpy. Je možné, že jadrové gény kódujúce faktory podieľajúce sa na patogenite druhu C. glabrata sú ovplyvnené petite mutáciou [18]. O metabolickú aktivitu sa opiera klinická diagnostika kandíd. Pri makroskopickom vyšetrení sa sleduje rast na pevnom médiu, sfarbenie, textúra a okraje kolónie [11, 19]. Biochemické testovanie zahŕňa najmä asimiláciu sacharidov a ureázový test. V klinickej praxi sa fenotypová identifikácia vykonáva rutinne pomocou diagnostických súprav, ako je napr. API test, či rastom na chromogénnom diagnostickom médiu CHROMagar. Na diagnostiku infekcií sa využíva aj sérológia [20-22]. Kvôli vyššej špecificite a krátkosti času potrebného na presnú identifikáciu bez nutnosti kultivácie sú však tradičné metabolické testy postupne vytláčané molekulárno-biologickými postupmi, ako napr. izolácia genómovej DNA, rRNA sekvenačná analýza, hybridizácia a génové sondy. PCR reakcia je v súčasnosti veľmi využívaná, pomerne jednoduchá a presná metóda identifikácie mikrobiálnych agens. Slúži najmä na medzidruhovú ale aj vnútrodruhovú klasifikáciu kandíd [23, 24].
Genetika
Genetický systém C. glabrata pozostáva z chromozómov jadra a mitochondriálnej DNA. Prítomnosť plazmidov nebola dosiaľ opísaná. C. glabrata disponuje 13 chromozómami s veľkosťou 0,5 Mb až 1,4 Mb [25, 26]. Celková veľkosť chromozomálnej DNA je 12,3 Mb, pričom rDNA tvorí okrem toho dva samostatné lokusy na chromozómoch 12 a 13. Nachádza sa tu približne 5300 génov pre proteíny a vyše 200 génov pre rôzne typy RNA. V porovnaní s kvasinkou S. cerevisiae – 16 chromozómov, 12,1 Mb, približne 6000 génov – nie sú tieto rozdiely evidentné. C. glabrata sa vyznačuje pomerne nízkou redundanciou DNA a vysokým stupňom regresívnej evolúcie, čo pravdepodobne súvisí s prispôsobením sa patogénnemu spôsobu života [26]. Každý z chromozómov obsahuje popri génoch aj centromérovú sekvenciu (CEN) v subterminálnej až terminálnej oblasti chromozómu, telomérové sekvencie (TEL) a autonómne sa replikujúce sekvencie (ARS), ktoré sú evolučne konzervované [27]. Mitochondriálny genóm C. glabrata patrí medzi najmenšie spomedzi všetkých mitochondriálnych genómov hemiaskomycétnych húb. Cirkulárna mtDNA má veľkosť 19 kb podľa Shu a Martin (1991) – 20 kb podľa Koszul et al. (2003), a jej kompletná sekvencia je publikovaná v práci Koszul et al. (2003). Obsahuje gény pre apocytochróm b (COB), tri podjednotky ATP-syntázy (ATP6, 8, 9), tri podjednotky cytochrómoxidázy (COX1, 2, 3), ribozomálny proteín VAR1p, 23 génov pre transferové RNA, malú a veľkú ribozomálnu RNA a RNA podjednotku RNázy P [28]. Tri intróny typu I sa nachádzajú v géne COX1. Všetky gény sú prepisované z jedného reťazca mitochondriálnej DNA. U niektorých rho– mutantov C. glabrata sa zistila prítomnosť dvoch cirkulárnych DNA o veľkosti 3 μm a 6 μm [30].
Faktory virulencie a patogenita Candida glabrata
Infekcie spôsobené zástupcami rodu Candida predstavujú v súčasnosti závažný terapeutický problém najmä pre imunokompromitovaných pacientov. Za posledných dvadsať rokov sa kandidémia a ochorenia s ňou asociované zaradili medzi najzávažnejšie fungálne infekcie so značnou morbiditou a mortalitou. Haploidná oportúnne patogénna kvasinka C. glabrata je druhým najčastejšie izolovaným zástupcom rodu Candida pochádzajúcim z kandidémií [8, 31]. Participuje na infekciách spojených s katetrizáciou, zavedením endoprotézy či iných umelých náhrad do organizmu. Rovnako predstavuje riziko pre pacientov s oslabeným imunitným systémom, ako sú diabetici, pacienti s vážnym základným ochorením a HIV pozitívni pacienti [32, 33]. K faktorom, ktoré významne prispievajú k diseminácii kmeňov C. glabrata v nemocničnom prostredí patria najmä: (i) nižší stupeň susceptibility voči antimykotikám; (ii) rýchly nástup získanej rezistencie v dôsledku haploidného genómu; (iii) produkcia faktorov virulencie (predovšetkým schopnosť tvoriť biofilm); (iv) prolongovaná terapia azolovými antifungálnymi látkami; (v) zmiešané fungálne a bakteriálne polymikróbne infekcie a v neposlednom rade zistenie, že rezistencia sa väčšinou objavuje ako následok selekcie rezistentných klonov z pôvodne zmiešanej populácie, a nie ako následok mutácie [34-36]. Aj napriek relatívne malému množstvu faktorov virulencie zodpovedá C. glabrata za vysoké percento fatálnych ochorení, najmä u pacientov so systémovou kandidózou. Medzi virulenčné faktory, ktoré môžu prispievať k patogenite kvasinky C. glabrata patria najmä: adherencia, produkcia extracelulárnych hydroláz, hydrofóbnosť bunkového povrchu (Cell Surface Hydrophobicity, CSH) a schopnosť tvoriť biofilm.
Adherencia
Adherencia je vôbec prvým krokom pri kolonizácii hostiteľského organizmu a následnom vzniku infekcie. V porovnaní s C. albicans má C. glabrata slabšiu schopnosť adherovať na epiteliálne bunky gastrointestinálneho traktu, urogenitálneho traktu a k endotelu ciev. Má ale schopnosť adherencie na trombocyty, čo jej umožňuje dobrú distribúciu v krvnom riečisku, najmä pri diseminovanej kandidóze. Znížená schopnosť adherovať na epitely hostiteľa je pravdepodobne dôsledkom absencie pravých hýf [37]. Adherencia je sprostredkovaná glykoproteínmi lokalizovanými na povrchu bunkovej steny – adhezínmi. Fungálne adhezíny sú zodpovedné za interakcie medzi bunkami (flokulácia, filamentácia), medzi bunkou a inertným povrchom (agar, plastický materiál) a za interakcie s hostiteľskými tkanivami [38-40]. U patogénnych kvasiniek je známe množstvo adhezínov kódovaných rôznymi génmi, ktoré sa exprimujú v rozličných fázach bunkovej morfogenézy. Všetky adhezíny majú podobnú štruktúru. Skladajú sa z troch domén (A, B, C) a amino-terminálnej signálnej sekvencie. Signálna sekvencia je tvorená 20–30 aminokyselinovými zvyškami, ktoré sú počas sekrečnej dráhy štiepené signálnymi proteázami. Za ňou nasleduje N-terminálna doména (A), ktorá ma štruktúru podobnú imunoglobulínu a zodpovedá za afinitu proteínu k substrátu. Na svojom povrchu nesie väzbové miesto a determinuje adherenciu. Za touto časťou sa nachádza segment variabilnej dĺžky (doména B), charakteristický vysokým obsahom zvyškov aminokyselín serínu a treonínu s veľkým množstvom tandemových repetícií. Táto doména slúži pravdepodobne ako medzerník a udržuje väzobné miesto vo vhodnej vzdialenosti od bunkovej steny. C-terminálna doména môže obsahovať glykozyl-fosfatidyl--inozitolovú (GPI) kotvu tvoriacu kovalentnú väzbu s β-1,6-glukánom bunkovej steny, čím celej štruktúre udeľuje stabilnú topológiu [41, 42]. Podľa prítomnosti GPI kotvy delíme adhezíny na GPI závislé a GPI nezávislé. Podľa charakteru väzby klasifikujeme adhezívne interakcie na [43]: (i) interakcie proteín-proteín (bielkovina na povrchu mikroorganizmu viaže proteínový alebo peptidový ligand na povrchu hostiteľskej bunky), (ii) interakcie proteín--sacharid (proteín s lektínovou aktivitou tvorí väzbu so sacharidom), (iii) interakcie proteín--nedefinovaný ligand. Najväčšiu skupinu adhezínov C. glabrata kóduje skupina génov označovaných EPA (EPithelial Adhesin). Lektíny EPA patria do rovnakej génovej rodiny ako flokulíny S. cerevisiae, sú Ca2+ závislé, ale na rozdiel od S. cerevisiae sa viažu so sacharidom obsahujúcim β-galaktozyl a β-N-galaktozaminyl. Patria teda do lektínovej skupiny sacharid viažúcich GPI proteínov. U C. glabrata sa charakterizovalo 51 GPI proteínov vo funkcii adhezínov, ktoré sa môžu podielať na adherencii kvasiniek k povrchu hostiteľských buniek [40]. Expresia génov EPA1, EPA6 a EPA7 je indukovaná počas infekcie urogenitálneho traktu, pričom kvasinke C. glabrata tak umožňuje kolonizáciu močového mechúra [6]. Produkt génu EPA6 zohráva dôležitú úlohu aj pri tvorbe biofilmu [41]. V genóme C. glabrata sa nenachádzajú homológy Als adhezínov, čo vysvetľuje jej neschopnosť bunkovej agregácie [44]. Vlastnosť adherencie môže byť ovplyvnená aj ďalšími faktormi, napr. hydrofóbnosťou bunkového povrchu (CSH). CSH zvyšuje adhéziu buniek C. glabrata ku akrylátovým a styrénovým povrchom. Schopnosť adherovať je limitujúcim faktorom, ktorý nielen u kandíd determinuje tvorbu biofilmu v podmienkach in vitro aj in vivo [45, 46].
Produkcia extracelulárnych hydroláz
Sekrécia hydrolytických enzýmov zohráva vo virulencii kandíd významnú úlohu. Predovšetkým sú to hydrolázy dvoch typov: proteinázy a fosfolipázy. Oba typy enzýmov sa podieľajú na deštrukcii zložiek bunkovej membrány a umožňujú inváziu kvasiniek vedúcu v konečnom dôsledku k lýze napadnutých buniek hostiteľského organizmu [37, 47]. Všetky extracelulárne sekretované proteinázy produkované zástupcami rodu Candida patria do rovnakej skupiny – sekretované aspartické proteázy (SAPs). Produkcia týchto enzýmov však bola u C. glabrata pozorovaná len vo veľmi malom množstve, čo je dôkazom celkovo zníženej virulencie oproti C. albicans [6]. Fosfolipázy sú skupinou enzýmov hydrolyzujúcich esterové väzby v glycerolfosfolipidoch. Názory na produkciu fosfolipáz u kvasinky C. glabrata sa rôznia. V istej štúdii sa sledovalo 41 izolátov pochádzajúcich z ústnej dutiny, pričom ani jeden z izolátov druhu C. glabrata neprodukoval fosfolipázy [48]. Na druhej strane stojí výsledok inej štúdie, kde izoláty druhu C. glabrata získané od 98 žien s vulvovaginálnou kandidózou boli schopné produkovať fosfolipázy [49].
Pseudofilamentácia – tvorba tzv. predĺžených buniek (tubes)
C. glabrata sa nevyznačuje tvorbou pravých hýf, je však schopná vo veľkej miere tvoriť predĺžené bunky, ktoré intenzívne rastú do dĺžky viac ako je 6-násobok priemeru bunky. Je to približne 9 μm. „Tubes“ ako sa tieto výbežky nazývajú sa na distálnom konci rozširujú a tvoria pučiacu bunku, príp. prvú priehradku provizórnej pseudohýfy. V bunkách, ktoré tvoria takéto pseudohýfy sa jadro delí. Jedno zostáva v materskej bunke, druhé vstupuje do apikálneho výpučku. Dá sa predpokladať, že „tubes“ môžu slúžiť ako prostriedok šírenia buniek C. glabrata cez tkanivá hostiteľa, podobne ako je to v prípade hýf C. albicans [50]. Tvorba pseudohýf sa u C. glabrata pozorovala pri kultivácii na médiu bez zdroja dusíka [12] a na agare obohatenom CuSO4 [50]. Za tvorbu pseudohýf v neprítomnosti zdroja dusíka zodpovedá gén STE12. Kmene mutantné v tomto géne nie sú schopné tvoriť pseudohýfy na médiu zbavenom zdroja dusíka [51].
Hydrofóbnosť bunkového povrchu
Pri rozvoji ochorenia zohráva dôležitú úlohu hydrofóbnosť bunkového povrchu (CSH), ktorá umožňuje adherenciu na tkanivá, syntetické povrchy, ale aj morfogenézu a schopnosť odolávať fagocytóze. Miesto primárneho kontaktu medzi patogénom a hostiteľským povrchom predstavuje bunková stena mikroorganizmu, konkrétne jej fibrilárna vrstva. Je tvorená glykoproteínmi, z ktorých majoritná časť prislúcha manoproteínom [52, 53]. Pravdepodobnosť úspešného kontaktu zvyšuje stupeň hydrofóbnosti bunkových povrchov [54]. Za hydrofóbny charakter sú zodpovedné glykozylované manoproteíny vonkajšej vrstvy bunkovej steny, najmä acido-labilné frakcie fosfomanoproteínov. Acido-labilné frakcie sú tvorené polymérmi β 1,2-glukánu, ktoré sa viažu pomocou fosfodiesterovej väzby na N-glykán [55]. U hydrofilných buniek je fibrilárna vrstva bunkovej steny tvorená dlhými, pravidelnými, radiálne usporiadanými fibrilami. Krátke, tupo zakončené a nepravidelne usporiadané fibrily sú charakteristické pre povrch hydrofóbnych buniek [56]. Korelácia medzi CSH a glykozyláciou povrchových manoproteínov sa dokázala kultiváciou pôvodne hydrofilných buniek s tunikamycínom, inhibítorom N-glykozylácie, ktoré tak nadobudli hydrofóbny fenotyp i hydrofóbnu štruktúru fibríl [57]. Tieto výsledky podporujú teóriu, že zvýšenie hydrofóbnosti, a tým aj zvýšenie adherencie, súvisí so zníženou glykozyláciou povrchových proteínov. Hydrofóbne bunky majú v porovnaní s hydrofilnými vyššiu schopnosť adherencie k epitelovým i endotelovým bunkám, sú rezistentné voči fagocytóze (znížená koncentrácia epitopov v dôsledku nízkej glykozylácie proteínov) a všeobecne virulentnejšie pri testovaní in vivo [58]. Niektoré antifungálne látky, napr. polyény nystatín a amfotericín B, významne znižujú CSH u kandíd. Redukcia CSH vyvolaná vplyvom týchto antimykotík môže byť spôsobená stratou povrchových štruktúr a fyzikálno-chemickými zmenami bunkovej steny. Vonkajšie podmienky najmä teplota a rast môžu taktiež ovplyvňovať CSH kandíd [59].
Tvorba biofilmu
Schopnosť tvoriť biofilm predstavuje pre mikroorganizmy ako pôvodcov ochorení unikátny nástroj obrany. S virulenciou druhov rodu Candida úzko súvisí schopnosť tvoriť biofilm v podmienkach in vivo. Ako biofilm môžeme definovať diferencované mikrobiálne spoločenstvo sesilných buniek uložených v extracelulárnej gélovitej hmote adherujúce k inertným i živým povrchom [60 až 62]. Extracelulárna matrix predstavuje komplex extracelulárneho materiálu zväčša glykoproteínového charakteru, ktorý ochraňuje jednotlivé bunky biofilmu pred fagocytózou, znižuje prenikanie toxických látok k bunkám, má podpornú funkciu, a tak stabilizuje integritu štruktúry biofilmu. Vo všeobecnosti je až 65 % mikrobiálnych ochorení ľudí asociovaných s tvorbou biofilmu [63-65]. Pri tvorbe biofilmu sa navyše významne mení expresia génov v porovnaní s planktonicky žijúcimi bunkami [66–68]. To má za následok mnohonásobné zvýšenie virulencie kandíd. Biofilmy sú tiež rezistentné voči celej škále antifungálnych látok, čo značne komplikuje terapiu takýchto infekcií [69]. Názory na význam tvorby biofilmu sú v súčasnej dobe veľmi podobné. Možno s určitosťou povedať, že asociácia voľných planktonických foriem do diferencovaného spoločenstva vo forme biofilmu predstavuje nástroj, ktorým bunky oveľa efektívnejšie čelia nepriazni okolitého prostredia [70, 71]. Výraz „Quorum sensing“ (politický význam pre uznášania schopnosť) presne vystihuje stav, kedy môže dôjsť ku tvorbe biofilmu. Na začiatku musí byť prítomné isté minimálne (kritické) množstvo mikrobiálnych buniek. Celý proces totiž spočíva v aktivačných dráhach medzi bunkami sprostredkovaných signálnymi molekulami. Medzibunková signalizácia zabraňuje premnoženiu kvasinkových buniek a prípadnému nedostatku živín. Rovnako dôležitá je aj v procese infekcie, najmä pri diseminácii a rozvoji perzistentnej infekcie. U C. albicans sú najvýznamnejšími regulátormi expresie génov zapojených do tvorby biofilmu alifatický alkohol farnezol a tyrozol. Majú antagonistický efekt, kým farnezol inhibuje proliferáciu buniek a tvorbu biofilmu, tyrozol naopak stimuluje tvorbu výpučkov a následné delenie buniek [72]. Hoci kvasinka C. glabrata nie je schopná filamentovať, predpokladá sa analogický efekt oboch zlúčenín pri formovaní biofilmu s výnimkou tvorby vláknitých štruktúr [46, 73]. Proces tvorby biofilmu predstavuje sled na sebe závislých reakcií.
Obr. 1. Zobrazenie medicínsky významnej tvorby biofilmu a jej úlohy v ochrane kvasiniek pred: (a, b) antimykotikami a protilátkami, (c, d) fagocytózou. Upravené podľa: (<a href="http://www.geocities.com/cesarcaro314/papers/Image9.jpg">http://www.geocities.com/cesarcaro314/papers/Image9.jpg</a>). Fig. 1. Representation of medically relevant biofilm formation and of its role in the protection of yeasts from: (a, b) antifungals and antibodies and (c, d) phagocytosis. Adapted from: (<a href="http://www.geocities.com/cesarcaro314/papers/Image9.jpg">http://www.geocities.com/cesarcaro314/papers/Image9.jpg</a>). 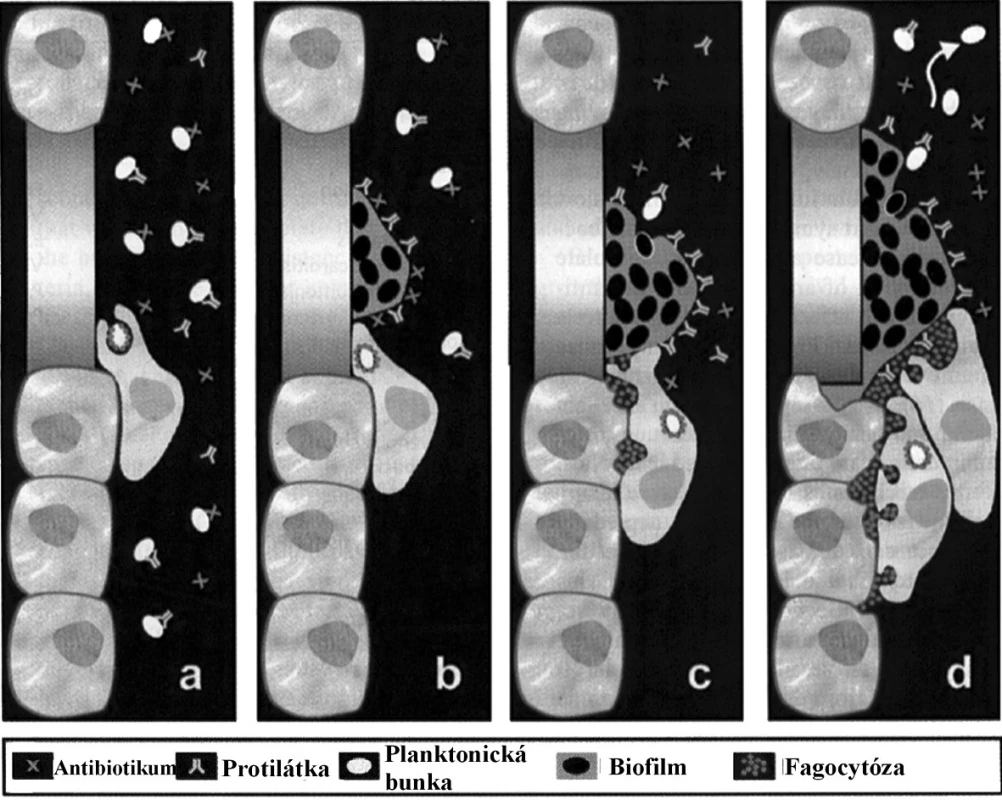
Primárnou fázou je adhézia solitérnych planktonických foriem a ich agregácia do mikrokolónií, ktorej výsledkom je vznik súvislej monovrstvy. Spájanie buniek je závislé na interakcii povrchových štruktúr, najmä adhezínov. Vytvorením súvislej monovrstvy dochádza k ďalšej maturácii biofilmu a k tvorbe mikrokolónií, na vznik ktorých nadväzuje diferenciácia makrokolónií. Tieto procesy predstavujú ireverzibilnú fázu a bunky takto spojené už nemôžu disociovať na voľné planktonické formy. Postupným organizovaním deliacich sa buniek sa formujú mnohopočetné póry a kanáliky, prostredníctvom ktorých sa zabezpečuje plynulá cirkulácia molekúl medzi bunkami v biofilme a okolitým prostredím. Póry majú pomerne veľký priesvit a prúdom tekutiny sú ľahko unášané častice latexu s priemerom 0,3μm [74, 75]. Neustále meniacu sa dynamiku biofilmu potvrdzuje fakt, že po dosiahnutí diferencovaného stavu sa niektoré bunky z kolónie oddeľujú a menia sa na planktonické formy schopné kolonizovať ďalšie povrchy. Toto štádium sa názyva aj disperzná fáza. Pritom si ale jednotlivé bunky ponechávajú istý čas svoj pôvodný fenotyp, najmä vyšší stupeň rezistencie proti antifungálnym látkam [76, 77]. Spúšťacie podnety pre zmenu regulácie v činnosti génov sú dané vonkajšími podmienkami v tvoriacom sa biofilme – zvýšený osmotický tlak, znížený obsah kyslíka a rastúca hustota populácie. V súčasnej klinickej praxi je podiel infekcií vyvolaných bakteriálnymi a fungálnymi patogénmi tvoriacimi biofilm viac než len významný. Vo svete celoplošne rastie podiel imunokompromitovaných pacientov s prolongovanou hospitalizáciou a tiež pacientov s dlhodobo zavedenými drénmi, kanylami, katétrami, tubusmi, príp. inými umelými náhradami do organizmu. Každý zo spomenutých faktorov je predispozíciou pre kolonizáciu biofilm tvoriacimi kvasinkami. Mortalita, zapríčinená kandidémiou, spôsobenou takýmito kmeňmi kvasiniek, je signifikantne vyššia v porovnaní s kandidémiou, spôsobenou kvasinkami, ktoré nie sú schopné tvoriť biofilm [78]. Z medicínskeho hľadiska predstavuje asociácia patogénnych mikroorganizmov do štruktúry biofilmu závažný terapeutický problém. Bunky kvasiniek rastúce v podobe biofilmu sú schopné odolávať vytrvalej terapii vďaka kombinácii ochranných mechanizmov ako sú: (i) znížená permeabilita extracelulárnej vrstvy zabraňujúca prieniku antifungálnych látok; (ii) zmenené chemické vlastnosti mikroenvironmentu na úrovni biofilmu, ktoré inaktivujú účinok antimykotík; (iii) aktivácia mechanizmov adaptívneho stresu a synchronizovaný rast a delenie buniek. Závažný problém predstavuje okrem spomínaných prítomnosť biofilm tvoriacich kvasiniek na oddeleniach ako sú ARO, chirurgia, traumatológia a jednotky popálenín. Kolonizácia povrchu, najmä už spomínaných kanýl, katétrov, drénov a tubusov, predstavuje hrozbu z hľadiska permanentného zdroja infekcie. Liečba takýchto ochorení často zlyháva, resp. exacerbuje, z dôvodu eradikácie len planktonických foriem mikroorganizmov prítomných v ložisku. Po ich sanácii sa však uvoľnia ďalšie jedince prítomné v biofilme a infekcia prepukne znova [79, 80].
Charakteristika mechanizmov rezistencie voči antifungálnym látkam u C. glabrata
Nielen u patogénnych kvasiniek predstavuje rezistencia proti klinicky relevantným antifungálnym látkam postupný sled rozličných procesov a mechanizmov. Dostupné antimykotiká patria na základe štruktúry iba k malému počtu chemicky odlišných látok, čo často spôsobuje vznik rezistencie proti viacerým liečivám súčasne. K mechanizmom zodpovedným za fenotyp rezistencie voči antifungálnym látkam patria najmä: (i) hyperexpresia či mutácia cieľového miesta, (ii) zmeny v zložení lipidov fungálnej cytoplazmatickej membrány, (iii) zvýšená expresia membránových efluxných púmp, ktorá má za následok mnohonásobnú rezistenciu proti štruktúrne a funkčne odlišným látkam. Enzymatická inaktivácia a modifikácia antimikróbnych látok predstavujúca rozšírený mechanizmus rezistencie u prokaryontov, nebola zatiaľ pozorovaná u kandíd. U fungálnych patogénov sa tiež nestretávame s prenosnou rezistenciou podmienenou horizontálnym transferom plazmidov či iných mobilných genetických elementov [6, 81, 82].
Mechanizmy rezistencie voči azolovým derivátom
V terapii mykotických ochorení sa najčastejšie využívajú imidazolové a triazolové antifungálne látky. Avšak ich nadmerná spotreba a permanentný selekčný tlak antimykotík indukuje najmä v nemocničnom prostredí vznik hyperinducibilných mutantných kmeňov kvasiniek, ktoré sú často rezistentné aj voči štrukturálne nepríbuzným látkam. Medzi najčastejšie mechanizmy rezistencie patogénnych kvasiniek rodu Candida proti azolom patria: (i) zmeny v bunkovej stene alebo cytoplazmatickej membráne; (ii) zmena afinity cieľovej štruktúry Erg11p (enzým 14α-lanosteroldemetyláza) spôsobená mutáciou či hyperexpresiou; (iii) aktívny eflux liečiva z bunky sprostredkovaný membránovými transportnými proteínmi [83, 84]. U kvasinky C. glabrata sa stretávame s tzv. vrodenou a získanou rezistenciou voči azolom. Molekulárny mechanizmus vrodenej rezistencie nie je presne známy, ale pravdepodobne zahŕňa nízku afinitu Erg11p k azolom, príp. schopnosť hyperexprimovať gén ERG11 počas vystavenia buniek prítomnosti azolov [85]. Vo fenotype získanej rezistencie figurujú dva mechanizmy. Nadexpresia membránových transportérov a génu ERG11. Aktívne vylučovanie xenobiotík z bunky sa realizuje dvomi typmi membránových transportérov: proteínmi patriacimi do skupiny primárnych ABC transportérov (ATP-Binding-Cassettes), ktorých zdroj energie pre transfer substrátov predstavuje ATP. Sú to napr. produkty génov CgCDR1 a CgCDR2 (PDH1). Druhú skupinu tvoria sekundárne MFS prenášače energizované protónmotívnym gradientom na cytoplazmatickej membráne (Major Facilitator Superfamily), ku ktorým patrí u C. glabrata napr. produkt génu CgMDR1 [18, 86, 87]. U C. glabrata bol in vitro popísaný fenomén zvýšenej rezistencie voči azolovým preparátom, tzv. HFAR (High-Frequency of Azole Resistance). Fenotyp HFAR je navodený po expozícii kvasiniek subinhibičným koncentráciám azolov a podľa viacerých autorov súvisí s nadexpresiou génov pre ABC-transportné proteíny [17, 88]. Mechanizmus HFAR je tiež úzko prepojený s funkčným stavom mitochondrií [16, 17, 89, 90]. Je možné, že sa stratou funkčných mitochondrií navodí nadprodukcia aj iných
Obr. 2. Schématické znázornenie ABC transportného systému. Upravené podľa: (<a href="http://www.ucm.es/info/mfar/U2/antifu2.gif">http://www.ucm.es/info/mfar/U2/antifu2.gif</a>). Fig. 2. Diagrammatic representation of the ABC transport system. Adapted from: (<a href="http://www.ucm.es/info/mfar/U2/antifu2.gif">http://www.ucm.es/info/mfar/U2/antifu2.gif</a>). 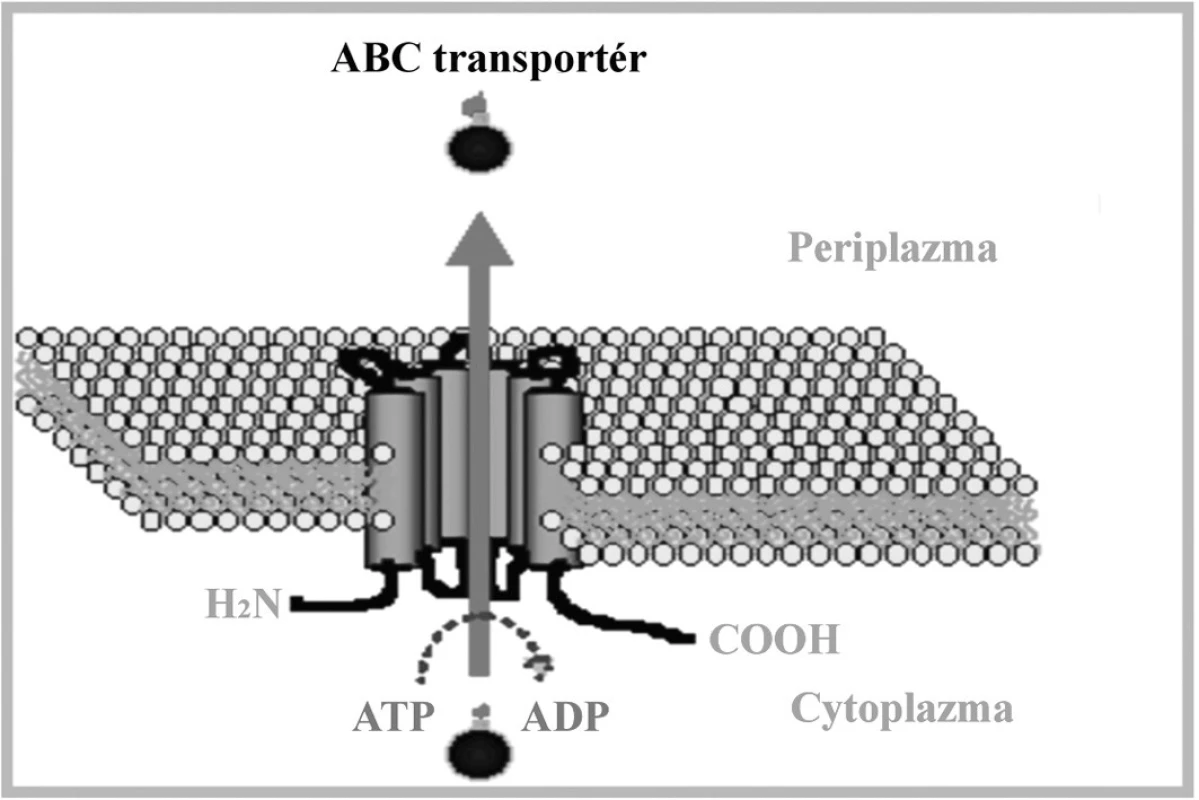
ABC-transportných proteínov, okrem CgCdr1p a CgCdr2p, čo je podporené zistením, že rho mutantny získané po etídium-bromidovej mutagenéze a defektné v génoch CgCDR1 a CgCDR2 vykazovali aj naďalej rezistenciu voči azolom [88]. Existuje tiež hypotéza, že funkčné mitochondrie zodpovedajú za konverziu netoxických prekurzorov ergosterolu na toxické. Preto je strata funkčných mitochondrií výsledkom selekčného tlaku navodeného použitím azolov [91]. Zlyhanie schopnosti kvasinkových buniek akumulovať azoly je vedúcou príčinou rezistencie voči tejto skupine liečiv. Tento fenomén sa pozoroval u C. albicans [92], C. glabrata [34], C. krusei [93, 94] a tiež v prípade Cryptococcus neoformans. Príčinu tohoto zlyhania predstavoval znížený influx alebo zvýšený eflux azolov z bunky. Nakoľko je vstup azolov do bunky sprostredkovaný, najmä pasívnou difúziou, je ich intracelulárna koncentrácia ovplyvnená zvýšeným efluxom z buniek. Najčastejšie je efluxný mechanizmus rezistencie asociovaný s aktivitou ABC a MFS transportérov. ABC transportéry sú zahrnuté v mnohých fyziologických procesoch, vrátane príjmu živín z prostredia, neklasickej sekrécii molekúl a toxínov a v neposlednom rade v mnohonásobnej rezistencii fungálnych patogénov. Ich fyziologickou funkciou je pravdepodobne detoxifikácia bunky, pretože sa podieľajú na vylučovaní endogénnych metabolitov, ako aj xenobiotík z bunky. Ďaľšou potenciálnou funkciou ABC proteínov je dynamická regulácia obdsahu lipidov a ich distribúcia v membráne. ATP-závislé pumpy sú schopné transportovať veľké množstvo štrukturálne rozdielnych substrátov, od malých iónov až po rozmerné proteíny. Transportný proces je poháňaný hydrolýzou ATP [95, 96]. Všetky ABC transportné pumpy majú podobnú štruktúru.
Sú zložené z jednej alebo dvoch základných štruktúrnych elementov: hydrofóbnej integrálnej membránovej domény obsahujúcej 4 až 6 transmembránových oblastí a ATP viažúcej domény orientovanej do cytosolu. Tieto domény obsahujú špecifické sekvencie: tzv. Walker A motív a Walker B motív, ktoré su od seba oddelené sekvenciou približne 120 aminokyselín. ABC signatúra, alebo C motív, je situovaná medzi Walker motívmi. Transmembránové domény tvoria cestu pre pohyb substrátu a determinujú tak substrátovú špecificitu transportného systému [97]. Gén CgCDR1 kóduje integrálny membránový proteín s veľkostou 169 kDa. Štruktúra a organizácia domén je typická pre ABC membránové proteíny [17, 98]. CgCDR1 vykazuje vysokú sekvenčnú homológiu s génom CDR1, ktorý bol prvýkrát izolovaný komplementáciou mutácie pdr5 kvasinky S. cerevisiae. CgCdr1p je s produktom Pdr5p identický na 75 %. Gén PDR5 je zodpovedný za rezistenciu voči cykloheximidu, chloramfenikolu, azolovým derivátom a iným nepríbuzným látkam. Komplementáciou došlo k znovuobnoveniu rezistencie, čím sa potvrdila účasť tohto proteínu na fenotype rezistencie. Delécia CgCDR1 vedie k hypersenzitivite voči flukonazolu, itrakonazolu, ketokonazolu, terbinafínu, amorolfínu, cykloheximidu, brefeldínu A, flufenazínu, metabolickým inhibítorom [99, 100] a k akumulácii azolov, čo poukazuje na kľúčovú úlohu tohto génu v rezistencii voči azolovým derivátom. Produkt génu CgCDR2/PDH1 má molekulovú hmotnosť 175 kDa a s CgCdr1p vykazuje 73% homológiu [100]. K jeho substrátom patri najmä azoly, terbinafín, amorolfín a ďalšie metabolické inhibítory. V práci Sanguinetti et al. (2005) sa pozorovala paralelná hladina expresie génov CgCDR1 a CgCDR2. Zatiaľ čo expresia génu CgCDR2 bola priemerná až podpriemerná, hladina CgCDR1 vykazovala úroveň hyperexpresie. Predpokladá sa, že na vzniku MDR sa gén CgCDR1 podieľa vyššou mierou ako gén CgCDR2 [101]. Fenotyp mnohonásobnej rezistencie môže byť u kvasinky C. glabrata spojený aj s nadexpresiou génu CgSNQ2, kódujúceho ABC transportér. Sekvencia génu vykazuje vysokú homológiu s génom ScSNQ2 kvasinky S. cerevisiae a 40 % homológiu s génom ScPDR5 tejto kvasinky [101]. Proteíny CgSnq2p a ScPdr5p sú podobné nielen štruktúrou, ale aj funkciou a čiastočnou substrátovou špecificitou. Promótorová oblasť génu ScSNQ2 obsahuje tri PDRE oblasti a YRE motívy, čo indukuje expresiu pod kontrolou transkripčných faktorov Pdr1p a Pdr3p a transkripčného faktora Yap1p [102]. Nadexpresia génu spôsobuje zvýšenie rezistencie voči mutagénom, ako napr. 4-nitrochinolínoxid (4NQO), sulfometuronmetyl, staurosporín, flufenazín, ale u C. glabrata aj voči flukonazolu [103]. ScSnq2p je esenciálny pre štandardný rast bunky [104]. Transkripčným regulátorom génov CgCDR1, CgCDR2/PDH1 aj CgSNQ2 je CgPdr1p, ktorý je homológom produktu génu PDR1 u S. cerevisiae. Transkripčný faktor s motívom zinkového prstu CgPdr1p sa podieľa na konštitutívnej i indukovanej expresii génov pre efluxné pumpy a tiež na expresii navodenej deléciou mtDNA [105, 106]. Gain of function mutácie génu CgPDR1 spojené so substitúciou aminokyselín v proteínovej štruktúre jeho produktu CgPdr1p zodpovedajú za hyperexpresiu génov pre membránové efluxné transportéry. Substitúcie aminokyselín W297S, F575L a P927L (Trp297Ser, Phe575Leu, Pro927Leu) v CgPdr1p zodpovedajú za konštitutívnu nadexpresiu génu CgPDR1 pre samotný transkripčný faktor a génov pre membránové efluxné pumpy CgCDR1 a CgCDR2 u klinických izolátov C. glabrata rezistentných voči azolom [85, 106]. V našom laboratóriu sme identifikovali viaceré mutácie CgPDR1, z ktorých však iba dve mali vplyv na substitúciu aminokyselín v CgPdr1p. Jednalo sa o zámenu L347F (Leu347Phe) a H576Y (His576Tyr) v CgPdr1p, ktoré pri expresii v hostiteľskom delečnom kmeni C. glabrata pdr1Δ navodili rezistenciu transformantov voči flukonazolu [107]. Mutácia spojená so zámenou prolínu v polohe 822 za leucín (P822L) viedla ku nadmernej expresii CgSNQ2, pričom nemala žiaden vplyv na zvýšenie expresie génov CgCDR1 a CgCDR2 [103]. Posledné štúdie na myšacom modeli navyše dokázali súvislosť a vplyv gain of function mutácií v géne CgPDR1 na zvýšenie virulencie a schopnosti kvasinky C. glabrata efektívnejšieprežívať v tele hostiteľa [108]. Transport látok prostredníctvom MFS transportérov je energizovaný protónmotívnou silou tvorenou membránovým potenciálom a elektrochemickým protónovým gradientom. MFS transportéry sú rozdelené do troch skupín označovaných ako I, II, a III. Kritériom tohto rozdelenia je počet a stupeň hydrofóbnosti domén [109, 110]. MFS transportéry sú prítomné v prokaryotických i eukaryotických bunkách a fungujú ako sekundárne aktívne transportéry, využívajúce symport, uniport a antiport na vylučovanie štruktúrne aj funkčne odlišných látok. V porovnaní s ABC transportérmi majú užšiu substrátovú špecificitu. MFS antiportery obsahujú konzervované motívy rozptýlené po celej dĺžke proteínu. Motívy A a B sú evolučne konzervované u všetkých MFS proteínov, s výnimkou motívu C typického pre transportéry s 12 a 14 transmembránovými segmentami. Motív C je charakteristický prítomnosťou repetitívnej sekvencie GXXXG, ktorá je nevyhnutná pri správnej konformácii helixov a dimerizácii. Vzhľadom na vyšší stupeň homológie proteínov v N-terminálnej časti, zodpovedá za substrátovu špecificitu pravdepodobne C-terminálna oblasť [110]. Štruktúra MFS transportérov je schématicky znázornená na obr. 3.
Obr. 3. Schématické znázornenie MFS transportného systému. Upravené podľa: (<a href="http://www.ucm.es/info/mfar/U2/antifu1.gif">http://www.ucm.es/info/mfar/U2/antifu1.gif</a>). Fig. 3. Diagrammatic representation of the MFS transport system. Adapted from: (<a href="http://www.ucm.es/info/mfar/U2/antifu1.gif">http://www.ucm.es/info/mfar/U2/antifu1.gif</a>). 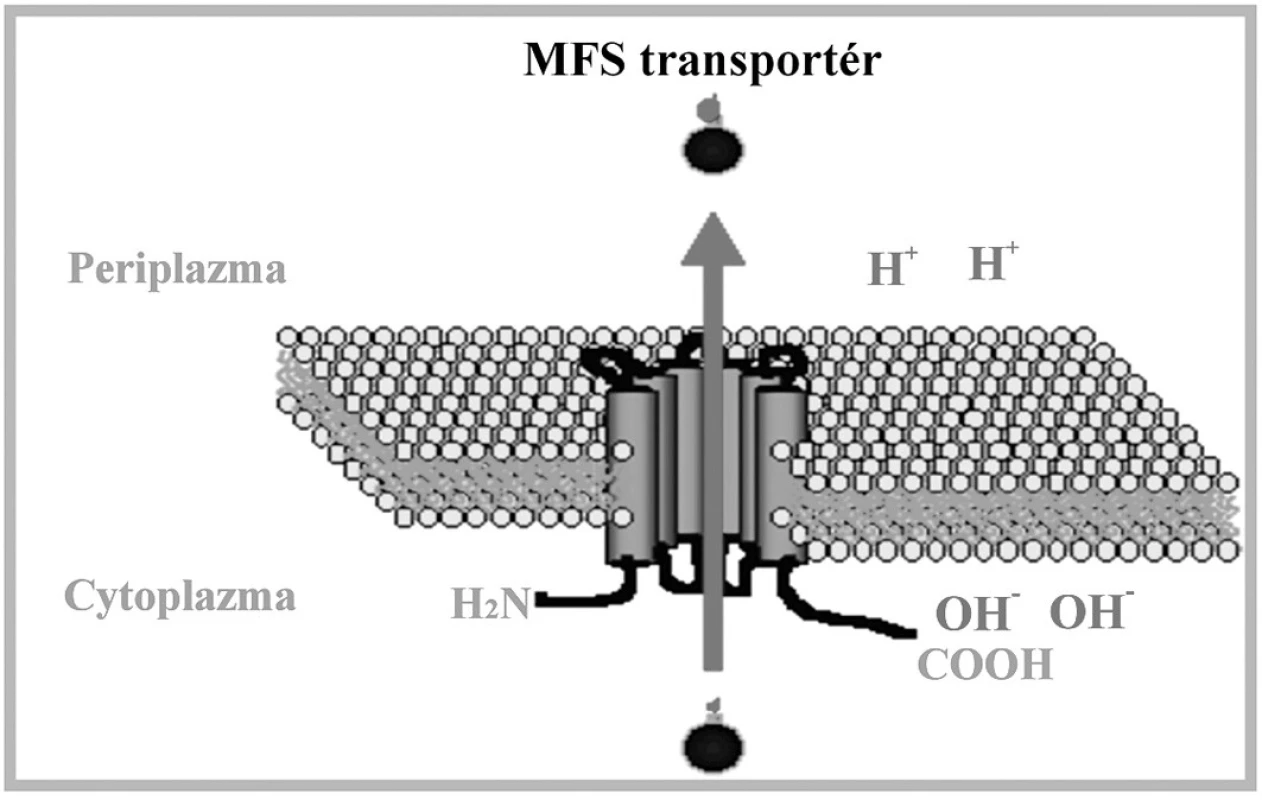
Jediný transportér z tejto skupiny identifikovaný u C. glabrata je produkt génu CgMDR1, o ktorom nie je veľa poznatkov [111]. Expresia CgMDR1 spôsobuje rezistenciu iba voči flukonazolu. Podrobnejšie je preštudovaný MFS transportér prítomný u C. albicans – CaMDR1. Proteín CaMdr1p je H+/substrát antiporter homologický s MFS transportérom ScFlr1p kvasinky S. cerevisiae a jeho nadexpresia v bunkách C. albicans vedie k fenotypu rezistencie voči širokej škále rôznych zlúčenín, napr. flukonazolu, cykloheximidu, metotrexátu, brefeldínu A, cerulenínu, 4NQO, 1,10-fenantrolínu [17], benomylu a flufenazínu [112]. V kmeňoch, v ktorých boli nezávisle od seba exprimované CaMdr1p a Cdr1p, sa pozorovalo, že síce oba transportéry zodpovedajú za eflux flukonazolu a metotrexátu, avšak afinita Cdr1p k metotrexátu je nižšia. Predpokladá sa, že spomínané proteíny sa líšia v substrátovej špecificite a sú zodpovedné za navodenie rezistencie voči rôznym inhibítorom [113]. Zvýšená expresia 14 α lanosteroldemetylázy, cieľového miesta azolových antimykotík, je taktiež zahrnutá v rezistencii voči tejto skupine liečiv. Zvýšená expresia génu ERG11 vedie k zvýšenej produkcii Erg11p, ktorého koncentrácia presiahne inhibičnú kapacitu intracelulárne lokalizovaných azolov. Hyperexpresia génu ERG11 môže byť spôsobená zmenou v regulácii transkripcie, za ktorú zodpovedajú najmä gain of function mutácie v génoch pre transkripčné faktory, ako napr. CgUPC2 [128]. U kmeňov C. glabrata rezistentných voči flukonazolu bola tiež dokázaná zvýšená amplifikácia génu ERG11 [37, 87, 114]. Azoly ovplyvňujú transkripčnú reguláciu promótora ERG11. Hladina indukcie je maximálna počas postdiauxického rastu a ovplyvňujú ju dva faktory: čas rastu v prítomnosti azolov a rastová fáza buniek v čase pridania azolov do kultivačného média. Iné inhibítory biosyntézy ergosterolu majú analogický efekt [115]. Mutácie v géne ERG11 sú bežným mechanizmom rezistencie voči azolom u klinických izolátov C. albicans. Znížená afinita azolových derivátov k cieľovému miestu je spôsobená substitúciou aminokyselín v proteínovej štruktúre Erg11p. Zámena aminokyselín zodpovedá za zmenu interagujúcich miest 14 α lanosteroldemetylázy buď priamo alebo nepriamo modifikáciou terciárnej štruktúry miesta vstupu. Môže nastať aj prípad, kedy liečivá vôbec nedosiahnú cieľové miesto [37, 116]. Tento mechanizmus rezistencie voči azolom nebol zatiaľ pozorovaný u kvasinky C. glabrata. Nami detegovaná mutácia v géne CgERG11 (A1505T) mala za následok substitúciu aminokyseliny v proteínovej štruktúre CgErg11p, ktorá znamenala nahradenie kyseliny glutámovej valínom v polohe 502 (Glu502Val). Heterologická expresia mutantnej alely CgERG11 v citlivom kmeni S. cerevisiae však nepotvrdila podieľ tejto mutácie na rezistecii voči azolom u klinických izolátov C. glabrata [107].
Mechanizmus rezistencie voči polyénom
Rezistencia proti polyénovým antimykotikám je u klinických izolátov kvasiniek pomerne vzácna, hoci má za posledných dvadsať rokov stúpajúci trend. Predpokladá sa, že za primárny mechanizmus rezistencie proti polyénom zodpovedá u patogénnych kvasiniek zablokovanie určitého kroku v biosyntetickej dráhe ergosterolu. Zablokovanie syntézy ergosterolu vedie k nahromadeniu jeho prekurzorov, ktoré sú v porovnaní s ergosterolom charakteristické zníženou afinitou k polyénom. Takýto mechanizmus rezistencie voči polyénom bol pozorovaný práve u klinických izolátov C. glabrata [117]. Kvantitatívna analýza obsahu sterolov v cytoplazmatickej membráne klinických izolátov odhalila hromadenie neskorých sterolových intermediátov spojené s deficitom maturovaného ergosterolu. Sekvenačná analýza génov CgERG11, CgERG6, CgERG5 a CgERG4 odhalila iba jedinú špecifickú missense mutáciu v géne CgERG6, ktorá spôsobila nahradenie cysteínu fenylalanínom v proteínovej štruktúre sterol-Δ24metyltransferázy. Zistilo sa tiež, že spomínané gény podliehajú zvýšenej expresii. Missense mutácia CgERG6 spôsobuje prerušenie biosyntézy ergosterolu, čím vyvoláva rezistenciu voči polyénom. Zmena v zložení sterolov cytoplazmatickej membrány kvasiniek vyvolaná opísanou mutáciou zodpovedá aj za tvorbu pseudohýf, ktorá sa pozorovala u klinického izolátu C. glabrata bez závislosti na použitom médiu [89, 117].
Mechanizmus rezistencie voči 5-fluorocytozínu a echinokandínom
Fluoropyrimidín 5-fluorocytozín patrí k štrukturálnym analógom dusíkatých báz a interferuje s metabolizmom pyrimidínových nukleotidov, čím inhibuje biosyntézu DNA, RNA a tým nepriamo aj syntézu proteínov. Rezistencia voči nemu môže byť spôsobená nedostatkom enzýmov esenciálnych pre metabolizmus 5-fluorocytozínu v bunke. Druhou možnosťou je deregulácia biosyntetickej dráhy pyrimidínov v bunke húb, ktorej produkty sú schopné kompetície s produktami metabolizmu 5-fluorocytozínu. U C. glabrata sa pozoroval prvý uvedený mechanizmus. Rezistencia voči 5-fluorocytozínu bola spôsobená stratou cytozínpermeázovej aktivity, čím nedochádzalo ku jeho konverzii na 5-fluorouridínmonofosfát [118, 119].
Rezistencia voči echinokandínom bola v prípade kvasinky C. glabrata pozorovaná len v ojedinelých prípadoch ako dôsledok zníženej afinity β (1,3)-D-glukánsyntázy (Fks1p) voči tejto skupine liečiv. Napriek tomu toho času nepredstavuje vážny problém [120].
Záver
C. glabrata je najčastejšie izolovaným druhom zo skupiny non-albicans a tiež druhým najčastejším pôvodcom kvasinkových vulvovaginitíd. Zvýšenú pozornosť si infekcie vyvolané C. glabrata zasluhujú najmä zníženou citlivosťou tohto druhu na flukonazol a vysokým percentom úmrtia pacientov so systémovou kandidózou vyvolanou C. glabrata. Charakteristika molekulárnych mechanizmov rezistencie voči antifungálnym látkam u klinických izolátov C. glabrata má význam z niekoľkých dôvodov. Jedným z nich je dôležitosť poznať spôsob, akým sa patogénne kvasinky bránia pred účinkom antifungálnych látok. Tento fakt je dôležitý pre ďalšiu efektívnu terapiu problematických infekcií spôsobených rezistentnými kmeňmi.
Poďakovanie:Táto práca vznikla za finančnej podpory grantov LPP-0022-06, LPP-0011-07, VVCE-0064-07 a grantu VEGA č. 1/0001/09.
Katedra mikrobiológie a virológie PF UK
RNDr. Norbert Berila
Mlynská dolina
842 15 Bratislava
Slovenská republika
e–mail: berila@fns.uniba.sk
Zdroje
1. Abi-Said, D., Anaissie, E., Uzun, O., Raad, I. et al., The epidemiology of hematogenous candidiasis caused by different Candida species. Clin Infect Dis, 1997, 24, 1122-1128.
2. Cheng, M.,Yang, Y., Yao, T., Lin, CH. et al., Risk factors for fatal candidemia caused by Candida albicans and non-albicans species. Infect Dis, 2005, 5, 22.
3. Diekema, D. J., Messer, S. A., Brueggemann, A. B. Epidemiology of candidemia : 3-year results from the emerging infections and the epidemiology of Iowa organisms study. J Clin Microbiol, 2002, 40, 1298-1302.
4. Brondz, I., Olsen, I. Multivariate analyses of cellular carbohydrates and fatty acids of Candida albicans, Torulopsis glabrata, and Saccharomyces cerevisiae. J Clin Microbiol, 1990, 28, 1854-1857.
5. Odds, F. C., Rinaldi, M. G., Cooper J. R. et al., Candida and Torulopsis: a blinded evaluation of use of pseudohypha formation as basis for identification of medically important yeasts. J Clin Microbiol, 1997, 35, 313-316.
6. Kaur, R., Domergue, R., Zupancic, M. L., Cormack, B. P. A yeast by any other name: Candida glabrata and its iteraction with the host. Curr Opinion Microbiol, 2005, 8, 378-384.
7. Lachke, S. A., Joly, S., Daniels, K., Soll, D. R. Phenotypic switching and filamentation in Candida glabrata. Microbiology, 2002a, 148, 2661-2674.
8. Srikantha, T., Zhao, R., Daniels, K., Radke, J., Soll, D. R. Phenotypic switching in Candida glabrata accompanied by changes in expression og genes with deduced functions in copper detoxifications and stress. Eucaryot cell., 2005, 4, 1434-1445.
9. Dujon, B., Sherman, D., Fisher, G., Durrens, P., Casaregola, S. Genome evolution in yeasts. Nature, 2004, 430, 35-44.
10. Kurtzmann, C. P., Fell, J. W. The yeasts, a taxonomic study. Elsevier Scientific B. V., 2000, Amsterdam, The Netherlands.
11. Larone, D. H. Medically important funghi: A guide to identification, 3rd ed. ASM Press, Washington, 1995 D.C.
12. Csank, C., Haynes, K. Candida glabrata displays pseudohyphal growth. FEMS Microbiol Lett., 2000, 189, 115-120.
13. Barnett, J. A., Payne, R. W., Yarrow, D. Yeasts: characteristic and identification. Cambridge University Press, 1983, Cambridge.
14. Fidel, P. L. Jr., Vazquez, J. A., Sobel, J. D. Candida glabrata: Review of epidemiology, pathogenesis and clinical disease with comparison to Candida albicans. Clin Microbiol Review, 1999, 12, 80-96.
15. Kocková-Kratochvílová, A. Taxonómia kvasiniek a kvasinkových mikroorganizmov. Alfa Bratislava,, 1990, 48-65.
16. Bouchara, J. P., Zouhair, R., Le Boudoil, S., Renier, G. et al., In-vivo selection of an azole-resistant petite mutant of Candida glabrata. J. Med Microbiol, 2000, 49, 977-984.
17. Sanglard, D., Ischer, F., Calabrese, D., Majcherczyk, P. A., Bille, J. The ATP binding cassette transporter gene CgCDR1 from Candida glabrata is involved in the resistance of clinical isolates to azole antifungal agents. Antimicrob. Agents Chemother, 1999, 43, 2753-2765.
18. Brun, S., Dalle, F., Saulnier, P., Renier, G. et al., Biological consequences of petite mutations in Candida glabrata. J. Antimicrob. Chemother., 2005, 56, 307-314.
19. Odds, F. C., Bernaerts, R. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol, 1998, 32, 1923-1929.
20. Bernal, S., Martín Mazuelos, E. Evaluation of the new API Candida system for identification of the most clinically important yeast species. Diag Microbiol Infect Dis, 1998, 32, 217-221.
21. Heelan, J. S., Siliezar, D., Coon, K. Comparison of rapid testing methods for enzyme production with the germ tube method for presumptive identification of Candida albicans. J Clin Microbiol, 1996, 34, 2487-2849.
22. Willinger, B. Laboratory diagnosis and therapy of inavsive fungal infections. Curr Drug Targets, 2006, 7, 513-522.
23. Boyanton, B. L. Jr., Luna, R. A., Fasciano, L. R., Menne, K. G., Versalovic, J. DNA pyrosequencing-based identification of pathogenic Candida species by using the internal transcribed spacer 2 region. Arch Pathol Lab Med, 2008, 132, 667-674.
24. Zeng, X., Kong, F., Halliday, C. Reverse line blot hybridization assay for identification of medically important fungi from culture and clinical specimens. J Clin Microbiol, 2007, 45, 2872-2880.
25. Dujon, B. Altogether now - sequencing the yeast genome. Curr Biol, 1992, 2, 279-281.
26. Dujon, B., Sherman, D., Fisher, G. Genome evolution in yeasts. Nature, 2004, 430, 35-44.
27. Cohn, M., McEachern, M. J., Blackburn, E. H. Telomeric sequence diversity within the genus Saccharomyces. Curr Genet, 1998, 33, 83-91.
28. Shu, H. H., Martin, N.C. RNase P RNA in Candida glabrata mitochondria is transcribed with substrate tRNAs. Nucleic Acids Res, 1991, 19, 6221-6226.
29. Koszul, R., Malpertuy, A., Frangeul, L., Bouchier, C. et al., The complete mitochondrial genome sequence of the pathogenic yeast Candida (Torulopsis) glabrata. FEBS Lett, 2003, 534, 39-48.
30. O’Connor, R. M., McArthur, C. R., Clark-Walker, G. D. Respiratory-deficient mutants of Torulopsis glabrata, a yeast with circular mitochondrial deoxyribonucleic acid of 6 μm. J Bacteriol, 1976, 126, 959-968.
31. Eggimann, P., Garbino, J., Pittet, D. Epidemiology of Candida species infections in critically ill non-immunocompromised patients. Lancet Infect Dis, 2003, 3, 685-702.
32. Meeěs De, T., Renaud, F. et al. Genetic structure of Candida glabrata populations in AIDS and non-AIDS patiens. J Clin Microbiol, 2002, 40, 2199-2206.
33. Nguyen, M. H., Peacock, D. J., Morrsis, A. J. The changing face of candidemia: emergence of non-Candida albicans species and antifungal resistance. Am J Med, 1996, 100, 617-623.
34. Hitchcock, C. A., Pye, G. W., Troke, E. M., Johnson, D., Warnock, D. W. Fluconazole resistance in Candida glabrata. Antimicrob. Agents Chemother, 2003, 37, 1962-1965.
35. Laverdiére, M., Rotstein, C., Bow, E. J., Roberts, R. S. et al., CANADIAN FLUCONAZOLE STUDY GROUP. Impact of prophylaxis on fungal colonization and infection rates in neutropenic patients. J Antimicrob. Chemother., 2000, 46, 1001-1008.
36. Newman, S. L., Flanigan, T. P., Fisher, A., Rinaldi, M. G., Stein, M., Vigilante, K. Clinically significant mucosal candidiasis resistant to fluconazole treatment in patients with AIDS. Clin Infect Dis, 1994, 19, 684-686.
37. Li, L., Redding, S., Dongari-Bagtzoglou, A. Candida glabrata, an emerging oral opportunistic pathogen. J Dent Res, 2007, 86, 204-215.
38. Guo, B., Styles, C. A., Feng, Q., Fink, G. R. A Saccharomyces gene family involved in invasive growth, cell-cell adjesion and mating. Proc Natl Acad Sci, 2000, 97, 12158-12163.
39. Las Penčz de, A., Pan, S. J., CastaĖo, I., Alder, J. et al., Virulence-related surface glycoproteins in the yeast pathogen Candida glabrata are encoded in subtelomeric clusters and subject to RAP-1 and SIR-dependent transcriptional silencing. Genes and Development, 2003, 17, 2245-2258.
40. Weig, M., Jänsch, L., Gross, U., Koster de, Ch. G. et al., Systematic identification in silico of covalently bound cell wall proteins and analysis of protein-polysaccharide linkages of the human pathoge Candida glabrata. Microbiology, 2004, 150, 3129-3144.
41. Dranginis, A. M., Rauceo, J. M., Coronado, J. E., Lipke, P. N. A biochemical guide to yeast adhesins: Glycoproteins for social and antisocial occasions. Microb Mol Biology Rev, 2007, 71, 282-294.
42. Loza, L., Fu, Y., Ibrahim, A. S., Sheppard, D. C. et al.,Functional analysis of the Candida albicans ALS1 gene product. Yeast, 2004, 21, 473-482.
43. Calderone, R. A., Braun, P. C. Adherence and receptor relationships of Candida albicans. Microbiol Rev, 1991, 1, 1-20.
44. Klotz, S. A., Gaur, N. K., Armond, R. D., Sheppard, D. Candida albicans Als proteins mediate aggregation with bacteria and yeasts. Medical Mycology, 2007, 45, 363-370.
45. Kuhn, D. M., Ghannoum, M. A. Candida biofilms: antifungal resistance and emerging therapeutic options. Curr Opin Investig. Drugs, 2004, 5, 186-197.
46. Kumamoto, C. A. Candida biofilms. Curr Opinion in Microbiol, 2002, 5, 608-611.
47. Chakrabarti, A., Nayak, N., Talwar, P. In vitro proteinase production by Candida species. Mycopathologia., 1991, 114, 163-168.
48. Samaranayke, L. P., Raeside, J. M., MacFarlane, T. W. Factors affecting the phospholipase activity of Candida species in vitro. Sabouraudia, 1984, 22, 201-207.
49. Al-Rawi, N., Kavangh, K. Characterisation of yeasts implicated in vulvovaginal candidosis in Irish woman. Br J Biomed Sci, 1999, 56, 99-104.
50. Lachke, S. A., Srikantha, T., Tsai, L. K., Daniels, K., Soll, D. R. Phenotypic switching in Candida glabrata involves phase-specific regulation of the metallothionein gene MT-II and the newly discovered hemolysin gene HLP. Infect Immun, 2002b, 68, 884-895.
51. Calcagno, A. M., Bignell, E., Warn, P., Jones, M. D., Denning, D. W. Candida glabrata STE12 is required for wild-type levels of virulence and nitrogen starvation induced filamentation. Mol Microbiol, 2003, 50, 1309-1318.
52. Glee P. M., Sunstrom P., Hazen K. C. Expression of surface hydrophobic proteins by Candida albicans in vivo. Infect Immun, 1995, 63, 1373-1379.
53. Singleton, D. R., Masuoka, J., Hazen, K. C. Cloning and analysis of a Candida albicans gene that affects cell surface hydrophobicity. J Bacteriol, 2001, 183, 3582-3588.
54. Masuoka, J., Hazen, K. C. Cell wall protein mannosylation determines Candida albicans cell surface hydrophobicity. Microbiology, 1997, 143, 3015-3021.
55. Singleton, D. R., Masuoka, J., Hazen, K. C. Surface hydrophobicity changes of two Candida albicans serotype B mn4DDD mutants. Eucaryotic Cell, 2005, Apr, 635-648.
56. Hazen, K. C., Hazen, B. W. Hydrophobic surface protein masking by the opportunistic fungal pathogen Candida albicans. Infect Immun, 1992, 60, 1499-1508.
57. Hazen, K. C., Lay, J. G., Hazen, B. W., Fu, F. C., Murthy, S. Partial biochemical characterisation of cell surface hydrophobicity and hydrophilicity of C. albicans. Infect Immun, 1990, 58, 3469-3476.
58. Luo, G., Samaranayke, L. P. Candida glabrata, an emerging fungal pathogen, exhibits superior relative cell surface hydrophobicity and adhesin to denture acrylic surfaces compared with Candida albicans. APMIS, 2002, 110, 601-610.
59. Egusa, H., Ellepola, A. N., Nikawa, H., Hamada, T. et al.,Sub-therapeutic exposure to polyene antimycotics elicits a pos-antifungal effect and depresses the cell surface hydrophobicity of oral Candida albicans isolates. J Oral Pathol Med, 2000, 29, 206-213.
60. Costerton, J. E. Microbial biofilms. Annu Rev Microbiol, 1995, 49, 711-745.
61. Nobile, C. J., Schneider, H. A., Nett, J. E. et al., Complementary adhesin functions in Candida albicans biofilm rormation. Curr Biol, 2008, 22, 1017-1024.
62. Ramage, G., Wickes, B. L., López-Ribot, J. L. A seed and feed model for the formation of Candida biofilms under flow conditions using an improved modified Robbins device. Rev Iberoam Mycol, 2008, 25, 37-40.
63. Avon, S. L., Goulet, J. P., Deslauriers, N. Removable acrylic resin disk as a sampling system for the study of denture biofilms in vivo. J Prosthet Dent, 2007, 97, 32-38.
64. Bachmann, S. P., Vandewalle, K., Ramage, G., Patterson, T. F. et al. In vitro activity of caspofungin against Candida albicans biofilm. Antimicrob Agents Chemother., 2002, 46, 3591-3596.
65. Ramage, G., Martinez, J. P., Lopez-Ribot, J. L. Candida biofilms on implanted biomaterials: a clinically significant problem. FEMS Yeast Res., 2006, 6, 979-986.
66. Chandra, J., Kuhn, D. M., Mulherjee, P. K., Hoyer, L. L., McCornick, T. Biofilm formation by the fungal pathogen Candida albicans. Development, architecture and drug resistance. J Bacteriol, 2001, 183, 5385-5394.
67. Garcia-Sanchez, S., Aubert, S., Iraqui, I., Janbon, G., Ghigo, J. M. Candida biofilms: a development state associated with specific and stable gene expression patterns. Eukaryot Cell, 2004, 3, 536-545.
68. O’Connor, L., Lahiff, S., Casey, F., Glennon, M. et al. Quantification of ALS gene expression in Candida species biofilms by RT-PCR using hybridisation probes on the LightCycler. Mol Cell Probes, 2005, 19, 153-162.
69. Seidler, M., Salvenmoser, S., Muller, F. M. In vitro effects of micafungin against Candida biofilms on polystyrene and central venous catheter sections. Int J Antimicrob Agents, 2006, 28, 568-573.
70. Costerton, J. W. Stewart and Greenberg. Biofilms: a common cause of persistante infections. Science, 1999, 284, 1318-1322.
71. D’Enfert, K. Biofilms and their role in the resistance of pathogenic Candida to antifungal agents. Curr Drug Targets, 2006, 4, 465-470.
72. Chen, H., Fujita, M., Feng, Q., Clardy, J., Fink, G. R. Tyrosol is quorum-sensing molecule in Candida albicans. Proc Nat Acad SCI USA, 2004, 101, 5048-5052.
73. Dhamnika, N., Hornby, J. M. Effect of farnesol on a mouse model of systemic candidiasis, determined by use of a DPP3 knockout mutant of Candida albicans. Infect and Immun, 2007, 75, 1609-1618.
74. Flemming, H. C., Wingender, J., Mayer, C., Korstgens, V., Borchard, W. Cohesiveness in biofilm matrix polymers, In: Community Structure and Co-operation in Biofilms. Cambridge University Press, 2000, Cambridge.
75. Thein, Z. M., Samaranayke, Y. H., Samaranayke, L. P. In vitro biofilm formation of Candida species under dynamic and anaerobic conditions. Archives of Oral Biology, 2007.
76. Mishra, N. N., Prasad, T., Sharma, N., Payasi, A. et al. Pathogenicity and drug resistance in Candida albicans and other yeast species. A review. Acta Microbiol Immunol Hung, 2007, 54, 201-235.
77. Nett, J., Andes, D. Candida biofilm development, modeling and host-pathogen inetraction. Curr. Opinion in Microbiol, 2006, 9, 340-345.
78. Tumbarello, M., Posteraro, B., Trecarichi, E. Biofilm production by Candida species and inadequate antifungal therapy as predictors of mortality for patients with candidemia. J Clin Microbiol, 2007, June p. 1843-1850.
79. Donlan, R. M. Biofilms and device-associated infections. Emerg. Infect Dis, 2001, 7, 277-281.
80. Raad, I. Intravascular-catheter-related infections. Lancet, 1998, 351, 893-898.
81. Bambeke, F., Balzi, E., Tulkens, P. M. Antibiotic efflux pumps., Biochem. Pharmacol, 2000, 15. 60, 457-470.
82. Bialkova, A., Subik, J. Biology of the pathogenic yeast Candida glabrata. Folia Microbiol, 2006, 51, 3-20.
83. Nguyen, M. H., Clancy, C. J., Yu, V. L., Morris, A. J. Do in vitro susceptibilzy data predict the microbiologic response to amphotericin B? Results of a prospective study of patients with Candida fungemia. J Infect Dis, 1998, 177, 425-430.
84. Redding, S. W., Kirkpatrick, W. R., Saville, S., Coco, B. J. et al. Multiple patterns of resistance to fluconazole in Candida glabrata isolates from a patient with oropharyngeal candidiasis receiving head and neck radiation. J Clin Microbiol, 2003, 41, 619-622.
85. Vermitsky, J. P., Edlind, T. D. Azole resistance in Candida glabrata: coordinate upregulation of multidrug transporters and evidence for a Pdr1-like transcription factor. Antimicrob Agents Chemother, 2004, 48, 3773-3781.
86. Kozovská, Z., Šubík, J. Modulácia mnohonásobnej rezistencie. Biologické listy, 2004, 69, 161-190.
87. Sanglard, D. Resistance of human fungal pathogens to antifungal drugs. Curr Opinion Microbiol, 2002, 5, 379-385.
88. Sanglard, D., Ischer, F., Bille, J. Role of ATP-binding-cassette transporter gene in high-frequency acquisition of resistance to azole antifungals in Candida glabrata. Antimicrob Agents Chemother, 2001, 45, 1174-1183.
89. Batova, M., Borecka-Melkusova, S., Simockova, M., Dzugasova, V. et al. Functional characterization of the CgPGS1 gene reveals a link between mitochondrial phospholipid homeostasis and drug resistance in Candida glabrata. Curr Genet, 2008, 53, 313-322.
90. Defontaine, A., Bouchara, J. P., Declerc, P., Planchenault, C. et al. In-vitro resistance to azoles associated with mitochondrial deficiency in Candida glabrata. J Med Microbiol, 1999, 48, 663-670.
91. Kontoyiannis, D. P. Modulation of fluconazole sensitivity by the interaction of mitochondria and Erg3p in Saccharomyces cerevisiae. J Antimicrob Chemother, 2000, 46, 191-197.
92. Sanglard, D., Kuchler, K., Ischer, F., Pagani, J. L. et al. Mechanisms of resistance to azole antifungal agents in Candida albicans isolates from AIDS patients involve specific multidrug transporters. Antimicrob Agents Chemother, 1995, 39, 2378-2386.
93. Denning, D. W., Venkateswarlu, K., Manning, N. J., Kelly, S. L. Reduced accumulation of drug in Candida krusei accounts for itraconazole resistance. Antimicrob Agents Chemother, 1996, 40, 2443-2446.
94. Venkateswarlu, K., Denning, D. W., Kelly, S. Inhibition and interaction of cytochrome P-450 of Candida krusei with azole antifungal drugs. J Med Vet Mycol, 1997, 35, 19-25.
95. Schmitt, L., Tampé, R. Structure and mechanisms of ABC transporters. Curr Opin Struct Biol, 2002, 12, 754-760.
96. Sipos, G., Huchler, K. Fungal ATP-binding cassette (ABC) transporters in drug resistance and detoxification. Curr Drug Targets, 2006, 7, 471-481.
97. Rea, P. A. MRP subfamily ABC transporters from plants and yeast. J Exp Bot, 1999, 50, 895-913.
98. Prasad, R., Kapoor, K. Multidrug resistance in yeast Candida. Internat. Rev Cyt, 2005, 215-248.
99. Sanglard, D., Ischer, F., Monod, M., Bille, J. Susceptibilities of Candida albicans multidrug transporter mutants to various antifungal antigens and other methabolic inhibitors. Antimicrob Agents Chemother, 1996, 40, 2300-2305.
100. Wada, S., Niimi, M., Niimi, K., Holmes, A. R., Monk, B. C. et al. Candida glabrata ATP-binding cassette transporters Cdr1p and Pdh1p expressed in a Saccharomyces cerevisiae strain deficient in membrane transporters show phosphorylation-dependent pumping properties. J Biol Chem, 2002, 227, 46809-46821.
101. Sanguinetti, M., Posteraro, B., Fiori, B., Ranno, S. et al. Mechanisms of azole resistance in clinical isolates og Candida glabrata collected during a hospital survey of antifungal resistance. Antimicrob Agents Chemother, 2005, 49, 668-679.
102. Mahe, Y., Lemoine, Y., Kuchler, K. The ATP binding cassette transporters Pdr5 and Snq2 of Saccharomyces cerevisiae can mediate transport of steroids in vivo. J Biol Chem, 1996, 271, 25167-25172.
103. Torelli, R., Posteraro, B., Ferrari, S., La Sorda, M. et al. The ATP-binding cassette transporter-encoding gene CgSNQ2 is contributing to the CgPDR1-dependent azole resistance of Candida glabrata. Mol Microbiol, 2008, 1, 186-201.
104. Decottignies, A., Lambert, L., Catty, P., Degand, H. et al. Identification and characterization of SNQ2, a new multidrug ATP binding cassette transporter of the yeast plasma membrane. J Biol Chem, 1995, 270, 18150-18157.
105. Drobna, E., Bialkova, A., Subik, J. Transcriptional regulators of seven yeast species: comparative genome analysis: Review Folia Microbiol, 2008, 53, 275-287.
106. Tsai, H. F., Krol, A. A., Sarti, K. E., Bennett, J. E. Candida glabrata PDR1, a transcriptional regulator of a pleiotropic drug resistance network, mediates azole resistance in clinical isolates and petite mutants. Antimicrob Agents Chemother, 2006, 50, 1384-1392.
107. Berila, N., Borecka, S., Dzugasova, V., Bojnansky, J., Subik, J. Mutations in the CgPDR1 and CgERG11 genes in azole resistant Candida glabrata clinical isolates in Slovakia. Int J Antimicrob Agents, 2009, 33, 574-578.
108. Ferrari, S., Ischer, F., Calabrese, D., Posteraro, B. et al. Gain of function mutations in CgPDR1 of Candida glabrata not only mediate antifungal resistance but also enhance virulence. PLOS Pathogens., 2009, 5, e1000268.
109. Calabrese, D., Bille, J., Sanglard, D. A. novel multidrug efflux transporter gene of major facilitator superfamily from Candida albicans (FLU1) confering resistance to fluconazole. Microbiol, 2000, 146, 2743-2754.
110. Del Sorbo, G., Schoonbeek, H. J., De Waard, M. A. Fungal transporters involved in efflux of natural toxic compounds and fungicides. Fungal Genet Biol, 2000, 30, 1-15.
111. White, T. C. Increased mRNA levels of ERG16, CDR and MDR1 correlate with increases in azole resistance in Candida albicans isolates from a patient infected with human imunodeficience virus. Antimicrob Agents Chemother, 1997, 28, 1482-1487.
112. Pasrija, R., Banerjee, D., Prasad, R. Structure and function analysis of a CaMdr1p, a major facilitator superfamily antifungal efflux transporter protein of Candida albicans: identification of amino acid residues critical for drug/H+ transport. Eukaryot Cell, 2007, 6, 443-453.
113. Kohli, A., Gupta, V., Krishnamurthy, S., Hasnain, S. E., Prasad, R. Specificity of drug transport mediated by CaMDR1: a major facilitator of Candida albicans. J Biosci, 2001, 26, 333-339.
114. Lyons, Ch. N., White, T. C. Transcriptional analyses of antifungal drug resistance in Candida albicans. Antimicrob Agents Chemother, 2000, 44, 2296-2303.
115. Song, J. L., Harry, J. B., Eastman, R. T., Oliver, B. G., White, T. C. The Candida albicans lanosterol 14-α-demethylase (ERG11) gene promoter is maximally induced after prolonged growth with antifungal drugs. Antimicrob Agents Chemother, 2004, 48, 1136-1144.
116. Marichal, P., Koymans, L., Willemsens, S., Bellens, D. Contributions of mutations in cytochrome P450 14α-demethylase (Erg11p, Cyp51p) to azole resistance in Candida albicans. Microbiol, 1999, 145, 2701-2713.
117. Vandeputte, P., Tronchin, G., Bergés, T., Hennequin, Ch. et al. Reduced susceptibility to polyenes associated with a missense mutation in the ERG6 gene in a clinical isolate of Candida glabrata with pseudohyphal growth. Antimicrob. Agents Chemother, 2007, 51, 982-990.
118. Carrillo-MuĖoz, A. J., Quindós, G., López-Ribot, J. L. (2004) Current developments in antifungal agents. Curr Med Chem Antiinfect Agents 3 : 297-323.
119. Sanglard, D., Ischer, F., Monod, M., Bille, J. Susceptibilities of Candida albicans multidrug transporter mutants to various antifungal antigens and other methabolic inhibitors. Antimicrob Agents Chemother, 2002, 40, 2300-2305.
120. Katiyar, S., Pfaller, M., Edlind, T. Candida albicans and Candida glabrata clinical isolates exhibiting reduced echinocandin susceptibility. Antimicrob Agents Chemother, 2006, 50, 2892-2894.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2010 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Vzpomínka na MUDr. Františka Galliu(k 60. výročí jeho úmrtí)
- Mobilní genetické elementy v epidemiologii rezistence bakterií k antibiotikům
- Oportúnne patogénna kvasinka Candida glabrata a jej mechanizmy rezistencie voči antimykotikám (súborný referát)
- Citlivosť kmeňov Staphylococcus aureus rastúcich v biofilme na vankomycín, gentamicín a rifampicín
- Zemřel prof. MUDr. Jiří Horáček, CSc. (24. 3. 1941 – 28. 3. 2010)
- Staphylococcus saprophyticus – jeho rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných z moče
- Genotypizace virového glykoproteinu B (gB) u příjemců transplantátu kmenových buněk krvetvorby s aktivní infekcí cytomegalovirem – sledování vlivu genotypů na průběh infekce
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Staphylococcus saprophyticus – jeho rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných z moče
- Oportúnne patogénna kvasinka Candida glabrata a jej mechanizmy rezistencie voči antimykotikám (súborný referát)
- Mobilní genetické elementy v epidemiologii rezistence bakterií k antibiotikům
- Citlivosť kmeňov Staphylococcus aureus rastúcich v biofilme na vankomycín, gentamicín a rifampicín
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



