-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv dlouhodobé terapie adalimumabu na biomarkery systémového zánětu u psoriázy
The Influence of Long Term Therapy with Adalimumab on Biomarkers of Systemic Inflammation in Psoriasis
Patients with psoriasis are at increased risk of atherosclerosis, which is characterized by endothelial dysfunction associated with systemic inflammation. It appears that anti-tumor necrosis alpha treatment may reduce this risk. The purpose of this study was to measure serum marker levels associated with systemic inflammation in patients with psoriasis compared to healthy subjects and to further evaluate the change in their levels after 3 months and 2 years of treatment with adalimumab. We investigated four biomarkers: highly sensitive C-reactive protein (hsCRP), oxidized low density lipoproteins (OxLDL), E-selectin and Interleukin 22 (IL-22). These markers were determined in healthy volunteers and in 28 patients with moderate to severe psoriasis before and after 3 and 24 months of adalimumab treatment. Patients with psoriasis had elevated markers levels compared to controls. After 3 months of treatment, E-selectin decreased significantly (p < 0.001), same as IL-22 (p < 0.001). HsCRP also decreased, but statistically insignificantly, OxLDLs were slightly higher than originally. After 24 months, 17 patients were still treated with adalimumab. In these patients, HsCRP (p < 0.05), E-selectin (p < 0.001) and IL-22 (p < 0.001) were significantly reduced. The OxLDL value remained elevated. A steady decrease in E-selectin, hsCRP and IL-22 after 24 months confirms that adalimumab suppresses systemic inflammation. Key words: adalimumab – biomarkers – psoriasis
Keywords:
adalimumab – biomarkers – Psoriasis – systemic inflammation
Autoři: S. Gkalpakiotis 1; P. Arenberger 1; S. Tivadar 1; P. Gkalpakioti 1; J. Potočková 2; P. Kraml 2
Působiště autorů: Dermatovenerologická klinika, 3. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, přednosta prof. MUDr. Petr Arenberger, DrSc, MBA, FCMA 1; Interní klinika, 3. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, přednosta prof. MUDr. Ivan Rychlik, CSc., FASN, FERA 2
Vyšlo v časopise: Čes-slov Derm, 96, 2021, No. 4, p. 179-185
Kategorie: Terapie, farmakologie a klinické studie
Souhrn
Pacienti s psoriázou jsou vystaveni zvýšenému riziku aterosklerózy, která je charakterizovaná endotelovou dysfunkcí spojenou se systémovým zánětem. Zdá se, že léčba anti-tumor nekrotizujícím faktorem alfa (anti-TNF-a) může toto riziko snížit. Účelem studie bylo změřit hladiny sérových markerů asociovaných se systémovým zánětem u pacientů s psoriázou v porovnaní se zdravými jedinci a dále zhodnotit změnu jejich hladin po 3 měsících a 2 letech při léčbě anti-TNF alfa adalimumabem. Zkoumali jsme čtyři biomarkery: vysoce senzitivní C-reaktivní protein (hsCRP), oxidovaný lipoprotein s nízkou hustotou (OxLDL), E-selektin a Interleukin 22 (IL-22). Tyto markery byly stanoveny u zdravých dobrovolníků a u 28 pacientů se středně těžkou až těžkou psoriázou před léčbou a po 3 a 24 měsících léčby adalimumabem. Pacienti s psoriázou měli zvýšené hladiny markerů ve srovnání s kontrolní skupinou. Po 3 měsících léčby významně poklesl E-selektin (p < 0,001), stejně tak IL-22 (p < 0,001). HsCRP pokleslo také, ale statisticky nevýznamně, OxLDL byl lehce vyšší než původně. Po 24 měsících bylo 17 pacientů stále léčeno adalimumabem. U těchto pacientů hsCRP (p < 0,05), E-selektin (p < 0,001) a IL-22 (p < 0,001) byly signifikantně snížené. Hodnota OxLDL zůstala zvýšena. Stabilní pokles E-selektinu, hsCRP a IL-22 po 24 měsících potvrzuje, že adalimumab potlačuje systémový zánět.
Klíčová slova:
adalimumab – biomarkery – psoriáza – systémový zánět
1. ÚVOD
Psoriáza je zánětlivé imunitně zprostředkované kožní onemocnění. Postihuje přibližně 2–4 % světové populace, přičemž nejnižší prevalence je v asijské populaci [12]. V posledních letech bylo zjištěno, že psoriáza je asociována s dalšími komorbiditami jako je psoriatická artritida, obezita, diabetes mellitus, dyslipidemie, arteriální hypertenze, zánětlivé onemocnění střev a deprese [4]. Zároveň je psoriáza významně spojována se zvýšeným rizikem s aterosklerózouasociovaného kardiovaskulárního onemocnění (CVD) [3, 8, 13, 22, 23]. Důvodem se zdá být systémový zánět, který byl popsán v roce 2011 jako „psoriatický pochod“ [2]. Aby se prokázalo, že pacienti s psoriázou mají vyšší riziko aterosklerózy, někteří autoři zkoumali tloušťku komplexu intima-media (IMT) krčních tepen, zatímco jiní, včetně naší skupiny, měřili různé, s aterosklerózou asociované biomarkery [1, 6, 7, 9, 27, 29]. V první studii jsme zjistili, že sérové hladiny E-selektinu, interleukinu 22 (IL-22), C-reaktivního proteinu měřeného vysoce senzitivním testováním (hsCRP) a komplexu oxidovaného lipoproteinu s nízkou hustotou (OxLDL-b2GPI) byly signifikantně zvýšené u pacientů s psoriázou v porovnání se zdravou kontrolou [9]. Systémová léčba psoriázy, jakou je inhibitor tumor nekrotizujícího faktoru alfa (anti-TNF-α) se zdá být efektivním přístupem v potlačování systémového zánětu [6, 11, 20, 21]. V naší první studii byly u 21 pacientů se středně těžkou až těžkou psoriázou před léčbou adalimumabem a po léčbě, stejně jako u zdravých kontrol, měřeny následující biomarkery: hsCRP jako obecný marker zánětu, OxLDL představující oxidovanou modifikaci nejaterogennějšího lipoproteinu LDL, oxidovaný lipoprotein s nízkou hustotou/β-2 glykoprotein I komplex (OxLDL/β2GPI), který formuje komplexy s imunoglobuliny v plazmě a je spolulokalizovaný s imunoreaktivními lymfocyty v aterosklerotických lézích, markery endoteliální dysfunkce jako vaskulární adhezní molekula 1 (VCAM -1) a E-selektin, IL-22, který je efektorovým cytokinem CD4+ T pomocných lymfocytů podskupiny Th22. Zvýšené koncentrace výše uvedených markerů byly sledovány u pacientů s manifestní aterosklerózou [3, 10, 15, 17, 18, 26, 24, 25, 26, 28). U psoriatiků byla většina markerů signifikantně zvýšená. Pacienti po 3měsíční léčbě adalimumabem měli v porovnání s kontrolní skupinou statisticky signifikantní pokles E-selektinu a IL-22. Hodnoty hsCRP poklesly také, ale nedosáhly statistického rozdílu. Zbytek markerů neprokázal signifikantní pokles [9]. Abychom poukázali, že pokles markerů po 3 měsících nebyl dočasný, přetestovali jsme hodnoty IL-22, E-selektinu a hsCRP po 24 měsících u pacientů kontinuálně léčených adalimumabem. Hodnoty OxLDL po 3 měsících byly lehce zvýšené. Abychom eliminovali možnost náhodného zvýšení OxLDL, doplnili jsme další testování po 24 měsících a současně jsme navýšili počet pacientů ve studii.
2. MATERIÁLY A METODY
Do studie bylo zahrnuto celkem 28 pacientů (15 mužů a 13 žen) s ložiskovou psoriázou a Psoriasis area and severity indexem (PASI) nad 10, naivní na biologickou léčbu a bez systémové terapie v posledních 3 měsících. Ke snížení rizika zkreslení výsledků byli vyloučení pacienti s psoriatickou artritidou, taktéž pacienti s hypercholesterolemií, hypetriglycidemií, diabetes mellitus a arteriální hypertenzí. Venózní krev byla odebrána před terapií, dále 3 měsíce a 24 měsíců po terapii adalimumabem (Humira) v klasickém dávkování pro psoriázu (80 mg subkutánní injekce na úvod, následně 40 mg po týdnu a poté 40 mg každý druhý týden). Do kontrolní skupiny bylo zařazeno 24 zdravých dobrovolníků a roztříděno podle věku, pohlaví a hodnoty BMI (Body Mass Index – index tělesné hmotnosti). Všichni účastníci studie souhlasí se zařazením do sledování.
Vzorky 10 ml venózní krve byly odebírány ráno do zkumavek po minimálně 10hodinovém lačnění a ponechány ke sražení. Zkumavky byly subsekvenčně centrifugovány na 2000 g po dobu 10 min při pokojové teplotě a následně uchované při -70 °C k další analýze.
Všechny vybrané markery byly stanoveny vysoce senzitivní ELISA (Enzyme-Linked ImmunoSorbent Assay) testy s použitím OxLDL ELISA kitu (Mercodia, Uppsala, Švédsko), E-selektin ELISA kitu (R&D systems, Minneapolis, Minnesota), CRP ultrasensitivního ELISA kitu (Biovendor, Brno, Česká republika) a Interleukin 22 ELISA kitu (R&D, Minneapolis, Minnesota).
Použili jsme jeden vzorek od každého pacienta a zdravého subjektu.
Statistická analýza byla provedena použitím Statistica 8.0 softwaru (Statsoft, USA). K srovnání 2 nezávislých vzorků s normální distribucí byl použit Student’s t-test a analýza vícerých skupin byla provedena použitím ANOVA testu. Korelace analýz byla provedena použitím Pearsonova korelačního koeficientu. Hodnoty p <0,05 byly považovány za statisticky významné.
3. VÝSLEDKY
3. 1. Biomarkery u psoriatických pacientů a porovnání s kontrolní skupinou
V úvodu měli pacienti se středně těžkou/těžkou psoriázou (28 pacientů) významně vyšší sérové koncentrace E-selektinu (54,73 ng/ml, SD 23,56 ng/ml) v porovnání se zdravými (27,75 ng/ml, SD 8,71 ng/ml), p < 0,001. Podobné výsledky byly pozorovány u hsCRP (3,94 μg/ml; SD 4,28 μg/ml), vs. (1,10 μg/ml; SD 1,29 μg/ml), p = 0027 a IL-22 (23.47 pg/ml; SD 20,03 pg/ml) vs. (6,70 pg/ml; SD 4,75 pg/ml), p < 0,001. Průměrná hodnota OxLDL (47,30 U/l; SD 13,31 U/l) nedosáhla statistického významu, i když u pacientů s psoriázou byla vyšší v porovnání s kontrolní skupinou (39,98U/l; SD 10,40 U/l).
3.2 Korelační analýzy
Nezjistili jsme žádnou korelaci mezi PASI skóre nebo BMI a kterýmkoliv ze zkoumaných markerů. Průměrná hodnota skóre PASI byla 26,72 před léčbou adalimumabem. Pacienti s psoriázou a kontrolní skupina byli spárováni na základě věku, pohlaví a BMI (tab. 1).
Tab. 1. Demografická data pacientů s psoriázou a zdravých kontrol 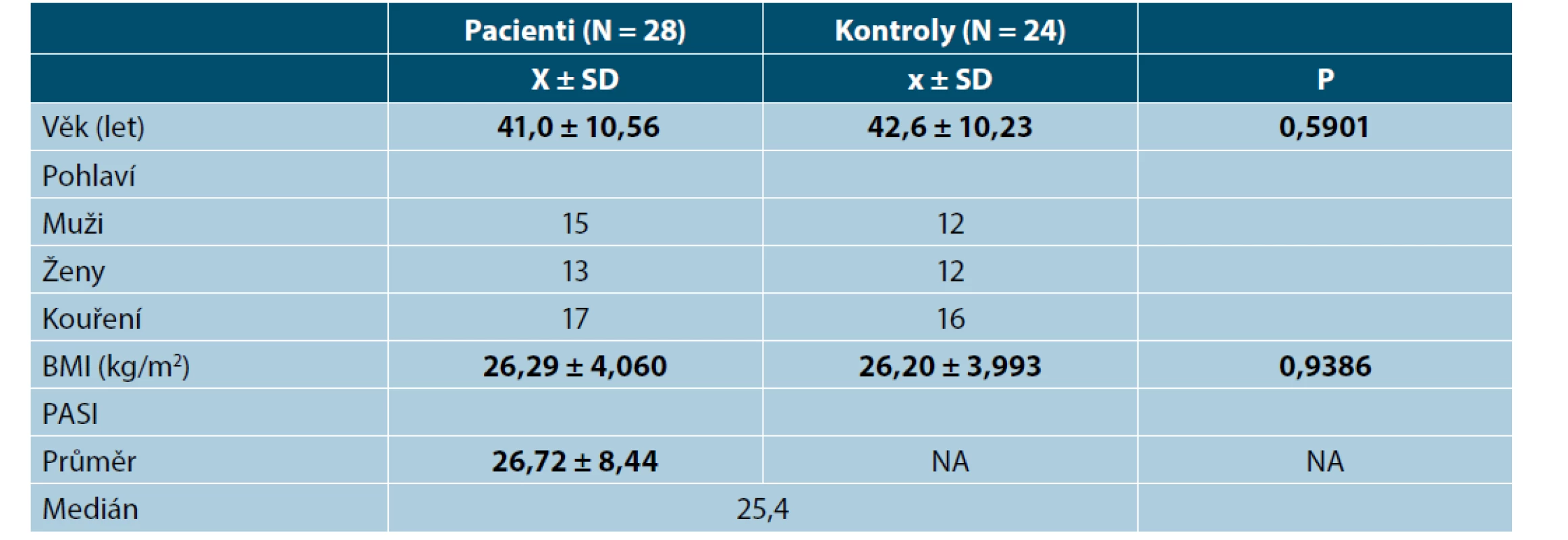
BMI – Body mass index, PASI – Psoriasis area and severity index, NA – Not Applicable
Hodnoty v tabulce jsou uvedeny jako průměr ± směrodatná odchylka, počty zastoupení v podskupinách a medián. Za statisticky významné je považováno p < 0,05.Po 3 měsících léčby adalimumabem jsme zhodnotili markery u 26 pacientů, 2 odmítli druhý odběr krve. Po 24 měsících celkem 17 pacientů setrvalo na léčbě adalimumabem. Tři pacienti se nedostavili na kontrolu a 6 pacientů nedosahovalo 50% zlepšení PASI a byli převedeni na jinou biologickou léčbu. Průměrné PASI u pacientů přetrvávajících na léčbě bylo 1,5 (obr. 1). Analyzovali jsme biomarkery po 3 měsících terapie adalimumabem a výsledky ukázaly statisticky významnou redukci E-selektinu (54,73 ng/ml; SD 23,56 ng/ml) vs. (35,32 ng/ml; SD 8,38 pg/ml), p < 0,001 a IL-22 (23,74 pg/ml; SD 20,03 pg/ml) vs. (11,44 pg/ml; SD 8,54 pg/ml; p <0,001). Hodnoty hsCRP (3,94 μg/ml; SD 4,28 μg/ml) vs. (2,5 μg/ml; SD 2,62 μg/l) byly také snížené, ale nevykazovaly statistický rozdíl. Hodnota OxLDL neklesla po 12 týdnech a naopak byla zvýšená (47,30 pg/ml; SD 13,31 pg/ml) vs. (51,89 pg/ml; SD 14,29 pg/ml). Po 24 měsících na léčbě adalimumabem byly u 17 pacientů sérové hodnoty E-selektinu (37,44 pg/ml; SD 10,77 ng/ml; obr. 2), IL-22 (5,84 ng/ml; SD 6,28 ng/ml, obr. 3) a hsCRP (2,07 ng/ml; SD 2,22 ng/ml; obr. 4). Ve srovnání se sérovými hodnotami před léčbou adalimumabem, všechny 3 markery ukázaly statisticky významné snížení. OxLDL stouplo po 24 měsících (70,79 ng/ml; SD 17,99 ng/ml; obr. 5).
Obr. 1. Změna PASI skóre 3 měsíce a 24 měsíců po nasazení adalimumabu 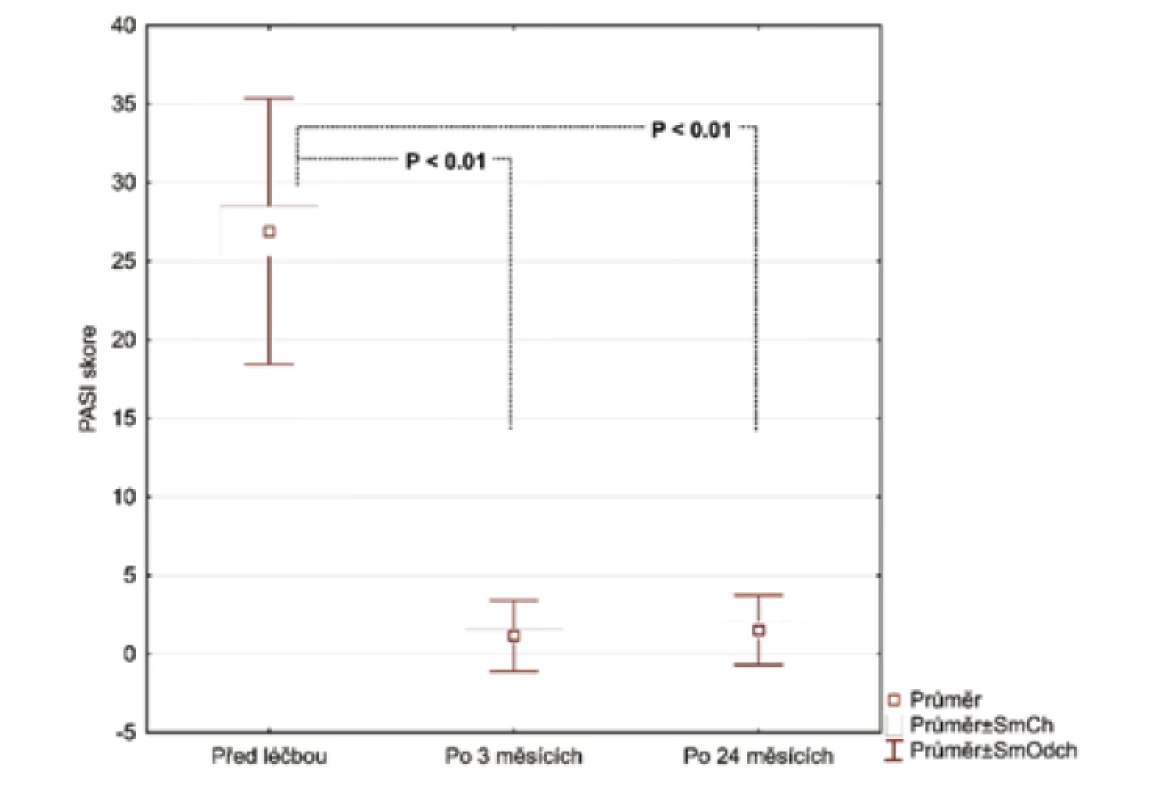
Obr. 2. Sérová hladina E-selektinu před léčbou adalimumabem a po 3 a 24 měsících po jejím zahájení 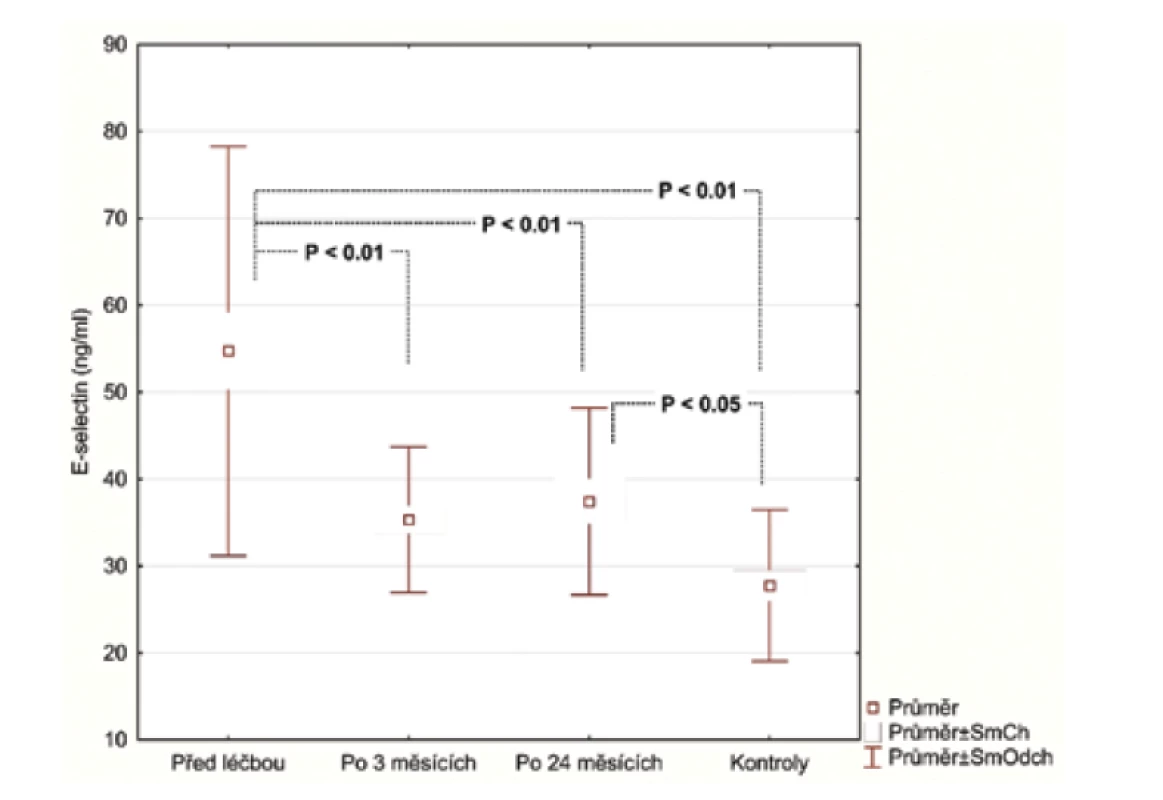
Obr. 3. Pokles IL-22 po 3 měsících a po 2 letech od nasazení adalimumabu 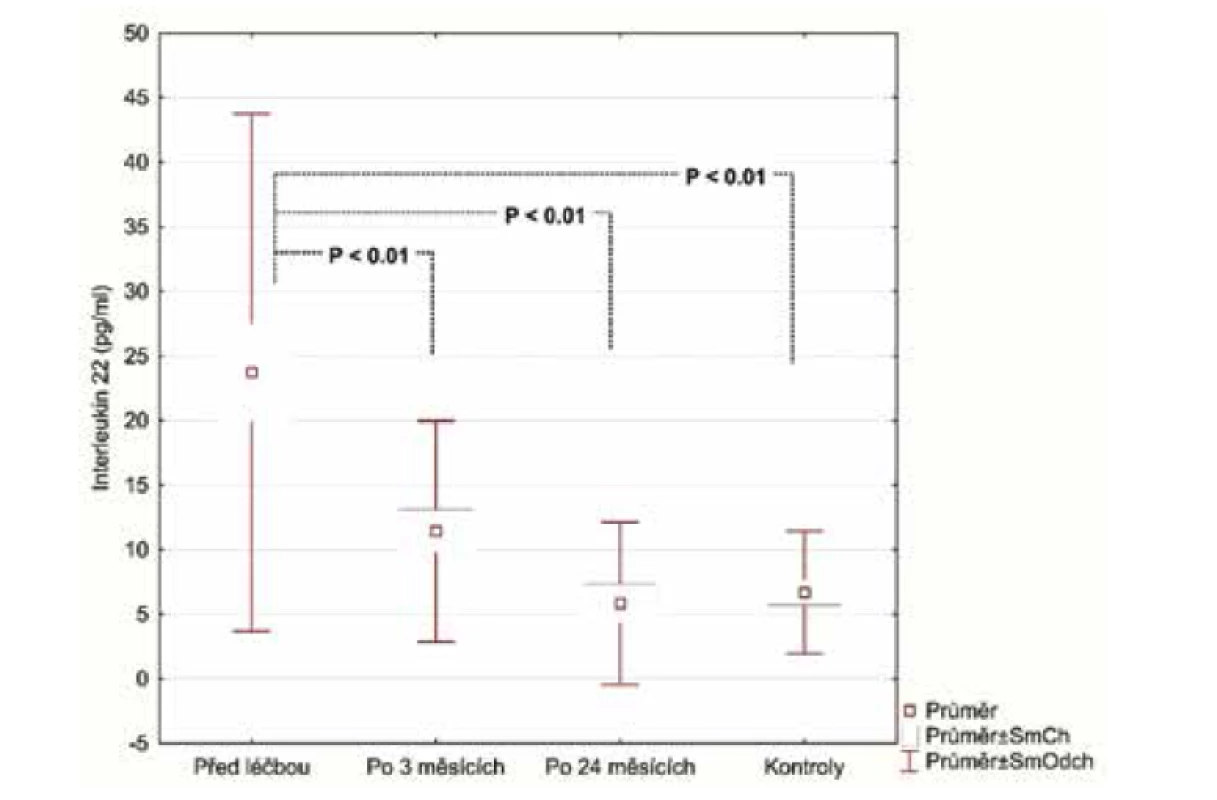
Obr. 4. Signifikantní pokles CRP po nasazené biologické terapii 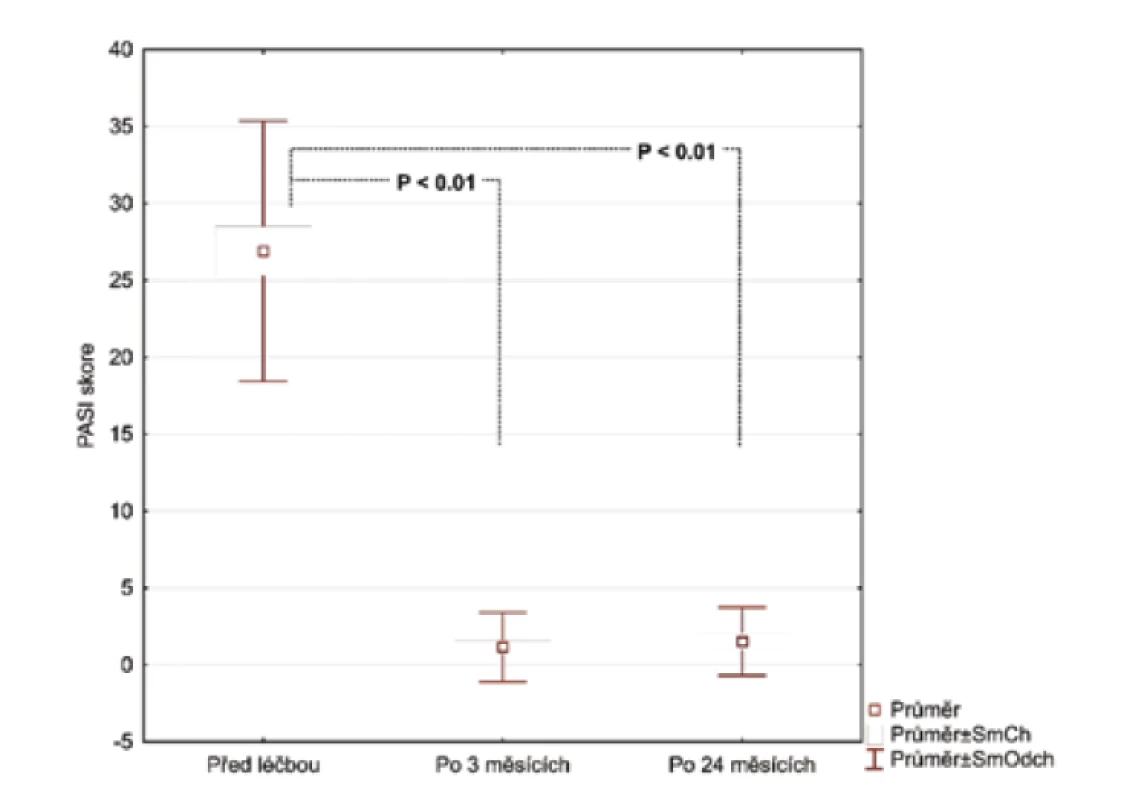
Obr. 5. Neočekáváné zvýšení OxLDL 3 měsíce a 2 roky po zahájení adalimumabu 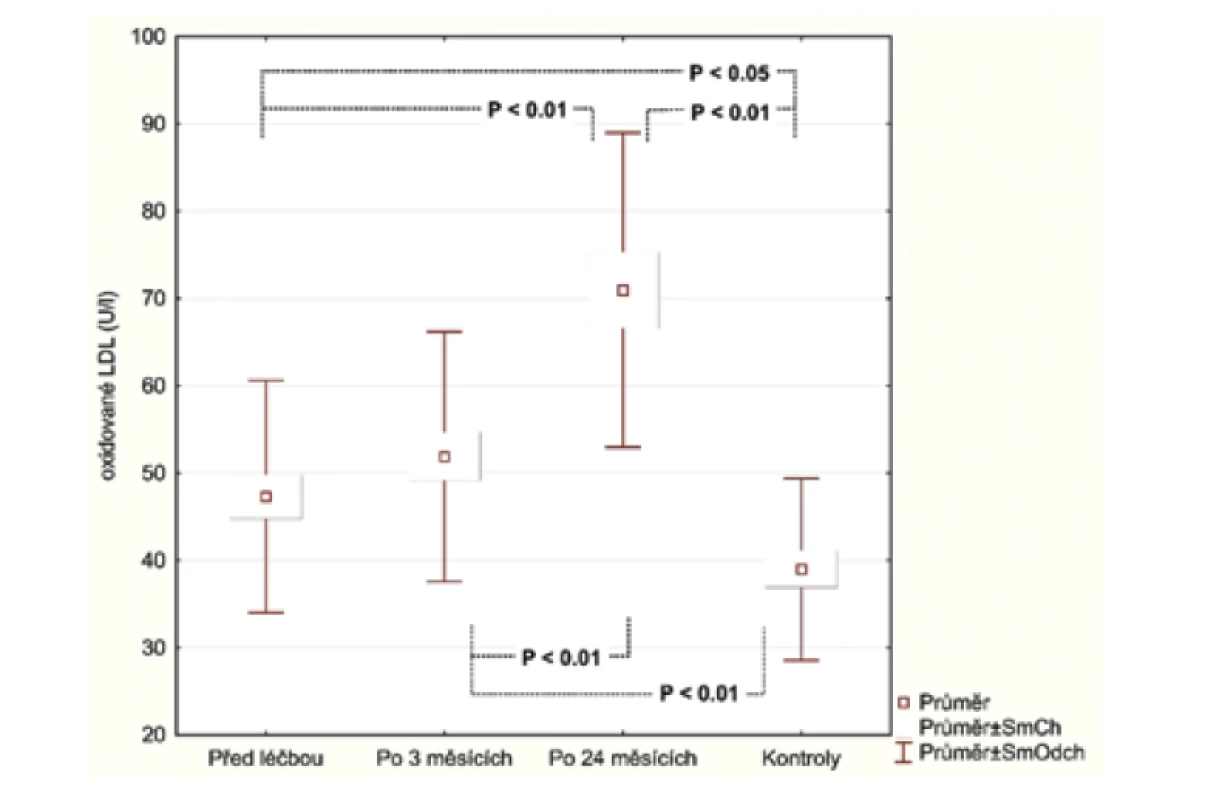
4. DISKUSE
Pacienti s psoriázou mají zvýšené kardiovaskulární riziko [3, 26]. Dobře známé spouštěče aterosklerózy jako inzulinová rezistence a endotelová dysfunkce jsou asociované s psoriázou a systémovým zánětem [15]. U pacientů s psoriázou byla nalezena elevace několika biomarkerů považovaných za potenciální hráče v patogenezi psoriázy a aterosklerózy (jako je koebnerisin a psoriasin) [1]. Dimetylarginin a osteoprotegerin, markery asociované s kardiovaskulárním onemocněním, byly vyšetřeny u 29 pacientů s těžkou psoriázou a výsledky ukázaly, že dimetylarginin koreluje se závažností psoriázy [24]. Hypotéza, že anti-TNF-α má pozitivní vliv na snížení rizika systémového zánětu potvrzuje i práce Genre et al. [6], kteří prokázali, že sérové hladiny E-selektinu významně klesly po 6 měsících léčby adalimumabem.
Naše první studie se zaměřila na 6 biomarkerů asociovaných se systémovým zánětem u pacientů se středně těžkou až těžkou psoriázou [9]. Porovnávali jsme plazmatické koncentrace těchto markerů mezi pacienty s psoriázou a zdravými kontrolními jedinci a poté jsme měřili jejich hladiny po 12týdenní léčbě adalimumabem. Zjistili jsme, že nejvýznamnější změny byly v hodnotách E-selektinu, IL-22 a hsCRP. Naplánovali jsme další analýzu těchto markerů po delší léčbě adalimumabem k potvrzení, zda pokles hodnot nebyl pouze dočasný. Doposud nejdelší sledování, které ukazovalo rozdíl v hodnotách kardiovaskulárních markerů po léčbě anti-TNF-α byl v intervalu 6 měsíců [6].
Všechny vyšetřované markery jsou indikátory systémového zánětu a aterosklerotického rizika. IL-22 patří do IL-10 rodiny cytokinů a je produkován T-17 a 22 pomocnými lymfocyty (Th17, 22). Hlavním místem působení IL-22 jsou tkáňové buňky, jako jsou epiteliální buňky a také buňky hladkého svalu. Může aktivovat různé signální dráhy včetně JAK/STAT. IL-22 významně přispívá k epiteliální remodelaci a zánětu přes inhibici terminální diferenciace keratinocytů a indukuje antimikrobiální peptidy a selektované chemokiny [18]. Shi et al. [28] prokázali, že IL-22 zhoršuje rozvoj aterosklerózy přes mechanismy, které jsou asociované s IL-6/STAT3 aktivací, Th17 buněčnou proliferací indukovanou přes dendritické buňky a stimulací buněk hladké svaloviny přes IL-22. U našich pacientů s psoriázou byl pozorován výrazný pokles IL-22 po 3 měsících, a ještě výraznější pokles po 24 měsících terapie adalimumabem.
Adhezní molekula E-selektin je považována za marker endotelové aktivace a dysfunkce a je asociována se zvýšeným rizikem aterosklerózy a manifestace kardiovaskulárního onemocnění [17, 10]. E-selektin byl nejenom významně zvýšený u pacientů s psoriázou ve srovnání se zdravou kontrolní skupinou, ale také ukázal signifikantní pokles při anti-TNF-α léčbě ve 3měsíčním a 24měsíčním intervalu. Tyto výsledky se shodují s výsledky jiných autorů [6].
OxLDL indukuje endoteliální buněčnou aktivaci a dysfunkci, vznik makrofágových pěnitých buněk, Immigraci buněk hladkého svalu a proliferaci endotelových buněk. Všechny tyto pochody přispívají k formaci aterosklerotického plátu [25]. OxLDL byl nalezen v psoriatickém ložisku [30]. V naší studii byla průměrná koncentrace OxLDL vyšší u pacientů s psoriázou než u kontrol, ale rozdíl nedosáhl statistického významu. Překvapivě, hodnoty OxLDL zůstaly vyšší v 3 - i 24měsíčním intervalu po zahájení léčby adalimumabem. Gerdes et al. [14] neprokázali rozdíl sérových hodnot OxLDL mezi psoriatiky a kontrolními skupinami. V jiných studiích OxLDL protilátky nekorelovaly se závažností cévní mozkové příhody nebo přítomností a závažností koronárního onemocnění [19, 14]. Domníváme se, že je potřeba více studií či větší kohorty pacientů k posouzení, zda OxLDL může být senzitivním kardiovaskulárním markerem u pacientů s psoriázou. Vysoce senzitivní C-reaktivní protein (hsCRP) byl hlášen jako nezávislý prediktor aterosklerózy a je asociován se stenózou karotid [16]. Hodnoty hsCRP poklesly po 3 měsících terapie, ale statistický význam byl dosažen až v analýze po 2 letech. Překvapivě, v recentní studii lékem anti-IL-17A byl po 52 týdnech léčby zjištěn neutrální vliv na aortální cévní zánět a biomarkery kardiometabolického onemocnění [5]. Autoři v této studii porovnávali různé aterosklerotické biomarkery před léčbou secukinumabem a po léčbě, ale E-selektin a IL-22 nebyl vyšetřován. Bylo by zajímavé zjistit, jaký vliv může mít tento lék na tyto markery.
5. ZÁVĚR
V provedené studii jsme prokázali, že markery asociované se systémovým zánětem (hsCRP, E-selektin a IL-22) nejenom významně poklesly po 12týdenní léčbě adalimumabem, ale jejich hodnoty zůstaly nízké i po 24 měsících. Tyto výsledky potvrzují, že pokles markerů nebyl náhodný nebo dočasný a podporuji myšlenku, že systémový zánět je potlačen působením adalimumabu. Hodnoty OxLDL se nesnížily, naopak jsme po 3 a 24 měsících pozorovali zvýšené hodnoty. Předpokládáme, že pravděpodobně není senzitivním markerem systémového zánětu u pacientů s psoriázou a je potřebný další výzkum.
Limitací této studie je nízký počet zahrnutých pacientů, přesto jsme prokázali statisticky významné výsledky. Přínosem práce je dlouhodobé sledování markerů.
Poděkování
Tato studie byla podpořena Výzkumným projektem Progress Q28 a Q36 uděleným Karlovou Univerzitou, Česká republika.
Do redakce došlo dne 26. 4. 2021.
Adresa pro korespondenci:
prim. doc. MUDr. Spyridon Gkalpakiotis, Ph.D., MBA
Dermatovenerologická klinika 3. LF UK a FNKV
Šrobárova 1150/50
100 34 Praha 10
e-mail: spyridon.gkalpakiotis@fnkv.cz
Zdroje
1. AWAD, S. M., ATTALLAH, D. A., SALAMA, R. H., MAHRAN, A. M., ABU EL-HAMED, E. Serum levels of psoriasin (S100A7) and koebnerisin (S100A15) as potential markers of atherosclerosis in patients with psoriasis. Clin Exp Dermatol., 2018, 43, p. 262 – 267.
2. BOEHNCKE, W. H., BOENHCKE, S., TOBIN, A. M., KIRBY, B. The ‚psoriatic march‘: a concept of how severe psoriasis may drive cardiovascular comorbidity. Exp Dermatol., 2011, 20, p. 303–307.
3. BOENHCKE, W.-H. Systemic inflammation and cardiovascular comorbidity in psoriasis patients: causes and consequences. Front Immunol., 2018, 9, p. 579.
4. DAVIDOVICI, B. B., SATTAR, N., PRINZ, J. et al. Psoriasis and systemic inflammatory diseases: potential mechanistic links between skin disease and comorbid conditions. J Invest Dermatol., 2010, 130, p. 1785–1796.
5. GELFAND, J. M., SHIN, D. B., DUFFIN, K. C. et al. A randomized placebo controlled trial of Secukinumab on aortic vascular inflammation in moderate to severe plaque psoriasis (VIP-S). J Invest Dermatol., 2020. [Epub ahead of print]. Dostupné na www: https://doi.org/10.1016/j.jid.2020.01.025.
6. GENRE, F., ARMESTO, S., CORRALES, A. et al. Significant sE-selectin levels reduction after 6 months of anti-TNF therapy in non-diabetic patients with moderate-to-severe psoriasis. J Dermatolog Treat., 2017, 28, p. 726–730.
7. GERDES, S., OSADTSCHY, S., BUHLES, N., BAUERCHT, H., MROWIETZ, U. Cardio - vascular biomarkers in patients with psoriasis. Exp Dermatol., 2014, 23, p. 322–325.
8. GISONDI, P., FOSTINI, A. C., FOSSÁ, I., GIROLOMONI, G., TARGHER, G. Psoriasis and the metabolic syndrome. Clin Dermatol., 2018, 36, p. 21–28.
9. GKALPAKIOTIS, S., ARENBERGEROVA, M., GKALPAKIOTI, P., POTOCKOVA, J., ARENBERGER, P., KRAML, P. Impact of adalimumab treatment on cardiovascular risk biomarkers in psoriasis: results of a pilot study. J Dermatol., 2017, 44, p. 363–369.
10. HOPE, S. A., MEREDITH, I. T. Cellular adhesion molecules and cardiovascular disease. Part II. Their association with conventional and emerging risk factors, acute coronary events and cardiovascular risk prediction. Intern Med J., 2003, 33, p. 450–462.
11. JÓKAI, H., SZAKONYI, J., KONTÁR, O. et al. Impact of effective tumor necrosis factor-alfa inhibitor treatment on arterial intimal-media thickness in psoriasis: results of a pilot study. J Am Acad Dermal., 2013, 69, p. 523–529.
12. JUNG, K. J., KIM, T. G., LEE, J. W. et al. Increased risk of atherosclerotic car-diovascular disease among patients with psoriasis in Korea: a 15-year nationwide population-based cohort study. J Dermatol., 2019, 46(10), p. 859–866.
13. KARADAG, A. S., YAVUZ, B., ERTUGRUL, D. T. et al. Is psoriasis a pre - atherosclerotic disease? Increased insulin resistance and impaired endothelial function in patients with psoriasis. Int J Dermatol., 2010, 49, p. 642–646.
14. KHAMBHATI, J., ENEGELS, M., ALLARD-RATICK, M., SANDESARA, P. B., QUYYUMI, A. A., SPERLING, L. Immunotherapy for the prevention of atherosclerotic cardiovascular disease: promise and possibilities. Atherosclerosis, 2018, 276, p. 1–9.
15. KIM, J. A., MONTAGNANI, M., KOH, K. K., QUON, M. J. Reciprocal relationships between insulin resistance and endothelial dysfunction: molecular and pathophysiological mechanisms. Circulation, 2006, 113, p. 1888–1904.
16. LIU, H., YAO, Y., WANG, Y. et al. Association between high-sensitivity C - reactive protein, lipoprotein-associated phospholipase A2 and carotid atherosclerosis: a cross-sectional study. J Cell Mol Med., 2018, 22, p. 5145–5150.
17. MALIK, I., DANESH, J., WHINCUP, P. et al. Soluble adhesion molecules and prediction of coronary heart disease: a prospective study and meta-analysis. Lancet, 2001, 358, p. 971–976.
18. MARTIN, J. C., WOLK, K., BÉRIOU, G. et al. Limited presence of IL-22 binding protein, a natural IL-22 inhibitor, strengthens psoriatic skin inflammation. J Immunol., 2017, 198, p. 3671–3678.
19. MASZTALEWIC, M., NOWACKI, P., KOTLEGA, D., BAJER - CZAJKOWSKA, A., DRECHSLER, H. Anti-oxLDL antibodies are clinically insignificant for stroke patients. Neurol Res., 2014, 36, p. 86–91.
20. MÄKI-PETÄJÄ, K. M., ELKHAWAD, M., CHERIVAN, J. et al. Anti-tumor necrosis factor-α therapy reduces aortic inflammation and stiffness in patients with rheumatoid arthritis. Circulation, 2012,126, p. 2473 – 2480.
21. MÄKI-PETÄJÄ, K. M., ELKHAWAD, M., CHERIVAN, J. et al. Effective continuous systemic therapy of severe plaque-type psoriasis is accompanied by amelioration of biomarkers of cardiovascular risk: results of a prospective longitudinal observational study. J Eur Acad Dermatol Venereol., 2011, 25, p. 1187–1193.
22. MEHTA, N. N., AZFAR, R. S., SHIN, D. B., NEIMANN, A. L., TROXEL, A. B., GELFAND, J. M. Patients with severe psoriasis are at increased risk of cardiovascular mortality: cohort study using the General Practice Research Database. Eur Heart J., 2010, 31, p. 1000 – 1006.
23. PATEL, N., NADKARNI, A., CARDWELL, L. A. et al. Psoriasis, depression, and inflammatory overlap: a review. Am J Clin Dermatol., 2017,18, p. 613–662.
24. PINA, T., GENRE, F., LOPEZ-MEJIAS, R. et al. Asymmetric dimethylarginine but not osteoprotegerin correlates with disease severity in patients with moderate-to-severe psoriasis undergoing anti-tumor necrosis factor: a therapy. J Dermatol., 2016, 43, p. 389–394.
25. PIRILLO, A., NORATA, G. D., CATAPANO, A. L. LOX - 1, OxLDL, and atherosclerosis. Mediators Inflamm., 2013, p. 152786.
26. RAABY, L., AHLEHOFF, O., de THURAH, A. Psoriasis and cardiovascular events: updating the evidence. Arch Dermatol Res., 2017, 309, p. 225–228.
27. ROBATI, R. M., PARTOVI-KIA, M., SADAT-AMINI, H., HAGHIGHATKHAH, H. R., YOUNESPOUR, S., TOOSSI, P. Serum osteopontin level and common carotid artery intima-media wall thickness in psoriasis. Int J Dermatol., 2016, 55, e.262–e267.
28. SHI, L., Ji, Q., LIU, L. et al. IL-22 produced by Th22 cells aggravates ath - erosclerosis development in ApoE−/ − mice by enhancing DC-induced Th17 cell proliferation. J Cell Mol Med., 2020, 24, p. 3064 – 3078.
29. TAKAHASHI, H., TSUJI, H., HASHIMOTO, Y., ISHIDA - -YAMAMOTO, A., IIZUKA, H. Serum cytokines and growth factor levels in Japanese patients with psoriasis. Clin Exp Dermatol., 2010, 35, p. 645–649.
30. TEKIN, N. S., TEKIN, I. O., BARUT, F., SIPAHI, E. Y. Accumulation of oxidized low-density lipoprotein in psoriatic skin and changes of plasma lipid levels in psoriatic patients. Mediators Inflamm., 2007, p. 78454.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2021 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Význam lokální oxygenoterapie a ozonoterapie pro léčbu nehojivých ran
-
Všechny články tohoto čísla
- Vývoj kůže a její bariérová funkce
- KONTROLNÍ TEST
- Vliv dlouhodobé terapie adalimumabu na biomarkery systémového zánětu u psoriázy
- Atopický ekzém – zkušenosti s léčbou dupilumabem v době koronaviru
- Pustuly a krusty ve kštici. Stručný přehled
- Zápis ze schůze výboru ČDS konané dne 17. 6. 2021
- Odborné akce 2021
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vývoj kůže a její bariérová funkce
- Pustuly a krusty ve kštici. Stručný přehled
- Atopický ekzém – zkušenosti s léčbou dupilumabem v době koronaviru
- Vliv dlouhodobé terapie adalimumabu na biomarkery systémového zánětu u psoriázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



