-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný stav moderní léčby psoriázy – aktualizovaná doporučení ČDS JEP k cílené léčbě závažné chronické psoriázy
Current Approach to Modern Treatment of Psoriasis – Updated Guidelines of ČDS JEP for Targeted Treatment of Severe Chronic Psoriasis
Psoriasis is a chronic genetically determined immune mediated inflammatory skin disease associated with systemic comorbidities that contribute to shortening of patients’ lives. Local therapy and phototherapy are the foundation of mild psoriasis treatment. In case this treatment is not effective, not tolerated or contraindicated, as well as in patients with severe form of disease or significantly decreased quality of life, systemic therapy is indicated. Current possibilities of systemic therapy in the Czech Republic include non-biological agents (acitretin, cyclosporine, methotrexate, new small molecule apremilast) and biological agents (adalimumab, brodalumab, certolizumab, etanercept, guselkumab, infliximab, ixekizumab, secukinumab, ustekinumab; use of risankizumab and tildrakizumab is expected in near future). Presented recommendations for „targeted“ systemic therapy of adult patients with moderate to severe psoriasis are based on the Czech guidelines published in 2012, recent international guidelines and international consensus meetings taking into account national clinical practice in the Czech Republic and current summaries of product characteristics.
Keywords:
Psoriasis – guselkumab – infliximab – guidelines – biological therapy – anti-TNF-α – anti-IL-12/23 – anti-IL-17 – anti-IL-23 – adalimumab – brodalumab – certolizumab – etanercept – ixekizumab – risankizumab – secukinumab – tildrakizumab – ustekinumab – Small molecules – apremilast
Autoři: P. Cetkovská 1; M. Kojanová 2; P. Arenberger 3; J. Fabianová 4
Působiště autorů: Dermatovenerologická klinika FN a LF UK, Plzeň, přednosta prof. MUDr. Karel Pizinger, CSc. 1; Dermatovenerologická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. Jiří Štork, CSc. 2; Dermatovenerologická klinika FNKV a 3. LF UK, Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 3; Farmakoterapie, Praha 4
Vyšlo v časopise: Čes-slov Derm, 94, 2019, No. 4, p. 135-162
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Psoriáza je chronické geneticky podmíněné imunitně zprostředkované zánětlivé onemocnění kůže sdružené se systémovými chorobami, které přispívají ke zkrácení délky života nemocných. Základem terapie pacientů s mírnějšími formami psoriázy je lokální léčba, popř. fototerapie. U nemocných, u kterých je tato léčba nedostatečně účinná, špatně snášená či kontraindikovaná, a dále u pacientů s těžkou, rozsáhlou psoriázou či s psoriázou výrazně snižující kvalitu života, je indikována systémová farmakoterapie. Současné možnosti systémové léčby středně těžké až těžké psoriázy v České republice zahrnují nebiologické léky (acitretin, cyklosporin, metotrexát, novou malou molekulu apremilast) a biologické léky (adalimumab, brodalumab, certolizumab, etanercept, guselkumab, infliximab, ixekizumab, secukinumab, ustekinumab; s předpokládaným budoucím použitím risankizumabu a tildrakizumabu). Prezentovaná doporučení pro biologickou systémovou léčbu dospělých pacientů se středně těžkou až těžkou psoriázou vychází z českých doporučení z roku 2012, aktuálních zahraničních doporučených postupů, z konsenzuálních mezinárodních jednání upravených na základě klinické praxe v České republice a příslušných současně platných souhrnů údajů o léčivých přípravcích.
Klíčová slova:
psoriáza – biologická terapie – doporučené postupy – anti-TNF-α – anti-IL-17 – anti-IL-12/23 – anti-IL-23 – adalimumab – brodalumab – certolizumab – etanercept – guselkumab – infliximab – ixekizumab – risankizumab – secukinumab – tildrakizumab – ustekinumab – malé molekuly – apremilast
ÚVOD
Psoriáza je chronické imunitně zprostředkované zánětlivé onemocnění, jehož prevalence se v západních zemích odhaduje na 2–3 %. Manifestace psoriázy mohou být různé; nejčastější formou (přibližně u 80 % pacientů) je ložisková psoriáza. Etiologie psoriázy je multifaktoriální, onemocnění vzniká u geneticky predisponovaných jedinců působením environmentálních vlivů (např. životní styl, infekce). V patogenezi psoriázy se uplatňují především dendritické buňky a regulační a pomocné (Th1 a Th17) lymfocyty, jejichž aktivita je spojena s vysokou expresí prozánětlivých cytokinů jako TNF-α, IFN-γ, IL-12, IL-17 nebo IL-23 [27].
Projevy psoriázy jsou obvykle lokalizovány na kůži, nehtech a ve kštici, velmi často jsou postiženy rovněž klouby. Psoriáza je provázena řadou souběžných onemocnění, jako jsou hypertenze, dyslipidémie, kardiovaskulární choroby, obezita, diabetes mellitus, metabolický syndrom či hepatopatie, ale i zánětlivá střevní onemocnění, psychiatrické poruchy nebo malignity. Psoriáza, v závislosti na tíži projevů, může mít značný dopad na kvalitu života pacientů, jejich fyzickou funkci a pracovní produktivitu. Závažná psoriáza zkracuje délku života nemocných [8].
U 50 % pacientů s psoriázou je onemocnění mírné a lze jej léčit lokálními přípravky, jako jsou deriváty vitaminu D3 či kortikosteroidy. U středně těžkých a těžkých forem pak obvykle bývá nutná systémová léčba, která zahrnuje fototerapii, konvenční systémovou léčbu a nové malé molekuly („nebiologickou“ léčbu) a biologickou terapii. Jak však dokumentují rozsáhlé průzkumy, pacienti s psoriázou jsou často podléčeni [5]. V mezinárodním průzkumu bylo téměř 90 % pacientů s hodnotou BSA >10 buď zcela bez léčby, či léčeno pouze lokálně [44]. Jak navíc dokládají údaje z registru BioReP (český registr pacientů s psoriázou léčených biologickou léčbou), biologická léčba je u nemocných se středně těžkou až těžkou psoriázou zahajována v průměru až po 22 letech trvání psoriázy [38, 39].
Perspektivy pacientů s psoriázou se výrazně zlepšily v souvislosti se zavedením cílené léčby. Biologická terapie byla v České republice poprvé použita v roce 2002 (psoriatická artritida), resp. 2004 (psoriáza) [14], spektrum biologických léků se stále rozšiřuje. Malá molekula apremilast je k léčbě dostupná od roku 2015. V poslední době byly v některých zemích vydány aktualizované a doplněné doporučené postupy pro terapii psoriázy, což se stalo podnětem pro aktualizaci českých doporučení. Současné doporučené postupy pro systémovou cílenou léčbu psoriázy navazují na předchozí doporučení k biologické léčbě závažné chronické ložiskové psoriázy publikované v roce 2012 [14] a na doporučené postupy pro systémovou „nebiologickou“ léčbu psoriázy vydané v roce 2017 [15], uveden je zde také apremilast (který nebyl zahrnut do doporučených postupů pro systémovou „nebiologickou“ léčbu). Doporučení vycházejí z dostupných současných mezinárodních postupů pro léčbu psoriázy [1, 28, 41, 51, 63] upravených na základě klinické praxe v České republice a příslušných aktuálně platných souhrnů o léčivých přípravcích (SPC).
Předkládané doporučené postupy nemohou být považovány za komplexní návod zajišťující úspěšnou léčbu v jednotlivých situacích. Práce nenahrazuje souhrny údajů o léčivých přípravcích. Protože vědecké informace týkající se cílené léčby neustále přibývají, naším cílem je zajistit recentní doporučení v době publikace a čtenáři jsou laskavě žádáni o sledování nových vědeckých poznatků a z toho vyplývajících upřesnění pokynů.
INDIKACE A KRITÉRIA K PODÁNÍ SYSTÉMOVÉ BIOLOGICKÉ LÉČBY A MALÝCH MOLEKUL
Biologické léky i malá molekula apremilast jsou obecně indikovány k terapii středně těžké až těžké ložiskové psoriázy u dospělých, kteří jsou kandidáty na systémovou léčbu; některé přípravky lze podat i u dětí. Efekt některých léků byl prokázán také při postižení nehtů, kštice či genitálu a při palmoplantární psoriáze, biologická terapie může být účinná rovněž u pacientů s generalizovanou pustulózní psoriázou nebo s psoriatickou erytrodermií [48].
Stanovení závažnosti psoriázy vychází z řady různých aspektů včetně rozsahu onemocnění, intenzity a lokalizace projevů, trvání a aktivity onemocnění, symptomů (např. svědění, bolest), odpovědi na předchozí léčbu nebo dopadu psoriázy na kvalitu života. Závažnost chronické ložiskové psoriázy se nejčastěji hodnotí pomocí skóre PASI (Psoriasis Area and Severity Index), které vyjadřuje tíži a rozsah projevů (hodnota 0 až 72), skóre BSA (Body Surface Area), jež udává procentuální postižení povrchu těla, popř. skóre PGA (Physician Global Assessment) či IGA (Investigator Global Assessment). Novějším způsobem výpočtu PASI je tzv. Precise PASI, který pracuje se stejnými vstupními daty jako PASI, zohledňuje však přesněji procenta postižené plochy těla, a nabízí tak vyšší rozlišení při nižších hodnotách BSA (< 5 %) [40]. Dopad psoriázy na kvalitu života pacientů se nejčastěji hodnotí pomocí skóre DLQI (Dermatology Life Quality Index). U pacientů s psoriázou nehtů či kštice pak jsou využívány škály NAPSI (Nail Psoriasis Severity Index) a PSSI (Psoriasis Scalp Severity Index).
Při tzv. pravidlu desítek podle Finlaye je onemocnění považováno za závažné, je-li splněno alespoň jedno z následujících kritérií: PASI > 10, BSA > 10 % nebo DLQI > 10. Psoriáza tedy může být závažná i u pacientů s méně rozsáhlými projevy, u nichž se však projevuje výrazné snížení kvality života – při významném postižení specifických, obtížně léčitelných oblastí nebo při intenzivním svědění [22].
Podle recentních doporučených postupů je biologická léčba indikována u pacientů s psoriázou, jejichž onemocnění vyžaduje systémovou terapii, jestliže standardní systémová léčba je neúčinná, špatně snášena či kontraindikována, onemocnění má velký dopad na fyzické, psychické a sociální funkce (DLQI > 10) a psoriáza je rozsáhlá (BSA > 10 % nebo PASI > 10) či je závažná v určitých lokalizacích (obtížně léčitelné partie, např. obličej, kštice, dlaně, plosky, genitál, nehty) [1, 28, 41, 48, 51, 63].
V České republice je zahájení biologické léčby hrazené zdravotní pojišťovnou možné pouze po splnění indikačních kritérií stanovených Státním ústavem pro kontrolu léčiv (SÚKL) [64].
TERAPEUTICKÉ CÍLE
Cílem léčby psoriázy je rychlé, co možná největší a trvalé snížení rozsahu a závažnosti projevů při co nejnižším výskytu nežádoucích účinků. Současné terapeutické cíle jsou založené na vybraných parametrech výsledků léčby, a to nejen s ohledem na závažnost kožních symptomů, ale i ve vztahu ke změnám kvality pacientova života. Dosud bylo běžně uznávanou hranicí klinicky významného zmírnění psoriázy dosažení odpovědi PASI 75, tj. alespoň 75% snížení skóre PASI. Dosažení hodnot v rozmezí PASI 50 až PASI 75 bylo považováno za částečný léčebný úspěch, pokud skóre DLQI nepřesahovalo 5. Pokud bylo skóre DLQI (při odpovědi v rozmezí PASI 50 až PASI 75) vyšší než 5, nebo nebylo-li dosaženo ani skóre PASI 50, jednalo se o selhání léčby a byla nutná úprava léčebného režimu (viz dále) [49].
V souvislosti s nástupem nejnovějších, vysoce účinných biologických léků se jeví léčebný cíl PASI 50 či PASI 75 jako nedostačující a jsou navrženy nové léčebné cíle, a to absolutní hodnota PASI ≤ 3, hodnota skóre DLQI 0/1 (tj. minimální vliv, resp. absence vlivu psoriázy na kvalitu života), PGA ≤ 1 nebo léčebná odpověď PASI 90, resp. PASI 100 (tj. téměř úplné či úplné vymizení projevů) [1]. Léčebné cíle je třeba stanovit ve shodě s pacientem na základě informované diskuse.
DOPORUČENÁ VYŠETŘENÍ PŘED ZAHÁJENÍM LÉČBY A V JEJÍM PRŮBĚHU
Před zahájením biologické léčby se provádí pečlivý odběr anamnézy, klinické a laboratorní vyšetření. Z hlediska anamnézy je nutné posoudit případná souběžná onemocnění, jako je zejména psoriatická artritida (PsA), kardiovaskulární choroby, zánětlivé střevní choroby, infekční, maligní a psychiatrická onemocnění. Je zapotřebí zhodnotit průběh psoriázy, způsob, délku a účinnost předcházející léčby, pátrat po kloubních a jiných potížích. Při vyšetření se určí závažnost kožního postižení pomocí objektivních škál (PASI, popř. BSA) a posoudí se vnímání choroby pacientem (skóre DLQI).
Před léčbou je nutné vyšetřit krevní obraz (včetně diferenciálního rozpočtu), provést kompletní biochemické vyšetření (včetně C-reaktivního proteinu), vyloučit infekce (aktivní či latentní tuberkulózu – TBC, virem hepatitidy B – HBV a C – HCV, infekci HIV) a u žen graviditu [14, 28, 41].
Ohledně monitorování v průběhu léčby nepanuje jednoznačná shoda. Je třeba postupovat individuálně, s ohledem na komorbidity a souběžnou medikaci konkrétního pacienta. Opakování krevního obrazu a biochemického vyšetření v průběhu biologické léčby záleží na výběru preparátu a rozhodnutí dermatologa. U infliximabu se kontrolují jaterní testy po zahájení terapie za 3 měsíce, a v případě normálních hodnot každých 6–12 měsíců [48].
Vzhledem ke zvýšenému riziku kardiovaskulárních chorob se u pacientů s těžkou psoriázou doporučuje pravidelně měřit krevní tlak, hodnotit index tělesné hmotnosti (BMI), vyšetřovat lipidogram a glykémii. I proto se jeví laboratorní screening jako vhodný, zejména u nemocných s komorbiditami. Po celou dobu terapie je třeba pamatovat na možnost vzniku různých infekcí (je proto nutné věnovat pozornost příznakům, jako jsou zvýšená teplota, únavnost, pokles hmotnosti, noční pocení, kašel, bolest na hrudi, dušnost aj.), pomýšlet na riziko nemelanomových kožních nádorů (NMSC), zejména při léčbě inhibitory TNF-α a u rizikových pacientů (anamnéza kožní malignity, předchozí fototerapie či léčba cyklosporinem) [14, 48].
BIOLOGICKÁ LÉČBA CHRONICKÉ LOŽISKOVÉ PSORIÁZY
Z biologických léků jsou pro terapii pacientů s psoriázou v současné době schváleny léky ze skupiny anti-TNF-α (infliximab, etanercept, adalimumab a certolizumab), anti-IL-12/23 (ustekinumab), anti-IL-17 (secukinumab, ixekizumab, brodalumab) a anti-IL-23 (guselkumab, tildrakizumab, risankizumab). Tyto skupiny se mezi sebou liší především mechanismem účinku a způsobem užívání, ale i rychlostí nástupu účinku a účinností, a do jisté míry i profilem nežádoucích účinků.
Léky cílené proti TNF-α
Tumor nekrotizující faktor α (TNF-α) je klíčový prozánětlivý cytokin, který je uvolňován mnoha typy buněk včetně keratinocytů a významně se podílí na vzniku různých zánětlivých chorob včetně psoriázy. Tento poznatek vedl k vývoji látek cíleně blokujících aktivitu tohoto cytokinu. V současné době jsou ve skupině anti-TNF-α registrovány léky adalimumab, certolizumab, etanercept a infliximab.
Infliximab
Infliximab je chimérická monoklonální protilátka IgG1, která se s vysokou afinitou váže na rozpustné a transmembránové formy TNF-α, nikoliv na lymfotoxin α (TNF-β) [59]. Základní charakteristiky infliximabu uvádí tabulka 1.
Tab. 1. Základní charakteristiky infliximabu 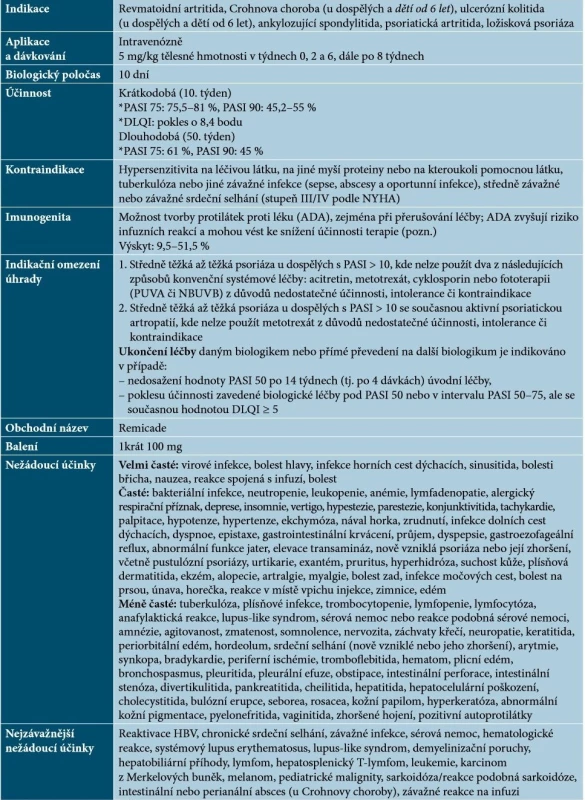
Vysvětlivky: tč. bez úhrady v ČR – označeno kurzivou
Pozn. V současnosti je na řadě pracovišť v ČR dostupné stanovení hladiny léku a ADA.
(podle [1, 41, 48, 59, 64])Infliximab lze podávat dlouhodobě se zachováním intervalů 8 týdnů mezi infuzemi. Při prodlouženém dávkování či přerušení léčby může docházet ke zvýšenému riziku infuzních reakcí a ztrátě účinnosti vlivem vývoje protilátek proti léku (ADA) [48]. K výskytu těchto reakcí dochází až u 20 % pacientů, většinou bývají mírné až středně závažné (flush, svědění, zimnice, bolest hlavy), pouze asi 1 % reakcí je závažných. Závažné reakce mohou být okamžité (hypotenze, tlak na hrudi, dýchací potíže, dušnost, bronchospasmus, edém hrtanu, kopřivka, erytém) nebo opožděné (1–14 dní po infuzi – myalgie, artralgie, bolesti hlavy, horečka, vyrážka a únava). Vyskytne-li se reakce mírná nebo středně závažná, lze v terapii pokračovat při dodržení následujících opatření: infuze se zpomalí či přeruší, podají se perorální antihistaminika (popř. paracetamol a/nebo kortikosteroidy), eventuálně stejná léčba se doporučuje 1 den před podáním další infuze a bezprostředně před jejím podáním [41, 48]. Je prokázáno, že podání acetaminofenu, hydroxyzinu, ranitidinu a metylprednisolonu bezprostředně před infuzí může snížit výskyt infuzních reakcí a prodloužit setrvání na léčbě [48]. Pokud se dostaví závažná reakce, je nutné zahájit symptomatickou léčbu a další infuze infliximabu se nesmí podávat [48, 59, 64].
Infliximab je vysoce účinný lék, který lze použít již v 1. linii biologické léčby, nicméně například doporučení BAD (British Association of Dermatologists) jej doporučují rezervovat pro použití u pacientů s velmi závažným onemocněním nebo pro případ, že jiné dostupné biologické léky selžou nebo je nelze použít [63]. Také podle švýcarských doporučení je infliximab indikován až po selhání jiných anti-TNF-α léků [41].
Je popsána účinnost infliximabu na palmoplantární psoriázu, postižení nehtů, kštice a případně u dalších forem psoriázy (erytrodermická, pustulózní). Při neúplné účinnosti je možno zvážit kombinaci infliximabu s lokální terapií (kortikosteroidy, deriváty vitaminu D), s acitretinem. Kombinace s metotrexátem (MTX) je dokumentována zejména u PsA a vzhledem k imunogenitě infliximabu a možné ztrátě účinnosti by měla být kombinovaná léčba zvážena u všech pacientů. Kombinace s NBUVB (úzkopásmové ultrafialové záření) není popsána, ale předpokládá se podobný efekt popisovaný u dalších anti-TNF-α léků [48].
Etanercept
Etanercept je humánní solubilní fúzní protein tvořený dimerem extracelulárních částí receptoru pro TNF typu 2 (p75) a Fc doménou lidského imunoglobulinu IgG1. Kompetitivně inhibuje vazbu TNF-α na jeho buněčné povrchové receptory, čímž blokuje jeho biologickou aktivitu [21]. Základní charakteristiky etanerceptu uvádí tabulka 2.
Tab. 2. Základní charakteristiky etanerceptu 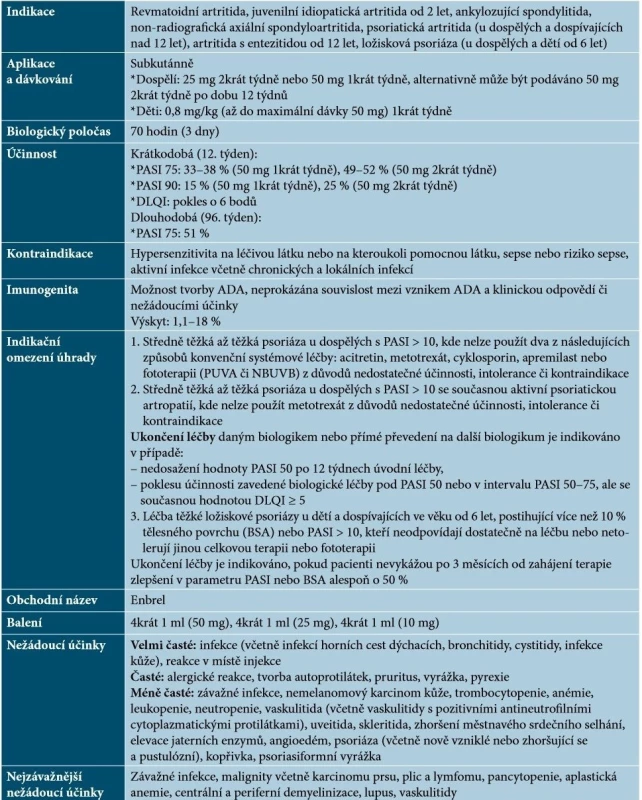
(podle [1, 21, 41, 48, 64]) Terapie etanerceptem má být ukončena u nemocných, kteří nevykazují odpověď po 12 týdnech. Nicméně může dojít k vyšší odpovědi při pokračování léčby. Při dosažení remise by měla léčba pokračovat po dobu 24 týdnů. U některých dospělých pacientů může být vhodné pokračování v terapii po 24 týdnech. Etanercept je možno použít i pro intermitentní léčbu bez rizika rebound fenoménu, kontinuální léčba však zajišťuje lepší kontrolu nad onemocněním, při opakovaném zahájení terapie může být její efekt nižší. Je dobře popsána účinnost etanerceptu i na psoriázu kštice a nehtů, případně u ostatních forem psoriázy. V případě neúplné účinnosti je možno zvážit kombinaci etanerceptu s lokální terapií (kortikosteroidy, deriváty vitaminu D), s acitretinem (může snížit riziko NMSC), eventuálně s MTX. Kombinace s NBUVB poskytuje vyšší účinnost, nejsou však známa dlouhodobá data [14, 21, 48, 64].
Adalimumab
Adalimumab je humánní monoklonální protilátka IgG1, která se specificky váže na TNF-α a neutralizuje biologickou funkci TNF-α blokováním jeho interakce s receptory p55 a p75 na povrchu buněk. Adalimumab rovněž moduluje biologickou odpověď, která je indukována nebo regulována TNF-α, včetně změn koncentrací adhezních molekul zodpovědných za migraci leukocytů (ELAM-1, VACM-1 či ICAM-1) [33]. Základní charakteristiky adalimumabu uvádí tabulka 3.
Tab. 3. Základní charakteristiky adalimumabu 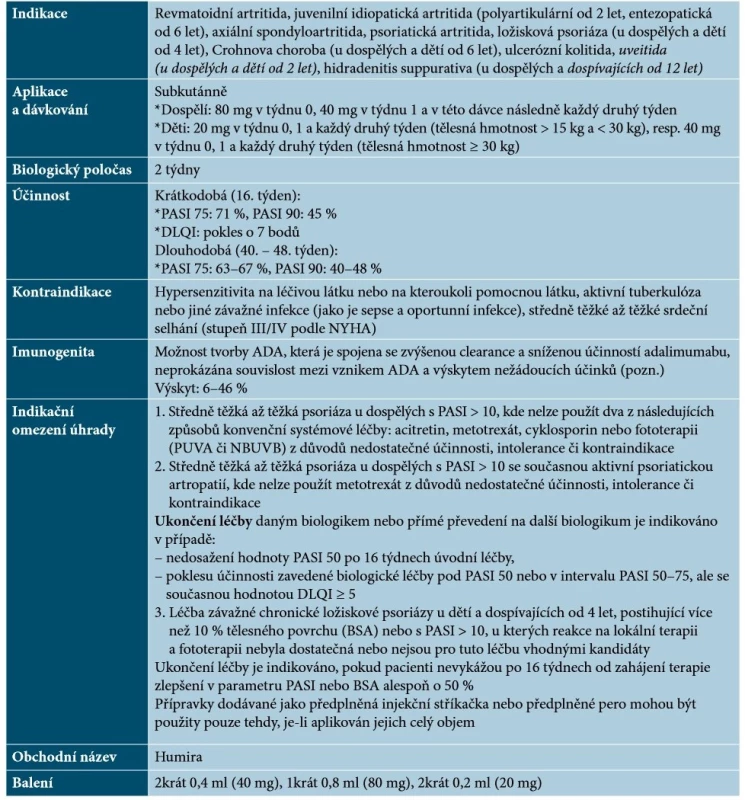

Vysvětlivky: tč. bez úhrady v ČR – označeno kurzivou
Pozn. V současnosti je dostupné stanovení hladiny léku a ADA na řadě pracovišť v ČR.
(podle [1, 33, 41, 48, 64])Adalimumab je vhodný pro dlouhodobé podávání. Je-li to nutné, může být jeho aplikace ukončena bez rizika rebound fenoménu, při opětovném zahájení terapie však může být jeho efektivita nižší [14, 33, 64]. Je dobře popsána účinnost adalimumabu na palmoplantární psoriázu, postižení nehtů, případně kštice a dalších forem psoriázy (erytrodermická, pustulózní). V případě neúplné účinnosti je možno zvážit kombinaci adalimumabu s lokální terapií (kortikosteroidy, deriváty vitaminu D), s acitretinem (vyšší efekt u palmoplantární psoriázy) či s MTX (může snížit vývoj ADA). Kombinace s NBUVB poskytuje vyšší účinnost, nejsou však známá dlouhodobá data [48].
Certolizumab
Certolizumab pegol je humanizovaný Fab fragment protilátky proti TNF-α konjugovaný s polyetylenglykolem (PEG). Má vysokou afinitu k humánnímu TNF-α, přičemž v závislosti na dávce neutralizuje membránově vázaný i solubilní TNF-α. Nepřítomnost Fc oblasti zabraňuje fixaci komplementu a protilátkami zprostředkované cytotoxicitě. Současně eliminuje interakci s neonatálním Fc gama receptorem, čímž se minimalizuje přenos certolizumabu přes placentu [16, 48]. Základní charakteristiky certolizumabu uvádí tabulka 4.
Tab. 4. Základní charakteristiky certolizumabu 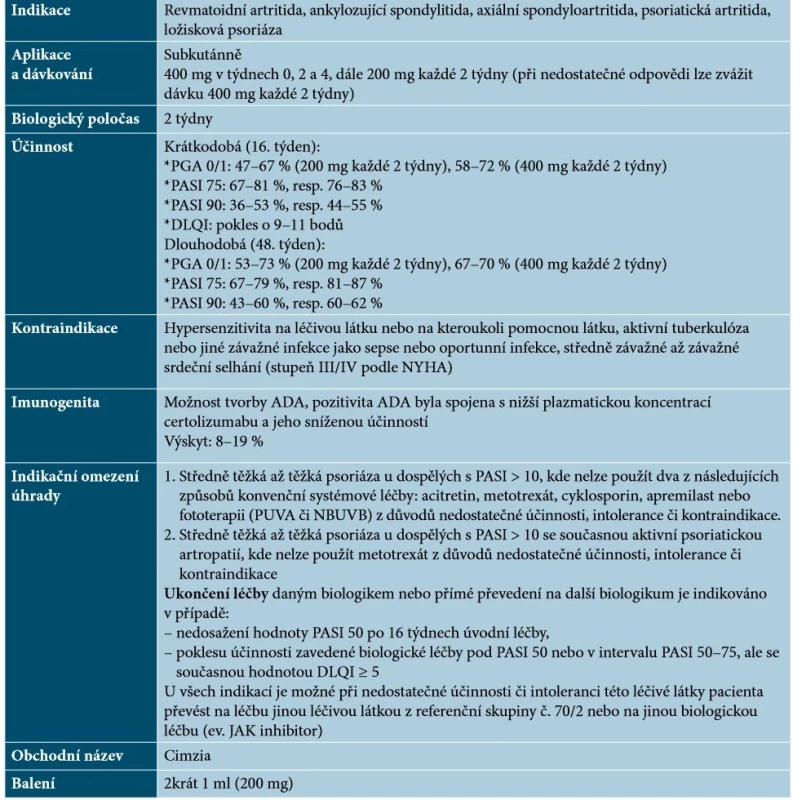
Certolizumab má pravděpodobně obdobné vlastnosti jako ostatní inhibitory TNF-α, pokud jde o léčebné kombinace, účinnost v obtížně léčitelných oblastech a možnou imunogenitu. O těchto parametrech nejsou dostatečná data, a extrapolují se proto data získaná u jiných inhibitorů TNF-α [48].
Specifika terapie anti-TNF-α léky
Zástupci skupiny anti-TNF-α jsou nejdéle používanými, ověřenými a účinnými léky v terapii psoriázy i psoriatické artritidy. Mechanismus jejich působení je v porovnání s modernějšími molekulami relativně méně selektivní, s čímž souvisí zvýšené riziko infekcí, a to zejména granulomatózních (TNF-α, podobně jako IL-12 či IFN-γ, jsou cytokiny nezbytné pro tvorbu a udržení granulomu) [55]. Mezi další významné nežádoucí účinky terapie inhibitory TNF-α patří infuzní reakce (infliximab), cytopenie, zhoršení nebo vznik srdečního selhání, lékově navozený lupus erythematosus či vzácně demyelinizační onemocnění [37, 48]. V porovnání s ostatními biologickými léky jsou proto inhibitory TNF-α kontraindikovány u pacientů se středně těžkým až těžkým srdečním selháváním (stupeň III/IV podle NYHA). Relativní kontraindikací je neléčená hepatitida B, anamnéza lymforetikulární malignity a preexistující roztroušená skleróza [1, 28, 48]. V průběhu anti-TNF-α léčby může dojít ke zvýšení tělesné hmotnosti [1].
Léky cílené proti interleukinu-12 a interleukinu-23
Dalšími cytokiny, které se významně uplatňují v patogenezi psoriázy, jsou interleukiny-12 a -23 (IL-12, IL-23), jež sdílejí společnou proteinovou podjednotku p40 (IL-23 vedle společné podjednotky obsahuje také unikátní podjednotku p19). Jde o heterodimerické cytokiny, které jsou uvolňovány aktivovanými antigen prezentujícími buňkami (makrofágy, dendritické buňky), přičemž oba cytokiny se podílejí na funkci imunitního systému. Interleukin-12 podporuje aktivaci a diferenciaci CD4+ T-lymfocytů směrem k fenotypu Th1, stimuluje uvolňování TNF-α, interferonu α a IL-2 a aktivuje NK buňky. Naproti tomu interleukin-23 podporuje vývoj Th17 buněk, které secernují IL-17, IL-22 či TNF-α [65]. Registrovaným představitelem skupiny anti-IL-12/IL-23 je ustekinumab.
Ustekinumab je plně humánní monoklonální protilátka IgG1κ, která se specificky váže na proteinovou podjednotku p40, čímž inhibuje aktivitu IL-12 a IL-23. Základní charakteristiky ustekinumabu uvádí tabulka 5.
Tab. 5. Základní charakteristiky ustekinumabu 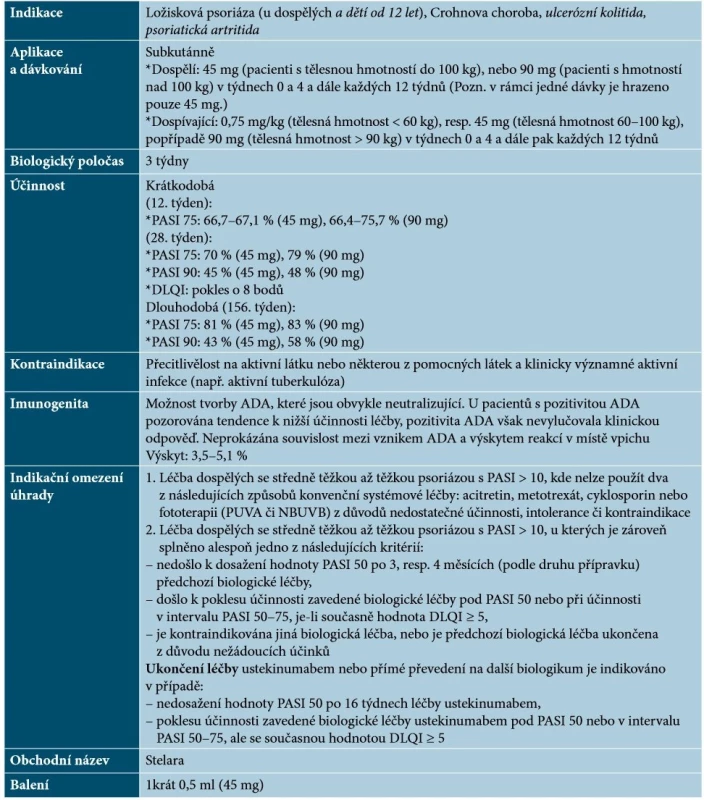

Vysvětlivky: tč. bez úhrady v ČR – označeno kurzivou (podle [1, 41, 64, 65]) Specifika terapie ustekinumabem
Ustekinumab je lék s velmi dobrým efektem na projevy psoriázy, při přerušení terapie nedochází k rebound fenoménu a při opakovaném zahájení této léčby je klinická odpověď podobná [64, 65]. Je popsána účinnost na palmoplantární psoriázu, postižení nehtů, případně kštice a dalších forem psoriázy (erytrodermická, anulární, pustulózní). V případě neúplné účinnosti je možno zvážit kombinaci ustekinumabu s lokální terapií (kortikosteroidy, deriváty vitaminu D), s acitretinem, s MTX. Kombinace s NBUVB poskytuje vyšší účinnost, nejsou však známá dlouhodobá data. U pacientů s psoriatickou artritidou je účinnost ustekinumabu v porovnání s inhibitory TNF-α nižší. Na rozdíl od inhibitorů TNF-α může být přínosný u pacientů s anamnézou demyelinizačního onemocnění a na rozdíl od inhibitorů IL-17 působí příznivě u zánětlivých střevních onemocnění (registrován je u nemocných s Crohnovou chorobou a od září 2019 i s ulcerózní kolitidou) [48, 65]. Nejčastějším nežádoucím účinkem ustekinumabu jsou infekce horních cest dýchacích, závažné infekce (např. TBC) jsou vzácné. Jsou popsané hypersenzitivní reakce, vzácně anafylaxe, angioedém, exfoliativní dermatitida a zcela nedávno neinfekční pneumonie (vzácné případy intersticiální pneumonie, eozinofilní pneumonie a kryptogenní organizující pneumonie) [1, 28, 48, 65]. Relativní kontraindikací je neléčená hepatitida B a anamnéza lymforetikulární malignity [48].
Léky cílené proti interleukinu-17
Dalším cytokinem, který se významně uplatňuje v patogenezi psoriázy, je interleukin-17. Interleukiny-17 (IL-17A až F) představují skupinu výrazně prozánětlivě působících cytokinů (nejsilnější prozánětlivý účinek vykazuje IL-17A), které jsou ve zvýšených koncentracích nacházeny v psoriatických lézích i u celé řady dalších zánětlivých onemocnění. Uvolňovány jsou především Th17 lymfocyty, ale i mastocyty, neutrofily, dendritickými buňkami či keratinocyty, a jejich fyziologickou funkcí je aktivace imunitní odpovědi proti bakteriálním či mykotickým patogenům. Blokáda IL-17A proto může vést k vyšší vnímavosti k recidivujícím stafylokokovým či kvasinkovým infekcím [2]. Od roku 2015 byly registrovány tři biologické léky cílené na IL-17, a to secukinumab, ixekizumab a brodalumab [64].
Secukinumab
Secukinumab je humánní monoklonální protilátka IgG1κ, která selektivně váže a neutralizuje IL-17A, čímž brání jeho interakci s receptorem pro IL-17. Tímto mechanismem secukinumab inhibuje uvolňování prozánětlivých cytokinů, chemokinů a mediátorů tkáňového poškození a snižuje zánět u IL-17A-imunitně zprostředkovaných onemocnění [18]. Základní charakteristiky secukinumabu uvádí tabulka 6.
Tab. 6. Základní charakteristiky secukinumabu 
Secukinumab je účinný u postižení kštice a nehtů, u palmoplantární, erytrodermické a pustulózní psoriázy a PsA. V současné době nejsou dostupná data o kombinaci s lokální nebo systémovou léčbou, ale předpokládá se, že se neodlišují od ostatních již uvedených biologik [48].
Ixekizumab
Ixekizumab je humanizovaná monoklonální protilátka IgG4, která se s vysokou afinitou a specificitou váže na IL-17A a IL-17A/F a neutralizuje je [67]. Základní charakteristiky ixekizumabu uvádí tabulka 7.
Tab. 7. Základní charakteristiky ixekizumabu 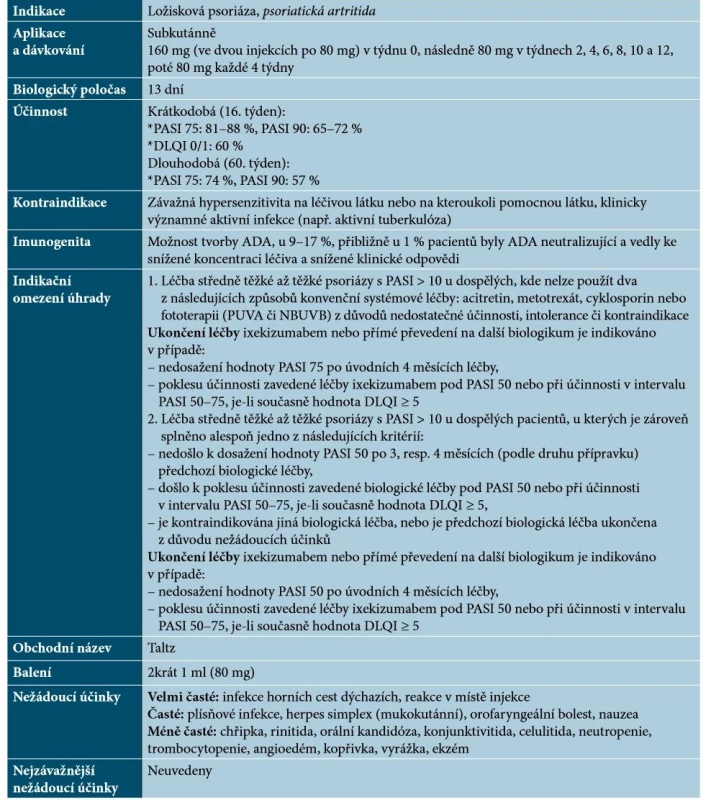
Vysvětlivky: tč. bez úhrady v ČR – označeno kurzivou
(podle [1, 64, 67])Ixekizumab je účinný u postižení kštice a nehtů, u palmoplantární, erytrodermické, pustulózní a inverzní psoriázy a PsA. V současné době nejsou dostupná data o kombinaci s lokální nebo systémovou léčbou, ale předpokládá se, že se nebudou lišit od ostatních již uvedených biologik [48].Brodalumab
Brodalumab je rekombinantní plně humánní monoklonální protilátka IgG2, která se váže s vysokou afinitou k lidskému receptoru pro IL-17 A a blokuje biologickou aktivitu prozánětlivých cytokinů (IL-17RA), IL-17F, IL-17A/F a IL-17E (známý jako IL-25) [43]. Základní charakteristiky brodalumabu uvádí tabulka 8.
Tab. 8. Základní charakteristiky brodalumabu 
(podle [1, 2, 43, 61, 64]) Brodalumab je účinný při postižení kštice a nehtů, u palmoplantární a pustulózní psoriázy. Ukazuje se jako účinný i u PsA, v této indikaci však zatím není schválen. V současné době nejsou dostupná data o kombinaci s lokální nebo systémovou léčbou, ale předpokládá se, že nebude odlišnost od ostatních již uvedených biologik [48].Specifika terapie anti-IL-17 léky
Inhibitory IL-17 jsou moderní, vysoce efektivní léky s velmi dobrou účinností na projevy psoriázy i psoriatické artritidy. Účinnost brodalumabu a ixekizumabu je v indukční fázi vyšší v porovnání s ostatními biologickými léky (včetně ustekinumabu a secukinumabu). Nepřímé důkazy naznačují, že inhibice IL-17 RA pravděpodobně vysvětluje dosažení odpovědí PASI 90 nebo PASI 100 i klinicky významné zlepšení již v 1. týdnu terapie [11, 55, 61].
Léčba inhibitory IL-17 je obvykle dobře snášena, nicméně jejich podávání může zvýšit riziko infekcí, zejména mukózních či kožních kandidóz. Ty jsou obvykle nezávažné až středně závažné, reagují na standardní terapii a nevyžadují přerušení biologické léčby. Při anti-IL-17 terapii (zejména při léčbě brodalumabem) byly zaznamenány případy exacerbace či nového vzniku Crohnovy choroby, vzácněji byla hlášena také neutropenie (většina případů byla mírná, přechodná a reverzibilní) či hepatotoxicita. U pacientů léčených brodalumabem byl popsán výskyt suicidálních představ a chování, včetně dokonaných sebevražd, kauzální vztah mezi těmito jevy a terapií brodalumabem však nebyl prokázán [43, 48].
Léky cílené proti interleukinu-23
Recentní výsledky výzkumu patogeneze psoriázy naznačují, že klíčovým cytokinem v patogenezi psoriázy je cytokin IL-23. Bylo zjištěno, že za přítomnosti IL-23 se vyvíjí patogenní Th17 lymfocyty, jež produkují prozánětlivé efektorové cytokiny jako IL-17, IL-22 a IFN-γ a podporují zánět, zatímco bez přítomnosti IL-23 vznikají nepatogenní Th17 lymfocyty, které produkují IL-17 zapojující se do slizniční ochrany a integrity bariérové tkáně. Zacílení na IL-23 prostřednictvím inhibice jeho unikátní podjednotky p19 tedy zřejmě brání aktivitě patogenních Th17 lymfocytů, přičemž (na rozdíl od inhibice IL-12/IL-23 a IL-17) ponechává intaktní ostatní složky imunitního systému, které jsou nezbytné pro obranyschopnost organismu (Th1 lymfocyty, nepatogenní Th17 lymfocyty) [9, 13, 24, 25].
Prvním registrovaným zástupcem skupiny inhibitorů IL-23 je guselkumab, následně byly registrovány tildrakizumab a risankizumab.
Guselkumab
Guselkumab je plně humánní monoklonální protilátka IgG1λ, která se selektivně váže na IL-23 (podjednotku p19). Zabraňuje interakci IL-23 s jeho receptorem, čímž dochází k inhibici signalizace IL-23 a tím též k blokádě uvolňování prozánětlivých cytokinů jako např. IL-17A [24, 69]. Základní charakteristiky guselkumabu uvádí tabulka 9.
Tab. 9. Základní charakteristiky guselkumabu 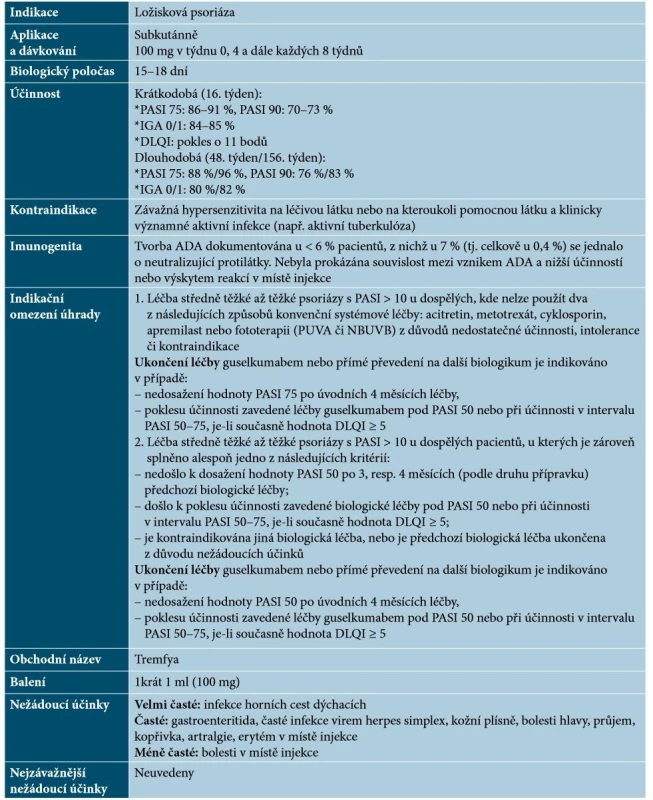
(podle [64, 69]) Guselkumab je prvním registrovaným blokátorem IL-23 a vysoce účinným lékem, jehož efekt je patrný již během prvních týdnů terapie a u většiny pacientů vede k velmi výraznému a setrvalému zmírnění projevů psoriázy; účinnost guselkumabu je popsána i po předchozí nedostatečné odpovědi na ustekinumab [7, 48, 57, 69]. Guselkumab byl účinný rovněž u pacientů s psoriatickým postižením nehtů, kštice či dlaní a plosek a na základě studií se ukazuje, že bude zřejmě účinný i u PsA [23, 48].
Tildrakizumab
Tildrakizumab je humanizovaná monoklonální protilátka IgG1κ, která se specificky váže na proteinovou podjednotku p19 IL-23 (bez vazby na IL-12) a inhibuje interakci IL-23 s jeho receptorem, čímž dochází k blokádě uvolňování prozánětlivých cytokinů [34]. Základní charakteristiky tildrakizumabu uvádí tabulka 10.
Tab. 10. Základní charakteristiky tildrakizumabu 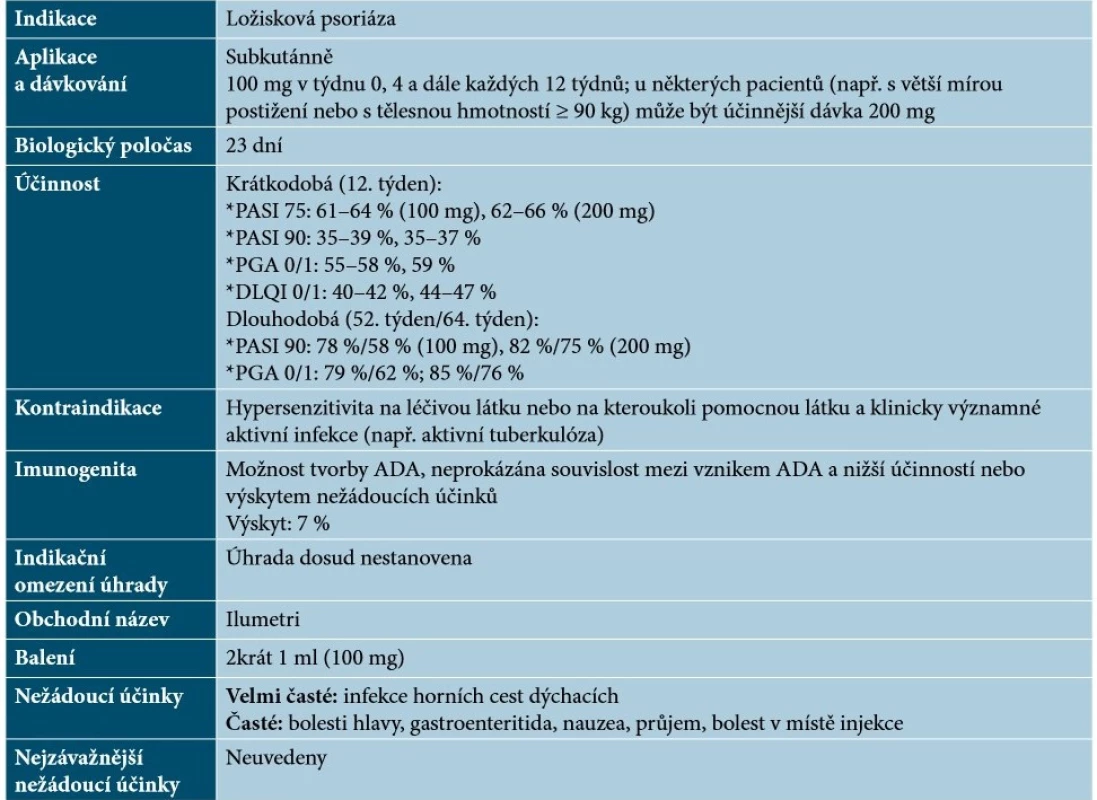
(podle [34, 48, 58]) Risankizumab
Risankizumab byl schválený Americkou lékovou agenturou (FDA) i Evropskou lékovou komisí (EMA) v dubnu 2019. Risankizumab je humanizovaná monoklonální protilátka IgG1, která se selektivně a s vysokou afinitou váže na podjednotku p19 IL-23 (bez vazby na IL-12) a brání interakci IL-23 s jeho receptorem. Tím dochází k inhibici buněčné signalizace závislé na IL-23 a blokádě uvolňování prozánětlivých cytokinů [30, 62]. Základní charakteristiky risankizumabu uvádí tabulka 11.
Tab. 11. Základní charakteristiky risankizumabu 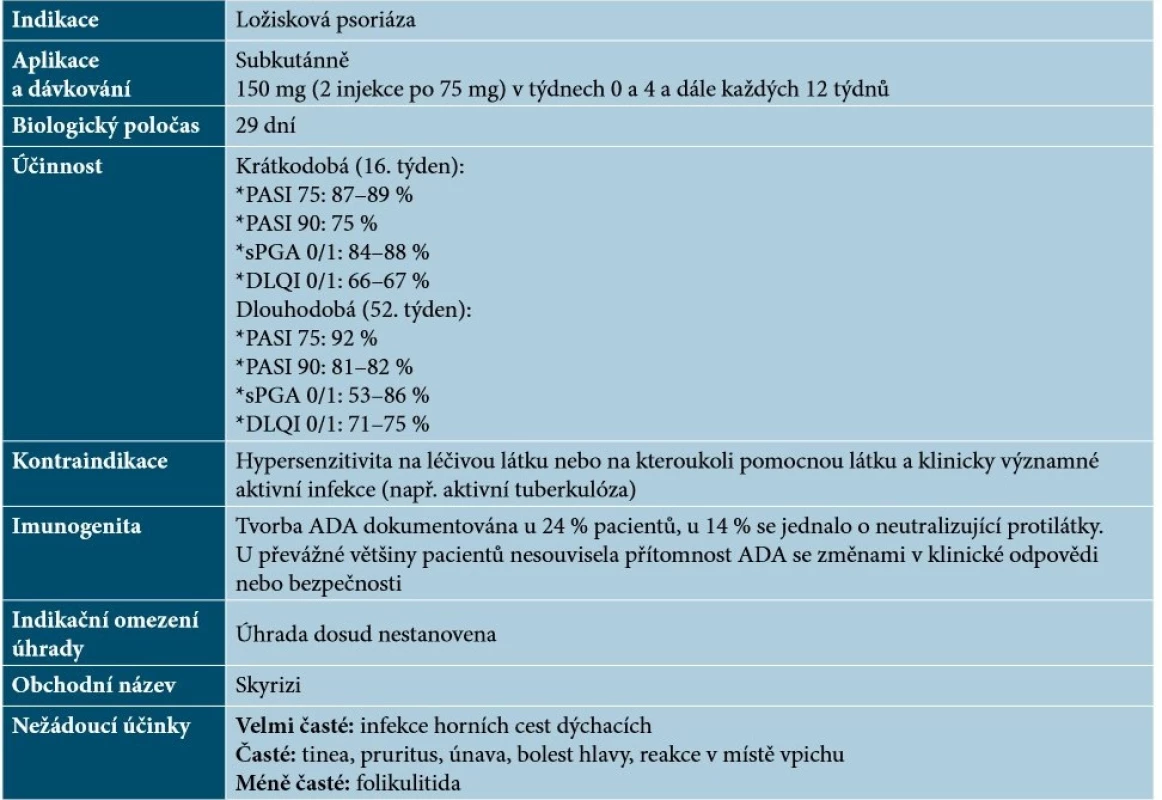
(podle [30, 48, 62]) Specifika terapie anti-IL-23 léky
Inhibitory IL-23 jsou nejmodernějšími biologickými léky pro terapii psoriázy. Vyznačují se velmi vysokou účinností a dobrou snášenlivostí. Data týkající se dlouhodobé bezpečnosti anti-IL-23 léků jsou stále shromažďována, dosud nebyla identifikována žádná specifická rizika spojená s touto terapií. Nejčastějšími nežádoucími účinky léčby jsou podobně jako u předchozích lékových skupin infekce, především infekce horních cest dýchacích. V současné době nejsou dostupná data o kombinaci s lokální nebo systémovou léčbou, ale předpokládá se, že nebude odlišnost od ostatních biologik [48].
MALÉ MOLEKULY V LÉČBĚ CHRONICKÉ LOŽISKOVÉ PSORIÁZY
Nebiologickým cíleným lékem schváleným pro terapii psoriázy je apremilast, perorálně podávaný inhibitor fosfodiesterázy 4 (PDE4) s malou molekulou. Působí intracelulárně, kde moduluje síť prozánětlivých a protizánětlivých mediátorů. Inhibice PDE4 zvyšuje intracelulární hladiny cyklického adenosinmonofosfátu (cAMP), což má za následek utlumení zánětlivé odpovědi díky modulaci exprese TNF-α, IL-23, IL-17 a jiných prozánětlivých cytokinů. Cyklický AMP také ovlivňuje hladiny protizánětlivých cytokinů, jako je například IL-10 [54]. Základní charakteristiky apremilastu uvádí tabulka 12.
Tab. 12. Základní charakteristiky apremilastu 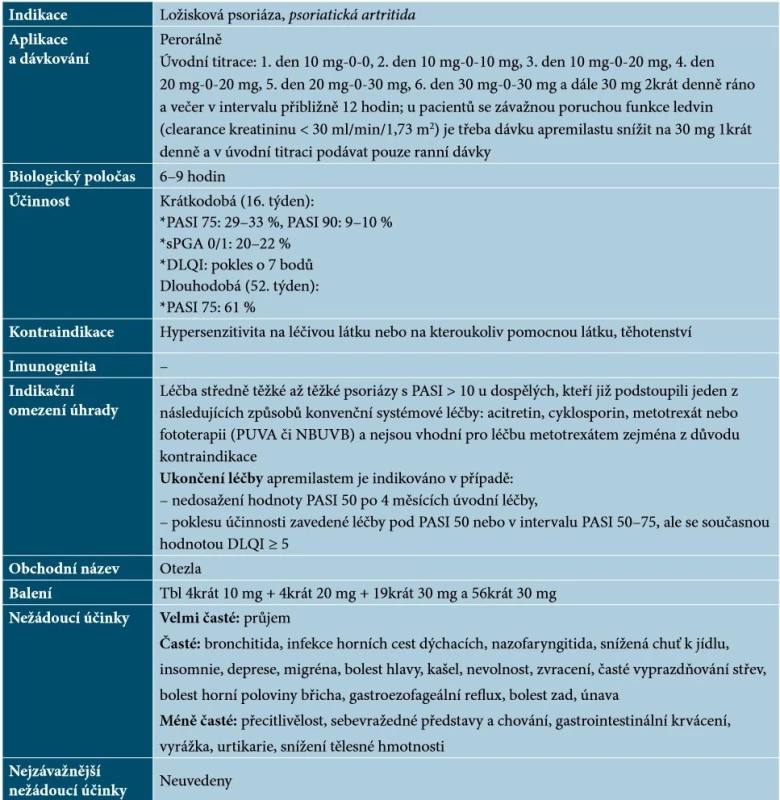
Vysvětlivky: tč. bez úhrady v ČR – označeno kurzivou
(podle [1, 48, 54])Apremilast prokázal svůj efekt nejen u pacientů s chronickou ložiskovou psoriázou, ale i u nemocných s palmoplantární psoriázou či s psoriázou nehtů a kštice [6, 52]. V porovnání s biologickými léky je účinnost apremilastu obecně nižší, a proto je určen zejména pro pacienty se středně těžkou psoriázou [9]. Apremilast lze podávat dlouhodobě, výhodou je, že není nutné laboratorní vyšetření před léčbou a monitorování v průběhu terapie [68].
Apremilast by neměli užívat pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy [1, 54].
Při léčbě je nutno dbát na možnost lékových interakcí – nedoporučuje se současné užívání apremilastu se silnými induktory enzymu CYP3A4 (např. rifampicin, fenobarbital, karbamazepin, fenytoin a třezalka tečkovaná), neboť může dojít ke snížení systémové expozice apremilastu, a tím ke snížení jeho účinnosti. U pacientů s podváhou na začátku léčby je třeba pravidelně kontrolovat tělesnou hmotnost. Podávání apremilastu je spojeno se zvýšeným rizikem psychiatrických poruch, jako je například insomnie a deprese. Pokud se u pacientů objeví nové psychiatrické příznaky či dojde ke zhoršení stávajících, nebo jsou zjištěny sebevražedné představy, je doporučeno léčbu apremilastem ukončit [54].
VÝBĚR A DLOUHODOBÉ VEDENÍ CÍLENÉ LÉČBY
Zahájit a vést biologickou terapii u pacientů s psoriázou by měl specializovaný lékař se zkušenostmi s diagnostikou a léčbou psoriázy; psoriatickou artritidu a/nebo komorbidity je třeba léčit ve spolupráci s příslušnými odborníky. Biologická terapie psoriázy je v České republice soustředěna do Center pro biologickou léčbu a sledována v klinické praxi formou zadávání dat do registru. Registr BioReP pro pacienty léčené biologiky a novými malými molekulami byl založen v roce 2005 (modernizován byl v roce 2011 a v roce 2019) a je spravován Českou dermatovenerologickou společností (ČDS JEP). V registru jsou zpracovávána data pacientů léčených „centrovými“ léky s hlavním cílem sledovat bezpečnost a účinnost této terapie v reálné klinické praxi.
Výběr léčiva má být výsledkem diskuse mezi lékařem a pacientem, který by měl být podrobně informován o všech možnostech léčby a o jejích rizicích a přínosech [63]. Je nutné zohlednit faktory související s onemocněním (závažnost a aktivita psoriázy, výsledky předchozí léčby, přítomnost PsA a dalších přidružených chorob), faktory na straně pacienta (kvalita života, věk, tělesná hmotnost, koncepční plány, preference a očekávání pacienta, interval a cesta podání, pravděpodobnost adherence) a faktory související s léčbou (účinnost a bezpečnost, vliv léčby i na případná přidružená onemocnění) [28, 48, 63]. Vzdělávání pacienta o etiologii, komorbiditách, možnostech léčby a faktorech životního stylu spojeného s lupénkou optimalizuje společné rozhodnutí, vztah mezi pacientem a lékařem a pozitivně ovlivňuje spokojenost pacientů a dodržování léčby [48].
Odezva na biologickou terapii (tj. dosažení cíle léčby) má být hodnocena primárně v časových intervalech příslušných pro dané léčivo (obvykle po 3–4 měsících léčby) a dále pravidelně v průběhu terapie (po dobu prvních 52 týdnů každé 3 měsíce a poté každých 6 měsíců). Pokud není účinnost dostatečná, lze zvážit navýšení dávek biologického léku, zkrácení intervalu mezi dávkami nebo přidání další léčby (lokální ošetření či kombinace s klasickou systémovou léčbou, nejčastěji s MTX). Některá uvedená řešení však mohou znamenat, že léčivo je podáváno jinak, než specifikuje SPC (tzv. off-label) nebo léčba není v souladu s kritérii úhrady zdravotní pojišťovnou, případně se výrazně zvýší náklady na léčbu [64]. Pokud léčbu nelze tímto způsobem upravit, nebo pokud ani po úpravě nedojde k adekvátní odpovědi, je nutná změna léčby. Změna biologického léku je indikována, pokud není dosaženo odpovědi na léčbu (primární selhání), onemocnění zpočátku reaguje, ale následně se léčebná odpověď vytratí (sekundární selhání), současná biologická terapie je špatně snášena nebo se stane kontraindikovanou [41, 49, 63]. Přechod z jednoho biologického léku na jiný je možný bez „washout intervalu“ (nový lék se začíná podávat v době plánované další dávky původního léku), někteří autoři doporučují pauzu v délce troj - až čtyřnásobku biologického poločasu předchozího léku [41, 48]. Pokud má být lék hrazen zdravotní pojišťovnou, je nutné dodržet podmínky úhrady, jak je stanoveno, nebo zažádat o schválení úhrady [64].
Psoriáza je celoživotní onemocnění s kolísavým chronickým průběhem a většina pacientů potřebuje dlouhodobou, celoživotní terapii. Dočasná přerušení systémové léčby jsou možná, nicméně u některých léků lze pozorovat nižší účinnost po přerušení léčby a pacienty je nutné pečlivě sledovat vzhledem k riziku vzplanutí choroby [14, 41].
RIZIKA CÍLENÉ TERAPIE A LÉČBA VE ZVLÁŠTNÍCH SITUACÍCH
Cílená léčba a infekční onemocnění
Biologické léky schválené k terapii psoriázy vzhledem ke svému mechanismu působení obecně zvyšují riziko infekcí. Z běžných infekcí jsou nejčastěji zaznamenávány infekce horních cest dýchacích, méně často infekce dolních cest dýchacích, infekce kůže (zejména herpes zoster a erysipel) nebo infekce močových cest [14, 56]. Vzácně může být biologická terapie komplikována výskytem závažných či oportunních infekcí [26].
Pacienti s psoriázou by před zahájením biologické léčby měli být vyšetřeni s ohledem na rizikové faktory infekcí (např. komorbidity, současná terapie, životní styl a cestování), známé infekce (minulé nebo současné) a známky a příznaky svědčící o infekci. Po známkách a příznacích infekce je třeba pátrat i v průběhu biologické léčby [63]. Klinicky významné je především riziko reaktivace hepatitidy B či C a tuberkulózy. Velmi specifická je terapie pacientů s psoriázou a infekcí virem HIV.
U infekcí v průběhu léčby je vhodné biologickou léčbu přerušit a znovu zahájit po ústupu symptomů [48].
U chronické hepatitidy B vedou zvýšené hodnoty TNF-α k potlačení virové replikace, podání anti-TNF-α léků proto může vést ke zvýšení replikace viru, a následně k reaktivaci a zhoršení infekce (riziko reaktivace při biologické léčbě je vyšší u pacientů s pozitivitou anti-HBsAg než anti-HBcAg) [3]. Před zahájením biologické léčby se doporučuje stanovení HBsAg, anti-HBsAg a anti-HBc. U pacientů s pozitivitou jakéhokoliv uvedeného markeru (kromě izolované pozitivity anti-HBsAg u pacientů očkovaných proti hepatitidě B) je indikováno kompletní sérologické vyšetření, tj. stanovení HBeAg, anti-HBe a HBV-DNA. U pacientů se zvýšeným rizikem infekce HBV může být vhodné průběžné testování (např. jednou ročně) na HBV; vyšetření je vhodné zopakovat také u nemocných s nevysvětlitelnou elevací jaterních enzymů ALT, AST [63]. Prodělaná či probíhající infekce HBV nemusí nutně znamenat úplnou kontraindikaci léčby, ale pacient musí být pečlivě sledován [28]. U HBsAg pozitivních pacientů může dojít k reaktivaci při podání terapie anti-TNF-α a ustekinumabu; inhibitory IL-17 se zdají být bezpečné při antivirové profylaxi, monitorování jaterních testů a sledování virové nálože. Data pro podání apremilastu či anti-IL-23 nejsou známá. U anti-HBc pozitivních pacientů je riziko reaktivace infekce nižší než u HBsAg pozitivních, proto je možno podat inhibitory TNF-α, ustekinumab i inhibitory IL-17 za předpokladu monitorování jaterních testů a titru HBV DNA. Zatím nejsou známá data pro podání apremilastu a anti-IL-23 léků [1, 36, 48]. U neimunních pacientů se před zahájením biologické léčby doporučuje očkování proti hepatitidě B [3].
Infekce virem hepatitidy C přechází do chronicity u více než 75 % pacientů. Průběh chronické hepatitidy C je obvykle benigní, nicméně u 10–20 % pacientů dochází k rozvoji jaterní cirhózy s rizikem vzniku hepatocelulárního karcinomu. Reaktivace hepatitidy C je méně častá, avšak dojde-li k ní, morbidita a mortalita pacientů je podobná jako v případě reaktivace hepatitidy B. Před zahájením biologické léčby se proto doporučuje stanovení anti-HCV a u pacientů s pozitivitou tohoto markeru je nezbytné doplnit kvantitativní vyšetření HCV RNA a jaterní testy [10]. U nemocných se zvýšeným rizikem infekce může být vhodné průběžné testování (např. jednou ročně) na HCV; vyšetření je vhodné zopakovat také u pacientů s nevysvětlitelnou elevací jaterních enzymů ALT, AST [63]. Ukazuje se, že anti--TNF-α léky mohou být poměrně bezpečně podány u nemocných s infekcí HCV – v průběhu této terapie hodnoty ALT a HCV RNA u většiny pacientů zůstávají beze změn, popř. klesnou [10]. U chronické hepatitidy C jsou během léčby inhibitory TNF-α nutné kontroly jaterních testů a virémie při antivirové léčbě. Bezpečnostní profil ustekinumabu je kontroverzní, naproti tomu inhibitory IL-17 a apremilast mají příznivý bezpečnostní profil, ale dostupné údaje jsou omezené. Pro léčbu inhibitory IL-23 u hepatitidy C není dostatek dat. U pacientů s infekční hepatitidou je před zahájením biologické léčby vždy vhodná konzultace hepatologa [36, 48].
Pacienti s infekcí HIV mají vyšší prevalenci psoriázy a těžší průběh onemocnění [14, 28]. V České republice je v současnosti biologická léčba podle SPC kontraindikovaná u klinicky závažných infekcí. V indikovaných případech, kdy nejsou jiné možnosti léčby, lze zvážit u pacientů s infekcí HIV podání apremilastu, případně inhibitorů TNF-α či ustekinumabu za předpokladu, že jsou pacienti zároveň léčeni antiretrovirovou terapií (HAART – highly active antiretroviral therapy), mají normální počet CD4+ T-lymfocytů a nedetekovatelnou virovou nálož a v nedávné době neprodělali oportunní infekci. Léčba psoriázy má probíhat ve spolupráci s infektologem, nutné je pečlivé monitorování a je třeba pamatovat na zvýšené riziko oportunních infekcí a malignit. O použití anti-IL-17 a anti-IL-23 léků u nemocných s infekcí HIV zatím není dostatek údajů [14, 36, 48].
Biologická léčba, především terapie anti-TNF-α léky, je spojena s rizikem vzniku tuberkulózy (viz výše), většina případů aktivní TBC je přitom způsobena reaktivací latentní infekce (LTBI) [56]. Infekce může být atypická, častěji bývá extrapulmonální a diseminovaná [63].
Aby se zabránilo vzniku TBC, je nutné pátrat po latentní či aktivní TBC před zahájením biologické léčby, během léčby a ještě 6 měsíců po jejím ukončení (vzhledem k prodloužené eliminaci léků). Před zahájením biologické terapie je důležité odebrat pečlivou, cílenou anamnézu a provést klinické vyšetření. Více ohroženy jsou některé skupiny pacientů, jako jsou imigranti ze zemí s vysokou prevalencí TBC, osoby s profesními riziky (pracující s vězni, bezdomovci či se specifickým biologickým materiálem) nebo se sníženou imunitou (nemocní s diabetes mellitus, jaterní cirhózou, malnutricí, chronickým selháním ledvin či některými hematologickými chorobami, pacienti dlouhodobě léčení imunosupresivy).
Před léčbou se provádí screeningová vyšetření, která zahrnují RTG hrudníku, tuberkulinový kožní test (TST, Mantoux II – MX II) a test uvolňování interferonu-γ (IGRA) [3, 28]. U tuberkulinového testu se za pozitivní výsledek považuje indurace v místě vpichu ≥ 6 mm. Výsledky mohou být zkresleny zejména předchozí kalmetizací (falešná pozitivita, hodnota 6–15) a imunosupresí, ať již v důsledku systémového onemocnění či terapie (falešná negativita). Z těchto důvodů jsou u pacientů očkovaných vakcínou BCG a u imunosuprimovaných osob upřednostňovány testy IGRA, nejčastěji se používá QuantiFERON TB-Gold test (QFT), méně často T-SPOT test, které měří uvolňování IFN-γ po stimulaci specifickými antigeny Mycobacterium tuberculosis [14]. Testy IGRA mají vyšší senzitivitu i specificitu než TST, přesto se mohou vyskytnout výsledky falešně pozitivní (opakované kožní tuberkulinové testy mohou posílit uvolňování IFN-γ) i falešně negativní (pacienti léčení imunosupresivy); testy IGRA nedokážou rozlišit mezi aktivní a latentní TBC a jsou méně citlivé na staré infekce [28].
Pokud je u pacienta zjištěna LTBI (tj. při pozitivitě MX II > 15 mm či pozitivním testu IGRA), biologická léčba je možná, ale souběžně musí probíhat profylaktická antituberkulózní léčba. Nejčastěji se podává isoniazid po dobu 6 měsíců v dávce 5 mg/kg (maximálně 300 mg denně) se současným podáním pyridoxinu 10 mg denně (prevence neuropatie). Během chemoprofylaxe je nutné pravidelně kontrolovat jaterní testy – před zahájením léčby, první 3 měsíce po 4 týdnech, později po 6–8 týdnech. Biologickou léčbu je možné zahájit nejdříve po 1–2 měsících profylaxe [3, 14, 28, 71].
U pacientů s psoriázou a LTBI jsou primárně doporučeny inhibitory IL-17 a apremilast. Anti-TNF-α léky (riziko reaktivace LTBI je nižší u pacientů léčených etanerceptem než infliximabem a adalimumabem) a ustekinumab je možno použít po chemoprofylaxi. Pro použití inhibitorů IL-23 zatím není dostatek důkazů, nicméně ve studiích s risankizumabem při léčbě nemocných s psoriázou a LTBI nedošlo i přes absenci profylaktické terapie k reaktivaci TBC po dobu 55 týdnů [3, 36, 62].
Screeningová vyšetření na přítomnost TBC je vhodné opakovat každý rok a dále při výskytu známek a příznaků svědčících pro TBC, při expozici TBC či při delším pobytu v prostředí s vysokým výskytem TBC. Pokud je zjištěna pozitivita TST či IGRA, je indikován RTG plic a vyšetření pneumologem; při vyloučení aktivní TBC se zahajuje preventivní antituberkulózní terapie. Ve většině případů se biologická léčba na 1–2 měsíce přerušuje. Pokud během biologické terapie vznikne aktivní TBC, doporučuje se tuto léčbu ukončit. Po zhojení TBC a skončení léčby antituberkulotiky je možné v indikovaném případě biologickou terapii znovu zahájit. U pacientů léčených anti-IL-12/IL-23, anti-IL-17 a anti-IL-23 léky (u nichž se nejeví zvýšené riziko reaktivace TBC) by snad kontrolní screeningová vyšetření mohla být prováděna méně často, k tomuto však zatím neexistuje specifický doporučený postup [14, 28, 63, 71].
V České republice byly Českou pneumologickou a ftizeologickou společností (ČPFS) vydány v roce 2005 (s aktualizací v roce 2016) doporučené postupy vyšetřování TBC při anti-TNF-α léčbě [23], které doporučují kompletní vyšetření před léčbou (RTG plic, MX II a QFT) a v prvním roce podávání biologika opakované vyšetření RTG a QFT po 6 měsících. Při negativitě provedených vyšetření a nepřítomnosti klinického podezření se kontroly v dalších letech provádí 1krát ročně. Opatření navržená ČPFS nejsou vždy v praxi dodržována a často se liší i postupy jednotlivých pneumologických pracovišť. Doporučený postup diagnostiky a léčby latentní tuberkulózní infekce WHO, ze kterého vychází i materiál ČPFS z roku 2015 [70, 72], je ve shodě s doporučenými postupy pro léčbu psoriázy AAD [48]. Před léčbou je doporučeno vyšetření TST či QFT, v případě pozitivity těchto vyšetření provést RTG a podat profylaktickou antituberkulózní léčbu (uvedena výše). Během léčby se u všech používaných preparátů doporučuje každoroční kontrola TST či QFT u rizikových skupin, u ostatních bez rizika se vyšetření provádí, podobně jako kontrolní RTG, podle rozhodnutí ošetřujícího dermatologa.
Riziko vzniku TBC v souvislosti s léčbou biologiky nelze podceňovat a při kontrolách nemocných je nutno pátrat po možných rizicích nákazy i možných příznacích (kašel, únava, noční pocení, nechutenství spojené s úbytkem hmotnosti, zvýšené teploty).
Cílená léčba a malignity
Ukazuje se, že u pacientů s psoriázou během biologické léčby není zvýšené riziko nádorových onemocnění kromě vyššího výskytu NMSC (zejména spinocelulárního karcinomu), a to především pokud pacienti dříve absolvovali fotochemoterapii PUVA a léčbu cyklosporinem. Léčba anti-TNF-α a ustekinumabem v monoterapii není spojena s rizikem solidního tumoru nebo lymforetikulární malignity, kombinace s jinými imunosupresivními látkami však může bezpečnostní profil změnit. Pro anti-IL-17 léky, anti-IL-23 léky a apremilast zatím nejsou k dispozici dostatečně dlouhodobá data ohledně rizika malignit, dosud však nebyly žádné případy hlášeny.
Před zahájením biologické léčby a v jejím průběhu by měli být pacienti vyšetřeni a sledováni s ohledem na jejich možnou minulou nebo současnou anamnézu nádorového onemocnění a možný vznik malignity v budoucnu včetně pravidelného vyšetřování kožního povrchu. Jestliže má pacient v anamnéze zhoubné onemocnění diagnostikované a léčené před méně než 5 lety, je třeba postupovat opatrně po domluvě s příslušným specialistou či onkologem. Biologická léčba se nesmí podávat během léčby invazivní malignity. Všichni pacienti by měli být zapojeni do screeningových programů nádorových onemocnění [28, 37, 48, 63].
Cílená léčba a obezita
Pacienti s psoriázou bývají obéznější než populace bez psoriázy. Všechny léky ze skupiny anti-TNF-α se používají v jednotném dávkování s výjimkou infliximabu, který se podává podle hmotnosti. Četné studie ukázaly, že terapeutická odpověď je lepší u pacientů s normálním BMI oproti vyššímu BMI, a je prokázáno, že snížení hmotnosti vede k lepšímu efektu anti-TNF-α léčby. Ustekinumab se dávkuje podle tělesné hmotnosti, ale tělesná hmotnost a přítomnost diabetu mohou ovlivňovat distribuční objem léku. Vzhledem k dávkování podle hmotnosti je ideálním lékem pro obézní pacienty infliximab a ustekinumab. Inhibitory IL-17 jsou vysoce účinné léky bez ohledu na tělesnou hmotnost, pacienti s normální hmotností však mají lepší odezvu na tuto terapii než pacienti s nadváhou a obezitou. Na rozdíl od inhibitorů TNF-α nebylo pozorováno, že by inhibitory IL-17 způsobovaly v klinických studiích zvýšení tělesné hmotnosti. Údaje o vlivu inhibitorů IL-23 na tělesnou hmotnost nejsou dostatečné, nicméně i tyto léky jsou vysoce účinnými látkami i u obézních pacientů. Apremilast může být s úspěchem používán u obézních pacientů, neboť ztráta hmotnosti je možným vedlejším účinkem [4, 20, 37, 68].
Cílená léčba a kardiovaskulární onemocnění
Psoriáza je nezávislým rizikovým faktorem pro rozvoj kardiovaskulárních nemocí [20, 37]. Chronický zánět hraje významnou roli při vzniku aterosklerózy, která je příčinou zvýšeného výskytu velkých kardiovaskulárních příhod (MACE – major adverse cardiovascular event), jako jsou infarkt myokardu, iktus, srdeční selhání a úmrtí z kardiovaskulárních příčin. Biologické léky svým protizánětlivým působením snižují výskyt MACE při léčbě psoriázy, například bylo dokumentováno snížení rizika infarktu myokardu při terapii anti-TNF-α léky [20, 37, 75]. Inhibitory TNF-α jsou proto preferovanou skupinou pro léčbu psoriázy u pacientů s kardiovaskulárním rizikem [29]. Ustekinumab má určité potenciální kardioprotektivní účinky, ale je zapotřebí více dlouhodobých údajů. Pro použití apremilastu a inhibitorů IL-17 a IL-23 je zapotřebí další sledování [37].
U pacientů léčených anti-TNF-α bylo pozorováno zhoršení příznaků srdečního selhávání, tato terapie by proto neměla být použita u nemocných se závažným srdečním selháváním (stupeň III/IV podle NYHA – New York Heart Association) [14, 63]. U pacientů s méně závažným srdečním selháváním (stupeň I/II podle NYHA) se před zahájením biologické léčby doporučuje konzultace kardiologa a provedení echokardiografického vyšetření; je-li ejekční frakce nižší než 50 %, neměly by se anti-TNF-α léky podávat. Léčba by měla být ukončena při nástupu nových symptomů nebo zhoršení příznaků dříve existujícího srdečního selhávání [3, 14, 37]. Terapie ustekinumabem, anti-IL-17 léky, anti-IL-23 léky i apremilastem se jeví u pacientů s městnavým srdečním selháním jako bezpečná [37].
Cílená léčba a demyelinizační onemocnění
Při terapii anti-TNF-α léky byl vzácně (u méně než 1 % pacientů) pozorován výskyt (či zhoršení projevů) demyelinizačních onemocnění, tato léčba proto nesmí být podávána pacientům s roztroušenou sklerózou či jiným demyelinizačním onemocněním a není doporučována, ani pokud má nemocný příbuzného v první linii s demyelinizačním onemocněním [14, 63]. Při terapii ustekinumabem nebylo dokumentováno zhoršení projevů roztroušené sklerózy, u pacientů s anamnézou demyelinizačního onemocnění je proto ustekinumab lékem volby. Anti-IL-17 léky (zmiňován je zejména secukinumab) mohou mít, podle dosavadních zjištění, na průběh roztroušené sklerózy příznivý vliv, je však zapotřebí dalších studií [3, 37]. U anti-IL-23 léků a apremilastu zatím není dostatek údajů [37].
Cílená léčba a zánětlivá střevní onemocnění
U nemocných s psoriázou byl popsán vyšší výskyt zánětlivých střevních onemocnění (IBD) v porovnání s běžnou populací. Nejvhodnější léčbou pro pacienty se současným IBD jsou adalimumab, infliximab či ustekinumab. Všechny tyto preparáty jsou schváleny pro léčbu Crohnovy choroby i ulcerózní kolitidy [3, 48, 65]. Ačkoliv nebyl potvrzen přímý kauzální vztah mezi anti-IL-17 léky a vznikem Crohnovy choroby, byl vzácně popsán vznik nebo zhoršení projevů již existujícího IBD, a proto se u pacientů s anamnézou IBD nedoporučuje jejich podání. Brodalumab je u pacientů s aktivní Crohnovou chorobou kontraindikován. Při zahajování terapie secukinumabem a ixekizumabem u pacientů s pozitivní rodinnou anamnézou IBD se doporučuje zvýšená opatrnost, vhodné je konzultovat gastroenterologa [37, 63]. V současné době probíhají klinické studie s inhibitory IL-23 (guselkumabem a risankizumabem) u morbus Crohn a ulcerózní kolitidy. U apremilastu nebylo popsáno zhoršení Crohnovy choroby, může však způsobovat (zejména v počátku léčby) průjem jako vedlejší účinek [37].
Cílená léčba a deprese
Psoriáza, zejména závažná, významně ovlivňuje kvalitu života a zároveň je spojena s vyšším výskytem psychických onemocnění [8, 74]. Zvýšený výskyt deprese potvrzuje sledování, ve kterém 16,5 % pacientů splnilo kritéria pro diagnózu závažné deprese bez ohledu na závažnost psoriázy [17]. V klinických studiích bylo prokázáno zlepšení kvality života a významné zmírnění deprese a úzkosti při léčbě etanerceptem, adalimumabem i ustekinumabem [19, 47, 66]. U nemocných s psoriázou je nutné sledovat příznaky úzkosti a deprese nebo sebevražedných myšlenek, pacienty informovat a nabídnout jim pomoc psychologa či psychiatra. Biologická léčba může pomoci zlepšit úzkosti a deprese u psoriázy [20], nicméně je nutno sledovat možné zhoršení psychického stavu i vlivem léčby, zejména při terapii apremilastem [1, 41, 54], popř. brodalumabem (u brodalumabu kauzální vztah nebyl prokázán) [43, 48].
Biologická léčba a tzv. paradoxní reakce
Biologická terapie může vést k novému výskytu či zhoršení projevů onemocnění, proti kterým by tato léčba měla být účinná. Z těchto reakcí byly nejčastěji hlášeny psoriáza, uveitida, sarkoidóza či Crohnova nemoc [12]. „Paradoxní psoriáza“, tj. zhoršení či nový výskyt psoriázy, je známým nežádoucím účinkem anti-TNF-α léků zejména při léčbě střevních zánětů, zaznamenána však byla i při terapii ustekinumabem [45, 48]. Nejčastěji se udává rozvoj pustulózní psoriázy na dlaních a ploskách nebo psoriáza kštice; postiženy bývají častěji ženy a průměrný věk v době manifestace projevů činí 30–45 let [12]. Léčebně se doporučuje kombinovaná lokální antipsoriatická terapie a u úporných případů změna biologika (účinnější je převedení na lék s jiným mechanismem účinku) [14, 45].
Cílená léčba a lupus erythematosus
Při podávání anti-TNF-α léků může vzácně dojít ke vzniku lupus erythematosus nebo k jeho opakovanému vzplanutí. Lupus vyvolaný anti-TNF-α terapií se vyznačuje vyšším výskytem hypokomplementémie a vyššími titry anti-dsDNA protilátek a častějším postižením ledvin a centrální nervové soustavy než lupus vyvolaný jinými léky. Ustekinumab je vhodnou léčbou pro pacienty se souběžnou psoriázou a lupus erythematosus. U apremilastu a inhibitorů IL-17 a IL-23 není dostatek dat, dosud však nebyly hlášeny případy indukce lupus erythematosus ani jeho vzplanutí [37].
Biologická léčba a vakcinace
Před zahájením biologické léčby je vhodné zkontrolovat a doplnit předepsaná očkování. V průběhu biologické léčby je bezpečné očkování neživými vakcínami, v důsledku imunosuprese však může být snížená odpověď na vakcínu (zejména u anti-TNF-α léků) [51]. Pacientům s biologickou terapií (ani dětem do 6 měsíců věku, jejichž matky dostávaly biologickou léčbu po 16. týdnu těhotenství) není možné aplikovat živé a atenuované vakcíny (BCG, spalničky, příušnice, zarděnky, rotaviry, orální poliomyelitida, orální tyfus, žlutá zimnice, varicella, herpes zoster).
Názory odborníků na délku přerušení léčby před podáním živých vakcín a po něm se liší – někteří doporučují přerušení biologické léčby 2 až 3 poločasy před podáním živých vakcín a po něm, jiní doporučují přerušení biologické léčby 4 týdny (nebo déle v závislosti na poločasu biologického účinku) před očkováním a do 1 až 2 týdnů po očkování [48]. Podle britských doporučených postupů mohou být živé či oslabené vakcíny podány nejdříve za 6 měsíců od ukončení biologické terapie (resp. za 12 měsíců v případě vakcíny proti herpes zoster) a biologickou léčbu lze opět zahájit nejdříve za 4 týdny od vakcinace [63]. Doporučenou dobu přerušení léčby před podáním živých vakcín a po něm u vybraných biologik uvádí tabulka 13.
Tab. 13. Přehled biologických poločasů, doby přerušení léčby před koncepcí a vakcinací u jednotlivých cílených léků 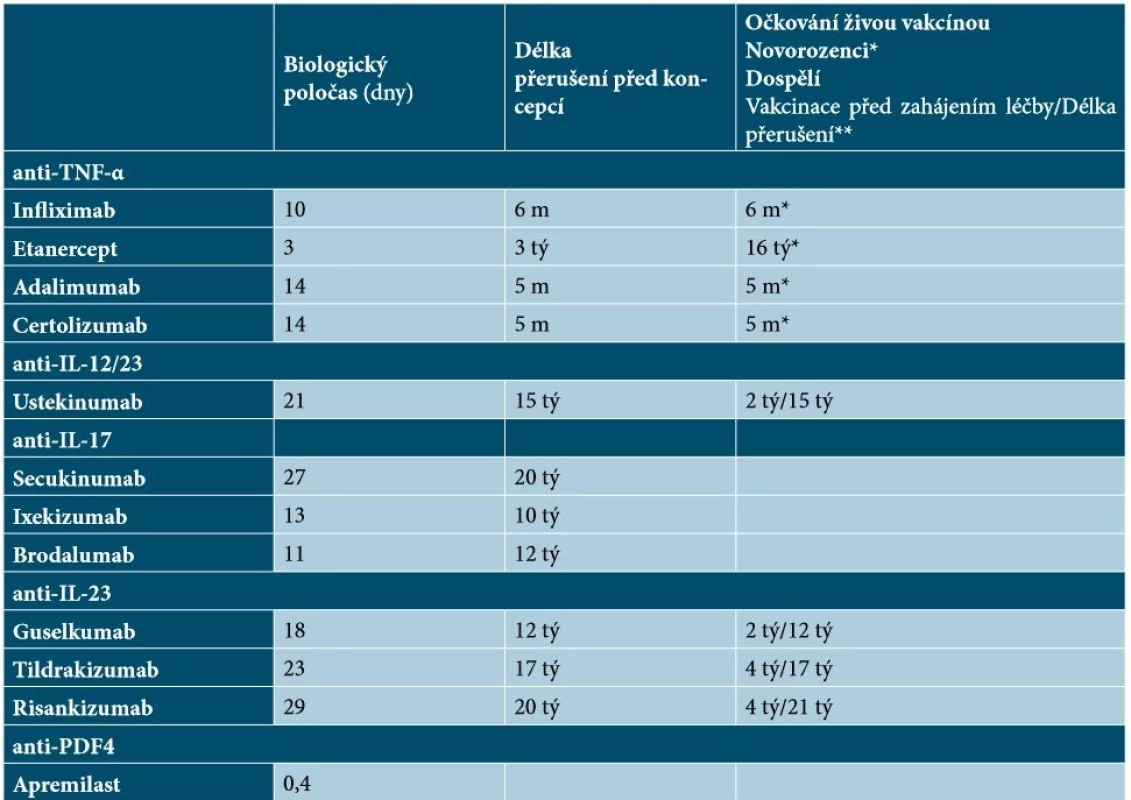
Vysvětlivky: m – měsíc, tý – týden
*Doporučená doba pro podání živé vakcíny novorozencům od podání poslední dávky biologika matce
** Doporučená doba mezi vakcinací a zahájením biologické léčby/Doporučený interval přerušení biologické léčby před očkováním živou vakcínou
(podle [16, 18, 21, 33, 34, 43, 54, 59, 62, 65, 67, 69])Před zahájením biologické terapie je vhodné očkování proti hepatitidě B a proti pneumokoku (zejména u starších pacientů); u pacientů nad 60 let, u nichž je plánována terapie anti-TNF-α léky, se také doporučuje zvážit očkování proti herpes zoster [56]. V průběhu systémové terapie je dále doporučeno každoroční očkování proti chřipce [1,14].
Biologická léčba a plánované operace
U pacientů podstupujících operační výkon může biologická terapie zvyšovat riziko infekce a zpomalovat hojení rány. U nemocných, u nichž je plánována operace, je proto vhodné zvážit přerušení biologické léčby s přihlédnutím na individuální rizikové faktory i komorbidity. Zohlednit je zapotřebí riziko pooperačních komplikací na jedné straně a zároveň riziko zhoršení psoriázy na druhé straně [63]. U výkonů s nízkým rizikem lze pokračovat v biologické léčbě (inhibitory TNF-α, ustekinumab), u výkonů se středním a vysokým rizikem (operace v oblasti dýchacího, gastrointestinálního a genitourinárního systému, narušení sterilního prostředí, přítomnost infikované či devitalizované tkáně, tabulka 14) je vhodné zvážit přerušení léčby 3–4 biologické poločasy před výkonem. U infliximabu se doporučuje přerušit léčbu 4–7 týdnů před operací (případně mezi dvěma infuzemi), u adalimumabu 6–10 týdnů, u etanerceptu 9–15 dní, u ustekinumabu 9–15 týdnů [1]. Léčbu inhibitory IL-17 se doporučuje ukončit 4 týdny před plánovaným výkonem, u inhibitorů IL-23 zatím není dostatek údajů [1, 48]. S biologickou léčbou po operaci je možné znovu začít, pokud nejsou přítomny známky infekce a rána se hojí uspokojivě (obvykle za 10–14 dní) [14, 48, 63].
Tab. 14. Stratifikace operačních výkonů podle rizika 
Biologická léčba a její přerušení
U pacientů, u kterých byla léčba přerušena, se při opakovaném podání řídí výše podané dávky závažností psoriázy a počtu vynechaných dávek. Startovací dávka je doporučena při vzplanutí psoriázy a/nebo při vynechání odpovídajícímu 3–4 poločasům konkrétního léku [48].
CÍLENÁ LÉČBA PSORIÁZY U SPECIFICKÝCH SKUPIN PACIENTŮ
Cílená léčba u pacientů s psoriatickou artritidou
Psoriatická artritida (PsA) se vyskytuje u 11–40 % pacientů s psoriázou [3]. Častější je u nemocných s postižením nehtů či kštice, s psoriatickými ložisky v inverzní lokalizaci a s těžkou, rozsáhlou psoriázou [46, 73]. Přibližně v 80 % případů se artritida projeví až po manifestaci psoriázy (průměrně za 10 let od prvních kožních příznaků). Nejčastěji jsou postiženy distální či proximální interfalangeální klouby rukou i nohou, metakarpo - a metatarzofalangeální klouby, zápěstí, hlezno, loket či koleno, přítomno však může být i axiální postižení (sakroiliakální klouby). Často se zároveň vyskytují daktylitidy a entezidy, popř. oční záněty (uveitida). Chronický zánět časem vede k ireverzibilnímu poškození kloubu a jeho funkce. Je zjištěno, že erozivní artropatie se vyskytuje u 40–60 % nemocných a často velmi brzy v průběhu onemocnění. U 27 % se vyvinula již v prvních pěti měsících od nástupu nemoci a u téměř 50 % v průběhu dvou let od nástupu nemoci. Je proto klíčová včasná diagnostika a léčba PsA [31, 35].
V terapii PsA jsou vysoce účinné a preferované anti-TNF-α léky (infliximab, adalimumab, etanercept, certolizumab), jejichž podávání vede ke zmírnění známek a příznaků PsA, včetně zpomalení radiografické progrese. Účinnost anti-TNF-α léků v indikaci psoriatické artritidy je srovnatelná, na kožní projevy však má nejvýraznější vliv infliximab (následovaný adalimumabem a etanerceptem). U pacientů, kteří neodpovídají na anti-TNF-α léky, lze použít anti-IL-17 léky – účinnost u psoriatické artritidy byla v klinických studiích demonstrována u secukinumabu, ixekizumabu i brodalumabu (ten však zatím není schválen v indikaci PsA) či ustekinumabu. Apremilast je rovněž účinný při léčbě PsA, nicméně prevence radiologické progrese nebyla sledována. Účinnost inhibitorů IL-23 je v současné době předmětem zkoumání [1, 37, 48].
Cílená léčba u pacientek plánujících koncepci, těhotných a kojících
Informací o účincích biologické léčby u pacientek s psoriázou plánujících koncepci, těhotných či kojících není dostatek. Riziko fetálních abnormalit u žen s psoriázou, které otěhotní při biologické terapii, nelze kvantifikovat. Ženám ve fertilním věku, u nichž je zahajována biologická terapie, se doporučuje účinná antikoncepce nejen v průběhu léčby, ale i po jejím ukončení (po dobu 6 měsíců u infliximabu, 3 týdnů u etanerceptu, 5 měsíců u adalimumabu i certolizumabu, 15 týdnů u ustekinumabu, 20 týdnů u secukinumabu, 10 týdnů u ixekizumabu, 12 týdnů u brodalumabu, 12 týdnů u guselkumabu, 17 týdnů u tildrakizumabu a 20 týdnů u risankizumabu; u apremilastu je doporučena antikoncepce k zabránění otěhotnění po dobu léčby) [ 16, 18, 21, 33, 34, 43, 54, 59, 62, 65, 67, 69] – viz tabulka 13. Mezi antikoncepčními metodami a biologickými léky přitom nejsou známy žádné interakce [63].
Graviditu je vhodné plánovat dopředu, aby mohla být léčebná strategie těmto plánům přizpůsobena. Vlivem hormonálních změn dochází přibližně u 55 % pacientek ke zmírnění projevů psoriázy, zatímco asi u 23 % nemocných ke zhoršení, více relapsů se objevuje po porodu [50]. Studie reprodukční toxicity na zvířatech nenaznačují škodlivé účinky na těhotenství, embryofetální vývoj, porod ani postnatální vývoj, nicméně z preventivních důvodů se doporučuje biologickou léčbu v těhotenství přerušit. V konkrétních případech lze o jejím pokračování uvažovat – aplikace biologické léčby a její délka je na zvážení ošetřujícího lékaře podle závažnosti základního onemocnění. Aplikace biologické terapie v graviditě nutně nepředstavuje důvod k přerušení těhotenství.
Léky cílené na TNF-α, IL-12/23 a IL-17 jsou řazeny do kategorie B podle FDA (tj. studie na zvířatech nepotvrdily riziko, kontrolované studie na těhotných nebyly provedeny). Protilátky IgG procházejí placentou v 1. trimestru pouze v minimální koncentraci (rizika biologické léčby u pacientek v 1. trimestru gravidity se tedy zdají být poměrné nízká), ve 2. a 3. trimestru jsou však aktivně transportovány z matčina oběhu přes placentu do cirkulace plodu. Menší pravděpodobnost přestupu je u etanerceptu a především u certolizumabu, který neobsahuje Fc fragment (tato část molekuly je zodpovědná za přestup IgG protilátek do krevního oběhu plodu) [3]. Je-li tedy nutné podávat biologickou terapii těhotným pacientkám s psoriázou, nejvhodnějším lékem je certolizumab, poté etanercept. Ustekinumab a secukinumab jsou považovány za bezpečné, ale dostupné údaje jsou omezené. O ixekizumabu, brodalumabu, apremilastu a inhibitorech IL-23 jsou k dispozici pouze minimální údaje [36, 48].
U většiny biologických léků není známo, zda se vylučují do mateřského mléka (imunoglobuliny se do mateřského mléka obecně vylučují). Riziko pro kojence, jejichž matky jsou léčeny biologickými léky, je zřejmě nízké (omezený přestup léků do mateřského mléka, degradace v zažívacím traktu kojence), nelze jej však vyloučit. U většiny biologických léků i apremilastu je nutno rozhodnout, zda přerušit kojení nebo biologickou léčbu, na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku. Pacientky léčené infliximabem nesmějí kojit minimálně po dobu 6 měsíců po ukončení léčby, u ustekinumabu 15 týdnů, u secukinumabu 20 týdnů, u guselkumabu 12 týdnů. U ixekizumabu a brodalumabu není doba uvedena; doporučuje se zvážit prospěch kojení pro dítě a prospěch léčby pro ženu a rozhodnout, jestli ukončit kojení nebo přípravek vysadit. Podávání apremilastu se při kojení nedoporučuje. Adalimumab a certolizumab se vylučují do mateřského mléka ve velmi nízkých, resp. minimálních koncentracích, proto je lze při kojení podávat [16, 18, 21, 33, 34, 43, 54, 59, 62, 65, 67, 69].
Biologická léčba u dětí a mladistvých
Až třetina případů psoriázy se manifestuje v dětském věku; tito pacienti mají velmi často pozitivní rodinnou anamnézu psoriázy. Vyvolávajícími faktory psoriázy v dětství bývají infekce horních cest dýchacích, trauma či stres [3]. Vypuknutí psoriázy u malých i starších dětí a dospívajících má velmi významný negativní vliv na kvalitu života postižených, a pokud nezabírá topická léčba, měla by být i u těchto pacientů zvážena systémová léčba [28, 36].
Z biologických léků jsou pro terapii středně těžké až těžké ložiskové psoriázy u dětí a dospívajících schváleny adalimumab (hrazen je u dospívajících a dětí od 4 let), etanercept (hrazen u dospívajících a dětí od 6 let) a ustekinumab (schválen u dospívajících od 12 let). Podání adalimumabu u pediatrických pacientů (na rozdíl od etanerceptu) není podmíněno selháním konvenční systémové terapie, ale pouze selháním lokální léčby a fototerapie [64].
Cílená léčba u seniorů
Vzhledem k nárůstu seniorské populace a k chronické povaze psoriázy představuje léčba tohoto onemocnění u starších pacientů významný medicínský problém. Starší pacienti často trpí různými dalšími nemocemi, např. kardiovaskulárními chorobami. Dochází u nich k poklesu výkonnosti imunitního systému (tzv. imunosenescence), která u nich může přispívat ke zvýšenému riziku vzniku neoplazií nebo infekčních onemocnění a k oslabení odpovědi na očkování. Senioři jsou rovněž méně často zařazováni do klinických studií. Z těchto příčin se dermatologové často obávají podat starším pacientům systémově aplikované léky vzhledem k možným bezpečnostním rizikům a omezují se pouze na topickou léčbu, která je často nedostatečná. Nicméně bylo zjištěno, že účinnost i bezpečnost (frekvence a typ nežádoucích účinků) biologických léků a apremilastu jsou u starších pacientů podobné jako u mladších nemocných [60, 68]. Seniorům tedy může být předepsána jakákoli léčba schválená pro dospělé pacienty, důležitý je však řádný vstupní screening, pečlivé průběžné sledování a zvýšená opatrnost v průběhu léčby [41].
BIOSIMILÁRNÍ LÉKY
Biosimilární léčiva jsou definována jako biologické léčivé přípravky (BLP), které jsou podobné již schváleným biologickým lékům, tzv. referenčním léčivým přípravkům. Podobně jako generika jsou biosimilární léčiva uváděna na trh po vypršení patentové ochrany originálních BLP. Na rozdíl od generik, která mají jednodušší chemickou stavbu a lze je považovat za identická se svým referenčním léčivým přípravkem, se však biosimilární léky vyznačují komplexní, velmi složitou strukturou, a nemohou být zcela identické s originálními BLP. Také schvalování biosimilárních léků se významně liší od schvalování generik. U biosimilárních přípravků je prokazována mj. klinická ekvivalence, tedy to, že kvalita, bezpečnost a účinnost daného preparátu je podobná jako u originálního BLP. Pokud jsou u daného léku tyto vlastnosti prokázány, může být schválen k použití ve stejných indikacích jako originální BLP, přičemž nemusí být provedeny klinické studie u pacientů u všech onemocnění (tzv. extrapolace dat v rámci indikací) [28].
K léčbě psoriázy byly do současné doby schváleny biosimilární anti-TNF-α léky: infliximab (Flixabi, Inflectra, Remsima, Zessly), etanercept (Benepali) a adalimumab (Amgevita, Hulio, Hyrimoz, Imraldi). V budoucnu lze očekávat registraci biosimilárního ustekinumabu a později i léků z řad anti-IL-17 a anti-IL-23. Postoj dermatologů k využití biosimilárních léků zůstává spíše rezervovaný. Formulován byl v Konsensu lékařů center biologické léčby oboru dermatovenerologie, dokument lze nalézt na internetových stránkách ČDS [42].
ZÁVĚR
Od publikace předchozích Doporučení k biologické léčbě závažné chronické ložiskové psoriázy v roce 2012 bylo registrováno několik dalších biologických léků. Tyto moderní, vysoce účinné léky umožňují dosáhnout výrazného zmírnění až vymizení projevů psoriázy, dlouhodobé remise a významného zlepšení kvality života pacientů. Na základě nových poznatků se ukazuje, že účinná systémová léčba závažné psoriázy má být zahájena co nejdříve, a to nejen kvůli rychlému ústupu kožních změn a zlepšení kvality života nemocného, ale též za účelem prevence rozvoje přidružených onemocnění vznikajících v důsledku nekontrolovaného systémového zánětu.
Do redakce došlo dne 24. 6. 2019.
Adresa pro korespondenci:
prof. MUDr. Petra Cetkovská, Ph.D.
Dermatovenerologická klinika LF UK a FN
Dr. E. Beneše 13
305 99 Plzeň
e-mail: cetkovska@fnplzen.cz
Zdroje
1. AMATORE, F., VILLANI, A. P., TABUER, M. et al. Psoriasis Research Group of the French Society of Dermatology (Groupe de Recherche sur le Psoriasis de la Société Française de Dermatologie). French guidelines on the use of systemic treatments for moderate-to-severe psoriasis in adults. J Eur Acad Dermatol Venereol, 2019 Feb 22. [Epub ahead of print].
2. AMIN, M., DARJI, K., NO, D. J. et al. Review of IL-17 inhibitors for psoriasis. J Dermatolog Treat, 2017 Nov 10 [Epub ahead of print].
3. AMIN, M., NO, D. J., EGEBERG, A. et al. Choosing First-Line Biologic Treatment for Moderate-to-Severe Psoriasis: What Does the Evidence Say? Am J Clin Dermatol, 2018, 19, p. 1–13.
4. ARMSTRONG, A. W., HARSKAMP, C. T, ARMSTRONG, E. J. The association between psoriasis and obesity: a systematic review and meta-analysis of observational studies. Nutr Diabetes, 2012, 3, p. 2:e54.
5. ARMSTRONG, A. W., ROBERTSON, A. D., WU, J. et al. Undertreatment, treatment trends, and treatment dissatisfaction among patients with psoriasis and psoriatic arthritis in the United States: findings from the National Psoriasis Foundation surveys, 2003-2011. JAMA Dermatol, 2013, 149, p. 1180–1185.
6. BISSONNETTE, R., PARISER, D. M., WASEL, N. R. et al. Apremilast, an oral phosphodiesterase-4 inhibitor, in the treatment of palmoplantar psoriasis: Results of a pooled analysis from phase II PSOR-005 and phase III Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis (ESTEEM) clinical trials in patients with moderate to severe psoriasis. J Am Acad Dermatol, 2016, 75, p. 99–105.
7. BLAUVELT, A., PAPP, K. A., GRIFFITHS, C. E. et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the continuous treatment of patients with moderate to severe psoriasis: Results from the phase III, double-blinded, placebo - and active comparator-controlled VOYAGE 1 trial. J Am Acad Dermatol, 2017, 76, p. 405–417.
8. BOEHNCKE, W. H., BOEHNCKE, S. More than skin-deep: the many dimensions of the psoriatic disease. Swiss Med Wkly, 2014, 144, p. 139–168.
9. BOEHNCKE, W. H., BREMBILLA, N. C. Unmet Needs in the Field of Psoriasis: Pathogenesis and Treatment. Clin Rev Allergy Immunol, 2018, 55, p. 295–311.
10. BONIFATI, C., LORA, V., GRACEFFA, D. et al. Management of psoriasis patients with hepatitis B or hepatitis C virus infection. World J Gastroenterol, 2016, 22, p. 6444–6455.
11. BREMBILLA, N. C., SENRA, L., BOEHNCKE, W. H. The IL-17 Family of Cytokines in Psoriasis: IL-17A and Beyond. Front Immunol, 2018, 9, p. 1682.
12. BRUZZESE, V., De FRANCESCO, V., HASSAN, C. New onset or worsening of psoriasis following biologic therapy: A case series. Int J Immunopathol Pharmacol, 2017, 30, p. 70–72.
13. CAI, Y., FLEMING, C., YAN, J. et al. New insights of T cells in the pathogenesis of psoriasis. Cell Mol Immunol, 2012, 9, p. 302–309.
14. CETKOVSKÁ, P., KOJANOVÁ, M. Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy. Čes-slov Derm, 2012, 87, p. 1–22.
15. CETKOVSKÁ, P., KOJANOVÁ, M., ARENBERGER, P. et al. Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy. Čes-slov Derm, 2017, 92, p. 3–17.
16. Cimzia. https://www.ema.europa.eu/en/medicines/human/EPAR/cimzia-0#product-information-section. Poslední aktualizace 9. 4. 2019, dostupné 22. 4. 2019.
17. COHEN, B. E., MARTIRES, K. J., HO, R. S. Psoriasis and the Risk of Depression in the US Population: National Health and Nutrition Examination Survey 2009-2012. JAMA Dermatol, 2016, 152, p. 73–79.
18. Cosentyx. https://www.ema.europa.eu/en/medicines/human/EPAR/cosentyx#product-information-section. Poslední aktualizace 25. 10. 2018, dostupné 22. 4. 2019.
19. DAUDEN, E., GRIFFITHS, C. E., ORTONNE, J. P. et al. Improvements in patient-reported outcomes in moderate-to-severe psoriasis patients receiving continuous or paused etanercept treatment over 54 weeks: the CRYSTEL study. J Eur Acad Dermatol Venereol, 2009, 23, p. 1374–1382.
20. ELMETS, C. A., LEONARDI, C. L., DAVIS, D. M. R. et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with awareness and attention to comorbidities. J Am Acad Dermatol, 2019, 80, p. 1073–1113.
21. Enbrel. https://www.ema.europa.eu/en/medicines/human/EPAR/enbrel#product-information-section. Aktualizace 5. 3. 2019, dostupné 22. 4. 2019.
22. FINLAY, A. Y. Current severe psoriasis and the rule of tens. Br J Dermatol, 2005, 152, p. 861–867.
23. FOLEY, P., GORDON, K., GRIFFITHS, C. E. M. et al. Efficacy of Guselkumab Compared With Adalimumab and Placebo for Psoriasis in Specific Body Regions: A Secondary Analysis of 2 Randomized Clinical Trials. JAMA Dermatol, 2018, 154, p. 676–683.
24. FOTIADOU, C., LAZARIDOU, E., SOTIRIOU, E. et al. Targeting IL-23 in psoriasis: current perspectives. Psoriasis (Auckl), 2018, p. 1–5.
25. GAFFEN, S. L., JAIN, R., GARG, A. V. et al. The IL-23-IL-17 immune axis: from mechanisms to therapeutic testing. Nat Rev Immunol, 2014, 14, p. 585–600.
26. GARCIA-DOVAL, I., COHEN, A. D., CAZZANIGA, S. et al. Risk of serious infections, cutaneous bacterial infections, and granulomatous infections in patients with psoriasis treated with anti-tumor necrosis factor agents versus classic therapies: Prospective meta-analysis of Psonet registries. J Am Acad Dermatol, 2017, 76, p. 299–308.
27. GIROLOMONI, G., STROHAL, R., PUIG, L. et al. The role of IL-23 and the IL-23/T<sub>H</sub> 17 immune axis in the pathogenesis and treatment of psoriasis. J Eur Acad Dermatol Venereol, 2017, 31, p. 1616–1626.
28. GISONDI, P., ALTOMARE, G., AYALA, F. et al. Italian guidelines on the systemic treatments of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol, 2017, 31, p. 774–790.
29. GKALPAKIOTIS, S., ARENBERGEROVA, M., GKALPAKIOTI, P. et al. Impact of adalimumab treatment on cardiovascular risk biomarkers in psoriasis: Results of a pilot study. J Dermatol, 2017, 44, p. 363–369.
30. GORDON, K. B., STROBER, B., LEBWOHL, M. et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet, 2018, 392, p. 650–661.
31. GOTTLIEB, A., KORMAN, N. J., GORDON, K. B. et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 2. Psoriatic arthritis: overview and guidelines of care for treatment with an emphasis on the biologics. J Am Acad Dermatol, 2008, 58, p. 851–864.
32. HOMOLKA, J. Doporučení pro biologickou léčbu preparáty blokujícími učinek TNF alfa 2016. http://www.pneumologie.cz/guidelines/. Dostupné 22. 4. 2019.
33. Humira. https://www.ema.europa.eu/en/medicines/human/EPAR/humira#product-information-section. Poslední revize 18. 12. 2018, dostupné 22. 4. 2019.
34. Ilumetri. https://www.ema.europa.eu/en/medicines/human/EPAR/ilumetri#product-information-section. Poslední revize 16. 4. 2019, dostupné 22. 4. 2019.
35. KANE, D., STAFFORD, L., BRESNIHAN, B. et al. A prospective, clinical and radiological study of early psoriatic arthritis: an early synovitis clinic experience. Rheumatology, 2003, 12, p. 1460–1468.
36. KAUSHIK, S. B., LEBWOHL, M. G. Psoriasis: Which therapy for which patient: Focus on special populations and chronic infections. J Am Acad Dermatol, 2019, 80, p. 43–53.
37. KAUSHIK, S. B., LEBWOHL, M. G. Psoriasis: Which therapy for which patient: Psoriasis comorbidities and preferred systemic agents. J Am Acad Dermatol, 2019, 80, p. 27–40.
38. KOJANOVÁ, M., FIALOVÁ, J., CETKOVSKÁ, P. et al. Analýza pacientů se středně těžkou až těžkou psoriázou před zahájením biologické léčby v České republice – údaje z registru BIOREP 2005–2016. Čes-slov Derm, 2016, 91, p. 223–232.
39. KOJANOVA, M., FIALOVA, J., CETKOVSKA, P. et al. Characteristics and risk profile of psoriasis patients included in the Czech national registry BIOREP and a comparison with other registries. Int J Dermatol, 2017, 56, p. 428–434.
40. KOLIOS, A. G., FRENCH, L. E., NAVARINI, A. A. Detection of small changes in psoriasis intensity with Precise PASI. Dermatology, 2015, 230, p. 314–317.
41. KOLIOS, A. G., YAWALKAR, N., ANLIKER, M. et al. Swiss S1 Guidelines on the Systemic Treatment of Psoriasis Vulgaris. Dermatology, 2016, 232, p. 385–406.
42. Konsensus lékařů center biologické léčby oboru dermatovenerologie k problematice biosimilars. Dostupné na www: https://www.derm.cz/aktuality/dlouhodobe/
43. Kyntheum. https://www.ema.europa.eu/en/medicines/human/EPAR/kyntheum#product-information-section. Poslední aktualizace 6. 11. 2018, dostupné 22. 4. 2019.
44. LEBWOHL, M. G., BACHELEZ, H., BARKER, J. et al. Patient perspectives in the management of psoriasis: Results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis Survey. J Am Acad Dermatol, 2014, 70, p. 871–881.
45. LEE, H, Y., WOO, C. H., HAW, S. Paradoxical Flare of Psoriasis after Ustekinumab Therapy. Ann Dermatol, 2017, 29, p. 794–795.
46. MEASE, P. J., GLADMAN, D. D., PAPP, K. A. et al. Prevalence of rheumatologist-diagnosed psoriatic arthritis in patients with psoriasis in European/North American dermatology clinics. J Am Acad Dermatol, 2013, 69, p. 729–735.
47. MENTER, A., AUGUSTIN, M., SIGNOROVITCH, J. et al. The effect of adalimumab on reducing depression symptoms in patients with moderate to severe psoriasis: a randomized clinical trial. J Am Acad Dermatol, 2010, 62, p. 812–818.
48. MENTER, A., STROBER, B. E., KAPLAN, D. H. et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol, 2019 Feb 13. [Epub ahead of print].
49. MROWIETZ, U., KRAGBALLE, K., REICH, K. et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res, 2011, 303, p. 1–10.
50. MURASE, J. E., CHAN, K. K., GARITE, T. J. et al. Hormonal effect on psoriasis in pregnancy and post partum. Arch Dermatol, 2005, 141, p. 601–606.
51. NAST, A., GISONDI, P., ORMEROD, A. D. et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris – Update 2015 – Short version – EDF in cooperation with EADV and IPC. J Eur Acad Dermatol Venereol, 2015, 29, p. 2277–2294.
52. NGUYEN, C. M., LEON, A., DANESH, M. et al. Improvement of Nail and Scalp Psoriasis Using Apremilast in Patients With Chronic Psoriasis: Phase 2b and 3, 52-Week Randomized, Placebo-Controlled Trial Results. J Drugs Dermatol, 2016, 15, p. 272–276.
53. O‘GARRA, A., REDFORD, P. S., McNAB, F. W. et al. The immune response in tuberculosis. Annu Rev Immunol, 2013, 31, p. 475–527.
54. Otezla. https://www.ema.europa.eu/en/medicines/human/EPAR/otezla#product-information-section. Poslední aktualizace 24. 4. 2019, dostupné 24. 4. 2019.
55. PAPP, K. A., LEBWOHL, M. G. Onset of Action of Biologics in Patients With Moderate-to-Severe Psoriasis. J Drugs Dermatol, 2017, 17, p. 247–500.
56. PAVELKA, K., VENCOVSKÝ, J., ŠENOLT, L. a spol. Farmakoterapie revmatických onemocnění. Praha: Maxdorf, 2017, p. 79.
57. REICH, K., ARMSTRONG, A. W., FOLEY, P. et al. Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo - and active comparator-controlled VOYAGE 2 trial. J Am Acad Dermatol, 2017, 76, p. 418–431.
58. REICH, K., PAPP, K. A., BLAUVELT, A. et al. Tildrakizumab versus placebo or etanercept for chronic plaque psoriasis (reSURFACE 1 and reSURFACE 2): results from two randomised controlled, phase 3 trials. Lancet, 2017, 390, p. 276–288.
59. Remicade. https://www.ema.europa.eu/en/medicines/human/EPAR/remicade#product-information-section. Poslední aktualizace 21. 3. 2019, dostupné 22. 4. 2019.
60. RICCERI, F., BARDAZZI, F., CHIRICOZZI, A. et al. Elderly psoriatic patients under biological therapies: an Italian experience. J Eur Acad Dermatol Venereol, 2018 Jun 15. [Epub ahead of print].
61. SAWYER, L., FOTHERINGHAM, I., WRIGHT, E. et al. The comparative efficacy of brodalumab in patients with moderate-to-severe psoriasis: a systematic literature review and network meta-analysis. J Dermatolog Treat, 2018 Jan 29 [Epub ahead of print].
62. Skyrizi. http://ec.europa.eu/health/documents/community-register/2019/20190426144462/anx_144462_cs.pdf. Dostupné 18. 6. 2019.
63. SMITH, C. H., JABBAR-LOPEZ, Z. K., YIU, Z. Z. et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2017. Br J Dermatol, 2017, 177, p. 628–636.
64. Státní úřad pro kontrolu léčiv Česká republika. http://www.sukl.cz/modules/medication/search.php. Dostupné 14. 5. 2019 (pozn. citace: název léku a oddíl ceny a úhrady v detailu léku).
65. Stelara. https://www.ema.europa.eu/en/medicines/human/EPAR/stelara#product-information-section. Poslední aktualizace 5. 9. 2019, dostupné 17. 9. 2019.
66. STROBER, B., GOODERHAM, M., DE JONG, E. M. G. J. et al. Depressive symptoms, depression, and the effect of biologic therapy among patients in Psoriasis Longitudinal Assessment and Registry. J Am Acad Dermatol, 2018, 78, p. 70–80.
67. Taltz. https://www.ema.europa.eu/en/medicines/human/EPAR/taltz#product-information-section. Poslední aktualizace 3. 8. 2018, dostupné 22. 4. 2019.
68. TORRES, T., PUIG, L. Apremilast: A Novel Oral Treatment for Psoriasis and Psoriatic Arthritis. Am J Clin Dermatol, 2018, 19, p. 23–32.
69. Tremfya. https://www.ema.europa.eu/en/medicines/human/EPAR/tremfya#product-information-section. Poslední aktualizace 23. 10. 2018, dostupné 22. 4. 2019.
70. VAŠÁKOVÁ, M. Doporučený postup diagnostiky a léčby latentní tuberkulózní infekce, 2015. http://www.pneumologie.cz/guidelines/. Dostupné 22. 4. 2019.
71. VENCOVSKÝ, J. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol, 2009, 17, p. 146–160.
72. WHO Guidelines on the management of latent tuberculosis infection 2015. http://apps.who.int/medicinedocs/documents/s21682en/s21682en.pdf. Dostupné 22. 4. 2019.
73. WILSON, F. C., ICEN, M., CROWSON, C. S. et al. Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study. Arthritis Rheum, 2009, 61, p. 233–239.
74. WU, J. J., FELDMAN, S. R., KOO, J. et al. Epidemiology of mental health comorbidity in psoriasis. J Dermatolog Treat, 2018, 29, p. 487–495.
75. WU, J. J., SUNDARAM, M., CLOUTIER, M. et al. The risk of cardiovascular events in psoriasis patients treated with tumor necrosis factor-α inhibitors versus phototherapy: An observational cohort study. J Am Acad Dermatol, 2018, 79, p. 60–68.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2019 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
-
Všechny články tohoto čísla
- Současný stav moderní léčby psoriázy – aktualizovaná doporučení ČDS JEP k cílené léčbě závažné chronické psoriázy
- KONTROLNÍ TEST
- Velkouzlová (nodulární) sarkoidóza. Popis případu
- Klinický případ: Krvácející nodulus na zádech. Stručný přehled
- Kolizní nádory – diagnosticky obtížné situace. Série případů
- Fotoprotekce
-
Zápis ze schůze výboru ČDS Praha
6. 6. 2019 - 19. výroční meeting Evropské společnosti dětské dermatologie (ESPD) Dubrovník 2.–4. 5. 2019
- COSMETIC INJECTION TECHNIQUES
- Odborné akce 2019
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný stav moderní léčby psoriázy – aktualizovaná doporučení ČDS JEP k cílené léčbě závažné chronické psoriázy
- Fotoprotekce
- Velkouzlová (nodulární) sarkoidóza. Popis případu
- Klinický případ: Krvácející nodulus na zádech. Stručný přehled
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




