-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinický případ: Retikulární purpura plosek
Autoři: Š. Hrňa 1; J. Štork 1; O. Kodet 1,2
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN , přednosta prof. MUDr. Jiří Štork, CSc. 1; Anatomický ústav 1. LF UK, přednosta prof. MUDr. Karel Smetana, DrSc. 2
Vyšlo v časopise: Čes-slov Derm, 91, 2016, No. 4, p. 170-172
Kategorie: Repetitorium
Pacientkou byla 53letá žena dlouhodobě léčená pro arteriální hypertenzi kombinací losartanu a hydrochlorothiazidu bez jiných pozoruhodností v osobní či rodinné anamnéze.
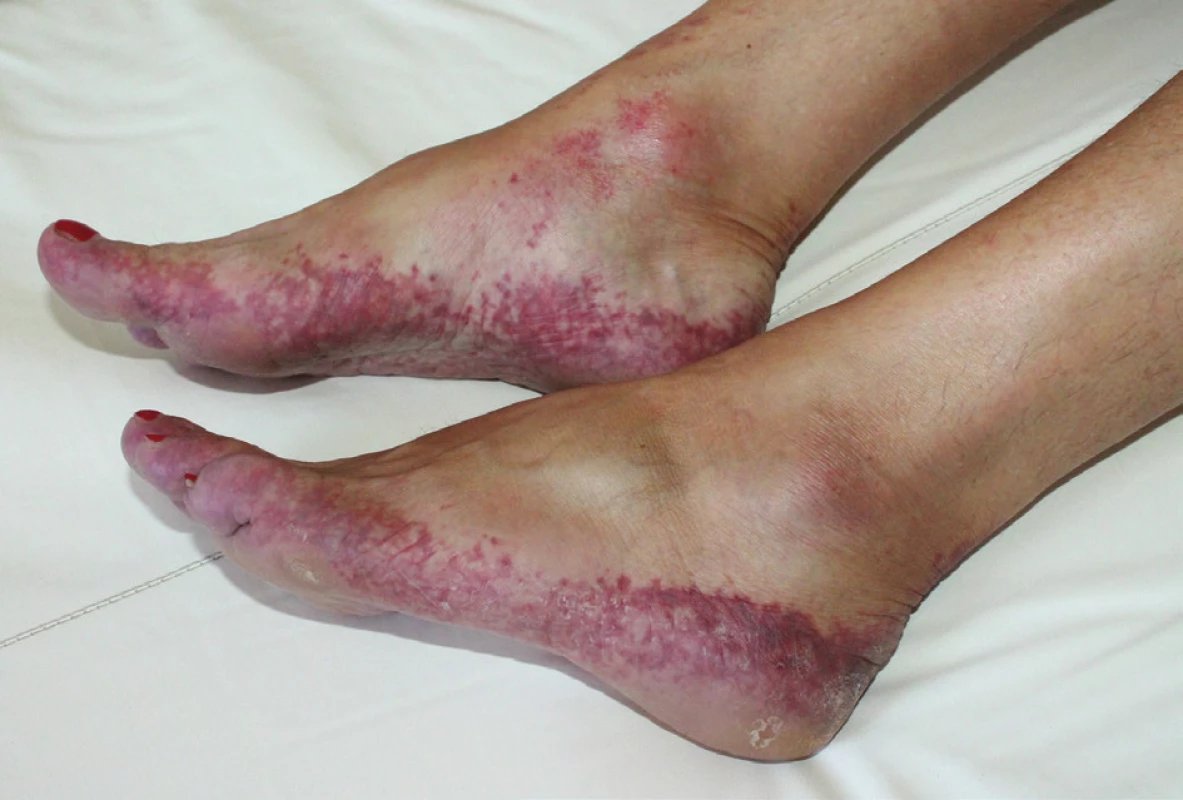
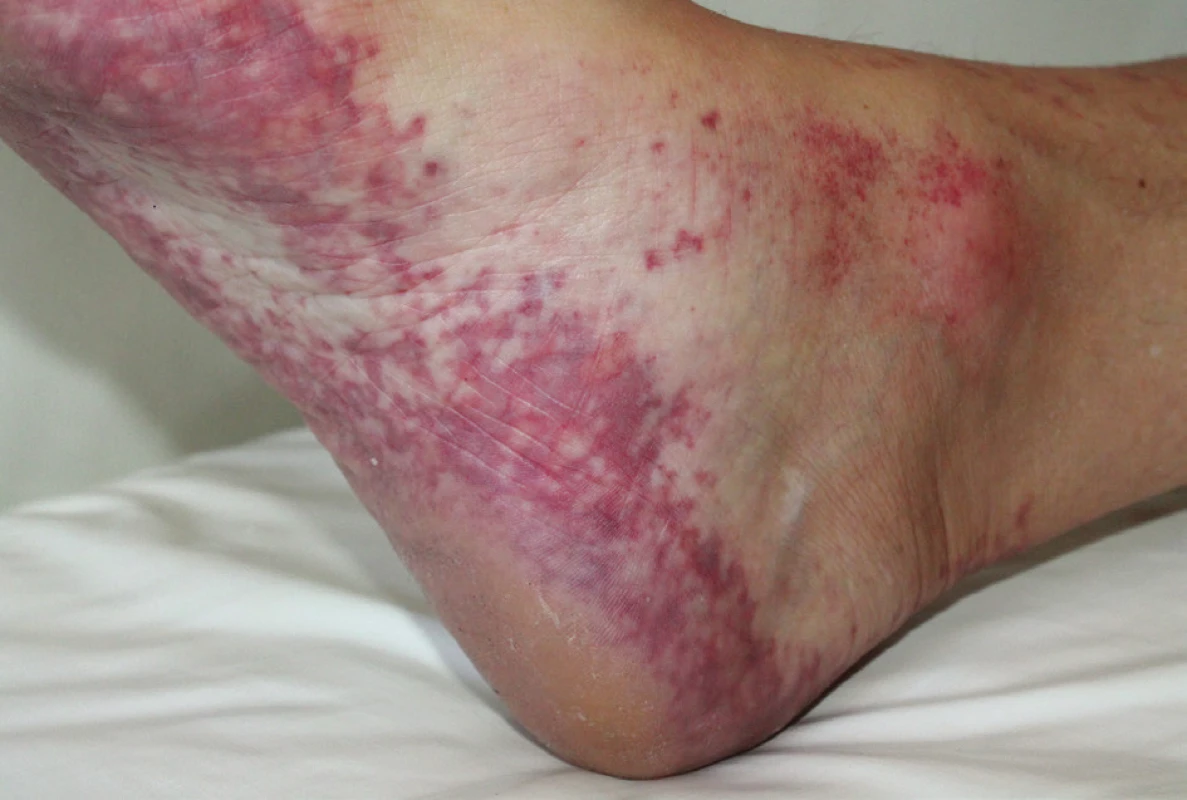
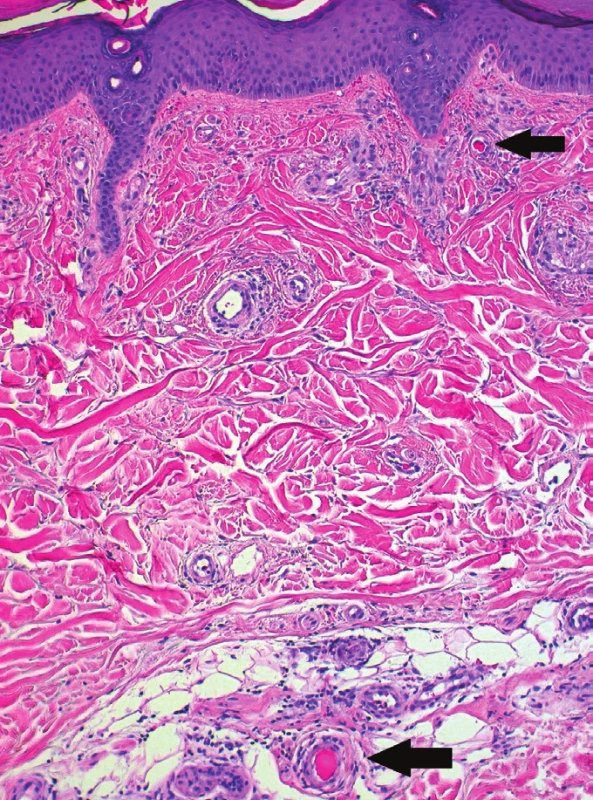
K vyšetření byla odeslána revmatologem pro asi měsíc trvající bolestivost a otoky drobných kloubů rukou a nohou několik dní provázené vznikem bezpříznakových projevů na ploskách. Autoprotilátky antinukleární, anti-ENA a ANCA byly negativní, v imunoelektroforéze bílkovin séra byl přítomen imunoglobulin IgG kappa. Objektivní vyšetření prokázalo retikulárně uspořádanou nepalpovatelnou purpuru chodidel s přesahem na jejich postranní partie, nárt a oblast hlezen s vynecháním středu plosek (obr. 1, 2) s nevýrazným postižením též oblasti kolen a hran dlaní. Byla provedena biopsie z projevu na hraně pravé paty k histologickému vyšetření (obr. 3, 4) a k vyšetření přímou imunofluorescencí.
HISTOPATOLOGICKÉ VYŠETŘENÍ
Epidermis byla beze změn. V koriu i podkoží byly v okolí cév patrny ojedinělé mononukleáry s ojedinělými neutrofily a erytrocytárními extravazáty. Průsvit některých zastižených cév byl vyplněný homogenní eozinofilní hmotou. Vyšetření přímou imunofluorescencí bylo negativní.
Nález podporuje diagnózu obliterující vaskulopatie.
Závěr
Obliterující vaskulopatie při gamapatii IgG kappa.
PRŮBĚH
Při kontrolním vyšetření došlo k progresi kožního nálezu. Na ploskách projevy purpury splývaly v plochy tmavě červené až lividní barvy a zvýraznilo se postižení dlaní. Scintigrafické vyšetření skeletu prokázalo osteolytická ložiska lbi, imunoelektroforéza moči monoklonální volné řetězce kappa a v séru byl přítomen kryoglobulin I. typu – IgG kappa. Biopsie kostní dřeně potvrdila diagnózu mnohočetného myelomu s monoklonální gamapatií IgG kappa. Hematoonkologická pulzní intravenózní léčba dexametazonem a bortezomibem vedla k postupnému zlepšení kožních projevů. Na další kontrolu se již nedostavila.
DISKUSE
Obliterující vaskulopatie jsou chorobné stavy primárně způsobené obliterací lumen cév s případnými druhotnými zánětlivými změnami vedoucí k ischémii příslušného okrsku tkáně v povodí postižené cévy. Vaskulopatie mohou být primární (např. maligní atrofická papulóza), neznámé etiologie, či sekundární, průvodním projevem jiného onemocnění.
Obliterace cév může být způsobena různými stavy, jako jsou poruchy trombocytů (např. heparinové nekrózy, trombotická trombocytopenická purpura), embolizace (např. krystaly cholesterolu a oxalátu, emboly při infekční endokarditidě, iatrogenní), systémové koagulopatie (např. antifosfolipidový syndrom, diseminovaná intravaskulární koagulopatie, purpura fulminans, kumarinové nekrózy) nebo vaskulární koagulopatie (např. livedoidní vaskulopatie, maligní atrofická papulóza), infekční (např. oportunními houbami), přítomností chladových aglutininů aj. [5, 13, 15].
Kryoglobulinémie jsou stavy provázené tvorbou sérových imunoglobulinů typu IgM nebo IgG, které při snížené teplotě reverzibilně gelifikují, a vedou tak k obliterující vaskulopatii (typ I) či imunokomplexové leukocytoklastické vaskulitidě (typ II, III). Nejčastěji jsou sekundárním projevem hepatitidy C, HIV infekce a lymfoproliferativních onemocnění, vzácněji hepatitidy B, EBV infekce a infekce CMV. Asi u 20–30 % případů se nepodaří zjistit vyvolávající příčinu, poté se kryoglobulinémie označuje jako esenciální. Kryoglobulinémie typu I je charakterizována produkcí monoklonálního imunoglobulinu IgM, méně pak IgG, které v chladu tvoří intravaskulární precipitáty a jsou příčinou obliterující vaskulopatie [9]. Nejčastěji doprovází mnohočetný myelom, Waldenströmovu makroglobulinémii a chronickou lymfatickou leukémii [12]. Smíšená kryoglobulinémie typu II je představována tvorbou imunoglobulinů polyklonálního charakteru ve směsi s imunoglobulinem monoklonálním, především IgM, méně IgG, vzácně IgA. Smíšená kryoglobulinémie typu III je způsobena přítomností polyklonálních imunoglobulinů IgM a/nebo IgG. Imunoglobuliny u smíšených kryoglobulinémií typu II a III mohou vykazovat autoprotilátkovou aktivitu (mohou se vázat na Fc nebo Fab fragmenty autologních imunoglobulinů) a ukládat se v podobě imunokomplexů v cévní stěně, které vedou k histologickému nálezu leukocytoklastické vaskulitidy. Smíšené kryglobulinémie se nachází nejčastěji při hepatitidě C, HIV infekci a u lymfoproliferativních onemocnění a často jsou zcela asymptomatické [12, 14].
V popsaném případě se jednalo o obliterující vaskulopatii při kryoglobulinémii typu I. V klinickém obraze této monoklonální kryoglobulinémie je vedle typické purpury a tvorby ulcerací i akrocyanóza, tvorba Raynaudova fenoménu, livedo racemosa (s projevy vzhledu „potrhané sítě“), teleangiektázie a projevy livedo reticularis [6, 11, 12]. Smíšená kryoglobulinémie s vaskulitidou se projevuje palpovatelnou purpurou, erytematózními papulami a podkožními noduly, lze pozorovat také chronické ulcerace a nekrózy. Postižení je zpravidla oboustranné, může být však lokalizováno jen na část postižené končetiny [12, 15]. Rozvoj kryoglobulinémie mohou doprovázet celkové nespecifické příznaky, únava, zvýšená tělesná teplota, bolesti svalů a kloubů. Může se jednat o postižení drobných cév kloubů (artritidy až v 70 %), nervů (senzitivní neuropatie, 40 %), ledvin (membranoproliferativní glomerulonefritidy, 20 %), bývá přítomna i hepatitida (30 %) [12].
V laboratorním vyšetření kryoglobulinémie je průkazná imunoelektroforéza bílkovin séra a moči na přítomnost paraproteinů a cílené vyšetření kryoglobulinů v séru (nutné dodržet preanalytickou fázy vyšetření, odběr má být proveden předehřátou jehlou do vyhřáté zkumavky, vzorek se zpracovává v temperované centrifuze) [6, 10]. Při vyšetřování jiných vaskulopatií se zaměřujeme především na faktory ovlivňující krevní srážlivost, vyšetření fibrinogenu, antitrombinu III, proteinu C a S, dále pak hladiny vitaminu B6, B12 a kyseliny listové. Lze doplnit i vyšetření antinukleárních a antikardiolipinových protilátek. Z koagulačních faktorů pak faktor V, případně doplnění genetického vyšetření Leidenské mutace [2, 5].
Vedle klinického obrazu může být diagnosticky nápomocna kožní biopsie. Histopatologicky je u monoklonální kryoglobulinémie postižení patrné v cévách horního koria, které jsou vyplněny homogenním, eozinofilním a PAS pozitivním materiálem. V okolí cév vedle perivaskulárních lymfocytárních infiltrátů s ojedinělými neutrofily nacházíme i erytrocytární extravazáty bez přítomné leukocytoklastické vaskulitidy [9]. U smíšené kryoglobulinémie jsou naopak známky leukocytoklastické vaskulitidy typické, která při tvorbě kožních ulcerací může postihovat cévy až středního kalibru. Je patrna i hyalinní degenerace cév horního až středního koria s depozity imunoglobulinů, které lze prokázat i přímou imunofluorescencí [14].
V terapii kryoglobulinémie je základní léčba primárního onemocnění, hepatitidy C (interferon alfa, ribavirin) nebo cílená onkologická terapie hematologické malignity. Při hyperviskózním syndromu a hrozícím orgánovém postižení přichází v úvahu i plazmaferéza. Jako indukční terapie se při mnohočetném myelomu podává pulzní intravenózní aplikace bortezomibu (inhibitor proteazomu), dexametazonu a cyklofosfamidu. Při progresi se používá lenalidomid (derivát thalidomidu, imunomodulátor) [16].
V případě vaskulopatií s trombotickým uzávěrem se v terapii obecně využívá antikoagulační terapie, např. deriváty dikumarolu (INR 2–3) nebo nízkomolekulární heparin v dávce 1 mg/kg v subkutánní aplikaci 1krát denně [1, 2, 3]. Nověji se do terapie vaskulopatií zavádějí antikoagulační preparáty ze skupiny inhibitorů faktoru Xa – xabany (rivaroxaban) s příznivým efektem i u pacientů bez zjištěných koagulačních poruch [4]. Dobrý efekt byl popsán u pulzů intravenózních imunoglobulinů [8]. U pacientů s projevy vaskulopatie při systémovém lupus erytematosus mohou být účinná antimalarika.
Významnou roli hrají i režimová opatření, kompresivní punčochy, vyvarování se vystavení výrazných teplotních změn a lokální aplikace emoliencií ke zlepšení prokrvení končetin.
Prognóza pacientů se odvíjí podle charakteru vyvolávajícího patologického stavu a včasného zahájení terapie. Kožní projevy mohou být chronické s obdobím recidiv a protrahovaným hojením kožních ulcerací [6].
Do redakce došlo dne 19. 7. 2016.
Adresa pro korespondenci:
MUDr. Ondřej Kodet, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 499/2
128 00 Praha 2
e-mail: ondrej.kodet@vfn.cz
Zdroje
1. BROWNING, C. E., CALLEN, J. P. Warfarin therapy for livedoid vasculopathy associated with cryofibrinogenemia and hyperhomocysteinemia. Arch Dermatol., 2006, 142, p. 75–78.
2. DI GIACOMO, T. B., HUSSEIN, T. P., SOUZA, D. G., et al. Frequency of thrombophilia determinant factors in patients with livedoid vasculopathy and treatment with anticoagulant drugs – a prospective study. J. Eur. Acad. Dermatol. Venereol., 2010, 24, p. 1340–1346.
3. HAIRSTON, B. R., DAVIS, M. D., GIBSON, L. E. et al. Treatment of livedoid vasculopathy with low-molecular-weight heparin: report of 2 cases. Arch. Dermatol., 2003, 139, p. 987–990.
4. KERK, N., DRABIK, A., LUGER, T. A. et al. Rivaroxaban prevents painful cutaneous infarctions in livedoid vasculopathy. Br. J. Dermatol., 2013,168, p. 898–899.
5. KERK, N., GOERGE, T. Livedoid vasculopathy - current aspects of diagnosis and treatment of cutaneous infarction. J. Dtsch. Dermatol. Ges., 2013, 11, p. 407–410.
6. KOJANOVÁ, M., LACINA, L., BÄUMELTOVÁ, I. et al. Klinický případ: Recidivující ulcerace bérců. Čes-slov. Derm., 2008, 83, s. 265–267.
7. KOVAČEVIČOVÁ, M., ŠVESTKOVÁ, S. Retikulární exantémy – patofyziologie, etiopatogeneze, klasifikace. Čes-slov. Derm., 2012, 87, s. 211–219.
8. KREUER, A., GAMBICHER, T., BREUCKMANN, F. et al. Pulsed intravenous immunoglobulin therapy in livedoid vasculitis: an open trial evaluating 9 consecutive patients. J. Am. Acad. Dermatol., 2004, 51, p. 574–579.
9. LIU, P. Y., PRETE, P. E., KUKES, G. Leukocytoclastic vasculitis in a patient with type 1 cryoglobulinemia. Case Rep. Rheumatol., 2011, 124940.
10. MOTYCKOVA, G., MURALI, M. Laboratory testing for cryoglobulins. Am. J. Hematol., 2011, 86, p. 500–502.
11. REQUENA, L., KUTZNER, H., ANGULO, J. et al. Generalized livedo reticularis associated with monoclonal cryoglobulinemia and multiple myeloma. J. Cutan. Pathol., 2007, 34, p. 198–202.
12. RETAMOZO, S., BRITO-ZERON, P., BOSCH, X. et al. Cryoglobulinemic disease. Oncology, 2013, 27, p. 1098–1105.
13. SHANKAR, S., VASUDEVAN, B., DED, P. et al. Livedoid vasculopathy: A vasculitic mimic. Arthritis Rheum., 2013, 65, p. 791.
14. TERRIER, B., CACOUB, P. Cryoglobulinemia vasculitis: an update. Curr. Opin. Rheumatol., 2013, 25, p. 10–18.
15. THOMPSON, A. K., PETERS, M. S., EL-AZHARY, R. A. et al. Cutaneous microemboli from hydrophilic polymer after endovascular procedures. J. Am. Acad. Dermatol., 2015, 73, p. 666–671.
16. VINCENT, RAJKUMAR, S. Multiple myeloma: 2014 Update on diagnosis, risk-stratification, and management. Am. J. Hematol., 2014, 89, p. 999–1009.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2016 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Co s NSTI? NPWT!
- Isoprinosine nově bez indikačních a preskripčních omezení
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
-
Všechny články tohoto čísla
- Porokeratózy
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Granuloma anulare v lokalizaci zhojeného herpes zoster: Wolfova izotopická reakce
- Klinický případ: Retikulární purpura plosek
- Dermatoskopie nepigmentovaných kožních nádorů. Kožní karcinomy a aktinické keratózy
- Muskuloskeletální ultrasonografie u pacientů s psoriázou a psoriatickou artritidou
- Zápis ze schůze výboru ČDS konané dne 26. května 2016 v Praze
- Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti dňa 11. 12. 2015 v PLK Smrdáky
- Zpráva o 74. výročním mítinku Americké akademie dermatologie (AAD), Washington, 3.–8. 3. 2016
- Setkání Center biologické léčby psoriázy
- Odborné akce v roce 2016
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Porokeratózy
- Dermatoskopie nepigmentovaných kožních nádorů. Kožní karcinomy a aktinické keratózy
- Klinický případ: Retikulární purpura plosek
- Granuloma anulare v lokalizaci zhojeného herpes zoster: Wolfova izotopická reakce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání