-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Závažná reakce typu generalizovaného bulózního fixního lékového exantému po nimesulidu – popis případu
Nimesulid-induced Severe Adverse Reaction of Generalized Bullous Fixed Drug Eruption Type – Case Report
The authors describe a case of generalized bullous fixed drug eruption after the systemic use of nimesulide successfully treated by an intravenous immunoglobulin. They discuss differential diagnoses particularly Stevens-Johnson syndrome and toxic epidermal necrolysis and provide an overview of current knowledge on the pathogenesis and treatment of this reaction.
Key words:
generalized bullous fixed drug eruption – toxic epidermal necrolysis – Stevens-Johnson syndrome – intravenous immunoglobulin – apoptosis – severe adverse drug reactions
Autoři: E. Březinová 1; V. Thon 2
; S. Zgažarová 1; E. Štrnálová 1; V. Vašků 1; L. Střelec 3; R. Sís 3; H. Jedličková 1
Působiště autorů: I. dermatovenerologická klinika, FN u sv. Anny a LF MU, Brno přednosta prof. MUDr. Vladimír Vašků, CSc. 1; Ústav klinické imunologie a alergologie, FN u sv. Anny a LF MU, Brno přednosta prof. MUDr. Jiří Litzman, CSc. 2; Oddělení psychiatricko-neurologické, Psychiatrická nemocnice Brno primář MUDr. Ivo Černý 3
Vyšlo v časopise: Čes-slov Derm, 89, 2014, No. 5, p. 225-229
Kategorie: Kazuistika
Souhrn
Autoři popisují případ generalizovaného bulózního fixního lékového exantému po perorálním užití nimesulidu léčeného celkově kortikosteroidy a intravenózními imunoglobuliny s dobrým účinkem. V práci je pojednána diferenciální diagnóza onemocnění, zejména ve vztahu ke Stevensovu-Johnsonovu syndromu a toxické epidermální nekrolýze, a je uveden přehled současných poznatků o patogenezi a léčbě této reakce.
Klíčová slova:
generalizovaný bulózní fixní lékový exantém – toxická epidermální nekrolýza – Stevensův-Johnsonův syndrom – intravenózní imunoglobuliny – apoptóza – závažné nežádoucí účinky léčivÚVOD
Fixní lékový exantém je jedním z typů kožních polékových reakcí. Je charakterizovaný vznikem jednoho či více anulárních nebo oválných erytematózních ložisek, která jsou důsledkem systémově aplikované látky [33, 38]. Tato ložiska zanechávají po zhojení obvykle hyperpigmentace. Po opakované expozici léčivu se reakce objevuje na stejných místech a mohou vznikat i ložiska nová, průběh onemocnění se tedy po opakované expozici dané látce může zhoršovat. Na základě klinických znaků a distribuci morf byla popsána řada variant fixního lékového exantému, např. fixní lékový exantém pigmentující, generalizovaný či mnohočetný, lineární, stěhovavý, nepigmentující, bulózní, ekzémový, urtikarielní, napodobující erythema dyschromicum migrans, působící vulvitidu, stomatitidu, napodobující celulitidu. Fixní lékové exantémy patří mezi vzácnější reakce, představují méně než 5 % všech kožních nežádoucích účinků léčiv. Klinický průběh onemocnění je většinou benigní, vzácně ale může mít až charakter toxické epidermální nekrolýzy. K nejčastějším komplikacím patří pozánětlivé pigmentace a infekce [42, 47].
Vzhledem k méně častému výskytu prezentujeme případ pacientky s generalizovaným bulózním exantémem charakteru generalizovaného bulózního fixního lékového exantému.
POPIS PŘÍPADU
V listopadu roku 2011 jsme přijali na I. DVK v Brně 85letou pacientku. Rodinná anamnéza byla nevýznamná. Pacientka se léčila s ischemickou chorobou srdeční, hypertenzí, demencí, vertebrogenním algickým syndromem, osteoartritidou, hyperlipidémií, osteoporózou, močovou inkontinencí. V minulosti prodělala operaci žlučníku, hysterektomii s adnexektomií, apendektomii. Pravidelně užívala rivastigmin, tiaprid, nitrendipin, furosemid, spironolakton, dihydrokodein, vápník, vitamin D, minerály, probiotikum. Udávala alergii na nimesulid (Aulin®), pirenzepin (Gastrozepin®), perfloxacin (Abaktal®). Alergická reakce po nimesulidu byla v minulosti provázena kožními příznaky, blíže se je však nepodařilo zjistit. Dva měsíce po úrazu (sériové fraktuře žeber) byla hospitalizovaná na psychiatrii pro zhoršení demence. Na naši kliniku byla z psychiatrie přeložena pro týden trvající, stále progredující exantém. V době přijetí byl exantém generalizovaný, makulózní, z větší části splývající do ložisek a ploch, s bulami a erozemi, s pozitivním Nikolského fenoménem, bez multiformních projevů. Sliznice ve viditelném rozsahu postiženy nebyly. Výsevu exantému předcházelo podání jedné tablety Coxtralu® (účinná látka nimesulid). Jiné nové léky pacientka neužívala. Pacientce byla již v psychiatrické léčebně podávána pro exantém celkově antihistaminika a hydrocortison (500 mg denně, celkem 4 dny), lokálně byl aplikován kombinovaný přípravek kortikosteroidu a antibiotika.
Ve vstupních laboratorních vyšetřeních: krevní obraz v normě, neutrofilie 82,9 % s posunem doleva (bez leukocytózy), hraniční CRP (11,6 mg/l), základní biochemická vyšetření v normě. Z moči (odběr z močového katétru) vykultivována Providentia rettgeri > 100 tis. b./ml, ze stěru z buly vykultivován Staphylococcus aureus, ve výtěru z krku opakovaně kultivační nález kvasinek (Candida glabrata, Candida tropicalis). Celkové IgE 116,4 kIU/l. Klinicky jsme stav zhodnotili jako závažnou polékovou reakci. Rozsah postižení kůže byl odhadován na 20 % BSA, což by mohlo odpovídat překryvu Stevensova-Johnsonova syndromu/toxické epidermální nekrolýzy (obr. 1), SCORTEN odpovídající 2 bodům (predikovaná mortalita 12 %).
Obr. 1. Puchýře a eroze postihující cca 20 % tělesného povrchu 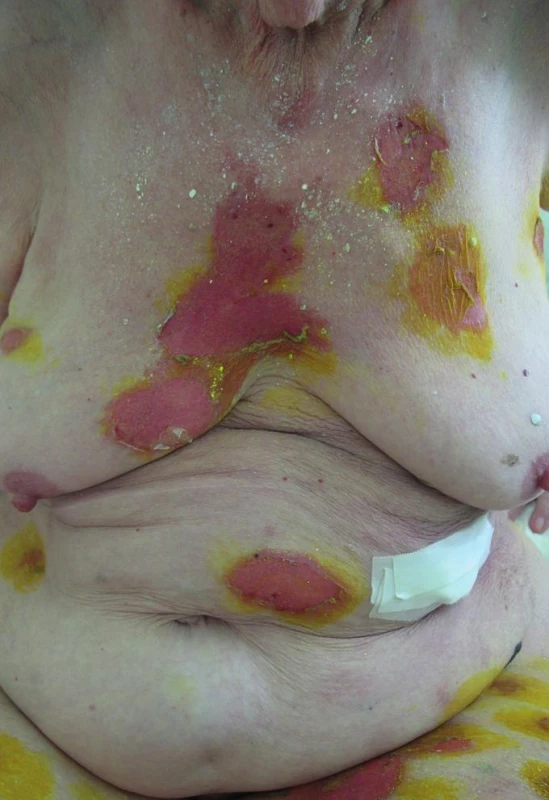
V době přijetí na naši kliniku se stále tvořily nové buly a eroze, proto bylo rozhodnuto o použití intravenózních imunoglobulinů (IVIG) (tj. 8. den rozvoje hypersenzitivní reakce). IVIG byly aplikovány v celkové dávce 0,45 g/kg během tří dnů (tj. 3 x 0,15 g/kg/den). Současně s IVIG byly podávány intravenózně kortikosteroidy, během tří dnů jsme podali 265 mg metylprednisolonu (max. 125 mg denně). Po kombinované terapii IVIG a kortikosteroidů se pokračovalo samostatně v terapii kortikosteroidy, které byly postupně vysazeny (do 14 dnů). Dále byl podáván nízkomolekulární heparin k prevenci hluboké žilní trombózy, antihistaminika, krystaloidy, H2 blokátor jako prevence vředové choroby gastroduodena, substituce kalia, probiotikum. Pro vzestup CRP (70,5 mg/l) byla pacientka přeléčena cefuroximem, pro kultivační nález kvasinek v krku byl doplněn flukonazol. Lokálně byly aplikovány na postiženou kůži kortikosteroidy IV. třídy, antibiotika, calcii pantothenas, dezinfekční oplachy, neadhezivní krytí Mepitel one®, Mepilex Ag®. Ošetřovatelský personál dodržoval aseptický přístup. Cílenou léčbu doplňovala léčba podpůrná, symptomatická a rehabilitace. Konzilium z oddělení ARO zhodnotilo pacientku jako stabilní z hlediska vitálních funkcí, tj. nevyžadující hospitalizaci na jednotce intenzivní péče.
Z okraje jednoho ložiska na břiše byla provedena probatorní excize (8. den rozvoje onemocnění, před podáním IVIG). Výsledek histologie: „Epidermis odtržena, část koria denudovaná, na části lpí vrstva cca dvou až tří řad keratinocytů, které jsou z větší části nekrotické. V adnexech epitel zachován, patrno štěpení intra i subepiteliální, bez akantolýzy. Pod epidermis četné melanofágy, řídce apoptotická tělíska. Zánětlivý infiltrát nevýrazný.“ K odlišení autoimunitních bulózních onemocnění bylo provedeno vyšetření přímou imunofluorescencí z tkáně z okraje ložiska s výsledkem nespecifického nálezu cytoidních tělísek (IgM +++) v junkční zóně. V nepřímé imunofluorescenci z krevního séra byly detekovány pouze protilátky proti ICS (intercelulární substance) v nízkém titru (1 : 10). Nález v souvislosti s klinickým obrazem umožňoval zvážit toxickou epidermální nekrolýzu, případně fixní lékový exantém. Hospitalizace na naší klinice trvala celkem 21 dnů. V době propuštění bylo přeepitelizováno 80 % projevů, k dohojení erozí se dobře osvědčily hydrofilní tylové polštářky s kyselinou hyaluronovou. Nejpomaleji se hojily eroze na hýždích a stehnech. Klinicky byla pacientka v dobrém stavu. Po týdnu od propuštění však došlo k závažné komplikaci. Pacientka byla operována pro ileus s nutností resekce gangrenózního úseku tenkého střeva, následně s rozvojem peritonitidy, klostridiové enterokolitidy, bronchopneumonie, s nutností podpory oběhu a ventilace za hospitalizace na ARO. Po třech měsících se subileózní stav opakoval. Kožní projevy byly zhojeny ad integrum po jednom měsíci léčby, celkově však trvala léčba následných komplikací téměř rok. Nyní je pacientka v dobrém stavu, žije sama v bytě.
DISKUSE
Klinický obraz a anamnéza pacientky svědčily pro generalizovaný bulózní fixní lékový exantém (GBFDE). Vzhledem k průběhu onemocnění a závažnosti stavu bylo nutno v diferenciální diagnostice pomýšlet zejména na překryvný syndrom SJS/TEN [3, 44].
Fixní lékový exantém (fixed drug eruption, FDE) je charakterizovaný dobře ohraničenými, okrouhlými či oválnými, červeno-fialovýni až hnědavými plaky, následně s tvorbou puchýřů. Ložiska u FDE mají typicky velikost do 5 cm, velmi často se objevují na rtu, genitálu a hýždích. Diseminované formy jsou vzácné a bulózní postižení zřídka přesahuje 10 % BSA [32, 34, 43]. Jsou také popsány případy generalizovaného bulózního FDE, existující i ve formě nepigmentujícího FDE („nonpigmenting FDE“), které klinicky nelze rozlišit od TEN a jsou považovány některými autory za abruptní formu TEN [36, 42]. Tento typ FDE má do 6 týdnů po vzniku reakce mortalitu asi 20%, především u starších nemocných nad 70 let věku [47]. Proti diagnóze SJS a TEN u naší pacientky svědčí nepřítomnost plošných erytémů a cárovitého odlučování epidermis, nebylo patrno postižení sliznic, které bývá u TEN v 90 % případů [18], nezaznamenali jsme ani údaj o prodromálních příznacích (zejména horečce), která závažné reakce typu SJS a TEN obvykle předchází a následně je doprovází.
FDE a TEN mohou být od sebe histologicky velmi obtížně odlišitelné. U FDE nacházíme typicky lichenoidní infiltrát s vakuolární degenerací epidermis a četnými intraepidermálními apoptotickými tělísky. Hustý lichenoidní infiltrát je u TEN popisován zřídka a je spojován s horší prognózou. Inkontinence pigmentu je typická pro fixní lékový exantém, ale nacházíme ji i ve starších projevech TEN [47].
Nimesulid, selektivní inhibitor cyklooxygenázy-2, byl popsán jako vyvolávající lék u FDE (nejčastěji na rtu), generalizovaného bulózního FDE i TEN [8, 41]. Typ první hypersenzitivní reakce na nimesulid u naší pacientky se nepodařilo zjistit. Rozsáhlé bulózní FDE se zpravidla objevují až při dalších atakách po užití léku, zatímco TEN se typicky rozvíjí již po první expozici léku [47].
V etiopatogenezi TEN se uplatňuje mechanismus opožděného typu kožních imunitních reakcí [1, 31]. Hlavní roli hraje aktivace cytotoxických T-lymfocytů a přirozených zabíječů (natural killer cells). Cytotoxické lymfocyty rozpoznají léčivo prezentované na HLA molekulách a dochází k jejich aktivaci [12]. K cytotoxickým signálům vedoucím k masivní apoptóze keratinocytů patří interakce receptoru Fas (FasR) s Fas ligandem (FasL), aktivace systému perforin/granzym B a cytolytický protein granulysin [12, 18]. Je zkoumán i vliv reaktivních kyslíkových radikálů, které vznikají v organismu při detoxikaci elektrofilních xenobiotik, tedy i léčiv [14].
U FDE se také předpokládá cytotoxická buněčná odpověď, zřejmě i vázaná na protilátky. Léčivo se váže jako hapten na keratinocyty a někdy také na melanocyty. Následně keratinocyty a mastocyty uvolňují cytokiny aktivující cytotoxické CD8+ lymfocyty. Aktivuje se i Fas-FasL dráha. Méně četné CD4+ lymfocyty hrají úlohu při hojení lézí. Specializované paměťové CD8+ lymfocyty jsou zřejmě zodpovědné za místní recidivy FDE [11, 25]. U TEN a FDE jsou některé mechanismy vedoucí k apoptóze keratinocytů podobné.
Diferenciálně diagnosticky bylo nutno vzhledem ke klinickému obrazu myslet i na další onemocnění, zejména autoimunitní puchýřnaté choroby jako bulózní pemfigoid či epidermolysis bullosa acquisita, eventuálně na stafylokokový syndrom opařené kůže (staphylococcal scalded skin syndrome, SSSS) [18, 20, 24, 34, 46]. Autoimunitní bulózní onemocnění a SSSS byly vyloučeny histologickým, imunofluorescenčním vyšetřením a dalším průběhem onemocnění [5, 6, 17, 23]. Ve vyšetření nepřímou imunofluorescencí byly nalezeny protilátky proti intercelulární substanci v nespecifickém, nízkém titru. Je zajímavé, že u TEN byly popsány cirkulující autoprotilátky proti desmoplakinu I a periplakinu, které se považují za epifenomén [21, 37] a mohly by korespondovat s tímto nálezem. Kultivační nález zlatého stafylokoka ve stěru z buly by ukazoval na možnost SSSS. Toto onemocnění se však u dospělých vyskytuje vzácně a bývá spojeno s imunosupresí a selháním ledvin [35]; má také jiný histologický obraz. Bulózní projevy u SSSS vznikají poškozením desmosomálních proteinů ve stratum granulosum exfoliativními toxiny zlatého stafylokoka a ne indukcí apoptózy v oblasti dermo-epidermální junkce, jak je tomu u TEN či FDE [26, 28]. U naší pacientky odpovídal nález odloučení nekrotické epidermis v celé tloušťce a minimální zánětlivý infiltrát s řídkými apoptotickými tělísky subepidermálně a v epitelu adnex spíše změnám u TEN než u FDE. Biopsie byla ale odebrána až po týdnu trvání exantému, lze předpokládat, že histologický obraz byl modifikován sekundárními změnami.
Zásadním krokem v terapii všech lékových reakcí je vysazení vyvolávajícího léčiva. Základem je vždy léčba symptomatická a podpůrná, včetně snahy o zachování sterilního prostředí [7, 10]. U případů rozsáhlých forem GBFDE je doporučován obdobný přístup jako u SJS a TEN [30]. Ohledně specifické terapie závažných polékových reakcí však dosud není stanoveno jednoznačné doporučení. Z imunomodulační léčby se nejčastěji diskutuje o léčbě glukokortikosteroidy a intravenózními imunoglobuliny (IVIG). IVIG obsahují protilátky proti receptoru Fas (CD95), tyto protilátky mohou mít jak agonistické, tak antagonistické působení. Výsledný efekt určitého preparátu IVIG tedy závisí do určité míry na poměru těchto protilátek [9, 40]. Dosud není zcela známo, jak velký je klinický význam různé anti-Fas aktivity preparátů IVIG v léčbě závažných polékových reakcí. Léčebný efekt IVIG totiž nespočívá pouze v inhibici Fas mediované signalizační dráhy apoptózy keratinocytů, ale také v imunomodulační aktivitě imunoglobulinů, v protiinfekčním působení a náhradě ztracených tekutin a proteinů. Výsledný efekt závisí také na individuální regulaci cytokinového prostředí, T-regulačních lymfocytů (T reg), stavu aktivace buňky, závažnosti a fázi onemocnění [19].
Podle Evropského dermatologického fóra by měla být léčba IVIG v případě TEN zahájena co nejdříve, doporučovány jsou vysoké dávky, celkově 3 g/kg aplikované v bolusech během tří až pěti dnů (tj. cca 1 g/kg/den). Multicentrická retrospektivní analýza ukázala, že k významným prognostickým faktorům náleží včasnost podání IVIG, jejich celková dávka a přítomnost komorbidit u pacienta. Ideální je doba podání IVIG v prvních 72 hodinách po vzniku reakce, zdá se však, že i pozdější podání má protektivní efekt na dosud nepostižené keratinocyty a zabraňuje tedy progresi onemocnění [39]. Léčba IVIG však není v této indikaci jednoznačně přijata, nebyl prokázaný její vliv na mortalitu [27].
U námi prezentované pacientky byla dávka IVIG 0,15 g/kg/den po dobu 3 dnů. IVIG byly podány až osmý den po začátku reakce. Onemocnění bylo v té době stále aktivní. Po aplikaci IVIG v kombinaci s metylprednisolonem došlo u pacientky velmi rychle k zástavě progrese onemocnění a její klinický stav se po třech týdnech léčby blížil normálu. Rovněž literatura popisuje použití i nižších dávek IVIG s léčebným efektem (od 0,2 do 0,75 g/kg/den po dobu 4 dnů) [45], než je v současnosti doporučováno (tj. 1 g/kg/den) [13, 14, 15, 16]. Recentní publikace uvádí i úspěchy s kombinovanou terapií IVIG a prednisonu [13].
Ačkoliv se akutní závažný stav u naší pacientky podařilo zvládnout, následovaly další život ohrožující komplikace. Ty mohly představovat pozdní důsledek prodělané polékové reakce a její terapie, které znamenaly zásah do homeostatických mechanismů a vitálních funkcí u starší polymorbidní pacientky. Jak u kortikosteroidů, tak u IVIG jsou popisovány nežádoucí účinky léčby. U systémově aplikovaných kortikosteroidů je to zvýšené riziko infekcí, maskování septikémie, opožděná reepitelizace, prodloužená doba hospitalizace a vyšší mortalita [12, 29]. V případě IVIG je popisováno riziko hyperviskózních syndromů, aseptické meningitidy a anafylaktoidní reakce [15, 16, 22]. Vyšší věk sám o sobě zhoršuje prognózu onemocnění. U starších pacientů (nad 65 let) je jak vyšší riziko vzniku polékových nežádoucích reakcí, tak vyšší mortalita než u pacientů nižších věkových kategorií. Ve vyšším věku se může měnit metabolismus a vylučování léčiv z organismu. Stejná dávka léčiva tak může u starších vyvolat vyšší plasmatické koncentrace. Pacienti jsou vnímavější k nežádoucím reakcím, odpověď imunitního systému s věkem slábne [4].
ZÁVĚR
Závažné lékové reakce potencionálně ohrožují každého jedince užívajícího alespoň jeden léčivý přípravek. Na základě studií byla sice vytipována léčiva, u nichž je pravděpodobnost vyvolání závažných reakcí vyšší, ovšem preventivní stažení tzv. rizikových léčiv z trhu není z praktického hlediska možné, ba ani účelné. Nebezpečí tkví také v existenci řady léčivých přípravků označených různými firemními názvy obsahující stejnou účinnou látku. Vzhledem k vzácnosti případů se nelze opřít o větší zkušenosti s eventuálním přesahem GBFDE směrem k TEN, které mají obdobné klinické i histologické znaky. Opakovaná reakce a klinický obraz svědčí v našem případě pro nepigmentující formu GBFDE, který má při velkém rozsahu u starších pacientů také významnou mortalitu. Zvolený terapeutický postup vedl k zvládnutí závažné kožní reakce s odlučováním epidermis, nezabránil ale pozdním komplikacím, které dále ohrozily život pacientky.
Do redakce došlo dne 16. 7. 2014.
Adresa pro korespondenci:
MUDr. Eva Březinová
I. dermatovenerologická klinika FN u sv. Anny v Brně a LF MU
Pekařská 53
656 91 Brno
e-mail: brezinova.eva@post.cz
Zdroje
1. ALLANORE, L., ROUJEAU, J. C. Clinic and Pathogenesis of Severe Bullous Skin Reactions: Stevens-Johnson Syndrome, Toxic Epidermal Necrolysis. In Pichler, W. J.: Drug Hypersensitivity. Basel: Karger, 2007, p. 267–277.
2. ARAKI, Y., SOTOZONO, C., INATOMI, T. Successful treatment of Stevens-Johnson syndrome with steroid pulse therapy at disease onset. Am. Ophtalmol, 2009, 147, 6, p. 1004–1011.
3. BASTUJI-GARIN, S., RZANY, S., STERN, R. S. Clinical classiffication of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch. Dermatol., 1993, 129, p. 92–96.
4. BASTUJI-GARIN, S., ZAHEDI, M., GUILLAUME, J. C., ROUJEAU, J. C. Toxic Epidermal Necrolysis (Lyell Syndrome) in 77 Elderly Patients. Age and Ageing, 1993, 22, p. 450–456.
5. BRENNER, S., BIALY-GOLAN, A., RUOCCO, V. Drug - -induced pemphigus. Clin. Dermatol., 1998, 16, p. 393–397.
6. BRENNER, S., GOLDBERG, I. Drug-induced pemphigus. Clin. Dermatol., 2011, 29, 4, p. 455–457. doi: 10.1016/j.clindermatol.2011.01.016.
7. CHANG, Y. S., HUANG, F. CH., TSENG, S. H. et al. Erythema Multiforme, Stevens-Johnson Syndrome, and Toxic Epidermal Necrolysis: Acute Ocular Manifestations, Causes, and Management. Cornea, 2007, 26, 2, p. 123–129.
8. CHATTERJEE, S., PAL, J., BISWAS, N. Nimesulide-induced hepatitis and toxic epidermal necrolysis. J. Postgrad. Med., 2008, 54, p. 150–151.
9. CHAVE, T. A., MORTIMER, N. J., SLADDEN, M. J., HALL, A. P., HUTCHINSON, P. E. Toxic epidermal necrolysis: current evidence, practical management and future directions. Br. J. Dermatol., 2005, 153, p. 241–253.
10. CHIE, S., MAYUMI, U., NORIKO, K. et al. Diagnosis and Treatment of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis With Ocular Complications: Management and Treatment. Ophthalmology, 2009, 116, 4, p. 685–690.
11. CHOI, H. J., KU, J. K., KIM, M. Y. et al. Possible role of Fas/Fas ligand-mediated apoptosis in the pathogenesis of fixed drug eruption. Br. J. Dermatol., 2006, 154, p. 419–425.
12. CHUNG, W., HUNG, S. Recent advances in the genetics and immunology of Stevens-Johnson syndrome and toxic epidermal necrosis. Journal of Dermatological Science, 2012, 66, p. 190–196.
13. COMPARIN, C., FILHO, G. H., TAKITA, L. C. et al. Treatment of toxic epidermal necrolysis with intravenous immunoglobulin: a series of three cases. An. Bras. Dermatol., 2012, 87, 3, p. 477–481.
14. DOWNEY, A., JACKSON, C. et al. Toxic epidermal necrolysis: review of pathogenesis and management. J. Am. Acad. Dermatol., 2012, 66, 6, p. 995–1003.
15. ENK, A., EUROPEAN DERMATOLOGY FORUM. Guidelines on the use of high-dose intravenous immunoglobulin in dermatology. Eur. J. Dermatol., 2009, 19, 1, p. 90–98. doi: 10.1684/ejd.2008.0580.
16. FAYE, O., ROUJEAU, J. C. Treatment of epidermal necrolysis with high-dose intravenous immunoglobulins (IVIG). Clinical experience to date. Drugs, 2005, 65, 15, p. 2085–2090.
17. FENG, S., ZHOU, W., ZHANG, J., JIN, P. Analysis of 6 cases of drug-induced pemphigus. Eur. J. Dermatol., 2011, 21, p. 696–699.
18. FRENCH, L. E. Toxic epidermal necrolysis and Stevens Johnson Syndrome: Our current understanding. Allergology International, 2006, 55, 1, p. 9–16.
19. GUNTEN, S., SIMON, H. U. Cell Death Modulation by Intravenous Immunoglobulin. J. Clin. Immunol., 2010, 30, 1, p. 24–30.
20. HAŠKOVÁ, M. Akutní generalizovaná exantematózní pustulóza (AGEP) potvrzená in vivo plátenkovými a prick testy. Čes.-slov. Derm., 1999, 74, 6, s. 260–261.
21. HINTERHUBER, G., BINDER, M., MARQUARD, Y. et al. Enzyme-linked immunosorbent assay for detection of peptide-specific human antidesmoplakin autoantibodies. Br. J. Dermatol., 2005, 153, p. 413–416.
22. HORN, J., THON, V., BARTONKOVA, D. et al. Anti-IgA antibodies in common variable immunodeficiency (CVID): diagnostic workup and therapeutic strategy. Clin. Immunol., 2007, 122, 2, p. 156–162.
23. JEDLIČKOVÁ, H. Imunofluorescenční vyšetření v dermatologii. Čes.-slov. Derm., 2011, 86, 4, p. 175–184.
24. JEDLIČKOVÁ, H., ZGAŽAROVÁ, S. Polékové exantémy. Dermatol. praxi, 2008, 2, 3, p. 126–129.
25. KORKIJ, W., SOLTANI, K. Fixed drug eruption. A brief review. Arch. Dermatol., 1984, 120, p. 520–524.
26. LAMAND, V., DAUWALDER, O., TRISTAN, A., CASALEGNO, J. S. Epidemiological data of staphylococcal scalded skin syndrome in France from 1997 to 2007 and microbiological characteristicks of Staphylococcus aureus associated strains. Clin. Microbiol. Infect, 2012, 18, E514-521, doi: 10.1111/1469-0691.12053.
27. LIPOVÝ, B., BRYCHTA, P., CHALOUPKOVÁ, Z., SUCHÁNEK, I. Staphylococcal scalded skin syndrome in the Czech Republic: an epidemiological study. Burns, 2012, 38, p. 296–300.
28. LEE, H. Y., LIM, Y. L., THIRUMOORTHY, T., PANG, S. M. The role of intravenous immunoglobulin in toxic epidermal necrolysis: a retrospective analysis of 64 patients managed in a specialized centre. Br. J. Dermatol., 2013, 169, p. 1304–1309.
29. LIPOVÝ, B., ŘIHOVÁ, H. et al. Toxická epidermální nekrolýza: přehled možností terapie. Hojení ran, 2011, 5, 4, s. 6–12.
30. LIPOWICZ, S., SEKULA, P., INGEN-HOUSZ-ORO, S., SASSOLAS, B., DUNANT, A., ROUJEAU, J. C., MOCKENHAUPT, M. Prognosis of generalized bullous fixed drug eruption: comparison with Stevens-Johnson syndrome and toxic epidermal necrolysis. Br. J. Dermatol., 2013, 168, 4, p. 726–732.
31. LYELL, A. Toxic epidermal necrolysis: an eruption resembling scalding of the skin. Br. J. Dermatol., 1956, 68, p. 355–361.
32. MALHEIRO, D., CADINHA, S., RODRIGUES, J., VAZ, M., CASTEL-BRANCO, M. G. Nimesulide-induced fixed drug eruption. Allergol Immunopathol, 2005, 33, 5, p. 285–287.
33. MOCKENHAUPT, M. Severe cutaneous drug reactions. In Burgdorf, W. H. C., Plewig, G., Wolff, H. H. Braun-Falco’s Dermatology (3rd Edition). Heidelberg: Springer Medizin Verlag, 2008, p. 473–483.
34. MOCKENHAUPT, M. The current understanding of Stevens-Johnson syndrome and epidermal necrolysis. Expert Rev. Clin. Immunol., 2011, 7, 6, p. 803–815.
35. MOCKENHAUPT, M., IDZKO, M., GROSBER, M. et al. Epidemiology of staphylococcal scalded skin syndrome in Germany. J. Invest. Dermatol., 2005, 124, p. 700–703.
36. OZKAYA-BAYAZIT, E., BAYAZIT, H., OZARMAGAN, G. Drug related clinical pattern in fixed drug eruption. Eur. J. Dermatol., 2000, 10, 4, p. 288–291.
37. PARK, G. T., QUAN, G., LEE, J. B. Sera from patients with toxic epidermal necrolysis contain autoantibodies to periplakin. Br. J. Dermatol., 2006, 155, p. 337–343.
38. PICHLER, J. W. Drug Hypersensitivity. In Rich, R. Clinical Immunology. Principles and Practice. Third Edition. China: Mosby Elsevier, 2009, p. 709–724.
39. PRINS, C., KERDEL, F. A., PADILLA, R. S. et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive cases. Arch. Dermatol., 2003, 139, 1, p. 26–32.
40. REIPERT, B. M., STELLAMOR, M. T. et al. Variation of anti-Fas antibodies in different lots of intravenous immunoglobulin. Vox sanguinis, 2008, 94, p. 334–341.
41. ROBARO CORDEIRO, M., GONCALO, M., FERNANDES, B. et al. Positive lesional patch tests in fixed drug eruptions from nimesulide. Contact Dermatitis, 2000, 453, p. 307.
42. SHIOHARA, T., MIZUKAWA, Y. A Fixed drug eruption: a disease mediated by self-inflicted responses of intraepidermal T cells. Eur. J. Dermatol., 2007, 17, 3, p. 201–208.
43. TOMKOVÁ, H. Fixní lékový exantém po moxastin teoklátu. Referátový výběr z dermatovenerologie, 2010, 52, 3, p. 76-77.
44. TOMKOVÁ, H., ŠTORK, J. Závažné lékové exantémy. Čes.-slov. derm., 2013, 88, 5, s. 203–212.
45. VIARD, I., WEHRLI, P., BULLANI, R. et al. Inhibition of Toxic Epidermal Necrolysis by Blockade of CD95 with Human Intravenous Immunoglobulin. Science, 1998, 282, p. 490–492.
46. VIKTORINOVÁ, M. Lékové exantémy po celkovém podání léků. Med. praxi, 2011, 8, 4, p. 181–185.
47. ZIEMER, M., MOCKENHAUPT, M. Severe Drug-Induced Skin Reactions: Clinical Pattern, Diagnostics and Therapy. In Khopkar, U. Skin Biopsy – Perspectives. Rijeka: InTech, 2011, p. 87-116. ISBN: 978-953-307-290-6, Available from: http://www.intechopen.com/books/skin-biopsy-perspectives/severe-drug-induced-skin-reactions-clinical-pattern-diagnostics-and-therapy.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2014 Číslo 5- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Co s NSTI? NPWT!
-
Všechny články tohoto čísla
- Struktura a funkce ekrinních potních žláz a možnosti ovlivnění produkce potu
- Doškolování lékařů - kontrolní test
- Závažná reakce typu generalizovaného bulózního fixního lékového exantému po nimesulidu – popis případu
- Pretibiální myxedém
- Cheyletiellóza – málo známá parazitóza
- Klinický případ: Bilaterální ulcerace bérců
-
Up-to-date Situation with Gonorrhoea:
Prague STI Center Results – Antimicrobial Susceptibility Monitoring - Zápis ze schůze Výboru ČDS
- Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti
- Odborné akce v roce 2014
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Struktura a funkce ekrinních potních žláz a možnosti ovlivnění produkce potu
- Pretibiální myxedém
- Cheyletiellóza – málo známá parazitóza
- Závažná reakce typu generalizovaného bulózního fixního lékového exantému po nimesulidu – popis případu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



