-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinem
The Follow-up of Patients with Severe Acne Vulgaris Treated with Systemic Isotretinoin
The aim of the follow-up was to evaluate safety of the treatment, the treatment possibilities in patients with other concomitant diseases and possibility of physical load in treated sportsmen. Following parameters were analyzed: sex and age, localization and type of acne, concomitant diseases, signs of depression and sport activities before treatment; all side effects including laboratory abnormalities, control of concomitant diseases, signs of depression and sport activities during the treatment. Finally, the therapeutic effect was evaluated. The total number of treated and followed patients was 100. Concomitant diseases and laboratory abnormalities before treament were present in 51 % of patients. Intensive sports activities were mentioned by 51 % of males and 10 % of females. Only mild side effects were observed during the treatment. In addition to previously known adverse effects, constipation and lower extremities cramps were newly recorded. No case of depression caused by isotretinoin was observed. Treatment results were excellent in 97 % of cases. The follow-up showed high efficacy and safety of isotretinoin. The treatment was successful also in patients with concomitant internal diseases and laboratory abnormalities. Adequate sports activities during therapy did not influenced the treatment efficacy and safety.
Key words:
acne – systemic isotretinoin – side effects
Autoři: Z. Nevoralová
Působiště autorů: Kožní oddělení, Nemocnice v Jihlavě, p. o., prim. MUDr. Štefan Dubáň
Vyšlo v časopise: Čes-slov Derm, 85, 2010, No. 4, p. 198-208
Kategorie: Klinické a laboratorní práce
Souhrn
Cílem sledování pacientů s těžkými formami akné léčených perorálním izotretinoinem bylo především posouzení bezpečnosti léčby, možnosti léčit i pacienty s jinými přidruženými chorobami a možnosti tělesné zátěže při léčbě u pacientů-sportovců. U nemocných jsme sledovali tato data: před léčbou pohlaví, věk, lokalizaci a závažnost akné, jiné choroby či laboratorní abnormality, depresi a sportovní aktivity, během léčby nežádoucí účinky včetně laboratorních změn, stabilizaci souběžných chorob, známky deprese a možnosti sportovních aktivit. Na závěr jsme vyhodnotili efekt léčby. Celkově jsme léčili a sledovali 100 pacientů. Jiné choroby a laboratorní abnormality před zahájením léčby byly přítomny u 51 % pacientů. Intenzivní sportovní aktivitu před zahájením sledování uvedlo 51 % mužů a 10 % žen. Během léčby se objevily jen nezávažné nežádoucí účinky. Kromě již dříve známých jsme nově zaznamenali zácpu a křeče dolních končetin. Depresi způsobenou izotretinoinem jsme nepozorovali. Výsledky terapie byly vynikající v 97 % případů. Sledování ukázalo vysokou účinnost a bezpečnost perorálního izotretinoinu. Léčba byla úspěšná i u pacientů s jinými chorobami a laboratorními abnormalitami. Přiměřené sportovní aktivity během terapie neměly vliv na bezpečnost a účinnost léčby.
Klíčová slova:
akné – perorální izotretinoin – nežádoucí účinkyÚVOD
Akné je chronická choroba, jejíž těžké formy často nereagují na konvenční léčbu.
Izotretinoin je jediný systémový lék, který postihuje všechny hlavní etiologické faktory akné, a má proto příznivý vliv i nejtěžší projevy této choroby. Dosud však existují obavy z nežádoucích účinků tohoto léku a z léčení pacientů, kteří jsou zároveň postiženi jiným onemocněním či pacientů věnujícím se sportovní činnosti. Cílem našeho sledování bylo zaznamenat řadu důležitých parametrů před i během léčby izotretinoinem, vyhodnotit je a srovnat s obdobnými sledováními ve světě. Pozornost jsme zaměřili zejména na bezpečnost léčby a na možnost léčit perorálním izotretinoinem pacienty s jinými přidruženými chorobami a laboratorními odchylkami a pacienty-sportovce. Jednalo se o první sledování tohoto typu v České republice.
Metody
Charakteristika izotretinoinu
Izotretinoin (chemicky 13-cis-retinová kyselina) patří do první nearomatické generace retinoidů. Je nejúčinnějším lékem v léčbě akné (42, 43). V mechanismu účinku dominuje přímý inhibiční vliv na mazovou žlázu a dozrávání sebocytů se specifickým působením na proliferující sebaceózní epitel. Předpokládá se, že izotretinoin způsobuje sebostázu zástavou buněčného cyklu sebocytů a jejich apoptózou (41) a také interferencí se sebocytárním metabolismem androgenů inhibicí oxidace 3-α hydroxysteroidů (35). Dále způsobuje snížení keratinizace ve folikulech (43). Díky ultrastrukturálním změnám korneocytů ve vývodech mazových žláz a uvolněním buněčné adheze dochází ke komedolytickému účinku. Redukce mikrobiální flóry je nepřímým důsledkem při potlačení tvorby mazu a eliminaci rohového materiálu v sebaceózních vývodech (34). Protizánětlivý účinek je dán schopností inhibovat chemotaxi neutrofilů a monocytů. Izotretinoin tak jako jediný působí na všechny čtyři hlavní etiopatogenetické faktory akné (7, 43).
Charakteristika souboru
Do sledování jsme zařadili 100 pacientů se závažnými formami akné. Výběr byl náhodný v pořadí, v jakém se dostavili k vyšetření. Podmínkou k zařazení do studie byla přítomnost těžké formy akné nereagující na předchozí terapii, dále věk nad 12 let, nepřítomnost obecně známých kontraindikací (alergie na složky přípravku, těžké jaterní choroby, dekompenzovaná deprese, hypervitaminóza A, výrazná hyperlipidémie, současná léčba tetracykliny, těhotenství a laktace) a spolupracující pacient. Před zahájením léčby jsme provedli podrobnou anamnézu (se zvážením eventuálních kontraindikací léčby) a objektivní vyšetření pacienta. Všichni pacienti (u mladistvých i jejich rodiče) byli podrobně poučeni o terapii a o možných nežádoucích účincích a byli požádáni o nahlášení všech závažných nežádoucích efektů léčby (včetně depresivních stavů) bez prodlení ošetřujícímu lékaři. Všichni podepsali informovaný souhlas s léčbou. U žen byla navíc dodržována všechna předepsaná opatření k prevenci gravidity. Sledování bylo prospektivní po dobu léčby perorálním izotretinoinem a následně jeden rok po ukončení terapie (následné sledování není předmětem tohoto článku). Vyšetřování probíhalo v době od května 2006 do prosince 2009 v Akné poradně kožního oddělení nemocnice v Jihlavě. Všichni pacienti sledování dokončili.
Pacienti užívali perorální izotretinoin (originální preparát Roaccutane® kapsle) v počáteční dávce 0,5 mg/kg/den. Denní dávka byla výjimečně snížena při větších nežádoucích účincích nebo naopak zvýšena až do dávky 0,7 mg/kg/den podle tolerance a efektu. Terapie trvala do dosažení kumulativní dávky 120 mg/kg u postižení obličeje a 150 mg/kg při postižení zad. Pacienti byli sledováni v intervalu jednoho měsíce po celou dobu léčby. Sledovali jsme tyto parametry: před léčbou pohlaví, věk, lokalizaci a závažnost akné, jiné choroby či laboratorní abnormality, depresi a sportovní aktivity, během léčby všechny nežádoucí účinky včetně laboratorních změn (viz dále), známky deprese, stabilizaci ostatních chorob a možnost sportovních aktivit. Na závěr jsme vyhodnotili efekt léčby.
Závažnost akné jsme určovali dle klasifikace Plewiga a Kligmana (43).
Z laboratorních hodnot jsme vyšetřovali sedimentaci erytrocytů (FW), krevní obraz a diferenciální rozpočet leukocytů (KO+diff), hladinu C-reaktivního proteinu (CRP), bilirubinu, alaninaminotransaminázy (ALT), γglutamyltransferázy (GMT), cholesterolu a jeho lehké a těžké frakce, triglyceridů, glykémie, kyseliny močové a kreatinfosfokinázy (CPK).
Eventuální stupeň deprese jsme zjišťovali vyplněním dotazníku BDI-II (Beckova sebeposuzovací škála deprese, verze 2), případné patologické nálezy jsme konzultovali s psychiatrem (problematika deprese bude podrobněji zmíněna v jiném sdělení).
Sportovní aktivity před léčbou byly hodnoceny jako pozitivní pouze při závodní nebo jiné velmi intenzivní a pravidelné sportovní činnosti (minimálně jedna hodina třikrát týdně). Během léčby byly povoleny tělesné aktivity podle námi vypracovaného schématu: výrazné zatížení jednoho nebo více velkých kloubů bylo povoleno v postupně narůstajících časových intervalech vždy o čtvrt hodiny po 3 dnech (tj. první 3 dny bez zatížení, 4.–6. den čtvrt hodiny, 7.–9. den půl hodiny, 10.–12. den tři čtvrtě hodiny, od 13. dne jedna hodina a dále stejným způsobem do maxima dvou hodin;, delší intenzivní aktivity nebyly povoleny). Schéma postupného zatěžování kloubů vychází z předpokladu, že k bolestem a výjimečně až k zánětům kloubů dochází z důvodů předpokládané exsikace kloubů, která ale může být i zcela minimální. Postupným zatěžováním kloubů si pacient otestuje svoji maximální tolerovanou zátěž. V případě bolestí kloubů jsme v navyšování zátěže kloubů do ústupu obtíží nepokračovali. Pacienti mohli užít paracetamol v tabletách, maximálně třikrát denně.
Efekt léčby jsme hodnotili následující škálou: zhojen (bez projevů akné), výrazně zlepšen (přítomnost do 5 zánětlivých morf na polovině obličeje nebo zad), zlepšen (přítomnost více než 5 zánětlivých morf na polovině obličeje nebo zad, ale méně než před zahájením léčby), nezlepšen (stav jako před zahájením léčby), zhoršen (počet zánětlivých morf vyšší než před zahájením léčby).
Výsledky
Z hlediska pohlaví 71 % pacientů tvořili muži, žen bylo 29 % . Věk pacientů byl v rozmezí 12 až 41 let, průměrný věk pro muže byl 17,6 roku, pro ženy 19,3 roku.
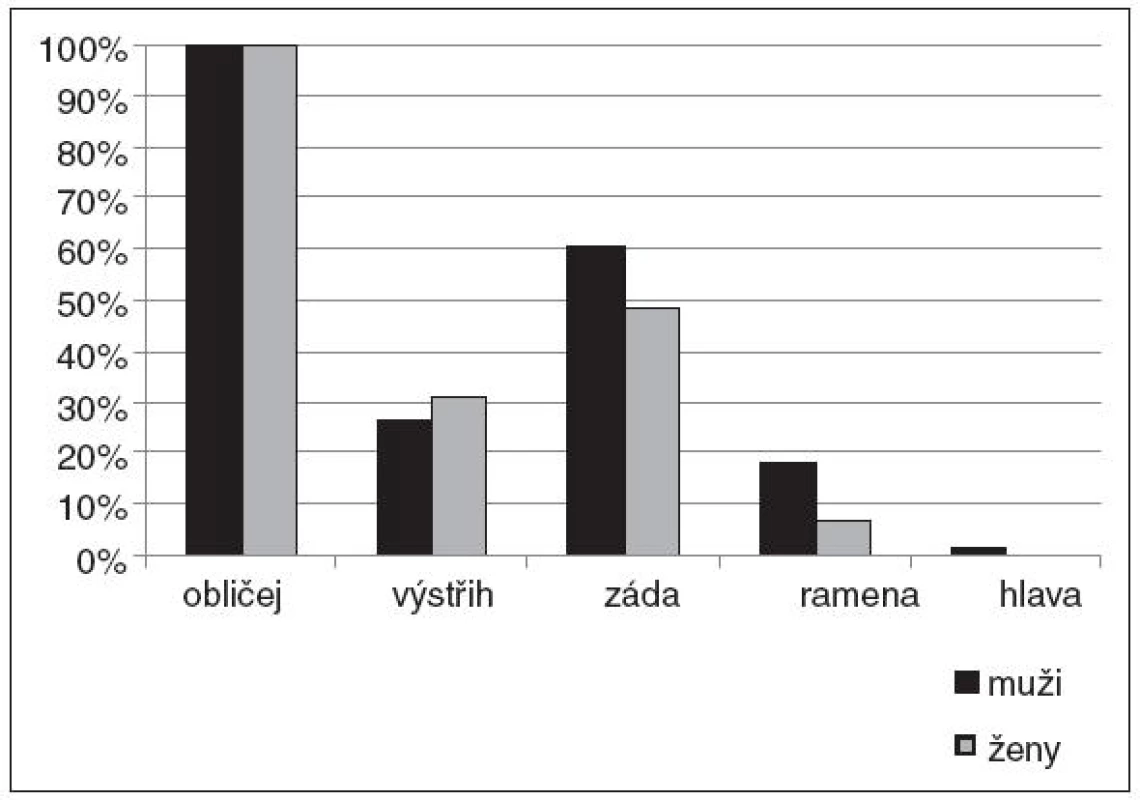
Lokalizace akné je znázorněna na obrázku 1.
Z hlediska tíže postižení pacientů trpělo 3 % sledovaných papulopustulózní akné III, 11 % papulopustulózní akné IV, 67 % nodulocystickou formou a 19 % konglobátní formou akné. U mužů převažovaly těžší formy akné – viz obr. 2a, u žen byla závažnost postižení lehce nižší – viz obr. 2b.
Obr. 2a. Závažnost akné – muži. 
Obr. 2b. Závažnost akné – ženy. 
Sledování před léčbou
Jiné choroby a laboratorní abnormality byly velmi časté, trpělo jimi 55 % pacientů (55 % mužů a 55 % žen). Dle četnosti se jednalo o následující stavy: hyperbilirubinémie u 23 % pacientů, hypercholesterolémie u 14 % pacientů, astma u 5 % pacientů, bolesti kloubů nebo zad u 5 % pacientů, lehká elevace transamináz u 3 % pacientů, hypertriglyceridémie u 2 % pacientů, celiakie u 2 % pacientů, diabetes mellitus I. typu u 1 % pacientů, morbus Crohn u 1 % pacientů, difuzní struma u 1 % pacientů, sekundární glaukom u 1 % pacientů, barvoslepost u 1 % pacientů, nosní polypy u 1 % pacientů. Podrobně jsou tyto diagnózy (včetně procentuálního zastoupení u mužů a žen) uvedeny v tabulce 1. Ostatními, z hlediska léčby perorálním izotretinoinem méně významnými chorobami, trpělo 19 % pacientů (25 % mužů a 3 % žen). Jednalo se o sennou rýmu, alergický zánět spojivek, atopický ekzém, osteochondrom kolene, poruchy růstu, srdeční šelest, obezitu, křečové žíly, lupénku a kopřivku. Někteří pacienti trpěli zároveň i několika chorobami nebo patologickými nálezy v laboratorních testech.
Tab. 1. Doprovodné choroby a laboratorní odchylky 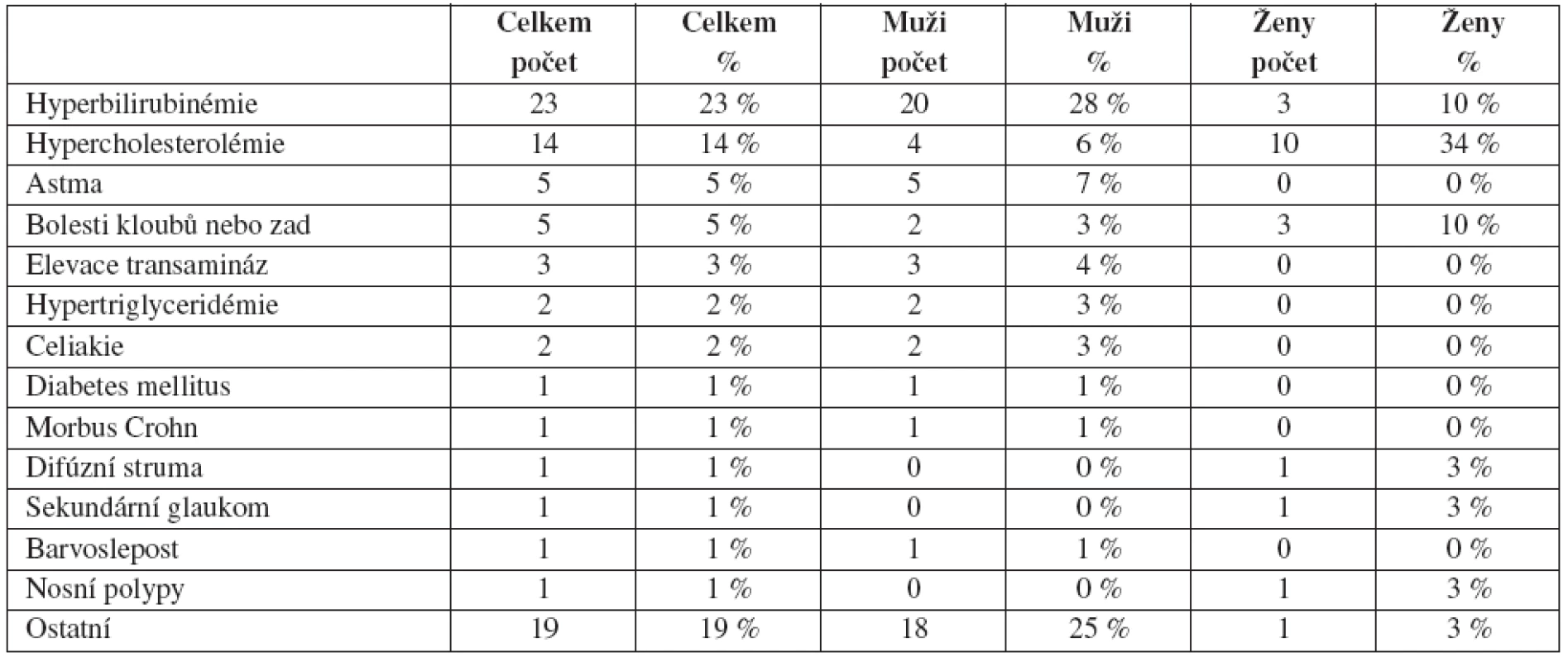
Před léčbou 6 % pacientů trpělo depresivními symptomy, 94 % pacientů bylo bez obtíží. Žádný depresivní stav nebyl považován za kontraindikaci k podání perorálního izotretinoinu.
Sportovní aktivity sledované skupiny byly velmi časté. Sportovalo 39 % nemocných – viz obr. 3 (51 % mužů a 10 % žen). Nejčastěji se pacienti věnovali fotbalu (16 % pacientů), hokejbalu (4 % pacientů), lednímu hokeji (3 % pacientů), florbalu (3 % pacientů) a posilování (3 % pacientů). Dalšími zaznamenanými sporty byly: kickbox, valetudo, rokenrol, závodní tanec, házená, volejbal, košíková, kulturistika, šerm, badminton, závodní hasičství, jízda na koni a cyklistika. Pět pacientů se intenzivně věnovalo zároveň dvěma sportům.
Obr. 2. Sportovní aktivity – celkem. 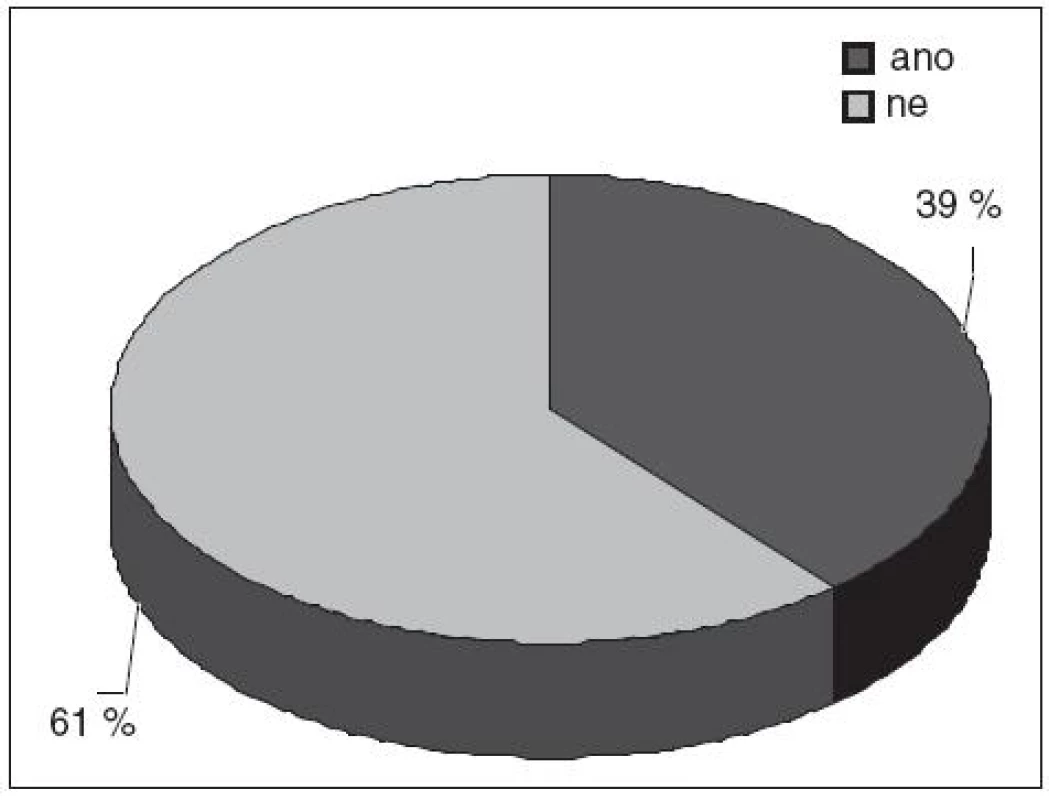
Sledování během léčby
Nežádoucí účinky jsou uvedeny v obr. 4. Suchost rtů jsme zaznamenali u 100 % pacientů, suchost kůže u 88 % pacientů (90 % mužů a 83 % žen), erytém kůže u 62 % pacientů (59 % mužů a 69 % žen), retinoidní dermatitidu u 43 % pacientů (39 % mužů a 52 % žen), suchost nosní sliznice u 39 % pacientů (39 % mužů a 38 % žen), krvácení z nosu u 32 % pacientů (38 % mužů a 17 % žen), suchost očí u 39 % pacientů (39 % mužů a 38 % žen), bolesti hlavy u 9 % pacientů (10 % mužů a 7 % žen), bolesti svalů u 4 % pacientů (3 % mužů a 7 % žen), bolesti kloubů u 17 % pacientů (21 % mužů a 7 % žen), bolesti zad u 10 % pacientů (7 % mužů a 17 % žen), únavu u 4 % pacientů (3 % mužů a 7 % žen), vypadávání vlasů u 3 % pacientů (0 % mužů a 10 % žen) a křehkost nehtů u 3 % pacientů (0 % mužů a 10 % žen). V jednotlivých případech jsme zaznamenali tyto obtíže: žaludeční nevolnosti, hubnutí, zácpu, metrorrhagii, křeče dolních končetin, opakovaně pak běžná nachlazení, anginy, infekce močových cest, zlomeniny, odřeniny, jedenkrát svrab a boreliózu. Odchylky v laboratorních hodnotách ukazuje tabulka 2. Zajímavé byly hodnoty FW a CRP. Ke zvýšení sedimentace došlo u 36 % pacientů, z nich 86 % pacientů mělo jen přechodně vyšší FW v souvislosti s nachlazením nebo jinou infekcí, ale 14 % pacientů mělo trvalé zvýšení hodnot FW v rozmezí 20-80/ hodinu po celou dobu léčby. Zvýšení C-reaktivního proteinu jsme zaznamenali u 39 % pacientů, vždy jen přechodně a s minimálním navýšením (do 30 mmol/l) v souvislosti s nachlazením či jinou infekcí. Během terapie nedošlo k dekompenzaci žádné doprovodné choroby. Léčba byla dokončena u všech pacientů.
Obr. 3. Nežádoucí účinky léčby. 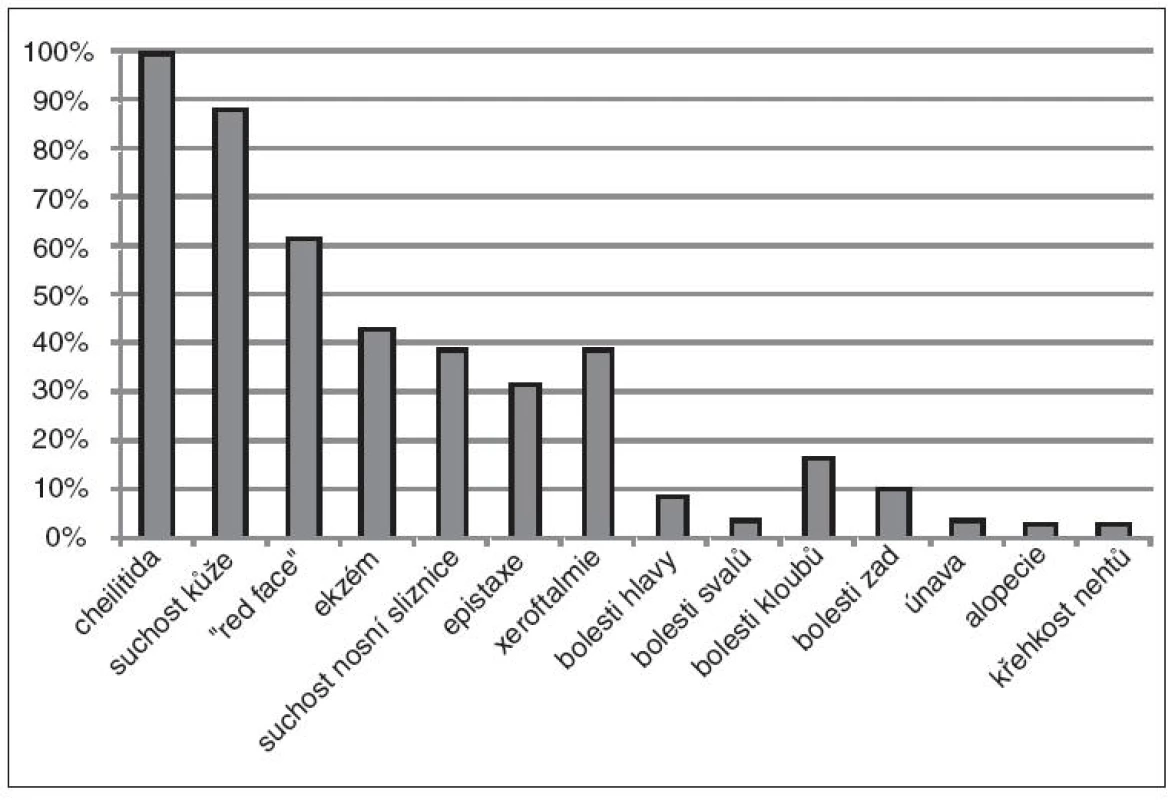
Tab. 2. Laboratorní odchylky během léčby Poznámka: V řádcích 5–8 údaje před závorkou udávají % pacientů s nově vzniklou laboratorní odchylkou, čísla v závorkách pak % všech pacientů s příslušnou odchylkou (včetně těch, kteří měli patologickou hodnotu již před zahájením sledování). 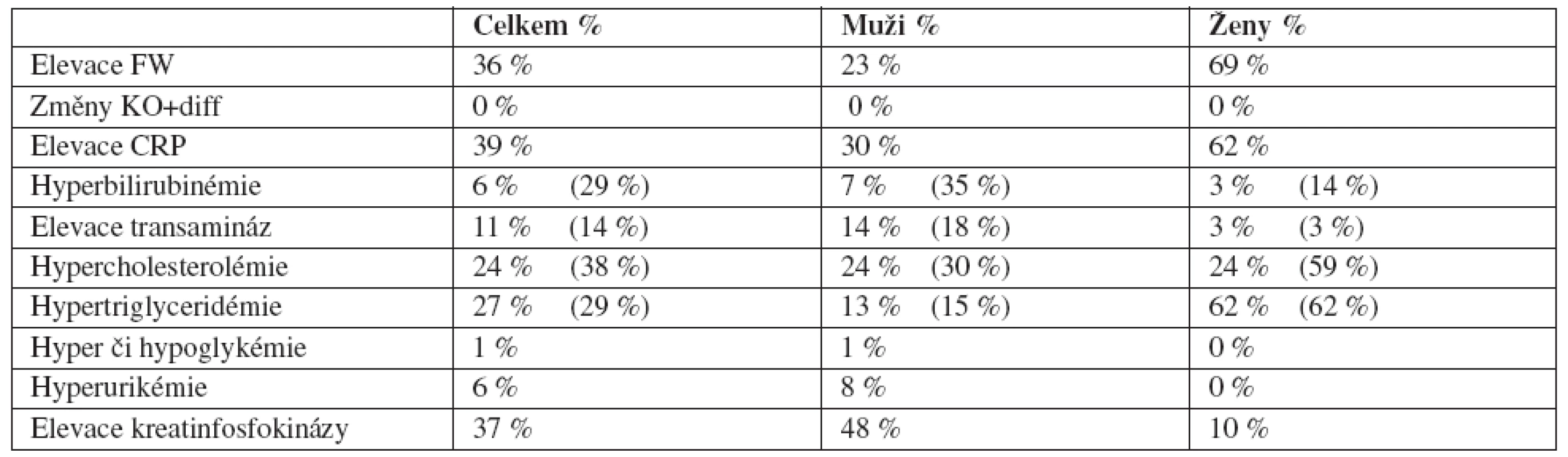
Během léčby jsme nezaznamenali zhoršení depresivního stavu u žádného z pacientů, kteří trpěli depresivními symptomy před léčbou. Naopak, u většiny pacientů depresivní obtíže vymizely. Symptomy deprese, způsobené závažnými exogenními faktory, se objevily u dvou jiných pacientů. Nenalezli jsme žádný případ deprese způsobený perorálním izotretinoinem.
Z hlediska sportovních aktivit při léčbě pacienti-sportovci tolerovali velmi dobře doporučené schéma postupného zatížení kloubů, do dvou měsíců většina z nich provozovala sportovní aktivity prakticky bez omezení a účastnila se i soutěží. U žádného našeho sportovce nedošlo během terapie k výrazným kloubním či svalovým obtížím, eventuální bolesti svalů a kloubů byly minimální.
Sledování při ukončení léčby
Co se týče efektu léčby 86 % pacientů (85 % mužů a 90 % žen) bylo po léčbě kompletně zhojeno, 11 % pacientů (13 % mužů a 10 % žen) téměř zhojeno, 3 % pacientů (4 % mužů a 0 % žen) bylo zlepšeno. Žádný pacient nebyl nezhojen a u žádného nedošlo ke zhoršení projevů – viz obr. 5a a 5b.
Obr. 5a. Výsledky léčby – muži. 
Obr. 5b. Výsledky léčby – ženy. 
Diskuse
Nalezli jsme řadu českých i zahraničních studií zabývajících se některými aspekty léčby perorálním izotretinoinem (4, 5, 9, 11, 20, 29, 32, 40, 42, 46, 47, 52, 54). Žádná z těchto studií nehodnotila všechny námi uvedené parametry, výzkumy byly zaměřeny především na sledování nežádoucích účinků léčby a účinnosti terapie. Námi zjištěná data týkající se pohlaví a věku pacientů, lokalizace a závažnosti akné odpovídají závěrům výše jmenovaných studií, proto je podrobněji nerozebíráme. Pozornost zaměřujeme na nežádoucí účinky při léčbě perorálním izotretinoinem, na souběžné choroby a jejich zvládání během terapie a na možnost sportovních aktivit během léčby.
Izotretinoin je obecně velmi dobře tolerován, ale možné nežádoucí účinky je nutné mít na paměti před zahájením i během léčby. Jednoznačně nejzávažnější je teratogenita a embryotoxicita preparátu, která se projevuje řadou malformací (11, 23, 43). Prevencí nežádoucích gravidit je přísné dodržování preventivního programu pro ženy. Ostatní nežádoucí účinky se dělí na lokální, systémové a laboratorní a jsou analogické hypervitaminóze A. Podrobně jsou popsány v řadě publikací (7, 8, 13, 19, 23, 43).
V našem souboru nedošlo ke graviditě u žádné pacientky. Frekvence místních nežádoucích účinků v našem sledování byla ve shodě s ostatními výše jmenovanými sledováními, jejich kompenzaci jsme prováděli dle známých doporučení. Bolesti hlavy u našich pacientů byly mírného stupně. U těžších stupňů cefalgií je důležité vyloučit intrakraniální hypertenzi. Pouze u dvou mužů jsme proto raději doporučili vyšetření neurologem a očním lékařem, syndrom nitrolebního přetlaku byl u nich vyloučen a obtíže byly diagnostikované jako migrenózní cefalea a minimalizovaly se po neurologem zahájené léčbě amitryptilinem. Bolesti svalů byly u pacientů minimální a pouze v úvodu léčby. Při bolestech kloubů a zad je nutno myslet na to, že může jít o první příznak počínající artritidy a že je nutno pacienty intenzivněji sledovat. Větší bolesti kloubů ihned po podání perorálního izotretinoinu se v našem sledování vyskytly u dvou pacientů – mužů (nešlo o sportovce), kde při dodržování klidového režimu a léčbě paracetamolem v tabletách bolesti postupně vymizely a dále se již neopakovaly. K rozvoji artritidy u nich nedošlo. Únava udávaná pacienty v naší studii byla jen mírná a přechodná. Uvedené výsledky jsou opět v souladu s ostatními jmenovanými sledováními. Z méně častých vedlejších účinků jsme zaznamenali u jednoho pacienta žaludeční obtíže (nevolnosti, zvracení). U dvou pacientů byl pozorován velmi vzácný nežádoucí účinek léčby perorálním izotretinoinem, a to hubnutí (4). Jeden z nich měl ale zároveň diabetes mellitus I. typu na inzulinu a nedodržoval zcela dietní opatření. Jedna pacientka udávala metroragii. Ta je vzácně udávána jako nežádoucí účinek perorálního izotretinoinu (24). Různé menstruační nepravidelnosti jsou ale zřejmě častější, než bylo dříve popisováno, např. Kwon a kolektiv ve svém sledování nalezli obtíže tohoto typu u osmi žen ze čtyřiceti, ale pro zajímavost pouze u jedné pacientky se jednalo o intermenstruální krvácení, u jedné o zkrácení intervalu mezi menses, u všech ostatních o amenoreu (28). Byly zaznamenány dva dosud nepopsané nežádoucí účinky, a to zácpa a křeče dolních končetin. Dietní chyby, lékové ani jiné příčiny nebyly nalezeny. Křeče dolních končetin neustupovaly po aplikaci venotonik ani po zavedení režimových opatření. Oba nežádoucí účinky se objevily po měsíci užívání a vymizely do 14 dnů po ukončení léčby perorálním izotretinoinem, lze je tedy považovat za velmi pravděpodobně související s léčbou perorálním izotretinoinem. Anginy, infekce močových cest, zlomeniny, odřeniny, svrab a boreliózu popsané v našem souboru hodnotíme jako události bez souvislosti s léčbou perorálním izotretinoinem. Naši pacienti utrpěli během léčby izotretinoinem drobné kožní úrazy a zlomeniny drobných kostí. Dávka léku nebyla u žádného z nich snížena, hojení probíhalo v normě a bez komplikací. Podle literatury (7) není zpomalené hojení fraktur nebo sportovních úrazů prokázáno. Existuje pouze teoretické riziko, odvozené z rizika předčasného uzavření epifýz, zhoršeného hojení poranění a zlomenin (7, 19), dle zvážení je možno eventuálně do zhojení léčbu izotretinoinem přerušit.
Většina našich laboratorních výsledků (hodnoty CRP, KO+diff, bilirubinu, transamináz, cholesterolu, kyseliny močové a CPK) byla v souladu s údaji uvedenými v literatuře. Odchylky v krevním obraze a diferenciálním rozpočtu leukocytů jsou občas popisovány, udávány jsou především leukopenie (neutropenie) (8, 19, 23), trombocytopenie (19, 23) a zvýšení počtu trombocytů (19). V našem souboru byly změny bezvýznamné. Nově zjištěné zvýšené hodnoty bilirubinu, transamináz, cholesterolu a urikémie během léčby byly jen mírného stupně (maximálně o 60% nad horní hranici normy), nebylo třeba zvláštních opatření. K výkyvům glykémie může dojít (23), v našem souboru byly nalezeny (ve smyslu hyper - i hypoglykémie) pouze u jednoho pacienta (viz dále), u ostatních pacientů byly hladiny glykémie v normě. Možnou hyperurikémii popisují Charakira a kolektiv (23), v našem souboru bylo zvýšení hladiny kyseliny močové v séru výjimečné a minimálních hodnot. Zvýšení CPK během léčby perorálním izotretinoinem popsal v literatuře například Hanson (19) v souvislosti s extrémní svalovou námahou. Podrobně rozebral tuto problematiku Kajmak v roce 2008 se závěrem, že zvýšené hladiny CPK s nebo i bez svalových obtíží během léčby izotretinoinem jsou benigním fenoménem, odběry CPK a renální testy je nutno provádět jen při extrémních svalových bolestech (27). Vyšší hladiny CPK jsme zaznamenali občas u sportovců po předcházející tělesné aktivitě, výjimečně i u ostatních pacientů. Naše výsledky podporují výše uvedené práce. Jedním z rozdílných výsledků proti ostatním sledováním bylo vysoké procento nově zjištěné hypertriglyceridémie během léčby u žen v našem sledování (62 %). Hodnoty triglyceridů byly u nich ale jen mírně elevované (většinou jen o 50 %, výjimečně až o 100 % nad horní hranici normy). Vždy stačilo pouze zavedení přísných dietních opatření, výjimečně krátkodobě snížení dávky o 10 mg izotretinoinu denně po dobu 4–8 týdnů, výjimečně až do ukončení léčby. Hypolipidemika nebylo nutno nasadit u žádné pacientky. Další zajímavostí pak bylo velmi výrazné zvýšení FW u 14 % žen a 1 % mužů, které trvalo po celou dobu léčby. Všichni tito pacienti byli prošetřeni vzhledem k jiné možné příčině elevace FW (internistou, popř. specializovaným dětským lékařem), příčina vyšší FW ale nebyla nalezena. Zvýšení FW je udáváno v literárních zdrojích (8, 19, 23) jako doprovodný efekt léčby perorálním izotretinoinem, hranice zvýšení ale nejsou uvedeny. Méně výrazné zvýšení FW a v naprosté většině i lehká elevace CRP (do 30 mmol/l) se vyskytla u řady pacientů (mužů i žen), vždy však byla v souvislosti s běžným nachlazením případně infekcí močových cest. Příčinou zvýšení mohla být opět léčba perorálním izotretinoinem či infekce nebo i kombinace obou příčin. Domníváme se proto, že hodnocení elevace FW či CRP během léčby perorálním izotretinoinem je nutno provádět uváženě. Je vhodné myslet na skutečnost, že významný podíl na zvýšení FW i CRP může mít právě léčba tímto preparátem.
Často obávaná depresev souvislosti s léčbou izotretinoinem nebyla zatím ve většině studií prokázána. Pacienti se závažnými formami akné jsou obecně depresivně a úzkostně laděni velice často (12, 37). Také u žádného pacienta v naší studii nebyla nalezena deprese způsobená léčbou perorálním izotretinoinem. Tyto nálezy potvrzují názor, že neexistuje kauzální vztah mezi izotretinoinem a depresí. Předpokládá se ale, že zcela výjimečně může deprese vzniknout jako idiosynkrastický efekt léku. Pacienta, případně rodiče, je nutné o této možnosti změny nálady poučit a též je informovat, že v případě jakékoliv změny nálady mají ihned informovat ošetřujícího lékaře či vyhledat psychiatrickou pomoc.
V našem souboru jsme nalezli velmi vysoké procento pacientů se souběžnou chorobou s akné či s významnou laboratorní odchylkou. V literatuře nebyla nalezena žádná studie, která by se zabývala obdobným procentuálním zastoupením, nemůžeme tedy naše výsledky srovnat. Byly publikovány buď ojedinělé kazuistiky pacientů se souběžnou chorobou (viz dále u jednotlivých chorob) nebo výjimečně větší soubory (4, 32). Největší byl soubor 21 pacientů s jinými systémovými chorobami autorů Hulla a Cunliffa z roku 1989 (22). Náš soubor 55 pacientů je tedy dle našeho nejlepšího vědomí největším dosud publikovaným souborem nemocných s akné, kteří byli léčeni perorálním izotretinoinem a zároveň měli další choroby či laboratorní odchylky. Žádná ze zjištěných nemocí ani laboratorních změn nebyla absolutní kontraindikací k nasazení perorálního izotretinoinu, nebylo ani nutno zahájit léčbu se sníženou denní dávkou. Tito pacienti byli jen podrobněji poučeni vzhledem ke specifiku své další choroby a dle potřeby jsme u nich provedli častější klinické či laboratorní kontroly.
Zvládání doprovodných chorob a laboratorních odchylek během perorální léčby izotretinoinem není příliš často diskutovaným tématem. Při sledování a léčbě našich pacientů jsme vycházeli z několika publikovaných souborů, z nalezených jednotlivých kazuistik a ze dvou v literatuře uvedených doporučení. Bruno a kolektiv (4) léčili bez omezení pacienty s lupénkou, ulcerózní kolitidou, atopickou dermatitidou, bipolární depresí, familiární hyperbilirubinémií a migrenózními bolestmi hlavy. Hull a Cunliffe publikovali v roce 1989 (22) úspěšnou léčbu perorálním izotretinoinem u 21 pacientů s ulcerózní kolitidou, Crohnovou chorobou, sclerosis multiplex, chronickým renálním selháním včetně jednoho dialýzovaného pacienta, s diabetes mellitus a hyperlipidemií II. typu. Dále existuje několik referencí o úspěšné léčbě perorálním izotretinoinem u pacientů s familiární hyperbiliribinémií (31, 51, 53). Během terapie došlo dokonce k poklesu hladin bilirubinu. Mechanismus, kterým izotretinoin snižuje hladiny bilirubinu v krvi u familiární hyperbiliribinémie, je zatím neznámý. Izotretinoin reverzibilně snižuje hladiny testosteronu v séru a tím může zvyšovat hladinu uridin difosfát-glukuronozyl transferázy (UDP-GT) díky eliminaci testosteronem mediované inhibice UDP-GT. Alternativně izotretinoin může zvýšit clearance bilirubinu hepatocyty vytvořením většího množství vazebných proteinů nebo intracelulárních vazebných ligandů nebo změnou afinity těchto enzymů k bilirubinu (53).
Doporučení při eventuálních systémových chorobách jsou podrobněji uvedena ve dvou publikacích. Cooper (7) se zabývá opatřeními při diabetes mellitus, familiární hyperbiliribinemii, hyperlipidemii, zlomeninách, jaterních a ledvinných chorobách. U diabetes mellitus má být hladina glykémie častěji monitorována (může se zvýšit i snížit). U familiární hyperbilirubinémie je efekt izotretinoinu nejasný, během léčby dochází spíše ke snížení hladin bilirubinu, takže častější monitorování hladin bilirubinu není nutné. Při úvodní hypertriglyceridémii je nutné podrobné poučení pacientů, zavedení přísných dietních opatření, častější kontroly testů, případně podání hypolipidemik. Při hodnotách nad 9 mmol/l je nebezpečí pankreatitidy. Pacienti s vyššími jaterními testy před léčbou musí dodržovat přísnou jaterní dietu. Jaterní funkce je nutno pravidelně kontrolovat, protože je u nich vyšší riziko hepatitidy. Dle potřeby je vhodná konzultace gastroenterologa. Cunliffe (10) uvádí tři protokoly léčby podle doprovodných chorob. Protokol 1(standardní dávkovací režim) doporučuje u Crohnovy choroby, ulcerózní kolitidy, epilepsie, spina bifida a diabetes mellitus, protokol 2 (iniciálně polovina dávky izotretinoinu) pro pacienty s chronickým renálním selháním, dialyzované, po transplantaci srdce nebo ledvin, nemocné s bipolárním depresivním syndromem, myalgickou encefalopatií, sclerosis multiplex a u HIV pozitivních. Protokol 3 (s postupným navyšováním dávek léku) je vhodný pro nemocné s morbus Behçet, cerebelární spongiformní encefalopatií, idiopatickou trombocytopenickou purpurou, cystickou fibrózou, leukémií a retinitis pigmentosa. Autor doporučuje úzce spolupracovat s příslušnými ošetřujícími lékaři.
V naší skupině byli nejčastěji zastoupeni pacienti s hyperbilirubinémií (23 %). Při pravidelných kontrolách u nich docházelo v naprosté většině ke snížení hladin bilirubinu, případně hladiny bilirubinu zůstaly téměř nezměněny. Ostatní jaterní testy byly v normě. Terapie proběhla u všech těchto pacientů zcela bez komplikací. Hypercholesterolémie a hypertriglyceridémie již před zahájením léčby jsou rizikovými faktory. V našem souboru tvořili takto postižení pacienti 16 procent. Podle Staelse (50) je zvýšení hladiny cholesterolu během léčby primárně pozorováno u pacientů s hyperlipidémií již před léčbou, zatímco hypertriglyceridémii nelze předvídat. Dle Altmana a kolektivu (3) je průměrný nárůst hladin cholesterolu během léčby o 60 %, triglyceridů o 15 %. Častější monitorování je podle těchto autorů nutné při hladinách cholesterolu nad 6,47 mmol/l a zvažování vysazení léku při hladinách nad 7,77 mmol/l (norma < 5,18 mmol/l), u hladin triglyceridů pak doporučují častější monitorování při hladinách nad 3,39 mmol/l a vysazení léku při hladinách nad 4,52 mmol/l (norma < 1,808 mmol/l). Podle Hansona a kolektivu (19) je doporučeno zvýšené sledování u hladin triglyceridů nad 5,00–6,00 mmol/l. Cooper (7) považuje za nutné při úvodní hypertriglyceridémii podrobné poučení pacientů, zavedení přísných dietních opatření, častější kontroly laboratorních nálezů, případně podání hypolipidemik. V naší laboratoři (biochemická laboratoř nemocnice v Jihlavě) je horní hranice normy hladina cholesterolu 5,00 mmol/l a triglyceridů 1,70 mmol/l. Během sledování jsme se rozhodli řídit Altmanovými doporučeními. Všichni pacienti byli před zahájením léčby podrobně poučeni o nutnosti dodržování přísných dietních opatření. Hladiny tuků byly kontrolovány individuálně (podle konkrétní hodnoty hladiny cholesterolu nebo triglyceridů) po 1 až 3 měsících, během sledování nedošlo k jejich výraznému zvýšení. U žádného pacienta nebylo nutno podávat hypolipidemika. Hladiny cholesterolu byly maximálně do 7,00 mmol/l (jen u jedné pacientky v rozmezí 7,10 až 9,00 mmol/l, internisté ale hypolipidemika nedoporučili) a hladiny triglyceridů maximálně 3,77 mmol/l (pouze u jednoho muže byly dvě naměřené hodnoty vyšší: 4,51 a 5,26 mmol/l, opět při vyšetření v metabolické poradně nebyla doporučena hypolipidemika, snížili jsme ale dávku izotretinoinu na 0,3 mg/kg/den). Elevace transamináz lehkého stupně byla nalezena před léčbou u dvou pacientů (oba byli muži, obézní, s vyššími hladinami tuků). Byla jim doporučena přísná redukční, hypolipidemická a játra šetřící dieta. Během léčby došlo u jednoho jen k minimální elevaci jaterních testů (ALT do 50 % a GMT do 40 % nad horní hranici normy), u druhého bylo zvýšení vyšší (ALT krátkodobě až o 200 % nad horní hranici normy, GMT maximálně o 40 %). Terapie obou byla dokončena bez komplikací, u pacienta s vyššími hodnotami GMT jsme ale snížili denní dávku izotretinoinu na 0,3 mg/kg/den) a léčbu úměrně prodloužili. Nebylo nutné přerušení léčby doporučované v literatuře (2, 19). Bolesti kloubů a zad (u 5 % pacientů) by mohly být problémem, protože stejné obtíže může způsobit i perorální izotretinoin. Hrozí tedy sumace obtíží. Tato skupina našich pacientů byla obzvláště pečlivě poučena stran postupného navyšování tělesné aktivity a sledování bolestí. U žádného nemocného nedošlo ke zhoršení obtíží během léčby. Celiakie (dva muži) a diabetes mellitus (jeden muž) nepředstavují problém při léčbě izotretinoinem a nebyly komplikací ani u našich pacientů. Léčbu perorálním izotretinoinem u pacientů se zánětlivými střevními chorobami podrobně popisují Godfrey a James (17). Léčili čtyři pacienty se zmíněnými chorobami a pouze u jednoho došlo k přechodnému zhoršení choroby. Autoři předpokládají, že u většiny pacientů je léčba izotretinoinem bezpečná. Ke zhoršení střevní choroby může výjimečně dojít, příčinou je asi exsikace střevní sliznice pravděpodobně v důsledku atrofie pohárkových buněk při léčbě perorálním izotretinoinem. V těchto případech je nutno léčbu ukončit. Úspěšnou léčbu pacienta s ulcerózní kolitidou perorálním izotretinoinem popsal Schleicher (49), naopak léčbou idukovanou proktosigmoitidu popsali Martin a kol. (38), Reniers (45) a Radmanesh (44). Hull a Cunliffe (22) léčili izotretinoinem dva pacienty s ulcerózní kolitidou a jednoho s Crohnovou chorobou, ani u jednoho nedošlo ke zhoršení základní choroby. V našem sledování byl léčen pro Crohnovu chorobu jeden muž. Během celého sledování byla jeho střevní choroba kompenzovaná, nebylo nutno změnit léčbu. Během léčby perorálním izotretinoinem může dojít ke zhoršení dechových obtíží u pacientů s astmatem (26) nebo k nové provokaci astmatických obtíží u nemocných s atopickým ekzémem (48). Příčinou je vysušující efekt retinoidů na respirační trakt obdobný efektu na kůži a sliznicích. V literatuře se uvádí i cvičením provokovaný bronchospasmus (15). Náš pacient s astmatem byl během celého sledování kompenzován, nedošlo u něj k žádnému astmatickému záchvatu, před léčbou byl řádně poučen o možném zhoršení obtíží. Nově vzniklé obtíže jsme nezaznamenali u žádného pacienta, ani u nemocných s atopickým ekzémem. Nosní polypy mohou být rizikem vyššího krvácení z nosu, naše pacientka trpěla po celou dobu léčby jen lehkou epistaxí.
Jedna pacientka s glaukomem a sekundární amaurózou a jeden pacient s barvoslepostí neuváděli žádné oční komplikace během léčby perorálním izotretinoinem. Ani jejich základní oční choroby se nezhoršily. Opatření u těchto očních chorob jsme v literatuře nenalezli. Velmi podrobný rozbor nežádoucích oftalmologických účinků provedli v roce 2001 Fraunfelder a kolektiv (16). Ti zařadili snížené barevné vidění (reverzibilní) mezi možné nežádoucí účinky izotretinoinu a glaukom mezi nepravděpodobné. Na základě těchto údajů předpokládáme, že žádná speciální opatření pro pacienty s výše uvedenými diagnózami nejsou třeba. U pacientů se sennou rýmou, alergickým zánětem spojivek a kopřivkou byly ve shodě s literaturou častější nežádoucí účinky typu suchosti kůže a sliznic (8). Pacient s osteochondromem kolena netrpěl během sledování žádnými bolestmi postiženého kloubu. U muže léčeného růstovým hormonem pro poruchu růstu, u pacienta se srdečním šelestem ani u nemocné s varixy nebyla nutná žádná zvláštní opatření během léčby. Terapie u nich proběhla bez komplikací.
V našem souboru jsme zjistili velmi vysoké procento pacientů zabývajících se aktivně sportem, tělesným aktivitám se věnovali zejména muži. V literatuře jsme nenalezli žádnou studii, která by se zabývala procentuálním zastoupením sportovců mezi pacienty léčenými perorálním izotretinoinem, naše výsledky tedy nelze porovnat. V žádné nám dostupné publikaci nebyla ani přesně specifikována opatření týkající se tělesných aktivit ani sdělení zabývající se podrobněji léčbou izotretinoinem u sportovců. Většinou sportovní aktivity nejsou omezeny, například Alcalay (1) referuje, že během jeho sledování nebyli pacienti stran sportovní aktivity omezováni, měli povolen i vysoce intenzivní fyzický trénink a posilování. Jen Leyden (33) udává možné větší nežádoucí účinky u těchto sportů: závodní bruslení, gymnastika, balet, běh na dlouhé tratě, vzpírání, kontaktní sporty. Všichni naši sportovci dodržovali stejně jako ostatní účastníci sledování schéma postupného zatěžování kloubů, obzvlášť pečlivě jsme poučili a sledovali pacienty provozující tanec, rokenrol, kickbox, valetudo, kulturistiku a posilování. Obecně je při léčbě retinoidy, hlavně po tělesné zátěži, určité riziko muskuloskeletálních obtíží zahrnujících především artralgie, artritidy, bolesti kostí, hyperkalcemii a skeletální změny. Podrobně je popsali například Kaplan a Haettich (25). Byly publikovány kazuistiky závažných artritid při léčbě perorálním izotretinoinem (6, 21, 36, 39) včetně bilaterální sakroilitidy (3) a těžké akutní myopatie (14). Tito pacienti nebyli sportovci. Tím spíše je nutno zvažovat možné riziko nežádoucích účinků tohoto typu při zvýšené tělesné zátěži, tedy u sportovců. U žádného našeho sportovce nedošlo k výrazným kloubním či svalovým obtížím, případné bolesti svalů a kloubů byly minimální a podle údajů pacientů byly srovnatelné s obtížemi při sportovním zatížení před léčbou perorálním izotretinoinem. K prevenci obtíží mohlo přispět právě přísné dodržování výše zmíněného postupného zatěžování kloubů.
Terapeutická účinnost izotretinoinu je dlouhodobě ověřena, první klinické zkoušky začaly probíhat již v roce 1971. Podle posledních evropských doporučení má být léčba zahájena denní dávkou 0,5 mg/kg/den (30) a ta dále doladěna dle účinku a snášenlivosti. Většina autorů doporučuje optimální denní terapeutickou dávku 0,5 až 1,0 mg/kg/den (43), v některých zemích je doporučováno až 2,0 mg/kg/den (7). V případě podávání nižší dávky trvá hojení déle a jsou možné častější relapsy choroby (18). Velmi důležitá je celková užitá dávka. Tato totální kumulativní dávka by měla být 120–150 mg/kg, výjimečně až 180 mg/kg (7, 43) u těžkého postižení hrudníku. Další zvyšování celkové dávky již nemá větší léčebný efekt a vede pouze k větší zátěži pacienta. Léčba by měla pokračovat ještě alespoň dva měsíce po zhojení nebo výrazném zlepšení kožního nálezu (7). Ideální je splnění obou kritérií. Optimální celkově užitá dávka s sebou přináší minimální riziko exacerbace projevů akné po vynechání izotretinoinu. Osobně se nám osvědčily denní dávky 0,5 až 0,7 mg/kg/den a tyto dávky léku užívali i sledovaní pacienti. Léčba byla pro pacienty snesitelnější pro nižší intenzitu nežádoucích účinků. Doporučené kumulativní dávky byly ve sledování dodrženy. Výsledky léčby byly (díky dodržení doporučeného dávkování) vynikající: 97 % pacientů bylo po ukončení terapie zhojeno nebo téměř zhojeno. Obdobné výsledky udává například Rulcová (46).
Závěr
Naše sledování prokázalo vysokou účinnost a bezpečnost perorálního izotretinoinu, je-li užíván podle doporučených pravidel. Pro vysokou účinnost je potřebné zejména dodržení denní dávky léku a celkové kumulativní dávky. Pro zajištění bezpečnosti terapie je nutné podrobné poučení pacienta (případně jeho rodičů) před léčbou, pečlivé monitorování obtíží včetně laboratorních kontrol během léčby a přísná kontrola dodržování preventivního programu pro ženy.
Během léčby perorálním izotretinoinem se nevyskytly žádné závažné nežádoucí účinky léčby, nejčastějšími vedlejšími projevy terapie byly nevýrazná suchost kůže a sliznic. Zaznamenali jsme dva, pokud je nám známo dosud nepopsané, nežádoucí účinky velmi pravděpodobně související s léčbou, a to zácpu a křeče dolních končetin. Ty však byly jen mírného rázu a nebyly důvodem k přerušení léčby. Při výskytu nežádoucích účinků je nutno zvážit jejich možnou souvislost s léčbou perorálním izotretinoinem a dále jejich závažnost. Při větším negativním dopadu je někdy nutno dávku izotretinoinu dočasně či trvale snížit či lék vynechat. K včasnému zhodnocení situace je nutno pacienty (eventuálně i jejich rodiče) požádat o ohlášení všech závažných nežádoucích efektů léčby ihned bez prodlení ošetřujícímu lékaři.
Nebyl zaznamenán žádný případ deprese způsobené perorálním izotretinoinem, naopak během léčby perorálním izotretinoinem došlo u většiny pacientů ke kompletnímu vymizení depresivních symptomů. Přesto je nezbytně nutné poučit pacienty (případně i jejich rodiče) o bezprostředním nahlášení všech závažných změn nálad (především depresivních stavů) ihned bez prodlení ošetřujícímu lékaři.
Ve srovnání s dostupnou literaturou byl náš výzkum podrobně zaměřen zejména na sledování pacientů s doprovodnými chorobami a na léčbu pacientů-sportovců. Těmto tématům se dosavadní studie věnovaly jen sporadicky a okrajově. Při zjištění další nemoci či laboratorní změny je nutno zvážit, zda tato situace není absolutní kontraindikací k užití perorálního izotretinoinu. Pokud jde o relativní kontraindikaci, je během léčby nutná zvýšená opatrnost a častější sledování. Při sledování sportovců je nutné důsledné poučení o omezení tělesných aktivit, zejména u závodních bruslařů, gymnastů, baletek, tanečníků, běžců na dlouhé tratě, vzpěračů, kulturistů a u pacientů provozujících kontaktní sporty. Doporučujeme důsledné dodržování schématu postupného zatěžování kloubů.
Věnování
Tuto práci bych chtěla věnovat památce profesora Vojtěcha Rosického, předního světového mineraloga a petrografa, spoluzakladale Masarykovy university v Brně (v letech 1925 až 1926 byl i jejím rektorem), který byl v roce 1942 umučen v koncentračním táboře v Mauthausenu a nemohl tak pokračovat v započaté vědecké práci.
Poděkování
Chtěla bych moc poděkovat paní docentce MUDr. Jarmile Rulcové, CSc., z kožní kliniky Fakultní nemocnice v Brně-Bohunicích za cenné rady, které mi poskytla při mém sledování a co se týče problematiky akné vůbec.
Dále děkuji paní primářce MUDr. Dagmar Dvořákové z Psychiatrické léčebny v Jihlavě za konzultaci pacientů s depresivními syndromy a za pomoc při zpracování dat týkajících se psychiatrické problematiky.
MUDr. Zuzana Nevoralová
Kožní oddělení nemocnice v Jihlavě
Vrchlického 59
586 33 Jihlava
E-mail: znevoralova@atlas.cz
Zdroje
1. ALCALAY, J., LANDAU, M., ZUCKER, A.: Analysis of laboratory data in acne patients treated with isotretinoin: is there really a need to perform routine laboratory tests? J Dermatol Treat, 2001, 12 (1), p. 9-12.
2. ALTMAN, S., ALTMAN, LJ., ALTMAN, JS.: A Proposed Set of New Guidelines for Routine Blood Tests during Isotretinoin Therapy for Acne vulgaris. Dermatology, 2002, 204 (3), p. 232-235.
3. BACHMEYER, C., CHAROUD, A., TURC, Y. et al.: Isotretinoin-Induced Bilateral Sacroilitis. Dermatology, 2003, 206, p. 285-286.
4. BRUNO, NP., BEACHAM, BE., BURNETT, JP.: Adverse Effects of Isotretinoin Therapy. Cutis, 1984, 33 (5), p. 484-487.
5. BUCHVALD, J.: Skúsenosti s isotretinoinom (Roaccutane) v liečbe akné a niektorých iných dermatóz. Čs Derm, 1985, 60 (4), s. 225-232.
6. CAMISA, C.: Acute arthritis during isotretinoin treatment for acne. J Am Acad Dermatol, 1986, 15 (5), s. 1061-1062.
7. COOPER, AJ. et al.: Treatment of acne with isotretinoin: Reccomendations based on Australian experience. Australas J Dermatol, 2003, 44, p. 97-105.
8. CUNLIFFE, WJ.: Side effects of acne therapy. In CUNLIFFE, W., J. Acne. London: Martin Dunitz Ltd., 1. vydání, 1989, p. 288-324.
9. CUNLIFFE, WJ. et al.: Roaccutane Treatment Guidelines: Results of an International Survey. Dermatology, 1997, 194, p. 351-357.
10. CUNLIFFE, WJ.: The difficult acne patient. Acta Dermatovenerol Croat, 2001, 9 (3), p. 183-195.
11. CUNLIFFE, WJ., GOLLNICK, HP.: Acne. Diagnosis and management.. In CUNLIFFE, WJ., GOLLNICK, HP. Acne. London: Martin Dunitz Ltd. 2001, p. 166.
12. DRENO, B., CHOSIDOW, O.: Isotretinoin and psychiatric effects: facts and hypothesis. Expert Rev Dermatol, 2008, 6, p. 711-720.
13. ELLIS, CHN., KRACH, KJ.: Uses and complications of isotretinoin therapy. J Am Acad Dermatol, 2001, 45 (5), p. S150-S157.
14. FIALLO, P.: Severe Acute Myopathy Induced by Isotretinoin. Arch Dermatol, 1996, 132, p. 1521-1522.
15. FISCHER, DA.: Exercise-induced bronchoconstriction related to isotretinoin therapy. J Am Acad Dermatol, 1985, 13 (3), p. 524.
16. FRAUNFELDER, FT., FRAUNFELDER, FW., EDWARDS, R.: Ocular Side Effects Possibly Associated with Isotretinoin Usage. Am J Ophthalmol, 2001, 132 (3), p. 299-305.
17. GODFREY, KM., JAMES, MP.: Treatment of severe acne with isotretinoin in patients with inflammatory bowel disease. Br J Dermatol, 1990, 123, p. 653-655.
18. GOLLNICK, H., P., CUNLIFFE, WJ.: Management of acne. A report from a global aliance to improve outcomes in acne. J Am Acad Dermatol, 2003, 49, p. 1-38.
19. HANSON, N., LEACHMAN, S.: Safety Issues in Isotretinoin Therapy. Semin Cutan Med Surg, 2001, 20 (3), p. 166-183.
20. HODGKISS-HARLOW CJ., EICHENFIELD, LF., DOHIL, MA.: Safety and adverse effects of isotretinoin in pediatric dermatology clinical setting (abstract). In CD of
21. HUGHES, RA.: Arthritis Precipitated by Isotretinoin Treatment for Acne Vulgaris. J Rheumatol, 1993, 20 (7), p. 1241-1242.
22. HULL, MS., CUNLIFFE, WJ.: The safety of isotretinoin in patients with acne and systemic diseases. J Dermatol Treat, 1989, 1, p. 35-37.
23. CHARAKIRA, A., MOUSER, PE., CHU, AC.: Safety and side effects of the acne drug, oral isotretinoin. Ashley Publications Ltd ISSN 1474-0338, 2004, p. 119-125.
24. CHRISTMAS, T.: Roaccutane and menorrhagia. J Am Acad Dermatol, 1988, 18 (3), p. 576-577.
25. KAPLAN, G., HAETTICH, B.: Rheumatological symptoms due to retinoids. Baillieres Clin Rheumatol, 1991, 5 (1), p. 77-99.
26. KAPUR, N.: Exacerbation of asthma by isotretinoin. Br J Dermatol, 2000, 142 (2), p. 370-393.
27. KAYMAK, Y.: Creatine phosphokinase values during isotretinoin treatment for acne. Int J Dermatol, 2008, 47 (4), p. 398-401.
28. KWON, HJ., LEE, JY., CHO, BK. et al.: Menstrual irregularity during isotretinoin treatment. J Eur Acad Dermatol Venereol, 2007, 21, p. 562-563.
29. LAYTON, AM., STAINFORTH, JM., CUNLIFFE, WJ.: Ten years‘ experience of oral isotretinoin for the treatment of acne vulgaris. J Dermatol Treat, 1993, 4 (Suppl.2), S2-S5.
30. LAYTON, AM., DRENO, B., GOLLNICK, HP. et al.: A review of European Directive for prescribing systemic isotretinoin for acne vulgaris. J Eur Acad Dermatol Venereol, 2006, 7, p. 773-776.
31. LE GAL, F., A., PAUWELS, CH.: Maladie de Gilbert et isotrétinoine, Ann Dermatol Venereol, 1997, 124, p. 463-466.
32. LEHUCHER-CEYRAC, D., WEBER-BUISSET, MJ.: Isotretinoin and Acne in Practice: A Prospective Analysis of 188 Cases over 9 Years. Dermatology, 1993, 186 (2), p. 123-128.
33. LEYDEN, JJ.: The role of isotretinoin in the treatment of acne: personal observationes. J Am Acad Dermatol, 1998, 39, p. S45-S49.
34. LEYDEN, JJ., MC GINLEY, KJ., FOGLIA, AN.: Qualitative and quantitative changes in cutaneous bacteria associated with systemic isotretinoin therapy for acne conglobata. J Invest Dermatol, 1986, 86 (4), p. 390-393.
35. KARLSSON, T., VAHLQUIST, A., KEDISHVILI, N. et al.: 13-Cis retinoic acid competitevely inhibits 3 alpha-hydroxysteroid oxidation by retinol dehydrogenace RoDH-4: a mechanism for its anti-androgenetic effects in sebaceous glands? Biochem Biophys Res Commun, 2003, 303(1), p. 273-278.
36. LEHUCHER-CEYRAC, D.: Acute Arthritis after Isotretinoin. Dermatology, 1999, 198, p. 406-407.
37. MARQUELING, AL., ZANNE, LT.: Depression and suicidal behavior in acne patients treated with isotretinoin: a systemic review. Sem Cut Med Surg, 2005, 24(2), p. 92-102.
38. MARTIN, P., MANLEY, PN., DEPEW, WT. et al.: Isotretinoin-Associated Proctosigmoiditis. Gastroenterology, 1987, 93 (3), p. 606-609.
39. MATSUOKA, LY., WORTSMAN, J., PEPPER, JJ.: Acute arthritis during isotretinoin 40. MC LANE, J.: Analysis of common side effects of isotretinoin. J Am Acad Dermatol, 2001, 45 (5), p. S188-S194.
41. NELSON, AM., GILLILAND, KL., CONG, Z.: 13-Cis retinoic acid induces apoptosis and cell cycle arrest in human SEB-1 sebocytes. J Invest Dermatol, 2006, 126(10), p. 2178-2189.
42. PLEWIG, G., GOLLNICK, HP., MEIGEL, W. et al.: 13-Cis retinoic acid in the oral therapy of acne conglobata. Results of a multi-center study. Hautarzt, 1981, 32(12), p. 634-646.
43. PLEWIG, G., KLIGMAN, AM.: Acne and Rosacea. 3rd Completely Revised and Enlarged Edition. Berlin-Heidelberg-New York: Springer-Verlag. 2000, p. 245-247, 577-730.
44. RADMANESH, M.: Anal fissure, rectal bleeding and proctitis as complications of systemic isotretinoin therapy: report of two cases. J Eur Acad Dermatol Venereol, 2006, 20, p. 1394.
45. RENIERS, DE., HOWARD, JM.: Isotretinoin-Induced Inflammatory Bowel Disease in an Adolescent. The Annals of Pharmacotherapy, 2001, 35, p. 1214-1216.
46. RULCOVÁ, J.: Zhodnocení průběhu a výsledků léčby acne vulgaris izotretinoinem. Čes-slov Derm, 2001, 76 (1), s. 25-31.
47. RULCOVÁ, J., ZÁHEJSKÝ, J.: Roaccutane v terapii těžších forem akné. Čs Derm, 1986, 61(6), s. 369-374.
48. SABROE, RA., STAUGTON, RCD., BUNKER, CB.: Bronchospasm induced by isotretinoin. Br J Dermatol, 1996, 312 (7035), p. 886.
49. SCHLEICHER, SM.: Oral isotretinoin and inflammatory bowel disease. J Am Acad Dermatol, 1985, 13(5), s. 834-835.
50. STAELS, B.: Regulation of lipid and lipoprotein mechanism by retinoids. J Am Acad Dermatol, 2001, 45, p. S158-S167.
51. SUARÉZ CJF., GARCIA, MV., BECERRA MP. e col.: Pueden ser tratados con isotretinoín los pacientes con acné y síndrome de Gilbert? Rev Esp Enf Digest, 1996, 8, p. 584-585.
52. VOHRADNÍKOVÁ, O. et al.: Léčba těžkých forem akné Roaccutanem. Čs Derm, 1988, 63 (6), s. 396-401.
53. WANG, JI., JACKSON, TL., KAPLAN DL.: Isotretinoin-associated normalisation of hyperbilirubinemia in patients with Gilbert´s syndrome. J Am Acad Dermatol, 1995, 32, p. 136-138.
54. ZANE, LT., LEYDEN, WA., MARQUELING, AL. et al.: A Polulation-Based Analysis of Laboratory Abnormalities During Isotretinoin Therapy for Acne Vulgaris. Arch Dermatol, 2006, 142, p. 1016-1022.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2010 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Význam lokální oxygenoterapie a ozonoterapie pro léčbu nehojivých ran
-
Všechny články tohoto čísla
- Prázdniny! Okurková sezóna nebo vysněný ráj pro workoholiky?
- Současné trendy a nové možnosti v léčbě melanomu
-
DOŠKOLOVÁNÍ LÉKAŘŮ – KONTROLNÍ TEST
Současné trendy a nové možnosti v léčbě melanomu
- Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinem
- Nystatin – nově dostupné léčivo pro magistraliter přípravu
- Komentář k Doporučením Evropského dermatologického fóra pro celkovou léčbu psoriasis vulgaris
- Pseudoxanthoma elasticum
- Klinický případ: Drsné papuly v obličeji
-
VI. kongres slovenských a českých dermatovenerológov
Bratislava, 3.–5. 6. 2010
- Zápis ze schůze výboru ČDS konané dne 1. dubna 2010 v Praze
- Zápis ze schůze výboru ČDS konané dne 6. května 2010 v Praze
- XII. Krajský seminár dermatológov Banskobystrického kraja, Sklené Teplice, 18. 6. 2010
-
7. jarní sympozium Evropské akademie dermatovenerologie (EADV)
Cavtat (Chorvatsko), 13. – 16. 5. 2010
-
10. kongres Evropské společnosti pro dětskou dermatologii (ESPD)
Lausanne (Švýcarsko), 20. – 22. 5. 2010
- Odborné akce v roce 2010
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nystatin – nově dostupné léčivo pro magistraliter přípravu
- Sledování souboru pacientů s těžkými formami acne vulgaris léčených perorálním izotretinoinem
- Současné trendy a nové možnosti v léčbě melanomu
- Klinický případ: Drsné papuly v obličeji
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání