-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dlouhodobé výsledky léčby testikulárních nádorů u dětí a dospívajících. Retrospektivní analýza souboru pacientů (1998–2021)
Long-term results of treatment of testicular tumors in children and adolescents. A retrospective analysis of a group of patients (1998–2021)
Aim: Retrospective analysis of 96 patients with primary testicular cancer treated at a pediatric oncology department in the period 1998–2021. Evaluation of epidemiology, age-specific distribution of types of germinal testicular tumors, type of operation, type of chemotherapy and treatment results. Evaluation of late effects of treatment in long-term survivors.
Methods and characteristics: during the study period, 96 patients with primary testicular tumor – 89 germinal tumor type (TGCT), 6 stromal tumor type were treated. 1 patient was diagnosed with primary non-Hodgkin’s testicular lymphoma. In 1 case, the tumor was bilateral. In 58 cases, TGCT was a malignant type of tumor, and a mature prepubertal teratoma was diagnosed in 31 cases. The TGCT subtype was significantly associated with the patient’s age. Malignant tumors predominated in adolescents; in prepubertal age, most tumors were benign. Higher clinical stages (III and IV) were more common in adolescents. All patients underwent surgery – radical orchiectomy in 81 patients, testis sparing surgery (TSS) in 15 patients. Residual tumor mass surgery in metastatic patients after the end of chemotherapy took place in 9 patients, only 2 patients showed signs of vital tumor. No retroperitoneal lymph node dissection was indicated in any patient. Watch and wait strategies without adjuvant treatment were indicated in all prepubertal patients, in 14 adolescent patients and in all patients with stromal tumor type. Chemotherapy was indicated according to the type of tumor, clinical stage, age of the patient, the dynamics of the tumor markers and the classification into the risk group.
Results: All 89 patients with TGCT achieved remission. 2 patients with vital residual tumor after the end of first-line treatment achieved clinical remission after the second-line treatment. 1 patient developed metachronous malignant TGCT in the contralateral testis 7,4 years after the primary diagnosis. 1 patient developed late metastatic progression of mixed TGCT after 3,1 years and exited. 5-year overall survival (OS) is 98,7%, 5-year event free survival (EFS) is 98,7%. The median follow-up after treatment is 11,5 years. Nephrotoxicity and ototoxicity gr I and II and fertility disorders were confirmed in 11 patients. Pulmonary toxicity is present in 2 patients, 2 patients have psychological problems.
Conclusion: Testicular tumors are rare in prepubertal children, their incidence increases with age. They are the most common cancer in adolescents. The germ cell tumors are the most frequent type. The distribution of histological types of TGCT is age-specific. The patient’s prognosis depends on early diagnosis, the extent of the disease and the dynamics of the decline in tumor markers. The gold standard of treatment is radical orchiectomy, TSS is possible in a well-defined group of prepubertal boys. Chemotherapy significantly improved the prognosis of TGCT and included testicular tumors among the curative types of tumors. The risks of toxicity and late effects of treatment lead to efforts to reduce the dose and duration of chemotherapy while maintaining the results. Improving health education in adolescents is also an important factor.
Keywords:
Adolescents – analysis – children – testicular tumors
Autoři: Viera Bajčiová 1; Pavel Zerhau 2; Matěj Husár 2; Marta Ježová 3; Denisa Krejčí 4
Působiště autorů: Klinika dětské onkologie FN Brno 1; Klinika dětské chirurgie, ortopedie a traumatologie FN Brno 2; Anatomický ústav FN Brno 3; Institut biostatistiky a analýz LF MU Brno 4
Vyšlo v časopise: Ces Urol 2022; 26(2): 99-110
Kategorie: Původní práce
Souhrn
Cíl: Retrospektivní analýza souboru 96 pacientů s primárním nádorem varlete léčených na dětské onkologii v období 1998–2021. Zhodnocení epidemiologie, věkově specifické distribuce typů germinálních nádorů varlat, typ operace, typ chemoterapie a výsledky léčby. U dlouhodobě přežívajících pacientů vyhodnocení pozdních následků léčby.
Soubor pacientů: Za sledované období bylo léčeno 96 pacientů s primárním nádorem testis – 89 germinální typ nádoru (TGCT), 6 stromální typ nádoru. Jeden pacient byl diagnostikován s primárním non‑Hodgkinovým lymfomem varlete. V 1 případě byl nádor bilaterální. U pacientů s TGCT se v 58 případech jednalo o maligní typ nádoru, ve 31 případech byl diagnostikovaný zralý teratom prepubertálního typu. Podtyp germinálního nádoru byl signifikantně asociován s věkem pacienta. Maligní nádory dominovaly u adolescentů, v prepubertálním věku byla většina nádorů benigních. Vyšší klinicka stadia (III a IV) byla častější u adolescentů. Všichni pacienti podstoupili operaci – radikální orchiektomie u 81 pacientů, orgán záchovná operace (TSS) u 15 pacientů. Operace reziduální nádorové masy u metastatických pacientů po ukončení chemoterapie proběhla u 9 pacientů, pouze u 2 pacientů byly přítomny známky vitálního nádoru. U žádného pacienta nebyla indikována retroperitoneální disekce lymfatických uzlin. Watch and wait strategie bez adjuvantní léčby byla indikována u všech prepubertálních pacientů, u 14 pacientů pubertálního věku a u všech pacientů se stromálním typem nádoru. Chemoterapie byla indikována dle typu nádoru, klinického stadia, věku pacienta, dynamiky poklesu nádorových markerů a zařazení do rizikové skupiny.
Výsledky: Všech 89 pacientů s TGCT dosáhlo remise nemoci. Dva pacienti s přítomným vitálním reziduálním nádorem po ukončení léčby 1. linie dosáhli klinické remise až po léčbě 2. linie. Jeden pacient vyvinul metachronní maligní TGCT v kontralaterálním varleti 7,4 roku od primární diagnózy. Jeden pacient rozvinul pozdní metastatickou progresi smíšeného TGCT po 3,1 roku a exitoval. Pětileté celkové přežití (Overal Survival, OS) je 98,7 %, pětileté přežití bez události (Event Free Survival, EFS) je 98,7%. Medián sledování po léčbě je 11,5 roku. U 11 pacientů byla potvrzena nefrotoxicita a ototoxicita gr. I a II a poruchy fertility. U dvou pacientů je přítomna plicní toxicita, dva pacienti mají psychologické problémy.
Závěr: Nádory varlat jsou u prepubertálních dětí vzácné, jejich incidence stoupá s věkem. U adolescentů jsou vůbec nejčastějším zhoubným nádorem. Převážnou většinu tvoří germinální nádory. Distribuce histologických typů TGCT je věkově specifická. Prognóza pacienta závisí od včasné diagnózy, rozsahu nemoci a dynamiky poklesu nádorových markerů. Zlatým standardem léčby je radikální orchiektomie, TSS je možná u přesně definované skupiny prepubertálních chlapců. Chemoterapie výrazně zlepšila prognózu TGCT a zařadila nádory varlat mezi kurativní typy nádorů. Rizika toxicity a pozdní následky léčby vedou ke snaze redukovat dávky a délku chemoterapie při udržení dosavadních výsledků. Důležitým faktorem je i zlepšování zdravotní osvěty u adolescentů.
Klíčová slova:
deti – analýza – dospívající – testikulární nádory
ÚVOD
Nádory varlat patří v dětském věku mezi vzácné typy nádorových onemocnění. U dětí pod 12 let věku tvoří pouze 1–2 % ze všech nádorů. Jejich incidence se prudce zvyšuje v pubertálním období a u adolescentů, u kterých tvoří 12–15 % a patří mezi nejčastější solidní nádory vůbec. V České republice je meziroční incidence testikulárních nádorů ve věkové skupině 0–14 let 1,7/1 milion, ve věkové skupině 15–19 let 24,2/1 milion. Incidence má, především u adolescentů, v posledních desetiletích stoupající trend (1, 2, 3, 4).
Přestože mají nádory varlat ve všech věkových skupinách celou řadu společných vlastností, existují věkově specifické rozdíly, které se projevují především v epidemiologii, patogenezi, věkové predilekci histologických typů nádorů, biologickém chování, cytogenetických a molekulárně genetických nálezech a následně v rozdílném přístupu k diagnostice a léčbě. Zatímco většina prepubertálních nádorů varlat jsou nádory benigní, až 75 % testikulárních nádorů u adolescentů jsou nádory maligní (3, 5, 6).
Zavedením chemoterapie na bázi cisplatiny a standardizaci operačních postupů se nádory varlat zařadily mezi kurabilní typy nádorů. Důležitým faktorem ovlivňujícím prognózu je délka anamnézy a trvání klinických příznaků. Pubertální chlapci a adolescenti jsou v tomto bodě opět riziková skupina pacientů. Přes 80 % pacientů s metastatickou chorobou jsou pacienti starší 15 let. Oddálení diagnózy a zahájení léčby má přímý vliv nejen na léčebnou strategii, délku a intenzitu léčby, ale i na následnou morbiditu, kvalitu života a v neposlední řadě i na mortalitu pacientů. Pozdní diagnóza a pokročilé onemocnění snižují šanci na trvalé vyléčení (7, 8, 9).
SOUBOR PACIENTŮ
Za sledované období v letech 1998–2021 bylo na naší klinice diagnostikováno a léčeno 120 pacientů s nádorovým postižením varlat a paratestikulárních tkání ve věku 0–19 let. Z tohoto souboru mělo 96 pacientů primární nádor testis, 24 pacientů mělo postižení nebo infiltraci varlete jiným primárním zhoubným onemocněním (infiltrace varlete při akutní leukemii, infiltrace non-Hodgkinovým lymfomem, rhabdomoysarkomem nebo pseudosarkomatózní proliferací) a 9 pacientů mělo paratestikulární rhabdomyosarkom. Do předkládané retrospektivní analýzy nejsou zahrnuti pacienti s metastatickým postižením varlete a pacienti s paratestikulárním rhabdomyosarkomem.
Z 96 primárních nádorů varlat mělo 89 pacientů germinální typ nádoru, 6 pacientů mělo stromální typ nádoru (3× nádor ze Sertoliho buněk, 2× juvenilní granulosa cell tumor a 1 pacient měl nádor z Leydigových buněk). Jeden pacient byl diagnostikován s primárním non‑Hodgkinovým lymfomem varlete. Převažovalo postižení pravého varlete u 51 pacientů, 43 chlapců mělo postiženo levé varle, v 1 případě byl nádor bilaterální a v 1 případě šlo o metachronní nádor v kontralaterálním varleti. Diagnóza byla stanovena na základě klinického a palpačního vyšetření skrota, zobrazovacích vyšetření (ultrazvukového vyšetření skrota, CT plic a břicha) a nádorových markerů AFP, β HCG a LDH. U pacientů s pozitivním β HCG jsme v rámci vstupních vyšetření doplnili i MRI mozku pro riziko CNS metastáz u choriokarcinomu (Tab. č. 1).
Tab. 1. Postižení varlat v onkologii (primární nádory i metastatické postižení)
Tab. 1. Testicular tumors in oncology (primary tumors and metastatic spread)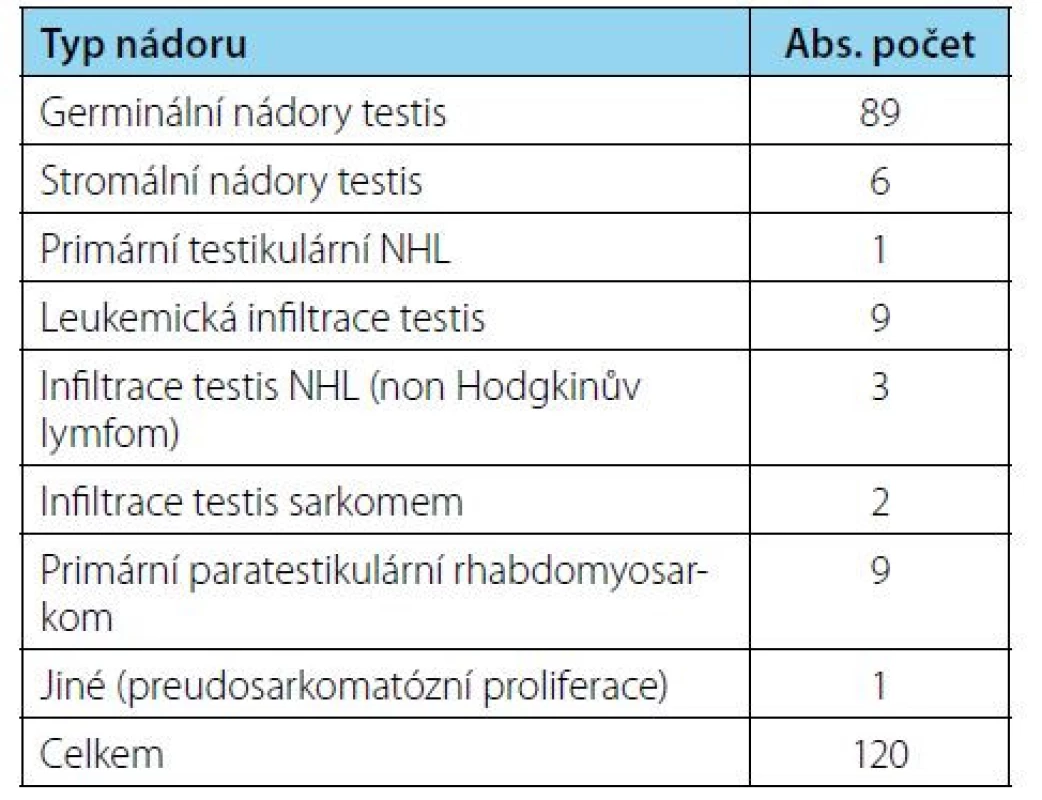
Stran rizikových nebo predispozičních faktorů jeden pacient měl gonadální dysgenezi v rámci hermafroditismu, ani jeden pacient s germinálním nádorem varlete neměl pozitivní rodinnou anamnézu s příbuzným v 1. linii s germinálním nádorem. Z dalších rizikových faktorů jsme u 5 pacientů detekovali retenci postiženého varlete v dětském věku. Dystrofické mikrokalcifikace byly detekovány u 12 pacientů, 11 pacientů mělo přítomnou GCNIS (Germ Cell Neoplasia In Situ) a u 6 pacientů byla histopatologicky potvrzena přítomnost mikrokalcifikací a GCNIS. Devět pacientů mělo diagnostikovanou vrozenou vývojovou vadu, z toho u 3 pacientů se jednalo o vícečetné vývojové vady. Nejčastější vrozené vývojové vady byly cévní – arteria renalis duplex. Z dalších vrozených vad byla přítomna polydaktylie, ageneze ledviny nebo hypospadie. U 6 pacientů byla přítomna varikokéla a/nebo hydrokéla.
U pacientů se stromálním nádorem varlete a u pacienta s primárním non‑Hodgkinovým lymfomem varlete jsme nedetekovali žádné rizikové faktory nebo hereditární predispozici.
U pacientů s germinálním typem nádoru se v 58 případech jednalo o maligní typ nádoru, ve 31 případech byl diagnostikovaný zralý teratom, ve většině případů (29 pacientů) prepubertálního typu. Podtyp germinálního nádoru byl signifikantně asociován s věkem pacienta. V dětské onkologii je důležitým faktorem u gonadálních nádorů posuzování nástupu puberty. Arbitrární hranice začátku puberty je dovršení 11 let věku. Z našeho souboru 96 pacientů s primárním nádorem varlete bylo 34 chlapců v prepubertálním věku (0–11 let), z nich 12 bylo pod 1 rok věku. Celkem 62 chlapců bylo v pubertálním a postpubertálním věku (pubertální věk, 11–15 let 24 chlapců, 38 pacientů starších 15 let). U prepubertálních chlapců dominoval prepubertální zralý teratom, u nejmladší věkové skupiny pod 5 let byl vrchol výskytu čisté formy nádoru ze žloutkového váčku (yolk sac tumor). U chlapců ve věkové skupině 11–15 let ještě převažoval zralý teratom prepubertálního a ve 2 případech postpubertálního typu, zatím co u skupiny adolescentů starších 15 let výrazně převládly smíšené germinální nádory a embryonální karcinom. Seminom byl diagnostikován pouze u 2 adolescentních pacientů (Obr. 1).
Obr. 1. Typ germinálního nádoru dle věku pacienta
Fig. 1. Type of germ cell tumor according to age of patient
Pacienti se stromálním typem nádoru varlete byli většinou mladší 10 let, 2 pacienti s juvenilním granulosa cell tumorem byli mladší 5 let a pacient s primárním non-Hodgkinovým lymfomem varlete měl 9 let v čase diagnózy.
Rozsah onemocnění v čase diagnózy, přítomnost metastáz a klinické stadium se rovněž lišily dle věku pacientů. Lokalizovanou nemoc měli všichni prepubertální pacienti. Se zvyšujícím věkem se zvyšoval i počet pacientů s lokálně pokročilou a metastatickou nemocí. U adolescentů starších 15 let mělo přítomné vzdálené metastázy 17 pacientů. Nejčastěji byly metastaticky postiženy retroperitoneální lymfatické uzliny, plíce, mediastinální lymfatické uzliny nebo mozek. Metastatické postižení jater bylo dokumentováno u 1 pacienta při metastatické pozdní progresi (Obr 2).
Obr. 2. Klinické stadium dle věku pacienta
Fig. 2. Clinical stage according to age of patient
Všichni pacienti se stromálním nádorem testis měli lokalizovanou nemoc.
U všech 96 pacientů s primárním nádorem varlete proběhla chirurgická léčba. Radikální orchiektomie byla provedena u 81 pacientů. Orgán záchovná operace (Testis Sparing Surgery – TSS) byla provedena u 15 pacientů, 14 pacientů bylo prepubertálních a 1 pacient byl v adolescentním věku. U všech pacientů byla TSS indikována na základě typického ultrazvukového nálezu, negativních hodnotách sérových nádorových markerů a benigní rychlé histologii. Operace reziduální nádorové masy u metastatických pacientů po ukončení adjuvantní chemoterapie proběhla u 9 pacientů bez ohledu na hladinu nádorových markerů (3× resekce reziduálních plicních metastáz, 6× resekce reziduální masy v retroperitoneu). U 7 pacientů s reoperací rezidua byly histologicky potvrzeny struktury zralého teratomu nebo fibrotická tkáň, pouze u 2 pacientů byly přítomny známky vitálního nádoru. U žádného pacienta nebyla indikována a provedena retroperitoneální disekce lymfatických uzlin (RPLND).
Adjuvantní chemoterapie byla indikována dle histologického typu nádoru, klinického stadia, věku pacienta, dynamiky poklesu nádorových markerů a zařazení do rizikové skupiny dle příslušných doporučení platných v dětské onkologii v čase diagnózy. Watch and wait strategie bez adjuvantní léčby byla indikována až na jednu výjimku (yolk sac tumor II. klinického stadia) u všech prepubertálních pacientů, u 14 pacientů pubertálního věku a u všech pacientů se stromálním typem nádoru. Adjuvantní chemoterapie na báze cisplatiny byla indikována u 1 prepubertálního pacienta s yolk sac nádorem, 43 pubertálních a adolescentních pacientů s germinálním nádorem. Intenzitu a délku chemoterapie určovalo zařazení do rizikové skupiny iniciálně dle COG klasifikace (Childrens Oncology Group), později dle IGCCC klasifikace (International Germ Cell Cancer Consensus Classification). V průběhu sledovaného období byly dle míry rizika použita tři léčebná schémata – standardní BEP, compressed BEP s redukovanými dávkami cytostatik (bleomycin pouze den 1, etoposid a cisplatina 3 dny) a C‑BEP pro nádory vysokého rizika s přidáním cyklofosfamidu. U 2 pacientů s přítomnými známkami vitálního nádoru při reoperaci reziduální nádorové masy po chemoterapii byla použita léčba 2. linie v kombinaci TIC. Žádný pacient nebyl léčen radioterapií nebo biologickou léčbou či imunoterapií.
VÝSLEDKY
Všech 89 pacientů s germinálním nádorem varlete dosáhlo klinickou kompletní remisi nemoci. Dva pacienti s přítomným vitálním reziduálním nádorem po ukončení léčby 1. linie dosáhli klinické remise až po léčbě 2. linie. U 1 pacienta se zralým prepubertálním teratomem po TSS došlo k nárůstu metachronního maligního smíšeného germinálního nádoru v kontralaterálním varleti 7,4 roku od primární diagnózy. Jeden pacient rozvinul pozdní metastatickou progresi smíšeného germinálního nádoru (metastázy do jater, retroperitoneálních uzlin, hilových plicních uzlin a plic) po 3,1 roku a pacient záhy exitoval pod obrazem jaterního selhání. Všichni ostatní pacienti žijí v kompletní remisi. Pětileté celkové přežití (Overal Survival, OS) je 98,7 %, pětileté přežití bez události (Event Free Survival, EFS) je 98,7 % (Obr. 3).
Obr. 3. Křivky celkového přežití a přežití bez události
Fig. 3. Overall survival and event free survival curves
Pacient s primárním testikulárním non‑Hodgkinovým lymfomem byl po radikální orchiektomii léčen kombinovanou chemoterapií dle protokolu NHL BFM 2012, rameno R1 a dosáhl kompletní remise nemoci. Pacienti se stromálním testikulárním nádorem jsou všichni v kompletní remisi bez nutnosti podání adjuvantní chemoterapie.
Pacienti po ukončení léčby zůstávají dlouhodobě ve sledování onkologa a v multioborovém sledování dle příslušných doporučení i po dosažení dospělého věku. Medián doby sledování je 11,5 roku. U 11 pacientů vysokého rizika byly diagnostikovány pozdní následky ve formě nefrotoxicity gr. I a II, ototoxicity gr. II a rovněž poruchy fertility a spermiogeneze. Plicní toxicita byla potvrzena u dvou pacientů. Rovněž psychické poruchy ve smyslu depresí, karcinofobie, pocitů méněcennosti a problémů navázat partnerský vztah byly diagnostikovány u dvou pacientů. Jednomu pacientovi se narodil zdravý syn. U většiny pacientů předchozí onkologická diagnóza a léčba zásadně neovlivnila výběr školy, povolání a profesionální uplatnění.
DISKUZE
Nádory varlat patří v dětské onkologii mezi vzácné nádory. Převážnou většinu tvoří germinální nádory (cca 98 %), jenom asi 2 % tvoří nádory stromální. Křivka incidence germinálních nádorů varlat je bimodální, s prvním menším vrcholem ve věku 0–4 roky a druhým vrcholem v období dospívání. U adolescentů jsou testikulární germinální nádory (TGCT) nejčastějším solidním nádorem vůbec. Tato epidemiologická data rovněž potvrzuje i analýza našeho souboru (3, 4, 6, 7, 8, 10) (Obr. 4).
Obr. 4. Testikulární nádory u dětí a dospívajících dle věkových skupin v ČR
Fig. 4. Age distribution of testicular tumors in children and adolescents in Czech republic
Dle WHO 2016 se klasifikace TGCT dělí na dvě zásadní skupiny – typ I TGCT, který není asociován s GCNIS. Do této skupiny patří prepubertální teratom a čistá forma yolk sac tumoru, teda TGCT vyskytující se dominantně v útlém dětském věku. Druhou skupinu – typ II TGCT vyrůstající na bázi GCNIS, tvoří většinou nádory typické pro postpubertální, adolescentní a později dospělý věk (embryonální karcinom, smíšené germinální nádory, postpubertální teratom, choriokarcinom a seminom). Věk je teda u TGCT i z hlediska patogeneze velmi důležitý prediktivní faktor. Věkově specifická distribuce histologických typů germinálních nádorů je patrná i v našem souboru s převahou zralých teratomů a čisté formy yolk sac nádoru u nejmenších dětí a převahu smíšených germinálních nádorů u dospívajících chlapců (3, 7, 8, 10, 11, 12, 13, 14, 15). I když etiologie TGCT není přesně známá, jsou známé faktory zvyšující riziko vzniku testikulárního nádoru u mladých chlapců. Mezi známé rizikové faktory patří kryptorchismus, pozitivní rodinná anamnéza a nádor varlete u příbuzných 1. linie (otec, bratr), kontralaterální nádor varlete, vrozené vývojové vady urogenitálního systému, dysgenetické gonády, hypogonadismus a infertilita (např. u Klinefelterova syndromu). Diskutuje se o vlivu prenatálních faktorů in utero (kouření matky v graviditě, vliv endo a exogenních estrogenů, malnutrice matky v průběhu gravidity a porucha placentární homeostatické kapacity, porodní hmotnost pod 3 000 gramů). Faktory zevního prostředí nemají u nádorů varlat u dětí a dospívajících zásadní roli. V naše souboru jsme ani u jednoho pacienta nepotvrdili testikulární nádor u příbuzných 1. linie, pouze pět pacientů mělo nádor v retinovaném varleti. Nejčastější byly vrozené vývojové vady, především cévního systému (3, 4, 7, 9, 10, 12, 15, 16, 17, 18).
Základem léčby nádorů varlat je chirurgická léčba. Operační postup určuje nález na zobrazovacích vyšetřeních, předoperační sérové hladiny nádorových markerů a věk pacienta. Standardním operačním postupem je radikální ingvinální orchiektomie (RIO). Transskrotální přístup (biopsie nebo skrotální orchiektomie) je považován za porušení standardních postupů. Orgán záchovná operace ingvinálním přístupem – testis sparing surgery (TSS) je v současnosti možná za přesně určených podmínek. TSS lze provést u prepubertálních chlapců s negativními hodnotami sérových nádorových markerů, typickým obrazem benigního zralého teratomu na ultrazvuku s Dopplerem (dobře ohraničené hypoechogenní ložisko, nízká vaskularizace, cystický charakter s okolními hyperechogenními ložisky, kalcifikace +/-). Doporučuje se provést peroperační rychlou histologii. V předchozích letech byla u každého chlapce s nádorem varlete, včetně zralého teratomu, indikována RIO, pokud se klinicky nebo rychlou histologií prokázala hormonální pubertální aktivace. I dnes je u dospívajících postpubertálních pacientů TSS stále kontroverzní, především z rizika vysoké incidence GCNIS. Vzácně lze zvažovat TSS u postpubertálních chlapců v případě malého nádoru pod 2 cm, ultrazvukového obrazu typického pro benigní nádor, negativních nádorových markerů, bilaterálního synchronního nebo metachronního TGCT nebo nádoru v solitárním varleti. Peroperační rychlá histologie je u postpubertálních pacientů klíčová (3, 5, 7, 11, 19). V našem souboru bylo možné provedení TSS u 15 pacientů (14,4 %) za dodržení výše uvedených podmínek, pouze dva pacienti byli postpubertální.
Disekce retroperitoneálních LU (RPLND) není v dětském věku u prepubertálních pacientů doporučena pro pozdní morbiditu. U postpubertálních pacientů ji lze zvažovat v případě přetrvávání reziduální masy po chemoterapii, i když se v dětské onkologii pořád preferuje pouhá excize reziduálního nádoru (3, 6, 7, 11, 19). V našem souboru jsme RPLND neindikovali ani u jednoho pacienta bez ohledu na věk.
Hodnocení rozsahu nemoci po operaci (vstupní staging) se může lišit u prepubertálních a postpubertálních pacientů. Záleží na použití pediatrické klasifikace nebo klasifikace TNM/AJCC onkologie dospělého věku. U prepubertálních pacientů je rozsah nemoci hodnocen dle COG klasifikace do čtyř klinických stadií (stadium I – lokalizovaná nemoc ohraničena na varle, obaly varlete intaktní, N0; stadium II – infiltrovány/porušeny obaly varlete, pozitivní angioinvaze, porušení stěny skrota, N0; stadium III – přítomné metastázy v regionálních LU nad 2 cm; stadium IV – vzdálené metastázy). U postpubertálních pacientů lze použít COG klasifikaci, ale v současnosti se již častěji používá klasifikace dle TNM/AJCC. Rovněž klasifikace rizikových skupin dle IGCCC se používá pouze u pacientů starších 11 let (3, 5, 15). Při hodnocení klinického stadia u vlastního souboru pacientů jsme použili pediatrickou COG klasifikaci.
Principy léčby TGCT u dětí a adolescentů historicky vycházely ze zkušeností onkologie dospělého věku. Zavedením efektivní léčby na bázi cisplatiny se zařadily TGCT mezi kurativní nádory. Indikací chemoterapie v léčbě nádorů varlat u dětí a dospívajících byl histologicky potvrzen maligní typ nádoru, rozsah nemoci (klinické stadium), věk pacienta a dynamika poklesu nádorových markerů. U malých dětí a prepubertálních pacientů nízkého rizika s poklesem sérových hladin nádorových markerů po operaci dle nomogramu je postačující pouze sledovat pacienta (watch and wait strategie) bez adjuvantní léčby. Historicky pubertální pacienti a adolescenti s nádory nízkého rizika nebo s prolongovaným poklesem nádorových markerů absolvovali tři cykly adjuvantní chemoterapie v kombinaci compressed BEP. Adolescenti s postpubertálním teratomem se rovněž léčili stejnou kombinací (3). Tato strategie se během let měnila a v současnosti všichni pacienti nízkého rizika s nádorem klinického stadia IA, IB, IS dle TNM a klinického stadia I dle COG jsou bez ohledu na věk pouze sledováni (3, 5, 7) (Tab. 2).
Tab. 2. Přehled léčebných schémat 1. linie u germinálních nádorů varlat
Tab. 2. Overveiw of the 1st line treatment regimens for testicular germ cell tumors
I když je pětileté přežití TGCT dosahující 97 % excelentní, problémem zůstávají pacienti s metastatickým a/nebo rekurentním germinálním nádorem. Iniciální snahou u pacientů vysokého rizika byla intenzifikace léčby buď přidáváním dalších léků (např cyklofosfamidu v schématu C‑BEP), nebo různé kombinace chemoterapie (TIC, VeIP, PEI, ICE) a vysoce dávkovaná chemoterapie s následným podáním autologních kmenových hematopoetických buněk. Dosažený terapeutický efekt nebyl zásadní, ovšem výrazně vyšší byla toxicita (3, 8).
Problémem byla nejenom akutní toxicita, ale především pozdní komplikace protinádorové léčby. Vzhledem k faktu, že se jedná o mladé pacienty s předpokládanou délkou života více než 50 let, kteří mají celý svůj produktivní život před sebou, nejsou otázky pozdních následků léčby a kvality života zanedbatelné. Je prokázáno, že dlouhodobě přežívající pacienti po léčbě TGCT mají výrazně vyšší morbiditu (nefrotoxicita, pneumotoxicita, ototoxicita, periferní polyneuropatie, psychologické problémy, deprese, metabolický syndrom, infertilita a v neposlední míře i sekundární malignity) ve srovnání se stejně starou populací. Proto je v dětské onkologii posledních let snaha o redukci indikací a podávání adjuvantní chemoterapie, snížení intenzity protinádorové léčby při zachování dosavadních léčebných výsledků (6, 8, 12, 15, 20, 21, 22). Pro dlouhodobě přežívající dětské onkologické pacienty je doporučeno ideálně celoživotní sledování. Dětští pacienti po léčbě testikulárního nádoru jsou v našem souboru sledováni po dobu 5 měsíců–23,5 roku s mediánem 11,5 roku. Pro tyto pacienty platí spíše pediatrická doporučení než ESMO doporučení platná v dospělé onkologii. V našem souboru u 11 pacientů byla prokázána pozdní orgánová toxicita (plicní, nefrotoxicita, ototoxicita) a poruchy spermiogramu. Tři pacienti mají psychické problémy vyžadující péči psychologa a/nebo psychiatra a léčbu antidepresivy (Tab 3). TGCT jsou velmi heterogenní skupinou nádorů nejen stran histologických typů, věkově specifické distribuce typů TGCT, jejich biologického chování, ale i stran patogeneze a chemosenzitivity. Méně než 10 % pacientů s TGCT je cisplatina rezistentních. Při hledání důvodů chemorezistence a efektivní léčebné strategie se pozornost zaměřila na molekulární charakteristiky TGCT. Klasifikace WHO 2016 usnadňuje hledání možností identifikace nových biomarkerů a prediktorů biologického chování TGCT (3, 10, 14).
Tab. 3. Současné doporučené postupy léčby u geminálních nádorů varlat u dějí a dospívajících
Tab. 3. Currently recommended criteria for testicular germ cell tumors in children and adolescents
TGCT jsou charakterizovány přítomností častých chromozomálních anomálií, ale nízkým počtem somatických mutací, a to u všech typů TGCT (mutační nálož je pouze kolem 0,5 mutací /1 megabázi), mikrosatelitní instabilita je prakticky negativní. Profil chromozomálních změn je věkově specifický. Nejčastějším a typickým znakem TGCT kromě prepubertálních TGCT a seminomů je gain chromozomu 12p v podobě overexprese izochromozomu 12p. Zvýšení počtu kopií izochromozomu 12p hraje roli v transformaci preinvazivního GCNIS na invazivní nádor a v klinické praxi v dětské onkologii pomáhá odlišit prepubertální typ teratomu (typ I, GCNIS non‑related) od postpubertálního teratomu (typ II, GCNIS related) (11 15). Nádory s více než třemi kopiemi isochromozomu 12p jsou asociovány s horší prognózou (4, 8, 12, 14). Prepubertální teratom je diploidní, prakticky všechny ostatní typy TGCT u dětí jsou aneuploidní s výjimkou seminomu, který je hypertriploidní. Prepubertální teratom nemá žádné somatické molekulárně genetické změny. Ostatní typy TGCT mají typické změny popsané na chromozomu 1, 4, 6, 11, 16, 20. TGCT v dětském věku mají nejčastěji anomálie chromozomu 1, 3 a 6. Ztráta distálního raménka 1p (delece 1p) je u dětských embryonálních nádorů (Wilmsův tumor, neuroblastom) asociována s horší prognózou. Předpokládá se, že tumor supresorické geny lokalizované na distálním úseku chromozomu 1 mohou mít podíl na schopnosti tkání podstoupit terminální diferenciaci. Proto lze deleci 1p považovat u dětských TGCT za prediktor klinického chování. Delece 1p byla nalezena u více než 50 % dětských nádorů ze žloutkového váčku (4, 6, 10, 14, 23, 24, 25).
Změny na dlouhém raménku chromozomu 6 (delece 6q) byly nalezeny u více typů nádorů. U dětských nádorů ze žloutkového váčku byla prokázána klonální delece distálního raménka 6q u 72 % vzorků. V tomto regionu je lokalizován gen růstového regulátoru IGF2R, jehož mutace může mít svou roli v patogenezi nádorů varlat (8, 12, 14).
Genetické studie navíc mohou pomoci predikovat toxicitu chemoterapie, např. prokázán polymorfismus v genu GSTP1 je spojován se zvýšeným rizikem periferní polyneuropatie a ototoxicity (10, 12).
Nicméně v klinické praxi v dětské onkologii u TGCT nejsou biologické studie a celoexomové sekvenování standardním postupem a součástí vyšetřovacích algoritmů. I když jsou studovány jako možné prediktivní a prognostické faktory, zatím nejsou zahrnuty do stratifikačních kritérií přiřazujících pacienty do rizikových skupin.
U našeho souboru testikulárních nádorů jsme kromě přítomnosti isochromozomu 12p další biologické studie neindikovali.
ZÁVĚRY
Nádory varlat jsou u prepubertálních dětí vzácné, jejich incidence stoupá s věkem. U adolescentů jsou vůbec nejčastějším zhoubným nádorem. Převážnou většinu tvoří germinální nádory, které představují velmi heterogenní skupinu stran epidemiologie, patogeneze, histologického typu a biologického chování. Distribuce histologických typů germinálních nádorů je u mladé generace věkově specifická. U prepubertálních pacientů převládají nádory benigní, s maligních typů dominuje yolk sac tumor. U adolescentů převažují nádory s maligním potenciálem, většinou se jedná o smíšené germinální nádory. Prognóza pacienta závisí od včasné diagnózy, rozsahu nemoci a dynamiky poklesu nádorových markerů. Zlatým standardem léčby je radikální orchiektomie, TSS je možná u přesně definované skupiny prepubertálních chlapců. Adjuvantní chemoterapie výrazně zlepšila prognózu TGCT. I když zařazujeme testikulární nádory mezi kurativní typy nádorů, nezanedbatelná je toxicita a pozdní následky protinádorové chemoterapie, které mohou výrazně ovlivnit následnou morbiditu a kvalitu života pacienta. Kromě deeskalace délky a dávkové intenzity chemoterapie v dětské onkologii při udržení dosavadních výsledků léčby má význam i zlepšení zdravotní osvěty u adolescentů, pravidelné preventivní prohlídky, a tím snížení počtu pacientů s pokročilým onemocněním.
Došlo: 16. 2. 2022
Přijato: 12. 4. 2022
Korespondenční adresa:
MUDr. Viera Bajčiová, CSc.
Klinika dětské onkologie FN Brno
Černopolní 9 662 53 Brno
e‑mail: bajciova.viera@fnbrno.cz
Střet zájmů: Žádný.
Zdroje
1. Dušek L, Abrahámová J, Lakomý R, et al. Multivariate analysis of risk factors for testicular cancer: a hospital‑based case‑control study in the Czech republic. Neoplasma. 2008; 55(4): 356–68.
2. Krejčí D, Zapletalová M, Svobodová I, et al. Childhood cancer epidemiology in the Czech republic (1994–2016). Cancer Epidemiol. 2020; 69 : 101848. doi:10.1016/canep.2020.101848.
3. Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patients. Semin Ped Surg. 2021; 30 : 151079.
4. Kusler KA, Poynter JN. International testicular cancer incidence rates in childen, adolescents an young adults. Cancer Epid. 2018; 56 : 106–111.
5. Stein R, Quaedackers J, Bhat NR, et al. EAU‑ESPU pediatric urology guidelines on testicular tumors in prepubertal boys. J Pediatr Urol. 2021 : 17 : 529–533.
6. Bajčiová V. Nádory varlat u dětí, adolescentů a mladých dospělých. Rozdíly v biologii napříč věkovým spektrem. Onkológia. 2007; 2(6): 380–384.
7. Lin X, Wu D, Zheng N, et al. Gonadal germ cell tumors in children. A retrospetive review of a 10-year single‑center experience. Medicine. 2017; 96 : 26–29.
8. Batool A, Karimi N, Wu XN, et al. Testicular germ cell tumor: a comprehensive review. Cell Molec Life Scien. 2019; doi.org/10.1007/s00010-019-03022-7.
9. Bajčiová V. Možnosti prevence a význam časné diagnostiky nádorů varlat u dětí a dospívajících. Current Media. 2016 : 29–34.
10. Lobo J, Gillis JM, Jerónimo C, et al. Human germ cell tumors are developmental cancers: impact of epigenetics on pathobiology and clinic. Int J Mol Sci. 2019; 20 : 258. doi:10.3390/ikms20020258.
11. Kooij CD, Hulsker CCC, Kraendonk MEG, et al. Testis sparing surgery in pediatric testicular tumors. Cancers. 2020; 12 : 2867. doi: 10.3390/ cancers 12102867.
12. Litchfield K, Levy M, Huddart RA, et al. The genomic landscape of testicular germ cell tumours: from susceptibility to treatment. Na Rev Urol. 2016; 13(7): 409–419.
13. Moch H, Cubilla AL, Humphrey PA, et al. The 2016 classification of tumours of the urinary system and male genital organs – part A: penile and testicular tumours. Eur Urol. 2016; 70 : 93–105.
14. Looijenga LHJ, Van der Kwast TH, Grignon D, et al. Report from the International Society of Urological Pathology (ISUP) Consultation Conference on Molecular Pathology of Urogenial Cancers. Am J Surg Pathol. 2020; 44: e66-e79.
15. Oldenburg J, Berney DM, Bokemeyer C, et al. Testicular seminoma and non‑seminoma: ESMO‑EURACAN clinical practice guideline for diagnosis, treatment and follow‑up. Ann Oncol. 2022; Jan 17: S0923-7534(22)00007-2.
16. Chieffi P. An up‑date on novel molecular targets in testicular gern cell tumors subtypes. Intractabl Rare Diseases Research. 2019; 8(2): 161–164.
17. McGlynn KA, Trabert B. Adolescent and adult risk factors for testicular cancer. Nat Rev Urol. 2014; 9(6): 339–349.
18. Elad D, Jaffa AJ, Grisaru D, et al. In utero programming of testicular cancer. J Dev Biol. 2021; 29 : 9(3). dpi:10.3390/jdb9030035.
19. Woo LL, Ross JH. Partial orchiectomy vs radical orchiectomy for pediatric testis. Transl Androl Urol. 2020; 9(5): 2400–2407.
20. Maroto P, Anguera G, Martin C. Long‑term toxicity of the treatment for germ cell cancer. A review. Crit Rew Oncol. 2018; 121 : 62-67.
21. Jovanovski A, Zugna D, Di Cuonzo D, et al. Quality of life among germ‑cell testicular cancer survivors: the effect of time since cancer diagnosis. Plos One. 2021; 16(20): e0258257. doi:org/10.1371/journal. pone.0258257.
22. DeSouza KW, Diniz dos Reis PE, Gomes IP. Campos de Carvalho E: Prevention strategies for testicular and penile cancer: an integrative review. Rev Esc Enferm USP. 2011; 45(1): 277–82.
23. Palmer RD, Foster NA, Vowler SL, et al. Malignant germ cell tumours of childhood: new associations of genomic imbalance. Br J Cancer. 2007; 96(4): 667–676.
24. Schneider DT, Schuster AE, Fritsch MK, et al. Genetic analysis of childhood germ cell tumors with comparative genomic hybridization. Klin Pediatr. 2001; 213(4): 204–211.
25. Zahn S, Sievers S, Alemazkour K, et al. Imbalances of chromozome arm 1p in pediatric and adult germ cell tumors are caused by true allelic loss: a combined comparative genomic hybridization and microsatellite analysis. Genes Chromos Cancer. 2006; 45(11): 995–1006.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2022 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Dynamická biopsie sentinelové uzliny a její role v invazivním stagingu u cN0 karcinomu penisu. Zkušenosti jednoho pracoviště za 10 let
- Klinicky manifestní nezánětlivá parauretrální cysta corpus spongiosum bulbární uretry
- Maligní solitární fibrózní tumor skrota
- Kavernózní lymfangiom nadledviny u mladé ženy
- Zdvojení močové trubice u dětí – tři případy
- Komplexní novinky v onkourologii – KNOU 2022
- Ohlédnutí za JEUS 2022
- EDITORIAL
- Urolitiáza v graviditě
- Dlouhodobé výsledky léčby testikulárních nádorů u dětí a dospívajících. Retrospektivní analýza souboru pacientů (1998–2021)
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zdvojení močové trubice u dětí – tři případy
- Klinicky manifestní nezánětlivá parauretrální cysta corpus spongiosum bulbární uretry
- Dynamická biopsie sentinelové uzliny a její role v invazivním stagingu u cN0 karcinomu penisu. Zkušenosti jednoho pracoviště za 10 let
- Maligní solitární fibrózní tumor skrota
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



