-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sledování a léčba pacientů po radikální prostatektomii s pozitivními okraji preparátu
Follow-up and treatment of patients following radical prostatectomy with positive surgical margins
Major statement:
The positive margins of the radical prostatectomy specimen is an unfavorable prognostic sign which is the indication of adjuvant treatment. Nearly a third of patients with such a finding, however, are alive with no evidence of disease and do not need further treatment.Aim:
The finding of positive surgical margins obtained in radical prostatectomy is an adverse prognostic factor that is usually an indication for adjuvant therapy. The study focused on long-term results of follow-up and treatment in patients after radical prostatectomy with positive surgical margins. The aim of the study was to evaluate what proportion of such patients can be spared subsequent treatment with known adverse effects.Patient cohort:
Of the 92 patients who underwent radical prostatectomy and had a finding of positive surgical margins, 72 were followed in the long term and evaluated. An adverse histological finding, high level of PSA nadir, and PSA growth were indications for further treatment – adjuvant radiotherapy, androgen deprivation therapy, or salvage radiotherapy. By contrast, a low PSA level in the long term allowed for watchful waiting and a mere surveillance of the patients. The results were evaluated statistically by using a nonparametric Mann-Whitney test.Results:
The patient cohort was divided into four groups according to treatment strategy: adjuvant androgen deprivation therapy (ADT), adjuvant radiotherapy (ART), salvage radiotherapy (SRT), and watchful waiting (WW). The efficacy of delayed treatment with salvage radiotherapy was similar when compared with adjuvant therapy; with a follow-up with a median of 86 months in the ART group and 59.7 months in the SRT group, the median of the last PSA level was 0.008 and 0.010 ng/ml, respectively (p = 0.7434). Failure of radiotherapy occurred in 13.6% and 10% of patients in the ART and SRT groups, respectively. The safety of the watchful waiting strategy in the WW group is demonstrated by the median of the last PSA level of 0.029 ng/ml (p = 0.1703) with a median follow-up of 58.5 months.Conclusion:
The presence of positive surgical margins after radical prostatectomy may not always indicate the need for further treatment. If administered in all the patients in the cohort, adjuvant therapy would have been unnecessary in 34.4%.KEY WORDS:
Prostate cancer, radical prostatectomy, adjuvant radiotherapy, salvage radiotherapy.
Autoři: Ladislav Jarolím; Štěpán Veselý; Marek Schmidt; Kateřina Dušková; Joana Do Carmo; Vojtěch Novák; Marek Babjuk
Působiště autorů: Urologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Ces Urol 2017; 21(2): 139-146
Kategorie: Originální práce
Souhrn
Hlavní stanovisko práce:
Nález pozitivních okrajů preparátu získaného při radikální prostatektomii je nepříznivým prognostickým faktorem, který bývá indikací adjuvantní léčby. Téměř třetina nemocných s takovým nálezem však žije bez evidence onemocnění a další léčbu nepotřebuje.Cíl:
Nález pozitivních okrajů preparátu získaného při radikální prostatektomii je nepříznivým prognostickým faktorem, který bývá indikací adjuvantní léčby. Studie byla zaměřena na dlouhodobé výsledky sledování a léčby pacientů po radikální prostatektomii s pozitivními okraji preparátu. Cílem studie bylo zhodnotit, jak velký podíl takových pacientů může být ušetřen následné léčby se známými nežádoucími vedlejšími účinky. Soubor pacientů: Z 92 pacientů po radikální prostatektomii s nálezem pozitivních okrajů preparátu bylo dlouhodobě sledováno a hodnoceno 72 pacientů. Nepříznivý histologický nález, vysoká hodnota nadiru PSA a růst PSA byly indikací k další léčbě - adjuvantní radioterapii, androgen deprivační léčbě, nebo salvage radioterapii. Dlouhodobě nízká hodnota PSA naopak dovolovala vyčkávací taktiku a pouhé sledování pacientů. Statistické zhodnocení výsledků bylo provedeno pomocí neparametrického Mann‑Whitney testu.Výsledky:
Soubor pacientů byl rozdělen do čtyř skupin dle léčebné strategie: adjuvantní androgen deprivační léčba (ADT), adjuvantní radioterapie (ART), salvage radioterapie (SRT) a samotné sledování (WW). Účinnost odložené léčby pomocí salvage radioterapie byla ve srovnání s adjuvantní léčbou obdobná, při době sledování s mediánem ve skupině ART 86 měsíců a SRT 59,7 měsíců byl medián poslední hodnoty PSA 0,008 a 0,010ng/ml (p=0,7434). K selhání radioterapie došlo ve skupině ART u 13,6 %, u SRT u 10 % pacientů. Bezpečnost vyčkávací strategie ve skupině WW dokládá medián poslední hodnoty PSA 0,029ng/ml (p=0,1703) při mediánu doby sledování 58,5 měsíců.Závěr:
Přítomnost pozitivních okrajů preparátu radikální prostatektomie nemusí vždy znamenat potřebu další léčby. Aplikace adjuvantní léčby u všech pacientů sledovaného souboru by byla ve 34,4 % nadbytečná.Klíčová slova:
Karcinom prostaty, radikální prostatektomie, adjuvantní radioterapie, salvage radioterapie.ÚVOD
Pozitivní chirurgické okraje znamenají přítomnost nádorových buněk na hranici preparátu prostaty. Pro lepší identifikaci okraje se často používá barvení preparátu tuší před jeho ponořením do fixačního roztoku. Je důležité, aby patolog explicitně přítomnost či nepřítomnost vyjádřil a vyvaroval se nejednoznačného popisu.
Nález pozitivních okrajů preparátu získaného při radikální prostatektomii je nepříznivým prognostickým faktorem, který představuje riziko ponechané části nádoru v okraji operačního pole a bývá indikací adjuvantní léčby. Předpokládaná nebo potvrzená přítomnost reziduálního onemocnění po radikální prostatektomii s kurativním záměrem je důvodem k indikaci další léčebné modality. Léčba pak může být zaměřená na tzv. lokální recidivu, na generalizaci, nebo na kombinaci obou možností.
V případě prokázané nebo předpokládané lokální recidivy se používá radioterapie zaměřená na zobrazitelné metastázy nebo na oblast předoperační lokalizace prostaty a na oblast spádové lymfatické drenáže.
Radioterapii lze aplikovat adjuvantně během šesti měsíců po operaci, tzn. jako sukcesivní součást radikální prostatektomie indikované pro riziko přítomnosti reziduálního onemocnění, nebo jako salvage, záchrannou terapii, indikovanou při průkazu reziduálního onemocnění. Adjuvantní radioterapie znamená využití další možnosti lokální kurativní léčby, přičemž její aplikace není podmíněna průkazem reziduálního lokálního onemocnění. Případná paralelní generalizace se adjuvantní radioterapií neovlivní. K radioterapii je možné se rozhodnout i po více než šesti měsících a indikovat salage radioterapii bez rizika prodlení. Salvage radioterapie je zaměřena na léčbu prokazatelné reziduální choroby s rizikem, že nemusí jít o lokální recidivu, nebo může být spolu s lokální recidivou přítomná i subklinická generalizace onemocnění. Salvage radioterapie pak ovlivní jen lokální progresi a prognózu onemocnění určí vzdálené metastázy, které se po salvage radioterapii projeví biochemickou nebo klinickou recidivou. Časná aplikace salvage radioterapie se opírá o předpoklad, že minimální lokální recidiva má větší šanci na vyléčení než onemocnění pokročilejší (1).
Při subklinické nebo zobrazitelné generalizaci se jako první v pořadí využívá systémová léčba, androgen deprivační terapie. Androgen deprivační léčba se také užívala jako adjuvantní léčba u pacientů s vyšším rizikem progrese, tedy s pozitivními okraji.
Stanovení léčebné strategie, výběr adekvátní léčby a její správné načasování je pro prognózu onemocnění zásadní. Léčbu lze nasadit bezodkladně po radikální prostatektomii, nebo lze zvolit vyčkávací strategii a léčbu přizpůsobit případným objektivním známkám remanentního onemocnění.
Cílem práce bylo ověřit, jak byla vyčkávací strategie v souboru nemocných s pozitivními okraji bezpečná a účinná ve srovnání s adjuvantní léčbou a jaký podíl pacientů může být ušetřen nadbytečné léčby se známými vedlejšími účinky, zejména signifikantními pozdními komplikacemi po adjuvantní radioterapii (2).
SOUBOR PACIENTŮ A METODY
Studie analyzuje výsledky sledování a léčby pacientů, kteří podstoupili radikální prostatektomii s nálezem pozitivních okrajů preparátu. Z 92 pacientů bylo dlouhodobě sledováno a hodnoceno 72 pacientů, 20 pacientů bylo předáno po radikální prostatektomii do péče ambulantních urologů. Sledování pacientů se z onkologického hlediska soustředilo na monitorování sérové hodnoty PSA po radikální prostatektomii (Immulite 2000 3rd Generation PSA, Siemens Medical, detekční limit 0,003 ng/ml). Nepříznivý histologický nález a vysoká hodnota nadiru PSA byla indikací k další léčbě – adjuvantní radioterapii nebo androgen deprivační léčbě. Nízké stacionární hodnoty dovolovaly vyčkávací taktiku a pouhé sledování pacientů, následný růst PSA byl indikací k salvage radioterapii. Adjuvantní radioterapie byla v této studii definována jako následná léčba započatá během šesti měsíců po radikální prostatektomii. Salvage radioterapie byla definována jako léčba započatá v době delší než šest měsíců po radikální prostatektomii u pacientů s minimálně třemi konsekutivními elevacemi PSA nad nadir měřenými ve tříměsíčních intervalech.
Soubor pacientů byl rozdělen do dvou skupin dle léčebné strategie po radikální prostatektomii: adjuvantní léčba a sledování. Adjuvantní léčba zahrnovala androgen deprivační léčbu (ADT), která byla zahájena jako časná u pacientů s rizikem progrese (včetně pozitivních okrajů), nebo u pacientů se suspektní subklinickou generalizací, a adjuvantní radioterapii u pacientů s předpokládaným reziduem v pánvi (ART). Pacienti, kteří měli po radikální prostatektomii dlouhodobě nízkou hodnotu PSA, byli jen sledováni (WW), v případě biochemické recidivy u nich byla indikována salvage radioterapie (SRT). Selhání radioterapie (RT) jsme definovali jako absenci poklesu PSA nebo novou elevaci nad hodnotu 0,2 ng/ml po dosažení nadiru PSA (3). Stejně jsme definovali i selhání androgen deprivační léčby. Statistické zhodnocení výsledků bylo provedeno pomocí neparametrického Mann‑Whitney testu.
VÝSLEDKY
Zastoupení kategorie pT zobrazuje tabulka 1.
Tab. 1. Počty pacientů dle kategorie pT – n (%) Tab. 1 Patients distribution according to category pT – n (%) 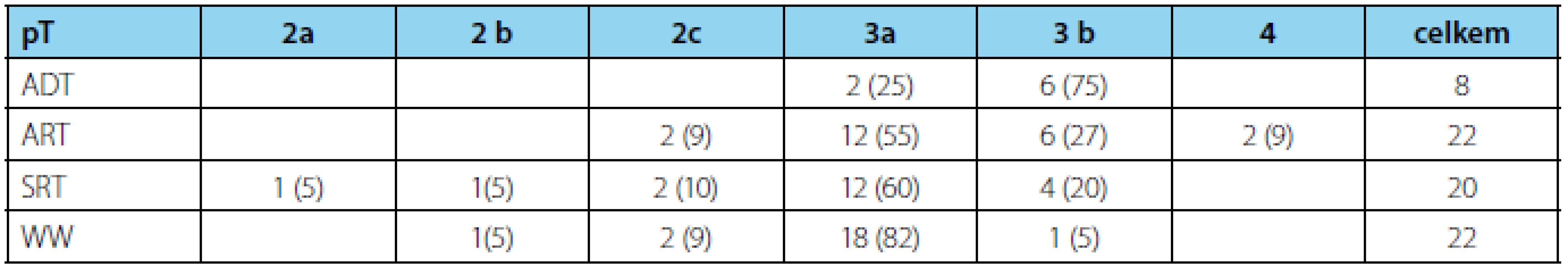
Ve všech skupinách převažuje kategorie pT3.
Délka pozitivních okrajů v jednotlivých skupinách se statisticky významně nelišila (p=0,258): ADT 1–4 mm, medián 2 mm, ART 1–10 mm, medián 4 mm, SRT 1–6 mm, medián 3,5 mm a WW 0,2–8 mm, medián 3 mm (Kruskal‑Wallis test).
Medián Gleasonova skóre (GS) definitivní histologie byl u všech pacientů 7 (tabulka 2). Medián hodnoty PSA u pacientů před adjuvantní androgen deprivační terapií byl 0,205 ng/ml, před adjuvantní radioterapií 0,155 a u pacientů před salvage radioterapií 0,104, přičemž medián intervalu mezi radikální prostatektomií a radioterapií byl u skupiny ART 4 měsíce a u skupiny SRT 17 měsíců.
Tab. 2. Počty pacientů dle Gleasonova skóre (GS) – n (%) Tab. 2 Patients distribution according to Gleason score (GS) – n (%) 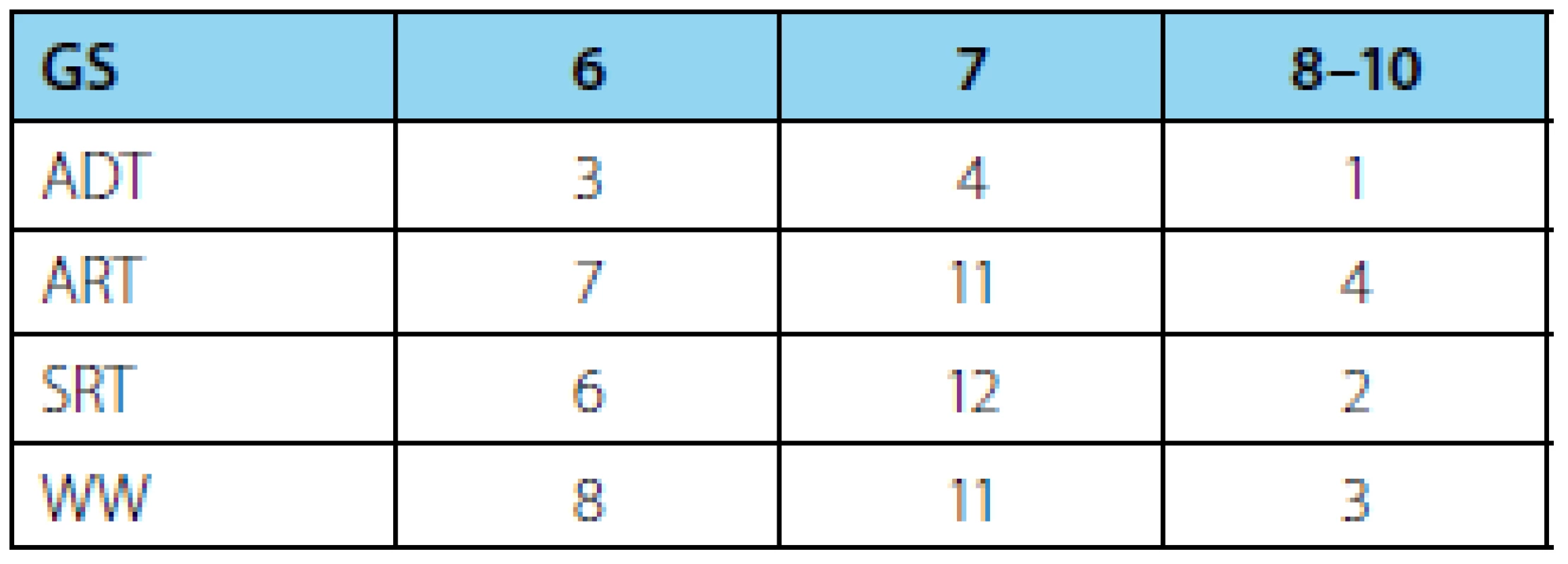
Medián celkové doby sledování po radikální prostatektomii byl u osmi pacientů ve skupině ADT s různými typy androgenní blokády 138 měsíců. Ve skupině ART byl medián celkové doby sledování 89,5 měsíců, ve skupině SRT 75,5 měsíce a WW 58,5 měsíce. Nabídka sekundární terapie progredujícím pacientům z WW ramene přirozeně zkracuje dobu sledování této skupiny.
Medián doby sledování po RT byl ve skupině ART 86 měsíců a SRT 59,5 měsíce. Hodnoty PSA měřené při posledních návštěvách se ve všech skupinách pohybovaly v tisícinách ng/ml, medián hodnoty byl ve skupině ADT 0,009 ng/ml, ve skupině ART 0,008 ng/ml, ve skupině SRT 0,010 ng/ml a ve skupině WW 0,029 ng/ml (p=0,1703).
Selhání adrogen deprivační léčby jsme pozorovali u dvou z osmi pacientů (25 %).
Účinnost odložené léčby pomocí salvage radioterapie byla ve srovnání s adjuvantní radioterapií obdobná, medián poslední hodnoty PSA 0,008 a 0,010 ng/ml (p=0,7434). Srovnali jsme četnost selhání RT v obou skupinách. Ve skupině ART jsme zaznamenali absenci poklesu PSA u dvou pacientů, u jednoho došlo k BR za 25 měsíců po RT (celkem 3 z 22, tzn. 13,6 %). Ve skupině SRT dospěli k biochemické recidivě dva pacienti za 83 a 32 měsíců po RT (2 z 20, tzn. 10 %). Ve skupině WW dospěl k BR jeden pacient (s transplantovanou ledvinou) 36 měsíců po radikální prostatektomii, za 63 měsíců po operaci dosáhl hodnotu PSA 0,485 ng/ml.
Ve skupině nemocných s vyčkávací strategií, kdy se indikovala RT až při elevaci PSA, došlo k selhání léčby u 3 ze 42 pacientů (7,1 %), ve skupině ART u dvojnásobně vyššího procenta (13,6 %) pacientů.
DISKUZE
Nález pozitivních okrajů preparátu získaného při radikální prostatektomii je nepříznivým prognostickým faktorem, který představuje riziko ponechané části nádoru v okraji operačního pole a bývá indikací adjuvantní léčby. Nález pozitivních okrajů je poměrně častý, udává se až v 68 % (4–6). Yee a spol. udávají četnost pozitivních okrajů 7,4 % (7). Přítomnost pozitivních chirurgických okrajů je samozřejmě vyšší u lokálně pokročilých nádorů, koreluje však i s mírou zkušeností operatéra. Zatímco se v letech 1987–1994 v souboru Hsu a spol. nacházely pozitivní okraje v 75 % a v letech 1995–1999 v 42 %, snížil se výskyt pozitivních okrajů u pacientů operovaných v letech 2000–2004 na 10 % (8). Eastham a spol. popsali 5x méně častý výskyt pozitivních okrajů u pacientů operovaných zkušenějšími urology (10 vs. 48 %) (9). Riziko recidivy po radikální prostatektomii je u pokročilých karcinomů významné zejména u nemocných s pozitivními okraji a pohybuje se mezi 30 % až 60 % (10). Na druhé straně jiné studie ukazují, že 50 % takových nemocných je bez progrese (11–14).
Remanentní nádorovou tkáň při pozitivních okrajích lze úspěšně likvidovat radioterapií. Srovnání efektu adjuvantní a salvage radioterapie je problematické. Adjuvantní radioterapie při minimálním reziduálním subklinickém onemocnění má příznivý efekt, podobně jako při časné salvage radioterapii bez morfologického průkazu metastáz, kdy jediným markerem přítomnosti reziduálního onemocnění je elevace minimální hladiny PSA. Na druhé straně aplikace salvage radioterapie při biopticky prokázané lokální recidivě s vysokou hodnotou PSA je spojena s vysokým rizikem neúspěchu pro možnou přítomnost současné generalizace. V takovém případě je výsledek salvage radioterapie ve srovnání s adjuvantní radioterapií horší. Navíc může být indikován k adjuvantní radioterapii pacient s histologicky nepříznivými známkami karcinomu, jako je třeba infiltrace váčků, který však nemusí mít reziduální onemocnění. Takový pacient by v budoucnu neprogredoval i v případě bez jakékoli terapie a vylepší celkové výsledky skupiny pacientů po adjuvantní radioterapii (1).
U pacientů s biochemickou recidivou (BR) po radikální léčbě se objeví klinicky prokazatelné onemocnění zřídka. Přestože je obvykle přirozený průběh recidivujícího karcinomu prostaty pomalý, může být někdy progrese rychlá a je indikována salvage terapie. Doba do BR, velocita PSA a čas zdvojnásobení hodnoty PSA jsou parametry, které jsou pro predikci dalšího průběhu užitečné. U pacientů s vysokým rizikem vzdálených metastáz a vhodných pro systémovou léčbu by měly být léze vizualizovány některým zobrazovacím vyšetřením. Transuretrální ultrasonografie má nízkou přesnost detekce recidivy. V časné fázi BR se může uplatnit multiparametrická nukleární magnetická rezonance (NMR). Konvenční zobrazovací metody, jako scintigrafie a počítačové tomografie (CT) se v časné fázi BR neužívají. Vyšetření pomocí pozitronové emisní tomografie (PET/CT) umožňuje měnit terapeutické strategie (od paliativní k léčení a naopak) asi u 20 % případů. V posledních letech se objevily příznivé zprávy o využití anti-1-amino - 2-[18 F] -fluorocyclobutane-1-carboxylic acid (anti-3-[18 F] FACBC) v detekci recidivy karcinomu prostaty (15).
Další důležitou roli v indikaci radioterapie i v hodnocení výsledků léčby hrají hodnoty PSA. Pacienti s pT3 a pozitivními chirurgickými okraji mohou profitovat z adjuvantní radioterapie. Retrospektivní analýzy adjuvantní radioterapie vs. salvage radioterapie ukazují na podobné onkologické výsledky, pokud je salvage radioterapie aplikována časně po objevení BR, tedy při hodnotách PSA do 0,5 ng/ml (16). Metaanalýza deseti retrospektivních studií ukázala zlepšení pětiletého přežívání bez BR u nemocných po časné salvage radioterapii oproti nemocným s hodnotou PSA před salvage radioterapií >0,5 ng/ml (17).
Karlin doporučuje nabídnout salvage radioterapii pacientům s GS 8–10 při nejnižších detekovatelných hodnotách PSA, dokonce 0,33 ng/ ml a méně. Pacienti s GS 7 a méně mají šanci být lépe stratifikováni a být sledováni opakovaným vyšetřením PSA, což může oddálit nebo zabránit potenciální toxicitě salvage radioterapie (18).
Salvage radioterapie při hodnotě PSA <0,5 – 0,6 ng/ml může nahradit masovou adjuvantní radioterapii, zvláště u extrakapsulární propagace nebo u „fokálních“ pozitivních chirurgických okrajů. Tento přístup by mohl uchránit minimálně 40–50 % pacientů, kteří jsou v současné době kandidáty adjuvantní radioterapie, zbytečné léčby (19). Ze 72 sledovaných pacientů naší studie bylo osm pacientů indikováno k paliativní ADT. Ze 64 pacientů, u kterých bylo možno uvažovat o kurativní radioterapii pro přítomnost pozitivních okrajů, nepodstoupilo 22 pacientů žádnou léčbu. Pokud by bylo podstoupilo všech 64 pacientů adjuvantní léčbu, 22 z nich, 34,4 %, by bylo ozářeno zbytečně.
Interval mezi radikální prostatektomií a radioterapií hraje důležitou úlohu. Zahájení adjuvantní radioterapie do pěti měsíců po radikální prostatektomii pro pT3 je dle výsledků publikovaných Kowalczykem spojena s nižší nádorově specifickou mortalitou. Pokud je časná adjuvantní radioterapie podána dříve než 3–4 měsíce po radikální prostatektomii, je rovněž sdružena s menším rizikem kostních příhod a menší potřebou androgen deprivační terapie (20). Multicentrická studie zahrnující 470 pacientů neprokázala superioritu časné salvage radioterapie indikované při BR 0,2 ng/ml ani adjuvantní radioterapie aplikované do čtyř měsíců po radikální prostatektomii (21).
Časnou salvage radioterapii jako lepší strategii než je adjuvantní radioterapie podporují nejsilnější data. Bylo prokázáno, že pro maximalizaci výsledků by salvage radioterapie měla být zahájena při nejnižších hodnotách PSA. Podobně to platí pro dávky >70 Gy cílené na lůžko po prostatě (22). V multicentrické studii se 472 pacienty publikované Brigantim byly jako rizikové faktory BR po salvage radioterapii identifikovány pT, GS a pozitivní chirurgické okraje (všechny s p≤0,04) (23). Podobně Kinoshita doporučuje pro výběr vhodného kandidáta salvage radioterapie zohlednit definitivní GS, nadir PSA a stav chirurgických okrajů, které představují nezávislé prediktory efektu salvage radioterapie (24). Guidelines EAU doporučují aplikovat salvage radioterapii v hodnotách PSA do 0,5 ng/ml (25). V naší studii z roku 2012 jsme prokázali, že aplikace savage radioterapie při hodnotách PSA do 0,2 ng/ ml měla 95% šanci na dlouhodobý úspěch, zatímco hodnoty PSA 0,2–0,3 ng/ml jen 55% šanci (1).
Nemocným s nepříznivými patologickými nálezy (pT3b, R1 a extraprostatická propagace) by měla být nabídnuta adjuvantní radioterapie a nemocným s BR nebo lokální recidivou bez průkazu generalizace by měla být nabídnuta salvage radioterapie. V diskuzi multidisciplinárního týmu s pacientem by měla být podrobně diskutována anamnéza pacienta, jeho hodnotová orientace, kvalita života a funkční stav, rizika možných krátkodobých a dlouhodobých vedlejších účinků radioterapie, stejně jako potenciální efekt radioterapie předcházející recidivě karcinomu (26).
V sestavě Simona a spol. byly nalezeny u 936 nemocných, kteří podstoupili radikální prostatektomii, pozitivní chirurgické okraje v 37 %, lokální recidiva u nich vznikla v 19 %. Pokud by se aplikovala adjuvantní radioterapie u všech pacientů s pozitivními chirurgickými okraji, bylo by 81 % z nich léčeno zbytečně (27). Podobné závěry učinili Lodde a spol., kdy v sestavě 486 nemocných po radikální prostatektomii pro tumor pT2–3 N0 M0 s pozitivními okraji definovali BR jako hodnotu PSA >0,3 ng/ml. U 75 % nemocných nebyla radioterapie během deseti let potřeba (28). V naší sestavě byl medián doby sledování pacientů bez potřeby radioterapie 58,5 měsíce s maximem 81 měsíců.
ZÁVĚR
Výsledky studie ukázaly, že aplikace adjuvantní radioterapie u všech pacientů po radikální prostatektomii s pozitivními okraji by byla u 34,4 % pacientů sledovaného souboru nadbytečná. Pacienty bylo možno bez rizika z prodlení pečlivě monitorovat a aplikovat radioterapii až při průkazu elevace PSA. Účinnost adjuvantní a salvage radioterapie byla obdobná, selhání adjuvantní radioterapie ve srovnání s vyčkávací strategií bylo dvojnásobně vyšší (13,6 vs. 7,1 %).
Došlo: 23. 3. 2017
Přijato: 12. 6. 2017
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Kontaktní adresa:
doc. MUDr. Ladislav Jarolím, CSc.
Urologická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 00 Praha 5
e-mail: ladislav.jarolim@lfmotol.cuni.cz
Zdroje
1. Jarolím L, Veselý Š, Babjuk M, et al. Časná salvage radioterapie po radikální prostatektomii indikovaná u pacientů s rostoucí hladinou PSA v hodnotách nižších, než je konvenční hranice biochemické recidivy 0,2 ng/ml. Ces Urol 2012; 16(2): 92–100.
2. Nohra J, Huyghe E, Soulie M, et al. Late severe complications (G3-4 RTOG) of 3D conformal adjuvant radiotherapy for prostate KC after radical retropubic prostatectomy. Eur Urol Suppl 2006; 5(2): 169.
3. Staník M, Doležel J, Čapák I, et al. Krátkodobé onkologické výsledky po radikální prostatektomii s rozšířenou pánevní lymfadenektomií a s nálezem uzlinových metastáz. Lze pomýšlet na úspěch bez systémové léčby? Ces Urol 2015, 19(2): 137–144.
4. Boccon‑Gibod L, Bertaccini A, Bono AV, et al. Management of locally advanced prostate cancer: a European Consensus. Int J Clin Pract 2003; 57(3): 187–194.
5. Bolla M, Collette L, Blank L, et al. Long‑term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360(9327): 103–106.
6. Gerber GS, Thisted RA, Chodak GW, et al. Results of radical prostatectomy in men with locally advanced prostate cancer: multi‑institutional pooled analysis. Eur Urol 1997; 32(4): 385–390.
7. Yee DS, Narula N, Amin MB, Skarecky DW, Ahlering TE. Robot‑assisted radical prostatectomy: current evaluation of surgical margins in clinically low-, intermediate-, and high‑risk prostate cancer. J Endourol 2009; 23(9): 1461–1465.
8. Hsu CY, Joniau S, Roskams T, Oyen R, Van Poppel H. Comparing results after surgery in patients with clinical unilateral T3a, prostate cancer treated with or without neoadjuvant androgen-deprivaion therapy. BJU Int 2007; 99(2): 311–314.
9. Eastham JA, Kattan MW, Riedel E, et al. Variations among individual surgeons in the rate of positive surgical margins in radical prostatectomy specimens. J Urol 2003; 170(6Pt1): 2292–2295.
10. Spahn M, Weiss C, Bader P, et al. Long‑term outcome of patients with high‑risk prostate cancer following radical prostatectomy and stage‑dependent adjuvant androgen deprivation. Urol Int 2010; 84(2): 164–173.
11. Briganti A, Wiegel T, Joniau S, et al. Early salvage radiation therapy does not compromise cancer control in patients with pT3N0 prostate cancer after radical prostatectomy: results of a match‑controlled multi‑institutional analysis. Eur Urol 2012; 62(3): 472–487.
12. Bolla M, van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2005; 366(9485): 572–578.
13. Wiegel T, Bottke D, Steiner U, et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate‑specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 2009; 27(18): 2924–2930.
14. Thompson IM, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 2006; 296(19): 2329–2335.
15. Schiavina R, Ceci F, Borghesi M, et al. The dilemma of localizing disease relapse after radical treatment for prostate cancer: which is the value of the actual imaging techniques? Curr Radiopharm 2013; 6(2): 92–95.
16. Bartkowiak D, Bottke D, Wiegel T. Adjuvant radiotherapy or early salvage radiotherapy in pT3R0 or pT3R1 prostate cancer. Curr Opin Urol 2013; 23(4): 360–365.
17. Pfister D, Bolla M, Briganti A, et al. Early salvage radiotherapy following radical prostatectomy. Eur Urol 2014; 65(6): 1034–1043.
18. Karlin JD, Koontz BF, Freedland SJ, et al. Identifying appropriate patients for early salvage radiotherapy after prostatectomy. J Urol 2013; 190(4): 1410–1415.
19. Cozzarini C. Editorial comment on: adjuvant radiotherapy for patients with locally advanced prostate cancer – a new standard? Eur Urol 2008; 54(3): 540–541.
20. Kowalczyk KJ, Gu X, Nguyen PL, et al. Optimal timing of early versus delayed adjuvant radiotherapy following radical prostatectomy for locally advanced prostate cancer. Urol Oncol 2014; 32(3): 303–308.
21. Pearse M, Fraser‑Browne C, Davis ID, et al. A phase III trial to investigate the timing of radiotherapy for prostate cancer with high‑risk features: background and rationale of the radiotherapy – adjuvant versus early salvage (RAVES) trial. BJU Int 2014; 113 Suppl 2 : 7–12.
22. King CR. Adjuvant versus salvage radiotherapy for high‑risk prostate cancer patients. Semin Radiat Oncol 2013; 23(3): 215–221.
23. Briganti A, Karnes RJ, Joniau S, et al. Prediction of outcome following early salvage radiotherapy among patients with biochemical recurrence after radical prostatectomy. Eur Urol 2014; 66(3): 479–486.
24. Kinoshita H, Shimizu Y, Mizowaki T, et al. Risk factors predicting the outcome of salvage radiotherapy in patients with biochemical recurrence after radical prostatectomy. Int J Urol. 2013; 20(8): 806–811.
25. Mottet N, Bellmunt J, Briers E, et al. EAU – ESTRO – SIOG Guidelines on Prostate Cancer 2016 http:// uroweb.org/guideline/prostate‑cancer/ 6. 10. 12-p. 84.
26. Thompson IM, Valicenti RK, Albertsen P, et al. Adjuvant and salvage radiotherapy after prostatectomy: AUA/ASTRO Guideline. J Urol. 2013; 190(2): 441–449.
27. Simon MA, Kim S, Soloway MS. Prostate specific antigen recurrence rates are low after radical retropubic prostatectomy and positive margins. J Urol 2006; 175(1): 140–144.
28. Lodde M, Lacombe L, Fradet Y. pT2-3N0M0 prostate cancer with positive and negative margins: clinical outcome and time to salvage radiotherapy. Eur Urol Suppl 2010; 9(2): 207–221.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2017 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Využití flexibilní nefroskopie k extrakci urolitiázy při laparoskopické a roboticky asistované pyeloplastice
- Intravezikální chemoterapie s využitím tepelné energie u pacientů s uroteliálním karcinomem močového měchýře bez invaze svaloviny
- Dysfunkce mikce u pacientů s posttraumatickou míšní lézí - úloha urologa
- Sledování a léčba pacientů po radikální prostatektomii s pozitivními okraji preparátu
- Funkční výsledky pyeloplastiky provedené v kojeneckém věku
- Nefrometrická skóre první a druhé generace pro predikci peri- a pooperačních výsledků resekcí ledvin
- Efficacy and safety of extracorporeal shock wave lithotripsy in the 21th century – controversy and clinical practice.
- Spontánní ruptura renálního angiomyolipomu
- Trombóza povrchové dorzální žíly penisu (Penilní Mondorova choroba)
- Zpráva o proběhlém 5. ročníku Video‑semináře Tipy a triky v Urologické operativně
- Zpráva z workshopu Sekce urodynamiky, neurourologie a urogynekologie ČUS ČLS JEP: Funkční urologie - Novinky 2017
- 2. ročník konference KNOU, pohled mladého lékaře
- ASSOC. PROF. ROMAN ZACHOVAL, M.D., PH.D., MBA, CELEBRATED HIS 50TH BIRTHDAY
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Trombóza povrchové dorzální žíly penisu (Penilní Mondorova choroba)
- Dysfunkce mikce u pacientů s posttraumatickou míšní lézí - úloha urologa
- Sledování a léčba pacientů po radikální prostatektomii s pozitivními okraji preparátu
- ASSOC. PROF. ROMAN ZACHOVAL, M.D., PH.D., MBA, CELEBRATED HIS 50TH BIRTHDAY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



